A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניטור אסטרוציט תגובתיות התפשטות במבחנה בתנאים כמו איסכמי
* These authors contributed equally
In This Article
Summary
שבץ איסכמי הוא אירוע מורכב שבו התרומה ספציפי של האסטרוציטים לאזור במוח המושפעים נחשפים גלוקוז חוסר חמצן (OGD) הוא קשה ללמוד. מאמר זה מציג מתודולוגיה להשיג האסטרוציטים מבודד וללמוד שלהם תגובתיות והתפשטות בתנאים OGD.
Abstract
שבץ איסכמי הוא פגיעה מוחית מורכבת הנגרמת על ידי כגון או תסחיף חוסם את זרימת הדם אל חלקים במוח. זה מוביל לקיפוח של חמצן, גלוקוז, אשר גורם אנרגיה ולמוות עצביים. לאחר עלבון שבץ איסכמי, האסטרוציטים הפך תגובתי, להתרבות סביב האתר פציעה כפי שהוא מתפתח. בתסריט הזה, קשה ללמוד את התרומה ספציפי של האסטרוציטים לאזור המוח חשוף איסכמיה. לכן, מאמר זה מציג מתודולוגיה ללמוד אסטרוציט העיקרי תגובתיות והתפשטות תחת מודל במבחנה של סביבה, כמו איסכמיה, שנקרא גלוקוז חוסר חמצן (OGD). האסטרוציטים הם בודדו אותנו מהמתרחש 1-4 ימים-חולדות neonatal הישן, מספר התאים astrocytic שאינם ספציפיים הוערכה באמצעות סמן סלקטיבי אסטרוציט גליה Fibrillary חומצי חלבון (GFAP) וצביעת גרעינית. התקופה שבה האסטרוציטים נחשפים לתנאי OGD יכול להיות מותאם אישית, כמו גם אחוז החמצן שהם נחשפים. גמישות זו מאפשרת למדענים לאפיין את משך התנאי איסכמי כמו בקבוצות שונות של תאים בתוך חוץ גופית. מאמר זה מתאר את מסגרת זמן של OGD זה לגרום אסטרוציט תגובתיות מורפולוגיה היפרטרופית, התפשטות כפי שהיא נמדדת immunofluorescence באמצעות מתרבים תאים גרעיניים אנטיגן (PCNA). מלבד התפשטות, האסטרוציטים עוברים אנרגיה סטרס חמצוני, להגיב OGD על ידי שחרור גורמים מסיסים לתוך התא האמצעי. בינוני יכול להיות ונשתמש בהם כדי לנתח את ההשפעות של מולקולות שפורסמו על ידי האסטרוציטים בתרבויות עצביים ראשי ללא אינטראקציה עם מתא לתא. לסיכום, המודל התרבות התא הראשי ניתן להשתמש ביעילות כדי להבין את התפקיד של האסטרוציטים מבודד על פגיעה.
Introduction
קו מוגדר כ- "חריפה נוירולוגיות בתפקוד כלי דם המקור עם התפתחות מהירה או פתאומית של תסמינים וסימנים, התואם מעורבותם של תחומי פעילות במוח"1,2. ישנם שני סוגים של שבץ: hemorrhagic, איסכמי. כאשר תפקוד כלי הדם נגרמת על-ידי מפרצת או תקלה עורקית, מלווה בהיחלשות עם קרע אחורי של עורק, זה נקרא שבץ מדמם3 אשר, ברוב המקרים, מובילה למוות. כאשר כגון או תסחיף מונעת זרימת הדם, גורם זמני מניעת חמצן, גלוקוז לאזור במוח, זה נקרא שבץ איסכמי4. כשל לטפח תאים סביב האזור הנגוע או מוביל איסכמי הליבה איזון homeostatic וחילוף, תפקוד אנרגטי, מוות עצביים ו דלקת5, אשר יכול לגרום נכות לכל החיים עבור חולים6.
שבץ איסכמי הוא פגיעה multifactorial המערבים מספר סוגים של תאים להגיב ולהפעיל את ההשפעות שלהם בנקודות זמן שונות. אינטראקציות רבות ליצור סביבה קשה ללמוד את אופן הפעולה של תאים בודדים. ? אז, איך לומדים את התרומה של סוג תא מסוים תחת סביבה מורכבת? מודל מקובל במבחנה של איסכמיה מורכב של חשיפת תאים כדי מניעת חמצן, גלוקוז (OGD), במשך תקופה מסוימת, ואחריו את השחזור של תאים normoxic לסביבה. מערכת זו מדמה של שבץ איסכמי ואחריו פגיעה reperfusion דם. בשיטה זו, תאים או רקמות נחשפים בתקשורת ללא גלוקוז בסביבה ללא חמצן, באמצעות תא ובשפתיים מיוחדים. זמן הדגירה OGD יכול להשתנות בין מספר דקות עד 24 h, בהתאם ההיפותזה רוצה להיבדק. מחקרים הראו כי בהתאם הזמנים של OGD, normoxic הסביבה, פנוטיפים ספציפי של שבץ (קרי, חריפה או subchronic) יכולה להיות מושגת. ראשי האסטרוציטים מבודד, נחשפים OGD עם שיקום האחורי לתנאים normoxic, הוא מודל הסלולר למד היטב כדי לחקות קו במבחנה7. שימוש OGD אפשרי לחשוף את המנגנונים המולקולריים עצמאית של תאים בודד תחת סביבה דמויי שבץ.
הידע שלנו על ביולוגיה אסטרוציט גודלת, זה הפך ברור כי הם חיוניים עבור שמירה על הסינפסות ומנחם תיקון, ופיתוח פלסטיות עצבית8. בתנאים רגילים, האסטרוציטים לשחרר ולהגיב ציטוקינים, נוגדנים, גורמי גדילה, gliotransmitters, שמירה על איזון מטבולי, הומאוסטזיס בתוך הסינפסות5,9. ב- neuroinflammation חריפה, כגון שבץ איסכמי, תאים אלה יכולים להפוך תגובתי, להראות ביטוי ארוכות טווח של גליה Fibrillary חומצי חלבון (GFAP) ולהציג היפרטרופיה שלהם מורפולוגיה5,10, 11 , 12. כמו אירוע איסכמי מתפתח, הומאוסטזיס שסופקו על-ידי האסטרוציטים הופך להיות מושפעת, לגבי ספיגת גלוטמט נורמלי, חילוף החומרים האנרגיה, חילופי מולקולות פעילים, נוגד חמצון פעילות13.
האסטרוציטים שהופעלה מחדש להתרבות סביב הרקמה לאוטם בזמן לויקוציטים נודדים לכיוון אזור lesioned14. תפוצת astrocytic ניתן למדוד באמצעות סמנים כגון מתרבים תאים גרעיניים אנטיגן (PCNA), Ki67 ו- bromodeoxyuridine (BrdU)15. תגובה proliferative זו נוצרת באופן תלוי-זמן והיא מסייעת ויוצרים את הצלקת גליה, מערך האסטרוציטים בלתי הפיך תגובתי לאורך parenchyma של אתר פגום אחרי הפציעה9. אחת מהפונקציות הראשונית של הצלקת הזאת היא להגביל את extravasation תא החיסון מהאזור הזה. עם זאת, מחקרים הראו כי הצלקת הופך ליקוי פיזי עבור אקסונים להרחיב, כפי הם משחררים מולקולות מעכבות את הצמיחה עצב, וליצור מכשול פיסי מניעת אקסונים הארכת סביב האזור הפגוע ה-16. עם זאת, יש ראיות מדעיות מראה כי לאחר פציעה בחוט השדרה, לגמרי מניעת היווצרות צלקת גליה עלול לפגום לרגנרציה של אקסונים17. לפיכך, ההקשר שבו נמדד התגובה astrocytic ספציפי, יש לקחת בחשבון על המסגרת של הפגיעה למד.
המתודולוגיה שהוצגו יכול להיות מיושם בו הפונקציה תגובותיהם של האסטרוציטים לאחר חוסר חמצן גלוקוזה, שניתן יהיה לשנותה בהתאם השאלות החוקר רוצה לענות. לדוגמה, מלבד שינוי מורפולוגי, את סמני הביע בזמנים שונים, OGD, supernatants מן האסטרוציטים נחשפים OGD ניתן עוד לנתח כדי לזהות גורמים מסיסים שפורסמו על ידי תאים אלה, או משתמשת באמצעי התקשורת ממוזגים להעריך שלה אפקט בתאים אחרים במוח. גישה זו מאפשרת מחקרים על תגובתיות אסטרוציט העלולה להוביל הבהרה של הגורמים ותקנות לווסת את תגובתם בתרחיש של שבץ איסכמי.
Protocol
כמחנכת חולדות (ספראג Dawley) 1-4 ימים הישנים משמשים כדי לבודד cortices. השיטה של המתת חסד היא עריפה, כפי שאושר על ידי הנחיות NIH.
1. הכנה של מכשירים וחומרים לניתוח
- Sterilize מכשירים ב החיטוי (טמפרטורה: 121 ºC, לחץ: 15 psi, זמן: כשעתיים וחצי) באמצעות קופסת מתכת או רגע איטום נרתיק עיקור. ראה חומרים טבלה של חומרים.
2. להשלים את הכנת DMEM
- ב גביע ליטר אחד המכיל 700 מ"ל מים בלוק, להוסיף Dulbecco ' s נשר שונה ' s אבקת בינוני בטמפרטורת החדר.
- להוסיף 3.7 g/L סודיום ביקרבונט, בעוד הפתרון הוא מעורבב עם פגים.
- התאם ה-pH ל 7.4, עם מים בלוק להביא נפח עד 1 L ולאחר מכן לסנן. למטרות תרבות, תוספת הנפח הרצוי של מדיה עם 10% FBS ו 1% פניצילין/סטרפטומיצין, וחמים -הלעפה תרוטרפמט 37. ראה חומרים טבלה של חומרים.
הערה: ה-pH היה להתאים ל- 7.4 באמצעות החדרת האלקטרודה מד pH לתוך כלי התקשורת. התקשורת חייב לבחוש, לאחר מכן להוסיף לאט NaOH M 1 באמצעות טפי.
3. תרבות אסטרוציט הראשי
הערה: לאחר זריעה, מדיה תא לשנות כל שלושה ימים, תאים יכולים להיות בוגר עד confluency (11-13 ימים). ביום השלישי, הקש את הבקבוק מספר פעמים כדי להרים microglial תאים ו אוליגודנדרוציטים ובתאים את התרבות, הסר את כל ' בת ' מדיה, לשטוף פעמיים באמצעות 10 מ"ל ל- PBS, וארוקן את PBS, ואז להוסיף מדיה חדשה טריים. ראה חומרים טבלה של חומרים.
- ניתוח מוח היילוד עכברוש
- בצע הקרע בשכונה תרביות רקמה. לקבל 1-4 ימים הגורים היילוד עכברוש זקן (2 מוחות עכברים משמשים לכל 75 ס מ 2 הבקבוק).
- להכין שלוש צלחות פטרי 60 מ מ, פיפטה 5 מ של DMEM מלאה על כל אחד.
הערה: והם יכולים להיות מחולקים כדלקמן: #1 עבור כל עכברוש המוח-#2 עבור כל cortices את המוח, ו- #3 עבור כל cortices קלופים (ללא קרומי המוח). - לתפוס את הגור ולרסס עם 70% אתנול. לערוף אותו ולמחוק את הגופה בתוך מיכל פסולת חומרים מסוכנים קטן.
- באמצעות את הפינצטה לנתח מיקרו, תחזיק את הראש. ולחתוך את העור מעל הראש כדי לחשוף את הגולגולת.
- עם עוד זוג מספריים, להפוך " T " החתך מתחיל מן הצד האחורי של הגולגולת לכיוון האף. השתמש זוג מלקחיים כדי להסיר בעדינות את הגולגולת.
- להסיר את המוח החשוף עם זוג מלקחיים ומניחים המוח באחת צלחות פטרי בעבר מילא בינונית.
- קבוצה נוספת של מכשירים סטריליים לשימוש והשלבים הבאים.
- להשתמש מלקחיים לנתח מיקרו הנח בעדינות את המוח על המכסה הפוך של צלחת פטרי 60 מ מ. כאשר הפטרי מושם על גזה סטרילית, ניתן להציג את המוח בבירור וזה יותר קל לנתח.
- לייצב את המוח עם מלקחיים לנתח מיקרו ולהפריד את הכדור מוחי על ידי בעדינות להקניט לאורך סדק קו האמצע עם החוד של המלקחיים לנתח מיקרו-
- Deflect, לקלף את cortices, משאיר מאחור את חומר לבן, ומעבירים אותם אל צלחת פטרי, בעבר עם התווית #2. חזור על התהליך עבור כל המוחות, המשלב את כל cortices גזור בצלוחית הפטרי שכותרתו #2-
- להוציא את ההיפוקמפוס מ מתחת לכל קליפת ולבטל את זה
- להשתמש את הפינצטה לנתח מיקרו פטרי 60 מ מ לקלף בעדינות קרומי המוח של האונות קורטיקלית בודדים, ולמקם אותם לתוך הפטרי שכותרתו #3-
- רקמות דיסוציאציה: שיטת בלנדר מהמגן
- שופכים ההשעיה רקמות/בינוניים (קלופים cortices של המוח) לתוך השקית בלנדר סטרילי ולהוסיף בינוני מספיק להביא את הנפח הכולל בתיק מ ל.
- מניחים את השקית לתוך הבלנדר מהמגן, עוזב כ 2 ס מ של התיק גלוי מעל הדלת הסגורה. הדיסוציאציה תא נעשית בזמן 2.5 דקות במהירות גבוהה.
הערה: לחלופין, ניתן לבצע זאת על-ידי סגירת התיק וחובטים זה בעדינות עם גביע בשכונה. הקפד להשתמש מטלית בין התיק ואת הספל כדי למנוע חיכוך. - שופכים התליה תא לתוך מסננת רשת מספר 60, ואז לשפוך את זרימת מסוננים דרך על גבי מסננת המספר 100, ומאפשרת לסנן לפי כוח המשיכה.
- באמצעות 15 מ"ל צינורות, centrifuge התליה תא ב g 200 x ומפרידה קליניים (רצוי הנדנדה דלי. רוטור) עבור 5 דק.
- יוצקים את תגובת שיקוע בתוך, ואז בעזרת פיפטה סרולוגית, מחדש להשעות מביצועם בגדר של תאים במקסימום של 5 מ של המדיה-
- תא ספירת
- micropipette, לאסוף 100 µL תא השעיה צינור microcentrifuge 1.5 mL, להוסיף 100 µL של trypan blue.
- להכניס hemocytometer 10 µL של ההשעיה שנאספו ולספור כל התאים הם קיימא בארבע פינות של הכיכר- הן נוסחות חישוב הצפיפות של התאים בהכנת המבחנות
- :
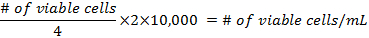
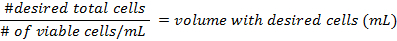
- להוסיף תאים לפחות 500,000 לכל 25 ס מ 2 הבקבוק. פיפטה עד 5 מ"ל של DMEM לתוך כל הבקבוק. התערובת לא צריך להגיע את צוואר הבקבוק. מקם אותם בתוך חממה 37 ° C-5% CO 2, 3 ימים ולאחר מכן לשנות את המדיה-
- טכניקות טיהור אסטרוציט: מדיה לשנות, מכאני וכימי אסטרטגיות
הערה: קצב חילוף החומרים של האסטרוציטים הוא גבוה לעומת סוגי תאים אחרים, לכן, תזונתית מקופח תנאים, תאים אלה להראות שיעורי הישרדות נמוכים אחרי כמה ימים. בניגוד האסטרוציטים, מיקרוגלייה אינם מושפעים מחסור תזונתי, להתרבות כזה בסביבות 18. כדי לשמור על מספר מצומצם של תאים microglial, המחברים לשנות astroglial תא תרבות התקשורת כל 3 ימים. שינוי זה קבוע בתקשורת תא יקטן גם האוכלוסייה microglial שיכול לגדול מעל טפט תא astrocytic הבקבוקון 19.- שימוש פסטר פיפטה לרוקן את התקשורת עם תאים שאינם מחסידי microglial מכל אחת המבחנות. שטיפת נפולת השאיר מאחור באמצעות סטרילי-מסוננים PBS לכל המבחנות באופן dropwise (5 מ ל/הבקבוק).
- להוסיף את DMEM סטרילי-מסוננים (עם סרום שור אנטיביוטי ו עוברית) dropwise כל הבקבוק (5 מ ל/הבקבוק). להתסיס בעדינות בתנועות מעגליות כדי לכסות את המשטח כולו.
- המקום התאים ב- 37 ° חממה C ב- 5% CO 2 8-10 ימים עד המבחנות להגיע confluency (> 95% לוחית כיסוי).
הערה: מספר פרוטוקולים הראו כי כאשר האסטרוציטים מגיעים confluency, שיטות מכנית, כגון טלטול התרבות בין 2 ל 24 שעות, מוביל הניתוק של תאים שנמצאים על גבי האסטרוציטים אלה, בעיקר מיקרוגלייה, קודמן תאים 19 , 20- - תאים Non-astrocytic מופחתים בתרבות על-ידי ביצוע רועד מסלולית-סל ד 180 למשך 30 דקות. לאחר הסרת התאים בתגובת שיקוע, מדיה חדשה היא pipetted לתוך הבקבוק (~ 15 מ"ל).
- לחסל את אוליגודנדרוציטים ובתאים, להגביר את המהירות חזק ל 200 סל ד 6-אייץ ' 21 , 22 , 23, תגובת שיקוע וביופסיה של מדיה חדשה pipet.
הערה: כדי להקטין את הנוכחות של מיקרוגלייה בתרבויות, שתי שיטות כימיות ניתן להשתמש ברצף (לא זמנית) בהמתודולוגיה התרבות התא העיקרי: אראבינוז ציטוזין (Ara-C) ו ללאוסין מתיל אסטר (LME) 24. - מיד כאשר תאים להגיע confluency (100%), 3-4 ימים לאחר הסרת מכני מיקרוגלייה, תאים אלה יכולים להיות מטופלים עם 8 מיקרומטר של antimitotic מתחם אראבינוז ציטוזין (Ara-C) ב- DMEM במשך 5 ימים (שינוי טריים Ara-C ב- DMEM מדי יום).
הערה: נקודת הזמן כדי להוסיף Ara-C הוא קריטי מכיוון המתחם הזה הוא סם antimitotic, אשר מפחית את מספר התאים חלוקת במהירות מיקרוגלייה 19 , 25 ו fibroblasts 26 . בניגוד מיקרוגלייה, כאשר confluent, האסטרוציטים להפסיק מתרבים באמצעות סימן דיכוי 27. - לאפשר 2 ימים עבור תאים להתאושש טיפול Ara-C.
- כדי להוסיף ולצמצם את זיהום microglial, לאחר תאים להגיע confluency, להשתמש מ 50 מ ללאוסין מתיל אסטר (LME) ב- DMEM קבוע ב- pH 7.4, עבור h 1 הלעפה תרוטרפמט 37.
הערה: LME חוצה את הממברנה של התאים, organelles, לאחר, להיות הידרוליזה ללאוסין המיוצר שמצטבר lysosomes של תאים אלה. ההצטברות של חומצה אמינית זו מובילה קרע של 28 , lysosomes 29 ונפיחות osmotic. LME הוא יעיל ב חיסול מיקרוגלייה, לעומת תאים אחרים, 20 , 30-
4. טיפוח האסטרוציטים ב 6-ובכן צלחות
- ציפוי coverslips עם פולי-D-ליזין
- coverslip לשים אחד בכל 35 מ מ פטרי צלחת, ואז להוסיף 100 µL של הפתרון מדולל פולי-D-ליזין coverslip כל ולחכות ח' 1
- להסיר את פולי-D-ליזין. ולשטוף פעמיים עם 2 מ"ל מים סטריליים.
- להסיר מים ולחכות coverslips להתייבש בתוך המנוע. לאחסן את coverslips ב-20 ° C עד שבועיים.
הערה: להקפיא את הפתרון מדולל פולי-D-ליזין; ניתן לאחסן עד שבועיים.
- Trypsinization
- באמצעות פיפטה של פסטר, תשאף האמצעי המבחנות. הוסף 5 מ ל/הבקבוקון של PBS סטרילי-מסוננים לשטוף בעדינות את התאים.
- וביופסיה כבוי החינוכית ולאחר מכן הוסף 5 מ ל/הבקבוק בפתרון סטרילי-מסוננים 0.25% טריפסין ו- 0.5 מ מ EDTA. הכנס את הבקבוקון הלעפה תרוטרפמט 37, 5% CO 2 מגשים עבור 10 דקות
הערה: בעוד התאים הם המקננת, חם 5 מ"ל הבקבוקון של טרי DMEM מלאה ב- 37 מעלות צלזיוס. - אחרי 10 דקות של דגירה, להתסיס כדי לוודא כי כל התאים מוסרות את הבקבוק. להוסיף במהירות של 5 מ של DMEM מלאה חמה לכל מבחנה לנטרל את טריפסין.
- Pipette בעדינות את התאים למעלה ולמטה מספר פעמים כדי לשבור את כל " גושים ". להעביר תאים מושעה שתי מבחנות שפופרת צנטרפוגה חרוט 15 mL-
- צנטריפוגה למשך 5 דקות ב- 200 x g כדי לאסוף בגדר התא. מחדש להשעות את צניפה ב 500 µL בינוני והמשך כדי למקם את התאים המבחנות.
הערה: דוגמאות של ניתוחים להתבצע עם תאים: 1) שעתוק במהופך תגובת שרשרת פולימראזית (RT-PCR) כדי לנתח ביטוי גנים; 2) תספיג להעריך ביטוי חלבון; 3) ניתוח cytometry זרימה לכמת את מספר ובתאים עצבית, חלבונים עניין; 4) immunofluorescence כדי לנתח בלוקליזציה וביטוי חלבונים.
- האסטרוציטים זריעת
- לאחר בטיפול את האסטרוציטים ראשי עם טריפסין (עיין 4.2), לאסוף 100 μL תא השעיה צינור microcentrifuge 1.5 mL ולהוסיף 100 μL של 0.5% trypan blue.
- להוסיף 10 μL של ההשעיה שנאספו ב- trypan כחול כדי hemocytometer ולספור כל התאים הם קיימא.
- להשתמש נוסחות את שלב 3.3 כדי לחשב את צפיפות התאים בהכנת המבחנות. מנות
- הכן הבאר מרובות על-ידי הוספת אחד סטרילי, פולי-D-ליזין מצופה coverslip אל כל טוב. Pipette התאים 50,000 ולמלא את שאר אמצעי האחסון בכל צלחת רב טוב טרי בינוני (כ 2 מ"ל).
- למקם את הכלים היטב רב לתוך החממה הלעפה תרוטרפמט 37 ב- 5% CO 2 ו, לאחר 5-7 ימים, האסטרוציטים עשוי לגדול לכסות את המשטח כולו של coverslips.
5. פרוטוקול OGD האסטרוציטים הראשי
- הכנה בינונית OGD
- Dulbecco תוספת ' s ששינה הנשר ' s בינונית ללא גלוקוז עם 3.7 g/L סודיום ביקרבונט, 1% פניצילין/סטרפטומיצין. ראה חומרים בטבלה 4.
- לטהר 20 מ"ל של המדיום גלוקוז חופשי על ידי מבעבעים עם 95% N 2 / 5% CO 2 10 דקות-זרם של 15 ליטר/דקה (מסומן עם מד זרימה) על-ידי הוספת על פיפטה סרולוגית למערכת הגז המדיום.
הערה: לאחר טיהור המדיום של חמצן, להתאים את רמת ה-pH-7.4 (עיין הערה על שלב 2.1). - לסנן המדיום ללא גלוקוז לצמיתות באמצעות מערכת סינון שפופרת 50 מ ל.
הערה: להכין טרי בינוני OGD עבור כל ניסוי, מבעבעים עם 95% N 2 / 5% CO 2 לפני השימוש, כדי להבטיח כי התאים חשופים לסביבה ללא חמצן.
- ניתוח ניסיוני
- בתוך המנוע תרביות רקמה, להסיר מדיה אסטרוציט coverslips בעבר מוכן (עיין שלב 4.3.5), תשטוף עם PBS הסלולר פעמיים כדי להסיר כל גלוקוז בתאים.
- להוסיף 2 מ"ל של התקשורת OGD לכל אחד טוב ומניחים את הכלים רב טוב בתוך החדר היפוקסיה עם הנהגים העפעפיים שלהם
- להתחבר את התערובת שסתום הכניסה ולהשאיר את שסתום היציאה פתוחה. לרוקן את המיכל עם תערובת גז של 95% N 2 / 5% CO 2, ב- 15 ליטר/דקה במשך 5 דק
- לעצור את זרימת הגז, קודם לסגור את המלחציים שסתום היציאה ואז לסגור את המלחציים לאורך צינור שסתום הכניסה גז-
הערה: ודא שיש אין נזילה הגז על ידי כיסוי החותם של התא עם סבון ומים. אם החותם הוא מאובטח, אין בועות יוצרות. - למקם את התא כולו לתוך החממה התרבות התא ב 37 ° C 1 h או 6 h ב- OGD.
- אחרי זמן הדגירה, האחות OGD המדיה ולעבד בקפידה pipet 2 מ של DMEM מלאה בכל ס מ 4.67 2 טוב בשביל normoxic ה 24
6. פרוטוקול הכנה Immunofluorescence אסטרוציט הראשי
הערה: כדי להעריך אסטרוציט טוהר, סוגי לתא מוח כמו נוירונים מיקרוגלייה, oligodendrocytes להפוך יכול יזוהו על-ידי immunofluorescence באמצעות סמנים תאים שונים. התפשטות סמני PCNA, propidium יודיד (PI) יכול לשמש על ראשי האסטרוציטים נחשפים OGD ואחריו normoxic תנאים. ראה חומרים טבלה של חומרים.
- Immunofluorescence הכנת
הערה: זה פרוטוקול immunofluorescence כללי, שינויים מזעריים שניתן לבצע כדי להשיג את אות אופטימלית (למשל, תקופות ארוכות יותר של דגירה, בטמפרטורת דגירה). כל סמן בטבלה 1 יכול לשמש על פי היצרן ' פרוטוקול s.- להערכת הכדאיות תאים, התאים יכולים להיות מודגרות למשך 5 דקות ב 37 ° C עם PI (5 מיקרומטר ב DMEM מלאה) ולשטוף פעמיים עם 2 מ של PBS עבור 5 דק תאים המציגים PI מכתים הם פחות קיימא.
הערה: שימוש בתאים מטופלים בשלב 5.2.6. - לתקן תאים לאחר PI מכתים, להוסיף 2 מ של 4% פורמלין לכל ס מ 4.67 2, עבור 20 דקות ב 4 הלעפה תרוטרפמט. לקבלת דוגמאות המסומנת PCNA, תיקון הפתרון המועדף הוא מתנול 10 דקות ב 4 הלעפה תרוטרפמט.
התראה: פורמלין, מתנול רעילים.
הערה: תמיד לבדוק נוגדנים ספציפיים פרוטוקולים של כל חברה. - לרחוץ תאים עם 2 מ של PBS במשך 5 דקות, חזור על שלב זה 3 פעמים.
- דגירה בתאים חסימת פתרון (0.5% ללא יונית חומרים פעילי שטח, 10% FBS ב- PBS) במשך 30 דקות בטמפרטורת החדר עם טלטול עדין.
- לרחוץ את התאים עם 2 מ של PBS במשך 5 דקות, חזור על שטיפת 3 פעמים.
- דגירה ב 4 מעלות צלזיוס, למשך הלילה (16 שעות), עם נוגדן ראשוני (PCNA, GFAP) בריכוז של 1% FBS ב- PBS.
- להסיר הפתרון נוגדן ראשוני לשטוף את התאים עם 2 מ של PBS במשך 5 דקות, חזור על שלב זה 3 פעמים.
- Incubate עם נוגדנים משניים מצומדת עם fluorophore בריכוז של 1% FBS ב- PBS, לשעה בטמפרטורת החדר.
- לרחוץ את התאים עם 2 מ של PBS במשך 5 דקות, חזור על שלב זה 3 פעמים. להוסיף 1 µg/mL של דאפי (4 ', 6 ' - diamidino - 2-phenylindole) עבור 5 דקות כדי להכתים את גרעין התא.
- לרחוץ תאים עם 2 מ של PBS 5 דקות, חזור על שלב זה פעמיים ולשמור ב- PBS.
- להכין את coverslips בשקופית מיקרוסקופ באמצעות הרכבה בינונית.
- להערכת הכדאיות תאים, התאים יכולים להיות מודגרות למשך 5 דקות ב 37 ° C עם PI (5 מיקרומטר ב DMEM מלאה) ולשטוף פעמיים עם 2 מ של PBS עבור 5 דק תאים המציגים PI מכתים הם פחות קיימא.
- מיקרוסקופ קונפוקלי
- לאחר הגדרת המיקרוסקופ, מניחים בצד coverslip למטה על הבמה מיקרוסקופ.
- באמצעות התוכנה, בחר קרן לייזר אל 543nm עבור נוגדן מצומדת GFAP-Cy3.
7. תא Assay הכדאיות
- Trypsinize ולכמת האסטרוציטים על-ידי ביצוע שלבים 4.3 ו- 4.4.
- להוסיף 1 x 10 4 תאים/טוב צלחות 96-ובכן, לגדל אותם כדי confluency.
- באמצעות המתודולוגיה משלב 5, לחשוף את צלחות 96-ובכן בתרבית או normoxic 1 h OGD או 6-אייץ ' OGD.
- OGD לאחר הטיפול, הוספת מדיה normoxic על כל התאים במשך 24 שעות ביממה ואת הכדאיות נמדדת באמצעות MTT ריאגנט assay (להשתמש בתור יצרן ' s ההוראות מציינות).
- פתרון MTT 5 מ"ג/מ"ל, להוסיף 10% מהנפח הכולל מכל קידוח, תקופת דגירה של h 3 הלעפה תרוטרפמט 37 עם הכימית MTT.
- להסיר מדיה, resuspend גבישים באמצעות 200 µL דימתיל סולפוקסיד. לקרוא את הצלחת בספקטרופוטומטר ב 570 nm.
הערה: ספיגת ירידה יחסית תאים שליטה לתאם עם הכדאיות פחות.
תוצאות
אחד החששות העיקריים של התרבות astrocytic העיקרי הוא הנוכחות של תאים אחרים כגון נוירונים, oligodendrocytes להפוך, fibroblasts מיקרוגלייה. איור 1, תאים מבודדים מן החולדה cortices היו שינויים מדיה כל 3 ימים והיו גם אינו מטופל או שטופלו עם הוספת LME עבור 1 ה 24 שעות מאוחר יותר, התאים היו ...
Discussion
פרוטוקול זה מתאר את ניתוקה של האסטרוציטים מן החולדה cortices. בשיטה זו, חיוני כדי להקטין זיהום עם סוגי הסלולר אחרים כגון מיקרוגלייה, oligodendrocytes להפוך fibroblasts. כדי לצמצם את מספר מיקרוגלייה, ניתן לנקוט בכמה צעדים: לשנות את המדיה מסלולית רועדת, טיפולים כימיים. ברגע טוהר התרבות הוא אישר immunofluorescence באמצ...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להודות Paola לופס Pieraldi לסיוע טכני. A.H.M. הוא אסיר תודה עבור מענקים 8G12MD007600 ו- U54-NS083924 נתמך בפרסום זה. אנו מודים NIH-NIMHD-G12-MD007583 גרנט על התמיכה מתקן. D.E.R.A. הוא אסיר תודה על האחווה שסופקו על-ידי-NIHNIGMS-R25GM110513. אנחנו אסירי תודה על השימוש באזור מכשור המשותף ולהעניק הסיוע של ד ר Priscila Sanabria עבור השימוש במתקן הדמיה אופטית של התוכנית RCMI על ידי G12MD007583. בנוסף, אנו רוצים להודות חוסה פאדילה על תפקידו מצטיינים צילום ועריכה פרוטוקול חזותי.
Materials
| Name | Company | Catalog Number | Comments |
| Instruments for Surgery - Step 1 | |||
| Operating scissor 5.5” | Roboz Company | RS-6812 | Tools used to decapitate the rats. |
| Curved forceps 7” | Roboz Company | RS-5271 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting scissors 4” | Roboz Company | RS-5882 | Cuts both the skin and skull of the rat. |
| Micro-dissecting forceps 4” angled, fine sharp | Roboz Company | RS-5095 | Holds the skin of the rat while the skull is removed. |
| Micro-dissecting forceps 4” slightly curved 0.8 | Roboz Company | RS-5135 | Tool used to separate cortices. |
| Micro-dissecting tweezers | Roboz Company | RS-4972 | Peels brain meninges. |
| Dissection microscope | Olympus | SZX16 | Important for removing the meninge from the cortices. |
| DMEM Preparation - step 2 | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | GibCo. Company | 11995-065 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| Filter System 1L with 0.22um pore | Corning | 431098 | |
| Astrocyte culture - step 3 | |||
| Serological pipets 5mL | VWR | 89130-896 | To pipette DMEM to containers with cells. |
| Serological pipets 10mL | VWR | 89130-898 | To pipette DMEM to containers with cells. |
| Serological pipets 25mL | VWR | 89130-900 | To pipette DMEM to containers with cells. |
| Centrifuge conical tube 15mL | Santa Cruz Biotechnology | sc-200250 | |
| Safe-lock tube 1.5mL | Eppendorf | 022363204 | |
| Barrier Tips 200 uL | Santa Cruz Biotechnology | sc-201725 | |
| Barrier Tips 1 mL | Santa Cruz Biotechnology | sc-201727 | |
| Biohazard Orange Bag 14 x 19" | VWR | 14220-048 | |
| 60mm petri dishes | Falcon | 351007 | |
| Sterile gauze pads | Honeywell Safety | 89133-086 | |
| Stomacher 80 Biomaster | Sewar Lab System | 030010019 | Triturate the brain tissue. |
| Stomacher 80 Blender Sterile Bags | Sewar Lab System | BA6040 | Sterile bag for the stomacher cell homogenizer. |
| Beaker 400mL | Pyrex | 1000 | |
| Sterile cell dissociation sieve, mesh #60 | Sigma-Aldrich Company | S1020 | To obtain a uniform single cell suspension. |
| Sterile cell dissociation sieve, mesh #100 | Sigma-Aldrich Company | S3895 | To obtain a uniform single cell suspension. |
| Invert phase microscope | Nikon | Eclypse Ti-S | Verify cells for contamination or abnormal cell growth. |
| 75cm2 sterile flasks | Falcon | 353136 | |
| Multi-well plate | Falcon | 353046 | |
| Micro cover glasses (coverslips), 18mm, round | VWR | 48380-046 | |
| Bright-Line hemacytometer | Sigma-Aldrich Company | Z359629 | |
| Pasteur pipettes | Fisher Scientific | 13-678-20D | |
| Ethyl alcohol | Sigma-Aldrich Company | E7023 | |
| L-leucine methyl ester hydrochloride 98% (LME) | Sigma-Aldrich Company | L1002 | Promotes the elimination of microglia cells in the primary cortical astrocyte cultutre. |
| Cytosine β-D-arabinofuranoside (Ara-C) | Sigma-Aldrich Company | C1768 | |
| Poly-D-Lysine Hydrobromide, mol wt 70,000-150,000 | Sigma-Aldrich Company | P0899 | |
| Trypsin/EDTA | GibCo. Company | 15400-054 | |
| Trypan Blue | Sigma-Aldrich Company | T8154 | |
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Sterile Water | Sigma-Aldrich Company | W3500 | |
| OGD Medium Preparation - step 5 | |||
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Dulbecco’s modified Eagle’s medium-free glucose | Sigma-Aldrich Company | D5030 | Supports the growth of cells. |
| Sodium bicarbonate | Sigma-Aldrich Company | S7277 | Supplement for the cell culture media. |
| Penicillin-Streptomycin | GibCo. Company | 15140-148 | Inhibits the growth of bacterias in the cell culture. |
| 200mM L-glutamine | GibCo. Company | 25030-081 | Amino acid that supplements the growth of cells. |
| Phospahet buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Filter System 50mL with 0.22um pore | Corning | 430320 | |
| Centrifuge conical tube 50 mL | VWR | 89039-658 | |
| Single Flow Meter | Billups-Rothenberg | SMF3001 | Measure gas flow in oxygen purge. |
| Hypoxia Incubator Chamber | StemCell | 27310 | Generates a hypoxic environment for the cell culture. |
| Traceable Dissolved Oxygen Meter | VWR | 21800-022 | |
| 95% N2/ 5% CO2 Gas Mixture | Linde | Purges the environment of oxygen. | |
| primary astrocyte immunofluorescence - step 6 | |||
| Phosphate buffer saline (PBS) tablets | Calbiochem | 524650 | |
| Formaline Solution Neutral Buffer 10% | Sigma-Aldrich | HT501128 | Solution used to fix cells. |
| Methanol | Fisher | A4544 | Solution used to fix cells. |
| Non-ionic surfactant (Triton X-100) | Sigma-Aldrich | T8787 | |
| Fetal bovine serum (FBS) | GibCo. Company | 10437-010 | Serum-supplement for the cell culture. |
| Anti-NeuN | Cell Signaling | 24307 | Detects mature neurons, serves to validate the astrocytic culture. |
| Anti-PCNA | Cell Signaling | 2586 | Detects proliferating cells. |
| Propidium Iodide (PI) | Sigma-Aldrich Company | P4170 | Apoptosis staining. |
| Anti-Olig1 | Abcam | AB68105 | Detects mature oligodendrocytes. |
| Anti-Iba1+ | Wako | 016-20001 | Detects microglial cells. |
| Anti-GFAP Conjugated with Cy3 | Sigma-Aldrich Company | C9205 | Detects reactive astrocytes in the treated cells. |
| Alexa Fluor 488 | Molecular Probe Life Technology | A1101 | Anti-Mouse Secondary Antibody |
| Alexa Fluor 555 | Molecular Probe Life Technology | A21428 | Anti-Rabbit Secondary Antibody |
| 4’,6’-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich Company | D9542 | Nuclear staining |
| Confocal microscope | Olympus |
References
- Goldstein, L. B., Bertels, C., Davis, J. N. Interrater reliability of the NIH stroke scale. Arch Neurol. 46 (6), 660-662 (1989).
- Hinkle, J. L., Guanci, M. M. Acute ischemic stroke review. J Neurosci Nurs. 39 (5), 285-293 (2007).
- Kassner, A., Merali, Z. Assessment of Blood-Brain Barrier Disruption in Stroke. Stroke. 46 (11), 3310-3315 (2015).
- Moskowitz, M. A., Lo, E. H., Iadecola, C. The science of stroke: mechanisms in search of treatments. Neuron. 67 (2), 181-198 (2010).
- Ben Haim, L., Carrillo-de Sauvage, M. A., Ceyzeriat, K., Escartin, C. Elusive roles for reactive astrocytes in neurodegenerative diseases. Front Cell Neurosci. 9, 278 (2015).
- Broderick, J., et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage in Adults 2007 Update: A Guideline From the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group: The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke. 38 (6), 2001-2023 (2007).
- Wang, R., et al. Oxygen-glucose deprivation induced glial scar-like change in astrocytes. PLoS One. 7 (5), e37574 (2012).
- Sofroniew, M. V. Reactive astrocytes in neural repair and protection. The Neuroscientist. 11 (5), 400-407 (2005).
- Sofroniew, M. V., Vinters, H. V. Astrocytes: biology and pathology. Acta neuropathologica. 119 (1), 7-35 (2010).
- Souza, D. G., Bellaver, B., Souza, D. O., Quincozes-Santos, A. Characterization of adult rat astrocyte cultures. PLoS One. 8 (3), e60282 (2013).
- Puschmann, T. B., et al. HB-EGF affects astrocyte morphology, proliferation, differentiation, and the expression of intermediate filament proteins. J Neurochem. 128 (6), 878-889 (2014).
- Robinson, C., Apgar, C., Shapiro, L. A. Astrocyte Hypertrophy Contributes to Aberrant Neurogenesis after Traumatic Brain Injury. Neural Plast. , 1347987 (2016).
- Brekke, E., Berger, H. R., Wideroe, M., Sonnewald, U., Morken, T. S. Glucose and Intermediary Metabolism and Astrocyte-Neuron Interactions Following Neonatal Hypoxia-Ischemia in Rat. Neurochem Res. , (2016).
- Cekanaviciute, E., et al. Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice. Glia. 62 (8), 1227-1240 (2014).
- Zhu, Z., et al. Inhibiting cell cycle progression reduces reactive astrogliosis initiated by scratch injury in vitro and by cerebral ischemia in vivo. Glia. 55 (5), 546-558 (2007).
- Bovolenta, P., Wandosell, F., Nieto-Sampedro, M. Neurite outgrowth over resting and reactive astrocytes. Restor Neurol Neurosci. 2 (4), 221-228 (1991).
- Anderson, M. A., et al. Astrocyte scar formation aids central nervous system axon regeneration. Nature. 532 (7598), 195-200 (2016).
- Hao, C., Richardson, A., Fedoroff, S. Macrophage-like cells originate from neuroepithelium in culture: characterization and properties of the macrophage-like cells. Int J Dev Neurosci. 9 (1), 1-14 (1991).
- Saura, J. Microglial cells in astroglial cultures: a cautionary note. J Neuroinflammation. 4, 26 (2007).
- Giulian, D., Baker, T. J. Characterization of ameboid microglia isolated from developing mammalian brain. J Neurosci. 6 (8), 2163-2178 (1986).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).
- Armstrong, R. C. Isolation and characterization of immature oligodendrocyte lineage cells. Methods. 16 (3), 282-292 (1998).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Pont-Lezica, L., Colasse, S., Bessis, A. Depletion of microglia from primary cellular cultures. Methods Mol Biol. 1041, 55-61 (2013).
- Svensson, M., Aldskogius, H. Synaptic density of axotomized hypoglossal motorneurons following pharmacological blockade of the microglial cell proliferation. Exp Neurol. 120 (1), 123-131 (1993).
- Wong, V. K., Shapourifar-Tehrani, S., Kitada, S., Choo, P. H., Lee, D. A. Inhibition of rabbit ocular fibroblast proliferation by 5-fluorouracil and cytosine arabinoside. J Ocul Pharmacol. 7 (1), 27-39 (1991).
- Nakatsuji, Y., Miller, R. H. Density dependent modulation of cell cycle protein expression in astrocytes. J Neurosci Res. 66 (3), 487-496 (2001).
- Reeves, J. P. Accumulation of amino acids by lysosomes incubated with amino acid methyl esters. J Biol Chem. 254 (18), 8914-8921 (1979).
- Thiele, D. L., Kurosaka, M., Lipsky, P. E. Phenotype of the accessory cell necessary for mitogen-stimulated T and B cell responses in human peripheral blood: delineation by its sensitivity to the lysosomotropic agent, L-leucine methyl ester. J Immunol. 131 (5), 2282-2290 (1983).
- Hamby, M. E., Uliasz, T. F., Hewett, S. J., Hewett, J. A. Characterization of an improved procedure for the removal of microglia from confluent monolayers of primary astrocytes. J Neurosci Methods. 150 (1), 128-137 (2006).
- Corvalan, V., Cole, R., de Vellis, J., Hagiwara, S. Neuronal modulation of calcium channel activity in cultured rat astrocytes. Proc Natl Acad Sci U S A. 87 (11), 4345-4348 (1990).
- Butler, I. B., Schoonen, M. A., Rickard, D. T. Removal of dissolved oxygen from water: A comparison of four common techniques. Talanta. 41 (2), 211-215 (1994).
- Tasca, C. I., Dal-Cim, T., Cimarosti, H. In vitro oxygen-glucose deprivation to study ischemic cell death. Methods Mol Biol. 1254, 197-210 (2015).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. J Vis Exp. (54), (2011).
- Rivera-Aponte, D., et al. Hyperglycemia reduces functional expression of astrocytic Kir4. 1 channels and glial glutamate uptake. Neuroscience. 310, 216-223 (2015).
- Berger, R., Garnier, Y., Pfeiffer, D., Jensen, A. Lipopolysaccharides do not alter metabolic disturbances in hippocampal slices of fetal guinea pigs after oxygen-glucose deprivation. Pediatric research. 48 (4), 531-535 (2000).
- Anderson, T. R., Jarvis, C. R., Biedermann, A. J., Molnar, C., Andrew, R. D. Blocking the anoxic depolarization protects without functional compromise following simulated stroke in cortical brain slices. Journal of neurophysiology. 93 (2), 963-979 (2005).
- Jarvis, C. R., Anderson, T. R., Andrew, R. D. Anoxic depolarization mediates acute damage independent of glutamate in neocortical brain slices. Cerebral Cortex. 11 (3), 249-259 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved