A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنوعا تصاعد الطريقة على المدى الطويل التصوير التنمية الزرد
In This Article
Summary
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Abstract
الأجنة الزرد توفر نظام تجريبي مثالي لدراسة عمليات التخلق معقدة نظرا لسهولة الوصول من والشفافية البصرية. على وجه الخصوص، واستطالة مؤخرة الجسم هي عملية أساسية في التطور الجنيني الذي تشوهات الأنسجة متعددة تعمل معا لتوجيه تشكيل جزء كبير من محور الجسم. من أجل مراقبة هذه العملية على المدى الطويل الوقت الفاصل بين التصوير من الضروري الاستفادة من تقنية متزايدة على أن يسمح الدعم الكافي للحفاظ على عينات في الاتجاه الصحيح أثناء نقلها إلى المجهر والاستحواذ. وبالإضافة إلى ذلك، يجب أن تصاعد أيضا توفير حرية كافية الحركة للنمو في المنطقة مؤخرة الجسم دون التأثير على تطورها الطبيعي. وأخيرا، يجب أن يكون هناك درجة معينة في براعة طريقة التركيب للسماح التصوير في التصوير المتنوعة مجموعة عمليات. هنا، نقدم تقنية متزايدة لتصوير تطوير الخلفي الجسم elongatioن في الزرد D. rerio. وتنطوي هذه التقنية المتزايدة الأجنة بحيث مناطق الرأس والكيس المحي مدرجة بالكامل تقريبا في الاغاروز، بينما تترك خارج المنطقة مؤخرة الجسم إلى استطال وتتطور بشكل طبيعي. سوف نظهر كيف يمكن تكييفها لتستقيم، مقلوب والرأسي للضوء ورقة المجهر مجموعة عمليات. في حين يركز هذا البروتوكول على تصاعد الأجنة للتصوير لمؤخرة الجسم، ويمكن بسهولة أن تتكيف لتصوير حي من جوانب متعددة للتنمية الزرد.
Introduction
الخلفي الجسم استطالة عملية أساسية في التطور الجنيني الذي الجنين يمتد لتشكيل جزء كبير من محور الجسم. إنه مثال لعملية التخلق المعقدة التي السلوكيات خلايا متعددة تعمل coordinately لتوليد التشكل على مستوى الأنسجة الفردية. هذه التشوهات الأنسجة التفاضلية ثم تعمل معا لتوليد استطالة من مؤخرة الجسم على مستوى الهيكل كله. ولكي نفهم كيف يتم التحكم في هذه العمليات وتنسيقها خلال التنمية، يجب أن تكون قادرة على متابعة هذه العمليات على مستويات متعددة (أي على مستوى الجزيئات والخلايا والسكان والأنسجة الخلية) وربط هذا مباشرة إلى التشكل من هيكل كامل .
الأجنة الزرد مثالية للتصوير الخلفي الجسم استطالة كما شفافيتها البصرية وحجم صغير يسمح لتطبيق التصوير ضوء مينيملي نهج مناسبة تماما لليفالبريد التصوير. (1) وقد تجلى ذلك من خلال سلسلة من المنشورات الحديثة التي تسلط الضوء على تطور الجسم الخلفية على مستوى الجزيئات، 2 الخلايا واحد و 3 و بين الأنسجة السلوكيات، 4 وكذلك على مستوى السكان الخلايا والجهاز كله. 5
تقنيات التصوير المتقدمة مثل متحد البؤر، المجهري متعددة الفوتون وطائرة انتقائية إضاءة المجهر (SPIM) وتمكن من التصوير على المدى الطويل من العمليات التنموية مع انخفاض تأثير سمية الخفيفة والصور وتبييض. مطلوبة تقنيات قوية لاقامة عينات حية لتحقيق ثلاثة أهداف: 1) الدعم الكافي للحفاظ على عينات في الاتجاه الصحيح أثناء نقلها إلى المجهر وخلال الاستحواذ، 2) حرية كافية للحركة من العينة للسماح ثمرة المنطقة مؤخرة الجسم دون التأثير على جمعة العادياإلمنائية، وأخيرا 3) درجة معينة في براعة طريقة التركيب للسماح التصوير في التصوير المتنوعة مجموعة عمليات.
هذا البروتوكول يدخل تقنية متزايدة لتصوير تطوير الزرد D. rerio. وتنطوي هذه التقنية المتزايدة الأجنة بحيث مناطق الرأس والكيس المحي مدرجة بالكامل تقريبا في الاغاروز، في حين ترك المنطقة مؤخرة الجسم إلى استطال وتتطور بشكل طبيعي. على هذا النحو، بل هو أيضا وسيلة مناسبة للتصوير على المدى الطويل من مناطق أخرى من الجسم النامية في الاغاروز يمكن التصوير من خلال تقنيات ضوء التصوير القياسية. هذا البروتوكول يوضح تصاعد الأجنة في اتجاه جانبي، على الرغم من أنه من الممكن أيضا إلى جبل الأجنة في توجهاتها بديل. وسوف تظهر كذلك كيف للتكيف مع أسلوب الاجهزة المجهر الخفيفة ورقة تستقيم، مقلوب والرأسية.
Protocol
1. إعداد حلول وسحبت زجاج إبرة
- جعل حل 25X الأسهم من تريكين (3-أمينو حمض البنزويك إيثيل استر، وتسمى أيضا إيثيل 3-أمينوبنزوات) في 4 ملغ / مل في 20 ملي تريس درجة الحموضة 8.8 و تحقيق ذلك الحل هو في درجة الحموضة 7. قسامة من 4 مل وتخزينها في -20 درجة مئوية.
ملاحظة: تريكين مخدر يعمل بشكل تفضيلي على قنوات الصوديوم الجهد بوابات العصبية وبالتالي عرقلة ارتعاش العضلات وحركة 6. - جعل حل العاملة من تريكين بتركيز نهائي من 0.17 ملغ / مل في E3 الجنين المتوسطة. 7
ملاحظة: أجعل تريكين حل العمل بشكل إرتجالي مثل الرقم الهيدروجيني لهذا الحل الانجرافات. - حل نقطة انصهار منخفضة agarose إلى تركيز النهائي من 1.5٪ في E3 المتوسطة الجنين في أنبوب 50 مل عن طريق تسخين الحل في الميكروويف. السماح لهذا الحل تتوازن إلى 42-45 درجة مئوية في أي حمام مائي أو مقعد بين كبار الحاضنة. إذا إعداد أطباق كبيرة لالرأسيضوء ورقة التصوير (الخطوة 4)، وجعل على 25 مل إضافية من ذوبان قياسي 1٪ الاغاروز في E3 الجنين المتوسطة.
- استخدام الزجاج البورسليكات مع الشعيرات الدموية خيوط مع أبعاد OD 1.20 مم، الرقم 0.69 ملم، وطول 10 مم.
- إذا تم سحب الشعيرات الدموية على نوع من التدفئة خيوط إبرة مجتذب موضح في الجدول من المعدات والكواشف، واستخدام الإعدادات التالية: الحرارة 600، سحب 120، السرعة 50، الوقت 225، 500. الضغط مع زوج من الملقط حادة، وكسر الإبرة الماضي فقط النقطة التي تنثني لإنشاء إبرة نظيفة وحادة لويوجه الأجنة وإزالة الاغاروز الزائد. ويمكن أيضا مشرط الصغير أن تستخدم لإزالة الاغاروز الزائد.
2. تضمين الأجنة لمقلوب أو المجهر تستقيم
- رفع الأجنة تصل إلى مرحلة مناسبة في E3 الجنين المتوسطة. 7
- في المرحلة المطلوبة والأجنة dechorionate مع زوج من الملقط حادة تحتها dissec مجهرتينغ المجهر.
- احتضان الأجنة dechorionated لمدة 5 دقائق على الأقل في العمل الحل تريكين.
- بمجرد أن يبرد الحل الاغاروز ذاب إلى 45 درجة مئوية، واستخدام ماصة باستير الزجاج لنقل الأجنة dechorionated مباشرة في أنبوب 50 مل مع نقل الحد الأدنى من E3 المتوسطة.
- إزالة الجنين جنبا إلى جنب مع ما يقرب من 1 مل من تصاعد المتوسطة وإضافة تقريبا. 100 ميكرولتر من تصاعد المتوسطة جنبا إلى جنب مع الجنين إلى دائرة مركزية من القاع الزجاج طبق بتري 35 ملم مع microwell 10 ملم.
- كما هو وضع والمتوسطة المتزايدة، نقل الجنين إلى حافة دائرة الاغاروز مع الذيل تواجه الخارج (الشكل 1A). استخدام إبرة الشعرية للحفاظ على الجنين في الاتجاه الأفقي المطلوب حتى يتم تعيين هلام تماما. لصورة الجسم تنمية الخلفي، ورعاية لتوجيه الجنين في مثل الجانبي التوجه وقت ممكن. لذلك، والحفاظ على الجنين في هذا الموقف الذي adjustmen دقيقةنهاية الخبر مع الإبرة الشعرية.
ملاحظة: يمكن إضافة أجنة متعددة إلى طبق متزايدة في هذه النقطة، إذا لزم الأمر. إذا كان هذا هو الحال، ونقل المنخفضة للذوبان الاغاروز في طبق أولا وإضافة الأجنة إلى وسط انخفاض الاغاروز. ثم، ودفع الأجنة إلى حواف من الحلبة الزجاج وتوجيه في الموضع المطلوب. ما يصل الى ستة أجنة يمكن تركيبه على هذا النحو قبل الاغاروز يصبح طدت.
3. إزالة الزائدة الاغاروز في جميع أنحاء الجسم الخلفي
ملاحظة: يصف هذا القسم الإجراء الذي يتم إزالة الاغاروز من المنطقة المحيطة مؤخرة الجسم. في حالة استطالة مؤخرة الجسم، فمن المهم التأكد من أن الذيل يمكن أن تنمو التدريجي بشكل طبيعي. عن طريق إزالة الاغاروز بعد الجنين قد أدرج تماما من الاغاروز، وتركت المغلقة الجنين من منطقة الرأس وما يقرب من نصف الكيس المحي.
- مرة واحدة وضعت قطرة الاغاروز، إغراق بتري ديSH مع الحل العمل تريكين.
- تحت المجهر مجهر تشريح مع ينتقل الضوء قاعدة، وضبط الموقف مرآة وزاوية الضوء الساقط بحيث تباين قوي يسمح للتخفيضات في الاغاروز أن نرى بوضوح من خلال العملية.
- لأداء قطع 1 (الشكل 1)، استخدم إبرة الشعرية أو مشرط الصغيرة إلى قطع الأغاروس منتصف الطريق على طول صفار، من موقف الخلفي فقط إلى مجال القلب تشكيل لموقف الجسيدة 5 (الموافق 5 الجسيدة الأمامية).
- بدء خفض الأولي المجاور لقلب تشكيل كما هو مبين، والطريقة كاملة من خلال الاغاروز على الزجاج.
- حفاظ على شعري أو مشرط الدقيقة في أعماق الاغاروز، وببطء شهدت صعودا وهبوطا في حين بدأت اجراء خفض طويل على الجنين كما هو موضح الشكل 1. قطع أقرب إلى الجنين ممكن من دون ثقب الجنين أو صفار البيض.
- بعد ذلك، جعل التخفيضات 2 و 3 (الشكل 1 )، بدءا من موقف ضد الجنين ومع قطع السير في هذا الطريق وصولا الى الزجاج قاع الطبق. جعل خفض 2 بحيث يكون عرضية إلى 5 القطع البدنية النمطية الأولى، والسماح لdorsalward كامل تتكشف من مؤخرة الجسم. جعل خفض 3 في زاوية 90 درجة مع سطح الصفار وبدءا من هارتفيلد.
ملاحظة: قص الاغاروز حتى حافة الدائرة الزجاج (كما هو موضح في الشكل رقم 1) يساعد في إزالة الاغاروز ككتلة كاملة (الخطوة 3.6). ومع ذلك، هذا ليس ضروريا. - بدءا من تقاطع تخفيضات 1 و 3، وجعل قطع قطري البطيء نحو نهاية قطع 2 في حين رفع ببطء صعودا من أجل إزاحة مربع من الاغاروز المحيطة مؤخرة الجسم.
ملاحظات: في بعض الحالات، سيصدر هذا في كتلة واحدة والانتهاء من عملية في آن واحد. وفي حالات أخرى، قد يستغرق عدة محاولات لتضليل تقديم كل الاغاروز التي تحيط بالجنين. - مع زوج من الملقط حادة، وإزالة ب فكهاخصلات الاغاروز من المتوسط الجنين. للمساعدة في هذه العملية، تحريك القطع الاغاروز إلى جانب الطبق واستخدام جدار طبق بتري عن الدعم في حين رفع من القطع الأغاروس.
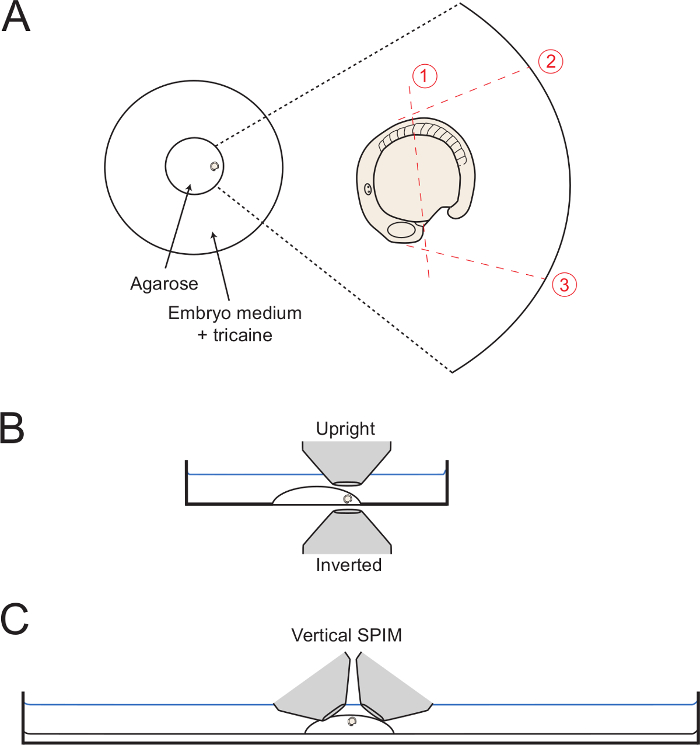
الشكل 1: رسم تخطيطي لتركيب المنبثقة تعيين. (A) ويبين الرسم موقف الجنين شنت داخل الحلبة وسط الزجاج طبق بتري. على اليمين هو تقريب الجنين مع كل قطع على التوالي من خلال المحيطة يظهر الاغاروز مع خطوط حمراء dottted. وتخطيطي (ب) الأجنة التي شنت في النظر الجانبي عرض سهولة الوصول لكل الأهداف المقلوب وتستقيم. (ج) وحرفين متتاليين مماثلة تبين كيف يمكن تركيبه الأجنة لالرأسي ورقة الخفيفة التصوير مجموعة عمليات. يرجى CLإك هنا لمشاهدة نسخة أكبر من هذا الرقم.
- إذا لا يتم حظر ارتعاش العضلات تماما في هذه النقطة، إضافة قطرات من تريكين من محلول المخزون من 4 ملغ / مل، ودرجة الحموضة 7.
4. تصاعد الأجنة لعمودي ضوء ورقة المجهر
ملاحظة: هذا هو الاختلاف على طريقة المبينة أعلاه أن يسمح للوصول لأهداف متعددة للتصوير من العينات التي SPIM الموجه رأسيا. الفكرة من وراء هذا الاختلاف هو رفع عينة أعلى قليلا من أسفل الطبق، للسماح لسهولة الوصول هدفين التصوير.
- قبل أخذ عينات تصاعد، ومعطف 100 ملم البلاستيك طبق بتري مع 1٪ الاغاروز في E3 المتوسطة على ارتفاع 5 مم والسماح لتعيين.
- ضع قطرة من 1 مل-انصهار منخفضة نقطة الاغاروز إلى وسط الطبق والسماح لضبط.
- الأجنة تضمينها في ذوبان منخفضة نقطة الاغاروز كما في القسم 2. ومع ذلك، هذه المرة، وإزالة الجنين من الأنبوب 50 ملمن الاغاروز مع انخفاض أصغر من حل (0.5 مل)، ووضع هذه قطرة صغيرة على الجزء العلوي من 1 مل قطرة في وسط الطبق.
- استخدام إبرة الشعرية لوضع الجنين في وسط قطرة صغيرة والحفاظ على التوجه الصحيح حتى يتم تعيين هلام.
- الفيضانات الطبق مع الحل العمل تريكين وإزالة الاغاروز الزائدة كما هو الحال في القسم 3 ولكن من دون قطع طريق وسادة من الاغاروز معيار 1٪.
النتائج
بروتوكول المبينة أعلاه تفاصيل تقنية تنوعا لاقامة الأجنة الزرد على المدى الطويل التصوير الفاصل الزمني. ويرد مثال على ذلك في الشكل 2A وفي الرسوم المتحركة / فيديو الشكل 1. تم حقن الأجنة في مرحلة 1 خلية مع مرنا ترميز بروتين فلوري photoconvertib...
Discussion
وتمكن هذه التقنية المتزايدة الأجنة أن تبقى تزال أثناء نقلها إلى المجهر وعلى المدى الطويل التجارب الوقت الفاصل بين التصوير تستهدف التالية الخلفية استطالة الجسم على مستويات طول متعددة. وعلاوة على ذلك، فمن تنوعا لأنه يتيح للتصوير على حد سواء وتستقيم المقلوب المجهر مج?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
References
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved