Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Универсальный способ крепления для Long Term Визуализация данио развития
В этой статье
Резюме
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Аннотация
Эмбрионы рыбок данио предлагают идеальную экспериментальную систему для изучения сложных морфогенетических процессов из-за легкости их доступности и оптической прозрачности. В частности, удлинение задний корпус является важным процессом эмбрионального развития, с помощью которых множественные деформации ткани действуют вместе, чтобы направлять формирование значительной части оси тела. Для того чтобы наблюдать этот процесс долгосрочного покадровой обработки изображений необходимо использовать монтажную технику, которая позволяет достаточную поддержку, чтобы сохранить образцы в правильной ориентации во время передачи в микроскоп и приобретения. Кроме того, крепление должно также обеспечить достаточную свободу движения для разрастания области тела заднего, не влияя на его нормальное развитие. Наконец, должна быть определенная степень в универсальности метода монтажа, чтобы позволить визуализацию на различных изображений наборах. Здесь мы представляем монтажную технику для визуализации развития заднего elongatio телап в данио D. rerio. Этот метод включает в себя монтаж эмбрионов таким образом, что участки головы и желтка почти полностью включены в агарозы, оставляя вне области тела задней удлиняется и нормально развиваться. Мы покажем , как это может быть адаптирована для вертикально, перевернутый и вертикальной световой микроскопии листа Наладки. Хотя этот протокол фокусируется на монтаже эмбрионов для визуализации для заднего тела, она легко может быть адаптирована для живого изображения нескольких аспектов данио развития.
Введение
Задней тела удлинение является важным процессом в эмбриональном развитии, с помощью которого эмбрион простирается, чтобы сформировать большую часть оси тела. Это является примером сложного морфогенетического процесса, с помощью которого несколько поведение ячеек действуют скоординировано для генерации морфогенез на уровне отдельных тканей. Эти деформации дифференциальной ткани затем действовать вместе, чтобы сформировать удлинение заднего тела на уровне целого структуры. Для того, чтобы понять , каким образом контролируются и координируются в процессе развития этих процессов, мы должны быть в состоянии следовать за этими процессами в различных масштабах (т.е. на уровне молекул, клеток, популяций и клеточные ткани) и связать это непосредственно к морфогенеза всей структуры ,
Эмбрионы рыбок данио идеально подходят для формирования изображения заднего удлинения тела, как их оптическая прозрачность и малый размер позволяет для применения минимально инвазивной визуализации света подходы хорошо подходят для Livэлектронной визуализации. 1 Об этом свидетельствует ряд недавних публикаций , которые пролили свет на развитие заднего тела на уровне молекул, 2 отдельные клетки, 3 и между тканевые поведения, 4, а также на уровне популяции клеток и целого органа. 5
Передовые методы визуализации, такие как конфокальной, многофотонной микроскопии и селективной плоскости освещения микроскопии (SPIM) включаете долгосрочную визуализацию процессов развития со снижением эффекта легкой токсичности и фото-отбелки. Надежные методы для монтажа живых образцов необходимы для достижения трех целей: 1) достаточной поддержки для сохранения образцов в правильной ориентации во время передачи в микроскоп и во время приобретения, 2) достаточная свобода передвижения образца, чтобы для вырост область задней тела, не затрагивая его нормальную Develвитие, и, наконец, 3) в определенной степени в универсальности метода монтажа, чтобы обеспечить визуализацию на различных изображений наборах.
Этот протокол вводит монтажный метод для получения изображения на развитие данио Д. rerio. Этот метод включает в себя монтаж эмбрионов таким образом, что участки головы и желтка почти полностью включены в агарозы, оставляя область тела заднюю удлиняется и нормально развиваться. Таким образом, он также является подходящим методом для долгосрочной визуализации других регионов развивающегося тела, как агароза позволяет визуализации с помощью стандартных методов визуализации света. Этот протокол демонстрирует монтаж эмбрионов в боковой ориентации, хотя также можно монтировать эмбрионов в альтеративного ориентаций. Она будет и далее показано, как адаптировать метод вертикально, перевернутых и вертикальных световых листов микроскопии установок.
протокол
1. Приготовление растворов и потянула Стекло иглы
- Сделать 25х исходный раствор Tricaine (3-амино-этиловый эфир бензойной кислоты, называемый также этиловый эфир 3-аминобензойной кислоты) в дозе 4 мг / мл в 20 мМ Трис, рН 8,8, и довести, что раствор при рН 7. аликвоты с помощью 4 мл и хранят при -20 ° С.
ПРИМЕЧАНИЕ: анестетик Tricaine действует преимущественно на нейронные напряжения закрытого натриевых каналов , тем самым блокируя подергивание мышц и движение 6. - Сделать рабочий раствор Tricaine при конечной концентрации 0,17 мг / мл в среде E3 эмбриона. 7
Примечание: Сделать Tricaine рабочего раствора экспромтом как рН этого раствора дрейфует. - Растворите температура плавления агарозы с низкой до конечной концентрации 1,5% в Е3 эмбриона среды в 50 мл трубки путем нагревания раствора в микроволновой печи. Пусть это решение уравновешивания до 42 - 45 ° C в любой водяной бане или настольном инкубаторе. При приготовлении больших блюд для вертикальнойсветло-лист изображений (этап 4), чтобы дополнительно 25 мл 1% -ного стандартного плавление агарозы в Е3 эмбриона среде.
- Использование боросиликатного стекла с капиллярами накаливания с размерами OD 1,20 мм, ID 0,69 мм, длина 10 мм.
- Если капилляры натянул типа нагрева нити накала иглы съемника , описанной в Таблице оборудования и реагентов, используйте следующие настройки: Тепло 600, Pull 120, скорость 50, Время 225, давление 500. С парой острых щипцов, перерыв игла просто мимо точки, в которой она сгибается для создания чистой и острой иглой для ориентировки эмбрионов и удаления избытка агарозы. Микро-скальпель также может быть использован для удаления избытка агарозы.
2. Вложение зародыши для инверсией или Upright микроскопией
- Поднимите эмбрионов до соответствующей стадии в E3 эмбриона среде. 7
- На нужной стадии, dechorionate эмбрионы с парой острых щипцов под бинокулярным dissecтин микроскоп.
- Инкубируйте dechorionated эмбрионов в течение не менее 5 мин в рабочем растворе Tricaine.
- После того, как расплавленную агарозу как раствор охлаждают до 45 ° С, используют стекло пипетки Пастера, чтобы передать dechorionated эмбриона непосредственно в 50 мл пробирку с минимальной передачей E3 среды.
- Удалить эмбрион вместе с примерно 1 мл среды монтажа и добавьте ок. 100 мкл среды монтажа вместе с эмбрионом к центральной окружности 35 мм со стеклянным дном чашки Петри с 10 мм микролунку.
- Как установка установочная среда, переместите эмбрион к краю круга агарозы с хвостом наружу (Фигура 1А). Используйте капиллярную иглу для поддержания эмбриона в желаемой боковой ориентации, пока гель полностью не установлен. Для развития задней образа тела, заботиться, чтобы сориентировать эмбриона в качестве боковой ориентации, как это возможно. Таким образом, сохранить зародыш в этом положении путем тщательного adjustmenTS с капиллярной иглой.
Примечание: Несколько эмбрионы могут быть добавлены к монтажной чашке в этот момент, в случае необходимости. Если дело обстоит именно так, перенесите легкоплавкой агарозы в чашку и добавьте первый эмбрионов к центру агарозы капли. Затем раздвинуть эмбрионы к краям стеклянного кольца и ориентируют в требуемое положение. До шести эмбрионов может быть установлен таким образом, прежде чем агароза становится затвердевает.
3. Удаление излишков агарозном вокруг тела Posterior
Примечание: В этом разделе описана процедура, с помощью которого агарозы удаляется из области, окружающей задний корпус. В случае удлинения задних тела, важно, чтобы убедиться, что хвост может подращивания нормально. Удаляя агарозы после того, как эмбрион был полностью включен агарозы, эмбрион остается обнесена области головы и примерно половину желтка.
- После агарозном падение установило, наводнение чашках диШ. с рабочим раствором Tricaine.
- Под рассекает бинокулярный микроскоп с переданным-светлым основанием, отрегулируйте положение зеркала и угла падающего света таким образом, что сильный контраст позволяет для сокращения агарозы, чтобы быть хорошо видно через операцию.
- Для выполнения вырезать 1 (рисунок 1), используйте капиллярную иглу или микро-скальпель , чтобы разрезать агарозы на полпути вдоль желтком, с позиции только позади формовочного поля сердца к положению сомит 5 (5 - й передняя сомитов).
- Начало первоначальный разрез, прилегающих к формовочной сердца, как показано, а также полный путь через агарозы к стеклу.
- Держите капилляр или микро-скальпель глубоко внутри агарозы, и медленно увидел вверх и вниз , в то время как начинают делать длинный разрез над эмбрионом , как показано на рисунке 1. Вырезать как можно ближе к эмбриону, как это возможно, не прокалывая эмбриона или желток.
- Затем, сделайте разрезы 2 и 3 (рис 1 ), Начиная с позиции против эмбриона и с разрезом пройдя весь путь вниз к стеклу дном блюдо. Сделать вырезать 2 таким образом, что он проходит по касательной к первым 5 сомитов, что позволяет полной dorsalward разворачивание заднего тела. Сделать вырезать 3 под углом к поверхности желтка 90 ° и, начиная с Хартфилда.
Примечание: не Режущий агарозы до края стеклянного круга (как показано на рисунке 1) помогает при удалении агарозы в качестве полного блока (этап 3.6). Тем не менее, в этом нет необходимости. - Начиная на пересечении разрезов 1 и 3, сделать медленный диагональный срез в направлении конца разреза 2 в то время как медленно поднимая вверх для того, чтобы сместить квадрат агарозы окружающих заднюю тела.
Примечания: В некоторых случаях это будет выпущен в одном блоке и операция завершается за один раз. В других случаях, это может занять несколько попыток дис-ложи все агарозы, окружающий зародыш. - С парой острых щипцов, удалите выбили бзамки агарозы из эмбриона среды. Чтобы помочь в этом процессе, перемещать агарозном части в сторону тарелки и использовать стенку чашки Петри в то время как поддержка подъема из агарозном куски.
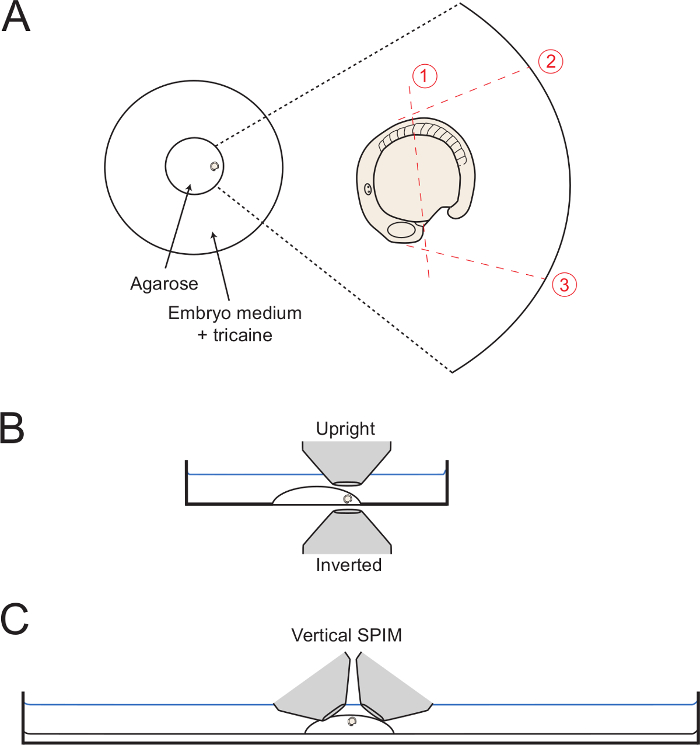
Рисунок 1: Схемы Монтажное Наладки. (A) На диаграмме показано положение смонтированного эмбриона в пределах центра стеклянного кольца Петри. Справа является увеличение эмбриона с каждым последующим разрезом через окружающий агарозы показано с dottted красными линиями. (Б) смонтированные эмбрионы, показана на виде сбоку отображая легкость доступа для обоих перевернутых и вертикальных целей. (C) Аналогичный биграмма , показывающий , как эмбрионы могут быть установлены для вертикального света листа изображений Наладки. Пожалуйста , клИк здесь, чтобы посмотреть увеличенную версию этой фигуры.
- Если подергивание мышц не полностью заблокирован в тот момент, добавьте капли Tricaine из маточного раствора 4 мг / мл, рН 7.
4. Монтаж Эмбрионы для вертикального световой микроскопии листа
Примечание: Это вариация на тему описанного выше метода, который позволяет для доступа нескольких задач для работы с изображениями образцов вертикально-ориентированной SPIM. Идея этой вариации, чтобы поднять образец немного выше, чем дно тарелки, чтобы обеспечить легкий доступ двух целей визуализации.
- До крепления образца пальто 100 мм пластиковая чашка Петри с 1% агарозы в Е3 среде до высоты 5 мм и позволяют установить.
- Поместите каплю 1 мл легкоплавкой агарозе в центр чашки и позволяют установить.
- Код для вставки эмбрионов в низкой температурой плавления агарозы как в разделе 2. Тем не менее, на этот раз, удалить эмбрион из 50 мл трубкиагарозы с меньшим каплю раствора (0,5 мл) и поместите эту небольшую каплю на верхней части по 1 мл падение в центр чашки.
- С помощью капиллярной иглы, чтобы поместить эмбрион в центре маленькой капли и поддерживать его правильную ориентацию до тех пор, пока гель не установлен.
- Наводнение блюдо с рабочим раствором Tricaine и удалить излишки агарозы, как и в разделе 3, но без разреза через подушку 1% стандартной агарозы.
Результаты
Протокол описанных выше подробно универсальный метод для монтажа эмбрионов данио для длительного визуализации времени истечения. Пример этого показан на фигуре 2А , и в анимации / видео Рисунок 1. Эмбрионы вводили на стадии 1 клеток с мРНК, кодирующей ...
Обсуждение
Эта монтажная техника позволяет эмбрионы должны храниться до сих пор в процессе передачи на микроскоп и более долгосрочных экспериментов покадровой обработки изображений, направленных на следующие заднего удлинения тела в различных масштабах длины. Кроме того, он является универсал...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Материалы
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
Ссылки
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены