É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método de montagem versátil para Long Term Imagens de Desenvolvimento Zebrafish
Neste Artigo
Resumo
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Resumo
embriões de peixe-zebra oferecer um sistema experimental ideal para estudar processos morfogenéticos complexas devido à sua facilidade de acessibilidade e transparência óptica. Em particular, o alongamento do corpo posterior é um processo essencial do desenvolvimento embrionário, através da qual múltiplos deformações tecido agir em conjunto para dirigir a formação de uma grande parte do eixo do corpo. A fim de observar esse processo por meio de imagens de lapso de tempo de longo prazo, é necessário utilizar uma técnica de montagem que permite um apoio suficiente para manter amostras na orientação correta durante a transferência para o microscópio e aquisição. Além disso, a montagem também deve proporcionar liberdade suficiente de movimento para a excrescência da região do corpo posterior, sem afectar o seu desenvolvimento normal. Finalmente, deve haver um certo grau de versatilidade do método de montagem para permitir a imagiologia em diversas imagem set-ups. Aqui, apresentamos uma técnica de montagem para a imagiologia do desenvolvimento de posterior elongatio corpon no peixe-zebra D. rerio. Esta técnica envolve a montagem de embriões de tal forma que as regiões da cabeça e do saco vitelino são quase inteiramente incluídas no agarose, deixando de fora região do corpo posterior para alongar e desenvolver normalmente. Vamos mostrar como isso pode ser adaptado para microscopia de luz folhas na vertical, invertida e vertical set-ups. Embora este protocolo centra-se na montagem de embriões para a imagem latente para o corpo posterior, poderia ser facilmente adaptado para a imagem ao vivo de vários aspectos do desenvolvimento do peixe-zebra.
Introdução
Posterior alongamento corpo é um processo essencial do desenvolvimento embrionário em que o embrião se estende de modo a formar uma grande parte do eixo do corpo. É um exemplo de um processo morfogenético complexo, através da qual vários comportamentos de células agir coordenadamente para gerar a morfogénese no nível de tecidos individuais. Estas deformações tecido diferencial, em seguida, actuar em conjunto para gerar o alongamento do corpo posterior em todo o nível da estrutura. Para entender como esses processos são controlados e coordenados durante o desenvolvimento, que deve ser capaz de seguir esses processos em múltiplas escalas (ou seja, no nível de moléculas, células, populações de células e tecidos) e relacionar esta diretamente para a morfogênese de toda a estrutura .
embriões de peixe-zebra são ideais para imagiologia alongamento posterior do corpo como a sua transparência óptica e pequeno tamanho permite a aplicação de luz de imagens minimamente invasiva abordagens bem adequado para live imagiologia. 1 Isto foi evidenciado por uma série de publicações recentes que lançaram luz sobre o desenvolvimento corporal posterior ao nível de moléculas, 2 células individuais, 3 e inter-tecidos comportamentos, 4, bem como ao nível da população celular e órgão inteiro. 5
técnicas de imagem avançadas, como confocal, microscopia multi-fotão e microscopia de iluminação avião seletiva (SPIM) estão permitindo que a imagem a longo prazo dos processos de desenvolvimento, com efeitos de toxicidade luz e foto-branqueamento diminuiu. técnicas robustas para a montagem de amostras vivas são necessárias para atingir três objectivos: 1) um apoio suficiente para manter as amostras na orientação correcta, durante a transferência para o microscópio e durante a aquisição, 2) liberdade de movimento suficiente da amostra para permitir a excrescência de a região do corpo posterior sem afectar a sua devel normaisvolvimento, e, finalmente, 3) um certo grau de versatilidade do método de montagem para permitir a imagiologia em diversas imagem set-ups.
Este protocolo apresenta uma técnica de montagem para a imagiologia do desenvolvimento do peixe-zebra D. rerio. Esta técnica envolve a montagem de embriões de tal forma que as regiões da cabeça e do saco vitelino são quase inteiramente incluídas na agarose, deixando região do corpo posterior para alongar e desenvolver normalmente. Como tal, também é um método adequado para a imagiologia de longo prazo de outras regiões do corpo em desenvolvimento como a agarose permite imagiologia por meio de técnicas de imagiologia de luz padrão. Este protocolo demonstra a montagem de embriões em uma orientação lateral, embora também seja possível a montagem em orientações embriões alternativos. Ela vai mostrar ainda mais como adaptar o método para configurações de microscopia na vertical, invertida e verticais de luz folhas.
Protocolo
1. Preparação de Soluções e puxou vidro Needle
- Adicione uma solução de estoque de 25x tricaina (3-amino éster de etilo do ácido benzóico, também chamado de acetato de 3-aminobenzoato de metilo) a 4 mg / mL em Tris 20 mM, pH 8,8 e trazer esta solução é a pH 7. alíquota, de 4 ml e armazenar a -20 ° C.
NOTA: O tricaina anestésico actua preferencialmente nos canais de sódio dependentes da voltagem neurais bloqueando assim espasmos musculares e movimento 6. - Adicione uma solução de trabalho de tricaina a uma concentração final de 0,17 mg / mL em meio de embrião E3. 7
NOTA: Faça o tricaina solução de trabalho de improviso como o pH desta solução deriva. - Dissolve-se o de agarose de baixo ponto de fusão até uma concentração final de 1,5% em meio de embrião E3, em um tubo de 50 ml por aquecimento da solução em um forno de microondas. Deixe que esta solução se equilibrar a 42 - 45 ° C em qualquer um banho de água ou de bancada incubadora. Se preparando grandes pratos para verticaisluz folhas de imagem (passo 4), faça um adicional de 25 mL de 1% de fusão padrão de agarose em meio embrião E3.
- Use o vidro de borosilicato com capilares de filamentos com dimensões de OD 1,20 mm, 0,69 mm ID, comprimento 10 mm.
- Se capilares são puxados sobre o tipo de aquecimento-filamento extrator de agulhas descrito na Tabela de equipamentos e reagentes, use as seguintes configurações: Calor 600, Pull 120, Velocity 50, Tempo 225, Pressão 500. Com um par de fórceps afiadas, ruptura a agulha apenas após o ponto em que se flexiona para criar uma agulha limpa e nítida para orientar os embriões e removendo o excesso de agarose. Um micro-bisturi também pode ser utilizado para remover o excesso de agarose.
2. Incorporação de embriões para Invertido ou Microscopia Vertical
- Levantar os embriões até o estágio adequado em meio embrião E3. 7
- Na fase necessária, embriões dechorionate com um par de fórceps afiadas debaixo de uma dissecção binocularmicroscópio ting.
- Incubar os embriões dechorionated para, pelo menos, 5 minutos na solução de trabalho tricaina.
- Uma vez que a solução de agarose fundida foi arrefecida até 45 ° C, utilizar uma pipeta de Pasteur de vidro para transferir o embrião dechorionated directamente para o tubo de 50 ml com transferência mínima de meio E3.
- Remover embrião em conjunto com cerca de 1 ml de meio de montagem e adicionar aprox. 100 ul de meio de montagem em conjunto com o embrião ao círculo central de uma placa de Petri com fundo de vidro com 35 milímetros de micropoços de 10 mm.
- À medida que o meio de montagem é a criação, mover o embrião para a borda do círculo de agarose com a cauda virada para fora (Figura 1A). Usar a agulha capilar para manter o embrião na orientação lateral desejada até que o gel é completamente definido. Para a imagem desenvolvimento corporal posterior, ter o cuidado de orientar o embrião de uma orientação que de lateral possível. Assim, manter o embrião nesta posição por adjustmen cuidadosasst com a agulha capilar.
NOTA: Múltiplos embriões podem ser adicionados ao prato de montagem neste ponto, se necessário. Se este for o caso, a transferência da agarose de baixa fusão no primeiro prato e adicionar os embriões para o centro da gota de agarose. Em seguida, empurrar os embriões para as extremidades do anel de vidro e orientação para a posição desejada. Até seis embriões pode ser montado desta maneira antes da agarose torna-se solidificou.
3. remoção do excesso de agarose em torno do corpo Posterior
NOTA: Esta seção descreve o procedimento pelo qual agarose é removido da região em torno do corpo posterior. No caso do alongamento do corpo posterior, é importante para garantir que a cauda podem crescer-out normalmente. Ao remover a agarose após o embrião tenha sido completamente incluídos por agarose, o embrião é deixado fechado pela região da cabeça e aproximadamente metade do saco vitelino.
- Uma vez que a queda de agarose definiu, inundar o petri dish com a solução de trabalho tricaina.
- Sob um microscópio de dissecação binocular com uma base de luz de transmissão, ajustar a posição do espelho e o ângulo de luz incidente de tal forma que o contraste forte permite que os cortes na agarose para ser visto claramente por meio da operação.
- Para executar corte 1 (Figura 1), utilizar a agulha capilar ou o micro-bisturi para cortar a meio caminho de agarose ao longo da gema, a partir de uma posição imediatamente posterior ao campo do coração formando para a posição de somito 5 (a 5 th somite anterior).
- Inicie o corte inicial adjacente ao coração formando como mostrado, e a forma total através da agarose ao vidro.
- Mantenha o capilar ou micro-escalpelo nas profundezas da agarose, e, lentamente, viu cima e para baixo, enquanto começando a fazer um longo corte sobre o embrião como mostra a Figura 1. Cortar o mais perto do embrião quanto possível, sem perfurar o embrião ou gema.
- Em seguida, fazer cortes 2 e 3 (Figura 1 ), A partir da posição contra o embrião e com o corte indo todo o caminho até o fundo de vidro prato. Adicione corte 2, de modo que é tangencial aos primeiros 5 somitos, permitindo dorsalward desdobramento completo do corpo posterior. Adicione cortar 3 a um ângulo de 90 ° com a superfície da gema e a partir da HEARTFIELD.
NOTA: o corte de agarose até que a extremidade do círculo de vidro (como se mostra na Figura 1) auxiliares na remoção da agarose como um bloco completo (passo 3.6). No entanto, isso não é necessário. - Começando na intersecção dos cortes 1 e 3, fazer um corte diagonal lento no final do corte 2 enquanto levanta-se lentamente para cima, a fim de desalojar o quadrado de agarose em torno do corpo posterior.
Notas: Em alguns casos, este será lançado em um bloco e a conclusão da operação de uma só vez. Em outros, pode levar várias tentativas para dis-lodge toda a agarose em torno do embrião. - Com um par de pinças cortantes, remover o b desalojadomechas de agarose a partir do meio do embrião. Para ajudar neste processo, movimentar as peças de agarose para o lado do prato e usar a parede da placa de Petri como suporte de elevação enquanto os pedaços de agarose.
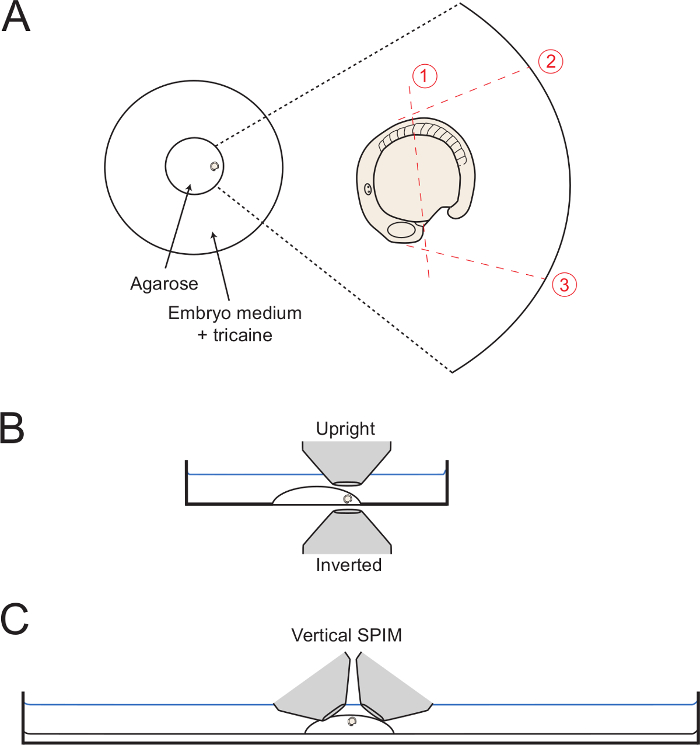
Figura 1: Diagrama de montagem set-ups. (A) O diagrama mostra a posição do embrião montado no interior do anel central de vidro numa placa de Petri. À direita é um zumbido do embrião com cada corte sucessivo através do circunda agarose mostrado com linhas vermelhas dottted. (B) Os embriões montados é diagramado em vista lateral exibindo a facilidade de acesso para ambos os objetivos invertidos e verticais. (C) A digram semelhante mostrando como os embriões podem ser montado para imagiologia folha de luz vertical set-ups. Por favor click aqui para ver uma versão maior desta figura.
- Se espasmos musculares não está completamente bloqueada nesse ponto, adicionar gotas de tricaina a partir da solução stock de 4 mg / ml, pH 7.
4. Montagem de embriões para Luz folhas Vertical Microscopia
NOTA: Esta é uma variação do método descrito acima, que permite o acesso de múltiplos objetivos para geração de imagens de amostras por SPIM verticalmente orientada. A ideia subjacente a esta variação é a de elevar a amostra ligeiramente maior do que o fundo do recipiente, para permitir o fácil acesso de dois objectivos de imagem.
- Antes da amostra de montagem, um revestimento 100 milímetros placa de petri de plástico com 1% de agarose em forma E3 a uma altura de 5 mm e deixar solidificar.
- Colocar uma gota de 1 ml de agarose de baixo ponto de fusão para o centro do prato e deixar solidificar.
- embriões incorporar em agarose de baixo ponto de fusão como no ponto 2. No entanto, este tempo, retire o embrião a partir do tubo de 50 mlde agarose com uma queda menor de solução (0,5 ml) e colocar esta pequena gota no topo de 1 ml a cair no centro do prato.
- Usar a agulha capilar para colocar o embrião no centro da pequena gota e manter a sua orientação correcta até gel é definido.
- Inundar o prato com solução de trabalho tricaina e remover o excesso de agarose, como na seção 3, mas sem cortar a almofada de 1% de agarose padrão.
Resultados
O protocolo descrito acima detalha uma técnica versátil para a montagem de embriões de peixes-zebra para imagiologia de lapso de tempo de longa duração. Um exemplo disto é mostrado na Figura 2A e na animação / vídeo Figura 1. Os embriões foram injectados no estádio de uma célula com o ARNm que codifica a proteína fluorescente photoconvertible kikumeGR. Na fase de 15 somito eles foram montados como descrito acima e trabalhada durante 12 horas...
Discussão
Esta técnica de montagem permite que embriões que permanecer estática durante a transferência para o microscópio e mais experimentos com imagens de lapso de tempo de longo prazo destinadas a seguinte alongamento do corpo posterior em várias escalas de comprimento. Além disso, é versátil na medida em que permite a imagem em microscopia invertida na vertical e fixados-ups, e uma sugestão é feita para como isto pode ser ainda adaptado para SPIM orientada verticalmente.
Um passo essen...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
Referências
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados