Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método de montaje versátil para largo plazo de imágenes de Desarrollo de pez cebra
En este artículo
Resumen
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Resumen
embriones de pez cebra ofrecen un sistema experimental ideal para estudiar los procesos morfogenéticos complejos debido a su facilidad de acceso y la transparencia óptica. En particular, la elongación posterior del cuerpo es un proceso esencial en el desarrollo embrionario mediante el cual múltiples deformaciones de tejido actúan juntos para dirigir la formación de una gran parte del eje del cuerpo. Con el fin de observar este proceso mediante formación de imágenes de lapso de tiempo a largo plazo, es necesario utilizar una técnica de montaje que permite un apoyo suficiente para mantener las muestras en la orientación correcta durante la transferencia al microscopio y de adquisición. Además, el montaje también debe proporcionar la suficiente libertad de movimiento para la derivación de la región posterior del cuerpo sin afectar su desarrollo normal. Por último, debe haber un cierto grado de versatilidad del método de montaje para permitir la formación de imágenes en diversas imágenes set-ups. A continuación, presentamos una técnica de montaje para obtener imágenes del desarrollo de elongatio posterior del cuerpon en el pez cebra D. rerio. Esta técnica consiste en embriones de tal manera que las regiones de la cabeza y del saco vitelino son casi en su totalidad incluidos en agarosa de montaje, dejando fuera de la región posterior del cuerpo para alargar y desarrollarse normalmente. Vamos a mostrar cómo esto puede ser adaptado para su posición vertical, invertida y vertical de la ficha técnica de microscopía de luz montajes. Si bien este protocolo se centra en los embriones para obtener imágenes de la parte posterior del cuerpo de montaje, que podría adaptarse fácilmente para la formación de imágenes en vivo de varios aspectos del desarrollo del pez cebra.
Introducción
Posterior elongación cuerpo es un proceso esencial en el desarrollo embrionario en la que el embrión se extiende para formar una gran parte del eje del cuerpo. Es un ejemplo de un proceso morfogenético complejo mediante el cual múltiples comportamientos celulares actúan coordinadamente para generar la morfogénesis en el nivel de los tejidos individuales. Estas deformaciones de tejido diferencial entonces actúan juntos para generar el alargamiento del cuerpo posterior en todo el nivel de la estructura. Para entender cómo estos procesos son controlados y coordinados durante el desarrollo, debemos ser capaces de seguir estos procesos en múltiples escalas (es decir, en el nivel de moléculas, células, las poblaciones de células y tejidos) y relacionar esto directamente a la morfogénesis de toda la estructura .
embriones de pez cebra son ideales para la elongación posterior del cuerpo de imagen como su transparencia óptica y pequeño tamaño permite la aplicación de impresión débil mínimamente invasiva enfoques adecuados para live imágenes. 1 Esto se ha evidenciado por una serie de publicaciones recientes que han arrojado luz sobre el desarrollo posterior del cuerpo a nivel de moléculas, 2 células individuales, 3 e inter-tejido comportamientos, 4, así como a nivel de la población de células y órganos en general. 5
Las técnicas de imagen avanzadas, como confocal, microscopía multifotónica y el plano selectiva microscopía de iluminación (SPIM) están permitiendo la formación de imágenes a largo plazo de los procesos de desarrollo, con una disminución del efecto de la toxicidad de la luz y foto-blanqueo. se requieren técnicas robustas para el montaje de muestras vivas para lograr tres objetivos: 1) el apoyo suficiente para mantener las muestras en la orientación correcta durante la transferencia al microscopio y durante la adquisición, 2) la suficiente libertad de movimiento de la muestra para permitir la derivación de la región posterior del cuerpo sin afectar a su desa normalesrrollo y, finalmente, 3) un cierto grado de versatilidad del método de montaje para permitir la formación de imágenes en diversas imágenes montajes.
Este protocolo presenta una técnica de montaje para la formación de imágenes el desarrollo del pez cebra D. rerio. Esta técnica consiste en embriones de montaje de tal manera que las regiones de la cabeza y el saco vitelino son casi totalmente incluyen en agarosa, dejando la región del cuerpo posterior para alargar y desarrollarse normalmente. Como tal, también es un método apropiado para la formación de imágenes a largo plazo de otras regiones del cuerpo en desarrollo como la agarosa permite obtener imágenes mediante técnicas de imagen la luz estándar. Este protocolo demuestra montaje de los embriones en una orientación lateral, aunque también es posible montar los embriones en orientaciones alterativas. Se mostrará aún más cómo adaptar el método para configuraciones de microscopía de luz hojas verticales, invertidos y verticales.
Protocolo
1. Preparación de soluciones y sacó la aguja de cristal
- Hacer una solución 25x social de Tricaína (3-amino éster etílico del ácido benzoico, también llamado acetato de 3-aminobenzoato) a 4 mg / ml en 20 mM Tris pH 8,8, y llevar esa solución es a pH 7. Una alícuota de 4 ml y almacenar a -20 ° C.
NOTA: El Tricaína anestésico actúa preferentemente sobre los canales de sodio dependientes de voltaje neuronales bloqueando así espasmos musculares y el movimiento 6. - Hacer una solución de trabajo de tricaína a una concentración final de 0,17 mg / ml en medio de embrión E3. 7
NOTA: Hacer que el Tricaína solución de trabajo de manera extemporánea como el pH de esta solución se desplaza. - Disolver la agarosa de bajo punto de fusión a una concentración final de 1.5% en medio de embrión E3 en un tubo de 50 ml por calentamiento de la solución en un horno de microondas. Deje que esta solución se equilibre a 42 - 45 ° C, ya sea en un baño de agua o de sobremesa incubadora. Si la preparación de grandes platos para verticales-Hoja de luz de imagen (paso 4), hace 25 ml adicionales de 1% de agarosa de fusión estándar en medio de embrión E3.
- Utilizar el vidrio de borosilicato con filamento capilares con unas dimensiones de 1,20 mm OD, ID 0,69 mm, longitud 10 mm.
- Si se tira de los capilares del tipo de calefacción-filamento extractor de aguja se describe en la tabla de equipos y reactivos, utilice la siguiente configuración: Calor 600, 120 Tire, Velocidad 50, Tiempo 225, 500. Presión Con un par de pinzas cortantes, ruptura la aguja justo después del punto en el que se flexiona para crear una aguja limpio y afilado para orientar embriones y eliminar el exceso de agarosa. Un micro-bisturí también se puede utilizar para eliminar el exceso de agarosa.
2. Incorporación de embriones para Microscopía vertical o invertida
- Elevar los embriones hasta la etapa apropiada en medio de embrión E3. 7
- En la etapa requerida, embriones dechorionate con un par de pinzas cortantes debajo de una disección binocularting microscopio.
- Incubar los embriones dechorionated durante al menos 5 min en la solución de trabajo de tricaína.
- Una vez que la solución de agarosa fundida se ha enfriado a 45 ° C, utilizar una pipeta Pasteur de vidrio para transferir el embrión dechorionated directamente en el tubo de 50 ml con transferencia mínima de medio E3.
- Eliminar embrión junto con aproximadamente 1 ml de medio de montaje y añadir aprox. 100 l de medio de montaje junto con el embrión al círculo central de un fondo de vidrio placa de Petri de 35 mm con un 10 mm de micropocillos.
- Como está fijando el medio de montaje, mueva el embrión hasta el borde del círculo de agarosa con la cola hacia el exterior (Figura 1A). Utilice la aguja capilar para mantener el embrión en la orientación lateral deseada hasta que el gel se ajusta por completo. Para el desarrollo posterior del cuerpo de la imagen, tener cuidado de orientar el embrión en el lateral como una orientación de lo posible. Por lo tanto, mantener el embrión en esta posición por adjustmen cuidadosasts con la aguja capilar.
NOTA: múltiples embriones se pueden añadir a la placa de montaje en este punto, si es necesario. Si este es el caso, transferir el bajo punto de fusión de agarosa en el plato primero y añadir los embriones para el centro de la gota de agarosa. A continuación, empuje los embriones a los bordes del anillo de vidrio y orientar en la posición deseada. Hasta seis embriones puede ser montado de esta manera antes de que la agarosa se solidifica.
3. Eliminación del exceso de agarosa alrededor del cuerpo posterior
NOTA: En esta sección se describe el procedimiento mediante el cual se extrae de agarosa de la región que rodea el cuerpo posterior. En el caso de la elongación posterior del cuerpo, es importante asegurarse de que la cola puede crecer de salida normalmente. Mediante la eliminación de la agarosa después de que el embrión ha sido completamente incluida por agarosa, el embrión se deja encerrado por la región de la cabeza y aproximadamente la mitad del saco vitelino.
- Una vez que la caída de agarosa se ha puesto, inundar el di Petrish con la solución de trabajo Tricaína.
- Bajo un microscopio binocular de disección con una base de luz transmitida, ajustar la posición del espejo y el ángulo de la luz incidente de tal manera que el fuerte contraste que permite que los recortes en la agarosa por verse claramente a través de la operación.
- Para realizar corte 1 (Figura 1), utilizar la aguja capilar o la micro-bisturí para cortar la mitad de camino de agarosa a lo largo de la yema, desde una posición justo posterior al campo que forman el corazón a la posición de la somite 5 (el 5º somite anterior).
- Iniciar el corte inicial adyacente al corazón formando como se muestra, y la forma completa a través de la agarosa al vidrio.
- Mantenga el capilar o micro-bisturí en lo profundo de la agarosa, y poco a poco vio arriba y abajo mientras empezando a hacer una larga incisión sobre el embrión como muestra la Figura 1. Cortar tan cerca del embrión como sea posible sin perforar el embrión o yema de huevo.
- A continuación, hacer cortes 2 y 3 (Figura 1 ), Partiendo de la posición en contra del embrión y con el corte va todo el camino hasta el fondo de cristal plato. Hacer cortada 2 de modo que es tangente a los primeros 5 somitas, lo que permite la plena dorsalward despliegue del cuerpo posterior. Hacer corte 3 en un ángulo de 90 ° con la superficie de la yema y a partir de la Heartfield.
NOTA: Cortar la agarosa hasta que el borde del círculo de vidrio (como se muestra en la Figura 1) ayuda en la eliminación de la agarosa como un bloque completo (paso 3.6). Sin embargo, esto no es necesario. - Comenzando en la intersección de los cortes 1 y 3, hacer un corte en diagonal lenta hacia el final del corte 2, mientras que levantar lentamente hacia arriba con el fin de desalojar la plaza de agarosa que rodea el cuerpo posterior.
Notas: En algunos casos, esto se dará a conocer en un solo bloque y la operación se completa de una sola vez. En otros, puede tomar varios intentos para dis-presenten el conjunto de agarosa que rodea al embrión. - Con un par de pinzas cortantes, retire la b desalojadocerraduras de agarosa del medio de embrión. Para ayudar en este proceso, mover las piezas de agarosa a un lado del plato y el uso de la pared de la placa de Petri como soporte mientras que el levantamiento de las piezas de agarosa.
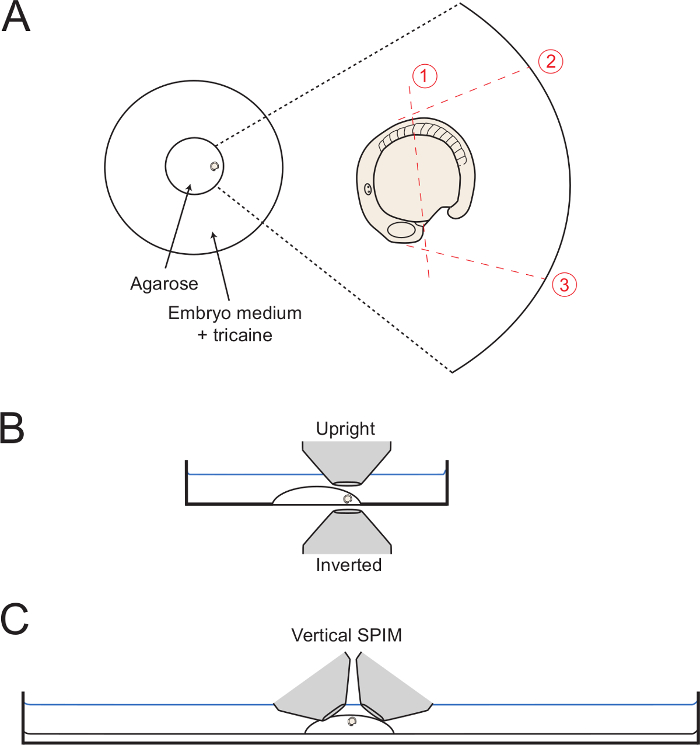
Figura 1: Diagramas de montaje Set-ups. (A) El diagrama muestra la posición del embrión montado dentro del anillo de vidrio centro de una placa de Petri. A la derecha es un enfoque del embrión con cada corte sucesivo a través de la que rodea agarosa muestran con líneas rojas dottted. (B) Los embriones montados se diagrama en vista lateral que muestra la facilidad de acceso para ambos objetivos invertidos y verticales. (C) Un digram similar que muestra cómo los embriones pueden ser montados para la hoja de luz vertical de imagen montajes. Por favor, click aquí para ver una versión más grande de esta figura.
- Si espasmos musculares no está completamente bloqueado en ese punto, añadir gotas de tricaína de la solución madre de 4 mg / ml, pH 7.
4. El montaje de los embriones de Luz-Hoja vertical Microscopía
NOTA: Esta es una variación en el método descrito anteriormente que permite el acceso de múltiples objetivos para la obtención de imágenes de muestras por SPIM orientado verticalmente. La idea detrás de esta variación es levantar la muestra ligeramente más alto que el fondo del plato, para permitir un fácil acceso de los dos objetivos de formación de imágenes.
- Antes de muestrear de montaje, capa de un plástico placa de Petri de 100 mm con 1% de agarosa en medio E3 a una altura de 5 mm y dejar solidificar.
- Colocar una gota de 1 ml de agarosa de bajo punto de fusión al centro del plato y dejar solidificar.
- Insertar en embriones de agarosa de bajo punto de fusión como en el apartado 2. Sin embargo, esta vez, quitar el embrión desde el tubo de 50 mlde agarosa con una caída menor de la solución (0,5 ml) y colocar esta pequeña gota en la parte superior de la 1 ml caer en el centro del plato.
- Utilice la aguja capilar para colocar el embrión en el centro de la pequeña gota y mantener su orientación correcta hasta que se establece gel.
- Inundar el plato con la solución de trabajo Tricaína y eliminar el exceso de agarosa al igual que en la sección 3, pero sin cortar a través del colchón de agarosa al 1% estándar.
Resultados
El protocolo descrito anteriormente detalla una técnica versátil para el montaje de embriones de pez cebra para la imagen de lapso de tiempo a largo plazo. Un ejemplo de esto se muestra en la figura 2A y en animada / video Figura 1. Los embriones fueron inyectados en la etapa de 1 célula con ARNm que codifica la proteína fluorescente fotoconvertible kikumeGR. En la etapa 15 somite se montaron como se describió anteriormente y la imagen de 12 hr en u...
Discusión
Esta técnica de montaje permite que los embriones que se le mantenga aún durante la transferencia al microscopio y más de los experimentos de imagen de lapso de tiempo a largo plazo destinados a la elongación posterior del cuerpo después en múltiples escalas de longitud. Además, es versátil en que permite la formación de imágenes en ambos microscopía en posición vertical e invertida montajes, y una sugerencia se hace para cómo esto puede ser adaptado además para SPIM orientado verticalmente.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Materiales
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
Referencias
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados