JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Zebrafish의 개발의 장기 이미징을위한 다목적 장착 방법
요약
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
초록
제브라 피쉬 배아 인해 접근성과 광 투과성의 용이성 복잡한 형태 형성 과정을 연구 할 수있는 이상적인 실험 시스템을 제공합니다. 특히, 후방 본체 신도 여러 조직 변형 몸 축의 큰 부분의 형성을 유도하기 위해 함께 작용하는 배아 발달에 필수적인 과정이다. 장기간 시간 경과 화상이 과정을 관찰하기 위해 충분한 지원 현미경 및 취득을 전송하는 동안 올바른 방향으로 샘플을 유지할 수있게 장착 기술을 활용하는 것이 필요하다. 또한, 장착은 정상적인 발달에 영향을주지 않고 후방 바디 영역의 생장에 대한 충분한 이동 자유를 제공한다. 마지막으로, 다양한 영상 셋업에 영상을 수 있도록 장착 방법의 다양성에 어느 정도가 있어야합니다. 여기서, 우리는 후방 바디 elongatio 개발을 이미징 실장 기술을 제시n은 제브라 피쉬 D. 레 리오한다. 이 기술은 일반적으로 신장 및 개발 후방 바디 영역을 남기면서, 헤드 및 난황 낭 영역이 거의 아가에 포함되도록 배아 장착 포함한다. 우리는이 똑바로 반전 및 수직 빛 시트 현미경 셋업에 대해 적용 할 수있는 방법을 보여줍니다. 이 프로토콜은 후방 몸 이미징을위한 배아를 장착에 초점을 맞추고 있지만, 쉽게 제브라 피쉬 개발의 여러 측면의 라이브 영상에 대해 적용 할 수 있습니다.
서문
후방 바디 신장 배아 몸 축 큰 부분을 형성하기 위해 연장되는 배아 발달에 필수적인 과정이다. 이는 다중 셀 동작 개별 조직의 형태 형성 수준을 생성하는 역할을 배위하는 복잡한 형태 형성 공정의 일례이다. 이러한 차동 조직 변형은 전체 구조 수준에서 후방 본체의 신장을 생성하도록 함께 작용한다. 이러한 프로세스 제어 및 개발 과정에서 조정하는 방법을 이해하려면, 우리는 (분자, 세포, 세포 집단과 조직의 수준에서 즉) 여러 규모에서 이러한 프로세스를 수행 할 수 있어야하고, 전체 구조의 형태 형성에 직접 연관에 .
자신의 광학 투명성과 작은 크기는 최소 침습 광 이미징의 응용 프로그램에 대해 허용하는 제브라 피쉬 배아는 거실에 적합 접근 이미징 후방 신체 신장에 이상적입니다전자 영상. 한 이것은 분자 레벨에서 후방 본체 개발을 밝혀왔다 최근 공보의 시리즈에 의해 입증 된 2 단 전지 4뿐만 아니라 세포 집단 및 전체 기관의 수준에서 3 간 조직 행동. (5)
이러한 공 초점, 다 광자 현미경 선택적 평면 조명 현미경 (SPIM)와 같은 고급 이미징 기술은 광 독성 광 표백 효과의 감소와 개발 프로세스의 장기 영상을 가능하게한다. 실제 샘플의 장착을위한 견고한 방법이 세 가지 목표를 달성하기 위해 필요하다 : 1) 충분한지지가 현미경 및 수집 동안 전송하는 동안 올바른 방향으로 샘플을 유지하기 위해, 2) 샘플의 이동 충분한 자유의 생장을 허용하는 정상 (STABLE)에 영향을주지 않고 후방 바디 영역opment, 그리고 마지막으로 3) 장착 방법의 다양성에 어느 정도의 다양한 영상 셋업에 영상을 허용합니다.
이 프로토콜은 제브라 D. 레 리오의 개발을 이미징 실장 기술을 소개한다. 이 기술은 일반적으로 신장 및 개발 후방 바디 영역을 남기면서 머리와 난황 낭 영역이 거의 아가 로스에 포함되도록 배아 장착 포함한다. 이와 같이,도 아가 표준 광 이미징 기술에 의해 촬상 가능으로 현상 신체의 다른 영역의 장기 촬상에 적합한 방법이다. 이 바꾸는 방향에서 배아를 탑재하는 것도 가능하지만,이 프로토콜은, 횡 방향으로 배아의 장착을 보여줍니다. 그것은 또한, 수직 반전 및 수직 빛 시트 현미경 설정하는 방법을 적용하는 방법을 보여줍니다.
프로토콜
1. 솔루션의 준비 및 뽑아 유리 바늘
- 20 mM 트리스 pH가 8.8에 4 ㎎ / ㎖에서 Tricaine (3- 아미노 벤조산 에틸 에스테르라고도 에틸 3- 아미노 벤조 에이트)의 25 배 스톡 용액을 제조하고 그 용액의 pH에서 4 밀리리터 매장 제 나누어에서 가져 -20 ° C.
참고 : 마취 Tricaine함으로써 근육의 경련 및 운동 (6)을 차단하는 신경 전압 문이 나트륨 채널을 우선적으로 작용한다. - E3 배아 매체에 0.17 ㎎ / ㎖의 최종 농도 Tricaine의 작동 용액을 만든다. (7)
참고 :이 용액의 pH가 품으로 즉흥적 솔루션을 작업 Tricaine을 확인합니다. - 전자의 용액을 가열하여 50 ㎖ 튜브에서 E3 배아 배지에서 1.5 %의 최종 농도로 저 융점 아가로 오스를 녹인다. 물 목욕이나 벤치 탑 인큐베이터 중 하나에서 45 ° C -이 솔루션은 42 평형을 보자. 수직에 대한 많은 요리를 준비하는 경우빛 장 영상 (4 단계), 아가로 오스 E3 배아 매체에 1 % 표준 용융의 추가 25 mL로.
- OD 1.20 mm, ID 0.69 mm, 길이 10mm의 크기와 필라멘트 모세 혈관과 붕규산 유리를 사용합니다.
- 날카로운 집게 한 쌍으로, 속도 (50), 시간 (225), 압력 (500) (120)를 당겨, 열 (600), 브레이크 : 모세 혈관은 장비 및 시약, 다음 설정을 사용의 표에 설명 된 가열 필라멘트 바늘 풀러의 종류에 가져온 경우 단지 지점 과거 바늘되는이 배아를 배향하고 초과 아가로 오스를 제거하는 깨끗하고 날카로운 바늘을 만들 구부러. 마이크로 메스 또한 과량 아가 로스를 제거 할 수있다.
거꾸로 또는 수직 현미경을위한 배아 2. 퍼가기
- E3 배아 매체에 적절한 단계로 배아를 올립니다. (7)
- 양안 dissec 아래 날카로운 집게 한 쌍의 필수 단계에서, dechorionate 배아팅 현미경.
- Tricaine 작업 용액에 적어도 5 분 동안 dechorionated 배아를 품어.
- 용융 아가 용액을 45 ° C로 냉각되면, E3 매체의 최소한의 전송로 50 ㎖ 튜브에 직접 dechorionated 배아를 전송하는 유리 파스퇴르 피펫을 사용한다.
- 매체를 장착 약 1 ml의와 함께 배아를 제거하고 약 추가 할 수 있습니다. 10 밀리미터 마이크로 웰과 35mm 유리 바닥 페트리 접시의 중앙 원에 배아와 함께 매체를 장착 100 ㎕.
- 설치 매체가 설정 될 때, 바깥쪽으로 (그림 1A)를 직면 꼬리 아가로 오스의 원의 가장자리로 배아를 이동합니다. 겔이 완전히 설정 될 때까지 원하는 횡 방향 배아를 유지하는 모세관 바늘을 사용한다. 이미지 후방 신체 발달, 가능한 한 측면 오리엔테이션에서 배아의 방향을주의하십시오. 따라서,주의 adjustmen하여이 위치에 배아를 유지모세관 바늘 TS.
주 : 필요한 경우, 여러 개의 배아이 시점에서 장착 접시에 첨가 될 수있다. 이 경우, 제 접시로 오스가 낮은 용융 전송하고 아가 드롭의 중심 배아를 추가한다. 그리고, 유리 링의 에지에 배아를 밀어 원하는 위치로 배향. 여섯 배아까지 아가로 오스가 응고되기 전에이 방법을 장착 할 수 있습니다.
후방 몸 주위 초과 아가로 오스 3. 제거
참고 :이 섹션은 아가로 오스는 후방 본체 주변 지역에서 제거하는 절차를 설명합니다. 후방 바디 연신의 경우에는 꼬리 성장 아웃 할 수있는 일반적으로 보장하는 것이 중요하다. 배아 완전히 아가가 포함 된 후, 아가 로스를 제거하여, 배아는 헤드 영역과 난황의 약 절반으로 둘러싸인 남겨진다.
- 아가 강하가 설정되면, 페트리 디 홍수Tricaine 작업 솔루션을 쉬.
- 전송 된 광 염기 쌍안 해부 현미경 하에서 강한 콘트라스트가 동작을 명확하게 볼 수 아가 로스의 절단이 가능하도록 상기 미러 위치 및 입사광의 각도를 조정한다.
- 절단 실행 1 (도 1) 바로 체절 (5) (5 차의 위치에 형성 심장 필드 후부 위치에서 난황 따라 아가 중도 절단 모세관 바늘 또는 마이크로 메스를 사용 전방 체절).
- 그림과 같이 형성 마음에 인접한 초기 절단, 유리에 아가로 오스를 통해 전체 방법을 시작합니다.
- 최대보고 그림 1과 같이 배 이상 긴 절단을 시작하면서 아래로 천천히 깊은 아가로 오스 내에서 모세관 또는 마이크로 메스를 유지하고. 배아 또는 노른자를 천공하지 않고 가능한 한 배아에 가깝게 잘라.
- 다음에, 절단하게 2, 3 (도 1 ), 배아에 대한 위치에서 유리에 이르기까지 모든 방법을가는 컷으로 시작은 접시를 바닥. 이 제 5 somites 접선되도록 후방 본체의 전개 전체 dorsalward 허용 2 절단 만든다. 노른자면과 90 ° 각도로 삼을 잘라 HEARTFIELD에서 시작합니다.
주 : 완전한 블록 (단계 3.6)로 오스를 제거하는 에이즈 (도 1에 도시 된 바와 같이) 유리 원형의 가장자리까지 아가로 오스를 절단. 그러나, 이것은 필요하지 않다. - 인하 1과 3의 교차점에서 시작, 천천히 후방 몸을 둘러싼 아가로 오스의 제곱을 제거하기 위해 위쪽으로 들어 올리는 동안 컷 2의 끝으로 천천히 대각선 컷을합니다.
주 : 일부 경우에, 이것은 하나의 블록에 출시되고 동작이 한 번에 완료된다. 다른 사람에서는 DIS-별장에 배아를 둘러싼 모든 아가로 오스를 여러 번 시도해야 할 수 있습니다. - 날카로운 집게 한 쌍으로, 빠질 B를 제거배아 매체로부터 아가로 오스의 잠금. 이 과정에 도움 접시 측으로 아가 로스 편을 이동시키고, 아가 로스 편을 들어 올리는 동안 지지체로서 배양 접시의 벽을 사용한다.
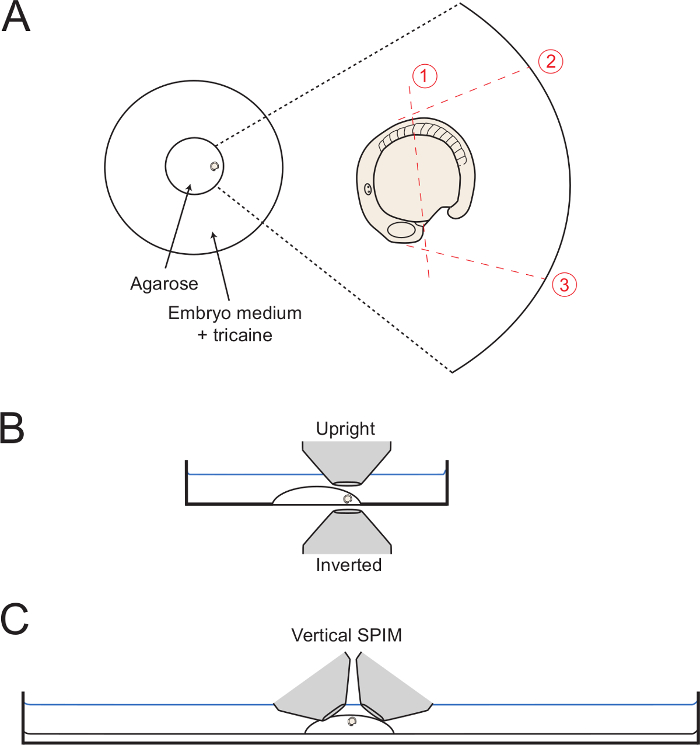
그림 1 : 설치 셋업의 다이어그램. (A) 다이어그램은 페트리 접시의 중앙 유리 링 내에 장착 된 배아의 위치를 나타낸다. 오른쪽에있는이 아가로 오스 dottted 빨간 선으로 표시 둘러싸을 통해 각각의 연속 컷 배아의 확대이다. (B)이 탑재 된 배아는 모두 반전 직립 목표에 대한 접근 용이성을 표시하는 측면도에 도시된다. (C) 배아가 수직 광 시트 영상 셋업 마운트 될 수있는 방법을 보여주는 유사한 digram. 카스티하세요이 그림의 더 큰 버전을 보려면 여기를 ICK.
- 근육 경련이 완전히 그 시점에서 차단되지 않은 경우, 4 ㎎ / ㎖, pH가 7의 원액에서 Tricaine 방울을 추가합니다.
4. 수직 빛 시트 현미경을위한 배아의 설치
참고 :이 그 위에서 설명한 방법에 변화가 수직 지향 SPIM에 의해 시료의 이미징을위한 여러 목적의 접근을 허용합니다. 이 변화의 뒤에 아이디어는이 영상 목표를 쉽게 액세스 할 수 있도록, 접시의 바닥보다 약간 높은 샘플을 들어 올릴 것입니다.
- 장착 샘플 전에 코트 5mm의 높이 E3 배지에서 1 % 아가로 오스와 100mm 플라스틱 페트리 접시에 세트 할 수있다.
- 접시의 중앙에 1 ml의 저 융점 아가 방울을 배치하고 설정할 수.
- 그러나 2 항에서와 같은 저 융점 아가로 오스에 포함 된 배아는, 이번에는 50 ㎖ 튜브에서 배아를 제거의 아가로 오스 용액 (0.5 ㎖)의 작은 방울과 접시의 중앙에 떨어 ㎖로 1 위에이 작은 방울을 배치합니다.
- 작은 방울의 중심 배아를 배치하고 겔이 설정 될 때까지의 올바른 방향을 유지하기 위해 모세관 바늘을 사용한다.
- Tricaine 작업 용액으로 요리 홍수와 섹션 3에서와 같이하지만, 1 % 표준 아가로 오스의 쿠션을 통해 절단하지 않고 초과 아가로 오스를 제거합니다.
결과
위에서 설명한 프로토콜은 장기간의 시간 경과 이미징을위한 제브라 피쉬 배아의 장착을위한 다양한 방법을 자세히 설명합니다. 이것의 예는도 2a 및 / 비디오 애니메이션도 1에 도시된다. 배아는 mRNA의이 photoconvertible 형광 단백질 kikumeGR을 인코딩으로 1 세포 단계에서 주입 하였다. 10 배 목표와 거꾸로 공 초점 현미경에 상술 한 바와 12 시간 동안 ...
토론
이 실장 기술은 배아가 현미경 및 여러 길이 스케일에서 후방 신체 신장을 다음 목표로 이상 장기 시간 경과 이미징 실험에 전송하는 동안 계속 유지 될 수 있습니다. 이 모두 수직 및 반전 현미경 셋업에서 촬상이 가능하고,이 제안은 상기 수직 배향 SPIM에 적응 될 수있는 방법에 대해 이루어지는 것을 또한, 다목적.
이 프로토콜의 중요한 단계는이 구조의 정상적인 개발을 ?...
공개
The authors have nothing to disclose.
감사의 말
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
자료
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
참고문헌
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유