Method Article
عزل وتحليل خلايا البنكرياس اللحمة المتوسطة عن طريق التدفق الخلوي
In This Article
Summary
هنا، نحن تصف طريقة لعزل الخلايا في البنكرياس المكروية من الجنينية والأنسجة الماوس حديثي الولادة والكبار، مع التركيز على عزل خلايا اللحمة المتوسطة. وتسمح هذه الطريقة التنميط التعبير الجيني الخلايا وإفراز البروتين من أجل توضيح الإشارات التي تنظم خارجي تطوير البنكرياس، وظيفة، وتكون الأورام.
Abstract
The pancreas is comprised of epithelial cells that are required for food digestion and blood glucose regulation. Cells of the pancreas microenvironment, including endothelial, neuronal, and mesenchymal cells were shown to regulate cell differentiation and proliferation in the embryonic pancreas. In the adult, the function and mass of insulin-producing cells were shown to depend on cells in their microenvironment, including pericyte, immune, endothelial, and neuronal cells. Lastly, changes in the pancreas microenvironment were shown to regulate pancreas tumorigenesis. However, the cues underlying these processes are not fully defined. Therefore, characterizing the different cell types that comprise the pancreas microenvironment and profiling their gene expression are crucial to delineate the tissue development and function under normal and diseased states. Here, we describe a method that allows for the isolation of mesenchymal cells from the pancreas of embryonic, neonatal, and adult mice. This method utilizes the enzymatic digestion of mouse pancreatic tissue and the subsequent fluorescence-activated cell sorting (FACS) or flow-cytometric analysis of labeled cells. Cells can be labeled by either immunostaining for surface markers or by the expression of fluorescent proteins. Cell isolation can facilitate the characterization of genes and proteins expressed in cells of the pancreas mesenchyme. This protocol was successful in isolating and culturing highly enriched mesenchymal cell populations from the embryonic, neonatal, and adult mouse pancreas.
Introduction
توازن الطاقة وهضم الطعام في الثدييات يعتمد على وظيفة البنكرياس السليم. ويتكون البنكرياس الكبار من اثنين من مقصورات الخلوية رئيسية: الإفرازية والغدد الصماء. الخلايا الإفرازية، بما في ذلك خلايا عنيبية التي تنتج وتفرز إنزيمات الجهاز الهضمي، والخلايا القناة التي تنقل هذه الانزيمات لللامعاء، وتشمل أكثر من 80٪ من مجموع كتلة البنكرياس 1. خلايا الغدد الصماء، والتي تشمل خلايا بيتا المنتجة للانسولين وخلايا ألفا لإنتاج الجلوكاجون، وتنظم في جزر لانجرهانز التي هي جزء لا يتجزأ في أنسجة خارجية الإفراز وتفرز الهرمونات لتنظيم مستويات الجلوكوز في الدم 2.
خلايا البنكرياس تكتسب مصيرهم متباينة من خلال درجة عالية من التنظيم، عملية متعددة الخطوات 3. الدلائل تشير إلى أن العظة خارجي المقدمة من الخلايا العصبية، الخلايا البطانية، وخلايا اللحمة المتوسطة توجيه تمايز الخلايا في البنكرياس وانتشار في تيكان الجنين 3، 4، 5. ومن الأمثلة على ذلك الشرط من الشريان الأورطي للمواصفات السلائف البنكرياس في وقت مبكر (6). في وقت لاحق في التنمية، عرضت الخلايا البطانية للعب دور محوري في التنمية في كل من خلايا الغدد الصماء وإفرازات البنكرياس وتعزيز بيتا تمايز الخلايا 4، 6، 7. عرضت خلايا اللحمة المتوسطة لدعم بقاء وتوسع من الأسلاف البنكرياس المشتركة، وذلك أساسا من خلال إفراز عامل النمو Fgf10 8 و 9. لقد أظهرنا أيضا أن هذه الخلايا تدعم انتشار الغدد الصماء وخارجية الإفراز السلائف، وكذلك من خلايا متمايزة (بما في ذلك خلايا عنيبية وبيتا) في البنكرياس الجنينية 5. في الآونة الأخيرة، كانت الخلايا الوسيطة مزيدأظهرت لتنظيم خلايا الغدد الصماء التمايز 10.
في البالغين، وعرضت وظيفة خلايا بيتا والكتلة تعتمد على الخلايا في المكروية، بما في ذلك الخلايا العصبية، المناعة، والخلايا البطانية، وكذلك pericytes 11 و 12 و 13. أثناء الإصابة، عرضت الخلايا البطانية لتجنيد الخلايا المناعية إلى البنكرياس لتشجيع تكرار خلايا بيتا 13. عرضت الخلايا البطانية أيضا على إنتاج مكونات المصفوفة خارج الخلية (ECM) لدعم التعبير الانسولين وخلايا بيتا وظيفة 14. نحن في الآونة الأخيرة أظهرت شرط pericytes خلايا البنكرياس من أجل وظيفة خلايا بيتا 11. وأخيرا، عرضت خلايا البنكرياس سدى لتنظيم تطور غدية الأقنية البنكرياس (PDAC) 15، 16. ومع ذلك، فإن معرفكيان العظة خارجي أن توجيه التنمية البنكرياس، وظيفة، وتكون الأورام غير معروفة إلى حد كبير.
تحديد العظة التي تقدمها خلايا البنكرياس المكروية يتطلب تميز الجينات والبروتينات التي عبرت عنها هذه الخلايا. هذا يعتمد على عزل هذه الخلايا من البنكرياس من أجل أداء والتعبير الجيني والتحليلات البروتين و / أو على إنشاء خطوط الخلايا. هنا، نقترح طريقة لعزل خلايا اللحمة المتوسطة من المكروية البنكرياس عن طريق استخدام أنسجة الأنزيمية الهضم ومضان تنشيط الخلايا الفرز (FACS) اما من الخلايا المسمى immunofluorescently أو الخلايا معربا عن البروتينات الفلورية. تم تنفيذ هذا البروتوكول بنجاح لعزل وتحليل البروتين الفلوري أصفر (YFP) -expressing خلايا اللحمة المتوسطة من الجنينية، حديثي الولادة، والكبار البنكرياس 5، 17.
Protocol
وأجريت التجارب وفقا لبروتوكولات التي وافقت عليها لجنة أبحاث الحيوان في جامعة تل أبيب.
1. عزل الأنسجة البنكرياس من الفئران
- لفئران بالغة:
- إعداد العازلة الهضم: 0.4 ملغ / مل كولاجيناز P و 0.1 نانوغرام / مل الدناز أنا الذائبة في هانكس "محلول الملح المتوازن (HBSS). طازجة إعداد 5 مل من العازلة في الماوس في 15 مل أنابيب مخروطية والاحتفاظ بها على الجليد حتى الاستخدام.
- الموت ببطء الفئران وفقا لمبدأ توجيهي المؤسسي.
- تشريح كل فأر لإزالة البنكرياس (للتعليم، من فضلك انظر المرجع 18)؛ وضعه في طبق ثقافة تحتوي على HBSS. ومن الممكن أن تؤدي هذه المرحلة تحت مجهر تشريحي، وزيادة كفاءة الهضم، وقطع الأنسجة في 2-4 قطعة.
- وضع أنسجة البنكرياس في أنبوب يحتوي المخزن في الجهاز الهضمي (المعدة في الخطوة 1.1.1). إبقاء الأنابيب على الجليد حتى يتم تشريح جميع الفئران وأنسجة البنكرياسالتي تم جمعها.
- كرر الخطوات من 1.1.2 - 1.1.4 مع الفئران المتبقية.
- لأجنة وحديثي الولادة الفئران:
- إعداد العازلة الهضم: 0.4 ملغ / مل كولاجيناز P و 0.1 نانوغرام / مل الدناز أنا الذائبة في HBSS. للأجنة والجراء في يوم ما بعد الولادة 7 (P7) أو أقل، وإعداد الطازجة 1،5-2 مل من العازلة في الماوس في أنبوب مخروطي 15 مل. لP7 أو الجراء القديمة، وإعداد 3-4 مل من العازلة في الماوس في أنبوب مخروطي 15 مل. الحفاظ على الجليد حتى الاستخدام.
- الموت ببطء الفئران وفقا لمبدأ توجيهي المؤسسي. للأجنة، وإزالة جميع الأجنة من رحم أمهم ووضعها في صحن الثقافة 10 ملم تحتوي على برنامج تلفزيوني. تشريح الجنين في وقت واحد.
- وضع الماوس على ظهرها، ورأسه مشيرا بعيدا من المحقق. باستخدام ملقط غرامة، وسحب ما يصل جلد البطن ومفتوحة في خط الوسط لفضح تجويف البطن يصل إلى الحجاب الحاجز الماوس 18.
- باستخدام ملقط غرامة، فصل الاب الكبدام جدار البطن الخلفي. مع حركة مستمرة نحو ذيل فأر، يستخرج الأعضاء الداخلية (بما فيها الكبد والمعدة والطحال والأمعاء والكلى والبنكرياس) ووضعها في صحن الثقافة التي تحتوي على HBSS.
- تحت مجهر تشريحي، وإزالة الكبد والكلى لفضح البنكرياس (الشكل 1). باستخدام ملقط غرامة، فصل البنكرياس من المعدة والاثني عشر، وأخيرا، من الطحال.
- وضع أنسجة البنكرياس في أنبوب يحتوي المخزن في الجهاز الهضمي (المعدة في الخطوة 1.2.1). لP14 أو كبار السن الجراء، وقطع الأنسجة إلى 2 قطعة لزيادة كفاءة الهضم. إبقاء الأنابيب على الجليد حتى يتم تشريح جميع الفئران وأنسجة البنكرياس جمعها.
- كرر الخطوات من 1.2.2 - 1.2.6 مع الفئران المتبقية.
2. البنكرياس الهضم
- احتضان أنابيب تحتوي على أنسجة البنكرياس (في المخزن الهضم) في كتلة التدفئة عند 37 درجة مئوية لمدة 30 دقيقة مع agitatايون في 700 دورة في الدقيقة. بعد 15 دقيقة، يدويا يهز الأنابيب التي كتبها قلب لهم 3-4 مرات ووضعها مرة أخرى في كتلة التدفئة.
ملاحظة: إذا كنت تستخدم كتلة التدفئة دون قدرات التحريض، وعكس أنابيب كل 5-10 دقيقة. تأكد من أن الأنسجة يهضم بشكل صحيح. إن لم يكن، وقطع الأنسجة إلى قطع صغيرة قبل الحضانة أو زيادة الانفعالات. - لوقف عملية الهضم الأنسجة، ووضع أنابيب على الجليد وإضافة 10 مل من HBSS الباردة إلى كل أنبوب. أنابيب الطرد المركزي عند 4 درجة مئوية و 300 x ج لمدة 5 دقائق، ونضح طاف.
- إعادة تعليق:
- لفئران بالغة وP14 أو الجراء القديمة، وإعادة تعليق بيليه مع 6 مل من برنامج تلفزيوني وتوتر من خلال مصفاة الخلية 70 ميكرومتر وضعت على رأس أنبوب البولي بروبلين جمع 15 مل المخروطية الجديد. لضمان استرداد خلية القصوى، وغسل أنبوب الأصلي مع 6 مل إضافية من برنامج تلفزيوني وسلالة من خلال مصفاة الخلية على أنبوب جمع.
- للأجنة والجراء ر الأصغرهان P14، وإعادة تعليق بيليه مع 2 مل من برنامج تلفزيوني وتوتر من خلال مصفاة الخلية 35 ميكرومتر وضعت على رأس 5 مل أنبوب مستديرة أسفل جمع البوليسترين (FACS أنبوب). لضمان استرداد خلية القصوى، وغسل أنبوب الأصلي مع 2 مل إضافية من برنامج تلفزيوني وسلالة من خلال مصفاة الخلية على أنبوب جمع.
- أنابيب الطرد المركزي عند 4 درجة مئوية و 300 x ج لمدة 5 دقائق، ونضح طاف. إزالة السائل بعناية، ويتم إرفاق خلايا فضفاضة إلى أنبوب البوليسترين.
3. إعداد إعتبر خلايا واحدة
- الاستعدادات العازلة: للعزلة الخلية FACS، وإعداد فرز عازلة عن طريق خلط PBS (بدون كلوريد الكالسيوم وكلوريد المغنيسيوم)، و 5٪ مصل بقري جنيني (FBS)، و 5 ملي EDTA. لتحليل التدفق الخلوي، وإعداد عازلة التحليل المكمل عازلة الفرز مع 0.05٪ أزيد الصوديوم. يمكن تخزين كل مخازن في 4-8 درجة مئوية لمدة تصل إلى 2 أشهر.
- إعادة تعليق الخلايا في الفرز أو آناتحلل العازلة. اعادة تعليق كل البنكرياس معزولة من الأجنة والجراء الذين تقل أعمارهم عن P7 في 1 مل من الجراء بين P8 وشهر واحد من العمر في 1.5 مل، ومن الفئران الأكبر سنا من شهر واحد في 3 مل. سلالة الخلايا من خلال مصفاة الخلية 35 ميكرومتر وضعت على رأس أنبوب البوليسترين جولة القاع (FACS أنبوب).
- لتلطيخ الضوابط، واخراج 50- إلى 100 ميكرولتر قسامات من العينات الواردة في الخطوة السابقة (لا يزيد عن 5٪ من إجمالي حجم العينة) ووضعها في أنابيب نظام مراقبة الأصول الميدانية الجديدة؛ تشمل أنبوب لكل fluorophore المستخدمة، بما في ذلك دابي والبروتينات الفلورية، فضلا عن عنصر تحكم غير ملوثين.
ملاحظة: عند استخدام الفئران المعدلة وراثيا مع الخلايا معربا عن بروتين فلوري، أو عند عدد الخلايا غير محدود، وتشمل الأنسجة غير المعدلة وراثيا كعنصر تحكم تلطيخ. إذا تم استخدام الخلايا معربا عن بروتين فلوري دون مزيد من تلطيخ، انتقل إلى الخطوة 3.8. - تدور أسفل الخلايا في 300 x ج لمدة 5 دقائق في 4 درجات مئوية، ونضح طاف.
- للكتلةالملك اعادة تعليق الخلايا مع عرقلة الحل (100 ميكرولتر الفرز أو عازلة تحليل تستكمل مع 1 ميكرولتر من مفتش الماعز)، واحتضان لمدة 30 دقيقة على الجليد.
- وصمة عار علامات سطح الخلية، وإعداد المزيج الذي يشمل جميع الأجسام المضادة fluorophore مترافق المطلوب في حجم 100 ميكرولتر لكل عينة. إعداد التخفيفات الأجسام المضادة 2X في الفرز أو عازلة تحليل (أي، يخفف من الأجسام المضادة للحصول على ضعف التركيز المطلوب، وإذا كان التخفيف النهائي من 1: 200 هو المطلوب، وتمييع الضد 1: 100). دون غسل عرقلة الحل، إضافة 100 ميكرولتر من الخليط إلى الخلايا عينة لتحقيق حجم تلطيخ النهائي من 200 ميكرولتر. احتضان لمدة 30-60 دقيقة على الجليد وفي الظلام.
- لتعيين تحليل أو فرز المعلمات (انظر الخطوات 4.3 و 5.2)، وإعداد أنابيب إضافية تحتوي على واحد فقط من الأجسام المضادة المستخدمة (تحكم تلطيخ). إعداد التخفيفات الأجسام المضادة 2X في الفرز أو عازلة تحليل (كما هو موضح في الخطوة 3.6). تأكد من أن تشمل الاشتراكيةngle تخفيف سيطرة تلطيخ لكل fluorophore المستخدمة، فضلا عن مراقبة غير ملوثين. دون غسل عرقلة الحل، إضافة 100 ميكرولتر من خليط الأجسام المضادة للخلايا (المعد في الخطوة 3.3) لتحقيق حجم تلطيخ النهائي من 200 ميكرولتر. احتضان لمدة 30 - 60 دقيقة على الجليد وفي الظلام.
- يغسل عن طريق ملء كل أنبوب مع تحليل أو فرز المخزن المؤقت إلى حجم القصوى من 4 مل. اختياريا، وإعادة سلالة الخلايا من خلال مصفاة الخلية 35 ميكرومتر (كما هو موضح في الخطوة 3.2).
- أجهزة الطرد المركزي في 300 x ج لمدة 5 دقائق في 4 درجات مئوية، وإزالة طاف بعناية.
- إعادة تعليق العينات في تحليل أو فرز العازلة. إعادة تعليق الخلايا المعزولة من الأجنة في 500 ميليلتر من الجراء الذين تقل أعمارهم عن شهر واحد في 1 مل، 1-3 أشهر من العمر في 2 مل، ومن الفئران الأكبر سنا من 3 أشهر في 3 مل. ضوابط تلطيخ يجوز إعادة علقت في 300 ميكرولتر من العازلة.
- إضافة 200 نانوغرام / مل من دابي إلى خلايا إعادة وقف التنفيذ لتحديد الخلايا الميتة. تأكد من تضمين المشارك أنبوبntaining خلايا غير ملوثين دون دابي لضبط عداد الكريات. انتقل إلى الخلية الفرز (الخطوة 4) أو تحليل (الخطوة 5).
4. خلية الفرز
- التحضير:
- لخلية الفرز قبل استخراج الحمض النووي الريبي، ومعطف أنبوب جمع 1.5 مل مع ريبونوكلياز المانع فورا قبل الفرز. تحقيقا لهذه الغاية، إضافة 1 مل من فرز العازلة، التي تحتوي على 0.01 U / مل ريبونوكلياز المانع، إلى أنبوب جمع 1.5 مل العقيمة. بعد 5 دقائق، دوامة أنبوب وإزالة السائل.
- لخلية الفرز قبل زراعة الخلايا، إضافة 3 مل من وسائل الاعلام زراعة معقم (Dulbecco لتعديل النسر متوسطة (DMEM) تستكمل مع FBS 20٪، 1٪ L-الجلوتامين، و 1٪ للبنسلين الستربتومايسين) في أنبوب جمع 15 مل العقيمة .
- قبل تحميل أنبوب إلى فارز FACS، دوامة لفترة وجيزة لإعادة تعليق الخلايا. إبقاء الأنابيب المتبقية على الجليد.
- تبدأ من خلال تحليل ضوابط تلطيخ لتحديد معايير الفرز (على سبيل المثال، الجهد والتعويض) والفرز بوابات (على سبيل المثال، بلغ مجموع سكان الخلية، الخلايا دابي سلبي الحية، والسكان الخلية ليتم فرزها).
- مرة واحدة يتم تعيين المعلمات وبوابات فرز تصل، تحميل العينات وبدء الفرز الخلية في أنابيب جمع.
ملاحظة: فرز الظروف تعتمد اعتمادا كبيرا على الصك. ونحن نستخدم عرض فوهة من 100 ميكرون، والضغط من 23.1 رطل لكل بوصة مربعة، وتصل سرعتها القصوى الفرز من 5. - الشروع في استخراج الحمض النووي الريبي أو زراعة خلايا فرزها.
ملاحظة: للحصول على استخراج الحمض النووي الريبي، الطرد المركزي الخلايا في 2000 x ج لمدة 5 دقائق وإزالة السائل الزائد قبل المتابعة مع بروتوكول استخراج القياسية. لزراعة الخلايا، إذا تم فرز الخلايا تحت ظروف غير معقمة، غسلها مرتين عن طريق ملء الأنبوب مع متوسط زراعة والطرد المركزي أنه في 300 x ج لمدة 7 دقائق قبل زراعة من أجل تقليل التلوث بها.
5. تحليل الخلايا عن طريق التدفق الخلوي
- قبل لoading كل أنبوب في الكريات، دوامة لفترة وجيزة لإعادة تعليق الخلايا. إبقاء الأنابيب المتبقية على الجليد.
- تبدأ من خلال تحليل عينات غير ملوثين واحدة الملطخة من أجل تحديد معالم تحليل (على سبيل المثال، والجهد والتعويض).
- مرة واحدة يتم تعيين المعلمات تحليل ما يصل، تحميل كل عينة، بما في ذلك السيطرة تلطيخ، وتسجيل النتائج. تحليل النتائج التي تم الحصول عليها باستخدام التدفق الخلوي برامج التحليل.
النتائج
مطلوب اللحمة المتوسطة البنكرياس خلال تطوير والبلوغ. الطريقة الموصوفة هنا يسمح للعزل خلايا اللحمة المتوسطة من الجنينية، حديثي الولادة، والبنكرياس الكبار. خلايا اللحمة المتوسطة، ولكن لا أنواع الخلايا الأخرى، والتعبير عن بروتين فلوري أصفر (YFP) في البنكرياس من Nkx3.2 -Cre. R26R الفئران 5، 11، 17، 19 -YFP. خلال التنمية، وأعرب عن Nkx3.2 (المعروف أيضا باسم BapX1) من قبل البنكرياس الجنينية، المعدة، والأمعاء اللحمة المتوسطة، وكذلك في مجموعة فرعية من القطع البدنية النمطية الهيكل العظمي 19 و 20 و 21. وأعرب عن هذا الجين في اللحمة المتوسطة البنكرياس من E9.5 حتى E11.5، مما يتيح التعبير الجيني تحت سيطرة Nkx3.2 -Cre من E9.5 5، 19، 20. وبناء على هذه العلامات، وخلايا يمكن تنقيته من الأنسجة البنكرياس السائبة باستخدام التدفق الخلوي. ويبين الشكل 2 تحليل التدفق الخلوي للخلايا واحدة من أنسجة البنكرياس الجنينية، حديثي الولادة، والكبار، معزولة كما هو موضح هنا. في حين أن الأنسجة البنكرياس غير المعدلة وراثيا لا تحتوي على خلايا الفلورسنت، Nkx3.2 -Cre. R26R -YFP أنسجة البنكرياس من جميع الأعمار تحليلها تحتوي على متميز سكان الخلية المسمى YFP (الشكل 2، مع وضع علامة البوابات).
وفقا للطريقة وصفها هنا، يمكن أن الخلايا معربا عن البروتينات الفلورية تكون إما النقي أو تحليلها بواسطة التدفق الخلوي، مع أو بدون المناعية إضافية. على سبيل المثال، بعد فرز على أساس وضع العلامات الفلورية، خلايا اللحمة المتوسطة يمكن تربيتها لإنشاء خط الخلية (لا يقل عن خمس مقاطع)، كما هو مبين في الشكل 3A. ملاحظة ر انه fibrocytic التشكل من الخلايا المستزرعة، نموذجية إلى خلايا اللحمة المتوسطة. وبالإضافة إلى ذلك، تم استخدام هذا النظام لتحليل التعبير الجيني من الخلايا فرزها. ولهذه الغاية، تم استخراج الحمض النووي الريبي من خلايا اللحمة المتوسطة مرتبة لتجميع كدنا]، وجرى تحليل مستويات التعبير الجيني QPCR. وكشف هذا التحليل أن الخلايا التي تم فرزها تعبر عن عموم الوسيطة علامة فيمنتين (الشكل 3B). وأخيرا، سطح علامة التعبير من قبل خلايا البنكرياس يمكن تحليلها من قبل التدفق الخلوي. على سبيل المثال، نحن عزل الخلايا من أنسجة البنكرياس من Nkx3.2 -Cre. R26R -YFP فئران بالغة باستخدام الطريقة الموصوفة هنا وملطخة لهم سطح الخلية بروتين سكري CD9، والتي أفادت تقارير أن أعرب عن طريق الخلايا الليفية 22. كما هو مبين في الشكل 3C، كل الخلايا في Nkx3.2 -Cre fluorescently المسمى؛ البنكرياس R26R -YFP تعبر عن CD9.
tp_upload / 55344 / 55344fig1.jpg "/>
الشكل 1: أنسجة البنكرياس الجنينية وحديثي الولادة. معزولة الجهاز الهضمي بأكمله، بما في ذلك في المعدة والطحال والأمعاء والبنكرياس، للجنين E15.5 (A) والجرو P4 (B). وترسيم الأنسجة البنكرياس مع الخط الأزرق. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
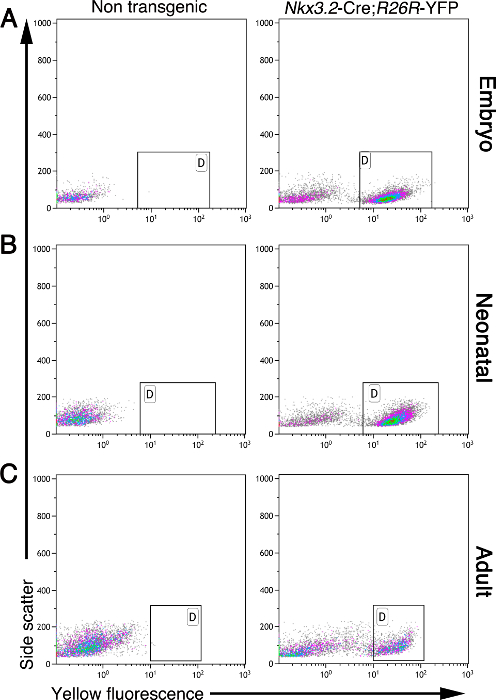
الشكل 2: خلايا اللحمة المتوسطة وfluorescently المسمى في Nkx3.2 -Cre. R26R -YFP أنسجة البنكرياس. تحليل التدفق الخلوي للخلايا البنكرياس معزولة من غير المعدلة وراثيا (من اليسار وحات) وNkx3.2 -Cre. R26R -YFP المعدلة وراثيا (لوحات اليمين) الفئران في مختلف الأعمار: الجنينية (A)، حديثي الولادة (B)، وإعلانالموج (C). وقد تم تحليل الخلايا عن الجانب مبعثر (المحور الصادي) ومضان الأصفر (محور س). وأشار غيتس (مع وضع علامة "D") وجود سكان الخلية YFP + في الفئران المعدلة وراثيا ولكن ليس في الضوابط غير المعدلة وراثيا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
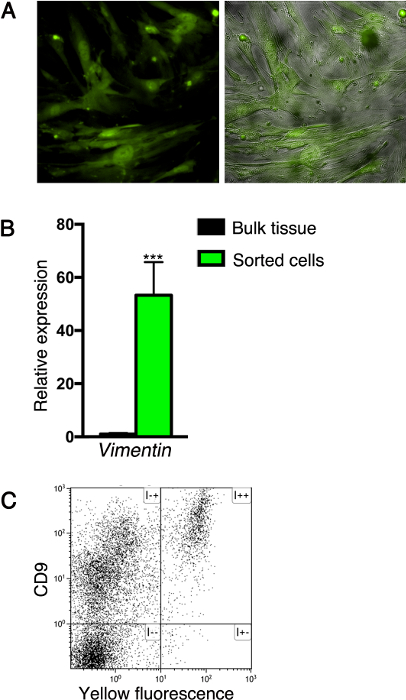
الشكل (3): التحاليل التي أجريت على خلايا البنكرياس معزولة. (أ) الخلايا مرتبة من نسيج البنكرياس من Nkx3.2 -Cre. كانت R26R -YFP الفئران حديثي الولادة (كما هو موضح في الشكل 2B) مثقف لإنشاء خط الخلية. تم تصوير الخلايا المستزرعة لمضان (الأخضر، الحق والألواح اليسرى) والطوري (الرمادي، اللوحة اليمنى). (ب) الرسم البياني شريط يظهر Vimentin1 (Vim1)مستويات التعبير YFP + -sorted الخلايا من أنسجة البنكرياس من Nkx3.2 -Cre. فئران بالغة R26R -YFP (كما هو موضح في الشكل 1C، الأخضر) بالمقارنة مع أنسجة البنكرياس لم يتم فرزها (أسود). تم استخراج الحمض النووي الريبي وتحليل التعبير الجيني عن طريق QPCR. تم تطبيع التعبير Cyclophilin. N = 4. *** P <0.001. تمثل البيانات يعني ± SD. (ج) تحليل تدفق-الخلوي للخلايا البنكرياس انفضوا من Nkx3.2 -Cre. R26R -YFP الفئران الكبار مع allophycocyanin (APC) ملطخة المناعية -conjugated-CD9 مكافحة الأجسام المضادة وتحليل لآسيا والمحيط الهادئ (المحور الصادي) ومضان الأصفر (محور س). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، نحن تصف طريقة لعزل وتحليل خلايا البنكرياس المكروية. وهذه الطريقة يمكن أن تستخدم لعزل خلايا اللحمة المتوسطة من الأنسجة الجنينية البنكرياس والكبار. وبالإضافة إلى ذلك، استخدمنا بنجاح هذا البروتوكول لعزل الخلايا البطانية من البالغين والأطفال حديثي الولادة البنكرياس 5، 17. ومع ذلك، قد لا تكون مناسبة للحصول على تعليق وحيد الخلية استنساخه من خلايا الظهارية البنكرياس (موصوفة بروتوكولات بديلة في المراجع 18 و 23 و 24). باستخدام هذه الطريقة، وخلايا fluorescently المسمى، إما التعبير عن البروتينات الفلورية أو immunostained عن علامات سطح، يمكن تنقيته بواسطة نظام مراقبة الأصول الميدانية أو تحليلها من قبل التدفق الخلوي. RNA يمكن استخراجها من خلايا النقاء لمحة نمط التعبير الجيني بهم. بدلا من ذلك، فإن الخلايا تنقيته يمكن تربيتها لإنشاء خط خلية للتحليل البروتين لاحق. وهذه الطريقة يمكن توصيف العوامل هxpressed من قبل المكروية البنكرياس، التي تحكم بها توالد، علم وظائف الأعضاء، والفيزيولوجيا المرضية.
اللحمة المتوسطة البنكرياس تدعم توالد الأنسجة عن طريق تعزيز انتشار السلائف وخلايا متباينة 5، 9. وقد أظهرت هذه الخلايا لدعم التوسع في الخلايا الجذعية الجنينية البشرية (HESC) -derived الأسلاف البنكرياس 17 و 25 و 26. لذلك، ترسيم الهوية من العوامل الوسيطة الجنينية من شأنها تسهيل الجهود المبذولة حاليا لتوليد خلايا بيتا المنتجة للأنسولين من hESCs والتي يسببها الخلايا الجذعية المحفزة (iPSCs) كعلاج محتمل لمرض السكري. سمحت الدراسات الجينية الماوس تحديد عوامل النمو، مثل Fgf10، التي يتم إنتاجها من قبل اللحمة المتوسطة لتعزيز التوسع ظهارة البنكرياس خلال المراحل الأولى من تطوير البنكرياس3 و 9. بهدف تحديد العوامل الإضافية التي أعرب عنها في اللحمة المتوسطة الجنينية، ونحن عزل هذه الخلايا باستخدام تسليخ مجهري-القبض على الليزر، واستخراج الحمض النووي الريبي، وويقوم الجين تحليل التعبير 26. ومع ذلك، بالإضافة إلى كونها عمالة مكثفة، ويعتمد هذا الأسلوب على تحديد الخلايا استنادا خصائصها المورفولوجية، الذي حصر استخدامه في مراحل النمو قبل المتفرعة من الظهارة في اللحمة المتوسطة المحيطة بها (أي E12.5). لتوصيف خلايا اللحمة المتوسطة في مراحل النمو اللاحقة، قمنا باستخدام الطريقة الموصوفة هنا 5، 17.
استخدمنا هذه الطريقة لتحليل التعبير سطح علامة من الأطفال حديثي الولادة اللحمة المتوسطة البنكرياس 5. وبالإضافة إلى ذلك، تم عزل خلايا اللحمة المتوسطة من الأنسجة الجنينية البنكرياس والأطفال حديثي الولادة من Nkx3.2 -Cre، الفئران R26-EYFP، استنادا إلىوضع العلامات الفلورية في هذا الخط الماوس، وكان مثقف لإنشاء خطوط الخلايا 17. تحليل البروتين من هذه الخلايا يسمح لتحديد العوامل التي يفرزها البنكرياس اللحمة المتوسطة مع القدرة على تعزيز الأسلاف البنكرياس المستمدة HESC 17. كنا مزيد من هذه الخلية طريقة العزل لتنقية خلايا اللحمة المتوسطة من أنسجة البنكرياس الكبار لاستخراج الحمض النووي الريبي والتعبير الجيني تحليل 17. ولذلك، يمكن استخدام هذا الأسلوب لتحديد الجينات والبروتينات التي أعرب عنها اللحمة المتوسطة البنكرياس، مع القدرة على دعم التنمية خلية البنكرياس.
عرضت خلايا البنكرياس الوسيطة أيضا أن تلعب دورا في تكون الأورام البنكرياس. يتميز PDAC قبل تشكيل سدى صلدة-الليفية الغنية تتألف من الخلايا الليفية، الخلايا المناعية، وECM 27. في حين كان يعتقد سدى لتعزيز التنمية في كثير منأنواع من السرطان، وقد تبين أنه لكبح جماح PDAC تقدم 15 و 16 و 28. هذا يشير إلى أن مكونات سدى البنكرياس تفرز العوامل التي تحول دون تكون الأورام. وعلاوة على ذلك، يمكن للتغيرات في سدى تكوين الخلايا وكذلك في النمط الظاهري الخلايا تكمن وراء تأثيرها على الخلايا الظهارية 15 و 16 و 28. وبالتالي يمكن أن الطريقة الموصوفة هنا تساعد في وصف أنواع مختلفة من الخلايا التي تشكل سدى PDAC بالمقارنة مع أنسجة البنكرياس صحية. فإنه كذلك السماح لتنقية مختلف أنواع الخلايا اللحمية لوصف التغيرات المحتملة في ملفاتهم الشخصية التعبير الجيني أثناء تطور PDAC. ولكن نظرا للتغيرات في تكوين ECM البنكرياس أثناء تكون الأورام 27، والتعديلات المعلمات الهضم الأنسجة، مثل إدراج المضافاتIONAL أنواع كولاجيناز أو زيادة فترة حضانة، قد يكون مطلوبا.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Adi Sasson for the technical assistance and Helen Guez for the critical reading of the manuscript. This work was supported by European Research Council starting grant no. 336204.
Materials
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213865001 | |
| DNase | Sigma-Aldrich | D5025-15KU | The effective units should be at least 2000 unitz/ml protein |
| Hanks’ Balanced Salt solution (HBSS) | Sigma-Aldrich | H6648 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-127-1A | |
| EDTA | Biological Industries | 01-862-1A | |
| Sodium Azide | Sigma-Aldrich | S2002 | |
| Goat IgG serum | Sigma-Aldrich | G9023 | |
| DAPI | Sigma-Aldrich | D9542 | |
| RNAse inhibitor | Invitrogen | N8080119 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Invitrogen | 11965092 | |
| L-Glutamine | Biological Industries | 03-020-1B | |
| Penicillin-streptomycin | Biological Industries | 03-031-1B | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | Without Calcium Chloride and Magnesium Chloride |
| 1.5 ml tubes | Sarstedt | 72 690 | |
| 15 ml conical tube | Corning | 430052 | |
| Round Bottom Polystyrene 5 ml tube | Corning | 352008 | FACS tube'. Make sure tube is compatible with the flow cytomter to be used, as there are slight differences in required tubes between brands |
| 5ml tube with 35 μm cell strainer Snap Cap | Corning | 352235 | FACS tube' |
| 70 μm cell strainer | Miltenyi Biotec | 130-098-462 | |
| Heating block with agitation | Eppendorf | ThermoMixer C | |
| Centrifuge | ThermoFisher | Heraeus Megafuge 40R | |
| Steromicroscope | Nikon | SMZ 745 | |
| Cell sorter | BD Biosciences | FACSAria IIu | |
| flow cytometer | Beckman Coulter | Gallios |
References
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Cabrera, O., Berman, D. M., Kenyon, N. S., Ricordi, C., Berggren, P. -. O., Caicedo, A. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Gittes, G. K. Developmental biology of the pancreas: a comprehensive review. Developmental biology. 326 (1), 4-35 (2009).
- Villasenor, A., Cleaver, O. Crosstalk between the developing pancreas and its blood vessels: An evolving dialog. Seminars in cell & developmental biology. , 1-8 (2012).
- Landsman, L., Nijagal, A., et al. Pancreatic mesenchyme regulates epithelial organogenesis throughout development. PLoS Biology. 9 (9), e1001143 (2011).
- Lammert, E., Cleaver, O., Melton, D. Induction of pancreatic differentiation by signals from blood vessels. Science. 294 (5542), 564-567 (2001).
- Pierreux, C. E., Cordi, S., et al. Epithelial: Endothelial cross-talk regulates exocrine differentiation in developing pancreas. Developmental biology. 347 (1), 216-227 (2010).
- Golosow, N., Grobstein, C. Epitheliomesenchymal interaction in pancreatic morphogenesis. Developmental biology. 4, 242-255 (1962).
- Bhushan, A., Itoh, N., et al. Fgf10 is essential for maintaining the proliferative capacity of epithelial progenitor cells during early pancreatic organogenesis. Development. 128 (24), 5109-5117 (2001).
- Larsen, B. M., Hrycaj, S. M., Newman, M., Li, Y., Wellik, D. M. Mesenchymal Hox6 function is required for mouse pancreatic endocrine cell differentiation. Development. 142 (22), 3859-3868 (2015).
- Sasson, A., Rachi, E., et al. Islet pericytes are required for beta-cell maturity. Diabetes. 65 (10), 3008-3014 (2016).
- Stanley, S. A., Kelly, L., et al. Bidirectional electromagnetic control of the hypothalamus regulates feeding and metabolism. Nature. 531 (7596), 647-650 (2016).
- Brissova, M., Aamodt, K., et al. Islet microenvironment, modulated by vascular endothelial growth factor-A signaling, promotes β cell regeneration. Cell metabolism. 19 (3), 498-511 (2014).
- Nikolova, G., Jabs, N., et al. The vascular basement membrane: a niche for insulin gene expression and Beta cell proliferation. Developmental cell. 10 (3), 397-405 (2006).
- Rhim, A. D., Oberstein, P. E., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer cell. 25 (6), 735-747 (2014).
- Özdemir, B. C., Pentcheva-Hoang, T., et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer cell. 25 (6), 719-734 (2014).
- Russ, H. A., Landsman, L., et al. Dynamic Proteomic Analysis of Pancreatic Mesenchyme Reveals Novel Factors That Enhance Human Embryonic Stem Cell to Pancreatic Cell Differentiation. Stem cells international. 2016, 6183562 (2016).
- Gout, J., Pommier, R. M., et al. Isolation and Culture of Mouse Primary Pancreatic Acinar Cells. Journal of Visualized Experiments. (78), e50514 (2013).
- Verzi, M. P., Stanfel, M. N., et al. Role of the homeodomain transcription factor Bapx1 in mouse distal stomach development. Gastroenterology. 136 (5), 1701-1710 (2009).
- Tribioli, C., Frasch, M., Lufkin, T. Bapx1: an evolutionary conserved homologue of the Drosophila bagpipe homeobox gene is expressed in splanchnic mesoderm and the embryonic skeleton. Mech Dev. 65 (1-2), 145-162 (1997).
- Hecksher-Sorensen, J., Watson, R., et al. The splanchnic mesodermal plate directs spleen and pancreatic laterality, and is regulated by Bapx1/Nkx3.2. Development. 131 (19), 4665-4675 (2004).
- Walmsley, G. G., Rinkevich, Y., Hu, M. S. Live Fibroblast Harvest Reveals Surface Marker Shift In Vitro. Tissue Engineering Part C: Methods. , (2014).
- Morris, J. P., Greer, R., et al. Dicer regulates differentiation and viability during mouse pancreatic cancer initiation. PloS one. 9 (5), 95486 (2014).
- Miyatsuka, T., Matsuoka, T. -. A., et al. Chronological analysis with fluorescent timer reveals unique features of newly generated β-cells. Diabetes. 63 (10), 3388-3393 (2014).
- Sneddon, J. B., Borowiak, M., Melton, D. A. Self-renewal of embryonic-stem-cell-derived progenitors by organ-matched mesenchyme. Nature. 491 (7426), 765-768 (2012).
- Guo, T., Landsman, L., Li, N., Hebrok, M. Factors expressed by murine embryonic pancreatic mesenchyme enhance generation of insulin-producing cells from hESCs. Diabetes. 62 (5), 1581-1592 (2013).
- Olive, K. P., Jacobetz, M. A., et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science. 324 (5933), 1457-1461 (2009).
- Raz, Y., Erez, N. An inflammatory vicious cycle: Fibroblasts and immune cell recruitment in cancer. Experimental cell research. 319 (11), 1596-1603 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved