Method Article
בידוד וניתוח תאים של mesenchyme הלבלב ידי cytometry הזרימה
In This Article
Summary
כאן, אנו מתארים שיטה לבידוד של תאים במייקרו-הסביבה של הלבלב עוברי, רקמת עכבר בילוד ומבוגרים, תוך התמקדות הבידוד של תאי mesenchymal. שיטה זו מאפשרת יצירת פרופיל של ביטוי גני התא והפרשת חלבון על מנת להבהיר את האותות החיצוניים המווסתים פיתוח לבלב, פונקציה, tumorigenesis.
Abstract
The pancreas is comprised of epithelial cells that are required for food digestion and blood glucose regulation. Cells of the pancreas microenvironment, including endothelial, neuronal, and mesenchymal cells were shown to regulate cell differentiation and proliferation in the embryonic pancreas. In the adult, the function and mass of insulin-producing cells were shown to depend on cells in their microenvironment, including pericyte, immune, endothelial, and neuronal cells. Lastly, changes in the pancreas microenvironment were shown to regulate pancreas tumorigenesis. However, the cues underlying these processes are not fully defined. Therefore, characterizing the different cell types that comprise the pancreas microenvironment and profiling their gene expression are crucial to delineate the tissue development and function under normal and diseased states. Here, we describe a method that allows for the isolation of mesenchymal cells from the pancreas of embryonic, neonatal, and adult mice. This method utilizes the enzymatic digestion of mouse pancreatic tissue and the subsequent fluorescence-activated cell sorting (FACS) or flow-cytometric analysis of labeled cells. Cells can be labeled by either immunostaining for surface markers or by the expression of fluorescent proteins. Cell isolation can facilitate the characterization of genes and proteins expressed in cells of the pancreas mesenchyme. This protocol was successful in isolating and culturing highly enriched mesenchymal cell populations from the embryonic, neonatal, and adult mouse pancreas.
Introduction
הומאוסטזיס אנרגיה ועיכול מזון ביונקים תלוי פונקצית לבלב נכונה. הלבלב המבוגר מורכב משני תאים סלולריים עיקריים: אקסוקרינית ואת האנדוקרינית. תאים אקסוקרינית, לרבות תאים acinar המייצרים ומפרישים אנזימים העיכול והתאים בתעלות אותה להעביר אנזימים אלה במעיים, להקיף יותר מ -80% ממסת 1 הלבלב הכולל. תאים האנדוקרינית, הכוללים תאי ביתא מייצר אינסולין ותאי אלפא מייצר גלוקגון, מאורגנים האיים לנגרהנס מוטבעות הרקמה אקסוקרינית ומפרישים הורמונים כדי לווסת את רמות סוכר בדם 2.
תאי לבלב לרכוש גורל הבדיל שלהם באמצעות תהליך מאוד מוסדר, רב שלבי 3. הראיות עולה כי רמזים חיצוניים הניתנים על ידי נוירונים, אנדותל ותאים mesenchymal להנחות התמיינות תאים בלבלב ושגשוגם ב tהוא העובר 3, 4, 5. דוגמא אחת היא הדרישה של אב העורקים עבור המפרט של מבשרי לבלב מוקדם 6. בהמשך הפיתוח, תאי אנדותל הוצגו לשחק תפקיד מרכזי בהתפתחות של שני תאים האנדוקרינית אקסוקרינית הלבלב לקדם בידול בטא תאים 4, 6, 7. תאי mesenchymal הוצגו לתמוך הישרדות ורחבה של אבות לבלב נפוצים, בעיקר באמצעות הפרשת גורם הגדילה Fgf10 8, 9. הראינו עוד, כי תאים אלו תומכים בריבוי מבשר האנדוקרינית אקסוקרינית, כמו גם של תאים ממוינים (כולל תאי acinar ובטא) בלבלב העוברי 5. לאחרונה, תאי mesenchymal היו עודהראה להסדיר תאים האנדוקרינית בידול 10.
בשינה המבוגרת, פונקצית תאי בטא ומסה הוצגו תלוי תאי microenvironment שלהם, כולל עצבי, חיסון, ותאי האנדותל, כמו גם pericytes 11, 12, 13. במהלך הפציעה, תאי אנדותל הוצגו לגייס תאים חיסוניים הלבלב לקדם בטא תאים שכפול 13. תאי האנדותל הוצגו נוספת לייצר תאי מטריקס (ECM) רכיבים לתמוך ביטוי אינסולין תאים בטא פונקציה 14. אנו לאחרונה הדגימו את הדרישה של pericytes איון לתפקוד תאים בטא 11. לבסוף, תאים של stroma הלבלב הוצגו להסדיר את התקדמות אדנוקרצינומה ductal הלבלב (PDAC) 15, 16. עם זאת, האידישות של רמזים חיצוניים המנחים בפיתוח לבלב, פונקציה, tumorigenesis הם ידועים ברובם.
זיהוי רמזים הניתנים על ידי תאים של microenvironment הלבלב דורש המאפיין את הגנים והחלבונים הביעו על ידי תאים אלו. זה תלוי לבודד תאים אלה מהלבלב כדי לבצע ביטוי גנים וניתוחי proteomic ו / או על הקמת שורות תאים. כאן, אנו מציעים שיטה לבודד תאים mesenchymal של microenvironment הלבלב על ידי ניצול הקרינה המופעל עיכול אנזימטי רקמת התא מיון (FACS) של כל אחד immunofluorescently שכותרתו תאים או תאים המבטאים חלבוני ניאון. פרוטוקול זה בוצע בהצלחה לבודד ולנתח חלבון פלואורסצנטי צהוב (YFP) -expressing תאים mesenchymal של העוברית, בילוד, ומבוגר הלבלב 5, 17.
Protocol
הניסויים נערכו על פי הפרוטוקולים שאושרו על ידי ועדת בעלי חיים למחקר באוניברסיטת תל אביב.
1. ניתוק של רקמת לבלב מעכברים
- עבור עכברים בוגרים:
- הכן את החיץ העיכול: 0.4 מ"ג / P collagenase מ"ל ו 0.1 ng / mL DNase אני מומס תמיסת מלח מאוזן "הנקס (HBSS). טרי להכין 5 מ"ל של חיץ לכל עכבר צינורות חרוטי 15 מ"ל ולשמור אותם על הקרח עד לשימוש.
- להרדים את העכברים על פי הנחיה מוסדית.
- לנתח כל עכבר כדי להסיר את הלבלב (להוראה, אנא ראה חומר עזר 18); ומניחים אותו בצלחת תרבות המכילה HBSS. אפשר לבצע בשלב זה תחת סטראו, וכדי להגביר את יעילות עיכול, לחתוך את הרקמה לתוך 2 - 4 חתיכות.
- מניחים את רקמת לבלב לתוך צינור המכיל מאגר העיכול (מוכן בשלב 1.1.1). שמור את הצינורות על קרח עד שכל העכברים הם גזורים ורקמות לבלבשנאסף.
- חזור על שלבים 1.1.2 - 1.1.4 עם עכברים הנותרים.
- עבור עוברים ועכברים בילוד:
- הכן את החיץ העיכול: 0.4 מ"ג / P collagenase מ"ל ו 0.1 ng / mL DNase אני מומס HBSS. עבור עוברי לגורים ב יום לאחר הלידה 7 (P7) ומטה, טרי להכין 1.5 - 2 מ"ל של חיץ לכל עכבר בתוך שפופרת 15 מ"ל קונית. לקבלת P7 או גורים מבוגרים, להכין 3 - 4 מ"ל של חיץ לכל עכבר בתוך שפופרת 15 מ"ל קונית. שמור על הקרח עד לשימוש.
- להרדים את העכברים על פי הנחיה מוסדית. עבור עוברי, להסיר את כל העוברים מן הרחם של אמא שלהם ומניחים אותם בצלחת תרבות 10 מ"מ המכיל PBS. לנתח עובר אחד בכל פעם.
- הנח את העכבר על הגב שלה, עם הראש שלה מצביע הרחק החוקר. בעזרת מלקחיים בסדר, להרים את עור הבטן ופתוח על קו האמצע כדי לחשוף את חלל הבטן עד סרעפת העכבר 18.
- בעזרת מלקחיים בסדר, לנתק את הכבד frאום דופן הבטן האחורית. בתנועה רציפה לקראת זנב עכבר, לגרוף את האיברים הפנימיים (כולל הכבד, הקיבה, הטחול, המעיים, הכליות והלבלב) ומניחים אותם בצלחת תרבות המכילה HBSS.
- תחת סטראו, להסיר את הכבד והכליות לחשוף את הלבלב (איור 1). בעזרת מלקחיים בסדר, לנתק את הלבלב מהבטן, תריסריון, ולבסוף, מן הטחול.
- מניחים את רקמת לבלב לתוך צינור המכיל מאגר העיכול (מוכן בשלב 1.2.1). עבור גורים P14 ומעלה, לחתוך את הרקמה לתוך 2 חתיכות כדי להגביר את יעילות העיכול. שמור את הצינורות על קרח עד שכל העכברים הם גזורים ורקמות לבלב שנאספו.
- חזור על שלבים 1.2.2 - 1.2.6 עם עכברים הנותרים.
2. עיכול לבלב
- דגירת הצינורות המכילים את רקמת הלבלב (חיץ עיכול) בתוך גוש חימום על 37 מעלות צלזיוס למשך 30 דקות עם agitatיון ב 700 סל"ד. לאחר 15 דקות, ידני לנער את הצינורות על ידי היפוך אותם 3 - 4 פעמים ומניחים אותם בחזרה בבלוק החימום.
הערה: אם באמצעות בלוק חימום ללא יכולות תסיסה, להפוך את הצינורות כל 5 - 10 דקות. ודא כי הרקמה מתעכל כראוי. אם לא, לחתוך את הרקמה לחתיכות קטנות יותר לפני הדגירה או להגדיל את התסיסה. - כדי לעצור את עיכול רקמות, מניחים את הצינורות על הקרח ולהוסיף 10 מ"ל של HBSS קר צינור אחד. צנטריפוגה צינורות ב 4 ° C ו- XG 300 דקות 5 ו לשאוב supernatant.
- Re-השעיה:
- עבור עכברי בוגרים P14 או גורים מבוגרים, מחדש להשעות את הגלולה עם 6 מיליליטר של PBS ו לסנן אותם דרך מסננת תא 70 מיקרומטר מונחת על גבי צינור פוליפרופילן אוסף חרוטים חדש של 15 מיליליטר. כדי להבטיח התאוששות התא מקסימלי, לשטוף את הצינור המקורי עם תוספת 6 מ"ל של PBS ו מסננים אותו דרך מסננת התא על צינור איסוף.
- עבור עוברים גורים צעירים tP14 האן, מחדש להשעות את גלולה עם 2 מ"ל של PBS ו לסנן אותם דרך מסננת תא 35 מיקרומטר מונח על גבי צינור איסוף קלקר 5 מ"ל מסביב לתחתית (צינור FACS). כדי להבטיח התאוששות תא מקסימלי, לשטוף את הצינור המקורי עם תוספת 2 מיליליטר של PBS ו מסנן אותו דרך מסננת התא על צינור האיסוף.
- צנטריפוגה צינורות ב 4 ° C ו- XG 300 דקות 5 ו לשאוב supernatant. הסר את הנוזל בזהירות, כמו תאים המחוברים באופן רופף אל צינור הקלקר.
3. הכנת תווית תאים בודדים
- ההכנות הצפת: בידוד תא על ידי FACS, להכין מיון חיץ על ידי ערבוב PBS (ללא כלוריד סידן מגנזיום כלוריד), 5% בסרום שור העובר (FBS), ו -5 מ"מ EDTA. עבור ניתוח תזרים cytometry, להכין חיץ ניתוח על ידי השלמת חיץ מיון עם אזיד הנתרן 0.05%. מאגרי שניהם עשויים להיות מאוחסן על 4-8 מעלות צלזיוס למשך עד 2 חודשים.
- מחדש להשעות תאים למיון או anaחיץ תמוגה. Re- להשעות כל הלבלב מבודד עוברים גורים מתחת לגיל P7 ב 1 מ"ל, מן הגורים בין P8 ו בן חודש ב 1.5 מ"ל, ו מעכברים מבוגרת חודש 3 מ"ל. מסננים את התאים דרך מסננת תא 35 מיקרומטר מונח על גבי צינור פוליסטירן מסביב לתחתית (צינור FACS).
- עבור פקדים מכתימים, להוציא 50 עד 100-μL aliquots ממדגמים שבוצעו בשלב הקודם (לא יותר מ -5% מנפח כלל המדגם) ולהכניס אותם לתוך צינורות FACS חדשים; כולל צינור עבור כל fluorophore בשימוש, כולל חלבוני DAPI ו ניאון, כמו גם עבור פקד בלא כתם.
הערה: בעת שימוש בעכברים טרנסגניים עם תאי מבטאי חלבון פלואורסצנטי, או כאשר המספר סלולארי מוגבל, כולל רקמות הלא מהונדס כביקורת מכתימה. אם תאי מבטאי חלבון פלואורסצנטי משמשים ללא מכתים נוסף, המשך לשלב 3.8. - ספין למטה התאים ב 300 XG במשך 5 דקות ב 4 ° C ו לשאוב supernatant.
- לקבלת גושמלך, מחדש להשעות את התאים עם פתרון חסימה (100 μL למיון או חיץ ניתוח בתוספת 1 μL של IgG עז) דגירה במשך 30 דקות על הקרח.
- כדי להכתים סמנים פני התא, להכין תערובת הכוללת את כל הנוגדנים fluorophore מצומדות הרצוי בהיקף של 100 μL לדגימה. כן דילולי נוגדן 2x במיון או חיץ ניתוח (כלומר, לדלל את הנוגדן להשיג את הריכוז הנדרש כפול; אם דילול סופי של 1: 200 הוא רצוי, לדלל את הנוגדן 1: 100). מבלי לשטוף היטב את הפתרון החוסם, להוסיף 100 μL של התערובת אל התאים המדגמים כדי להשיג נפח מכתים סופי של 200 μL. דגירה של 30-60 דקות על הקרח בחושך.
- כדי להגדיר את הניתוח או פרמטרי מיון (ראה צעדים 4.3 ו -5.2), להכין צינורות נוספים המכילים רק אחד הנוגדנים המשמשים (שליטה מכתימה). כן דילולי נוגדן 2x במיון או חיץ ניתוח (כמתואר בשלב 3.6). הקפד לכלול סידילול מלא מכתים ngle לכל fluorophore בשימוש, כמו גם פקד בלא כתם. מבלי לשטוף היטב את הפתרון חוסם, להוסיף 100 μL של תערובות נוגדנים לתאי (מוכן בשלב 3.3) כדי להשיג נפח מכתים סופי של 200 μL. דגירה של 30 - 60 דקות על הקרח בחושך.
- לשטוף על ידי מילוי צינור אחד עם ניתוח או מיון חיץ לנפח מקסימאלי של 4 מיליליטר. לחלופין, מחדש נקע את התאים דרך מסננת תא 35 מיקרומטר (כמתואר בשלב 3.2).
- צנטריפוגה XG ב 300 במשך 5 דקות ב 4 ° C ולהסיר את supernatant בזהירות.
- מחדש להשעות את הדגימות בניתוח או מיון חיץ. Re- להשעות את התאים מבודדים מעוברים ב 500 μL, מן הגורים מתחת לגיל חודש ב 1 מ"ל, מ 1 - 3 חודשים הישן 2 מ"ל, ו מעכברים מעל גיל 3 חודשים ב 3 מ"ל. בקרות מכתימות ניתנות מחדש תלויות 300 μL של חיץ.
- הוספת 200 ng / mL של DAPI מחדש מושעה תאים לזהות את התאים המתים. הקפד לכלול שיתוף צינורntaining תאים בלא כתם ללא DAPI עבור הגדרות cytometer. המשך מיון תא (שלב 4) או ניתוח (שלב 5).
4. מיון תאים
- כנות:
- עבור מיון התא לפני מיצוי RNA, מעיל צינור איסוף 1.5 מ"ל עם RNase מעכב מיד לפני מיון. לשם כך, להוסיף 1 מ"ל של מיון חיץ, המכיל 0.01 U / mL RNase מעכב, אל צינור 1.5 מ"ל אוסף סטרילי. לאחר 5 דקות, מערבולת הצינור ולהסיר את הנוזל.
- עבור מיון התא לפני תרבית תאים, להוסיף 3 מ"ל של התקשורת culturing סטרילי (בינוני הנשר שונה של Dulbecco (DMEM) השלימו עם FBS 20%, 1% L- גלוטמין, ו -1% פניצילין, סטרפטומיצין) לתוך צינור איסוף 15 מ"ל סטרילי .
- לפני טעינת שפופרת לתוך סדרן FACS, מערבולת אותו קלות על מנת מחדש להשעות את התאים. שמור את הצינורות הנותרים על קרח.
- התחל על ידי ניתוח הבקרות המכתימות מנת לקבוע את פרמטרי המיון (למשל, מתח ופיצויים) ומיון שערים (למשל, אוכלוסיית תאים כוללת, תאי DAPI שלילי חיות, אוכלוסיות תאים להיות מסודרים).
- לאחר הפרמטרים ושערי מיון מוגדרים, טען את הדגימות וליזום מיון תא לתוך הצינורות האוספים.
הערה: תנאי מיון הם תלויים במידה רבה על המכשיר. אנו משתמשים ברוחב זרבובית של 100 מיקרומטר, בלחץ של 23.1 psi, ומהירות מיון מקסימלי של 5. - המשך מיצוי RNA או culturing של תאים ממוינים.
הערה: לקבלת מיצוי RNA, צנטריפוגה התאים XG ב 2000 במשך 5 דקות ולהסיר את הנוזל העודף לפני שתמשיך עם פרוטוקול מיצוי סטנדרטי. עבור culturing תאים, אם התאים מוינו בתנאים לא סטריליים, לשטוף אותם פעמיים על ידי מילוי צינור עם המדיום culturing ו צנטריפוגה זה ב XG 300 7 דקות לפני culturing כדי למזער זיהום שלהם.
5. ניתוח Cell על ידי cytometry זרימה
- לפני שאניoading כל צינור לתוך, מערבולת cytometer אותו קלות על מנת מחדש להשעות את התאים. שמור את הצינורות הנותרים על קרח.
- התחל על ידי ניתוח דגימות בלא כתם חד מוכתם על מנת לקבוע את הפרמטרים ניתוח (לדוגמה, מתח ופיצויים).
- לאחר הפרמטרים ניתוח מוגדרים, לטעון כל דגימה, כולל בקרת מכתים, ולהקליט את התוצאות. לנתח את התוצאות שהושגו באמצעות זרימת cytometry תוכנה לניתוח.
תוצאות
Mesenchyme הלבלב נדרש במהלך התפתחות ובגרות. השיטה המתוארת כאן מאפשרת הבידוד של תאי mesenchymal מן עוברי, בילוד, והלבלב המבוגר. תאים mesenchymal, אך אין סוגי תאים אחרים, לבטא חלבון פלואורסצנטי צהוב (YFP) בלבלב של Nkx3.2 -Cre; R26R -YFP עכברים 5, 11, 17, 19. במהלך פיתוח, Nkx3.2 (הידוע גם בשם BapX1) בא לידי ביטוי על ידי לבלב עוברי, קיבת mesenchyme מעיים, כמו גם תת-קבוצה של somites שלד 19, 20, 21. גן זה התבטא mesenchyme הלבלב מ E9.5 עד E11.5, המאפשר ביטוי גנים בשליטת Nkx3.2 -Cre מ E9.5 5, 19, 20. בהתבסס על תיוג זה, יכול להיות מטוהרים תאים מרקמות הלבלב בכמות גדולה באמצעות cytometry הזרימה. תרשים 2 מציג ניתוח התזרים-cytometry של תאים בודדים מן עובריות, בילוד, ורקמות לבלב מבוגרות, מבודדות כפי שמתואר כאן. בעוד רקמות הלבלב שאינו מהונדס לא מכילים תאים פלורסנט, Nkx3.2 -Cre; R26R -YFP רקמת לבלב מכל הגילים נתחו מכילה אוכלוסיית תאים YFP שכותרתו ברורה (איור 2; המסומנות שערים).
בעקבות השיטה המתוארת כאן, תאי מבטאי חלבוני ניאון יכולים להיות מטוהרים או מנותח על ידי cytometry זרימה, עם או בלי immunostaining נוסף. לדוגמה, לאחר מיון מבוסס על תיוג פלורסנט, תאים mesenchymal יכול להיות מתורבת להקים קו תא (במשך חמש קטעים לפחות), כפי שמוצג באיור 3 א. הערה t הוא fibrocytic מורפולוגיה של תאים בתרבית, אופייני לתאי mesenchymal. בנוסף, מערכת זו שימשה לנתח ביטוי גנים על ידי תאים ממוינים. לשם כך, RNA הופק מתאי mesenchymal מסודרים לסנתז cDNA, ורמות ביטוי גנים נותחו על ידי qPCR. ניתוח כזה עולה כי תאים ממוינים לבטא את vimentin סמן הפאן mesenchymal (איור 3 ב). לבסוף, ביטוי סמן פני השטח על ידי תאי הלבלב יכול להיות מנותח על ידי-cytometry הזרימה. לדוגמה, אנחנו מבודדים תאים מרקמות הלבלב של Nkx3.2 -Cre; R26R -YFP עכברים בוגרים בשיטה המתוארת כאן ומוכתמת אותם עם פני התא גליקופרוטאין CD9, אשר דווחו להתבטא פיברובלסטים 22. כפי שניתן לראות בתרשים 3C, כל fluorescently שכותרתו התאים Nkx3.2 -Cre; לבלב R26R -YFP להביע CD9.
tp_upload / 55,344 / 55344fig1.jpg "/>
איור 1: רקמת לבלב עוברית בילוד. בדרך מבודדת כולו עיכול, כולל הבטן, טחול, מעי, ולבלב, של עובר E15.5 (א) ו גור P4 (B). רקמת הלבלב היא תחום עם קו כחול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
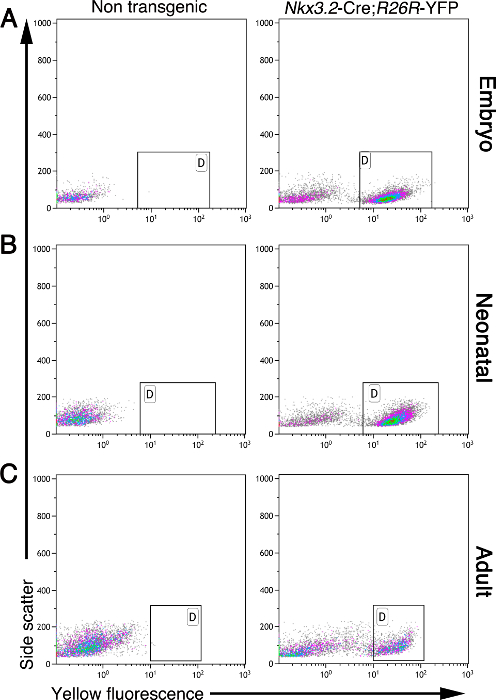
איור 2: תאים mesenchymal מסומנים fluorescently ב Nkx3.2 -Cre; R26R -YFP רקמת לבלב. ניתוח זרימה cytometry של תאי הלבלב מבודד שאינו מהונדס (פאנלים משמאל) Nkx3.2 -Cre; R26R -YFP מהונדס (לוחות מימין) עכברים בגילים שונים: עוברי (א), בילוד (B), ומודעהult (C). תאים נותחו על פיזור בצד (ציר y) קרינה צהובה (ציר x). גייטס (מסומן "D") מצביע על בעיית אוכלוסיית תא YFP + בעכברים טרנסגניים אך לא בקבוצת ביקורת הלא מהונדסת. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
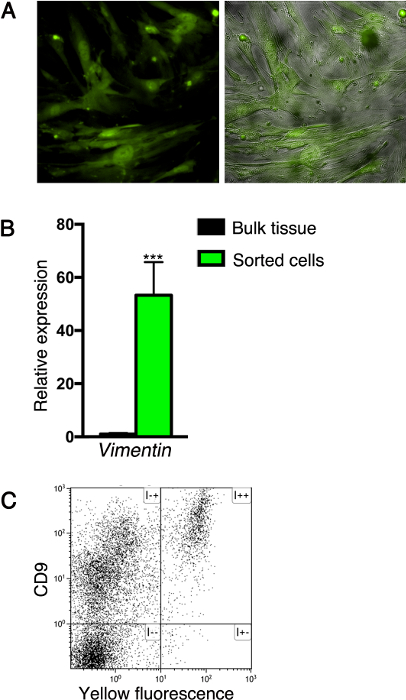
איור 3: ניתוח של תאי לבלב מבודדים. (א) תאים ממוינים מן רקמת לבלב של Nkx3.2 -Cre; R26R -YFP עכברים בילוד (כמתואר באיור 2B) היו בתרבית להקים קו התא. תאים בתרבית הם צילמו עבור פלואורסצנטי (ירוק; ימין לוחות משמאל) לעומת שלב (אפור; פאנל מימין). (ב) בתרשים בר מראה Vimentin1 (Vim1)רמות הביטוי על ידי YFP + -sorted תאים מרקמות הלבלב של Nkx3.2 -Cre; עכברי בוגרי R26R -YFP (כמתואר באיור 1C; ירוק) לעומת רקמת לבלב ממוינת (שחורה). RNA הופק ביטוי גנים נותח על ידי qPCR; הביטוי היה מנורמל Cyclophilin. N = 4. *** P <0.001. הנתונים מייצגים את ממוצע ± סטיית תקן. (ג) ניתוח זרימת cytometry של תאי לבלב התפזרו Nkx3.2 -Cre; חיסוניים מוכתם מבוגר עכברי R26R -YFP עם allophycocyanin (APC), מצומדות נוגדן אנטי CD9 ונותח עבור APC (ציר y) קרינה צהובה (ציר x). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
כאן אנו מתארים שיטה לבודד ולנתח תאים של microenvironment הלבלב. שיטה זו יכולה לשמש כדי לבודד תאי mesenchymal מרקמות לבלב עובריות מבוגרות. בנוסף, אנו השתמשנו בהצלחה בפרוטוקול זה כדי לבודד תאי האנדותל מן המבוגר בילוד הלבלב 5, 17. עם זאת, זה לא יכול להיות מתאים לקבלת השעית תא בודד לשחזור של תאי אפיתל לבלב (פרוטוקולים חלופיים מתוארים הפניות 18, 23, ו -24). באמצעות שיטה זו, שכותרתו תאי פלורסנטי, או להביע חלבוני ניאון או immunostained עבור סמני פני שטח, יכול להיות מטוהר על ידי FACS או מנותח על ידי cytometry זרימה. RNA יכול להיות מופק תאים מטוהרים לפרופיל דפוס ביטוי הגנים שלהם. לחלופין, תאים מטוהרים יכול להיות מתורבת להקים קו תא לניתוח proteomic שלאחר מכן. שיטה זו תאפשר האפיון של גורמי דוארxpressed ידי microenvironment הלבלב, אשר למשול organogenesis, פיזיולוגיה, והפתופיזיולוגיה שלה.
Mesenchyme הלבלב תומך organogenesis רקמות באמצעות קידום ההתפשטות של מבשר ותאי בדיל 5, 9. תאים אלה הוצגו לתמוך הרחבת תאי גזע עובריים אנושיים (hESC) -derived אבות לבלב 17, 25, 26. לכן, המגדיר את זהותו של גורמי mesenchymal עובריים יקל מאמצים נוכחיים כדי ליצור תאים בטאו מייצר אינסולין מן hESCs ותאי גזע מושרים (iPSCs) כתרופה פוטנציאל סוכרת. מחקרים גנטיים עכבר איפשר זיהוי של גורמי גדילה, כגון Fgf10, המיוצרים על ידי mesenchyme לקדם הרחבת האפיתל הלבלב בשלבים הראשונים של התפתחות הלבלב3, 9. במטרה לזהות גורמים נוספים לידי ביטוי mesenchyme העוברי, אנחנו מבודדים תאים אלה באמצעות microdissection ליזר שנתפס, חילוץ RNA שלהם, ובצענו ניתוח ביטוי גנים 26. עם זאת, בנוסף להיותו העבודה-אינטנסיבי, שיטה זו מסתמכת על זיהוי תאים בהתבסס על תכונות מורפולוגיות שלהם, אשר מגביל את השימוש בו לשלבים התפתחותיים לפני הסתעפות של האפיתל לתוך mesenchyme שמסביב (כלומר, E12.5). כדי לאפיין תאים mesenchymal בשלבים התפתחותיים מאוחר יותר, שיישמנו השיטה המתוארת כאן 5, 17.
השתמשנו בשיטה זו כדי לנתח ביטוי סמן פני השטח על ידי mesenchyme 5 הלבלב בילוד. בנוסף, תאי mesenchymal בודדו רקמת לבלב עוברית בילוד של Nkx3.2 -Cre; עכברי R26-EYFP, מבוסס עלתיוג פלורסנט שלהם בתור העכבר הזה, והיה תרבותי להקים שורות תאים 17. ניתוח proteomic של תאים אלה מותר לצורך זיהוי של גורמים מופרשים mesenchyme הלבלב עם היכולת לקדם אבות לבלב נגזר hESC 17. בנוסף, אנו השתמשנו בשיטת בידוד תא זה לטהר תאי mesenchymal מרקמות לבלב מבוגרים עבור ביטוי גני מיצוי RNA ניתוח 17. לכן, שיטה זו יכולה לשמש כדי לזהות גנים וחלבונים שהביעו mesenchyme הלבלב, עם היכולת לתמוך בפיתוח תאי לבלב.
תאי mesenchymal לבלב הוצגו עוד לשחק תפקיד tumorigenesis לבלב. PDAC מאופיין ההיווצרות של stroma desmoplastic עשיר-פיברובלסטים מורכבים פיברובלסטים, תאי מערכת חיסון, ECM 27. בעוד stroma היה נהוג לחשוב כדי לקדם את הפיתוח של רביםסוגים של סרטן, זה הוצג לרסן התקדמות PDAC 15, 16, 28. הדבר מצביע על כך רכיבים של stroma הלבלב להפריש גורמים המעכבים tumorigenesis. יתר על כן, שינויים בהרכב הסלולר stroma וכן פנוטיפ תא יכולים ביסוד השפיעו על תאי אפיתל 15, 16, 28. השיטה המתוארת כאן ולכן יכול לסייע באפיון תאים מסוגים שונים שמרכיבים stroma PDAC לעומת רקמת לבלב בריא. זה היה עוד יותר את הטיהור של סוגי תאי סטרומה השונים לאפיין שינויים פוטנציאליים פרופילי ביטוי הגנים שלהם במהלך התקדמות PDAC. עם זאת, בשל שינויים בהרכב ECM לבלב במהלך tumorigenesis 27, התאמות של הפרמטרים לעיכול רקמה, כגון הכללת additional סוגי collagenase או הגדלת זמן הדגירה, ייתכן שתידרש.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Adi Sasson for the technical assistance and Helen Guez for the critical reading of the manuscript. This work was supported by European Research Council starting grant no. 336204.
Materials
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213865001 | |
| DNase | Sigma-Aldrich | D5025-15KU | The effective units should be at least 2000 unitz/ml protein |
| Hanks’ Balanced Salt solution (HBSS) | Sigma-Aldrich | H6648 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-127-1A | |
| EDTA | Biological Industries | 01-862-1A | |
| Sodium Azide | Sigma-Aldrich | S2002 | |
| Goat IgG serum | Sigma-Aldrich | G9023 | |
| DAPI | Sigma-Aldrich | D9542 | |
| RNAse inhibitor | Invitrogen | N8080119 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Invitrogen | 11965092 | |
| L-Glutamine | Biological Industries | 03-020-1B | |
| Penicillin-streptomycin | Biological Industries | 03-031-1B | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | Without Calcium Chloride and Magnesium Chloride |
| 1.5 ml tubes | Sarstedt | 72 690 | |
| 15 ml conical tube | Corning | 430052 | |
| Round Bottom Polystyrene 5 ml tube | Corning | 352008 | FACS tube'. Make sure tube is compatible with the flow cytomter to be used, as there are slight differences in required tubes between brands |
| 5ml tube with 35 μm cell strainer Snap Cap | Corning | 352235 | FACS tube' |
| 70 μm cell strainer | Miltenyi Biotec | 130-098-462 | |
| Heating block with agitation | Eppendorf | ThermoMixer C | |
| Centrifuge | ThermoFisher | Heraeus Megafuge 40R | |
| Steromicroscope | Nikon | SMZ 745 | |
| Cell sorter | BD Biosciences | FACSAria IIu | |
| flow cytometer | Beckman Coulter | Gallios |
References
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Cabrera, O., Berman, D. M., Kenyon, N. S., Ricordi, C., Berggren, P. -. O., Caicedo, A. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Gittes, G. K. Developmental biology of the pancreas: a comprehensive review. Developmental biology. 326 (1), 4-35 (2009).
- Villasenor, A., Cleaver, O. Crosstalk between the developing pancreas and its blood vessels: An evolving dialog. Seminars in cell & developmental biology. , 1-8 (2012).
- Landsman, L., Nijagal, A., et al. Pancreatic mesenchyme regulates epithelial organogenesis throughout development. PLoS Biology. 9 (9), e1001143 (2011).
- Lammert, E., Cleaver, O., Melton, D. Induction of pancreatic differentiation by signals from blood vessels. Science. 294 (5542), 564-567 (2001).
- Pierreux, C. E., Cordi, S., et al. Epithelial: Endothelial cross-talk regulates exocrine differentiation in developing pancreas. Developmental biology. 347 (1), 216-227 (2010).
- Golosow, N., Grobstein, C. Epitheliomesenchymal interaction in pancreatic morphogenesis. Developmental biology. 4, 242-255 (1962).
- Bhushan, A., Itoh, N., et al. Fgf10 is essential for maintaining the proliferative capacity of epithelial progenitor cells during early pancreatic organogenesis. Development. 128 (24), 5109-5117 (2001).
- Larsen, B. M., Hrycaj, S. M., Newman, M., Li, Y., Wellik, D. M. Mesenchymal Hox6 function is required for mouse pancreatic endocrine cell differentiation. Development. 142 (22), 3859-3868 (2015).
- Sasson, A., Rachi, E., et al. Islet pericytes are required for beta-cell maturity. Diabetes. 65 (10), 3008-3014 (2016).
- Stanley, S. A., Kelly, L., et al. Bidirectional electromagnetic control of the hypothalamus regulates feeding and metabolism. Nature. 531 (7596), 647-650 (2016).
- Brissova, M., Aamodt, K., et al. Islet microenvironment, modulated by vascular endothelial growth factor-A signaling, promotes β cell regeneration. Cell metabolism. 19 (3), 498-511 (2014).
- Nikolova, G., Jabs, N., et al. The vascular basement membrane: a niche for insulin gene expression and Beta cell proliferation. Developmental cell. 10 (3), 397-405 (2006).
- Rhim, A. D., Oberstein, P. E., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer cell. 25 (6), 735-747 (2014).
- Özdemir, B. C., Pentcheva-Hoang, T., et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer cell. 25 (6), 719-734 (2014).
- Russ, H. A., Landsman, L., et al. Dynamic Proteomic Analysis of Pancreatic Mesenchyme Reveals Novel Factors That Enhance Human Embryonic Stem Cell to Pancreatic Cell Differentiation. Stem cells international. 2016, 6183562 (2016).
- Gout, J., Pommier, R. M., et al. Isolation and Culture of Mouse Primary Pancreatic Acinar Cells. Journal of Visualized Experiments. (78), e50514 (2013).
- Verzi, M. P., Stanfel, M. N., et al. Role of the homeodomain transcription factor Bapx1 in mouse distal stomach development. Gastroenterology. 136 (5), 1701-1710 (2009).
- Tribioli, C., Frasch, M., Lufkin, T. Bapx1: an evolutionary conserved homologue of the Drosophila bagpipe homeobox gene is expressed in splanchnic mesoderm and the embryonic skeleton. Mech Dev. 65 (1-2), 145-162 (1997).
- Hecksher-Sorensen, J., Watson, R., et al. The splanchnic mesodermal plate directs spleen and pancreatic laterality, and is regulated by Bapx1/Nkx3.2. Development. 131 (19), 4665-4675 (2004).
- Walmsley, G. G., Rinkevich, Y., Hu, M. S. Live Fibroblast Harvest Reveals Surface Marker Shift In Vitro. Tissue Engineering Part C: Methods. , (2014).
- Morris, J. P., Greer, R., et al. Dicer regulates differentiation and viability during mouse pancreatic cancer initiation. PloS one. 9 (5), 95486 (2014).
- Miyatsuka, T., Matsuoka, T. -. A., et al. Chronological analysis with fluorescent timer reveals unique features of newly generated β-cells. Diabetes. 63 (10), 3388-3393 (2014).
- Sneddon, J. B., Borowiak, M., Melton, D. A. Self-renewal of embryonic-stem-cell-derived progenitors by organ-matched mesenchyme. Nature. 491 (7426), 765-768 (2012).
- Guo, T., Landsman, L., Li, N., Hebrok, M. Factors expressed by murine embryonic pancreatic mesenchyme enhance generation of insulin-producing cells from hESCs. Diabetes. 62 (5), 1581-1592 (2013).
- Olive, K. P., Jacobetz, M. A., et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science. 324 (5933), 1457-1461 (2009).
- Raz, Y., Erez, N. An inflammatory vicious cycle: Fibroblasts and immune cell recruitment in cancer. Experimental cell research. 319 (11), 1596-1603 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved