Method Article
Aislar y analizar células del páncreas mesénquima por Citometría de Flujo
En este artículo
Resumen
A continuación, describimos un método para el aislamiento de células en el microambiente de páncreas, tejido de ratón neonatal y adulto embrionario, centrándose en el aislamiento de las células mesenquimales. Este método permite que los perfiles de expresión génica de células y la secreción de proteínas con el fin de dilucidar las señales extrínsecas que regulan el desarrollo del páncreas, la función y la tumorigénesis.
Resumen
The pancreas is comprised of epithelial cells that are required for food digestion and blood glucose regulation. Cells of the pancreas microenvironment, including endothelial, neuronal, and mesenchymal cells were shown to regulate cell differentiation and proliferation in the embryonic pancreas. In the adult, the function and mass of insulin-producing cells were shown to depend on cells in their microenvironment, including pericyte, immune, endothelial, and neuronal cells. Lastly, changes in the pancreas microenvironment were shown to regulate pancreas tumorigenesis. However, the cues underlying these processes are not fully defined. Therefore, characterizing the different cell types that comprise the pancreas microenvironment and profiling their gene expression are crucial to delineate the tissue development and function under normal and diseased states. Here, we describe a method that allows for the isolation of mesenchymal cells from the pancreas of embryonic, neonatal, and adult mice. This method utilizes the enzymatic digestion of mouse pancreatic tissue and the subsequent fluorescence-activated cell sorting (FACS) or flow-cytometric analysis of labeled cells. Cells can be labeled by either immunostaining for surface markers or by the expression of fluorescent proteins. Cell isolation can facilitate the characterization of genes and proteins expressed in cells of the pancreas mesenchyme. This protocol was successful in isolating and culturing highly enriched mesenchymal cell populations from the embryonic, neonatal, and adult mouse pancreas.
Introducción
homeostasis de la energía y la digestión de alimentos en los mamíferos dependen de la función pancreática adecuada. El páncreas adulto se compone de dos principales compartimentos celulares: la exocrino y endocrino. Células exocrinas, incluyendo las células acinares que producen y secretan enzimas digestivas y las células de los conductos que transportan estas enzimas en el estómago, abarcan más de 80% de la masa pancreática total 1. Células endocrinas, que incluyen las células beta productoras de insulina y glucagón células alfa productoras, se organizan en los islotes de Langerhans que están incrustados en el tejido exocrino y secretan hormonas para regular los niveles de glucosa en la sangre 2.
Células pancreáticas adquieren su destino a través de una diferenciada, proceso de varios pasos altamente regulada 3. La evidencia sugiere que las señales extrínsecas proporcionadas por neuronal, endotelial, y las células mesenquimales guían la diferenciación de células de páncreas y la proliferación en tél embrión 3, 4, 5. Un ejemplo es el requisito de la aorta para la especificación de precursores tempranos pancreáticas 6. Más tarde en el desarrollo, se demostró que las células endoteliales para jugar un papel central en el desarrollo de ambas células endocrinas y exocrinas pancreáticas y para promover la diferenciación de las células beta 4, 6, 7. Se demostró que las células mesenquimales para apoyar la supervivencia y expansión de células progenitoras pancreáticas comunes, principalmente a través de la secreción del factor de crecimiento Fgf10 8, 9. Además, hemos demostrado que estas células apoyan la proliferación de endocrinas y exocrinas precursores, así como de las células diferenciadas (incluyendo las células acinares y beta) en el páncreas embrionario 5. Recientemente, células mesenquimales eran másdemostrado que regulan la diferenciación de las células endocrinas 10.
En el adulto, la función de las células beta y de masas se muestran a depender de las células en su microentorno, incluyendo neuronal, inmune, y las células endoteliales, así como los pericitos 11, 12, 13. Durante la lesión, se mostró que las células endoteliales para reclutar células inmunes al páncreas para promover la replicación de las células beta 13. Las células endoteliales se muestran adicionalmente para producir componentes de la matriz extracelular (ECM) para apoyar la expresión de insulina y de las células beta función 14. Recientemente hemos demostrado el requisito de pericitos de los islotes para la función de las células beta 11. Por último, se demostró que las células del estroma de páncreas para regular la progresión de adenocarcinoma ductal pancreático (PDAC) 15, 16. Sin embargo, el identidad de señales extrínsecas que guían el desarrollo del páncreas, la función y la tumorigénesis son en gran parte desconocidos.
La identificación de las señales proporcionadas por las células del microambiente páncreas requiere la caracterización de los genes y las proteínas expresadas por estas células. Esto depende de aislamiento de estas células del páncreas en orden para llevar a cabo la expresión génica y análisis proteómicos y / o en el establecimiento de líneas celulares. Aquí, se propone un método para aislar células mesenquimales del microambiente páncreas mediante la utilización de la digestión enzimática del tejido y de fluorescencia de células activadas (FACS) de cualquiera de las células marcadas immunofluorescently-o células que expresan las proteínas fluorescentes. Este protocolo se realizó con éxito para aislar y analizar la proteína fluorescente amarilla (YFP) que expresan las células mesenquimales del embrionario, neonatal y adulto páncreas 5, 17.
Protocolo
Los experimentos se llevaron a cabo de acuerdo a los protocolos aprobados por el Comité de Investigación Animal de la Universidad de Tel Aviv.
1. Aislamiento de tejido pancreático de ratones
- Para los ratones adultos:
- Preparar el tampón de digestión: 0,4 mg / ml de colagenasa P y 0,1 ng / ml de DNasa I disuelto en solución salina equilibrada de Hanks (HBSS). Recién preparar 5 ml de tampón por ratón en 15 mL tubos cónicos y mantenerlos en hielo hasta su uso.
- La eutanasia a los ratones de acuerdo con la directriz institucional.
- Diseccionar cada ratón para extirpar el páncreas (por instrucción, por favor, véase la referencia 18); colocarlo en una placa de cultivo que contiene HBSS. Es posible realizar esta etapa bajo un microscopio estereoscópico, y para aumentar la eficiencia de digestión, cortar el tejido en 2 - 4 piezas.
- Coloque el tejido pancreático en un tubo que contenía tampón digestivo (preparado en la etapa 1.1.1). Mantener los tubos en hielo hasta que todos los ratones se diseccionaron y tejidos pancreáticosrecogido.
- Repetir los pasos 1.1.2 - 1.1.4 con los ratones restantes.
- Para los embriones y ratones recién nacidos:
- Preparar el tampón de digestión: 0,4 mg / ml de colagenasa P y 0,1 ng / ml de DNasa I disuelto en HBSS. Para los embriones y los cachorros en el día postnatal 7 (p7) o menos, recién preparar 1,5 - 2 ml de tampón por ratón en un tubo cónico de 15 ml. Para p7 o cachorros mayores, preparar 3 - 4 ml de tampón por ratón en un tubo cónico de 15 ml. Mantener en hielo hasta su uso.
- La eutanasia a los ratones de acuerdo con la directriz institucional. Para los embriones, retire todos los embriones del útero de su madre y colocarlos en una placa de cultivo de 10 mm que contenía PBS. Diseccionar un embrión a la vez.
- Coloque el ratón sobre su espalda, con la cabeza apuntando lejos del investigador. Con unas pinzas finas, tire hacia arriba de la piel del abdomen y abierto en la línea media para exponer la cavidad abdominal hasta el diafragma del ratón 18.
- Con unas pinzas finas, separar el hígado from la pared abdominal hacia atrás. Con un movimiento continuo hacia la cola del ratón, saca los órganos internos (incluyendo el hígado, el estómago, el bazo, los intestinos, los riñones y el páncreas) y colocarlos en una placa de cultivo que contiene HBSS.
- Bajo un microscopio estereoscópico, quitar el hígado y los riñones para exponer el páncreas (Figura 1). Con unas pinzas finas, separar el páncreas desde el estómago, el duodeno, y finalmente, a partir del bazo.
- Coloque el tejido pancreático en un tubo que contenía tampón digestivo (preparado en la etapa 1.2.1). Para p14 o más cachorros, cortar el tejido en 2 piezas para aumentar la eficiencia de digestión. Mantener los tubos en hielo hasta que todos los ratones se diseccionaron y se recogieron tejidos pancreáticos.
- Repetir los pasos 1.2.2 - 1.2.6 con los ratones restantes.
2. La digestión del páncreas
- Incubar los tubos que contienen el tejido pancreático (en tampón de digestión) en un bloque de calentamiento a 37 ° C durante 30 min con agitatde iones a 700 rpm. Después de 15 minutos, agitar manualmente los tubos por inversión de los 3 - 4 veces y colocarlos de nuevo en el bloque de calentamiento.
NOTA: Si se utiliza un bloque de calentamiento sin capacidades de agitación, invertir los tubos de cada 5 - 10 minutos a. Asegúrese de que el tejido se digiere correctamente. Si no, cortar el tejido en piezas más pequeñas antes de la incubación o aumentar la agitación. - Para detener la digestión de los tejidos, se colocan los tubos en hielo y añadir 10 ml de HBSS fría a cada tubo. Centrifugar los tubos a 4 ° C y 300 xg durante 5 min y aspirar el sobrenadante.
- Resuspensión:
- Para los ratones adultos y crías de p14 o de edad avanzada, volver a suspender el sedimento con 6 ml de PBS y se cuela a través de un filtro de células de 70 micras colocado en la parte superior de un nuevo tubo de polipropileno de recogida cónico de 15 ml. Para asegurar la recuperación celular máxima, lavar el tubo original con un 6 ml adicionales de PBS y se cuela a través del filtro de células en el tubo de recogida.
- Para los embriones y crías jóvenes tHan p14, volver a suspender el sedimento con 2 ml de PBS y la tensión a través de un filtro de células de 35 micras colocado en la parte superior de un tubo de recogida de poliestireno de fondo redondo de 5 ml (tubo de FACS). Para asegurar la recuperación celular máxima, lavar el tubo original con un 2 ml adicionales de PBS y se cuela a través de la filtro de células en el tubo de recogida.
- Centrifugar los tubos a 4 ° C y 300 xg durante 5 min y aspirar el sobrenadante. Eliminar el líquido cuidadosamente, ya que las células están sueltos del tubo de poliestireno.
3. Preparación de células marcadas individuales
- preparaciones Buffer: Para el aislamiento de células por FACS, se preparan tampón de clasificación mediante la mezcla de PBS (sin cloruro de calcio y cloruro de magnesio), 5% de suero bovino fetal (FBS), y EDTA 5 mM. Para el análisis de citometría de flujo, preparar tampón de análisis, completándolo tampón de clasificación con azida de sodio al 0,05%. Tanto los tampones pueden ser almacenadas a 4-8 ° C durante un máximo de 2 meses.
- células de clasificación o ana resuspendertampón de lisis. Vuelva a suspender cada páncreas aisladas de embriones y crías menores de p7, en 1 ml de crías entre P8 y un mes de edad en 1,5 ml, y de los ratones tienen más de un mes de 3 ml. Colar las células a través de un filtro de células de 35 micras colocado en la parte superior de un tubo de poliestireno de fondo redondo (tubo FACS).
- Para la tinción controles, llevará a cabo de 50 a 100 mu l alícuotas de las muestras realizadas en el paso anterior (no más del 5% del volumen total de la muestra) y colocarlos en nuevos tubos de FACS; incluir un tubo para cada fluoróforo utilizado, incluyendo DAPI y proteínas fluorescentes, así como para un control sin teñir.
NOTA: Al usar ratones transgénicos con células que expresan una proteína fluorescente, o cuando el número de células es limitado, incluir un tejido no transgénica como control de la tinción. Si se usan células que expresan una proteína fluorescente sin más tinción, continúe en el paso 3.8. - Spin-abajo de las células a 300 xg durante 5 min a 4 ° C y aspirar el sobrenadante.
- para bloquerey, volver a suspender las células con solución de bloqueo (100 l de tampón de clasificación o análisis suplementado con 1 l de IgG de cabra) e incubar durante 30 minutos en hielo.
- Para la tinción de marcadores de superficie celular, preparar una mezcla que incluye todos los anticuerpos fluoróforo conjugado deseados en un volumen de 100 l por muestra. Preparar diluciones de anticuerpos de 2x en la clasificación o tampón de análisis (es decir, diluir el anticuerpo para obtener el doble de la concentración requerida, y si una dilución final de 1: 200 se desea, diluir el anticuerpo 1: 100). Sin lavar la solución de bloqueo, añadir 100 l de la mezcla a las células de la muestra para conseguir un volumen de tinción final de 200 mL. Incubar durante 30 a 60 min en hielo y en la oscuridad.
- Para establecer el análisis o parámetros de clasificación (consulte los pasos 4.3 y 5.2), se preparan tubos adicionales que contienen sólo uno de los anticuerpos utilizados (control de tinción). Preparar diluciones de anticuerpos en la clasificación de 2x o tampón de análisis (como se describe en el paso 3.6). Asegúrese de incluir un SIdilución de control de tinción ngle para cada fluoróforo utilizado, así como un control sin teñir. Sin lavar la solución de bloqueo, añadir 100 l de mezclas de anticuerpos a las células (preparados en la etapa 3.3) para conseguir un volumen de tinción final de 200 mL. Incubar durante 30 - 60 minutos en hielo y en la oscuridad.
- Lavar llenando cada tubo con el análisis o clasificación tampón a un volumen máximo de 4 ml. Opcionalmente, volver a tensar las células a través de un filtro de células de 35 mm (como se describe en el paso 3.2).
- Centrifugar a 300 xg durante 5 min a 4 ° C y separar el sobrenadante con cuidado.
- Volver a suspender las muestras en el análisis o tampón de clasificación. Vuelva a suspender las células aisladas de embriones en 500 l, a partir de cachorros de menos de un mes de 1 ml, de 1 - 3 meses de edad en 2 ml, y de los ratones de más de 3 meses en 3 ml. controles de tinción pueden re-suspendido en 300 l de tampón.
- Añadir 200 ng / ml de DAPI a las células re-suspendido para identificar las células muertas. Asegúrese de incluir un tubo de containing células sin teñir y sin DAPI para los ajustes del citómetro. Proceder a la clasificación celular (etapa 4) o el análisis (paso 5).
4. Clasificación de la célula
- Preparativos:
- Para la clasificación de células antes de la extracción de RNA, capa un tubo de recogida de 1,5 ml con RNasa inhibidor inmediatamente antes de la clasificación. Con este fin, se añade 1 ml de tampón de clasificación, que contiene 0,01 inhibidor U / ml de RNasa, a un tubo de recogida estéril 1,5 ml. Después de 5 minutos, vórtice del tubo y eliminar el líquido.
- Para clasificación de células antes del cultivo de células, añadir 3 ml de medio de cultivo estéril (de Eagle modificado por Dulbecco (DMEM) suplementado con 20% FBS, 1% de L-glutamina, y penicilina-estreptomicina al 1%) en un tubo de recogida estéril de 15 ml .
- Antes de cargar un tubo en un clasificador FACS, vórtice brevemente para volver a suspender las células. Mantener los tubos restantes en hielo.
- Para empezar, el análisis de los controles de tinción para determinar los parámetros de clasificación (por ejemplo, Puertas de tensión y compensación) y clasificación (por ejemplo, la población total de células, células DAPI-negativos en vivo, y las poblaciones de células para ser ordenados).
- Una vez que los parámetros de clasificación y las puertas están configurados, cargar las muestras e iniciar la clasificación de células en los tubos de recogida.
NOTA: Clasificación de las condiciones dependen del instrumento altamente. Utilizamos una anchura de boquilla de 100 micras, una presión de 23,1 kPa, y una velocidad máxima de 5 clasificación. - Proceder a la extracción de RNA o el cultivo de células clasificadas.
NOTA: Para la extracción de RNA, centrifugar las células a 2000 xg durante 5 min y eliminar el exceso de líquido antes de continuar con un protocolo de extracción estándar. Para el cultivo de células, si se clasificaron las células en condiciones no estériles, lavar dos veces al llenar el tubo con medio de cultivo y centrifugación que a 300 xg durante 7 min antes de cultivo con el fin de minimizar su contaminación.
5. Análisis celular por citometría de flujo
- antes de loading cada tubo en el citómetro, vórtice brevemente para volver a suspender las células. Mantener los tubos restantes en hielo.
- Para empezar, el análisis de las muestras no teñidas y manchados individuales con el fin de determinar los parámetros de análisis (por ejemplo, de tensión y de compensación).
- Una vez que los parámetros de análisis se establecen, cargar cada muestra, incluyendo el control de la tinción, y registrar los resultados. Analizar los resultados obtenidos utilizando citometría de flujo de software de análisis.
Resultados
Se requiere que el mesénquima de páncreas durante el desarrollo y la edad adulta. El método aquí descrito permite el aislamiento de las células mesenquimales de la, neonatal, y el páncreas adulto embrionario. Las células mesenquimales, pero no otros tipos de células, expresan la proteína fluorescente amarilla (YFP) en el páncreas de Nkx3.2 -Cre; R26R-YFP ratones 5, 11, 17, 19. Durante el desarrollo, Nkx3.2 (también conocido como BapX1) se expresa por páncreas embrionario, el estómago, y el mesénquima intestino, así como en un subconjunto de somitas esquelético 19, 20, 21. Este gen se expresa en el mesénquima de páncreas de E9.5 hasta E11.5, lo que permite la expresión de genes bajo el control de Nkx3.2 -Cre de E9.5 5, 19, 20. Con base en este etiquetado, las células pueden purificarse a partir de tejido pancreático mayor usando citometría de flujo. La Figura 2 muestra un análisis de citometría de flujo de células individuales a partir de tejidos pancreáticos embrionarias, neonatal y adulto, aislado como se describe aquí. Mientras que los tejidos pancreáticos no transgénicos no contenían células fluorescentes, Nkx3.2 -Cre; R26R YFP tejido pancreático de todas las edades analizadas contiene una población de células marcado con YFP distinta (Figura 2; marcado con puertas).
Siguiendo el método descrito aquí, las células que expresan proteínas fluorescentes pueden ser purificada o analizada por citometría de flujo, con o sin la inmunotinción adicional. Por ejemplo, después de la clasificación basada en el etiquetado fluorescente, las células mesenquimatosas pueden ser cultivadas para establecer una línea de células (por lo menos cinco pasajes), como se muestra en la Figura 3A. nota t que fibrocytic morfología de las células cultivadas, típicos de las células mesenquimales. Además, se utilizó este sistema para analizar la expresión de genes de células clasificadas. Con este fin, se extrajo el ARN de las células mesenquimales según sintetizar cDNA, y los niveles de expresión de genes fueron analizados por qPCR. Este análisis reveló que las células clasificadas expresan el marcador pan-mesenquimal vimentina (Figura 3B). Por último, la expresión de marcadores de superficie por las células pancreáticas se puede analizar por citometría de flujo. Por ejemplo, se aislaron células del tejido pancreático de Nkx3.2 -Cre; R26R YFP ratones adultos utilizando el método descrito aquí y manchado con la superficie de la célula glicoproteína CD9, que fue reportado a ser expresado por los fibroblastos 22. Como se muestra en la Figura 3C, todas las células del Nkx3.2 -Cre fluorescentemente marcado; Páncreas R26R YFP expresan CD9.
tp_upload / 55344 / 55344fig1.jpg "/>
Figura 1: tejido pancreático embrionario y neonatal. Aislado tracto gastrointestinal entero, incluyendo el estómago, el bazo, el intestino y el páncreas, de un embrión E15.5 (A) y un cachorro p4 (B). El tejido pancreático está demarcado con una línea azul. Haga clic aquí para ver una versión más grande de esta figura.
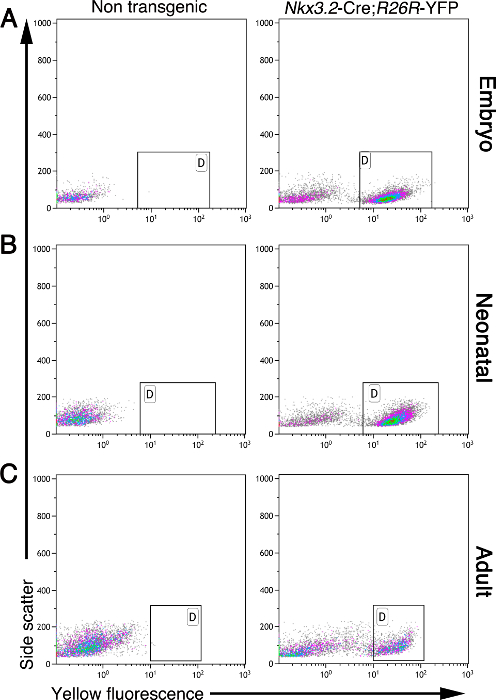
Figura 2: Las células mesenquimales están etiquetados con fluorescencia en Nkx3.2 -Cre; R26R-YFP tejido pancreático. Análisis de citometría de flujo de células pancreáticas aisladas de no transgénico (paneles de la izquierda) y Nkx3.2 -Cre; R26R YFP transgénico (paneles de la derecha) ratones en distintas etapas: embrionaria (A), neonatal (B), y adULT (C). Las células se analizaron para la dispersión lateral (eje y) y la fluorescencia amarilla (eje x). Puertas (marcado con "D") indicó la presencia de una población de células YFP + en ratones transgénicos, pero no en los controles no transgénicos. Haga clic aquí para ver una versión más grande de esta figura.
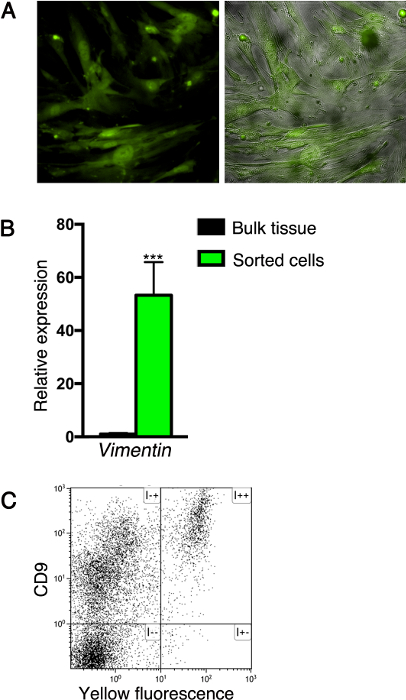
Figura 3: Análisis de células pancreáticas aisladas. Las células (A) ordenados a partir del tejido pancreático de Nkx3.2 -Cre; R26R-YFP ratones recién nacidos (como se describe en la Figura 2B) se cultivaron para establecer una línea celular. Las células cultivadas se obtuvieron imágenes de fluorescencia (verde; paneles derecho e izquierdo) y contraste de fases (gris, panel derecho). (B) Diagrama de barras que muestra Vimentin1 (VIM1)los niveles de expresión de YFP + -sorted células del tejido pancreático de Nkx3.2 -Cre; Ratones adultos R26R-YFP (como se describe en la Figura 1C; verde) en comparación con el tejido pancreático sin clasificar (negro). Se extrajo el ARN y la expresión génica se analizó mediante qPCR; la expresión se normalizó a la ciclofilina. N = 4. *** P <0,001. Los datos representan la media ± SD. (C) Análisis de citometría de flujo de células pancreáticas dispersos de Nkx3.2 -Cre; R26R-YFP ratones adultos inmuno-teñidas con aloficocianina (APC) conjugada con anticuerpo anti-CD9 y se analizó para APC (eje y) y la fluorescencia amarilla (eje x). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, se describe un método para aislar y analizar las células del microambiente de páncreas. Este método se puede utilizar para aislar células mesenquimales de tejido pancreático embrionario y adulto. Además, hemos utilizado con éxito este protocolo para aislar células endoteliales de los adultos y el páncreas neonatal 5, 17. Sin embargo, puede no ser adecuado para la obtención de una suspensión de una sola célula reproducible de las células epiteliales pancreáticas (protocolos alternativos se describen en las referencias 18, 23, y 24). Usando este método, las células marcadas con fluorescencia, ya sea que expresan proteínas fluorescentes o inmunotinción para marcadores de la superficie, se puede purificar por FACS o analizado por citometría de flujo. ARN se puede extraer de las células purificadas al perfil de su patrón de expresión génica. Alternativamente, las células purificadas pueden ser cultivadas para establecer una línea de células para el análisis proteómico posterior. Este método permitirá a la caracterización de los factores expressed por el microambiente páncreas, que gobiernan su organogénesis, la fisiología y la fisiopatología.
El mesénquima de páncreas apoya la organogénesis de tejido mediante la promoción de la proliferación de precursores y células diferenciadas 5, 9. Se muestran estas células para apoyar la expansión de las células madre embrionarias (células madre) -derivado progenitores pancreáticos 17, 25, 26. Por lo tanto, la delimitación de la identidad de los factores mesenquimales embrionarias facilitaría los esfuerzos actuales para generar células beta productoras de insulina a partir de hESCs y células madre pluripotentes inducidas (iPSCs) como una cura potencial para la diabetes. Alfombrillas de estudios genéticos permitieron la identificación de factores de crecimiento, tales como Fgf10, que son producidos por el mesénquima para promover la expansión epitelio pancreático durante las primeras etapas del desarrollo del páncreas3, 9. Con el objetivo de identificar factores adicionales expresados en el mesénquima embrionario, aislamos estas células utilizando microdisección por láser capturado, se extrae su ARN, y realizó el análisis de la expresión génica 26. Sin embargo, además de ser de mano de obra intensa, este método se basa en la identificación de células en base a sus características morfológicas, lo que limita su uso a las etapas de desarrollo antes de la ramificación del epitelio en el mesénquima que rodea (es decir, E12.5). Para caracterizar las células mesenquimales en las etapas posteriores del desarrollo, hemos empleado el método descrito aquí 5, 17.
Se utilizó este método para analizar la expresión de marcadores de superficie por mesénquima pancreática neonatal 5. Además, se aislaron células mesenquimales de tejido pancreático embrionario y neonatal de Nkx3.2 -Cre; ratones R26-EYFP, basado ensu etiquetado fluorescente en esta línea de ratones, y se cultivaron para establecer líneas celulares 17. El análisis proteómico de estas células se permiten para la identificación de los factores segregados por el mesénquima de páncreas con la capacidad de promover progenitores pancreáticos de células madre derivadas de 17. Además, utiliza este método de aislamiento de células para purificar células mesenquimáticas de los tejidos pancreáticos adultos para la extracción de ARN y la expresión génica análisis 17. Por lo tanto, este método puede ser utilizado para identificar los genes y las proteínas expresadas por el mesénquima de páncreas, con la capacidad de soportar el desarrollo de células de páncreas.
células mesenquimales pancreáticos se muestran más para jugar un papel en la tumorigénesis páncreas. PDAC se caracteriza por la formación de un estroma desmoplásico de fibroblastos rica compuesta de fibroblastos, células del sistema inmune, y ECM 27. Mientras que el estroma se considera que promueve el desarrollo de muchostipos de cáncer, se ha demostrado para frenar la progresión de la PDAC 15, 16, 28. Esto sugiere que los componentes del estroma de páncreas secretan factores que inhiben la tumorigénesis. Además, los cambios en la composición celular del estroma, así como en el fenotipo celular pueden ser la base de su efecto en las células epiteliales de 15, 16, 28. El método descrito aquí, por tanto, puede ayudar en la caracterización de los diferentes tipos de células que componen un estroma PDAC en comparación con tejido pancreático sano. Permitiría además la purificación de los diferentes tipos de células del estroma para caracterizar los cambios potenciales en sus perfiles de expresión génica durante la progresión del PDAC. Sin embargo, debido a los cambios en la composición de ECM de páncreas durante la tumorigénesis 27, los ajustes de los parámetros de digestión de tejido, tales como la inclusión de Additional tipos de colagenasa o aumentar el tiempo de incubación, puede ser requerida.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors thank Adi Sasson for the technical assistance and Helen Guez for the critical reading of the manuscript. This work was supported by European Research Council starting grant no. 336204.
Materiales
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213865001 | |
| DNase | Sigma-Aldrich | D5025-15KU | The effective units should be at least 2000 unitz/ml protein |
| Hanks’ Balanced Salt solution (HBSS) | Sigma-Aldrich | H6648 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-127-1A | |
| EDTA | Biological Industries | 01-862-1A | |
| Sodium Azide | Sigma-Aldrich | S2002 | |
| Goat IgG serum | Sigma-Aldrich | G9023 | |
| DAPI | Sigma-Aldrich | D9542 | |
| RNAse inhibitor | Invitrogen | N8080119 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Invitrogen | 11965092 | |
| L-Glutamine | Biological Industries | 03-020-1B | |
| Penicillin-streptomycin | Biological Industries | 03-031-1B | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | Without Calcium Chloride and Magnesium Chloride |
| 1.5 ml tubes | Sarstedt | 72 690 | |
| 15 ml conical tube | Corning | 430052 | |
| Round Bottom Polystyrene 5 ml tube | Corning | 352008 | FACS tube'. Make sure tube is compatible with the flow cytomter to be used, as there are slight differences in required tubes between brands |
| 5ml tube with 35 μm cell strainer Snap Cap | Corning | 352235 | FACS tube' |
| 70 μm cell strainer | Miltenyi Biotec | 130-098-462 | |
| Heating block with agitation | Eppendorf | ThermoMixer C | |
| Centrifuge | ThermoFisher | Heraeus Megafuge 40R | |
| Steromicroscope | Nikon | SMZ 745 | |
| Cell sorter | BD Biosciences | FACSAria IIu | |
| flow cytometer | Beckman Coulter | Gallios |
Referencias
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Cabrera, O., Berman, D. M., Kenyon, N. S., Ricordi, C., Berggren, P. -. O., Caicedo, A. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Gittes, G. K. Developmental biology of the pancreas: a comprehensive review. Developmental biology. 326 (1), 4-35 (2009).
- Villasenor, A., Cleaver, O. Crosstalk between the developing pancreas and its blood vessels: An evolving dialog. Seminars in cell & developmental biology. , 1-8 (2012).
- Landsman, L., Nijagal, A., et al. Pancreatic mesenchyme regulates epithelial organogenesis throughout development. PLoS Biology. 9 (9), e1001143 (2011).
- Lammert, E., Cleaver, O., Melton, D. Induction of pancreatic differentiation by signals from blood vessels. Science. 294 (5542), 564-567 (2001).
- Pierreux, C. E., Cordi, S., et al. Epithelial: Endothelial cross-talk regulates exocrine differentiation in developing pancreas. Developmental biology. 347 (1), 216-227 (2010).
- Golosow, N., Grobstein, C. Epitheliomesenchymal interaction in pancreatic morphogenesis. Developmental biology. 4, 242-255 (1962).
- Bhushan, A., Itoh, N., et al. Fgf10 is essential for maintaining the proliferative capacity of epithelial progenitor cells during early pancreatic organogenesis. Development. 128 (24), 5109-5117 (2001).
- Larsen, B. M., Hrycaj, S. M., Newman, M., Li, Y., Wellik, D. M. Mesenchymal Hox6 function is required for mouse pancreatic endocrine cell differentiation. Development. 142 (22), 3859-3868 (2015).
- Sasson, A., Rachi, E., et al. Islet pericytes are required for beta-cell maturity. Diabetes. 65 (10), 3008-3014 (2016).
- Stanley, S. A., Kelly, L., et al. Bidirectional electromagnetic control of the hypothalamus regulates feeding and metabolism. Nature. 531 (7596), 647-650 (2016).
- Brissova, M., Aamodt, K., et al. Islet microenvironment, modulated by vascular endothelial growth factor-A signaling, promotes β cell regeneration. Cell metabolism. 19 (3), 498-511 (2014).
- Nikolova, G., Jabs, N., et al. The vascular basement membrane: a niche for insulin gene expression and Beta cell proliferation. Developmental cell. 10 (3), 397-405 (2006).
- Rhim, A. D., Oberstein, P. E., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer cell. 25 (6), 735-747 (2014).
- Özdemir, B. C., Pentcheva-Hoang, T., et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer cell. 25 (6), 719-734 (2014).
- Russ, H. A., Landsman, L., et al. Dynamic Proteomic Analysis of Pancreatic Mesenchyme Reveals Novel Factors That Enhance Human Embryonic Stem Cell to Pancreatic Cell Differentiation. Stem cells international. 2016, 6183562 (2016).
- Gout, J., Pommier, R. M., et al. Isolation and Culture of Mouse Primary Pancreatic Acinar Cells. Journal of Visualized Experiments. (78), e50514 (2013).
- Verzi, M. P., Stanfel, M. N., et al. Role of the homeodomain transcription factor Bapx1 in mouse distal stomach development. Gastroenterology. 136 (5), 1701-1710 (2009).
- Tribioli, C., Frasch, M., Lufkin, T. Bapx1: an evolutionary conserved homologue of the Drosophila bagpipe homeobox gene is expressed in splanchnic mesoderm and the embryonic skeleton. Mech Dev. 65 (1-2), 145-162 (1997).
- Hecksher-Sorensen, J., Watson, R., et al. The splanchnic mesodermal plate directs spleen and pancreatic laterality, and is regulated by Bapx1/Nkx3.2. Development. 131 (19), 4665-4675 (2004).
- Walmsley, G. G., Rinkevich, Y., Hu, M. S. Live Fibroblast Harvest Reveals Surface Marker Shift In Vitro. Tissue Engineering Part C: Methods. , (2014).
- Morris, J. P., Greer, R., et al. Dicer regulates differentiation and viability during mouse pancreatic cancer initiation. PloS one. 9 (5), 95486 (2014).
- Miyatsuka, T., Matsuoka, T. -. A., et al. Chronological analysis with fluorescent timer reveals unique features of newly generated β-cells. Diabetes. 63 (10), 3388-3393 (2014).
- Sneddon, J. B., Borowiak, M., Melton, D. A. Self-renewal of embryonic-stem-cell-derived progenitors by organ-matched mesenchyme. Nature. 491 (7426), 765-768 (2012).
- Guo, T., Landsman, L., Li, N., Hebrok, M. Factors expressed by murine embryonic pancreatic mesenchyme enhance generation of insulin-producing cells from hESCs. Diabetes. 62 (5), 1581-1592 (2013).
- Olive, K. P., Jacobetz, M. A., et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science. 324 (5933), 1457-1461 (2009).
- Raz, Y., Erez, N. An inflammatory vicious cycle: Fibroblasts and immune cell recruitment in cancer. Experimental cell research. 319 (11), 1596-1603 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados