Method Article
フローサイトメトリーによる膵臓間葉の細胞を単離と解析
要約
ここでは、間葉系細胞の単離に着目し、胚、新生児および成体マウス組織からの膵臓微小環境内の細胞を単離するための方法を記載します。この方法は、膵臓の発達、機能、及び腫瘍形成を調節する外因性シグナルを解明するために、細胞遺伝子発現およびタンパク質分泌のプロファイリングを可能にします。
要約
The pancreas is comprised of epithelial cells that are required for food digestion and blood glucose regulation. Cells of the pancreas microenvironment, including endothelial, neuronal, and mesenchymal cells were shown to regulate cell differentiation and proliferation in the embryonic pancreas. In the adult, the function and mass of insulin-producing cells were shown to depend on cells in their microenvironment, including pericyte, immune, endothelial, and neuronal cells. Lastly, changes in the pancreas microenvironment were shown to regulate pancreas tumorigenesis. However, the cues underlying these processes are not fully defined. Therefore, characterizing the different cell types that comprise the pancreas microenvironment and profiling their gene expression are crucial to delineate the tissue development and function under normal and diseased states. Here, we describe a method that allows for the isolation of mesenchymal cells from the pancreas of embryonic, neonatal, and adult mice. This method utilizes the enzymatic digestion of mouse pancreatic tissue and the subsequent fluorescence-activated cell sorting (FACS) or flow-cytometric analysis of labeled cells. Cells can be labeled by either immunostaining for surface markers or by the expression of fluorescent proteins. Cell isolation can facilitate the characterization of genes and proteins expressed in cells of the pancreas mesenchyme. This protocol was successful in isolating and culturing highly enriched mesenchymal cell populations from the embryonic, neonatal, and adult mouse pancreas.
概要
哺乳類におけるエネルギー恒常性と食品の消化は適切な膵臓機能に依存しています。外分泌と内分泌:成人の膵臓は、2つの主要な細胞内コンパートメントで構成されています。生成及び分泌する消化酵素および消化管にこれらの酵素を輸送管細胞を、合計膵臓の質量1の80%以上を含む腺房細胞を含む外分泌細胞、。インスリン産生β細胞及びグルカゴン産生α細胞、内分泌細胞、外分泌組織中に埋め込まれ、血糖値2を調節するホルモンを分泌しているランゲルハンス島に編成されます。
膵臓細胞は、高度に調節され、多段階プロセス3を介してそれらの分化の運命を獲得します。証拠は、ニューロン、内皮細胞、および間葉細胞によって提供される外因性の手がかりは、トンで膵臓細胞の分化と増殖を導くことを示唆しています彼胚3、4、5。一例としては、早期膵臓前駆体6の仕様のための大動脈の要件です。後で開発において、内皮細胞は、両方の膵臓の内分泌および外分泌細胞の発達において中心的な役割を果たすことが示され、β細胞分化4、6、7を促進します。間葉細胞は、主として成長因子FGF10 8,9の分泌を介して、共通の膵臓前駆細胞の生存および増殖を支持することが示されました。我々はさらに、これらの細胞は、胚性膵臓5における内分泌と外分泌前駆細胞の増殖、ならびにの(腺房とベータ細胞を含む)に分化した細胞をサポートすることを示しました。最近では、間葉系細胞はさらにでした内分泌細胞の分化10を調節することが示さ。
成人では、β細胞機能及び質量は、ニューロン、免疫、および内皮細胞、ならびに周皮11、12、13を含むそれらの微小環境中の細胞に依存することが示されました。傷害時に、内皮細胞は、β細胞の複製13を促進するために膵臓に免疫細胞を動員することが示されました。内皮細胞は、さらに、インスリン発現およびβ細胞機能14を支持するために、細胞外マトリックス(ECM)の成分を生成することが示されました。我々は最近、β細胞機能11のための膵島周皮細胞の必要性を実証しました。最後に、膵臓間質細胞は、膵管腺癌(PDAC)15、16の進行を調節することが示されました。しかし、ID膵臓の発達、機能、および腫瘍形成を導く外因性の手がかりの実体は不明な点が多いです。
膵臓の微小環境の細胞により提供されるキューを識別することは、これらの細胞によって発現された遺伝子やタンパク質を特徴づける必要があります。これは、および/または細胞株を確立する上で、遺伝子発現およびプロテオミクス分析を実行するために、膵臓から、これらの細胞を単離することに依存します。ここでは、蛍光タンパク質を発現する免疫蛍光標識された細胞または細胞のいずれかの組織の酵素消化および蛍光活性化セルソーティング(FACS)を利用して、膵臓の微小環境の間葉系細胞を単離する方法を提案します。このプロトコルは正常に、胚、新生児、および成人膵臓5、17の間葉系細胞を単離し、黄色蛍光タンパク質(YFP)発現を分析するために行きました。
プロトコル
実験は、テルアビブ大学の動物実験委員会によって承認されたプロトコルに従って行いました。
マウスからの膵臓組織の1の単離
- 成体マウスの場合:
- 私はハンクス平衡塩溶液(HBSS)中に溶解し0.4ミリグラム/ mLのコラゲナーゼPおよび0.1 ngの/ mLのDNアーゼ:消化緩衝液を準備します。たて15-mLコニカルチューブにマウス当たり緩衝液5mlを準備し、使用するまで氷上で保管してください。
- 制度ガイドラインに従ってマウスを安楽死させます。
- (命令のために、文献18を参照してください)膵臓を除去するために、各マウスを解剖。 HBSSを含む培養皿に入れてください。 4個の - 実体顕微鏡下でこの段階を実行するために、及び、消化効率を高める2に組織を切断することが可能です。
- (ステップ1.1.1で調製した)消化緩衝液を含むチューブに膵臓組織を置きます。すべてのマウスを解剖し、膵臓組織されるまで氷上にチューブを保ちます集めました。
- 残りのマウスと1.1.4 - を繰り返して、1.1.2を繰り返します。
- 胚および新生児マウスの場合:
- 0.4ミリグラム/ mLのコラゲナーゼPおよび0.1 ngの/私はHBSSに溶解mLのDNアーゼ:消化緩衝液を準備します。 15-mLコニカルチューブにマウスあたり2mLの緩衝液 - 生後7日(P7)または若い時胚および仔のために、新たに1.5を準備します。 15-mLコニカルチューブにマウス当たり緩衝液4mL - P7または古い子犬の場合は、3を準備します。使用するまで氷上で保管してください。
- 制度ガイドラインに従ってマウスを安楽死させます。胚のために、母親の子宮からすべての胚を除去し、PBSを含む10 mmの培養皿に配置します。一度に一つの胚を解剖。
- その頭が研究者から離れて指していると、その背中の上でマウスを置きます。細かい鉗子を使用して、マウスの絞り18までの腹腔を露出するように正中線で腹部の皮膚、オープンを引き上げます。
- 微細な鉗子を使用して、肝臓のFRを外しバック腹壁をオム。マウス尾に向かって連続運動では、(肝臓、胃、脾臓、腸、腎臓、および膵臓を含む)内臓をかき出すとHBSSを含む培養皿に配置します。
- 実体顕微鏡下では、膵臓( 図1)を露出するために肝臓と腎臓を削除します。細かい鉗子を使用して、脾臓から、最終的には胃、十二指腸から膵臓を切り離し、と。
- (ステップ1.2.1で調製した)消化緩衝液を含むチューブに膵臓組織を置きます。 P14以前仔については、消化効率を高めるために2片に組織を切断します。すべてのマウスを解剖し、膵臓の組織が収集されるまで氷上でチューブを保管してください。
- 残りのマウスと1.2.6 - を繰り返して、1.2.2を繰り返します。
2.膵臓消化
- agitatで37℃で30分間加熱ブロック中の(消化緩衝液中)膵臓組織を含むチューブをインキュベート700 rpmでイオン。 15分後、手動でそれらを3反転させることによってチューブを振る - 4回、バック加熱ブロック内に配置します。
注: - 10分攪拌機能なしの加熱ブロックを使用している場合は、チューブごと5を反転。組織が適切に消化されていることを確認します。ない場合は、インキュベーションの前に小さな断片に組織を切断や撹拌を増加させます。 - 、組織消化を停止し、氷上でチューブを配置し、各チューブに冷HBSS 10mLのを追加します。遠心管4℃で5分間、300×gで、上清を吸引除去します。
- 再懸濁:
- 成体マウスおよびP14または古い子犬のために、PBS 6mLのでペレットを再懸濁し、新しい15 mLコニカルコレクションのポリプロピレンチューブの上に置い70μmのセルストレーナーを介して株。最大の細胞の回復を確実にするために、PBSの追加の6 mLでオリジナルのチューブを洗浄し、コレクションチューブにセルストレーナーを介して株。
- 胚および仔のための若いトン漢P14は、PBS 2mLでペレットを再懸濁し、5-mLの丸底ポリスチレンコレクションチューブ(FACSチューブ)の上に置か35μmのセルストレイナーを介して株。最大の細胞の回復を確実にするために、PBSの追加の2 mLでオリジナルのチューブを洗浄し、コレクションチューブにセルストレーナーを介して株。
- 遠心管4℃で5分間、300×gで、上清を吸引除去します。細胞がゆるくポリスチレンチューブに接続されているように、慎重に液体を削除します。
3.準備標識単細胞
- 緩衝液調製物は:FACSによる細胞の単離のために、PBS(塩化カルシウムおよび塩化マグネシウムなし)、5%ウシ胎児血清(FBS)、および5mM EDTAを混合することによってバッファを仕分け準備します。フローサイトメトリー分析のために、0.05%アジ化ナトリウムを用いてバッファを選別補充による分析バッファを準備します。両方のバッファは、最大2ヶ月間4~8℃で保存することができます。
- ソートやANAで細胞を再懸濁溶解バッファー。再懸濁を1.5mLの古いP8と1ヶ月の間仔から、および3mLの中で1カ月以上経過したマウスから、1ミリリットル中のp7より若い胚および仔から分離された各膵臓を。丸底ポリスチレンチューブ(FACSチューブ)の上に置か35ミクロンの細胞ストレーナーを通して細胞株。
- コントロールを染色するために、前の手順(全試料体積の5%以上)で行われたサンプルから100-μLアリコートを50-取り出し、新しいFACSチューブに入れます。 DAPI蛍光タンパク質を含む使用された各蛍光団、のためだけでなく、未染色のコントロールのためのチューブを含みます。
注:蛍光タンパク質を発現する細胞を有するトランスジェニックマウスを使用する場合は、細胞数が限られている場合、または、染色対照としての非トランスジェニック組織を含みます。蛍光タンパク質を発現する細胞は、さらに、染色することなく使用されている場合は、3.8に進みます。 - 4℃で5分間、300×gで細胞をスピンダウンし、上清を吸引します。
- 圏のための王は、(ヤギIgGの1μLを補っソート100μLまたは解析用バッファ)をブロッキング溶液で細胞を再懸濁し、氷上で30分間インキュベートします。
- 細胞表面マーカーを染色するために、サンプルあたり100μLの容量で全ての所望のフルオロフォア標識抗体を含む混合物を準備します。選別または分析緩衝液中の2倍の抗体希釈液を調製する( すなわち、二重の必要な濃度を得るために抗体を希釈し、1の最終希釈場合:100:200が所望される、抗体1希釈)。ブロッキング溶液を洗浄することなく、200μLの最終染色量を達成するために、サンプル細胞に混合物の100μLを追加します。氷上で30〜60分間、暗所でインキュベートします。
- 解析や並べ替えのパラメータを(ステップ4.3と5.2を参照)を設定するには、一つだけ(染色対照)使用される抗体のが含まれている追加のチューブを準備します。 (ステップ3.6で説明したように)ソートや解析バッファに2倍抗体希釈液を調製します。 SIを含めるようにしてください使用した各蛍光団だけでなく、未染色の制御のためのngle染色対照希釈。ブロッキング溶液を洗浄することなく、200μLの最終染色量を達成するために、細胞(ステップ3.3で調製した)に対する抗体混合物の100μLを追加します。氷の上で、暗所で60分 - 30インキュベートします。
- 分析を各チューブに充填するか、4 mLと最大容量までバッファをソートすることによって洗浄します。 (ステップ3.2で説明したように)必要に応じて、35ミクロンの細胞ストレーナーを介して細胞を再株。
- 4℃で5分間、300×gで遠心分離し、上清を注意深く取り除きます。
- 再懸濁分析におけるサンプルまたは並べ替えバッファ。再懸濁1ミリリットル中に1ヶ月より若い仔から、1から500μL中の胚から単離された細胞、 - 2ミリリットルで3カ月齢、および3mLの中で3カ月以上経過したマウスからを。染色対照は緩衝液300μLに再懸濁することができます。
- 死んだ細胞を同定するために細胞を再懸濁するためにDAPIの200 ngの/ mLを加え。チューブの共同を含めるようにしてくださいサイトメーターの設定のためにDAPIずに未染色細胞をntaining。セルソーティング(ステップ4)、または分析(ステップ5)に進みます。
4.セルソーティング
- 準備:
- RNaseでRNA抽出に先立って、コート1.5-mLの捕集管を細胞選別のための阻害剤すぐにソートする前に。この目的のために、滅菌した1.5 mlのコレクションチューブに、0.01 U / mLのRNase阻害剤を含有する緩衝液を選別の1ミリリットルを加えます。 5分後、チューブをボルテックスし、液体を除去。
- セルは、従来の細胞培養物にソートするための、無菌の15-mLのコレクションチューブに(20%FBS、1%L-グルタミン、および1%ペニシリン - ストレプトマイシンを補充したダルベッコ改変イーグル培地(DMEM))無菌の培養培地を3 mLを加え。
- FACSソーターにチューブをロードする前に、渦それは簡単に細胞を再懸濁します。氷の上に残っているチューブを保管してください。
- 例えば、(選別パラメータを決定するために染色コントロールを分析することによって開始し、 電圧補償)および選別ゲート( 例えば、全細胞集団、生DAPI陰性細胞、および細胞集団)をソートします。
- ソートパラメータとゲートが設定されたら、サンプルをロードし、コレクションチューブに細胞ソーティングを開始します。
注:ソート条件は、機器に大きく依存しています。私たちは、100μmのノズル幅、23.1 PSIの圧力、および5の最大のソート速度を使用します。 - RNA抽出または選別された細胞の培養に進みます。
注:RNA抽出のために、5分間、2000×gで細胞を遠心分離し、標準的な抽出プロトコルを続行する前に、過剰な液体を除去します。細胞は、非滅菌条件下で選別された場合、細胞を培養するために、培養培地でチューブを充填し、その汚染を最小限にするために培養する前に7分間300×gでそれを遠心分離することによって二回洗っ。
フローサイトメトリーによって5細胞分析
- リットルになる前にそれは簡単に再懸濁細胞にサイトメーター、渦の中に各チューブをoading。氷の上に残っているチューブを保管してください。
- 分析パラメータ( 例えば、電圧補償)を決定するために、染色されていない単染色した試料を分析することによって開始します。
- 分析パラメータが設定されると、染色対照を含め、各サンプルをロードし、結果を記録。解析ソフトウェアフローサイトメトリーを用いて得られた結果を分析します。
結果
膵臓の間充織は、開発と成人期に必要とされます。ここで説明する方法は、胚、新生児、および成人の膵臓からの間葉系細胞の単離を可能にします。間葉系細胞、ない他の細胞型は、Nkx3.2 -Creの膵臓に黄色蛍光タンパク質(YFP)を発現します。 R26R -YFPマウス5、11、17、19。開発時には、(またBapX1として知られている)Nkx3.2は胚膵臓、胃、および腸間葉だけでなく、骨格体節19、20、21のサブセットで表されます。この遺伝子は、E9.5 5からNkx3.2 -Creの制御下での遺伝子発現を可能にする、E9.5からE11.5まで、膵臓間葉において発現されました 19、20。この標識に基づいて、細胞を、フローサイトメトリーを用いてバルク膵臓組織から精製することができます。ここで説明するように、図2は 、胚、新生児、および単離された成人の膵臓組織からの単一細胞のフローサイトメトリー分析を示します。非トランスジェニック膵臓組織は、蛍光細胞を含んでいなかったのに対し、Nkx3.2 -Cre;すべての分析年齢層からR26R -YFP膵臓組織は別個のYFP標識細胞集団(;ゲートが付いている図2)が含まれています。
ここで説明する方法に従って、蛍光タンパク質を発現する細胞を精製またはまたは追加の免疫染色することなく、フローサイトメトリーで分析のいずれかであり得ます。 図3Aに示すように、例えば、蛍光標識に基づいて並べ替えた後に、間葉系細胞は、(少なくとも5継代)細胞株を確立するために培養することができます。トンに注意してください。彼は、間葉系細胞への典型的な培養細胞の形態を、線維芽細胞のできます。また、このシステムは、選別された細胞により遺伝子発現を分析しました。この目的のために、RNAは、cDNAを合成するために選別さ間葉細胞から抽出し、遺伝子の発現レベルをqPCRにより分析しました。このような分析は、選別された細胞は、汎間葉マーカーのビメンチン( 図3B)を発現することが明らかになりました。最後に、膵臓細胞による表面マーカーの発現は、フローサイトメトリーによって分析することができます。例えば、我々はNkx3.2 -Creの膵臓組織から細胞を単離しました。ここに記載された方法を用いてR26R -YFP成体マウスおよび細胞表面が線維芽細胞22で表現することが報告されたCD9を、糖タンパク質とそれらを染色しました。 図3Cに示されるように、すべてのNkx3.2 -Creで細胞を蛍光標識しました。 R26R -YFPの膵臓はCD9を発現します。
tp_upload / 55344 / 55344fig1.jpg "/>
図1:胚および新生児の膵臓組織。 E15.5胚(A)とp4の子犬(B)の胃、脾臓、小腸、および膵臓を含む、単離された全消化管、。膵臓組織は青色の線で区画されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
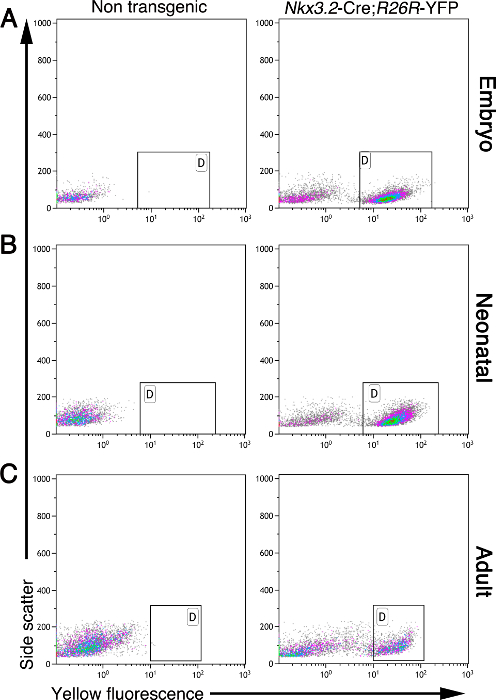
図2:間葉系細胞を蛍光Nkx3.2 -Creで標識されています。 R26R -YFP膵臓組織。フローサイトメトリーの非トランスジェニック(左パネル)から単離された膵臓細胞の分析およびNkx3.2 -Cre; R26R -YFP様々な年齢でのトランスジェニック(右パネル)マウス:胚(A)、新生児(B)、および広告ULT(C)。細胞を、側方散乱(y軸)と黄色蛍光(x軸)について分析しました。 ( "D"でマーク)ゲイツ氏は、非トランスジェニックコントロールにおけるトランスジェニックマウスにおけるYFP +細胞集団の存在ではなく、を示しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
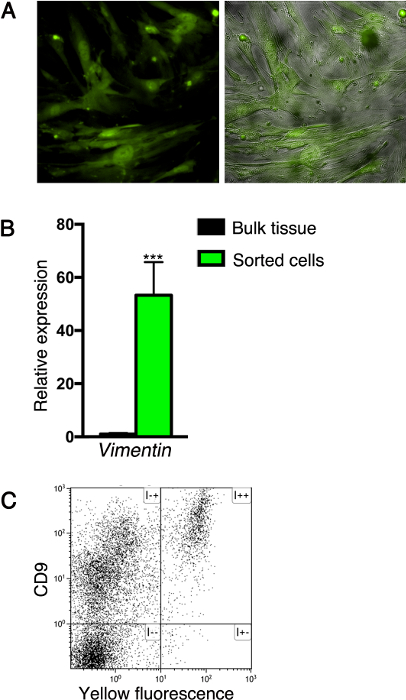
図3:孤立した膵臓細胞の解析。 Nkx3.2 -Creの膵臓組織から選別(A)細胞; R26R -YFP( 図2B参照)新生仔マウスは、細胞株を確立するために培養しました。位相コントラスト(灰色;右パネル);培養した細胞を蛍光(右と左のパネル緑)のために画像化しました。 (B)Vimentin1(VIM1)を示すバーダイアグラムNkx3.2 -Creの膵臓組織からYFP + -sorted細胞による発現レベル;ソートされていない膵臓組織(黒)と比較して、R26R -YFPの成体マウス(緑を図1Cに記載されています)。 RNAを抽出し、遺伝子発現を定量PCRによって分析しました。式は、 シクロフィリンに対して標準化しました。 N = 4 *** P <0.001。データは、平均±SDを表します。 (C)Nkx3.2 -Creから分散した膵臓細胞のフローサイトメトリー分析。 R26R -YFP成体マウスの免疫染色されたアロフィコシアニン(APC)とは、抗CD9抗体を抱合し、APC(y軸)と黄色蛍光(x軸)について分析しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここでは、膵臓の微小環境の細胞を分離し、分析する方法について説明します。この方法は、胚および成体膵臓組織からの間葉系細胞を単離することができます。加えて、我々は成功し、成人および新生児の膵臓5、17から内皮細胞を単離するために、このプロトコルを使用していました。しかし、(代替プロトコルは文献18、23、及び24に記載されている)、膵臓上皮細胞の再現可能な単一細胞懸濁液を得るために適当ではないかもしれません。この方法では、蛍光標識された細胞を用いて、いずれかの蛍光タンパク質を発現するか、表面マーカーについて免疫染色し、FACSにより精製またはフローサイトメトリーによって分析することができます。 RNAは、それらの遺伝子発現パターンをプロファイリングするために精製された細胞から抽出することができます。あるいは、精製された細胞は、その後のプロテオーム解析のための細胞株を確立するために培養することができます。このメソッドは、要素eの特性評価を可能にしますその器官、生理学、および病態生理を支配する膵臓の微小環境によってxpressed。
膵臓の間葉は、前駆体および分化した細胞5、9の増殖を促進することによって、組織の器官形成をサポートしています。これらの細胞は、ヒト胚性幹細胞(hESCの)の拡大を支援することが示された膵臓前駆細胞を17、25、26に由来。従って、胚の間葉要素の同一の輪郭を描くことは、糖尿病に対する潜在的治療法として、ヒトES細胞及び人工多能性幹細胞(iPS細胞)からのインスリン産生β細胞を生成するために、現在の努力を促進するであろう。マウスの遺伝学的研究は、膵臓の発達の初期段階の膵臓上皮の拡大を促進するために間葉により産生されるようFGF10などの成長因子、の同定を可能に3,9。胚間葉において発現さらなる因子を同定する目的で、我々は、レーザー捕捉顕微解剖を使用して、これらの細胞を単離し、それらのRNAを抽出し、遺伝子発現解析26を行います。しかし、労働集約型であることに加えて、この方法は、従来、周囲の間充織( すなわち、E12.5)への上皮の分岐に発達段階にその使用を制限し、その形態学的特徴に基づいて、細胞を同定することに依存しています。後で発達段階での間葉系細胞を特徴づけるために、我々はここ5、17記載の方法を採用しました。
私たちは、新生児の膵臓の間葉5によって表面マーカーの発現を分析するために、このメソッドを使用していました。また、間葉系細胞は、Nkx3.2 -Creの胚および新生児の膵臓組織から単離された; R26-EYFPマウス、に基づいこのマウス系統での蛍光標識、および細胞株17を確立するために培養しました。 hESC由来の膵臓前駆細胞17を促進する能力と膵臓の間葉によって分泌される因子の同定のために許可されたこれらの細胞のプロテオーム解析。我々はさらに、RNAの抽出および遺伝子発現解析17のために、成体膵臓組織からの間葉系細胞を精製するために、この細胞分離法を使用しました。したがって、この方法は、膵臓細胞の発達をサポートする能力を、膵臓の間充織によって発現された遺伝子およびタンパク質を同定するために用いることができます。
膵臓の間葉系細胞は、さらに、膵臓腫瘍形成において役割を果たすことが示されました。 PDACは、線維芽細胞からなる線維芽細胞が豊富な線維形成、間質、免疫細胞、及びECM 27の形成によって特徴付けられます。間質は、多くの発展を促進すると考えられていたが癌の種類は、それがPDACの進行15、16、28を抑制することが示されました。これは、膵臓間質の成分が腫瘍形成を阻害する因子を分泌することを示唆しています。また、間質細胞の組成物中、並びに細胞表現型の変化は、上皮細胞15、16、28日にそれらの効果を基礎とすることができます。ここで説明する方法は、したがって、健康な膵臓組織と比較して、PDAC間質を構成するさまざまな細胞型を特徴付けるのを助けることができます。さらに、異なる間質細胞型の精製は、PDACの進行の間に、それらの遺伝子発現プロフィールの潜在的な変化を特徴づけることを可能にします。しかしながら、そのようなADDITを含めるように腫瘍形成27中の膵臓ECM組成の変化、組織消化パラメータの調整に起因ionalコラゲナーゼタイプまたはインキュベーション時間を増加させる、必要とされ得ます。
開示事項
The authors have nothing to disclose.
謝辞
The authors thank Adi Sasson for the technical assistance and Helen Guez for the critical reading of the manuscript. This work was supported by European Research Council starting grant no. 336204.
資料
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213865001 | |
| DNase | Sigma-Aldrich | D5025-15KU | The effective units should be at least 2000 unitz/ml protein |
| Hanks’ Balanced Salt solution (HBSS) | Sigma-Aldrich | H6648 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-127-1A | |
| EDTA | Biological Industries | 01-862-1A | |
| Sodium Azide | Sigma-Aldrich | S2002 | |
| Goat IgG serum | Sigma-Aldrich | G9023 | |
| DAPI | Sigma-Aldrich | D9542 | |
| RNAse inhibitor | Invitrogen | N8080119 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Invitrogen | 11965092 | |
| L-Glutamine | Biological Industries | 03-020-1B | |
| Penicillin-streptomycin | Biological Industries | 03-031-1B | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | Without Calcium Chloride and Magnesium Chloride |
| 1.5 ml tubes | Sarstedt | 72 690 | |
| 15 ml conical tube | Corning | 430052 | |
| Round Bottom Polystyrene 5 ml tube | Corning | 352008 | FACS tube'. Make sure tube is compatible with the flow cytomter to be used, as there are slight differences in required tubes between brands |
| 5ml tube with 35 μm cell strainer Snap Cap | Corning | 352235 | FACS tube' |
| 70 μm cell strainer | Miltenyi Biotec | 130-098-462 | |
| Heating block with agitation | Eppendorf | ThermoMixer C | |
| Centrifuge | ThermoFisher | Heraeus Megafuge 40R | |
| Steromicroscope | Nikon | SMZ 745 | |
| Cell sorter | BD Biosciences | FACSAria IIu | |
| flow cytometer | Beckman Coulter | Gallios |
参考文献
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Cabrera, O., Berman, D. M., Kenyon, N. S., Ricordi, C., Berggren, P. -. O., Caicedo, A. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Gittes, G. K. Developmental biology of the pancreas: a comprehensive review. Developmental biology. 326 (1), 4-35 (2009).
- Villasenor, A., Cleaver, O. Crosstalk between the developing pancreas and its blood vessels: An evolving dialog. Seminars in cell & developmental biology. , 1-8 (2012).
- Landsman, L., Nijagal, A., et al. Pancreatic mesenchyme regulates epithelial organogenesis throughout development. PLoS Biology. 9 (9), e1001143 (2011).
- Lammert, E., Cleaver, O., Melton, D. Induction of pancreatic differentiation by signals from blood vessels. Science. 294 (5542), 564-567 (2001).
- Pierreux, C. E., Cordi, S., et al. Epithelial: Endothelial cross-talk regulates exocrine differentiation in developing pancreas. Developmental biology. 347 (1), 216-227 (2010).
- Golosow, N., Grobstein, C. Epitheliomesenchymal interaction in pancreatic morphogenesis. Developmental biology. 4, 242-255 (1962).
- Bhushan, A., Itoh, N., et al. Fgf10 is essential for maintaining the proliferative capacity of epithelial progenitor cells during early pancreatic organogenesis. Development. 128 (24), 5109-5117 (2001).
- Larsen, B. M., Hrycaj, S. M., Newman, M., Li, Y., Wellik, D. M. Mesenchymal Hox6 function is required for mouse pancreatic endocrine cell differentiation. Development. 142 (22), 3859-3868 (2015).
- Sasson, A., Rachi, E., et al. Islet pericytes are required for beta-cell maturity. Diabetes. 65 (10), 3008-3014 (2016).
- Stanley, S. A., Kelly, L., et al. Bidirectional electromagnetic control of the hypothalamus regulates feeding and metabolism. Nature. 531 (7596), 647-650 (2016).
- Brissova, M., Aamodt, K., et al. Islet microenvironment, modulated by vascular endothelial growth factor-A signaling, promotes β cell regeneration. Cell metabolism. 19 (3), 498-511 (2014).
- Nikolova, G., Jabs, N., et al. The vascular basement membrane: a niche for insulin gene expression and Beta cell proliferation. Developmental cell. 10 (3), 397-405 (2006).
- Rhim, A. D., Oberstein, P. E., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer cell. 25 (6), 735-747 (2014).
- Özdemir, B. C., Pentcheva-Hoang, T., et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer cell. 25 (6), 719-734 (2014).
- Russ, H. A., Landsman, L., et al. Dynamic Proteomic Analysis of Pancreatic Mesenchyme Reveals Novel Factors That Enhance Human Embryonic Stem Cell to Pancreatic Cell Differentiation. Stem cells international. 2016, 6183562 (2016).
- Gout, J., Pommier, R. M., et al. Isolation and Culture of Mouse Primary Pancreatic Acinar Cells. Journal of Visualized Experiments. (78), e50514 (2013).
- Verzi, M. P., Stanfel, M. N., et al. Role of the homeodomain transcription factor Bapx1 in mouse distal stomach development. Gastroenterology. 136 (5), 1701-1710 (2009).
- Tribioli, C., Frasch, M., Lufkin, T. Bapx1: an evolutionary conserved homologue of the Drosophila bagpipe homeobox gene is expressed in splanchnic mesoderm and the embryonic skeleton. Mech Dev. 65 (1-2), 145-162 (1997).
- Hecksher-Sorensen, J., Watson, R., et al. The splanchnic mesodermal plate directs spleen and pancreatic laterality, and is regulated by Bapx1/Nkx3.2. Development. 131 (19), 4665-4675 (2004).
- Walmsley, G. G., Rinkevich, Y., Hu, M. S. Live Fibroblast Harvest Reveals Surface Marker Shift In Vitro. Tissue Engineering Part C: Methods. , (2014).
- Morris, J. P., Greer, R., et al. Dicer regulates differentiation and viability during mouse pancreatic cancer initiation. PloS one. 9 (5), 95486 (2014).
- Miyatsuka, T., Matsuoka, T. -. A., et al. Chronological analysis with fluorescent timer reveals unique features of newly generated β-cells. Diabetes. 63 (10), 3388-3393 (2014).
- Sneddon, J. B., Borowiak, M., Melton, D. A. Self-renewal of embryonic-stem-cell-derived progenitors by organ-matched mesenchyme. Nature. 491 (7426), 765-768 (2012).
- Guo, T., Landsman, L., Li, N., Hebrok, M. Factors expressed by murine embryonic pancreatic mesenchyme enhance generation of insulin-producing cells from hESCs. Diabetes. 62 (5), 1581-1592 (2013).
- Olive, K. P., Jacobetz, M. A., et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science. 324 (5933), 1457-1461 (2009).
- Raz, Y., Erez, N. An inflammatory vicious cycle: Fibroblasts and immune cell recruitment in cancer. Experimental cell research. 319 (11), 1596-1603 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved