Method Article
Разделительный и анализ клеток поджелудочной железы мезенхимы с помощью проточной цитометрии
В этой статье
Резюме
Здесь мы опишем метод для выделения клеток в поджелудочной железе микросреды из эмбриональной, неонатальной и взрослой ткани мыши, сосредоточив внимание на выделения мезенхимальных клеток. Этот метод позволяет профилирование экспрессии генов клеток и секреции белка с целью выяснения примесного сигналы, которые регулируют развитие поджелудочной железы, функции и онкогенеза.
Аннотация
The pancreas is comprised of epithelial cells that are required for food digestion and blood glucose regulation. Cells of the pancreas microenvironment, including endothelial, neuronal, and mesenchymal cells were shown to regulate cell differentiation and proliferation in the embryonic pancreas. In the adult, the function and mass of insulin-producing cells were shown to depend on cells in their microenvironment, including pericyte, immune, endothelial, and neuronal cells. Lastly, changes in the pancreas microenvironment were shown to regulate pancreas tumorigenesis. However, the cues underlying these processes are not fully defined. Therefore, characterizing the different cell types that comprise the pancreas microenvironment and profiling their gene expression are crucial to delineate the tissue development and function under normal and diseased states. Here, we describe a method that allows for the isolation of mesenchymal cells from the pancreas of embryonic, neonatal, and adult mice. This method utilizes the enzymatic digestion of mouse pancreatic tissue and the subsequent fluorescence-activated cell sorting (FACS) or flow-cytometric analysis of labeled cells. Cells can be labeled by either immunostaining for surface markers or by the expression of fluorescent proteins. Cell isolation can facilitate the characterization of genes and proteins expressed in cells of the pancreas mesenchyme. This protocol was successful in isolating and culturing highly enriched mesenchymal cell populations from the embryonic, neonatal, and adult mouse pancreas.
Введение
Энергетический гомеостаз и переваривание пищи у млекопитающих зависит от правильной функции поджелудочной железы. Взрослый поджелудочной железы состоит из двух основных сотовых отсеков: экзокринной и эндокринных. Экзокринных клетки, в том числе ацинарных клеток , которые продуцируют и секретируют пищеварительные ферменты и воздуховоде клетки , которые транспортируют эти ферменты в кишечнике, охватывают более 80% от общей массы поджелудочной железы 1. Эндокринные клетки, которые включают в себя инсулин-продуцирующие бета - клетки и глюкагон-продуцирующих альфа - клетки, организованы в островках Лангерганса, которые встроены в экзокринной ткани и секретируют гормоны , чтобы регулировать уровень глюкозы в крови 2.
Панкреатические клетки приобретают свою дифференцированную судьбу через высоко отрегулированной, многоступенчатого процесса 3. Имеющиеся данные свидетельствуют о том, что внешние раздражители, нейронные, эндотелиальные и мезенхимальные клетки поджелудочной железы руководства дифференцировки и пролиферации клеток в тон эмбрион 3, 4, 5. Одним из примеров является требование аорты для спецификации ранних предшественников панкреатических 6. Позднее в развитии, эндотелиальные клетки были показаны , чтобы играть центральную роль в развитии обоих панкреатических эндокринных и экзокринных клеток и способствовать дифференциации клеток бета-4, 6, 7. Мезенхимных клеток было показано , что поддерживает выживание и расширение общих панкреатических клеток - предшественников, главным образом , за счет секреции фактора роста Fgf10 8, 9. Далее мы показали , что эти клетки поддерживают пролиферацию эндокринных и экзокринных предшественников, а также дифференцированных клеток ( в том числе ацинарных и бета - клетки) в эмбриональном поджелудочной железы 5. В последнее время, мезенхимальные клетки были далеепоказано, регулирует эндокринные клетки дифференцировки 10.
У взрослых, функции бета-клеток и массы было показано , что в зависимости от клеток в их микросреды, в том числе нейронные, иммунной и эндотелиальных клеток, а также перицитах 11, 12, 13. Во время травмы, эндотелиальные клетки были показаны рекрутировать иммунные клетки поджелудочной железы , чтобы способствовать репликации бета-клеток 13. Эндотелиальные клетки были дополнительно показано производить внеклеточного матрикса (ЕСМ) компоненты для поддержки экспрессии инсулина и бета-клеточную функцию 14. Недавно мы показали требование островковых перицитами для функции бета-клеток 11. И наконец, клетки поджелудочной железы стромы было показано , что регулируют прогрессирование рака поджелудочной протоковой аденокарциномы (PDAC) 15, 16. Тем не менее, идентификаторсубъект внешних сигналов, которые направляют развитие поджелудочной железы, функции и туморогенез в значительной степени неизвестны.
Определение раздражители, возникающие в клетках поджелудочной железы микросреды требует характеризующее генов и белков, выраженных этими клетками. Это зависит от того, изолируя эти клетки из поджелудочной железы для осуществления экспрессии генов и протеомические анализы и / или на создание клеточных линий. Здесь мы предлагаем метод для выделения мезенхимальных клеток поджелудочной железы микроокружения путем использования ткани ферментативного расщепления и флуоресценции активированного сортировки клеток (FACS) либо immunofluorescently-меченых клеток или клеток, экспрессирующих флуоресцентные белки. Этот протокол был успешно выполнен , чтобы изолировать и проанализировать желтый флуоресцентный белок (YFP) -expressing мезенхимальные клетки эмбриональной, неонатальной и взрослой поджелудочной железы 5, 17.
протокол
Эксперименты проводились в соответствии с протоколами, утвержденными Комитетом по исследованиям животных в Тель-Авивском университете по.
1. Выделение панкреатической ткани мышей
- Для взрослых мышей:
- Готовят переваривании буфер: 0,4 мг / мл коллагеназы P и 0,1 нг / мл ДНКазы I, растворенное в Хэнкса сбалансированный солевой раствор (HBSS). Свеже готовят 5 мл буфера на мышь в 15 мл конические пробирки и держать их на льду до использования.
- Усыпить мышей в соответствии с институциональной руководства.
- Проанализируйте каждую мышь, чтобы удалить поджелудочную железу (для инструкции, пожалуйста, см Reference 18); поместите его в чашку с культурой, содержащей HBSS. Можно выполнить эту стадию при помощи стереомикроскопа, и для повышения эффективности пищеварения, разрезал ткань в 2-х - 4-х штук.
- Поместите ткань поджелудочной железы в пробирку, содержащую пищеварительный буфер (полученного на стадии 1.1.1). Хранить пробирки на лед, пока у всех мышей не рассечены и панкреатические тканисобраны.
- Повторите шаги 1.1.2 - 1.1.4 с остальными мышей.
- Для эмбрионов и новорожденных мышей:
- Подготовка буфера пищеварения: 0,4 мг / мл коллагеназы P и 0,1 нг / мл ДНКазы I, растворенного в HBSS. Для получения эмбрионов и щенков в постнатальный день 7 (Р7) или моложе, свеже готовят 1,5 - 2 мл буфера на мышь в конической трубе 15 мл. Для P7 или старших щенков, подготовить 3 - 4 мл буфера на мышь в конической трубе 15 мл. Хранить на льду до использования.
- Усыпить мышей в соответствии с институциональной руководства. Для получения эмбрионов, удалить все эмбрионы из матки матери и поместить их в чашку для культивирования 10 мм, содержащую PBS. Проанализируйте один эмбрион за один раз.
- Положите мышь на спине, с его головой, указывая в сторону от следователя. Использование тонких щипцов, подтянуть кожу с брюшка и откройте на средней линии , чтобы обнажить брюшную полость до диафрагмы 18 мыши.
- Использование тонких щипцов, отсоединение фр печениом задней брюшной стенки. При непрерывном движении по направлению к хвосту мыши, выкопайте внутренние органы (в том числе печени, желудка, селезенки, кишечника, почек и поджелудочной железы) и поместить их в чашку с культурой, содержащей HBSS.
- Под стереомикроскопа, удалить печень и почки , чтобы обнажить поджелудочной железы (рисунок 1). Использование тонких щипцов, отделить поджелудочной железы от желудка, двенадцатиперстной кишки, и, наконец, из селезенки.
- Поместите ткань поджелудочной железы в пробирку, содержащую пищеварительный буфер (полученного на стадии 1.2.1). Для p14 или старше мышат, разрезать ткань на 2 части, чтобы повысить эффективность пищеварения. Хранить пробирки на лед, пока у всех мышей не рассечены и панкреатические ткани собирали.
- Повторите шаги 1.2.2 - 1.2.6 с остальными мышей.
2. Поджелудочная Переваривание
- Инкубировать пробирки, содержащие ткани поджелудочной железы (в пищеварении буфере) в нагревательном блоке при 37 ° С в течение 30 мин с agitatионов при 700 оборотах в минуту. Через 15 мин вручную встряхнуть пробирки, переворачивая их 3 - 4 раза и поместите их обратно в нагревательном блоке.
ПРИМЕЧАНИЕ: При использовании нагревательного блока без возможности перемешивания, инвертировать трубок каждые 5 - 10 мин. Убедитесь, что ткань правильно усваивается. Если нет, то разрезать ткань на более мелкие куски перед инкубацией или увеличить возбуждение. - Чтобы остановить перевариванию ткани, поместить пробирки на лед и добавляют 10 мл холодной HBSS в каждую пробирку. Центрифуга пробирки при температуре 4 ° С и 300 мкг в течение 5 мин и аспирата супернатант.
- Ресуспензию:
- Для взрослых мышей и p14 или старших мышат, повторно приостанавливать осадок 6 мл PBS и процедить его через сито 70 клеток мкм, помещенной сверху на новый 15-мл коническую сбора полипропиленовую трубку. Для того, чтобы обеспечить максимальное восстановление клеток, мыть оригинальную трубку с дополнительным 6 мл PBS и процедить его через сито клеток на пробирку.
- Для получения эмбрионов и щенков младшего тхань P14, повторно приостанавливать осадок с 2 мл PBS и процедить его через сито 35 клеток-мкм, помещенной сверху с круглым дном пробирки полистирола 5-мл (FACS-трубки). Для того, чтобы обеспечить максимальное восстановление клеток, мыть оригинальную трубку с дополнительным 2 мл PBS и процедить его через сито клеток на пробирку.
- Центрифуга пробирки при температуре 4 ° С и 300 мкг в течение 5 мин и аспирата супернатант. Удалить жидкость осторожно, так как клетки слабо прикреплены к полистирольной трубки.
3. Подготовка Маркированный одиночных клеток
- Буферные препараты: Для выделения клеток путем FACS, готовят сортировку буфера путем смешивания PBS (без хлорида кальция и хлорида магния), 5% фетальной бычьей сыворотки (FBS) и 5 мМ ЭДТА. Для проточной цитометрии анализа, подготовки буфера для анализа путем дополнения сортировки буфера с 0,05% азида натрия. Оба буфера можно хранить при температуре 4-8 ° С в течение до 2-х месяцев.
- Повторное приостановить клетки в сортировке или анабуфера для лизиса. Повторное приостановить каждый поджелудочной железы, выделенных из эмбрионов и щенков в возрасте до Р7 в 1 мл, от мышат между P8 и одного месяца в 1,5 мл, а у мышей старше одного месяца в 3 мл. Штамм клеток через клеточный фильтр 35 мкм, помещенной сверху емкости с круглым дном трубки из полистирола (FACS трубка).
- Для окрашивания контроля, вынуть 50- до 100-мкл аликвоты из образцов, сделанных на предыдущем шаге (не более 5% от общего объема выборки) и поместить их в новые FACS труб; включают в себя трубку для каждого флуорофора использованы, включая DAPI и флуоресцентные белки, а также для управления неокрашенной.
Примечание: При использовании трансгенных мышей с клетками, экспрессирующими флуоресцентный белок, или, когда количество клеток ограничено, включают в себя не-трансгенной ткани в качестве контроля окрашивания. Если клетки, экспрессирующие флуоресцентный белок используют без дальнейшей окраски, переходите к шагу 3.8. - Спин-вниз клетки при 300 мкг в течение 5 мин при 4 ° С и аспирата супернатант.
- Для блокакороль, вновь приостановить клетки с блокирующим раствором (100 мкл буфера сортировки или анализа с добавлением 1 мкл козьего IgG) и инкубировать в течение 30 минут на льду.
- Прокрашиваться маркеров клеточной поверхности, приготовить смесь, которая включает в себя все требуемые флуорофором-конъюгированные антитела в объеме 100 мкл на образце. Готовят 2x разведений антител в сортировки или анализа буфера (то есть, разбавить антитела , с получением двойной требуемой концентрации, если конечное разведение 1: 200 желателен, разбавленные антитела 1: 100). Без промывки блокирующий раствор, добавляют 100 мкл смеси для образца клеток для достижения конечного объема окрашиванием по 200 мкл. Выдержите в течение 30-60 мин на льду и в темноте.
- Для установки анализа или сортировки параметров (см шаги 4.3 и 5.2), подготовить дополнительные трубки, которые содержат только одно из антител, используемых (контроль окрашивания). Приготовьте 2x разведений антител в сортировке или буфер анализа (как описано в пункте 3.6). Убедитесь в том, чтобы включить сиngle контроль окрашивания разбавление для каждого флуорофора, используемого, а также неокрашенной контроля. Без промывки блокирующий раствор, добавляют 100 мкл антител смесей к клеткам (приготовленным на стадии 3.3) для достижения конечного объема окрашиванием по 200 мкл. Выдержите в течение 30 - 60 мин на льду и в темноте.
- Промыть, заполнив каждую пробирку с анализом или сортировки буфером до максимального объема 4 мл. Необязательно, повторно штамм клеток через клеточный фильтр 35 мкм (как описано в пункте 3.2).
- Центрифуга при 300 мкг в течение 5 мин при 4 ° С и осторожно удалите супернатант.
- Повторное приостановить образцы анализа или сортировки буфера. Повторное приостановить клетки, выделенные из эмбрионов в 500 мкл, от щенков в возрасте до одного месяца, в 1 мл, от 1 - 3 месяца в 2 мл, а у мышей в возрасте старше 3-х месяцев в 3 мл. Окрашивание средства управления могут быть повторно суспендируют в 300 мкл буфера.
- Добавить 200 нг / мл DAPI для ресуспендировали клетки, чтобы идентифицировать мертвые клетки. Убедитесь в том, чтобы включить трубку сотрудничестваntaining неокрашенные клетки без DAPI для настройки цитометра. Перейдите к ячейке сортировки (шаг 4) или анализа (этап 5).
4. сортировки клеток
- Подготовка:
- Для сортировки клеток до экстракции РНК, пальто собирающий трубки 1,5 мл с ингибитором РНКазы непосредственно перед сортировкой. С этой целью, добавить 1 мл буфера сортировки, содержащего 0,01 ингибитор Ед / мл РНКазы, в стерильную пробирку для сбора 1,5 мл. Через 5 мин, вихревые трубки и удаления жидкости.
- Для сортировки клеток до культивирования клеток, добавляют 3 мл стерильной культуральной среды (среда Игла в модификации Дульбекко (DMEM), дополненной 20% FBS, 1% L-глутамина и 1% пенициллин-стрептомицина) в стерильную пробирку для сбора 15-мл ,
- Перед загрузкой трубки в сортировщик FACS, вихревое он кратко повторно суспендирования клеток. Держите оставшиеся пробирки на лед.
- Начните с анализа контроля окрашивания для определения параметров сортировки (например, Напряжения и компенсации) и сортировочные ворота (например, общая популяция клеток, живых DAPI-негативных клеток и клеточных популяций, подлежащих сортировке).
- После того, как параметры сортировки и ворота устанавливаются, загружать образцы и инициировать сортировки клеток в пробирки для сбора.
Примечание: Сортировка условия в значительной степени зависят от инструмента. Мы используем ширину сопла 100 мкм, давление 23,1 фунтов на квадратный дюйм, и максимальную скорость сортировки 5. - Перейдите к экстракции РНК или культивирования отсортированных клеток.
Примечание: Для экстракции РНК, центрифугировать клетки при 2000 х г в течение 5 мин и удалить лишнюю жидкость перед продолжением со стандартным протоколом экстракции. Для культивирования клеток, если клетки были отсортированы в нестерильных условиях, мыть их дважды, заполнив пробирку среда для культивирования и центрифугирование ее при 300 х г в течение 7 мин перед культивированием, чтобы минимизировать их загрязнение.
5. Анализ клеточного методом проточной цитометрии
- Перед тем, лoading каждую трубку в цитометре, вихрем он кратко повторно суспендирования клеток. Держите оставшиеся пробирки на лед.
- Начните с анализа неокрашенных и окрашенных одинарные образцы, чтобы определить параметры анализа (например, напряжения и компенсации).
- После того как параметры анализа устанавливаются, загрузите каждый образец, включая контроль окрашивания, и записывать результаты. Анализ полученных результатов с помощью проточной цитометрии программного обеспечения для анализа.
Результаты
Поджелудочный мезенхимы требуется во время развития и взрослой жизни. Описанный здесь метод позволяет изолировать мезенхимальных клеток из эмбриональных, новорожденных и взрослых поджелудочной железы. Мезенхимальные клетки, но никакие другие типы клеток, выражают желтый флуоресцентный белок (YFP) в поджелудочной железе Nkx3.2 -Cre; R26R -YFP мышей 5, 11, 17, 19. Во время разработки, Nkx3.2 (также известный как BapX1) выражается эмбриональной поджелудочной железы, желудка, кишечника и мезенхимы, а также в подгруппе скелетной сомитов 19, 20, 21. Не было высказано Этот ген в поджелудочной мезенхимы от E9.5 до E11.5, позволяя экспрессию гена под контролем Nkx3.2 -Cre от E9.5 5, 19, 20. На основе этой маркировки, клетки могут быть очищены из объемной ткани поджелудочной железы с использованием проточной цитометрии. На рисунке 2 показан анализ проточной цитометрии отдельных клеток из эмбриональных, неонатальных и взрослых тканях поджелудочной железы, выделенные , как описано здесь. В то время как нетрансгенные панкреатические ткани не содержат флуоресцентные клетки, Nkx3.2 -Cre; R26R -YFP ткани поджелудочной железы из всех проанализированных возрастов содержит ярко выраженный YFP меченных популяции клеток (рисунок 2, отмеченные воротами).
Следуя методике, описанной здесь, клетки, экспрессирующие флуоресцентные белки могут быть либо очищены или проанализированы с помощью проточной цитометрии, с или без дополнительного иммунное окрашивание. Например, после того, как сортировка основана на флуоресцентного мечения, мезенхимальные клетки можно культивировать создать клеточную линию (по крайней мере , пять проходов), как показано на фигуре 3А. Примечание т он fibrocytic морфологии культивируемых клеток, характерных для клеток мезенхимы. Кроме того, эта система была использована для анализа экспрессии генов, отсортированных клеток. С этой целью, РНК экстрагировали из отсортированных клеток мезенхимы синтезировать кДНК, и уровни экспрессии генов были проанализированы с помощью кПЦР. Такой анализ показал , что отсортированные клетки экспрессируют пан-мезенхимальных маркера виментин (рис 3B). Наконец, экспрессия маркеров поверхности с помощью панкреатических клеток могут быть проанализированы с помощью проточной цитометрии. Например, мы выделили клетки из поджелудочной железы ткани Nkx3.2 -Cre; R26R -YFP взрослых мышей , используя метод , описанный здесь , и окрашивают их с поверхностью клетки гликопротеина CD9, о котором сообщалось, экспрессируется фибробластами 22. Как показано на фиг.3С, все флуоресцентно меченных клеток в Nkx3.2 -Cre; R26R -YFP поджелудочной железы выразить CD9.
tp_upload / 55344 / 55344fig1.jpg "/>
Рисунок 1: Эмбриональные и неонатальной ткани поджелудочной железы. Изолированные весь желудочно - кишечного тракта, в том числе желудка, селезенки, кишечника и поджелудочной железы, в качестве E15.5 эмбриона (А) и Р4 детеныша (B). Ткани поджелудочной железы разграничены с синей линией. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
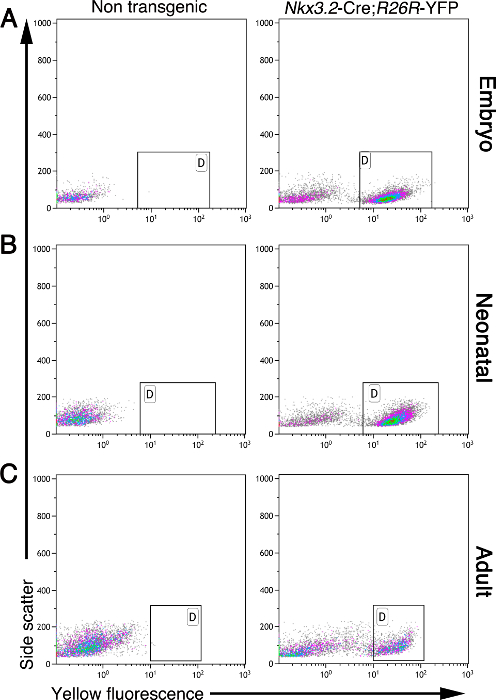
Рисунок 2: мезенхимальные клетки флуоресцентно меченных в Nkx3.2 -Cre; R26R -YFP ткани поджелудочной железы. Flow-цитометрии анализ панкреатических клеток , выделенных из не-трансгенной (слева панели) и Nkx3.2 -Cre; R26R -YFP трансгенная (правая панели) мышей различного возраста: эмбриональная (А), неонатальной (B), и объявлениящ (С). Клетки анализировали на содержание бокового рассеяния (Y-ось) и желтой флуоресценции (ось х). Ворота (отмеченные "D") указывает на наличие популяции YFP + клеток у трансгенных мышей , но не в нетрансгенным контролем. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
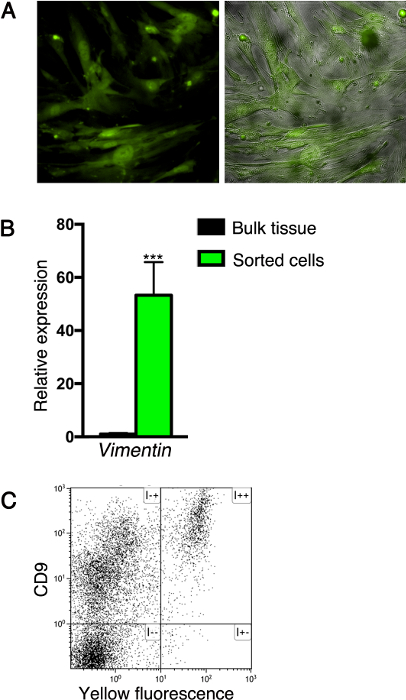
Рисунок 3: Анализ изолированных клеток поджелудочной железы. (А) Клетки , отсортированных из ткани поджелудочной железы из Nkx3.2 -Cre; R26R -YFP неонатальной мышей (как описано на фигуре 2В) культивировали создать клеточную линию. Культивируемые клетки были обследованы для флуоресценции (зеленые, правой и левой панелей) и фазового контраста (серый цвет, правая панель). (B) Bar диаграмма , показывающая Vimentin1 (Vim1)Уровни экспрессии по YFP + -sorted клеток из ткани поджелудочной железы из Nkx3.2 -Cre; R26R -YFP взрослых мышей (как описано на рисунке 1C, зеленый) по сравнению с несортированным ткани поджелудочной железы (черный). РНК экстрагировали, и экспрессия гена анализировали с помощью кПЦР; выражение нормализовалось циклофилин. N = 4. *** Р <0,001. Данные представляют собой среднее ± стандартное отклонение. (C) Flow-цитометрии анализ рассредоточенных клеток поджелудочной железы из Nkx3.2 -Cre; R26R -YFP взрослых мышей иммуно-окрашивались аллофикоцианин (APC) -conjugated анти-CD9 антитела и анализировали на APC (ось у) и желтой флуоресценции (ось х). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Здесь мы опишем метод для выделения и анализа клеток поджелудочной железы микросреды. Этот метод может быть использован для выделения мезенхимных клеток из эмбриональных и взрослых ткани поджелудочной железы. Кроме того, мы успешно использовали этот протокол , чтобы изолировать эндотелиальные клетки от взрослых и новорожденных поджелудочной железы 5, 17. Тем не менее, оно не может быть пригодным для получения воспроизводимых одной клеточной суспензии панкреатических эпителиальных клеток (альтернативные протоколы описаны в работах 18, 23 и 24). С помощью этого метода, флуоресцентно меченые клетки, либо экспрессирующих флуоресцентные белки или иммунологически для поверхностных маркеров, могут быть очищены с помощью FACS или анализировали с помощью проточной цитометрии. РНК можно экстрагировать из очищенных клеток в профиль их экспрессии генов. В качестве альтернативы, очищенные клетки можно культивировать, чтобы установить линию клеток для последующего анализа протеомики. Этот метод позволит характеристику факторов еxpressed поджелудочной железы микросреды, которые регулируют ее органогенеза, физиологии и патофизиологии.
Поджелудочный мезенхимы поддерживает органогенеза ткани путем стимулирования пролиферации предшественников и дифференцированных клеток 5, 9. Эти клетки были показаны для поддержки расширения человеческого эмбриональных стволовых клеток (чЭСК) -derived панкреатических клеток - предшественников 17, 25, 26. Поэтому, разграничивая идентичность эмбриональных факторов мезенхимальных облегчило бы текущие усилия по выработке инсулин-продуцирующие бета-клетки из ЭСК и индуцированных плюрипотентных стволовых клеток (ИПСК) в качестве потенциального лекарства от диабета. Мышиные генетические исследования позволили выявить факторы роста, такие как Fgf10, которые производятся мезенхимы в целях содействия расширению панкреатический эпителий на ранних стадиях развития поджелудочной железы3, 9. С целью выявления дополнительных факторов , выраженных в эмбриональной мезенхимы, мы выделили эти клетки с помощью лазера захваченное микродиссекции, экстрагируют их РНК и проводили анализ экспрессии генов 26. Тем не менее, в дополнение к рабочей интенсивным, этот метод основан на идентификации клеток на основе их морфологических признаков, что ограничивает его использование стадии развития до ветвлении эпителия в окружающую мезенхимы (т.е. E12.5). Для характеристики мезенхимальных клеток на более поздних стадиях развития, мы использовали метод , описанный здесь , 5, 17.
Мы использовали этот метод для анализа экспрессии маркера поверхности с помощью неонатальной поджелудочной железы мезенхимы 5. Кроме того, мезенхимальные клетки выделяли из эмбрионального и неонатального ткани поджелудочной железы из Nkx3.2 -Cre; мышей R26-EYFP, основанный наих флуоресцентное мечение в этой линии мышей, и культивировали для установления клеточных линий 17. Протеомики анализ этих клеток , разрешенных для идентификации факторов , секретируемых поджелудочной железы мезенхимы с возможностью продвижения чЭСК производных панкреатических клеток - предшественников 17. Кроме того , мы использовали этот метод выделения клеток , чтобы очистить мезенхимных клеток из взрослых тканей поджелудочной железы для экстракции РНК и анализа экспрессии генов 17. Таким образом, этот способ может быть использован для идентификации генов и белков, выраженных панкреатического мезенхимы, с возможностью поддержки развития панкреатического клеток.
Панкреатические мезенхимальные клетки были дополнительно показано, играют важную роль в поджелудочной онкогенеза. ККПР характеризуется образованием фибробластами богатых десмопластической стромы , состоящей из фибробластов, клеток иммунной системы , и ECM 27. В то время как строма считалось, что способствует развитию многихвиды рака, было показано сдерживать ККПР прогрессии 15, 16, 28. Это говорит о том, что компоненты поджелудочной стромы секретируют факторы, которые ингибируют образование опухолей. Более того, изменения в строме клеточного состава, а также в клеточных фенотипа может лежать в основе их влияние на эпителиальные клетки 15, 16, 28. Таким образом, описанный здесь способ может помочь при характеристике различных типов клеток, которые составляют ККПР стромы по сравнению с здоровой ткани поджелудочной железы. Было бы в дальнейшем позволит очистку различных типов клеток стромы, чтобы охарактеризовать возможные изменения в их профилях экспрессии генов во время прогрессии PDAC. Тем не менее, из - за изменений в поджелудочной композиции ECM во время онкогенеза 27, корректировки параметров ткани с пищеварением, такие как включение AdditРациональная типа коллагеназы или увеличение времени инкубации, может потребоваться.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank Adi Sasson for the technical assistance and Helen Guez for the critical reading of the manuscript. This work was supported by European Research Council starting grant no. 336204.
Материалы
| Name | Company | Catalog Number | Comments |
| Collagenase P | Roche | 11213865001 | |
| DNase | Sigma-Aldrich | D5025-15KU | The effective units should be at least 2000 unitz/ml protein |
| Hanks’ Balanced Salt solution (HBSS) | Sigma-Aldrich | H6648 | |
| Fetal Bovine Serum (FBS) | Biological Industries | 04-127-1A | |
| EDTA | Biological Industries | 01-862-1A | |
| Sodium Azide | Sigma-Aldrich | S2002 | |
| Goat IgG serum | Sigma-Aldrich | G9023 | |
| DAPI | Sigma-Aldrich | D9542 | |
| RNAse inhibitor | Invitrogen | N8080119 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Invitrogen | 11965092 | |
| L-Glutamine | Biological Industries | 03-020-1B | |
| Penicillin-streptomycin | Biological Industries | 03-031-1B | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | Without Calcium Chloride and Magnesium Chloride |
| 1.5 ml tubes | Sarstedt | 72 690 | |
| 15 ml conical tube | Corning | 430052 | |
| Round Bottom Polystyrene 5 ml tube | Corning | 352008 | FACS tube'. Make sure tube is compatible with the flow cytomter to be used, as there are slight differences in required tubes between brands |
| 5ml tube with 35 μm cell strainer Snap Cap | Corning | 352235 | FACS tube' |
| 70 μm cell strainer | Miltenyi Biotec | 130-098-462 | |
| Heating block with agitation | Eppendorf | ThermoMixer C | |
| Centrifuge | ThermoFisher | Heraeus Megafuge 40R | |
| Steromicroscope | Nikon | SMZ 745 | |
| Cell sorter | BD Biosciences | FACSAria IIu | |
| flow cytometer | Beckman Coulter | Gallios |
Ссылки
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129 (10), 2447-2457 (2002).
- Cabrera, O., Berman, D. M., Kenyon, N. S., Ricordi, C., Berggren, P. -. O., Caicedo, A. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proceedings of the National Academy of Sciences of the United States of America. 103 (7), 2334-2339 (2006).
- Gittes, G. K. Developmental biology of the pancreas: a comprehensive review. Developmental biology. 326 (1), 4-35 (2009).
- Villasenor, A., Cleaver, O. Crosstalk between the developing pancreas and its blood vessels: An evolving dialog. Seminars in cell & developmental biology. , 1-8 (2012).
- Landsman, L., Nijagal, A., et al. Pancreatic mesenchyme regulates epithelial organogenesis throughout development. PLoS Biology. 9 (9), e1001143 (2011).
- Lammert, E., Cleaver, O., Melton, D. Induction of pancreatic differentiation by signals from blood vessels. Science. 294 (5542), 564-567 (2001).
- Pierreux, C. E., Cordi, S., et al. Epithelial: Endothelial cross-talk regulates exocrine differentiation in developing pancreas. Developmental biology. 347 (1), 216-227 (2010).
- Golosow, N., Grobstein, C. Epitheliomesenchymal interaction in pancreatic morphogenesis. Developmental biology. 4, 242-255 (1962).
- Bhushan, A., Itoh, N., et al. Fgf10 is essential for maintaining the proliferative capacity of epithelial progenitor cells during early pancreatic organogenesis. Development. 128 (24), 5109-5117 (2001).
- Larsen, B. M., Hrycaj, S. M., Newman, M., Li, Y., Wellik, D. M. Mesenchymal Hox6 function is required for mouse pancreatic endocrine cell differentiation. Development. 142 (22), 3859-3868 (2015).
- Sasson, A., Rachi, E., et al. Islet pericytes are required for beta-cell maturity. Diabetes. 65 (10), 3008-3014 (2016).
- Stanley, S. A., Kelly, L., et al. Bidirectional electromagnetic control of the hypothalamus regulates feeding and metabolism. Nature. 531 (7596), 647-650 (2016).
- Brissova, M., Aamodt, K., et al. Islet microenvironment, modulated by vascular endothelial growth factor-A signaling, promotes β cell regeneration. Cell metabolism. 19 (3), 498-511 (2014).
- Nikolova, G., Jabs, N., et al. The vascular basement membrane: a niche for insulin gene expression and Beta cell proliferation. Developmental cell. 10 (3), 397-405 (2006).
- Rhim, A. D., Oberstein, P. E., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer cell. 25 (6), 735-747 (2014).
- Özdemir, B. C., Pentcheva-Hoang, T., et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer cell. 25 (6), 719-734 (2014).
- Russ, H. A., Landsman, L., et al. Dynamic Proteomic Analysis of Pancreatic Mesenchyme Reveals Novel Factors That Enhance Human Embryonic Stem Cell to Pancreatic Cell Differentiation. Stem cells international. 2016, 6183562 (2016).
- Gout, J., Pommier, R. M., et al. Isolation and Culture of Mouse Primary Pancreatic Acinar Cells. Journal of Visualized Experiments. (78), e50514 (2013).
- Verzi, M. P., Stanfel, M. N., et al. Role of the homeodomain transcription factor Bapx1 in mouse distal stomach development. Gastroenterology. 136 (5), 1701-1710 (2009).
- Tribioli, C., Frasch, M., Lufkin, T. Bapx1: an evolutionary conserved homologue of the Drosophila bagpipe homeobox gene is expressed in splanchnic mesoderm and the embryonic skeleton. Mech Dev. 65 (1-2), 145-162 (1997).
- Hecksher-Sorensen, J., Watson, R., et al. The splanchnic mesodermal plate directs spleen and pancreatic laterality, and is regulated by Bapx1/Nkx3.2. Development. 131 (19), 4665-4675 (2004).
- Walmsley, G. G., Rinkevich, Y., Hu, M. S. Live Fibroblast Harvest Reveals Surface Marker Shift In Vitro. Tissue Engineering Part C: Methods. , (2014).
- Morris, J. P., Greer, R., et al. Dicer regulates differentiation and viability during mouse pancreatic cancer initiation. PloS one. 9 (5), 95486 (2014).
- Miyatsuka, T., Matsuoka, T. -. A., et al. Chronological analysis with fluorescent timer reveals unique features of newly generated β-cells. Diabetes. 63 (10), 3388-3393 (2014).
- Sneddon, J. B., Borowiak, M., Melton, D. A. Self-renewal of embryonic-stem-cell-derived progenitors by organ-matched mesenchyme. Nature. 491 (7426), 765-768 (2012).
- Guo, T., Landsman, L., Li, N., Hebrok, M. Factors expressed by murine embryonic pancreatic mesenchyme enhance generation of insulin-producing cells from hESCs. Diabetes. 62 (5), 1581-1592 (2013).
- Olive, K. P., Jacobetz, M. A., et al. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science. 324 (5933), 1457-1461 (2009).
- Raz, Y., Erez, N. An inflammatory vicious cycle: Fibroblasts and immune cell recruitment in cancer. Experimental cell research. 319 (11), 1596-1603 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены