A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في الوقت الحقيقي الرحلان الشاردي مع تيتراميثيلامونيوم لكمية حجم الكسر و تورتوسيتي من الدماغ خارج الخلية الفضاء
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول الرحلان الشاردي في الوقت الحقيقي، وهي الطريقة التي يقيس المعلمات المادية من الفضاء خارج الخلية (إكس) من أدمغة المعيشة. يتم استخدام انتشار جزيء خامل صدر في إكس لحساب كسر حجم إكس و تورتوسيتي. وهو مثالي لدراسة التغيرات العكسية الحادة ل إكس الدماغ.
Abstract
يصف هذا الاستعراض المفاهيم الأساسية والبروتوكول لأداء طريقة الرحلان الشاردي في الوقت الحقيقي (رتي)، ومعيار الذهب لاستكشاف وتحديد مساحة خارج الخلية (إكس) من الدماغ الحية. ويحيط إكس جميع خلايا الدماغ ويحتوي على كلا السائل الخلالي ومصفوفة خارج الخلية. نقل العديد من المواد اللازمة لنشاط الدماغ، بما في ذلك الناقلات العصبية والهرمونات، والمواد الغذائية، يحدث عن طريق نشر من خلال إكس. تحدث تغييرات في حجم وهندسة هذا الفضاء أثناء عمليات الدماغ العادية، مثل النوم، والظروف المرضية، مثل نقص التروية. ومع ذلك، فإن هيكل وتنظيم المخ الدماغ، وخاصة في الدول المريضة، لا يزال غير مستكشفة إلى حد كبير. طريقة رتي يقيس اثنين من المعلمات الفيزيائية للدماغ الحية: حجم الكسر و تورتوسيتي. حجم جزء هو نسبة حجم الأنسجة التي يشغلها إكس. يعد التعفن مقياسا للعوائق النسبية التي تواجهها المادة عندما تنتشر عن طريق إعادة الدماغجيون بالمقارنة مع وسيلة مع عدم وجود عوائق. في رتي، يتم نبض جزيء خامل من ميكرولكترود مصدر في إكس الدماغ. كما تنتشر جزيئات بعيدا عن هذا المصدر، يتم قياس تركيز تغيير أيون مع مرور الوقت باستخدام ميكرولكترود أيون انتقائية وضعه ما يقرب من 100 ميكرون بعيدا. من منحنى الانتشار الناتج، يمكن حساب كل من حجم الكسر و تورتوسيتي. وقد استخدمت هذه التقنية في شرائح الدماغ من أنواع متعددة (بما في ذلك البشر) وفي الجسم الحي لدراسة التغيرات الحادة والمزمنة ل إكس. خلافا لغيرها من الأساليب، رتي يمكن استخدامها لدراسة كل من التغييرات عكسها ولا رجعة فيه إلى إكس الدماغ في الوقت الحقيقي.
Introduction
الفضاء خارج الخلية (إكس) هو شبكة من قنوات مترابطة الخارجي لجميع خلايا الدماغ ويحتوي على كلا السائل الخلالي ومصفوفة خارج الخلية ( الشكل 1A والشكل 1B ). توزيع العديد من المواد اللازمة لوظيفة الخلايا الدماغية، بما في ذلك المواد الغذائية والهرمونات والناقلات العصبية، يحدث عن طريق نشر من خلال إكس. التغيرات في المعلمات الفيزيائية لهذا الفضاء، بما في ذلك حجم والهندسة، ومصفوفة خارج الخلية، يمكن أن تؤثر بشكل كبير الانتشار من خلال إكس وتركيزات أيون المحلية الاستحمام خلايا الدماغ، والتي لها تأثير عميق على وظيفة خلايا الدماغ 1 ، 2 .
في الوقت الحقيقي يستخدم الرحلان الشاردي (رتي) لتحديد اثنين من الخصائص الهيكلية للمنطقة الدماغ: حجم الكسر و تورتوسيتي 3 ، 4 ،"كريف"> 5. جزء حجم ( α ) هي نسبة حجم الأنسجة التي يشغلها إكس ( V إكس ) بالنسبة إلى حجم الأنسجة الكلي ( V الأنسجة ) في حجم الابتدائية ممثل؛
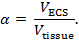
إن العسر ( λ ) هو العائق النسبي الذي تواجهه المادة عندما تنتشر عن طريق منطقة الدماغ بالمقارنة مع وسط دون عوائق؛

حيث D * (سم 2 ق -1 ) هو معامل الانتشار الفعال للمادة في الدماغ و D (سم 2 ق -1 ) هو معامل الانتشار الحر للمادة في وسط الحرة، مثل هلام الاغاروز المخفف.
اليوم، مادة التحقيق الأكثر شيوعا ل Rطريقة تي هي كاتيون تيتراميثيلامونيوم صغيرة (تما). تما لديه الوزن الجزيئي من 74 غرام / مول، ينفصل تماما في الحل، ولها شحنة موجبة واحدة. وقد أظهرت الدراسات رتي مع هذا أيون أن α  0.2 و λ
0.2 و λ  1.6 1 ، 2 . وهذا يعني أن إكس هو ما يقرب من 20٪ من حجم الدماغ الكلي، وأن نشر جزيء صغير، خامل يحدث ما يقرب من 2.5 مرات أبطأ في إكس من في وسط مع عدم وجود عوائق 3 . ومع ذلك، على حد سواء α و λ تختلف مع عمر الدماغ، والمنطقة، والدولة وفي الحالات المرضية 1 . وقد ارتبطت تغيرات هذه المعلمات بتطور المخ، والشيخوخة، والنوم، والصرع، والعديد من العمليات الأساسية الأخرى وأمراض الدماغ 1، 6 . في حين تقيس تقنيات أخرى α و λ ، رتي يمكن قياس سواء في المناطق المحلية من الأنسجة الحية في الوقت الحقيقي. لهذا السبب، أصبح رتي أداة لا غنى عنها للتحقيق في التغييرات في α و λ خلال التحديات الحادة والتي يمكن عكسها.
1.6 1 ، 2 . وهذا يعني أن إكس هو ما يقرب من 20٪ من حجم الدماغ الكلي، وأن نشر جزيء صغير، خامل يحدث ما يقرب من 2.5 مرات أبطأ في إكس من في وسط مع عدم وجود عوائق 3 . ومع ذلك، على حد سواء α و λ تختلف مع عمر الدماغ، والمنطقة، والدولة وفي الحالات المرضية 1 . وقد ارتبطت تغيرات هذه المعلمات بتطور المخ، والشيخوخة، والنوم، والصرع، والعديد من العمليات الأساسية الأخرى وأمراض الدماغ 1، 6 . في حين تقيس تقنيات أخرى α و λ ، رتي يمكن قياس سواء في المناطق المحلية من الأنسجة الحية في الوقت الحقيقي. لهذا السبب، أصبح رتي أداة لا غنى عنها للتحقيق في التغييرات في α و λ خلال التحديات الحادة والتي يمكن عكسها.
تم التحقق من صحة نظرية رتي أصلا من قبل نيكولسون وفيلبس، وقد استخدمت هذه التقنية على نطاق واسع منذ ذلك الوقت 4 ، 7 . التجارب التي تستخدم رتي تبدأ مع الافراج عن نبض تما من مصدر ميكرولكترود بواسطة الرحلان الشاردي في هلام الاغاروز مخفف. مرة واحدة طرد، الأيونات تنتشر بحرية بعيدا عن مصدر نقطة، واختيار من عدد لا حصر له من المسارات العشوائية ( الشكل 1D ). يتم قياس تركيز أيون المتغيرة مع مرور الوقت باستخدام ميكرولكترود أيون انتقائي (إيسم) وضعه تقريبا100 ميكرون بعيدا ( الشكل 1C ). التغيرات في تركيز تما هي الرسوم البيانية وتركيبها على منحنى يسمح لحساب كل من D وعدد النقل من ميكرولكترود الرحلان الشاردي (المعلمات التي نوقشت في البروتوكول). مع هذه القيم، يتم تكرار الإجراء في منطقة الدماغ التي تهم الحصول على D * وحساب كل من α و λ . السيطرة على ميكرولكترود الرحلان الشاردي، وجمع البيانات والرسوم البيانية وتركيب منحنى تركيز تما، وحساب المعلمات التجريبية كلها عادة ما يتم من قبل البرامج واندا و والتر، والتي تم تصميمها خصيصا لهذا الغرض (البرنامج وأدلة هم متاحة مجانا من المؤلفين عند الطلب).
يصف القسم بروتوكول من هذا الاستعراض الإجراءات الأساسية اللازمة لتصميم وأداء رتي في شرائح الدماغ القوارض. وقد استخدمت هذه التقنية أيضا في غير قضيبنماذج الأنف والحنجرة، بما في ذلك شرائح الدماغ البشري وفي الأعمال التحضيرية المجراة الدماغ 1، 4، 6، 8، 9. يقدم قسم النتائج ممثل كل من النتائج المثالية وغير مثالية لتسليط الضوء على الفروق الدقيقة في تفسير البيانات. وأخيرا، يغطي قسم المناقشة باختصار تقنيات استكشاف الأخطاء وإصلاحها، وقيود رتي، والتقنيات البديلة المستخدمة لدراسة إكس، والتطبيقات المستقبلية ل رتي.

الشكل 1: الرسوم البيانية من الانتشار من خلال إكس. ( أ ) مخطط إكس: يوضح حجم وموقع إكس في قسم الدماغ نموذجي. الأصفر يصادف إكس بين عمليات خلايا الدماغ الرمادي. حجم إكس هو ما يقرب من 20٪ من إجمالي حجم الأنسجة ( أي حجم حجم = 0.2) في ظل الظروف الفسيولوجية. ( ب ) رسم تخطيطي مكبر لل إكس: يسلط الضوء على المعلمات المادية المساهمة في تورتوسيتي، بما في ذلك هندسة خلايا الدماغ (الرمادي) والمصفوفة خارج الخلية (رسم بياني كشبكة من غليكوسامينوغليكانز متعددة الألوان والبروتيوغليكان). ( ج ) رسم بياني ثلاثي الأبعاد للانتشار من مصدر نقطة: يوضح الحركة الصافية للجزيئات الخاملة من مصدر اليونتوفيريت إلى إيسم. وباستثناء حواجز الانتشار والامتصاص الخلوي، تنتشر الجزيئات إلى الخارج في جميع الاتجاهات، وتنتج جبهة تركيز كروية. و إيسم يحد من التركيز المحلي للجزيئات الخاملة صدر من مصدر اليونتوفوريتيك. ( د ) محاكاة الكمبيوتر للانتشار في إكس من الدماغ: [أقصى اليسار] الإعداد لمحاكاة مونت كارلو. وتمثل المجالات الخضراء عمليات الخلايا الدماغية ويمثل الصليب الأحمر مصدر نقطة. هذا نماذج الإعداد المخططة أنسجة المخ في الشكل 1A . [الصور الوسطى] 3 و6 جزيئات تؤدي حركات عشوائية لأنها تنتشر من خلال الفضاء خارج الخلية من الدماغ، مبين في 2 أبعاد. [أقصى اليمين] يمشي عشوائية من العديد من الجزيئات الصادرة من مصدر نقطة. الحركة الصافية لجميع الجزيئات من مصدر نقطة هو الخارج كما هو مبين في الشكل 1C . وتحدد المسارات العشوائية التراكمية المسافات بين الخلايا ( أي إكس؛ انظر المرجع 5 لمزيد من التوضيح). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
وكانت جميع الإجراءات الحيوانية، وتستخدم للحصول على عينات الأنسجة، موافقة لجنة الأخلاقيات الحيوانية في مركز سوني الطبي دونستات.
1. إعداد الحلول والمعدات
- إعداد 150 ملي كلوريد الصوديوم حل الردم للبرميل إشارة من إيسم. تخزينه في حقنة 10 مل تعلق على مرشح 0.22 ميكرون (لإزالة البكتيريا أو الجسيمات).
- إعداد 150 ملي تما كلوريد (تما-كل) حل الردم ل ميكرولتروديس. تخزينه في حقنة 10 مل تعلق على مرشح 0.22 ميكرون. إعداد الحلول تما-كل (في هذا البروتوكول) من 5 مليون حل الأسهم المصنعة لضمان التركيز الصحيح.
- كلوريديز لا يقل عن أربعة أسلاك الفضة لتصنيع ميكرولتروديس عن طريق غمر الأسلاك في التبييض (هيبوكلوريت الصوديوم) لمدة 2 ساعة على الأقل. إزالة الفائض الزائد مع الإيثانول والسماح للأسلاك لتجف.
- إعداد 50 مل من الاغاروز 0.3٪ في 150 ملي كلوريد الصوديوم و 0.5 ملي تما-كل في كوبوتغطيته. استخدام الاغاروز التي هي مسحوق وطازجة إلى حد معقول لضمان القياسات نشر جيدة.
- الحرارة ومزج الحل الاغاروز مع شريط ضجة إلى حله. السماح للحل لتبرد لدرجة حرارة الغرفة. تخزين هذا في 4 درجات مئوية لمدة تصل إلى 1 أسبوع.
- إعداد غير مبال (الأرض) القطب مصنوعة من 4٪ الاغاروز في 1 M بوكل (الاتجاهات في الملحق أ)
- تلفيق صغيرة، التي يسهل اختراقها الكأس التي يمكن أن يصلح في الغرفة التجريبية والتي تسمح للاستمرارية الكهربائية بين محتوياته والبيئة الخارجية ( الشكل 2A ). وضع حلقة معدنية على الجزء السفلي من هذا الكأس لمنعه من العائمة عندما غمرت جزئيا في الماء.
- استخدام التخفيف التسلسلي من 5 M تما-كل الأسهم لجعل خمسة 100 مل تما-كل حلول لمعايرة إيسمز. يجب أن يكون الحلول تركيزات النهائية من 0.5، 1، 2، 4، و 8 مم تما-كل، وكلها في 150 ملي كلوريد الصوديوم. تخزين حلول المعايرة في كوب قابل للغلق لمنع التبخر.
2. الإعداد الإلكتروني
- توصيل مكونات الإعداد التجريبي رتي وفقا لرسم تخطيطي كتلة في الشكل 2B . تشمل مكبر للصوت مع اثنين من قنوات الإدخال (واحدة منها يجب أن تكون مقاومة عالية جدا للبرميل أيون انتقائي لل إيسم)، مرشح تمرير منخفض تعيين في 10 هرتز، مسجل الرسم البياني، A / D + D / A (أو مكبر للصوت قادر على توفير نبضات تيار مستمر)، وجهاز كمبيوتر (بيسي) تشغيل برامج واندا و والتر. افحص اإلعداد اإللكتروني للتأكد من أن جميع التوصيلات في مكانها.
- درع الإعداد التجريبي في العلبة المؤرضة (مثل قفص فاراداي)، إذا لزم الأمر، كما إيسمس لديها مقاومة عالية وحساسة للتحف التي أنشأتها الحركة القريبة.
- إنشاء محطة معايرة إيسم مخصصة تتألف من مكبر للصوت المدخلات المزدوجة، ومسجل الرسم البياني، وحامل إيسم المناسب، والقطب الأرض غير مبال. اذا كان ممكنا،درع العلبة. تخطي هذه الخطوة إذا تم معايرة إيسمز في الإعداد التجريبي (الخطوة 3.29)

الشكل 2: مسامية كأس التجريبية والإعداد الإلكتروني. ( أ ) كأس التجارب المسامية: تستخدم شبكة مسامية لإنشاء كوب تجريبي يسمح بالاستمرارية الكهربائية بين أغاروس (داخل) وسائل الاستحمام التجريبي (في الخارج). يتم إرفاق حلقة معدنية إلى أسفل الكأس لمنع الكأس من العائمة في حل الاستحمام. ( ب ) مخطط تخطيطي لإعداد رتي (الخطوتان 2.1 و 2.2): يرتبط إيسم بمكبر للصوت (أمب.). و إيسم اثنين من برميل. واحد يحتوي على مبادل أيون السائل (ليكس) في غيض ويولد الجهد النسبي ل لوغاريتم تركيز تما في طرف جنبا إلى جنب مع الجهد المحيط المحلي. عشريتم تمثيل مسار الإشارة e بخط أحمر. البرميل الآخر من إيسم يعرف باسم برميل مرجعي ويقيس الجهد المحيط في طرف إيسم؛ يتم توصيله بواسطة مسار إشارة زرقاء. مكبر للصوت واثنين من ما يسمى مراحل الرأس التي تتصل إيسم. هذه الوحدات لديها مكاسب من 1 (X1) وتتناسب مع مقاومة عالية من ميكرولكترود إلى مقاومة منخفضة من بقية الدوائر مكبر للصوت. يجب أن تكون المرحلة الرأسية الموصلة إلى البرميل الأيوني الانتقائي قادرة على مطابقة مقاومة واردة تبلغ حوالي 1000 ميجاواط، في حين أن مقاومة البرميل المرجعي عادة ما تكون حوالي 10 ميجاواط. بعد مغادرة مرحلة الرأس، يتم عكس الجهد من البرميل المرجعي وطرحه من الجهد على برميل أيون انتقائية باستخدام مكبر للصوت تجميع (Σ) للحصول على النقي إشارة الجهد أيون. وتمرر نواتج مكبر الصوت لوحدة تكييف الإشارة التي توفر تضخيم إضافي ومرشاح تمرير منخفض متعدد الأقطاب (≤10 هز؛لتر)، مما يزيل الضوضاء ويمنع تعبير الإشارة في المحول التناظري إلى الرقمي (A / D). يتم عرض مخرجات الفلتر أيضا على مسجل مخطط الشريط. محول A / D التحويل الرقمي الإشارات ويرسلها إلى جهاز كمبيوتر شخصي (بيسي). كما يولد جهاز الكمبيوتر إشارة رقمية يتم تحويلها بواسطة محول رقمي إلى تناظري (D / A) إلى نبض الجهد التناظري الذي يتم تغذيته إلى وحدة الرحلان الشاردي، الذي يحول الجهد إلى نبض الحالي من السعة الثابتة ويرسله إلى ميكرولكترود الرحلان الشاردي. ويمثل مسار إشارة الرحلان الشاردي بالخط الأخضر. الحصول على البيانات وإشارة الرحلان الشاردي هي تحت سيطرة برنامج واندا، الذي يولد ملف الإخراج لكل سجل نشر في شكل الجهد مقابل تسجيل الوقت، جنبا إلى جنب مع جميع المعلمات التي تحدد التجربة. برنامج آخر، والتر، يقرأ ملف الإخراج ويستخدم إيسم معايرة البيانات لتحويل الفولتية الرقمية إلى تركيزات. تركيز التركيزثم يتم تركيب منحنيات الوقت رسوس في والتر إلى الحل المناسب لمعادلة الانتشار. يتم استخراج D و n t إذا كان الوسيط هو الاغاروز، و λ و α المستخرجة إذا كان الوسيط هو الدماغ. الإشارات التناظرية هي خطوط صلبة. الإشارات الرقمية هي خطوط منقط. وهناك أيضا القطب الأرض غير مبال (لا يظهر) في الحمام الذي يحتوي على شريحة. خطوط حمراء = إشارة أيون، خطوط زرقاء = إشارة مرجعية، خطوط خضراء = قيادة الرحلان الشاردي، خطوط صلبة = تناظرية، خطوط منقط = رقمي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد ومعايرة ميكرولتروديس أيون انتقائي
- افتعال إيسم باستخدام البروتوكول أدناه يوم واحد قبل التجربة. جعل إيسمس على دفعات للتأكد من أن اثنين على الأقل من العمل في يوم التجربة.
ملاحظة: معظم إيسمز مستقرة ليوم واحد أواثنين. إيسم تلفيق حساس للرطوبة والظروف الجوية. ليس كل ميكرولكترود معايرة بنجاح. - رقاقة بعيدا حوالي 0.5 سم من الزجاج في نهاية واحدة من البراميل من الزجاج المزدوج البورسليكات الشعرية الشعرية باستخدام زوج قديم من ملقط.
- رقاقة برميل واحد على الطرف الآخر من الشعرية ( الشكل 3A ). تأكد من أن الحاجز غير معطوب (حرج). تحذير: ارتداء نظارات واقية لمنع الإصابة بسبب الزجاج قذيفة.
- وضع الشعرية في زجاجة من الأسيتون لمدة 1 ساعة على الأقل لإزالة الملوثات.
- إزالة الشعرية من الأسيتون والنبض نظيفة وجافة، غاز النيتروجين المضغوط أو الهواء من خلال ذلك لإزالة أي الأسيتون الزائد. إزالة جميع الأسيتون في الشعرية، كما الأسيتون المتبقية يمكن أن تتداخل مع سيلانيزاتيون (حاسم).
- تلفيق غيض من ميكروبيبيت على مجتذب عمودي أو أفقي. خياط المعلمات لسحب ماصة مع تفتق طويلة وتلميح حاد، حوالي 1 ميكرون أو أقل في القطر. في نهاية هذه الخطوة، وسيتم إجراء شعري واحد إلى اثنين من الماصات ( الشكل 3A ).
- تصور ميكروبيبيت واحد تحت مركب، المجهر تستقيم مع هدف 10X. قطع طرف قبالة باستخدام شريحة المجهر الزجاج بحيث القطر النهائي من طرف ( أي، كل برميل) ما بين 2 و 5 ميكرون ( الشكل 3B ). وسوف يشار إلى هذا ماصة باسم إيسم من الآن فصاعدا.
- ملء برميل متقطع من إيسم مع 150 ملي كلوريد الصوديوم الحل المرجعي من خلال افتتاح على الجانب متقلب باستخدام حقنة 10 مل تعلق على مرشح 0.22 ميكرون و 28 G، 97 ملم إبرة ( الشكل 3B ). لا ملء برميل الماضي ثلاثة أرباع ارتفاع برميل.
- ملء برميل غير مكسورة من إيسم مع 150 ملي تما-كل حل الردم. اضغط على إيسم بلطف لضرب أي فقاعات الهواء للخروج من الحل. تحقق من وجود فقاعات تحت الميكروفونالمجهر تستخدم لتقطيع طرف.
- لهب الجزء الخلفي من إيسم باستخدام الموقد بنسن للتأكد من أن أي اتصال من حل الردم يحدث عبر الحاجز في الجزء الخلفي من إيسم. تأكد من أن الجزء العلوي من إيسم جاف بعد المشتعلة.
- إدراج سلك الفضة كلوريديزد في الحل المرجعي لل إيسم وثني سلك جاحظ من الشعرية للاحتفال هذا كما برميل المرجعي ( الشكل 3C ). تأكد من أن السلك هو مغمورة في حل الردم ويبقى في حل لمدة التجربة.
- حرك طول قصير من أنابيب البولي تيترافلوروإيثيلين (حوالي 20 سم طويلة) على طرف 25 G حقنة إبرة. وضع الطرف الآخر من الأنابيب في الجزء الخلفي من برميل ايون انتقائي. تأكد من أن الأنابيب في برميل ولكن فوق حل الردم ( الشكل 3C ).
- تسخين عصا من الشمع الأسنان مع الموقد بنسن وختم كل من الأنابيب و سيلفإيه في البراميل الخاصة بهم ( الشكل 3C ). تأكد من أن يتم إنتاج ختم الهواء الكامل حول الأنابيب البلاستيكية في برميل ايون انتقائية (حرجة).
- إعداد وعاء زجاجي شفاف صغير (5 مل أو أقل) من 4٪ كلوروتريميثيلزيلان في الزيلين. الحذر: سيلينيس والسيلانات هي خطرة جدا على الصحة؛ التعامل مع كل من المواد الكيميائية داخل غطاء الدخان وتجاهل بشكل مناسب.
- وضع الحاوية أمام مجهر تشريح ستيريو شنت أفقيا في غطاء الدخان. تأمين إيسم عموديا على الحاوية باستخدام ميكرومانيبولاتور ( الشكل 3D ).
- تراجع غيض من ميكرولكترود في حل كلوروتريميثيلزيلان.
- إرفاق حقنة فارغة 10 مل إلى إبرة قياس 25 مما يؤدي إلى إيسم. تطبيق ضغط الهواء الإيجابي من حقنة حتى يتم تشكيل فقاعة من حل تما-كل. وينبغي تنفيذ هذه الخطوة تحت التصور المباشر من خلال المجهر.
- اضغط على حامل إيسم بلطف لضرب فقاعة قبالة الطرف.
- رسم حل كلوروتريميثيلزيلان إلى ارتفاع ما يقرب من 1500 ميكرون في غيض من إيسم باستخدام الضغط السلبي على حقنة 10 مل.
- طرد تماما محلول كلوروتريميثيلزيلان من طرف إيسم حتى يتم إنشاء فقاعة من حل تما-كل في طرف ( الشكل 3D ).
- كرر الخطوات 3.19 و 3.20 خمس مرات. تأكد من أن عمود حتى من دون انقطاع من السوائل يتم سحبها إلى طرف في كل مرة. إذا كان لا يمكن استخلاص أي حل في طرف، تحقق ما إذا كان يتم حظر الأنابيب، وختم الهواء غير مكتملة، أو يتم حظر غيض إيسم.
- مسح كل من حل كلوروتريميثيلزيلان من طرف حتى يتم إنشاء فقاعة من حل تما-كل.
- مع الحفاظ على الضغط الإيجابي على حقنة، وإزالة إيسم من محلول زيلين. تأكد من أن جميع الحل زيلين طرد من طرف إيسم، كما الزيلين الزائدة سوف تدمر ذروةشماعات العمود التي تم إنشاؤها في الخطوات اللاحقة.
- وضع غيض من إيسم في وعاء صغير وشفاف (إما واحد مبادل جاء في أو كوفيت صغير) عقد مبادل أيون السائل (ليكس) ل تما. تنفيذ هذه الخطوة تحت التصور المباشر باستخدام الإعداد المجهر الأفقي.
- تطبيق كمية صغيرة من الضغط السلبي لرسم الحد الأدنى من ليكس في طرف ( أي، بمجرد ينظر ليكس دخول طرف، ووقف تطبيق الضغط السلبي).
- افصل حقنة 10 مل من الأنبوب والسماح إيسم للجلوس لمدة 5 دقائق. خلال ذلك الوقت، فإن ليكس يدخل تلميح سيلانيزد حتى تصل إلى حالة من التوازن.
- إزالة إيسم من ليكس. سحب الأنبوب من برميل مبادل (في حين إزالة الشمع قليلا ممكن). وضع سلك الفضة كلوريديزد في افتتاح الصغيرة التي تم إنشاؤها في نهاية الجزء الخلفي من إيسم. ختم السلك في الردم من برميل مبادل مع ذاب الشمع.
- السماح إيسم للجلوسلمدة 30 دقيقة على الأقل. إرفاق إسمس الانتهاء إلى حافة داخل كوب باستخدام أي طي، لاصقة مؤقتة.
- معايرة إيسم عن طريق تسجيل الجهد يقاس إيسم في كل حل المعايرة المحرز في الخطوة 1.8.
ملاحظة: يمكن إجراء المعايرة في محطة المعايرة (انظر الخطوة 2.3) أو في الإعداد التجريبي. ويرد هذا الإجراء في الملحق باء وفي هاك وآخرون 10 . - إذا كانت معايرة إيسم ناجحة لعدة إيسم، توقف هنا حتى يوم الاستخدام المقصود. إن لم يكن، تلفيق المزيد من إيسمز.
- في يوم التجربة، مرة أخرى معايرة ميكرولكترود (انظر الخطوة 3.29).

الشكل 3: إعداد ميكرولكترود أيون انتقائية. ( أ ) إيسم بعد التقطيع مرة أخرى نهايات شعري وسحب (الخطوات 3،2-3،6): برميل واحد في كلا الطرفين سفا الزجاج الشعرية هو متقطع. يتم إنشاء إيسم عن طريق سحب واحد الزجاج المزدوج الماسورة الشعرية لتوليد اثنين ميكروبيبيتس مع نصائح دقيقة. ( ب ) إيسم بعد إعادة تعبئة كل من البراميل (الخطوات 3-7-3.9): غيض من إيسم واحد يتم تقطيعها إلى قطر 2-5 ميكرون. يتم ردم برميل أيون انتقائية مع تما-كل، والردم المرجعي هو ردم مع كلوريد الصوديوم. ( ج ) إيسم قبل طلاء مع كلوروتريميثيلزيلان (الخطوات 3.11-3.13): يتم إدخال سلك الفضة كلورديزد في برميل مرجعية. يتم توصيل بوليتترافلورثيلين (بتف) أنابيب إلى إبرة 25 G وإدراجها في برميل أيون انتقائية. يتم إنشاء ختم الهواء محكم على رأس كل من برميل باستخدام الشمع الأسنان. ( د ) طلاء ميكروبيبيت مع كلوروتريميثيلزيلان (الخطوات 3.15-3.26): [التكبير المنخفض] علقت إيسم في كلوروتريميثيلزيلان تمشيا مع ستيريوميكروسكوب شنت أفقيا. [التكبير عالية] وجهة نظر من خلال ستيريوميكروسك أفقيا شنتأوب من طرف إيسم في محلول كلوروتريميثيلزيلان. بعد التصور من طرف من خلال المجهر، يتم طرد كمية صغيرة من حل تما-كل من برميل أيون انتقائية (بما فيه الكفاية لتوليد فقاعة صغيرة من حل تما-كل). يتم استغلال حامل إيسم للافراج عن فقاعة حل تما-كل ثم يتم رسم كلوروتريميثيلزيلان في طرف. وتكرر هذه الدورة عدة مرات. بعد أن يتم إخراج كلوروتريميثيلزيلان من إيسم، يتم وضع إيسم في مبادل أيون السائل (ليكس) ل تما و ليكس يتم رسمها في غيض من برميل ايون انتقائي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إعداد الرحلان الشاردي الموجات الدقيقة
ملاحظة: يجب أن تكون ملفقة ميكرولترودس الرحلان الشاردي في يوم التجربة.
- سحب الزجاجية البورسليكات الزجاجية مزدوجة الماسورة على رأسية أو حومجزأة ريزونتال. خياط المعلمات لسحب ماصة على غرار ميكروبيبيتس سحبت في الخطوة 3.6 ( الشكل 4A ).
- وضع ميكروبيبيت تحت المجهر المركب المستخدمة في الخطوة 3.7 وقطع طرف قبالة باستخدام شريحة المجهر الزجاج بحيث القطر الناتج ما بين 2 و 5 ميكرون ( الشكل 4A ).
- ملء كلا برميل مع 150 ملي تما-كل حل الردم باستخدام حقنة 10 مل تعلق على مرشح 0.22 ميكرون و 28 G، 97 ملم إبرة ( الشكل 4A ).
- اضغط على ميكروبيبيت برفق لضمان عدم ترك أي فقاعات الهواء في حل كل من برميل.
- وضع كلوريديزد الأسلاك الفضية في كل برميل من ميكروبيبيت. تأكد من أن الأسلاك عميقة بما فيه الكفاية في حلول الردم بحيث أنها ستبقى على اتصال مع حلول لمدة التجربة.
- ختم الأسلاك في برميل باستخدام الشمع الساخن الأسنان. التعشيق بلطف t انه الأسلاك عن طريق التواء لهم حول بعضها البعض (الانتهاء ميكرولكترود هو مبين في الشكل 4B ).
الشكل 4: إعداد الرحلان الشاردي ميكرولكترود. ( أ ) الرحلان الشاردي ميكرولكترود بعد الردم كلا برميلين (الخطوات 4،1-4،3): يتم سحبها ميكرولكترود الشريان الديودي من أنبوب شعري. يتم تقطيع غيض من ميكرولكترود إلى قطر 2-5 ميكرون. كل من برميل من ميكرولكترود الرحلان الشاردي مليئة حل تما-كل. ( ب ) الانتهاء الرحلان الشاردي ميكرولكترود (الخطوات 4،5-4،6): ميكرولكترود الرحلان الشاردي مع اثنين من أسلاك الفضة كلوريديزد إدراجها في برميل. يتم ختم برميل من ميكرولكترود مع الشمع، والأسلاك الفضية هي الملتوية معا في الجزء الخلفي من ميكرولكترود./files/ftp_upload/55755/55755fig4large.jpg "تارجيت =" _ بلانك "> الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. إعداد السوائل النخاعية الاصطناعية والقضيب شرائح الأنسجة الدماغ
- إعداد 1 لتر من السائل النخاعي الاصطناعي (أسف) مع تركيبة مناسبة للتجربة وإضافة 0.5 ملي تما-كل لذلك.
ملاحظة: و تما-كل ضروري لإنشاء تركيز الخلفية من تما خلال التجربة. - إعداد شرائح الدماغ القوارض بسمك 400 ميكرون وفقا لبروتوكولات القياسية 11 ، 12 . استخدام أسف أعدت في الخطوة 5.1 لتشريح وصيانة شرائح الدماغ.
6. الرحلان الشاردي في الوقت الحقيقي في أغاروس
- تشغيل الكمبيوتر تشغيل برامج والتر واندا.
ملاحظة: هذه البرامج متاحة بحرية عند الطلب. في حين أن هذا البرنامج ليس أساسيا، برمجة مماثلةوالبرمجيات أو إجراء التحليل باليد سيكون مطلوبا خلاف ذلك. - تشغيل أسف من خلال غرفة الغمر بمعدل مناسب (على سبيل المثال، 2 مل / دقيقة). ضبط درجة الحرارة إلى درجة الحرارة المطلوبة و أسف فقاعة مع 95٪ O 2 /5٪ كو 2 (أو آخر خليط الغاز المناسب) لمدة التجربة.
- جبل غير مبال (الأرض) القطب في حامل مناسب وغمر غيض في أسف يمر من خلال غرفة الغمر. توصيل السلك إلى الأرض من إعداد التسجيل.
- ملء كوب يسهل اختراقها (المحرز في الخطوة 1.7) مع الاغاروز 0.3٪ أعدت سابقا ووضعه في غرفة الغمر. تأكد من أن الحل لا يعمل فوق الجزء العلوي من الكأس.
- تأمين إيسم معايرة إلى حامل ماصة من ميكرومانيبولاتور و ميكرولكترود الرحلان الشاردي إلى الثانية. تعيين أصحاب إلى زاوية مناسبة للإعداد ( الشكل 5A ).
- الاتصالو إيسم و الرحلان الشاردي ميكرولكترود الأسلاك إلى مراحل رأس كل منها من مكبر للصوت تسجيل. بدلا من ذلك، الاتصال مباشرة إلى مكبر للصوت (اعتمادا على الإعداد).
- تأكد من أن الوزن / المواقع من الأسلاك أو مقاطع ربط لا يسبب أي حركة من ميكرولترودس، كما تقلبات صغيرة في تحديد المواقع يمكن أن تؤثر على النتائج.
- بدوره على الإعداد الإلكتروني (من الخطوة 2). بدء والتر واندا في حالات منفصلة.
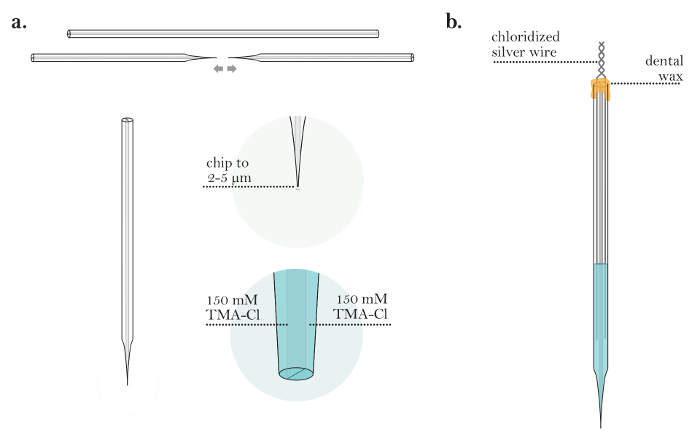
- في واجهة المستخدم الرسومية واندا، انقر فوق "معايرة" ( الشكل 6A ). في مربع المعايرة ( الشكل 6B )، وملء الفولتية قياس خلال المعايرة إيسم (الخطوة 3.29) وانقر على "صالح البيانات".
ملاحظة: هذا يتيح تركيب التمثيل التالي للمعادلة نيكولسكي (بدلا من ذلك تناسب المعادلة بوسائل أخرى للحصول على M و K ):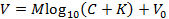
لهاه، V هو الجهد المقاس (مف)، M هو منحدر نيكولسكي (مف)، C هو تركيز أيون (مم)، K هو التدخل (مم)، و V 0 هو الجهد الإزاحة (مف) 3 . - انقر فوق "قبول" في المربع معايرة لنقل تلقائيا المنحدر ( M ) والتداخل ( K ) التي تم إنشاؤها في الخطوة 6.9 إلى واجهة المستخدم الرسومية الرئيسية.
ملاحظة: هنا، يمثل K تدخل نا، وهو عادة لا يكاد يذكر. - على الجانب الأيسر من واجهة المستخدم الرسومية، تأكد من تعيين كافة المعلمات التجريبية في الإدخالات المقابلة ( الشكل 6A ).
- في المربع "طريقة المصدر"، قم بتعيين المصدر إلى مصدر الإيونتوفوريتيك (الافتراضي)، و "مدة التسجيل" إلى "200 ثانية" (افتراضي)، و "نبض بيجين" إلى "10 ثانية" (افتراضي)، و "بولز إند" إلى "60 ثانية" (الافتراضي)، "التحيز الحالي" إلى "20 نا" (الافتراضي)، و"التيار الرئيسي" إلى "100 نا" (الافتراضي)، و "عامل التحويل" إلى قيمة مناسبة.
- في مربع قياس القطب، تعيين "حمام ج" إلى تركيز تما الواردة داخل الحل حمام (أعرب في ملي). تعيين "إجمالي الربح"، "قناة الانتاج"، "قناة إيسم"، و "المرجع القناة" إلى القيم المناسبة لنظام الحصول على البيانات قيد الاستخدام.
ملاحظة: "عامل التحويل" يجب تعيين إلى قيمة مناسبة (محددة إلى وحدة يونتوفوريتيك قيد الاستخدام). تحدد هذه القيمة مقدار التيار الذي تم تمريره لجهد مطبق معين من محول D / A (نا / مف).
- ضع مسبار درجة الحرارة في كوب أجار. تسجيل درجة الحرارة المقاسة في "درجة الحرارة" دخول في "قياس القطب" مربع من واجهة المستخدم الرسومية ( الشكل 6A ).
- بدوره على إضاءة المرحلة الفرعية. إذا لزم الأمر، قم بتشغيل الكاميرا المرفقة بالميكروفونالجيروسكوب وكاميرا مراقبة.
- خفض ميكرولترودس 1000 ميكرون على الأقل في عمق الاغاروز ومركز لهم في الكأس ( الشكل 5B ). تصور لهم تحت المجهر باستخدام هدف 10X (الماء الغمر الهدف مع مسافة العمل الطويلة).
- إزاحة الجهد على مكبر للصوت إلى 0 مف لكل من المرجعية وقنوات إيسم من أجل إنشاء الجهد المسجل في الاغاروز كجهد خط الأساس.
- على مكبر للصوت ثنائي القناة، يدويا نقل موصل قناة إيسم إلى إخراج الطرح الجهد لضبط الطرح 'على' بين المرجعية وقنوات إيسم.
ملاحظة: الطرح يضمن أن التغييرات الجهد في قناة إيسم تعكس التغييرات في تركيز تما وحدها. - نقل إيسم بحيث يلمس غيض من ميكرولكترود الرحلان الشاردي. مركز نصائح على بعضها البعض في جميع المحاور الاتجاه الثلاثة.
- صفر المواقف النسبية لكل من ميكرولتروديس علىميكرومانيبولاتور صناديق التحكم. تأكد من أن تتمركز ميكرولتروديس بدقة وبدقة (الحرجة).
- نقل إيسم 120 ميكرون بعيدا عن ميكرولكترود الرحلان الشاردي في محور واحد (محور اليسار واليمين، الشكل 5B ). إدخال هذه المسافة في "قياس القطب" مربع من واجهة المستخدم الرسومية ( الشكل 6A ).
- بدء تسجيل عن طريق النقر على "اكتساب" في واجهة المستخدم الرسومية ( الشكل 6A ). السماح للبرنامج لتسجيل تسجيل كامل.
ملاحظة: ميكرولكترود الرحلان الشاردي يتلقى تيار التحيز المستمر. بعد النقر على "اكتساب"، هناك تأخير قصير قبل تطبيق التيار الرئيسي لفترة محدودة. - كرر الخطوة 6.20 مرتين إلى ثلاث مرات أخرى. انتظر حتى ترجع إشارة تما إلى خط الأساس قبل الحصول على سجلات جديدة. فإن البرنامج حفظ كل سجل للتحليل في وقت لاحق.
- تحقق تباعد اثنين من ميكرولترودس عن طريق تحريك إيسم مرة أخرى رo الموضع الصفر المحدد بواسطة مربع التحكم. إذا لم تعد تركز ميكرولتروديس، مركز لهم مرة أخرى باستخدام نفس الاستراتيجية كما في الخطوة 6.17. تسجيل أي تغييرات في موقف الأقطاب.
ملاحظة: إذا تغير التباعد بأكثر من حوالي 2٪، فإن السجلات المكتسبة في الخطوة 6.19 لا يمكن اعتبارها دقيقة ويجب أن تؤخذ جديدة.

الشكل 5: الإعداد للتجارب في أغار. ( أ ) الإعداد لتجربة في أجار مخفف (الخطوات 6.1-6.5): وعاء مسامية صغيرة مليئة أجار مخفف وضعت في غرفة نضح تشغيل. ويحتفظ ميكرولكترود الرحلان الشاردي (الجانب الأيسر) و إيسم (الجانب الأيمن) من قبل أصحاب ميكرولكترود. يتم تركيب أصحاب ميكرولكترود في الأسلحة من ميكرومانيبولاتورس الروبوتية. يتم وضع مسبار درجة الحرارة في هلام أجار، والقطب الأرض غير مبال هو بلأسد داخل غرفة الغمر. ( ب ) عرض مكبرة من ميكرولكتروديس في أجار: يتم تصوير ميكرولكترود الرحلان الشاردي (الجانب الأيسر) و إيسم (الجانب الأيمن) في أجار باستخدام هدف غمر الماء 10X (الهدف مغمورة هنا في 150 ملي كلوريد الصوديوم). يتم وضع ميكرولكترودس باستخدام ميكرومانيبولاتورس إلى عمق 1000 ميكرون. وتباعد بين ميكرولترودس هو 120 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: واندا واجهة برامج الكمبيوتر. ( أ ) التنقل واندا واجهة المستخدم الرسومية (غوي): الشاشة التي تظهر بعد فتح برنامج واندا. في المربع (1)، يتم اختيار المتوسطة المناسبة، جزيء الرحلان الشاردي، وتقنية. (2) يتم النقر على "معايرة" لفتحمربع المعايرة واندا. بعد معايرة إيسم (انظر الشكل 6 ب والملحق ب)، يتم وضع إيسم في أجار أو الدماغ، كما هو موضح في الخطوتين 6 و 8 من البروتوكول. في المربع (6)، يتم إدخال جميع القيم المناسبة للتجربة التي يتم تنفيذها. (7) يتم النقر "اكتساب" لأخذ تسجيل. يظهر الرسم البياني للجهد مقابل الوقت في الجزء العلوي الأيمن من واجهة المستخدم الرسومية واندا. ( ب ) معايرة إيسم في واندا : النافذة التي تفتح بعد النقر على (2) "معايرة" في واجهة المستخدم الرسومية واندا. يتم إدخال القيم من الخطوة 3.29 في المربع (3)، و (4) يتم تحديد "فيت البيانات". ومن المؤكد أن منحنى المعايرة خطية. (5) يتم قبول "قبول" للعودة إلى واجهة المستخدم الرسومية واندا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
7. أغاروس تحليل البيانات
- افتح البرنامج والتر على الكمبيوتر (بيسي). في "0. السجلات من:" القائمة، انقر فوق زر "واندا / فولتورو" لقراءة السجلات التي تم إنشاؤها من قبل واندا ( الشكل 7A ) .Assuming أن الإخراج إلى جدول بيانات مطلوب، وفتح البرنامج المناسب. انقر فوق "ورقة 1،3" في "1. كتابة إكسيل؟" القائمة ( الشكل 7B ).
- في النافذة المنبثقة التالية، حدد السجل (السجلات) المطلوب قراءتها وانقر على "فتح" ( الشكل 7 ب )؛ لاحظ أن السجلات سوف تكون الرسوم البيانية تلقائيا. لبدء إجراء التثبيت، قم بتنفيذ الخطوات التالية.
- في القائمة "2. خيارات"، انقر على زر "حدد ريك". في " الشكل 2 " نافذة منبثقة، استخدم الماوس لتحريك مرمى على السجل الأول ليتم معالجتها ( الشكل 7C ). اضغط على زر الماوس إما لاختيار السجل.
- انقر فوق on "منحنى مناسب" في القائمة. حدد العدد المطلوب من التكرارات من المناسب. استخدام ما لا يقل عن 20 تكرار من المناسب للحصول على تناسب دقيق للبيانات.
- في القائمة، حدد "الكل" لتناسب جميع نقاط البيانات وحدد "متابعة؛" البرنامج سوف تناسب المنحنى المعروضة. مراقبة الإجراء المناسب ومقارنة السجل التجريبي مع أفضل منحنى المجهزة التي تم الحصول عليها.
- حدد الخيار لكتابة النتيجة إلى برنامج جدول البيانات المناسب عن طريق النقر على "إكسيل" في القائمة "7. النتائج" ( الشكل 7D ). ملاحظة (وتسجيل) البيانات الهامة التالية التي سيتم استخدامها لتحديد وظيفة ميكرولكترود الرحلان الشاردي: ' D (E5) '، ' مرجع D (E5) '، ' r_app '، رقم النقل ' ن ر '، ' يبدو n t '.
ملاحظة: " D (E5) ": قياس معامل الانتشار الحرتكس 10 5 (سم 2 / s)؛ " المرجع D (E5) ": معامل الانتشار الحر النظري x 10 5 (سم 2 / s). يتم استخراج هذه القيمة من قاعدة بيانات داخل والتر استنادا إلى أيون، والمتوسطة، ودرجة الحرارة المدخلات. " r_app ": تباعد ميكرولكترود واضح (سم)، وتحسب على أساس قياس والمرجعية D (E5) . " n t ": رقم النقل (بلا أبعاد). هذا الرقم يحدد جزء من تيار الرحلان الشاردي التي يتم استخدامها لاطلاق سراح تما 4 . " واضح ن ر ": رقم النقل الظاهري (بلا أبعاد). هذا هو رقم النقل المحسوب من r_app . وينبغي أن يكون هذا الرقم قريبا من المقياس n t . - كرر الخطوات 7،1-7،3 لكل من السجلات لزوج المختار من ميكرولتروديس.
- تحديد ما إذا كان ميكرولكترود الرحلان الشاردي قابلة للاستخدام عن طريق القيام بما يلي.
- قارن " r_app" مع r الفعلية ( أي 120 ميكرون)؛ يتم استيفاء هذا المعيار إذا كان متوسط القيم من جميع التجارب في حدود 4٪ من بعضها البعض.
- قارن " D (E5)" بالمرجع D (E5) ؛ يتم استيفاء هذا المعيار إذا كانت القيم المتوسطة من جميع التجارب ضمن 8٪ من بعضها البعض.
- قارن " ن ر " بين التجارب مع نفس ميكرولكترود. يتم استيفاء هذا المعيار إذا كان متوسط القيم من جميع التجارب ضمن 10٪ من بعضها البعض.
- إذا لم يتم الوفاء أحد المعايير من الخطوة 7.5، استكشاف ميكرولكترود الرحلان الشاردي أو بدء اختبار واحد آخر.
- إذا تم اعتبار ميكرولكترود الرحلان الشاردي مناسبة للتجربة، سجل متوسط عدد النقل من جميع التجارب في حقل "النقل N N" في واجهة المستخدم الرسومية واندا ( الشكل 6A ).
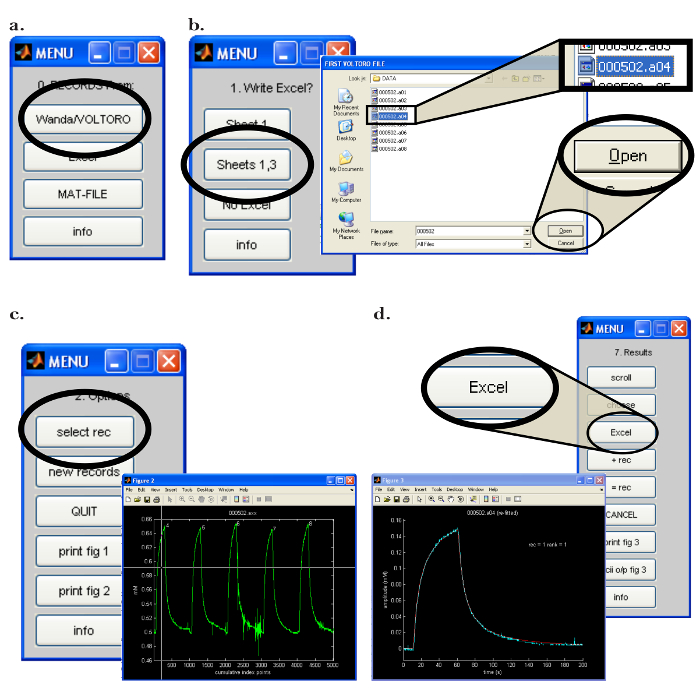
الشكل 7: والتر واجهة برامج الكمبيوتر. ( أ ) اختيار برنامج جمع البيانات في والتر: "0. السجلات من:" القائمة تفتح بعد بدء تشغيل برنامج والتر. يتم اختيار الخيار لتحميل السجلات المحفوظة من قبل واندا عن طريق النقر على زر "واندا / فولتورو". ( ب ) اختيار موقع البيانات وتحليل بيانات الإنتاج في والتر: [يسار] بعد فتح برنامج جداول البيانات المناسب، يتم اختيار "جداول 1،3" لإخراج جميع تحليل بيانات والتر لبرنامج جداول البيانات الذي تم فتحه سابقا. [رايت] بعد اختيار موقع إخراج تحليل البيانات، يتم فتح نافذة منبثقة، مما يتيح للمستخدم اختيار التسجيلات الأولى والأخيرة ليتم قراءتها من قبل والتر. ( ج ) اختيار التسجيل للتحليل في والتر: [يمين] بعد اختيار الملفات التي سيتم قراءتها، سيتم فتح نافذة منبثقة مع جميع السجلات المختارة ديسلعبت كرسم بياني (" الشكل 2 "). [يسار] في "2.Options" القائمة، "حدد ريك" يتم النقر، ويتم استخدام الماوس لتحريك مرمى لتحديد أول تسجيل للتحليل. إما الضغط على زر الماوس لاختيار التسجيل. ( د ) تصدير تحليل البيانات من والتر إلى جدول بيانات: بعد تركيب البيانات، تظهر نافذة منبثقة وقائمة "7. النتائج". [يسار] الرسم البياني للتسجيل المحدد (الأزرق) مع منحنى نشر المجهزة التي تم إنشاؤها بواسطة والتر (الأحمر). [رايت] و "7. النتائج" القائمة تسمح للمستخدم لكتابة البيانات من التحليل إلى برنامج جدول البيانات عن طريق النقر على زر "إكسل". الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
8. الرحلان الشاردي في الوقت الحقيقي في شرائح الدماغ
- وضع 400 ميكرون سميكة ث الدماغالقمل في غرفة التسجيل، وضمان أنه مغمورة تماما في أسف المتدفقة. وضع شريحة باستخدام فرشاة الطلاء بالألوان المائية وتأمينه بلطف مع الشبكة.
- نقل كل من ميكرولكترود الرحلان الشاردي و إيسم فوق مجال الاهتمام على شريحة الدماغ. تغمر على حد سواء في أسف المتدفقة ولكن فوق شريحة.
- إزاحة الجهد لكلا المرجعية وقنوات الاستشعار الأيونية إلى "0" مف. انتظر الجهد في كل القنوات لتحقيق الاستقرار. على مسجل الرسم البياني، بمناسبة الجهد قياسها على قناة الاستشعار أيون من إيسم. استخدم هذا لحساب المعلمة الأساسية V في واندا.
- وضع إيسم والرحلان الشاردي ميكرولكترود 200 ميكرون عميقة في شريحة و 120 ميكرون بعيدا عن بعضها البعض. انتظر لتحقيق الاستقرار في إشارة بعد تحريك ميكرولكترود في شريحة الدماغ.
ملاحظة: التيار التحيز تطبيقها على ميكرولكترود الرحلان الشاردي يسبب تراكم صغير من تما. فمن الخطأ الشائع أن تأخذ أروسرعان ما سرعان ما استخفت بتراكم الإشارة. - على مسجل الرسم البياني، بمناسبة الجهد استقرت تقاس في شريحة الدماغ على قناة أيون الاستشعار عن إيسم. حساب الفرق الجهد بين إشارة تما يقاس في الخطوة 8.3 والخطوة 8.4 وإدخال هذه القيمة في حقل "خط الأساس الخامس (مف)" في مربع قياس القطب من واجهة المستخدم الرسومية واندا ( الشكل 6A ).
- على الجانب الأيسر من واجهة المستخدم الرسومية، تأكد من تسجيل جميع المعلمات التجريبية / إدخالها بشكل صحيح. تعيين "المتوسطة" إلى "الدماغ"، "رقم النقل" إلى متوسط القيمة المحسوبة ل ميكرولكترود الرحلان الشاردي في الخطوة 7.4، و "درجة الحرارة" لدرجة حرارة الحمام التي تحتوي على شريحة.
ملاحظة: يجب تسجيل V لكل مجموعة من القياسات. سيتم تحويل خط الأساس الخامس من قبل واندا إلى المعلمة الأساسية C (مم) ( أي تركيز تما في أنسجة المخ). - بدء التسجيل عن طريق النقر على "اكتساب" والسماح لها أن تأخذ تسجيل كامل. انتظر حتى تعود إشارة تما إلى خط الأساس قبل الحصول على تسجيل جديد.
- تأخذ 2-3 التسجيلات المتعاقبة قبل إزالة ميكرولكتروديس من موقع الدماغ المختار. إدخال درجة الحرارة تقاس في برنامج واندا مباشرة قبل كل تسجيل.
- نقل كل من ميكرولترودس قطريا مرة أخرى إلى سطح الشريحة. رفع كلا إلى 50 ميكرون على الأقل فوق شريحة. باستخدام مسجل الرسم البياني، وتحديد أي تغيير بين V قياس الآن وقياسها من الخطوة 8.3.
- مركز نصائح إيسم و ميكرولكتروديس يونتوفوريتيك النسبية بعضها البعض في x-، y-، و z-- محاور. الحصول على تغييرات التباعد، إن وجدت، من عرض مربع التحكم ميكرومانيبولاتور.
9. تحليل البيانات الدماغ
- افتح جدول بيانات جديد لمخرجات التحليل.
- كرر الخطوات 7،1-7،4 في والتر للتحليله التسجيلات المأخوذة من الدماغ.
- اكتب البيانات على برنامج جدول البيانات بالنقر على "إكسيل" في قائمة والتر. تسجيل α ، حجم جزء من إكس الدماغ. λ ، تورتوسي من الدماغ إكس. و k (s -1 )، وإزالة غير محددة.
10. فحص رقم النقل ومعيار إيسم
- قياس رقم النقل إيسم ( ن ر ) في نهاية التجربة باستخدام البروتوكول أدناه. بدلا من ذلك، تحقق ن ر بعد محاكمات الحرجة أو عندما القياسات تظهر الشاذة. ومع ذلك، يمكن فحص ن ر مرات عديدة جدا يؤدي إلى صدمة لشريحة الدماغ.
- أخذ تسجيلات جديدة في الاغاروز. راجع الخطوات 6.4 و 6.11 و 6.12 و 6.14 و 6.15 و 6.17-6.22.
- كرر الخطوات 7،1-7،4 في والتر للحصول على n ر من التسجيلات الاغاروز الجديدة. فحص جدول البيانات: إذا كان n ر قد تغير أكثر من ذلكمن 10٪ من ن ر تم الحصول عليها قبل قياسات الدماغ، والبيانات التي تم الحصول عليها مع هذا ميكرولكترود اليونتوفوريتيك ليست موثوقة.
- إجراء معايرة جديدة (انظر الخطوة 3.29) ل إيسم بعد جمع كافة بيانات الدماغ. استخدام بيانات المعايرة إيسم التي تم الحصول عليها حديثا كمدخل في مربع واندا معايرة (انظر الخطوات 6.9 و 6.10) والتحقق من أن قيمة المنحدر يختلف أقل من 10٪ من المعايرة السابقة.
ملاحظة: البيانات التي تم الحصول عليها مع هذا إيسم غير موثوق بها إذا كانت قيمة المنحدر تختلف بأكثر من 10٪ من المعايرة السابقة.
Access restricted. Please log in or start a trial to view this content.
النتائج
ويتجلى فائدة تقنية رتي في تجربة مصممة لقياس التغيرات في α وخلال تحدي هايبوسمولار ( الشكل 8 والشكل 9 ). وقد تبين سابقا أن تقليل الأسمولية من إكس عن طريق الغسيل على أسف منخفض التوتر سيؤدي إلى انخفاض في α وزيادة ف...
Access restricted. Please log in or start a trial to view this content.
Discussion
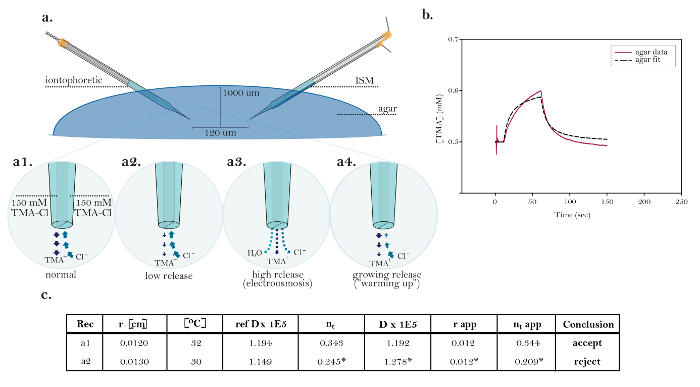
الشكل 10: البيانات غير المثالية التي تبين القضايا التقنية المشتركة. ( أ ) الرسوم البيانية من القضايا التقنية المشتركة مع ميكرولترودس الرحلان الشاردي: مقارنة الإفراج العادي من تما من ميكرولكترود الش...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
وأيد العمل من قبل المعاهد الوطنية للصحة نيندس منحة R01 NS047557.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
References
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved