Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Beyin Ekstraselüler Alanının Hacim Fraksiyonu ve Kıvrımını Nicelleştirmek için Tetrametilamonyum ile Gerçek Zamanlı İyontoforez
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, canlı beyinlerin hücre dışı alanının (ECS) fiziksel parametrelerini ölçen bir yöntem olan gerçek zamanlı iyontoforez'i tanımlamaktadır. ECS hacim fraksiyonunu ve kıvırcıklığı hesaplamak için, ECS'ye salınan atıl bir molekülün difüzyonu kullanılır. Beyindeki ECS'de akut geri dönüşümlü değişikliklerin incelenmesi için idealdir.
Özet
Bu derlemede, yaşayan beynin hücre dışı alanını (ECS) araştırmak ve ölçmek için altın standart olan gerçek zamanlı iyontoforez (RTI) yöntemini gerçekleştirmek için temel kavramlar ve protokol açıklanmaktadır. ECS tüm beyin hücrelerini çevreler ve hem interstisyel sıvı hem de hücre dışı matris içerir. Nörotransmitterler, hormonlar ve besinler dahil olmak üzere beyin aktivitesi için gerekli olan birçok maddenin taşınması, ECS yoluyla difüzyon yoluyla gerçekleşir. Bu alanın hacmi ve geometrisindeki değişiklikler, uyku gibi normal beyin süreçleri ve iskemi gibi patolojik koşullar sırasında ortaya çıkar. Bununla birlikte, özellikle hastalıklı ülkelerdeki beyin ECS'sinin yapısı ve düzenlenmesi, büyük ölçüde keşfedilmemiş olarak kalmaktadır. RTI yöntemi canlı beyindeki iki fiziksel parametreyi ölçer: hacim fraksiyonu ve kıvırcıklık. Hacim fraksiyonu, ECS tarafından işgal edilen doku hacminin oranıdır. Kıvrımlanma, bir maddenin bir beyin yoluyla difüze ederken karşılaştığı göreli engelin bir ölçüsüdür.Engelsiz bir ortamla karşılaştırıldığında. RTI'de, atıl bir molekül, bir kaynak mikro elektrottan beyin ECS'ye palslanır. Moleküller bu kaynaktan uzaklaştıkça, iyonun değişen konsantrasyonu, yaklaşık olarak 100 um uzaklığa yerleştirilmiş bir iyon seçici mikroelektrod kullanarak zamana göre ölçülür. Elde edilen difüzyon eğrisinden hacim fraksiyonu ve kıvrımlılık hesaplanabilir. Bu teknik, birden fazla türün (insan dahil) beyin dilimlerinde ve in vivo olarak ECS'de akut ve kronik değişiklikler üzerinde çalışılmıştır. Diğer yöntemlerin aksine, RTI, gerçek zamanlı olarak beyindeki ECS'de geri döndürülebilir ve geri dönüşü olmayan değişiklikleri incelemek için kullanılabilir.
Giriş
Ekstrasellüler boşluk (ECS), tüm beyin hücrelerinin dışındaki birbirine bağlı kanalların ağıdır ve hem interstisyel sıvı hem de hücre dışı matris içerir ( Şekil 1a ve Şekil 1b ). Besin maddeleri, hormonlar ve nörotransmitterler de dahil olmak üzere beyin hücresi fonksiyonu için gerekli birçok maddenin dağılımı ECS yoluyla difüzyon yoluyla gerçekleşir. Hacim, geometri ve hücre dışı matris de dahil olmak üzere bu alanın fiziksel parametrelerindeki değişiklikler, beyin hücresi fonksiyonu 1 , 2 üzerinde derin bir etkisi olan beyin hücrelerini içine alan ECS ve yerel iyon konsantrasyonları ile difüzyonu önemli ölçüde etkileyebilir.
Bir beyin bölgesinin iki yapısal özelliğini belirlemek için gerçek zamanlı iyontoforez (RTI) kullanılır: hacim fraksiyonu ve kıvırcıklık 3 , 4 ,"Xref"> 5. Hacim fraksiyonu ( α ), temsili bir temel hacimdeki toplam doku hacmine ( V doku ) göre ECS tarafından işgal edilen doku hacminin ( V ECS ) oranıdır;
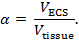
Kıvrılma ( λ ), herhangi bir engel bulunmayan bir ortamla karşılaştırıldığında, bir maddenin beyin bölgesi boyunca difüze ederken karşılaştığı göreli engeldir;

Burada D * (cm 2 s -1 ), maddenin beyindeki etkin difüzyon katsayısıdır ve D (cm 2 s -1 ), maddenin seyreltilmiş agaroz jel gibi bir serbest ortamdaki serbest difüzyon katsayısıdır.
Bugün, R için en çok kullanılan prob maddesiTI yöntemi, küçük katyon tetrametilamonyumdur (TMA). TMA, 74 g / mol'lük bir moleküler ağırlığa sahiptir, çözeltide tamamen ayrışır ve bir pozitif yüke sahiptir. RTI iyonu ile yapılan çalışmalar, α  0.2 ve λ
0.2 ve λ  1.6 1 , 2 . Bu, ECS toplam beyin hacminin kabaca% 20'sidir ve küçük, inert bir molekülün difüzyonunun, ECS'de engeller olmadan bir ortamdan yaklaşık 2.5 kat daha yavaş gerçekleştiği anlamına gelir 3 . Bununla birlikte hem α hem de λ , beyin yaşı, bölge ve durumuna ve patolojik koşullara göre değişir 1 . Bu parametrelerin değişimleri beyin gelişimi, yaşlanma, uyku, epilepsi ve beynin diğer birçok temel süreci ve hastalığı ile bağlantılıdır 1, 6 . Diğer teknikler α ve λ değerlerini ölçmekle birlikte , RTI, gerçek zamanda canlı doku lokalize bölgelerinde hem de ölçebilir. Bu nedenle, RTI, akut ve geri dönüşümlü zorluklar sırasında α ve λ'daki değişiklikleri araştırmak için vazgeçilmez bir araç haline gelmiştir.
1.6 1 , 2 . Bu, ECS toplam beyin hacminin kabaca% 20'sidir ve küçük, inert bir molekülün difüzyonunun, ECS'de engeller olmadan bir ortamdan yaklaşık 2.5 kat daha yavaş gerçekleştiği anlamına gelir 3 . Bununla birlikte hem α hem de λ , beyin yaşı, bölge ve durumuna ve patolojik koşullara göre değişir 1 . Bu parametrelerin değişimleri beyin gelişimi, yaşlanma, uyku, epilepsi ve beynin diğer birçok temel süreci ve hastalığı ile bağlantılıdır 1, 6 . Diğer teknikler α ve λ değerlerini ölçmekle birlikte , RTI, gerçek zamanda canlı doku lokalize bölgelerinde hem de ölçebilir. Bu nedenle, RTI, akut ve geri dönüşümlü zorluklar sırasında α ve λ'daki değişiklikleri araştırmak için vazgeçilmez bir araç haline gelmiştir.
RTI destek teori başlangıçta Nicholson ve Phillips tarafından doğrulandı ve teknik o zaman 4, 7 beri yaygın olarak kullanılmaktadır. RTI'yi kullanan deneyler, bir kaynak mikroelektrodundan İyontoforez ile bir seyreltilmiş agaroz jeline TMA darbesinin salınması ile başlar. Bir kez atılırsa, iyonlar potansiyel olarak sonsuz sayıda rastgele yol seçerek nokta kaynağından serbestçe dağılırlar ( Şekil 1d ). İyonun değişen konsantrasyonu, kabaca konumlandırılmış bir iyon seçici mikro elektrot (ISM) kullanılarak zaman içinde ölçülür100 um uzakta ( Şekil lc ). TMA konsantrasyonundaki değişiklikler, hem D'yi hem de iyonforez mikroelektrodunun taşıma numarasını (Protokol'de tartışılan parametreleri) hesaplamaya olanak tanıyan bir eğride gösterilir. Bu değerler ile, D * elde etmek ve hem α hem de λ hesaplamak için prosedür beyin bölgelerinde tekrarlanır. İyontoforez mikroelektrodunun kontrolü, veri toplama, TMA konsantrasyon eğrisinin grafiklenmesi ve uyumu ve deneysel parametrelerin hesaplanması, tipik olarak bu amaç için tasarlanmış Wanda ve Walter programları tarafından yapılır (yazılım ve kılavuzları şunlardır: Istek üzerine yazarlar tarafından ücretsiz olarak temin edilebilir).
Bu derlemenin Protokol bölümü, kemirgen beyin dilimlerini RTI'yi tasarlamak ve gerçekleştirmek için gerekli olan temel işlemleri anlatmaktadır. Teknik, aynı zamanda çubuk olmayan çubuktaInsan beyni dilimleri ve in vivo beyin preparatları dahil 1 , 4 , 6 , 8 , 9 modelleri. Temsilci Sonuçlar bölümü, veri yorumlamadaki nüansları vurgulamak için hem ideal hem de ideal olmayan sonuçlar sunar. Son olarak, Tartışma bölümü, sorun giderme teknikleri, RTI sınırlamaları, ECS'yi incelemek için kullanılan alternatif teknikler ve RTI'nin gelecekteki uygulamaları kısaca anlatılmaktadır.

Şekil 1: ECS aracılığıyla Difüzyon Diyagramları. ( A ) ECS Diyagramı: Tipik bir beyin bölümünde ECS'nin boyut ve yerini gösterir. Sarı, gri beyin hücresi süreçleri arasındaki ECS'yi işaretler. ECS hacmi, toplam doku hacminin kabaca% 20'sidir ( yani, hacim fraksiyonu = 0.2) fizyolojik koşullar altında. ( B ) ECS'nin büyütülmüş şeması: Beyin hücresi geometrisi (gri) ve hücre dışı matris (çok renkli glikozaminoglikanlar ve proteoglikanlardan oluşan bir örgü şeklinde diyagramlanmış) dahil olmak üzere kıvırcıklığa neden olan fiziksel parametreleri vurgulamaktadır. ( C ) Nokta kaynağından difüzyonun 3D diyagramı: İyontoforetik bir kaynaktan bir ISM'ye atıl moleküllerin net hareketi gösterir. Difüzyon bariyerleri ve hücresel alımını hariç tutarak, moleküller her yöne doğru dışarı doğru yayılır, bu da küresel bir konsantrasyon önü üretir. ISM, iyontoforetik kaynaktan salınan atıl moleküllerin yerel konsantrasyonunu nicelendirir. ( D ) Beynin ECS'sinde difüzyonun bilgisayar simülasyonu: [Sol sol] Monte Carlo simülasyonu için kurulum; Yeşil küreler beyin hücresi süreçlerini temsil eder ve kırmızı kros bir nokta kaynağını temsil eder. Bu kurulum, Şekil 1a'da çizilen beyin dokusunu modeller. [Orta resimler] 3 ve6 molekül, rastgele hareketler yaparak beynin hücre dışı alanına yayılırken, 2 boyutta gösterilir. [Sağ-sağ] Noktasal kaynaktan salınan birçok molekülün rastgele yürüyor. Noktasal kaynaktan tüm moleküllerin net hareketi Şekil 1c'de gösterildiği gibi dışarıya doğrudur . Kümülatif rasgele yürüyüşler, hücreler arasındaki boşlukları ( yani, ECS, daha fazla açıklama için referans 5'e bakınız) özetler. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Protokol
Doku örnekleri almak için kullanılan tüm hayvan işlemleri, SUNY Downstate Tıp Merkezi'ndeki hayvan etiği komitesince onaylandı.
1. Çözümlerin ve Ekipmanların Hazırlanması
- ISM referans varil için 150 mM NaCl dolgu çözeltisi hazırlayın. 0.22 μm'lik bir filtreye (bakteri veya partikülleri çıkarmak için) bağlı 10 mL şırınga içine saklayın.
- Mikroelektrodlar için 150 mM TMA klorür (TMA-Cl) doldurma çözeltisi hazırlayın. 0.22 μm'lik bir filtreye bağlı 10 mL enjektörde saklayın. Doğru konsantrasyonu sağlamak için TMA-Cl solüsyonlarını (bu protokolde) 5 M üretici stok solüsyonundan hazırlayın.
- Mikroelektrodların üretimi için telleri ağartıcı (sodyum hipoklorit) içine enjekte ederek en azından dört gümüş telini en az 2 saat boyunca klorlaştırın. Fazla ağartmayı etanolle çıkarın ve tellerin kurumasına izin verin.
- 50 mL% 0.3 agaroz 150 mM NaCl ve 0.5 mM TMA-Cl içinde bir beher içerisinde hazırlayınVe örtün. İyi difüzyon ölçümleri yapmak için toz haline getirilmiş ve makul derecede taze olan agaroz kullanın.
- Isıtıp çözmek için agaroz çözeltisini bir karıştırma çubuğu ile karıştırın. Çözeltinin oda sıcaklığına soğumasına izin verin. 1 haftaya kadar 4 ° C'de saklayın.
- 1 M KCl'de% 4 agarozdan yapılmış kayıtsız (topraklanmış) bir elektrot hazırlayın (Ek A'daki yönergeler)
- Deneysel odaya sığabilen ve içeriği ile dış ortam arasında elektriksel süreklilik sağlayan küçük, gözenekli bir fincan hazırlayın ( Şekil 2a ). Kısmen suya batırıldığında yüzmesini önlemek için bu kabın altına bir metal halka yerleştirin.
- ISM'lerin kalibrasyonu için beş 100 mL TMA-Cl solüsyonu yapmak için 5 M TMA-Cl stokunun seri seyreltik kullanın. Çözeltilerin nihai konsantrasyonları 0.5, 1, 2, 4 ve 8 mM TMA-Cl, hepsi de 150 mM NaCI olmalıdır. Buharlaşmayı önlemek için kalibrasyon solüsyonlarını kapatılabilir bir kapta saklayın.
2. Elektronik Kurulum
- RTI deney düzeneğinin bileşenlerini Şekil 2b'deki blok diyagrama göre bağlayın; Iki giriş kanallı bir amplifikatör (bunlardan biri ISM'nin iyon seçici namlusu için çok yüksek empedans olmalıdır), 10 Hz'de düşük geçiren bir filtre, bir grafik kaydedici, bir A / D + D / A Dönüştürücü, bir iyontoforetik birim (veya sabit akım darbeleri sağlayabilen bir amplifikatör) ve Wanda ve Walter programlarını çalıştıran bir bilgisayar (PC). Elektronik kurulumu bütün bağlantıların yerinde olduğundan emin olmak için inceleyin.
- ISM'ler yüksek dirençli oldukları ve yakınlardaki hareket tarafından yaratılan eserlere duyarlı oldukları için, deney düzeneğini topraklı bir muhafaza (örn. Faraday kafesi) içinde kalkanlayın.
- Çift girişli amplifikatör, grafik kaydedici, uygun bir ISM tutacağı ve ilgisiz bir toprak elektrodundan oluşan özel bir ISM kalibrasyon istasyonu oluşturun. Eğer mümkünse,Muhafazayı koruyun. Deney düzeneğinde ISM'ler kalibre ediliyorsa bu adımı atlayın (adım 3.29)

Şekil 2: Gözenekli Deneysel Kupa ve Elektronik Kurulum. ( A ) gözenekli deneysel fincan: Gözenekli bir ağ, agaroz (iç) ile deneysel banyo sıvısı (dış) arasında elektriksel süreklilik sağlayan deney kabını oluşturmak için kullanılır. Bardağın banyo çözeltisinde yüzmesini önlemek için fincanın altına bir metal halka takılmıştır. ( B ) RTI kurulumunun blok diyagramı (adımlar 2.1 ve 2.2): Bir ISM bir amplifikatöre bağlanır (amp.). ISM'nin iki varili var. Bir tanede sıvı iyon değiştirici (LIX) bulunur ve yerel ortam voltajıyla birlikte uçtaki TMA konsantrasyonunun logaritması ile orantılı bir voltaj üretir; inciE sinyal yolu kırmızı bir çizgi ile gösterilir. ISM'nin diğer varilleri referans barrel olarak bilinir ve ISM'nin ucundaki ortam voltajını ölçer; Mavi bir sinyal yolu ile bağlıdır. Amfikatör, ISM'ye bağlanan iki adlandırılmış baş kademesine sahiptir; Bu birimlerin kazançları 1 (x1) ve mikroelektrodin yüksek empedansını amplifikatör devresinin geri kalanının düşük empedansı ile eşleştirir. İyon seçici namluya bağlı olan kafa sahası, yaklaşık 1.000 MΩ'lık bir giriş direnciyle eşleşebilmelidir, buna karşın referans namlu direnci tipik olarak yaklaşık 10 MΩ'dur. Baş sahnesinden ayrıldıktan sonra, referans namludaki voltaj ters çevrilir ve saf iyon sinyal voltajını elde etmek için bir toplam amplifikatör (Σ) kullanarak iyon seçici namludaki voltajdan çıkarılır. Amplifikatörün çıkışları ilave amplifikasyon ve çok kutuplu bir alçak geçiren filtre (≤10 Hz; tipik olarak bir Bessel fi) sağlayan bir sinyal düzenleyici üniteye geçerLter), gürültüyü ortadan kaldırır ve analogdan dijitale çeviricide (A / D) sinyal aliasingini önler. Filtrenin çıktıları ayrıca bir şerit grafik kaydedicide görüntülenir. A / D dönüştürücü sinyalleri sayısallaştırır ve bir kişisel bilgisayara (PC) gönderir. PC aynı zamanda bir dijital-analog dönüştürücü (D / A) tarafından voltajı sabit genlikteki akım darbesine dönüştüren ve analog türevli voltaj darbesine dönüştürülen dijital bir sinyal üretir İyontoforez mikroelektrine. İyontoforez sinyal yolu yeşil bir çizgi ile gösterilir. Veri toplama ve iyontoforez sinyali, deneyi tanımlayan tüm parametrelerin yanı sıra, voltaja karşı zaman kaydı şeklinde her difüzyon kaydı için bir çıkış dosyası oluşturan Wanda programının kontrolü altındadır. İkinci bir program olan Walter çıktı dosyasını okur ve dijitalize voltajları konsantrasyonlara dönüştürmek için ISM kalibrasyon verilerini kullanır. Konsantrasyon veDaha sonra rsus zaman eğrileri, difüzyon denklemine uygun çözeltiye Walter'a yerleştirilir. Ortam agaroz ise D ve n t çıkarılır ve ortam beyin ise λ ve α ekstrakte edilir. Analog sinyaller düz çizgilerdir; Dijital sinyaller noktalı çizgilerdir. Ayrıca, dilim içeren banyoda kayıtsız bir toprak elektrotu (gösterilmiyor) bulunmaktadır. Kırmızı çizgiler = iyon sinyali, Mavi çizgiler = referans sinyali, Yeşil çizgiler = iontophoresis komutu, Katı çizgiler = analog, Noktalı çizgiler = dijital. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
3. İyon Seçici Mikroelektrodların Hazırlanması ve Kalibrasyonu
- Deneyden bir gün önce aşağıdaki protokolü kullanarak ISM'ler yapın. Deney gününde en az iki çalışmanın yapılmasını sağlamak için ISM'leri gruplar halinde oluşturun.
NOT: Çoğu ISM, bir gün boyunca kararlıdır veyaiki. ISM imalatı nem ve atmosferik koşullara karşı hassastır. Her mikroelektrot başarıyla kalibre edilmez. - Eski bir çift forseps kullanarak çift barrel borosilikat cam kapilerden birinin ucunda kabaca 0,5 cm cam kırın.
- Kılcal ucun karşı ucundaki tek bir namluyu parçalayın ( Şekil 3a ). Septumun hasar görmediğinden emin olun (kritik). Dikkat: Mermi camı nedeniyle yaralanmayı önlemek için gözlük takın.
- Kirleticileri gidermek için kılcal damla en az 1 saat boyunca bir şişe aseton koyun.
- Asetondan kılcal damarları çıkarın ve fazla aseton çıkartmak için temiz, kuru, sıkıştırılmış azot gazı veya hava püskürtün. Kalan aseton silanizasyona (önemli) müdahale edebileceğinden kılcal içindeki tüm asetonu çıkarın.
- Dikey veya yatay çekme makinesinde mikropipetin ucunu üretin. Uzun bir koniklikle bir pipet çekmek için parametreleri ayarlayın veKeskin uç, yaklaşık 1 μm veya daha az çap. Bu adımın sonunda, bir kılcal damar iki pipete çevrilecektir ( Şekil 3a ).
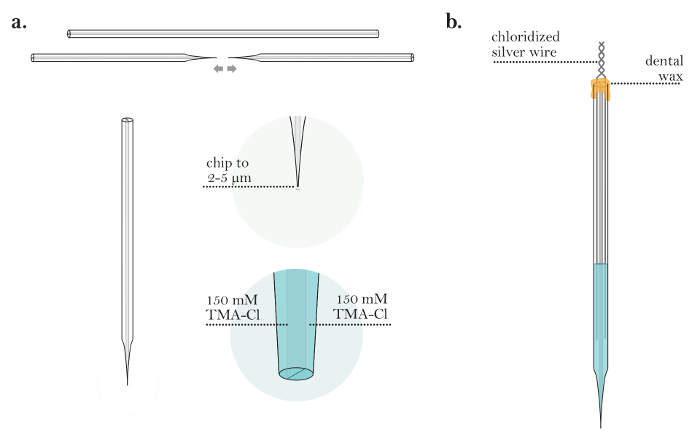
- 10X'lik bir objektifle bileşik, dik bir mikroskop altında tek bir mikropipet görüntüleyin. Uçun son çapı ( yani, her iki fıçı) 2 ila 5 μm arasında olacak şekilde cam mikroskoplu bir slayt kullanarak ucunu kesin ( Şekil 3b ). Bu pipet şu andan itibaren bir ISM olarak anılacaktır.
- 0.22 μm filtre ve 28 G, 97 mm iğne ( Şekil 3b ) bağlı bir 10 mL şırınga kullanarak yontma tarafında açıklık yoluyla 150 mM NaCl referans çözümü ile ISM yontma varil doldurun. Haznenin dördüncü yüksekliğini namluyu doldurmayın.
- ISM'nin yontma yapılmamış varilini 150 mM TMA-Cl dolgu çözeltisi ile doldurun. Herhangi bir hava kabarcıklarını çözeltiden dışarı atmak için ISM'ye hafifçe dokunun. Mikrofonun altındaki kabarcıkları kontrol edinUcu kesmek için kullanılan roskop.
- ISM'nin arkasındaki bölme boyunca dolgu çözeltisiyle iletişim kurulmadığından emin olmak için bir Bunsen brülörü kullanarak ISM'nin arkasını alevleyin. Alevlenmeden sonra ISM'nin en üstteki dörtte birinin kurumasına dikkat edin.
- ISM'nin referans çözeltisine klorlanmış bir gümüş tel yerleştirin ve bunu referans namlusu olarak işaretlemek için kılcaltan çıkıntı yapan teli bükün ( Şekil 3c ). Telin dolgu çözeltisine batırıldığından ve deney süresince çözeltide kaldığından emin olun.
- 25 G'lik bir şırınga iğnesinin ucuna kısa bir polietrafluoroetilen boru hattını (yaklaşık 20 cm uzunluğunda) kaydırın. Borunun diğer ucunu iyon seçici namlu arkasına yerleştirin. Borunun namluda, ancak dolgu çözeltisinin üzerinde olduğundan emin olun ( Şekil 3c ).
- Bir bronz brülör ile bir diş mumu ısısı ısıtın ve hem hortum hem de silviyi kapatın( Şekil 3c ). İyon seçici namluda plastik boru etrafında tam bir hava sızdırmazlığı sağlandığından emin olun (kritik).
- Ksilen içinde% 4 klorotrimetilsilan'dan küçük, saydam bir cam kap (5 mL veya daha az) hazırlayın. Dikkat: Xylene'ler ve silanlar sağlık için çok tehlikelidir; Her iki kimyasalın bir duman davlumbazı içinde ele alınması ve uygun şekilde atılması.
- Kap dondurucuda yatay olarak monte edilmiş bir stereo diseksiyon mikroskopunun önüne yerleştirin. Bir mikromanipülatör kullanarak ISM'yi kabın üzerine dikey olarak sabitleyin ( Şekil 3d ).
- Mikroelektrotun ucunu klorotrimetilsilan çözeltisine daldırın.
- ISM'ye giden 25 gauge iğnesine boş 10 mL'lik bir şırınga takın. TMA-Cl çözeltisinin kabarcığı oluşana kadar pozitif hava basıncını şırınga ile uygulayın; Bu adım mikroskopta doğrudan görselleştirme altında yapılmalıdır.
- Kabarcık ucunu uçlarıyla vurmak için ISM tutacağına hafifçe dokunun.
- 10 mL şırıngayı negatif basınç kullanarak ISM'nin ucuna yaklaşık 1,500 μm'lik bir yüksekliğe klorotrimetilsilan çözeltisi çizin.
- Klorotrimetilsilan solüsyonunu ISM ucundan tamamen uçtan uca TMA-Cl çözeltisi kabarcığı oluşturana kadar dışarı atın ( Şekil 3d ).
- 3.19 ve 3.20 numaralı adımları beş kez tekrarlayın. Her seferinde uca düzgün, kesintisiz bir akışkan sütunun çekildiğinden emin olun. Uça hiçbir çözüm getirilemiyorsa, borunun tıkalı olup olmadığını, hava sızdırmazlığının eksik olup olmadığını veya ISM'nin ucu bloke olup olmadığını kontrol edin.
- TMA-Cl solüsyonu kabarcığı oluşana kadar klorotrimetilsilan solüsyonunun ucundan dışarı doğru yıkayın.
- Şırınga üzerinde pozitif basınç uygularken, ISM'yi ksilen çözeltisinden çıkarın. Fazla ksilenin ekseni mahfeleceğinden, tüm ksilen çözeltisinin ISM ucundan atıldığından emin olunAskı kolonunu sonraki adımlarda yarattı.
- ISM'nin ucunu, TMA için sıvı iyon değiştiricisini (LIX) tutan küçük, şeffaf bir kapta (ya eşanjör geldi ya da küçük bir küvet) yerleştirin. Yatay mikroskop kurulumunu kullanarak doğrudan görselleştirme altında bu adımı uygulayın.
- Az miktarda LIX'ı uça çekmek için az miktarda negatif basınç uygulayın ( yani, LIX uça girdiği görüldüğünde negatif basıncı uygulamayı bırakın).
- 10 mL'lik şırıngayı borudan çıkarın ve ISM'yi 5 dakika bekletin. Bu süre zarfında, LIX, silanize edilmiş ucu, denge durumuna gelene kadar girecek.
- ISM'yi LIX'tan kaldırın. Boruyu eşanjör namlusunun dışına doğru çekin (mümkün olduğunca az mumu alınırken). ISM'nin arka ucunda oluşturulan küçük açıklığa klorlanmış gümüş tel koyun. Telin erimiş balmumu ile eşanjör namlusunun dolguya yapıştırın.
- ISM'nin oturmasına izin verEn az 30 dakika boyunca. Tamamlanmış ISM'leri, herhangi bir esnek, geçici bir yapıştırıcı kullanarak bir beherin içine takın.
- Adım 1.8'de hazırlanan her kalibrasyon çözeltisinde ISM tarafından ölçülen voltajı kaydederek ISM'yi kalibre edin.
NOT: Kalibrasyon bir kalibrasyon istasyonunda (bkz. Adım 2.3) yapılabilir veya deney düzeneğinde gerçekleştirilebilir. Bu prosedür Ek B'de ve Haack ve diğerleri 10'da özetlenmiştir. - ISM kalibrasyonu birden fazla ISM için başarısız olursa, burada amaçlanan kullanım gününe kadar duraklayın. Değilse, daha fazla ISM imal edin.
- Deney günü mikroelektrodu tekrar kalibre edin (bakınız adım 3.29).

Şekil 3: İyon Seçici Bir Mikroelektrodun Hazırlanması. ( A ) Bir kılcalın uçlarını kesip çekerek sonra ISM (adım 3.2-3.6): Her iki ucunda tek bir namlu oFa cam kapiller yontulmuş. Bir ISM, ince ipuçlarıyla iki mikropipet oluşturmak üzere bir çift barrel cam kılcal çekerek üretilir. ( B ) İki fıçı dolumdan sonra ISM (adım 3.7-3.9): Tek bir ISM'nin ucu 2-5 μm çapa yontulur. İyon seçici varil TMA-Cl ile doldurulur ve referans varil NaCl ile doldurulur. ( C ) klorotrimetilsilan ile kaplamadan önceki ISM (basamaklar 3.11-3.13): Referans varil içine bir klorlanmış gümüş tel yerleştirilir. Polytetrafluoroethylene (PTFE) boru 25 G'lik bir iğneye bağlanır ve iyon seçici namluya sokulur. Diş mumu kullanılarak her iki fıçıın üstünde hava geçirmez bir mühür oluşturulur. ( D ) Bir mikropipeti klorotrimetilsilan ile kaplama (adım 3.15-3.26): [Düşük büyütme] Yatay olarak monte edilen bir stereomikroskop doğrultusunda klorotrimetilsilan içerisinde asılı bir ISM. [Yüksek büyütme] Yatay olarak monte edilen stereomicroscKlorotrimetilsilan çözeltisi içinde bir ISM ucu. Mikroskop ile ucu görselleştirdikten sonra, az miktarda TMA-Cl çözeltisi iyon seçici varilden dışarı atılır (TMA-Cl çözeltisinin küçük bir kabarcık oluşturması için yeterlidir). ISM tutacağı bir TMA-Cl solüsyonu balonunu serbest bırakmak için vurulur ve sonra klorotrimetilsilan ucu içine çekilir. Bu döngü birkaç kez tekrarlanır. Bütün klorotrimetilsilan ISM'den atıldıktan sonra ISM, TMA için sıvı iyon değiştiricisine (LIX) konur ve iyon seçici namluun ucuna LIX çekilir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
4. İyontoforez Mikroelektrodlarının Hazırlanması
NOT: İyontoforez mikroelektrodları deney günü üzerinde imal edilmelidir.
- Dikey veya ho üzerinde çift barrel borosilikat cam kapiller çekinYatay çekme makinesi. 3. adımda çekilen mikropipetlere benzer bir pipet çekmek için parametreleri ayarlayın ( Şekil 4a ).
- Adım 3.7'de kullanılan bileşik mikroskop altında mikropipet yerleştirin ve sonuçta ortaya çıkan çapın 2 ila 5 μm arasında olduğu ( Şekil 4a ) bir cam mikroskop lamı kullanarak ipucu kesin.
- 0.22 μm filtreye ve 28 G, 97 mm iğneye ( Şekil 4a ) bağlı 10 mL'lik bir şırınga kullanarak 150 mM TMA-Cl dolgu çözeltisiyle iki varili doldurun.
- Her iki varilin solüsyonunda hava kabarcıklarının kalmamasını sağlamak için mikropipere hafifçe dokunun.
- Klorlanmış gümüş telleri mikropipetin her iki fıçısına yerleştirin. Tellerin, dolum çözeltilerinde yeterince derin olduğundan emin olun, böylece deney süresince çözeltilerle temas halinde kalacaktır.
- Sıcak diş mumu kullanarak telleri fıçılara mühürle. Hafifçe kenetleyin t Onları birbirlerine sararak teller ( Şekil 4b'de gösterilen tamamlanmış mikroelektrod).
Şekil 4: Bir İyontoforez Mikroelektrodun Hazırlanması. ( A ) İki fıçıın dolgusundan sonra iyontoforez mikroelektrotu (basamaklar 4.1-4.3): Bir iyontoforiz mikro elektrotu kılcal borudan çekilir. Mikroelektronun ucu 2-5 μm çapa yontulmuştur. İyonitforez mikroelektrodun her iki varilleri TMA-Cl çözeltisi ile doldurulur. ( B ) Tamamlanan iyontoforez mikroelektrotu (adım 4.5-4.6): Varillere iki klorlanmış gümüş tel bulunan bir iyontoforesis mikroelektrot. Mikroelektron gövdeleri balmumu ile kapatılır ve gümüş teller mikroelektrodun arkasında birlikte bükülür./files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank "> Bu figürde daha büyük bir sürümünü görmek için lütfen tıklayınız.
5. Suni Beyin Omuralı Sıvısı ve Kemirgen Beyin Dokusu Dilimlerinin Hazırlanması
- Deney için uygun bir kompozisyon ile yapay beyin omurilik sıvısı (ACSF) 1 L hazırlayın ve 0.5 mM TMA-Cl buna ekleyin.
NOT: Deney sırasında TMA'nın arka plan konsantrasyonunu oluşturmak için TMA-Cl gereklidir. - Standart protokoller 11 , 12'ye göre 400 μm kalınlığında kemirgen beyin dilimlerini hazırlayın. Adım 5.1'de hazırlanan ACSF'yi beyin dilimlerinin diseksiyonu ve bakımı için kullanın.
6. Agarozda Gerçek Zamanlı İyontoforez
- Walter ve Wanda programlarını çalıştıran bilgisayarı açın.
NOT: Bu programlar isteğe bağlı olarak ücretsiz olarak temin edilebilir. Bu yazılım esasta olmamasına rağmen, benzer programlamaYazılımın veya elle yapılan analizin yapılması gerekir. - ACSF'yi uygun bir oranda ( örneğin, 2 mL / dakika) dalma odasında çalıştırın. Deney süresince sıcaklık denetleyicisini istenen bir sıcaklığa ayarlayın ve deney süresince% 95 O 2 /% 5 CO 2 (veya başka bir uygun gaz karışımı) ile ACSF kabarcıklayın.
- Kayıtsız bir (zemin) elektrotu uygun bir yuvaya takın ve ucu, dalma odası boyunca akan ACSF'ye batırın. Kabloyu kayıt aygıtı tabanına bağlayın.
- Gözenekli kabı (adım 1.7'de hazırlanmıştır) önceden hazırlanmış% 0.3 agaroz ile doldurun ve dalma odasına yerleştirin. Çözeltinin fincanın üstünden geçmediğinden emin olun.
- Kalibre edilmiş bir ISM'yi, bir mikromanipülatörün pipet tutucusuna ve ikinci bir iyontoforez mikro elektrotuna sabitleyin. Tutucuları, kurulum için uygun bir açıyla ayarlayın ( Şekil 5a ).
- bağlamakISM ve iyontoforez mikroplak tellerini kayıt amplifikatörünün kendi baş safhalarına bağlar. Alternatif olarak doğrudan amplifikatöre bağlayın (kuruluma bağlı olarak).
- Bağlantı kablolarının veya klipslerinin ağırlık / konumlandırılmasının, mikro elektrodların herhangi bir harekete neden olmamasına dikkat edin, çünkü pozisyonlamadaki küçük dalgalanmalar sonuçları etkileyebilir.
- Elektronik kurulumu açın (2. adımdan). Walter ve Wanda'yı ayrı durumlarda başlatın.
- Wanda GUI'de "Kalibre Et" i tıklayın ( Şekil 6a ). Kalibrasyon kutusunda ( Şekil 6b ), ISM kalibrasyonu (adım 3.29) sırasında ölçülen gerilimleri girin ve "Verileri Sığdır" ı tıklayın.
NOT: Bu, Nicolsky denkleminin aşağıdaki gösterimine uymayı sağlar (alternatif olarak, M ve K'yi elde etmek için başka bir yöntemle denklemi sığdırır):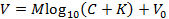
OnaE, V ölçülen voltaj (mV), M Nicolsky eğimi (mV), C iyon konsantrasyonu, mM K , parazit (mM) ve V 0 ofset voltajı (mV) 3'tür . - Basamak 6.9'da üretilen eğimi ( M ) ve paraziti ( K ) ana GUI'ye otomatik olarak aktarmak için Kalibrasyon kutusundaki "Kabul Ediyorum" düğmesine tıklayın.
NOT: Burada, K , genellikle önemsiz olan Na girişimini temsil eder. - GUI'nin sol tarafında, tüm deneme parametrelerinin karşılık gelen girdilere ayarlandığından emin olun ( Şekil 6a ).
- Kaynak Yöntemi kutusunda, kaynağı "ion salı" (varsayılan), "Kayıt Süresi" ni "200 s" (varsayılan), "Pals Başlama" yı "10 s" (varsayılan), "Darbe Sonu" "60 s" (varsayılan), "Öngeriye Akım" dan "20 nA" (varsayılan),"Ana Akım" dan "100 nA" (varsayılan) ve "Dönüşüm Faktörü" uygun bir değere ayarlayın.
- Ölçüm Elektrodu kutusunda "Banyo C" 'ni banyo solüsyonunda bulunan TMA konsantrasyonuna ayarlayın (mM cinsinden ifade edilir). "Toplam Kazanç", "Çıkış Kanalı", "ISM Kanalı" ve "Ref Kanalı" nı, kullanılan veri toplama sistemi için uygun değerlere ayarlayın.
NOT: "Dönüşüm Faktörü" uygun bir değere ayarlanmalıdır (kullanımdaki iyondoforik üniteye özeldir). Bu değer, D / A dönüştürücüsünden verilen bir gerilim için iletilen akım miktarını (nA / mV) belirtir.
- Agar fincana bir sıcaklık probu yerleştirin. Ölçülen sıcaklığı GUI'nin "Ölçüm Elektrodu" kutusunda "Sıcaklık" girişine kaydedin ( Şekil 6a ).
- Alt kademe aydınlatıcısını açın. Gerekirse, mikrofona bağlı kamerayı açınRoscope ve kamera monitörü.
- Mikroelektrodları agarozun en az 1000 μm derinliğinde indirin ve onları fincanın ortasına indirin ( Şekil 5b ). Onları 10X'lik bir objektif (uzun bir çalışma mesafesine sahip suya daldırma objektif) kullanarak mikroskop altında görüntüleyin.
- Başlangıç voltajı olarak agarozda kaydedilen gerilimi oluşturmak için amplifikatördeki voltajı hem referans hem de ISM kanalları için 0 mV'ye ayarlayın.
- İki kanallı amplifikatörde, ISM kanal konektörünü referans ve ISM kanalları arasında 'çıkarma' ayarlamak için el ile voltaj çıkarma çıkışına getirin.
NOT: Çıkarma, ISM kanalındaki gerilim değişikliklerinin tek başına TMA konsantrasyonundaki değişiklikleri yansıtmasını sağlar. - ISM'yi iyontoforez mikroplakrodın ucuna dokunacak şekilde hareket ettirin. İpuçlarını üç yönlü eksende ortalayın.
- Her iki mikro elektrodun daMikromanipülatör kontrol kutuları. Mikroelektrodların doğru ve tam merkezlendiğinden emin olun (kritik).
- İSM 120 μm'yi bir eksende (sol-sağ eksen, Şekil 5b ) iyontoforez mikro elektrotundan uzaklaştırın. Bu mesafeyi GUI'nin "Ölçüm Elektrodu" kutusuna girin ( Şekil 6a ).
- GUI'de "Acquire" ( Şekil 6a ) tıklayarak bir kayıt başlatın; Programın tam bir kayıt kaydetmesine izin verin.
NOT: İyontoforez mikro elektroduna sabit bir bias akımı gelir. "Acquire" düğmesine tıkladıktan sonra, ana akımın sınırlı bir süre için uygulanması için kısa bir gecikme olur. - Adım 6.20'yi iki ila üç kez tekrarlayın. Yeni kayıtlar almadan önce TMA sinyali taban çizgiye dönene kadar bekleyin; Program daha sonraki analiz için her kaydı kaydeder.
- ISM'yi arkaya doğru hareket ettirerek iki mikro elektrodağının aralığını kontrol edinO kontrol kutusu tarafından belirtilen sıfır konumu. Mikroelektrod merkezli değilse, adım 6.17'deki ile aynı stratejiyi kullanarak tekrar merkezleyin. Elektrotların herhangi bir değişikliğini kaydedin.
NOT: Boşluk yaklaşık% 2'den fazla değişirse, adım 6.19'da elde edilen kayıtlar doğru sayılmaz ve yenileri alınmalıdır.

Şekil 5: Agar Deneyleri için Kurulum. ( A ) Seyreltik ağarda deneyin kurulması (adımlar 6.1-6.5): Seyreltilmiş bir agara doldurulmuş küçük gözenekli bir kap, çalışan bir perfüzyon odasına yerleştirilir. Bir iyontoforez mikroelektrot (sol taraf) ve bir ISM (sağ taraf) mikroelektrod tutucular tarafından tutulur; Mikroelektrot tutucular, robot mikromanipülatörlerin kollarına takılmıştır. Bir sıcaklık probu agar jelle yerleştirilir ve ilgisiz bir toprak elektrotu plSu altında kalma odasında ased. ( B ) Agardaki mikroelektrodların büyütülmüş görünümü: Bir iontophoresis microelectrode (sol taraf) ve bir ISM (sağ taraf), 10X su daldırma objesi (150 mM NaCl içine daldırılmış objektif) kullanarak agarda görselleştirilir. Mikroelektrodlar mikromanipülatörler kullanılarak 1000 μm derinliğe yerleştirilir; Mikroelektrodler arasındaki boşluk 120 μm'dir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 6: Wanda Bilgisayar Yazılım Arabirimi. ( A ) Wanda grafik kullanıcı arayüzünde gezinme (GUI): Wanda yazılımını açtıktan sonra görüntülenen ekran. Kutudaki (1), uygun ortam, iyontoforez molekülü ve tekniği seçilmiştir. (2) Açmak için "Kalibre et" tıklandığındaWanda Kalibrasyon kutusu. ISM'yi kalibre ettikten sonra (bkz. Şekil 6b ve Ek B), ISM protokolün 6. ve 8. adımlarında anlatıldığı gibi agar veya beyinde konumlandırılmıştır. Kutudaki (6), gerçekleştirilen deney için uygun tüm değerler girilir. (7) Bir kayıt almak için "Acquire" tıklandı; Wanda GUI'nin sağ üst kısmında voltaja karşı bir grafik grafiği görüntülenir. ( B ) Wanda'daki ISM'yi Kalibre Etme : Wanda GUI'sinde (2) "Kalibre Et" i tıkladıktan sonra açılan pencere. Adım 3.29'daki değerler kutuya (3) girilir ve (4) "Fit Data" seçilir. Kalibrasyon eğrisi doğrusal olarak doğrulanır. (5) Wanda GUI'ye geri dönmek için "Kabul Et" tıklanmıştır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
7. Agaroz Veri Analizi
- AçBilgisayarda Walter programı (PC). "0. Records From:" menüsünde, Wanda tarafından üretilen kayıtları okumak için "Wanda / VOLTORO" düğmesini tıklayın ( Şekil 7a ). Çıktının bir elektronik tabloya yüklenmesi gerekiyorsa, uygun yazılımı açın. "1. Yazma Excel?" Bölümündeki "Sayfa 1,3" Menü ( Şekil 7b ).
- Bir sonraki açılır pencerede, okunacak olan kayıtları seçin ve "Aç" ı tıklayın ( Şekil 7b ); Kayıtların otomatik olarak grafiksel olarak gösterileceğini unutmayın. Montaj işlemine başlamak için aşağıdaki adımları uygulayın.
- "2. Seçenekler" menüsünde "kayıt seç" düğmesine tıklayın. " Şekil 2 " açılır penceresinde, çapraz çizgileri işlenecek ilk kayıtın üzerine getirmek için fareyi kullanın ( Şekil 7c ); Kaydı seçmek için herhangi bir fare düğmesine basın.
- Tıklayın oN "fit curve" menüsü. İstenilen sayıda montaj yinelemesini seçin; Verilerin doğru biçimde uyuşması için en az 20 tekrarlama yinelemesi kullanın.
- Menüde, tüm veri noktalarını sığdırmak için "hepsi" seçeneğini seçin ve "devam et" i seçin. Program gösterilen eğriye uyacaktır. Montaj prosedürünü gözlemleyin ve elde edilen en uygun eğri ile deneysel kayıtları karşılaştırın.
- Sonuçları "7. Sonuçlar" menüsündeki "Excel" i tıklayarak uygun elektronik tablo programına yazma seçeneğini belirtin ( Şekil 7d ). İyonotransfer mikroelektrodunun işlevselliğini belirlemek için kullanılacak olan kritik verileri not edin (ve kaydedin ) : ' D (E5) ', ' Referans D (E5) ', ' r_app ', taşıma numarası ' n t ', ' Görünür n 't.
NOT: " D (E5) ": Ölçülen serbest difüzyon katsayısıtx 10 5 (cm2 / sn); " Referans D (E5) ": Teorik serbest difüzyon katsayısı x 10 5 (cm 2 / s). Bu değer, Walter içindeki iyon, ortam ve sıcaklık girişine dayalı bir veritabanından çıkarılır. " R_app ": Ölçülen ve referans D (E5) temel alınarak hesaplanan görünen mikroelement aralığı (cm ) . " N t ": Taşıma numarası (boyutsuz). Bu sayı, TMA 4'ü serbest bırakmak için kullanılan iyontoforez akımının fraksiyonunu belirler. " Görünen n t ": Görünür taşıma numarası (boyutsuz). Bu, r_app'den hesaplanan bir taşıma numarasıdır. Bu numara ölçülen n t yakın olmalıdır. - Seçilen mikroelektrod çifti için kayıtların her biri için 7.1-7.3 adımlarını tekrarlayın.
- Aşağıdakileri yaparak iyontoforez mikroplakrodının kullanılabilir olup olmadığını belirleyin.
- " R_app" ı gerçek r ( yani, 120 μm) ile karşılaştırın; Tüm denemelerdeki ortalama değerlerin birbirinin% 4'ü dahilinde olması durumunda bu kriter yerine getirilir.
- " D (E5)" ile Referans D (E5) ; Tüm denemelerdeki ortalama değerler birbirinin% 8'i içindeyse bu kriter yerine getirilir.
- Denemeler arasındaki " n t " değerini aynı mikroelektrot ile karşılaştırın; Tüm denemelerden ortalama değerlerin birbirinin% 10'u dahilinde olması durumunda bu kriter yerine getirilir.
- Adım 7.5'teki kriterlerden biri yerine getirilmemişse, iyontoforez mikroelektrotunu gidermek veya başka bir testi başlatmaya çalışmak.
- İyontoforez mikro elektrotu deney için uygun görülürse, Wanda GUI'deki "Transport Num N" alanında ( Şekil 6a ) tüm denemelerden ortalama taşıma numarasını kaydedin .
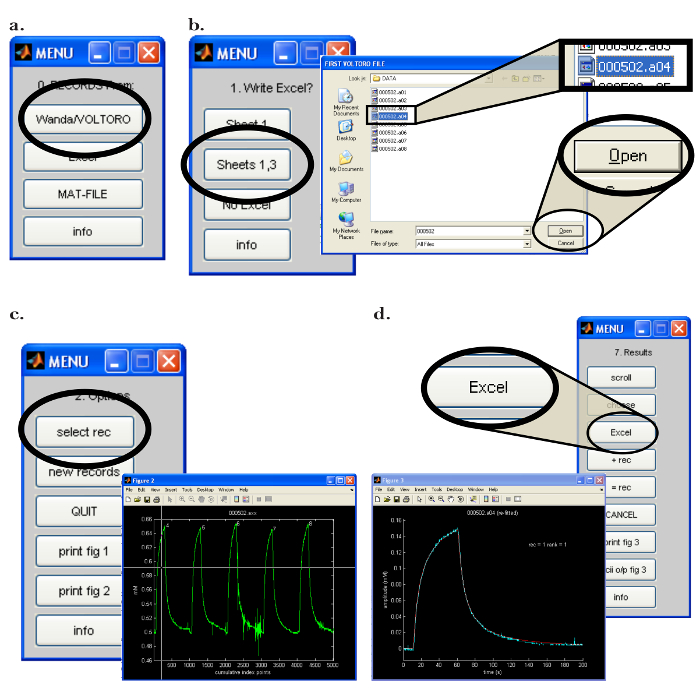
Şekil 7: Walter Bilgisayar Yazılım Arabirimi. ( A ) Walter'da veri toplama programını seçme: "0. Records From:" menüsü Walter yazılımını başlattıktan sonra açılır. Wanda tarafından kaydedilen kayıtları yükleme seçeneği, "Wanda / Voltoro" düğmesini tıklayarak seçilir. ( B ) Walter'da veri ve veri analizi çıktı konumunu seçme: [Sol] Uygun elektronik tablo programı açıldıktan sonra, "Sheets 1,3" seçilerek Walter veri analizinin tamamı daha önce açılmış elektronik tablo programına çıktı olarak seçilir. [Sağ] Veri analizi çıktı konumu seçildikten sonra, kullanıcıya Walter tarafından okunacak ilk ve son kayıtları seçme imkanı veren bir açılır pencere açılır. ( C ) Walter'de analiz edilecek kaydı seçme: [Sağ] Okunacak dosyalar seçildikten sonra, seçilen tüm kayıtların bulunduğu bir açılır pencere açılacaktırGrafik olarak oynatılır (" Şekil 2 "). [Solda] "2.Options" menüsünde, "select rec" tıklandı ve analiz için ilk kaydı belirlemek için fareyi ipin üstünde gezdirmek için kullanılır; Kaydı seçmek için fare düğmesine basıldığında. ( D ) Veri analizini Walter'tan bir elektronik tabloya dışa aktarma: Verileri taktıktan sonra, bir açılır pencere ve "7. Sonuçlar" menüsü görüntülenir. [Solda] Seçilen kaydın grafiği (mavi) Walter tarafından üretilen takviye edilmiş difüzyon eğrisi ile (kırmızı). [Sağ] "7. Sonuçlar" menüsü, "Excel" düğmesini tıklayarak analizin verilerini bir elektronik tablo programına veri yazmasına izin verir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
8. Beyin Dilimlerinde Gerçek Zamanlı İyontoforezler
- 400 μm kalınlığında bir beyin yerleştirinIşınlarının ACSF'ye tamamen batırılmasını sağlamak için kayıt odasında bulaştırın. Dilimi suluboya fırça ile yerleştirin ve ızgarayla hafifçe sabitleyin.
- İyontoforez mikroplakrodını ve ISM'yi beyin dilimindeki ilgi alanının üzerine getirin. Hem akışkan ACSF'de, hem de dilimin üstünde dalın.
- Referans ve iyon algılayan kanalların gerilimini "0" mV'ye ayarlayın. Her iki kanaldaki gerilimin dengelenmesini bekleyin. Grafik kaydedicide, ISM'nin iyon algılama kanalında ölçülen gerilimi işaretleyin. Wanda'daki temel V parametresini hesaplamak için bunu kullanın.
- ISM'yi ve iyontoforez mikroplazı 200 mikron derinliğinde dilim ve 120 um uzaklığa yerleştirin. Mikroelektrodu beyin dilimine kaydırdıktan sonra sinyalin stabilize olmasını bekleyin.
NOT: İyontoforez mikroelektroduna uygulanan öngerilim akımı, TMA'nın küçük bir birikmesine neden olur. Genel kabul gören bir hatadır.Çok yakında ekoplamak ve sinyal oluşumunu hafife almak. - Harita kayıt cihazında, beyin diliminde ölçülen stabilize voltajı ISM'nin iyon algılama kanalında işaretleyin. Adım 8.3 ve adım 8.4'te ölçülen TMA sinyali arasındaki voltaj farkını hesaplayın ve bu değeri Wanda GUI'nin Ölçüm Elektrod kutusunda "Taban Varsa V (mV)" alanına girin ( Şekil 6a ).
- GUI'nin sol tarafında tüm deneysel parametrelerin doğru kaydedildiğinden / girildiğinden emin olun. "Orta" dan "Beyin" e, "Nakil numarası", adım 7.4'te iyontoforez mikroelektrod için hesaplanan ortalama değere, "Sıcaklık" ise dilimi içeren banyoda sıcaklığa ayarlayın.
NOT: V her ölçüm seti için kaydedilmelidir. Başlangıçtaki V , Wanda tarafından başlangıçtaki C (mM) parametresine ( yani, beyin dokusunda TMA konsantrasyonu) dönüştürülecektir. - "Acquire" düğmesini tıklayarak kaydı başlatın ve tam bir kayıt almasına izin verin. Yeni bir kayıt edinmeden önce TMA sinyali taban çizgisine dönene kadar bekleyin.
- Mikroelektrodları seçilen beyin yerinden çıkarmadan önce iki ila üç ardışık kaydı yapın. Ölçülen sıcaklığı her kayıttan hemen önce Wanda yazılımına girin.
- Her iki mikro elektrod da diyagonal olarak dilimin yüzeyine geri getirin. Her ikisini de dilimden en az 50 μm yukarıda kaldırın. Harita kayıt cihazını kullanarak, şimdi ölçülen V ve adım 8.3'teki ölçüm arasındaki herhangi bir değişikliği belirleyin.
- ISM'nin uçlarını ve iyontoforetik mikroelektrotları x, y ve z eksenlerinde birbirine göre ortalayın. Mikromanipülatör kontrol kutusunun ekranından aralık değişiklikleri varsa bulun.
9. Beyin Veri Analizi
- Analiz çıktısı için yeni bir e-tablo açın.
- Analiz etmek için Walter'daki 7.1-7.4 adımlarını tekrarlayınE kayıtları beyinden alınmıştır.
- Walter menüsündeki "Excel" i tıklayarak verileri elektronik tablo programına yazın. Beyin ECS'sinin α hacim fraksiyonunu kaydedin; Λ , beyin kıvırcıklığı ECS; Ve k (s- 1 ), spesifik olmayan temizleme.
10. Taşıma Numarasını ve ISM Kalibrasyonunu Kontrol Etme
- Aşağıdaki protokolü kullanarak deneyin sonunda ISM taşıma numarasını ( n t ) ölçün. Alternatif olarak, kritik denemelerden sonra veya ölçümler anormal görünüyorsa, n t 'yi kontrol edin. Ancak, kontrol n t çok kez beyin dilim travmaya neden olabilir.
- Agarozda yeni kayıtlar alın. 6.4, 6.11, 6.12, 6.14, 6.15 ve 6.17-6.22 adımlarına bakın.
- Yeni agaroz kayıtlarından n t elde etmek için Walter'daki 7.1-7.4 adımlarını tekrarlayın. E-tabloyu inceleyin: n t daha fazla değişmişseBeyin ölçümlerinden önce elde edilen n t'den % 10'dan daha fazla olduğu için, bu iyontoforetik mikroelektrot ile elde edilen veriler güvenilir değildir.
- Tüm beyin verileri toplandıktan sonra ISM için yeni bir kalibrasyon gerçekleştirin (adım 3.29'a bakın). Yeni alınan ISM kalibrasyon verilerini Wanda Kalibrasyon kutusundaki girdi olarak kullanın (bkz. Adımlar 6.9 ve 6.10) ve eğim değerinin bir önceki kalibrasyona göre% 10'dan daha az fark olup olmadığını kontrol edin.
NOT: Eğim değeri önceki kalibrasyondan% 10'dan fazla farklıysa, bu ISM ile elde edilen veriler güvenilir değildir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Rti tekniğin yardımcı a değişiklikleri ölçmek için tasarlanmış bir deneyde bir hypoosmolar cebine (Şekil 8 ve Şekil 9) sırasında gösterilmiştir. Daha önce, hipotonik ACSF ile yıkanarak ECS ozmolaritesini indirgeme a bir azalma ve A 13 bir artış üretecektir gösterilmiştir.
Bu deneyde, RTI her iki...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
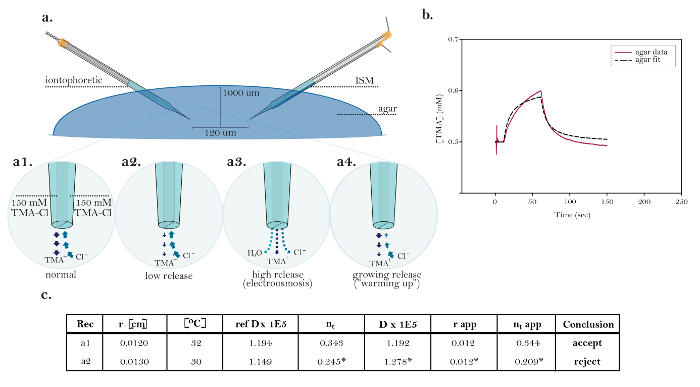
Şekil 10: Ortak Teknik Konuları Gösteren İdeal Olmayan Veriler. ( A ) İyontoforez mikroelektrodlarıyla ortak teknik konuların diyagramları: Üç kaynaktan oluşan, teknik bir sorun gösteren, işleyen bir iyontoforez mikroelektrodunun TMA'nın normal salınımının karşılaştırılması. [Yüksek büyütme, a1] İdeal bir iyontoforetik kaynaktaki akım, TMA salınımı ve klorür al?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, rekabet eden mali çıkarlarının olmadığını beyan ettiler.
Teşekkürler
Çalışma, NIH NINDS hibe R01 NS047557 tarafından desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
Referanslar
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır