Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Itophorèse en temps réel avec du tétraméthylammonium pour quantifier la fraction de volume et la tortuosité de l'espace extracellulaire du cerveau
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit l'iontophorèse en temps réel, une méthode qui mesure les paramètres physiques de l'espace extracellulaire (ECS) des cerveaux vivants. La diffusion d'une molécule inerte libérée dans l'ECS est utilisée pour calculer la fraction de volume ECS et la tortuosité. Il est idéal pour étudier les modifications réversibles aiguës des ECS du cerveau.
Résumé
Cette revue décrit les concepts et le protocole de base pour effectuer la méthode de l'iontophorèse en temps réel (RTI), l'étalon-or pour explorer et quantifier l'espace extracellulaire (ECS) du cerveau vivant. L'ECS entoure toutes les cellules du cerveau et contient à la fois du liquide interstitiel et de la matrice extracellulaire. Le transport de nombreuses substances requises pour l'activité du cerveau, y compris les neurotransmetteurs, les hormones et les nutriments, se produit par diffusion à travers l'ECS. Les changements dans le volume et la géométrie de cet espace se produisent au cours des processus cérébrales normaux, comme le sommeil, et les pathologies, comme l'ischémie. Cependant, la structure et la régulation des ECS du cerveau, en particulier dans les états malades, restent largement inexplorées. La méthode RTI mesure deux paramètres physiques du cerveau vivant: fraction volumique et tortuosité. La fraction de volume est la proportion de volume tissulaire occupée par ECS. La tortuosité est une mesure de l'obstacle relatif qu'une substance rencontre lors de la diffusion à travers un cerveauPar rapport à un milieu sans obstruction. Dans RTI, une molécule inerte est pulsée à partir d'une microélectrode source dans l'ECS du cerveau. Au fur et à mesure que les molécules se diffusent loin de cette source, la concentration changeante de l'ion est mesurée au fil du temps en utilisant une microélectrode sélective d'ions positionnée à environ 100 μm. A partir de la courbe de diffusion résultante, on peut calculer la fraction de volume et la tortuosité. Cette technique a été utilisée dans des tranches de cerveau provenant d'espèces multiples (y compris les humains) et in vivo pour étudier des modifications aiguës et chroniques à ECS. Contrairement à d'autres méthodes, RTI peut être utilisé pour examiner à la fois des modifications réversibles et irréversibles de l'ECS du cerveau en temps réel.
Introduction
L'espace extracellulaire (ECS) est le réseau de canaux interconnectés extérieurs à toutes les cellules du cerveau et contient à la fois le fluide interstitiel et la matrice extracellulaire ( Figure 1a et Figure 1b ). La distribution de nombreuses substances requises pour la fonction des cellules cérébrales, y compris les nutriments, les hormones et les neurotransmetteurs, se produit par diffusion à travers le système ECS. Les changements dans les paramètres physiques de cet espace, y compris le volume, la géométrie et la matrice extracellulaire, peuvent influer drastiquement sur la diffusion à travers l'ECS et les concentrations d'ions locales qui se baignent dans les cellules du cerveau, ce qui a un impact profond sur la fonction des cellules cérébrales 1 , 2 .
L'iontophorèse en temps réel (RTI) est utilisée pour déterminer deux caractéristiques structurelles d'une région du cerveau: fraction volumique et tortuosité 3 , 4 ,"Xref"> 5. La fraction de volume ( α ) est la proportion de volume tissulaire occupée par ECS ( V ECS ) par rapport au volume tissulaire total ( tissu V ) dans un volume élémentaire représentatif;
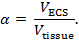
La tortuosité ( λ ) est l'obstacle relatif qu'une substance rencontre lors de la diffusion dans une région du cerveau par rapport à un milieu sans obstruction;

Où D * (cm 2 s -1 ) est le coefficient de diffusion efficace de la substance dans le cerveau et D (cm 2 s -1 ) est le coefficient de diffusion libre de la substance dans un milieu libre, tel qu'un gel d'agarose dilué.
Aujourd'hui, la substance de sondes la plus utilisée pour le RLa méthode TI est le petit cation tétraméthylammonium (TMA). Le TMA a un poids moléculaire de 74 g / mol, se dissocie complètement en solution et a une charge positive. Les études de RTI avec cette ion ont démontré que α  0,2 et λ
0,2 et λ  1.6 1 , 2 . Cela signifie que l'ECS représente environ 20% du volume total du cerveau et que la diffusion d'une petite molécule inerte est environ 2,5 fois plus lente dans l'ECS que dans un milieu sans obstruction 3 . Cependant, α et λ varient selon l'âge, la région et l'état du cerveau et dans les pathologies 1 . Les modifications de ces paramètres ont été liées au développement du cerveau, au vieillissement, au sommeil, à l'épilepsie et à de nombreux autres processus et maladies fondamentales du cerveau 1, 6 . Alors que d'autres techniques mesurent α et λ , RTI peut mesurer à la fois dans les régions localisées du tissu vivant en temps réel. Pour cette raison, RTI est devenu un outil indispensable pour étudier les changements dans α et λ lors de défis aigus et réversibles.
1.6 1 , 2 . Cela signifie que l'ECS représente environ 20% du volume total du cerveau et que la diffusion d'une petite molécule inerte est environ 2,5 fois plus lente dans l'ECS que dans un milieu sans obstruction 3 . Cependant, α et λ varient selon l'âge, la région et l'état du cerveau et dans les pathologies 1 . Les modifications de ces paramètres ont été liées au développement du cerveau, au vieillissement, au sommeil, à l'épilepsie et à de nombreux autres processus et maladies fondamentales du cerveau 1, 6 . Alors que d'autres techniques mesurent α et λ , RTI peut mesurer à la fois dans les régions localisées du tissu vivant en temps réel. Pour cette raison, RTI est devenu un outil indispensable pour étudier les changements dans α et λ lors de défis aigus et réversibles.
La théorie de RTI a été initialement validée par Nicholson et Phillips, et la technique a été largement utilisée depuis cette époque 4 , 7 . Les expériences utilisant RTI commencent par la libération d'une impulsion de TMA à partir d'une microélectrode source par iontophorèse dans un gel dilué d'agarose. Une fois éjectés, les ions diffusent librement loin de la source ponctuelle, en choisissant d'un nombre potentiellement infini de chemins aléatoires ( figure 1d ). La concentration changeante de l'ion est mesurée au fil du temps à l'aide d'une microélectrode sélective d'ions (ISM) positionnée à peu près100 μm loin ( Figure 1c ). Les changements dans la concentration de TMA sont représentés graphiquement et ajustés à une courbe qui permet le calcul de D et du nombre de transport de la microélectrode d'iontophorèse (paramètres discutés dans le protocole). Avec ces valeurs, la procédure est répétée dans une région du cerveau d'intérêt pour obtenir D * et pour calculer α et λ . Le contrôle de la microélectrode d'iontophorèse, la collecte de données, la représentation graphique et l'ajustement de la courbe de concentration de TMA et le calcul des paramètres expérimentaux sont généralement réalisés par les programmes Wanda et Walter, spécialement conçus à cet effet (le logiciel et leurs manuels sont Librement disponible auprès des auteurs sur demande).
La section Protocole de cette revue décrit les procédures de base nécessaires à la conception et à l'exécution de RTI dans les tranches de cerveau de rongeurs. La technique a également été utilisée en non-tigemodèles ent, notamment des tranches de cerveau humain et in vivo des préparations de cerveau 1, 4, 6, 8, 9. La section Résultats représentatifs fournit des résultats idéaux et non idéaux pour mettre en évidence les nuances de l'interprétation des données. Enfin, la section de discussion couvre brièvement les techniques de dépannage, les limitations de RTI, les techniques alternatives utilisées pour étudier l'ECS et les applications futures de RTI.

Figure 1: Diagrammes de diffusion à travers ECS. (A) Schéma d'ECS: Démontre la taille et l' emplacement de l'ECS dans une section typique du cerveau. Yellow marque le ECS entre les processus des cellules du cerveau gris. Le volume de l'ECS est d'environ 20% du volume tissulaire total ( c.-à-d., Fraction de volume = 0.2) dans des conditions physiologiques. ( B ) Diagramme agrandi de l'ECS: met en évidence des paramètres physiques contribuant à la tortuosité, y compris la géométrie des cellules du cerveau (gris) et la matrice extracellulaire (diagrammes sous forme de maille de glycosaminoglycanes multicolores et de protéoglycans). ( C ) diagramme 3D de diffusion à partir d'une source ponctuelle: démontre le mouvement net des molécules inertes d'une source iontophorétique à un ISM. À l'exclusion des barrières de diffusion et de l'absorption cellulaire, les molécules diffusent vers l'extérieur dans toutes les directions, produisant un front de concentration sphérique. L'ISM quantifie la concentration locale des molécules inertes libérées par la source iontophorétique. ( D ) Simulation par ordinateur de la diffusion dans ECS du cerveau: [Extrême gauche] Configuration pour la simulation de Monte Carlo; Les sphères vertes représentent les processus des cellules du cerveau et la croix rouge représente une source ponctuelle. Cette configuration modélise le tissu cérébral diagramme de la figure 1a . [Images du milieu] 3 et6 molécules effectuant des mouvements aléatoires lorsqu'elles se diffusent à travers l'espace extracellulaire du cerveau, montrées en 2 dimensions. [Extrême droite] Des randonnées aléatoires de nombreuses molécules sorties de la source ponctuelle. Le mouvement net de toutes les molécules de la source ponctuelle est vers l'extérieur comme représenté sur la figure 1c . Les randonnées aléatoires cumulatives décrivent les espaces entre les cellules ( c.-à -d. ECS, voir la référence 5 pour plus d'explications). Cliquez ici pour voir une version plus grande de ce chiffre.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures animales, utilisées pour obtenir des échantillons de tissus, ont été approuvées par le comité d'éthique animale au SUNY Downstate Medical Center.
1. Préparation des solutions et de l'équipement
- Préparez une solution de remplissage de NaCl 150 mM pour le baril de référence de l'ISM. Rangez-le dans une seringue de 10 mL attachée à un filtre de 0,22 μm (pour éliminer les bactéries ou les particules).
- Préparez une solution de remplissage de chlorure de TMA 150 mM (TMA-Cl) pour les microélectrodes. Rangez-le dans une seringue de 10 mL attachée à un filtre de 0,22 μm. Préparez les solutions TMA-Cl (dans ce protocole) à partir d'une solution stock 5 M pour assurer la bonne concentration.
- Chloriser au moins quatre fils en argent pour la fabrication de microélectrodes en immergant les fils dans l'eau de Javel (hypochlorite de sodium) pendant au moins 2 h. Retirer l'eau de javel excessive avec de l'éthanol et laisser sécher les fils.
- Préparer 50 ml d'agarose à 0,3% dans NaCl 150 mM et TMA-Cl 0,5 mM dans un bécherEt couvrez-le. Utilisez de l'agarose en poudre et raisonnablement frais pour assurer de bonnes mesures de diffusion.
- Chauffer et mélanger la solution d'agarose avec une barre d'agitation pour la dissoudre. Laisser refroidir la solution à température ambiante. Conservez ceci à 4 ° C pendant 1 semaine.
- Préparez une électrode indifférente composée d'agarose à 4% dans du KCl 1 M (indications dans le Supplément A)
- Fabriquer une petite tasse poreuse qui peut s'accorder dans la chambre expérimentale et qui permet une continuité électrique entre son contenu et l'environnement extérieur ( Figure 2a ). Placez une bague en métal au fond de cette tasse pour éviter qu'elle ne flotte lorsqu'elle est partiellement immergée dans l'eau.
- Utilisez une dilution en série d'un stock TMA-Cl de 5 M pour fabriquer cinq solutions TMA-Cl de 100 mL pour l'étalonnage des ISM. Les solutions devraient avoir des concentrations finales de 0,5, 1, 2, 4 et 8 mM de TMA-Cl, tous dans NaCl 150 mM. Conservez les solutions d'étalonnage dans une coupelle scellable pour éviter l'évaporation.
2. Configuration électronique
- Connectez les composants de la configuration expérimentale RTI selon le schéma de principe de la figure 2b ; Comprennent un amplificateur avec deux canaux d'entrée (dont l'un devrait être très haute impédance pour le barillet sélectif aux ions de l'ISM), un filtre passe-bas réglé à 10 Hz, un enregistreur graphique, un A / D + D / A Un convertisseur, une unité iontophorétique (ou un amplificateur capable de fournir des impulsions à courant constant) et un ordinateur (PC) exécutant les programmes Wanda et Walter. Inspectez la configuration électronique pour confirmer que toutes les connexions sont en place.
- Observez la configuration expérimentale dans une enceinte mise à la terre (comme une cage de Faraday), si nécessaire, car les ISM ont une résistance élevée et sont sensibles aux artefacts créés par le mouvement à proximité.
- Créez une station d'étalonnage ISM dédiée comprenant un amplificateur à double entrée, un enregistreur graphique, un support ISM approprié et une électrode de masse indifférente. Si possible,Protéger l'enceinte. Passez cette étape si les ISM sont calibrés dans l'installation expérimentale (étape 3.29)

Figure 2: Coupe expérimentale poreuse et configuration électronique. (A) tasse expérimentale Porous: Un maillage poreux est utilisé pour créer une tasse expérimentale qui permet d'assurer la continuité électrique entre l'agarose ( à l' intérieur) et le fluide de bain expérimental ( à l' extérieur). Une bague métallique est fixée au fond de la coupe pour empêcher la tasse de flotter dans la solution de bain. ( B ) Schéma de blocage de la configuration RTI (étapes 2.1 et 2.2): Un ISM est connecté à un amplificateur (ampl.). L'ISM dispose de deux barils. L'un contient un échangeur d'ions liquides (LIX) dans la pointe et génère une tension proportionnelle au logarithme de la concentration de TMA à l'extrémité avec la tension ambiante locale; ThLe chemin du signal e est représenté par une ligne rouge. L'autre barillet de l'ISM est connu sous le nom de barillet de référence et mesure la tension ambiante à la pointe de l'ISM; Il est connecté par un chemin de signal bleu. L'amplificateur a deux étapes dites tête qui se connectent à l'ISM; Ces unités ont un gain de 1 (x1) et correspondent à la haute impédance de la microélectrode à la faible impédance du reste des circuits de l'amplificateur. Le stade de la tête relié au canon sélectif aux ions doit être compatible avec une résistance entrante d'environ 1000 MΩ, alors que la résistance du barillet de référence est typiquement d'environ 10 MΩ. Après avoir quitté la tête, la tension du barillet de référence est inversée et soustraite de la tension sur le barillet sélectif aux ions en utilisant un amplificateur de sommation (Σ) pour obtenir la tension du signal ionique pur. Les sorties de l'amplificateur passent à une unité de conditionnement de signal qui fournit une amplification supplémentaire et un filtre passe-bas multipolaire (≤ 10 Hz, généralement un Bessel fiLter), qui supprime le bruit et empêche l'aliasing du signal au convertisseur analogique-numérique (A / D). Les sorties du filtre sont également affichées sur un enregistreur graphique à bande. Le convertisseur A / D numérise les signaux et les envoie à un ordinateur personnel (PC). Le PC génère également un signal numérique converti par un convertisseur numérique-analogique (D / A) à une impulsion de tension analogique qui est alimentée à l'unité d'iontophorèse, qui convertit la tension en une impulsion courante d'amplitude constante et l'envoie À la microélectrode à iontophorèse. Le chemin du signal d'iontophorèse est représenté par une ligne verte. L'acquisition de données et le signal d'iontophorèse sont sous le contrôle du programme Wanda, qui génère un fichier de sortie pour chaque enregistrement de diffusion sous la forme d'un enregistrement de tension en fonction du temps, ainsi que de tous les paramètres qui définissent l'expérience. Un deuxième programme, Walter, lit le fichier de sortie et utilise les données d'étalonnage ISM pour convertir les tensions numérisées en concentrations. La concentration vLes courbes de temps rsus sont ensuite installées dans Walter à la solution appropriée pour l'équation de diffusion. D et n t sont extraits si le milieu est de l'agarose, et λ et α extrait si le milieu est le cerveau. Les signaux analogiques sont des lignes pleines; Les signaux numériques sont des lignes pointillées. Il existe également une électrode de sol indifférente (non représentée) dans le bain contenant la tranche. Lignes rouges = signal ionique, lignes bleues = signal de référence, lignes vertes = commande iontophorèse, lignes solides = analogique, lignes pointillées = numérique. Cliquez ici pour voir une version plus grande de ce chiffre.
3. Préparation et étalonnage des microélectrodes sélectives par ions
- Fabriquer des ISM en utilisant le protocole ci-dessous un jour avant l'expérience. Faire des ISM en lots pour s'assurer qu'au moins deux fonctionnent le jour de l'expérience.
REMARQUE: La plupart des ISM sont stables pour un jour oudeux. La fabrication ISM est sensible à l'humidité et aux conditions atmosphériques. Toutes les microélectrodes ne seront pas toutes calibrées avec succès. - Éloigner environ 0,5 cm de verre à la fin de l'un des barils d'un capillaire en verre à base de borosilicate à double canon en utilisant une ancienne pince.
- Branchez un seul canon à l'extrémité opposée du capillaire ( Figure 3a ). Assurez-vous que le septum n'est pas endommagé (critique). Attention: porter des lunettes de protection contre les blessures dues au verre à projectile.
- Placez le capillaire dans une bouteille d'acétone pendant au moins 1 heure pour éliminer les contaminants.
- Retirez le capillaire de l'acétone et suivez-le, essorez, essorez, de l'azote gazeux ou de l'air pour éliminer tout excès d'acétone. Retirez toute l'acétone dans le capillaire, car l'acétone résiduelle peut interférer avec la silanisation (cruciale).
- Fabriquer la pointe de la micropipette sur un extracteur vertical ou horizontal. Adaptez les paramètres pour extraire une pipette avec une longue conicité etPointe tranchante, d'environ 1 μm ou moins de diamètre. À la fin de cette étape, un capillaire sera transformé en deux pipettes ( Figure 3a ).
- Visualisez une micropipette unique sous un microscope vertical composé, avec un objectif 10X. Couper la pointe à l'aide d'une glissière de microscope en verre de sorte que le diamètre final de la pointe ( c.-à-d., Les deux barils) soit compris entre 2 et 5 μm ( figure 3b ). Cette pipette sera appelée ISM à partir de maintenant.
- Remplissez le barillet étiré de l'ISM avec une solution de référence de NaCl 150 mM à travers l'ouverture sur le côté étiré en utilisant une seringue de 10 mL attachée à un filtre de 0,22 μm et une aiguille de 28 G, 97 mm ( Figure 3b ). Ne remplissez pas le canon après trois quarts de hauteur du baril.
- Remplissez le barillet non ébréché de l'ISM avec une solution de remplissage TMA-Cl 150 mM. Appuyez délicatement sur l'ISM pour éliminer les bulles d'air de la solution. Vérifiez les bulles sous le microRoscope utilisé pour écailler la pointe.
- Flame le dos de l'ISM à l'aide d'un brûleur Bunsen pour s'assurer qu'aucune communication de la solution de remblayage ne se produit à travers le septum à l'arrière de l'ISM. Assurez-vous que le premier quart de l'ISM soit sec après la flamme.
- Insérez un fil d'argent chloré dans la solution de référence de l'ISM et pliez le fil qui dépasse du capillaire pour marquer ceci comme barillet de référence ( Figure 3c ). Assurez-vous que le fil est immergé dans la solution de remblai et reste en solution pendant la durée de l'expérience.
- Glisser une courte longueur de tube polytétrafluoroéthylène (environ 20 cm de long) sur l'extrémité d'une aiguille de seringue 25 G. Placez l'autre extrémité du tube à l'arrière du canon sélectif aux ions. Assurez-vous que le tube est dans le canon mais au-dessus de la solution de remblai ( Figure 3c ).
- Chauffer un bâton de cire dentaire avec un brûleur Bunsen et sceller à la fois le tube et le silvEtre fils dans leurs barils respectifs ( Figure 3c ). Assurez-vous qu'un joint d'étanchéité complet est produit autour du tube en plastique dans le barillet sélectif aux ions (critique).
- Préparez un petit récipient en verre transparent (5 ml ou moins) de chlorotriméthylsilane à 4% dans du xylène. Attention: les xylènes et les silanes sont très dangereux pour la santé; Manipuler les deux produits chimiques à l'intérieur d'une hotte et les éliminer de manière appropriée.
- Placez le récipient devant un microscope à dissection stéréo monté horizontalement dans une hotte aspirante. Fixez l'ISM verticalement sur le conteneur à l'aide d'un micromanipulateur ( Figure 3d ).
- Trempez la pointe de la microélectrode dans la solution de chlorotriméthylsilane.
- Fixez une seringue vide de 10 mL à l'aiguille de calibre 25 menant à l'ISM. Appliquer une pression d'air positive de la seringue jusqu'à formation d'une bulle de solution de TMA-Cl; Cette étape devrait être effectuée sous une visualisation directe au microscope.
- Appuyez délicatement sur le support ISM pour éliminer la bulle de la pointe.
- Dessinez la solution de chlorotriméthylsilane à une hauteur d'environ 1 500 μm dans la pointe de l'ISM en utilisant une pression négative sur la seringue de 10 ml.
- Enlever complètement la solution de chlorotriméthylsilane de la pointe de l'ISM jusqu'à ce qu'une bulle de solution de TMA-Cl soit créée à la pointe ( Figure 3d ).
- Répétez les étapes 3.19 et 3.20 cinq fois. Assurez-vous qu'une colonne de liquide uniforme et ininterrompue est aspirée dans la pointe à chaque fois. Si aucune solution ne peut être insérée dans la pointe, vérifiez si le tube est bloqué, le joint d'air est incomplet ou la pointe de l'ISM est bloquée.
- Rincer toute la solution de chlorotriméthylsilane hors de la pointe jusqu'à ce qu'une bulle de solution de TMA-Cl soit créée.
- Tout en maintenant une pression positive sur la seringue, retirer l'ISM de la solution de xylène. Assurez-vous que toute la solution de xylène est expulsée de la pointe ISM, car le xylène en excès va ruiner l'excColonne de suspension créée dans les étapes suivantes.
- Placez la pointe de l'ISM dans un petit conteneur transparent (soit l'échangeur ou une petite cuvette) en tenant l'échangeur d'ions liquides (LIX) pour TMA. Effectuez cette étape sous visualisation directe à l'aide de la configuration du microscope horizontal.
- Appliquer une petite quantité de pression négative pour attirer une quantité minimale de LIX dans la pointe ( c'est-à-dire, dès que LIX est entré dans la pointe, arrêter d'appliquer une pression négative).
- Débranchez la seringue de 10 mL du tube et laissez l'ISM reposer pendant 5 min. Pendant ce temps, le LIX entrera dans la pointe silanisée jusqu'à ce qu'elle atteigne un état d'équilibre.
- Supprimez l'ISM du LIX. Retirez le tube du canon de l'échangeur (tout en enlevant le plus possible de cire). Placez un fil d'argent chloré dans la petite ouverture créée à l'extrémité arrière de l'ISM. Sceller le fil dans le remblai du canon de l'échangeur avec de la cire fondue.
- Autoriser l'ISM à s'asseoirPendant au moins 30 min. Fixez les ISM complétés à la jante intérieure d'un bécher en utilisant n'importe quel adhésif flexible et temporaire.
- Calibrez l'ISM en enregistrant la tension mesurée par l'ISM dans chaque solution d'étalonnage réalisée à l'étape 1.8.
REMARQUE: L'étalonnage peut être effectué dans une station d'étalonnage (voir étape 2.3) ou dans la configuration expérimentale. Cette procédure est décrite dans le complément B et dans Haack et al 10 . - Si l'étalonnage ISM a réussi pour plusieurs ISM, faites une pause ici jusqu'au jour de l'utilisation prévue. Sinon, fabriquez plus d'ISM.
- Le jour de l'expérience, calibrez à nouveau la microélectrode (voir étape 3.29).

Figure 3: Préparation d'une microélectrode sélective d'ions. (A) ISM après l' écaillage arrière les extrémités d'un tube capillaire et de traction (étapes 3.2 à 3.6): Un seul cylindre aux deux extrémités oLe capillaire de verre fa est ébréché. Un ISM est généré en tirant un capillaire en verre à double canon pour générer deux micropipettes avec des fines pointes. ( B ) ISM après le remblayage des deux barils (étapes 3.7-3.9): La pointe d'un ISM unique est étirée à un diamètre de 2-5 μm. Le barillet sélectif aux ions est remblayé avec TMA-Cl, et le barillet de référence est relié au NaCl. ( C ) ISM avant le revêtement avec du chlorotriméthylsilane (étapes 3.11-3.13): Un fil d'argent chloré est inséré dans le barillet de référence. Le tube de polytétrafluoroéthylène (PTFE) est relié à une aiguille de 25 G et inséré dans le cylindre sélectif aux ions. Un joint hermétique sur les deux barils est créé à l'aide de cire dentaire. ( D ) Revêtement d'une micropipette avec du chlorotriméthylsilane (étapes 3.15-3.26): [Faible grossissement] Un ISM suspendu dans le chlorotriméthylsilane conformément à un stéréomicroscope monté horizontalement. [Agrandissement élevé] La vue à travers une stéréomicroste montée horizontalementOpe d'un tip ISM dans la solution de chlorotriméthylsilane. Après la visualisation de la pointe par un microscope, une petite quantité de solution de TMA-Cl est expulsée du barillet sélectif aux ions (assez pour générer une petite bulle de solution de TMA-Cl). Le support ISM est tapoté pour libérer une bulle de solution TMA-Cl, puis le chlorotriméthylsilane est étiré dans la pointe. Ce cycle est répété plusieurs fois. Une fois que le chlorotriméthylsilane a été éjecté de l'ISM, l'ISM est placé dans l'échangeur d'ions liquides (LIX) pour TMA et LIX est entraîné dans la pointe du canon sélectif d'ions. Cliquez ici pour voir une version plus grande de ce chiffre.
4. Préparation des microélectrodes d'iontophorèse
NOTE: Les microélectrodes d'iontophorèse doivent être fabriquées le jour de l'expérience.
- Tirez un capillaire en verre à base de borosilicate à double canon sur une verticale ouExtracteur rizontal. Adaptez les paramètres pour extraire une pipette similaire aux micropipettes tirées à l'étape 3.6 ( Figure 4a ).
- Placez la micropipette sous microscope composé utilisé à l'étape 3.7 et coupez la pointe en utilisant une glissière de microscope en verre de sorte que le diamètre résultant soit compris entre 2 et 5 μm ( Figure 4a ).
- Remplissez les deux barils avec la solution de remplissage TMA-Cl 150 mM en utilisant une seringue de 10 mL attachée à un filtre de 0,22 μm et une aiguille de 28 G, 97 mm ( Figure 4a ).
- Tapotez délicatement la micropipette pour s'assurer qu'aucune bulle d'air n'est laissée dans la solution des deux barriques.
- Placez des fils d'argent chlorés dans les deux barils de la micropipette. Assurez-vous que les fils sont assez profonds dans les solutions de remblai afin qu'ils restent en contact avec les solutions pour la durée de l'expérience.
- Sceller les fils dans les barils en utilisant de la cire dentaire chaude. Relier doucement t Il câline en les tordant les uns aux autres (microélectrode complétée montrée à la figure 4b ).
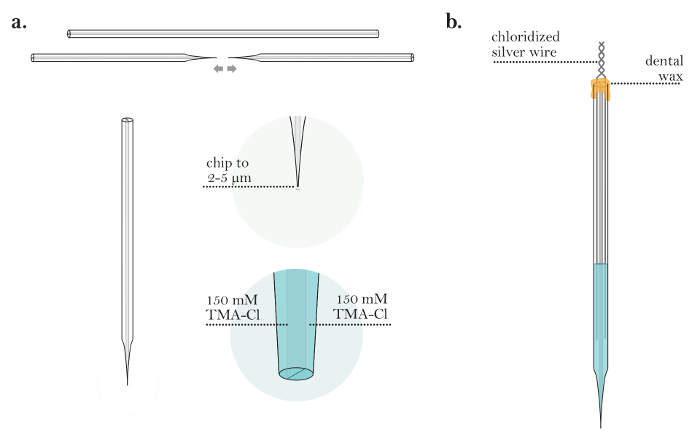
Figure 4: Préparation d'une microélectrode d'iontophorèse. (A) L' iontophorèse microélectrode après le remblayage deux canons (étapes 4/1 à 4/3): Une microélectrode d'iontophorèse est tiré à partir d' un tube capillaire. La pointe de la microélectrode est étirée à un diamètre de 2 à 5 μm. Les deux barils de la microélectrode à iontophorèse sont remplis de solution de TMA-Cl. ( B ) Microélectrode d'iontophorèse terminée (étapes 4.5-4.6): une microélectrode à iontophorèse avec deux fils d'argent chlorés et insérés dans les barils. Les barils de la microélectrode sont scellés avec de la cire, et les fils d'argent sont tordus à l'arrière de la microélectrode./files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.
5. Préparation du liquide céphalorachidien artificiel et des tranches de tissus cérébrales des rongeurs
- Préparer 1 L de liquide cérébrospinal artificiel (ACSF) avec une composition appropriée pour l'expérience et ajouter 0,5 mM de TMA-Cl.
REMARQUE: Le TMA-Cl est nécessaire pour établir une concentration de fond de TMA pendant l'expérience. - Préparer des tranches de cerveau de rongeurs d'une épaisseur de 400 μm selon les protocoles standard 11 , 12 . Utilisez l'ACSF préparé à l'étape 5.1 pour la dissection et la maintenance des tranches de cerveau.
6. Itophorèse en temps réel en agarose
- Allumez l'ordinateur exécutant les programmes Walter et Wanda.
REMARQUE: ces programmes sont disponibles gratuitement sur demande. Bien que ce logiciel ne soit pas essentiel, des programmes similairesLogiciel ou effectuer l'analyse à la main serait autrement nécessaire. - Exécutez l'ACSF à travers la chambre de submersion à un taux approprié ( par exemple, 2 mL / min). Réglez le régulateur de température à une température désirée et à une bulle ACSF avec 95% de O 2 /5% de CO 2 (ou un autre mélange de gaz approprié) pendant la durée de l'expérience.
- Monter une électrode indifférente (terre) dans un support approprié et immerger la pointe dans l'ACSF traversant la chambre de submersion. Connectez le fil au sol de la configuration de l'enregistrement.
- Remplir le gobelet poreux (fabriqué à l'étape 1.7) avec l'agarose à 0,3% préparé précédemment et le placer dans la chambre de submersion. Assurez-vous que la solution ne dépasse pas le dessus de la tasse.
- Fixez un ISM calibré au support de pipette d'un micromanipulateur et d'une microélectrode à iontophorèse à la seconde. Réglez les supports sur un angle approprié pour la configuration ( Figure 5a ).
- RelierLes fils de microélectrode ISM et iontophorèse à leurs étages respectifs de l'amplificateur d'enregistrement. Alternativement, connectez-vous directement à l'amplificateur (selon la configuration).
- Assurez-vous que le poids / positionnement des fils ou des clips de connexion ne provoque aucun mouvement des microélectrodes, car de petites fluctuations de positionnement peuvent influencer les résultats.
- Activez la configuration électronique (à partir de l'étape 2). Démarrez Walter et Wanda dans des cas distincts.
- Dans la GUI de Wanda, cliquez sur "Calibrer" ( Figure 6a ). Dans la zone Calibration ( Figure 6b ), remplissez les tensions mesurées lors de l'étalonnage ISM (étape 3.29) et cliquez sur "Ajuster les données".
REMARQUE: cela permet d'ajuster la représentation suivante de l'équation de Nicolsky (en variante, ajuster l'équation par un autre moyen pour obtenir M et K ):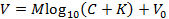
SaE, V est la tension mesurée (mV), M est la pente de Nicolsky (mV), C est la concentration d'ion (mM), K est l'interférence (mM) et V 0 est la tension de décalage (mV) 3 . - Cliquez sur "Accepter" dans la zone Calibrer pour transférer automatiquement la pente ( M ) et l'interférence ( K ) générée à l'étape 6.9 jusqu'à l'interface graphique principale.
REMARQUE: ici, K représente l'interférence Na, ce qui est généralement négligeable. - Sur le côté gauche de l'interface graphique, assurez-vous que tous les paramètres expérimentaux sont définis dans les entrées correspondantes ( Figure 6a ).
- Dans la zone Méthode source, définissez la source à la source iontophorétique (par défaut), la "Durée d'enregistrement" à "200 s" (par défaut), le "Commande d'impulsion" à "10 s" (par défaut), la "Fin d'impulsion" À "60 s" (par défaut), le "Courbe de polarisation" à "20 nA" (par défaut), le"Main Current" à "100 nA" (par défaut), et "Factor de conversion" à une valeur appropriée.
- Dans la boîte à électrode de mesure, réglez "Bath C" à la concentration de TMA contenue dans la solution de bain (exprimée en mM). Réglez le "gain total", "Canal de sortie", "Canal ISM" et "Canal Ref." Pour les valeurs appropriées pour le système d'acquisition de données utilisé.
REMARQUE: Le «facteur de conversion» doit être réglé sur une valeur appropriée (spécifique à l'unité iontophorétique utilisée). Cette valeur spécifie la quantité de courant transmise pour une tension appliquée donnée à partir du convertisseur D / A (nA / mV).
- Placez une sonde de température dans la tasse de gélose. Enregistrez la température mesurée dans l'entrée "Température" dans la case "Électrode de mesure" de la GUI ( Figure 6a ).
- Allumez l'illuminateur de sous-étage. Si nécessaire, allumez l'appareil photo sur le microRoscope et moniteur de caméra.
- Abaisser les microélectrodes d'au moins 1000 μm de profondeur dans l'agarose et les centrer dans la tasse ( Figure 5b ). Visualisez-les au microscope à l'aide d'un objectif 10X (objectif immersion à l'eau avec une longue distance de travail).
- Offrez la tension de l'amplificateur à 0 mV pour les canaux de référence et ISM afin d'établir la tension enregistrée dans l'agarose comme tension de référence.
- Sur l'amplificateur à deux canaux, déplacez manuellement le connecteur du canal ISM vers la sortie de soustraction de tension pour régler la soustraction 'on' entre les canaux de référence et ISM.
REMARQUE: la soustraction garantit que la tension change dans le canal ISM reflète les changements de la concentration de TMA seule. - Déplacez l'ISM afin qu'il touche la pointe de la microélectrode à iontophorèse. Centrez les conseils les uns sur les autres dans les trois axes directionnels.
- Zéro les positions relatives des deux microélectrodes sur leBoîtes de contrôle micromanipulateur. Assurez-vous que les microélectrodes sont centrées de manière précise et précise (critique).
- Déplacez l'ISM à 120 μm de la microélectrode d'iontophorèse dans un axe (l'axe gauche-droite, figure 5b ). Entrez cette distance dans la boîte "Electrode de mesure" de l'interface graphique ( Figure 6a ).
- Démarrez un enregistrement en cliquant sur "Acquérir" dans l'interface graphique ( Figure 6a ); Permettent au programme d'enregistrer un enregistrement complet.
NOTE: La microélectrode à iontophorèse reçoit un courant de polarisation constant. Après avoir cliqué sur «Acquérir», il y a un court délai avant que le courant principal ne soit appliqué pendant une durée limitée. - Répétez l'étape 6.20 deux à trois fois de plus. Attendez que le signal TMA revienne à la ligne de base avant d'acquérir de nouveaux enregistrements; Le programme sauvegardera chaque enregistrement pour une analyse ultérieure.
- Vérifiez l'espacement des deux microélectrodes en déplaçant l'ISM vers l'arrière tO la position zéro spécifiée par la boîte de contrôle. Si les microélectrodes ne sont plus centrées, centrez-les à nouveau en utilisant la même stratégie qu'à l'étape 6.17. Notez toute modification de la position des électrodes.
REMARQUE: si l'espacement change de plus d'environ 2%, les enregistrements acquis à l'étape 6.19 ne peuvent pas être considérés comme précis et de nouveaux doivent être pris.

Figure 5: Configuration des expériences dans Agar. (A) le programme d' installation pour l' expérience dans de l' agar dilué (étapes 6.1 à 6.5): Un petit récipient poreux rempli d'agar dilué placé dans une chambre de perfusion en cours d' exécution. Une microélectrode d'iontophorèse (côté gauche) et un ISM (côté droit) sont maintenus par des supports de microélectrodes; Les microélectrodes sont montés dans les bras des micromanipulateurs robotiques. Une sonde de température est placée dans un gel d'agar, et une électrode de sol indifférente est pDans la chambre de submersion. ( B ) Vue agrandie des microélectrodes en gélose: une microélectrode à iontophorèse (côté gauche) et un ISM (côté droit) sont visualisés en gélose en utilisant un objectif 10X d'immersion dans l'eau (objectif immergé ici dans NaCl 150 mM). Les microélectrodes sont positionnées à l'aide de micromanipulateurs à une profondeur de 1000 μm; L'espacement entre microélectrodes est de 120 μm. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 6: Wanda Computer Software Interface. (A) Navigation Wanda interface utilisateur graphique (GUI): L'écran qui apparaît après l' ouverture du logiciel Wanda. Dans la boîte (1), le milieu approprié, la molécule d'iontophorèse et la technique sont sélectionnés. (2) "Calibrer" est cliqué pour ouvrirLa boîte d'étalonnage Wanda. Après l'étalonnage de l'ISM (voir la figure 6b et le complément B), l'ISM est positionné dans la gélose ou le cerveau, comme décrit aux étapes 6 et 8 du protocole. Dans la case (6), toutes les valeurs appropriées pour l'expérience en cours d'exécution sont saisies. (7) "Acquérir" est cliqué sur un enregistrement; Un graphique de la tension par rapport au temps apparaît dans la partie supérieure droite de la GUI de Wanda. ( B ) Calibrage d'ISM dans Wanda : la fenêtre qui s'ouvre après avoir cliqué sur (2) "Calibrer" dans la GUI de Wanda. Les valeurs de l'étape 3.29 sont entrées dans la case (3), et (4) "Ajuster les données" est sélectionné. La courbe d'étalonnage est confirmée pour être linéaire. (5) "Accepter" est cliqué pour retourner à la GUI de Wanda. Cliquez ici pour voir une version plus grande de ce chiffre.
7. Analyse des données d'agarose
- Ouvrez leProgramme Walter sur l'ordinateur (PC). Dans le menu "0. Records From:", cliquez sur le bouton "Wanda / VOLTORO" pour lire les enregistrements générés par Wanda ( Figure 7a ) .Essumir que la sortie d'une feuille de calcul est nécessaire, ouvrez le logiciel approprié. Cliquez sur "Sheet 1,3" dans le "1. Write Excel?" Menu ( Figure 7b ).
- Dans la fenêtre contextuelle suivante, sélectionnez les enregistrements à lire et cliquez sur "Ouvrir" ( Figure 7b ); Notez que les enregistrements seront automatiquement représentés graphiquement. Pour commencer la procédure de montage, procédez comme suit.
- Dans le menu "2. Options", cliquez sur le bouton "select rec". Dans la fenêtre contextuelle " Figure 2 ", utilisez la souris pour déplacer le réticule sur le premier enregistrement à traiter ( Figure 7c ); Appuyez sur le bouton de la souris pour choisir l'enregistrement.
- Cliquez sur oN "courbe d'ajustement" dans le menu. Sélectionnez le nombre d'itérations souhaitées; Utilisez au moins 20 itérations d'ajustement pour obtenir un ajustement précis des données.
- Dans le menu, sélectionnez "tout" pour correspondre à tous les points de données et sélectionnez "continuer"; Le programme correspond à la courbe affichée. Observez la procédure d'ajustement et comparez l'enregistrement expérimental avec la meilleure courbe ajustée obtenue.
- Sélectionnez l'option pour écrire le résultat dans la feuille de calcul appropriée en cliquant sur "Excel" dans le menu "7. Résultats" ( Figure 7d ). Notez (et enregistrez) les données critiques suivantes qui seront utilisées pour déterminer la fonctionnalité de la microélectrode d'iontophorèse: ' D (E5) ', ' Référence D (E5) ', ' R_app ', numéro de transport ' n t ', ' Apparent N t '.
REMARQUE: " D (E5) ": coefficient de diffusion libre mesuréTx 10 5 (cm 2 / s); " Référence D (E5) ": coefficient de diffusion théorique libre x 10 5 (cm 2 / s). Cette valeur est extraite d'une base de données dans Walter en fonction de l'ion, du moyen et de l'entrée de température. " R_app ": espacement de la microélectrode apparente (cm), calculé en fonction de la mesure et de la référence D (E5) . " N t ": numéro de transport (sans dimension). Ce nombre détermine la fraction du courant d'iontophorèse qui est utilisé pour libérer TMA 4 . " Apparent n t ": Numéro de transport apparent (sans dimension). Il s'agit d'un numéro de transport calculé à partir de r_app . Ce nombre devrait être proche du n t mesuré. - Répétez les étapes 7.1-7.3 pour chacun des enregistrements pour une paire choisie de microélectrodes.
- Déterminer si la microélectrode à iontophorèse est utilisable en procédant comme suit.
- Comparez " r_app" avec le r réel ( c.-à-d. 120 μm); Ce critère est rempli si les valeurs moyennes de tous les essais sont inférieures à 4% l'une de l'autre.
- Comparez « D (E5)» avec la référence D (E5) ; Ce critère est rempli si les valeurs moyennes de tous les essais sont inférieures à 8% l'une de l'autre.
- Comparez le " n t " entre les essais avec la même microélectrode; Ce critère est rempli si les valeurs moyennes de tous les essais sont inférieures à 10% l'une de l'autre.
- Si l'un des critères de l'étape 7.5 n'a pas été rempli, dépanner la microélectrode d'iontophorèse ou commencer à tester une autre.
- Si la microélectrode d'iontophorèse est jugée appropriée pour l'expérience, enregistrez le nombre moyen de transport de tous les essais dans le champ "Transport Num N" dans la GUI de Wanda ( Figure 6a ).
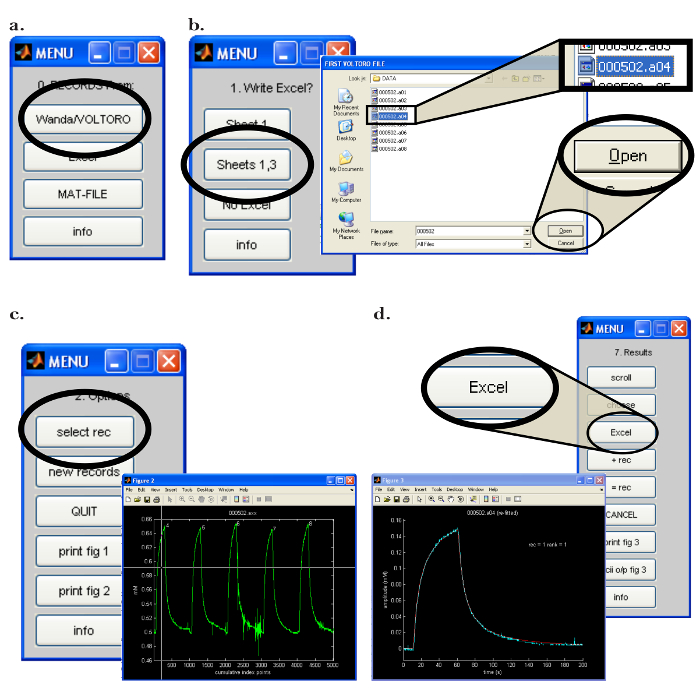
Figure 7: interface de logiciel Walter. (A) Le choix du programme de collecte de données Walter: Les « 0. Les enregistrements de: » menu apparaît après le démarrage du logiciel Walter. L'option de charger les enregistrements enregistrés par Wanda est sélectionnée en cliquant sur le bouton "Wanda / Voltoro". ( B ) Choisir l'emplacement de sortie de l'analyse des données et des données dans Walter: [Gauche] Une fois la feuille de calcul appropriée ouverte, "Feuilles 1,3" est choisie pour produire toutes les analyses de données Walter dans la feuille de calcul précédemment ouverte. [Droite] Une fois l'emplacement de sortie de l'analyse de données choisi, une fenêtre contextuelle s'ouvre, permettant à l'utilisateur de choisir les premier et dernier enregistrements à lire par Walter. ( C ) Choisir l'enregistrement pour analyser dans Walter: [Droite] Une fois que les fichiers à lire sont choisis, une fenêtre pop-up s'ouvrira avec tous les enregistrements choisis.Joué en tant que graphique (" Figure 2 "). [Gauche] Dans le menu "2.Options", "select rec" est cliqué, et la souris permet de déplacer les réticences pour identifier le premier enregistrement à analyser; On appuie sur le bouton de la souris pour choisir l'enregistrement. ( D ) Exportation de l'analyse de données de Walter vers une feuille de calcul: après avoir installé les données, une fenêtre contextuelle et le menu "7. Résultats" apparaissent. [Gauche] Graphique de l'enregistrement sélectionné (bleu) avec la courbe de diffusion ajustée générée par Walter (rouge). [Droite] Le menu "7. Résultats" permet à l'utilisateur d'écrire les données de l'analyse dans une feuille de calcul en cliquant sur le bouton "Excel". Cliquez ici pour voir une version plus grande de ce chiffre.
8. Itophorèse en temps réel dans des tranches de cerveau
- Placez un cerveau de 400 μm d'épaisseur sDes poux dans la chambre d'enregistrement, en veillant à ce qu'il soit complètement immergé dans l'ACSF qui s'écoule. Placez la tranche à l'aide d'un pinceau aquatique et fermez doucement avec une grille.
- Déplacez à la fois la microélectrode d'iontophorèse et l'ISM au-dessus du champ d'intérêt sur la tranche de cerveau. Immergez les deux dans l'ACSF qui coule mais au-dessus de la tranche.
- Offrez la tension pour les canaux de référence et de détection d'ions à "0" mV. Attendez que la tension dans les deux canaux se stabilise. Sur l'enregistreur graphique, marquer la tension mesurée sur le canal de détection d'ions de l'ISM. Utilisez cette option pour calculer le paramètre V de référence dans Wanda.
- Placez la microélectrode ISM et iontophorèse de 200 μm de profondeur dans la tranche et 120 μm l'une de l'autre. Attendre la stabilisation du signal après avoir déplacé la microélectrode dans la tranche du cerveau.
NOTE: Le courant de polarisation appliqué à la microélectrode à iontophorèse provoque une faible accumulation de TMA. C'est une erreur commune à prendre.Ecording trop tôt et sous-estimer l'accumulation de signal. - Sur l'enregistreur graphique, marquez la tension stabilisée mesurée dans la tranche du cerveau sur le canal de détection d'ions de l'ISM. Calculez la différence de tension entre le signal TMA mesuré à l'étape 8.3 et l'étape 8.4 et saisissez cette valeur dans le champ "Baseline V (mV)" dans la case Electrode de mesure de la GUI Wanda ( Figure 6a ).
- Sur le côté gauche de l'interface graphique, assurez-vous que tous les paramètres expérimentaux sont correctement enregistrés / entrés. Réglez "Moyen" sur "Cerveau", "Numéro de transport" à la valeur moyenne calculée pour la microélectrode d'iontophorèse à l'étape 7.4 et "Température" à la température du bain contenant la tranche.
REMARQUE: V doit être enregistré pour chaque ensemble de mesures. La ligne de référence V sera convertie par Wanda dans le paramètre C (mM) de base ( c'est-à-dire la concentration de TMA dans le tissu cérébral). - Commencez l'enregistrement en cliquant sur «Acquérir» et permettez-lui de prendre un enregistrement complet. Attendez que le signal TMA revienne à la ligne de base avant d'acquérir un nouvel enregistrement.
- Prenez deux ou trois enregistrements successifs avant de retirer les microélectrodes de l'emplacement choisi du cerveau. Entrez la température mesurée dans le logiciel Wanda immédiatement avant chaque enregistrement.
- Déplacez les deux microélectrodes en diagonale vers la surface de la tranche. Relevez les deux à au moins 50 μm au-dessus de la tranche. À l'aide de l'enregistreur graphique, déterminez tout changement entre le V mesuré maintenant et sa mesure à partir de l'étape 8.3.
- Centrez les pointes de l'ISM et les microélectrodes iontophorétiques entre elles dans les axes x, y, et z. Obtenez des changements d'espacement, le cas échéant, à partir de l'affichage de la boîte de contrôle micromanipulateur.
9. Analyse des données cérébrales
- Ouvrez une nouvelle feuille de calcul pour la sortie d'analyse.
- Répétez les étapes 7.1-7.4 dans Walter to analyzE les enregistrements tirés du cerveau.
- Écrivez les données sur la feuille de calcul en cliquant sur "Excel" dans le menu Walter. Enregistrer la fraction volumique α de l'ECS du cerveau; Λ , tortuosité du cerveau ECS; Et k (s -1 ), dégagement non spécifique.
10. Vérification du numéro de transport et de l'étalonnage ISM
- Mesurez le numéro de transport ISM ( n t ) à la fin de l'expérience en utilisant le protocole ci-dessous. Alternativement, vérifiez n t après des essais critiques ou lorsque les mesures semblent anormales. Cependant, la vérification n t trop de fois peut entraîner un traumatisme à la tranche du cerveau.
- Prenez de nouveaux enregistrements en agarose. Voir les étapes 6.4, 6.11, 6.12, 6.14, 6.15 et 6.17-6.22.
- Répétez les étapes 7.1-7.4 dans Walter pour obtenir le n t des nouveaux enregistrements d'agarose. Inspectez la feuille de calcul: si le n t a changé par plusQue 10% des n t obtenus avant les mesures du cerveau, les données obtenues avec cette microélectrode iontophorétique ne sont pas fiables.
- Effectuez un nouvel étalonnage (voir l'étape 3.29) pour l'ISM après que toutes les données du cerveau ont été collectées. Utilisez les données d'étalonnage ISM nouvellement obtenues comme entrée dans la boîte d'étalonnage Wanda (voir les étapes 6.9 et 6.10) et vérifiez que la valeur de la pente diffère de moins de 10% par rapport à l'étalonnage précédent.
REMARQUE: les données obtenues avec cet ISM ne sont pas fiables si la valeur de la pente diffère de plus de 10% par rapport à l'étalonnage précédent.
Access restricted. Please log in or start a trial to view this content.
Résultats
L'utilité de la technique RTI est démontrée dans une expérience conçue pour mesurer les changements dans α et pendant un défi hypoosmolaire ( Figure 8 et Figure 9 ). Il a déjà été démontré que la réduction de l'osmolarité de l'ECS par lavage sur ACSF hypotonique produirait une diminution de α et une augmentation de λ 13 .
Access restricted. Please log in or start a trial to view this content.
Discussion
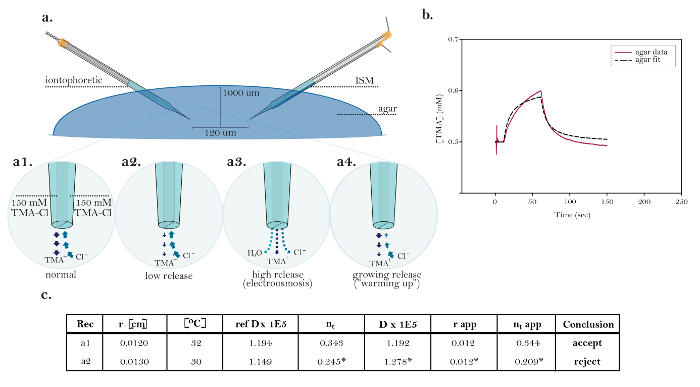
Figure 10: Données non idéales démontrant des problèmes techniques communs. (A) Les diagrammes de problèmes techniques communs avec iontophorèse microélectrodes: Comparaison de la libération normale de la TMA d'un ionophorèse fonctionnement microélectrodes avec trois sources démontrant des problèmes techniques. [Agrandissement élevé, a1] Le courant dans une source iontophorétique...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont pas d'intérêts financiers concurrents.
Remerciements
Le travail a été soutenu par NIH NINDS subvention R01 NS047557.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
Références
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon