Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ионтофорез в реальном времени с тетраметиламмонием для количественного определения объемной доли и торможности внеклеточного пространства мозга
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает ионтофорез в реальном времени, метод измерения физических параметров внеклеточного пространства (ECS) живых мозгов. Диффузия инертной молекулы, высвобождаемой в ECS, используется для расчета объемной доли ECS и извилистости. Он идеально подходит для изучения острых обратимых изменений в ECS мозга.
Аннотация
В этом обзоре описаны основные концепции и протокол для выполнения метода ионтофореза в реальном времени (RTI), золотой стандарт для исследования и количественной оценки внеклеточного пространства (ECS) живого мозга. ECS окружает все клетки мозга и содержит как интерстициальную жидкость, так и внеклеточный матрикс. Транспортировка многих веществ, необходимых для активности мозга, включая нейротрансмиттеры, гормоны и питательные вещества, происходит путем диффузии через ECS. Изменения объема и геометрии этого пространства происходят при нормальных мозговых процессах, таких как сон и патологические состояния, такие как ишемия. Однако структура и регуляция ECS головного мозга, особенно в больных государствах, по-прежнему в значительной степени не изучены. Метод RTI измеряет два физических параметра живого мозга: объемную долю и извилистость. Объемная доля - это доля объема ткани, занимаемого ECS. Тортютность - это мера относительного препятствия, с которым сталкивается вещество при рассеивании через мозгПо сравнению со средой без препятствий. В RTI, инертная молекула пульсирует от исходного микроэлектрода в мозг ECS. Когда молекулы диффундируют от этого источника, изменяющаяся концентрация ионов измеряется во времени с использованием ион-селективного микроэлектрода, расположенного примерно на расстоянии 100 мкм. Из полученной диффузионной кривой можно рассчитать как объемную долю, так и извилистость. Этот метод использовался в срезах мозга у нескольких видов (включая людей) и in vivo для изучения острых и хронических изменений в ECS. В отличие от других методов, RTI может использоваться для изучения как обратимых, так и необратимых изменений в ECS мозга в реальном времени.
Введение
Внеклеточное пространство (ECS) представляет собой сеть взаимосвязанных каналов, внешних по отношению ко всем клеткам мозга, и содержит как интерстициальную жидкость, так и внеклеточный матрикс ( рис. 1а и рис. 1b ). Распределение многих веществ, необходимых для функционирования мозговых клеток, включая питательные вещества, гормоны и нейротрансмиттеры, происходит путем диффузии через ECS. Изменения физических параметров этого пространства, включая объем, геометрию и внеклеточную матрицу, могут существенно повлиять на диффузию через ECS и локальные концентрации ионов, которые купают клетки головного мозга, которые оказывают глубокое влияние на функцию клеток мозга 1 , 2 .
В настоящее время ионтофорез (RTI) используется для определения двух структурных характеристик области мозга: объемная доля и извилистость 3 , 4 ,"Xref"> 5. Объемная доля ( α ) представляет собой долю объема ткани, занимаемого ECS ( V ECS ) относительно общего объема ткани ( V- ткань ) в типичном элементарном объеме;
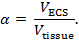
Tortuosity ( λ ) является относительным препятствием, которое вещество встречает при рассеивании через область мозга по сравнению со средой без препятствий;

Где D * (см 2 с -1 ) - эффективный коэффициент диффузии вещества в головном мозге, а D (см 2 с -1 ) - коэффициент свободной диффузии вещества в свободной среде, такой как разбавленный агарозный гель.
Сегодня наиболее часто используемое зондирующее вещество для RМетод ТИ представляет собой небольшой катион тетраметиламмоний (ТМА). TMA имеет молекулярную массу 74 г / моль, полностью диссоциирует в растворе и имеет один положительный заряд. RTI с этим ионом показали, что α  0,2 и λ
0,2 и λ  1.6 1 , 2 . Это означает, что ECS составляет примерно 20% от общего объема мозга и что диффузия небольшой инертной молекулы в ECS происходит примерно в 2,5 раза медленнее, чем в среде без препятствий 3 . Однако как α, так и λ изменяются в зависимости от возраста, региона и состояния мозга, а также в патологических условиях 1 . Изменения этих параметров были связаны с развитием мозга, старением, сном, эпилепсией и многими другими фундаментальными процессами и заболеваниями мозга 1, 6 . В то время как другие методы измеряют α и λ , RTI может измерять как в локализованных областях живой ткани в реальном времени. По этой причине RTI стала незаменимым инструментом для исследования изменений α и λ во время острых и обратимых проблем.
1.6 1 , 2 . Это означает, что ECS составляет примерно 20% от общего объема мозга и что диффузия небольшой инертной молекулы в ECS происходит примерно в 2,5 раза медленнее, чем в среде без препятствий 3 . Однако как α, так и λ изменяются в зависимости от возраста, региона и состояния мозга, а также в патологических условиях 1 . Изменения этих параметров были связаны с развитием мозга, старением, сном, эпилепсией и многими другими фундаментальными процессами и заболеваниями мозга 1, 6 . В то время как другие методы измеряют α и λ , RTI может измерять как в локализованных областях живой ткани в реальном времени. По этой причине RTI стала незаменимым инструментом для исследования изменений α и λ во время острых и обратимых проблем.
Теория, поддерживающая RTI, была первоначально подтверждена Николсоном и Филлипсом, и этот метод был широко использован с того времени 4 , 7 . Эксперименты с использованием RTI начинаются с высвобождения импульса ТМА из исходного микроэлектрода путем ионтофореза в разбавленный агарозный гель. После выталкивания ионы свободно диффундируют от точечного источника, выбирая из потенциально бесконечного числа случайных путей ( рис. 1d ). Меняющаяся концентрация ионов измеряется во времени с использованием ион-селективного микроэлектрода (ISM), расположенного примерно100 мкм ( рис. 1в ). Изменения концентрации ТМА рисуются и привязаны к кривой, которая позволяет рассчитывать как D, так и транспортный номер микроэлектрода ионофореза (параметры, обсуждаемые в Протоколе). С этими значениями процедура повторяется в интересующей области мозга для получения D * и для вычисления как α, так и λ . Управление микроэлектроном ионтофореза, сбор данных, графическое отображение и подгонка кривой концентрации ТМА, а также расчет экспериментальных параметров обычно выполняются программами Wanda и Walter, которые были специально разработаны для этой цели (программное обеспечение и их руководства Свободно предоставляется авторам по запросу).
В разделе «Протокол» настоящего обзора описаны основные процедуры, необходимые для проектирования и проведения РТИ в мозговых срезах грызунов. Этот метод также использовался в не-стержнеЛОР - модели, в том числе срезов головного мозга человека и в естественных препаратов мозга 1, 4, 6, 8, 9. В разделе «Репрезентативные результаты» представлены как идеальные, так и неидеальные результаты для выявления нюансов в интерпретации данных. Наконец, в разделе «Обсуждение» вкратце рассматриваются методы устранения неполадок, ограничения RTI, альтернативные методы, используемые для изучения ECS, и будущие приложения RTI.

Рисунок 1: Диаграммы диффузии через ECS. (А) Схема ECS: Демонстрирует размер и расположение ECS в типичной секции мозга. Желтый обозначает ECS между процессами серой клетки головного мозга. Объем ECS составляет примерно 20% от общего объема ткани ( т. Е. Объемная доля = 0.2) в физиологических условиях. ( B ) Увеличенная диаграмма ECS: показывает физические параметры, способствующие извилистости, включая геометрию мозга (серый) и внеклеточный матрикс (схематично как сетка разноцветных гликозаминогликанов и протеогликанов). ( C ) Трехмерная диаграмма диффузии из точечного источника: Демонстрирует чистое движение инертных молекул от ионтофоретического источника до ISM. Исключая диффузионные барьеры и поглощение клеток, молекулы диффундируют наружу во всех направлениях, создавая сферический фронт концентрации. МСМ количественно определяет локальную концентрацию инертных молекул, высвобождаемых из ионтофоретического источника. ( D ) Компьютерное моделирование диффузии в ECS головного мозга: [Далеко слева] Настройка для моделирования методом Монте-Карло; Зеленые сферы представляют собой процессы в мозговых ячейках, а красный крест - точечный источник. Эта установка моделирует мозговую ткань, показанную на рисунке 1a . [Средние изображения] 3 и6, выполняющие случайные движения, когда они диффундируют через внеклеточное пространство головного мозга, показано в двух измерениях. [Крайний правый] Случайные блуждания многих молекул, выпущенных из точечного источника. Чистое движение всех молекул от точечного источника наружу, как показано на рисунке 1в . Кумулятивные случайные блуждания описывают пространства между ячейками ( т. Е. ECS, см. Ссылку 5 для дальнейшего объяснения). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры для животных, используемые для получения образцов тканей, были одобрены комитетом по этике животных в Медицинском центре SUNY Downstate.
1. Подготовка решений и оборудования
- Подготовьте 150 мМ раствор засыпки NaCl для эталонного ствола ISM. Храните его в 10 мл шприце, прикрепленном к фильтру 0,22 мкм (для удаления бактерий или частиц).
- Приготовить 150 мМ раствор TMA хлорида (TMA-Cl) для микроэлектродов. Храните его в 10 мл шприце, прикрепленном к фильтру 0,22 мкм. Подготовьте решения TMA-Cl (в этом протоколе) из 5 м запатентованного раствора производителя, чтобы обеспечить правильную концентрацию.
- Хлоридируйте по меньшей мере четыре серебряных провода для изготовления микроэлектродов, погружая провода в отбеливатель (гипохлорит натрия) в течение не менее 2 часов. Удалите излишки отбеливателя с этанолом и дайте проводам высохнуть.
- Подготовьте 50 мл 0,3% агарозы в 150 мМ NaCl и 0,5 мМ TMA-Cl в стаканеИ покрыть его. Используйте агарозу, которая является порошкообразной и достаточно свежей, чтобы обеспечить хорошие измерения диффузии.
- Разогрейте и смешайте раствор агарозы с мешалкой, чтобы растворить его. Дайте раствору остыть до комнатной температуры. Хранить при температуре 4 ° C в течение 1 недели.
- Подготовьте безразличный (заземленный) электрод, изготовленный из 4% агарозы в 1 М KCl (указания в Приложении A)
- Создайте небольшую пористую чашу, которая может помещаться в экспериментальную камеру и которая обеспечивает электрическую непрерывность между ее содержимым и внешней средой ( рис. 2а ). Поместите металлическое кольцо на дно этой чашки, чтобы предотвратить его плавание при частичном погружении в воду.
- Используйте серийное разведение 5 M TMA-Cl, чтобы сделать пять 100 мл TMA-Cl растворов для калибровки ISM. Растворы должны иметь конечные концентрации 0,5, 1, 2, 4 и 8 мМ TMA-Cl, все в 150 мМ NaCl. Храните калибровочные растворы в герметичной чашке для предотвращения испарения.
2. Электронная настройка
- Подключите компоненты экспериментальной установки RTI в соответствии с блок-схемой на рис. 2b ; Включают в себя усилитель с двумя входными каналами (один из которых должен быть очень высоким импедансом для ион-селективного цилиндра ISM), фильтр нижних частот, установленный на 10 Гц, блок-рекордер, A / D + D / A Конвертер, ионтофоретический блок (или усилитель, способный подавать импульсы постоянного тока), и компьютер (ПК), на котором запущены программы Wanda и Walter. Проверьте электронную установку, чтобы убедиться, что все соединения установлены.
- Защитите экспериментальную установку в заземленной оболочке (например, клетке Фарадея), если это необходимо, поскольку ISM имеют высокое сопротивление и чувствительны к артефактам, созданным близлежащим движением.
- Создайте специализированную калибровочную станцию ISM, состоящую из двух входного усилителя, устройства для записи диаграмм, соответствующего держателя ISM и равномерного заземляющего электрода. Если возможно,Экранируйте корпус. Пропустите этот шаг, если ISM откалиброваны в экспериментальной установке (шаг 3.29)

Рисунок 2: Пористая экспериментальная чашка и электронная настройка. (А) Пористая экспериментальная чашка: Пористый сетка используется для создания экспериментальной чашки , которая позволяет электрическую непрерывность между агарозами (внутри) и экспериментальной купальной жидкостью (снаружи). Металлическое кольцо прикреплено к нижней части чашки, чтобы чашка не плавала в купальном растворе. ( B ) Блок-схема установки RTI (шаги 2.1 и 2.2): ISM подключен к усилителю (amp.). У ИСМ есть два ствола. Один содержит жидкий ионообменник (LIX) в наконечнике и генерирует напряжение, пропорциональное логарифму концентрации ТМА на наконечнике вместе с локальным внешним напряжением; гоE сигнальный путь представлен красной линией. Другой цилиндр ИСМ известен как опорный цилиндр и измеряет напряжение окружающей среды на кончике ИСМ; Он связан синим сигнальным трактом. Усилитель имеет две так называемые головные ступени, которые подключаются к ISM; Эти единицы имеют коэффициент усиления 1 (x1) и соответствуют высокому импедансу микроэлектрода до низкого импеданса остальных схем усилителя. Стадии головку, соединенную с ионоселективным стволом должен иметь возможность соответствовать входящее сопротивление около 1000 МОм, а сопротивление эталонного ствола, как правило, около 10 МОм. После выхода на сцене головки, напряжение от опорного ствола инвертируется и вычитается из напряжения на ион-селективного ствол с помощью суммирующего усилителя (a), чтобы получить чистое напряжение ионного сигнала. Выходы усилителя переходят в блок формирования сигнала, который обеспечивает дополнительное усиление и мультипольный фильтр нижних частот (≤10 Гц, как правило, Bessel fiLter), который удаляет шум и предотвращает наложение сигналов на аналого-цифровой преобразователь (A / D). Выходы фильтра также отображаются на магнитофоне. АЦП преобразует в цифровую форму сигналы и отправляет их на персональный компьютер (ПК). ПК также генерирует цифровой сигнал, который преобразуется цифро-аналоговым преобразователем (D / A) в аналоговый импульс напряжения, который подается в блок ионтофореза, который преобразует напряжение в импульс тока постоянной амплитуды и отправляет его К микроэлектроду ионофореза. Канал сигнала ионтофореза представлен зеленой линией. Сигнал сбора данных и ионтофореза находится под контролем программы Wanda, которая генерирует выходной файл для каждой записи диффузии в виде записи напряжения и времени вместе со всеми параметрами, которые определяют эксперимент. Вторая программа, Walter, считывает выходной файл и использует данные калибровки ISM для преобразования оцифрованных напряжений в концентрации. Концентрация veКривые времени rsus затем устанавливаются в Уолтере для соответствующего решения уравнения диффузии. D и n t извлекаются, если среда является агарозной, а λ и α экстрагируются, если средой является мозг. Аналоговые сигналы - сплошные линии; Цифровые сигналы - пунктирные линии. В ванне, содержащей срез, имеется также равномерный заземляющий электрод (не показан). Красные линии = ионный сигнал, синие линии = опорный сигнал, зеленые линии = команда ионтофореза, сплошные линии = аналоговые, пунктирные линии = цифровые. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Подготовка и калибровка ион-селективных микроэлектродов
- Создайте ISM, используя протокол за один день до эксперимента. Внесите ISM в партии, чтобы обеспечить как минимум две работы в день эксперимента.
ПРИМЕЧАНИЕ. Большинство ISM стабильны в течение дня илидва. Изготовление ISM чувствительно к влажности и атмосферным условиям. Не каждый микроэлектрод успешно откалибрует. - Отрежьте примерно 0,5 см стекла в конце одного из бочек двухствольного боросиликатного капилляра, используя старую пару щипцов.
- Чип одного ствола на противоположном конце капилляра ( рис. 3а ). Убедитесь, что перегородка не повреждена (критическая). Осторожно: надевайте защитные очки, чтобы предотвратить травмы из-за снарше.
- Поместите капилляр в бутылку ацетона в течение не менее 1 часа для удаления загрязняющих веществ.
- Удалите капилляр из ацетона и пульсируйте чистый, сухой, сжатый газообразный азот или воздух через него, чтобы удалить лишний ацетон. Удалите весь ацетон в капилляр, так как остаточный ацетон может мешать силанизации (критический).
- Выполните наконечник микропипетки на вертикальном или горизонтальном съемнике. Определите параметры, чтобы вытащить пипетку с длинным конусом иОстрый наконечник диаметром около 1 мкм или менее. В конце этого шага один капилляр будет превращен в две пипетки ( рис. 3а ).
- Визуализируйте одну микропипетку под микроскопом, вертикальным микроскопом с объективом 10X. Отрежьте наконечник с помощью стеклянного слайда микроскопа, чтобы конечный диаметр наконечника ( то есть, оба ствола) составлял от 2 до 5 мкм ( рисунок 3b ). С этого момента эта пипетка будет называться ISM.
- Заполните скошенный барабан ISM 150 мМ эталонным раствором NaCl через отверстие на скошенной стороне, используя шприц объемом 10 мл, прикрепленный к фильтру 0,22 мкм и игле 28 G, 97 мм ( рисунок 3b ). Не заполняйте ствол, превышающий три четверти высоты ствола.
- Заполните необработанную ствол ISM 150 мМ раствором TMA-Cl для обратной засыпки. Коснитесь ISM осторожно, чтобы выбить пузырьки воздуха из раствора. Проверьте наличие пузырьков под микрофономRoscope используется для обрезки наконечника.
- Пламя задней части ISM с помощью горелки Bunsen, чтобы гарантировать, что сообщение об обратной засыпке не встречается на перегородке в задней части ISM. Убедитесь, что верхняя четверть ISM сухая после пламени.
- Вставьте хлорированную серебряную проволоку в эталонный раствор ISM и согните провод, выступающий из капилляра, чтобы отметить это как опорный цилиндр ( рис. 3c ). Убедитесь, что провод погружен в раствор обратной засыпки и остается в растворе в течение всего эксперимента.
- Нанесите небольшую длину политетрафторэтиленовой трубки (длиной около 20 см) поверх наконечника иглы шприца 25 G. Поместите другой конец трубки в задней части ионоселективного ствола. Убедитесь, что труба находится в стволе, но выше раствора обратной засыпки ( рис. 3c ).
- Нагрейте палочку зубного воска с помощью горелки Бунзена и запечатайте как трубу, так и silvПровод в их соответствующие бочки ( рис. 3в ). Убедитесь, что вокруг пластиковой трубки в ионоселективном цилиндре (критический) создается сплошное воздушное уплотнение.
- Подготовьте небольшой прозрачный стеклянный контейнер (5 мл или менее) 4% хлортриметилсилана в ксилоле. Осторожно: ксилолы и силаны очень опасны для здоровья; Обрабатывайте оба химических вещества внутри вытяжного шкафа и выбрасывайте их соответствующим образом.
- Расположите контейнер перед стереоскопическим рассекающим микроскопом, установленным горизонтально в вытяжном шкафу. Закрепите ISM вертикально над контейнером с помощью микроманипулятора ( рис. 3d ).
- Окуните кончик микроэлектрода в раствор хлортриметилсилана.
- Прикрепите пустой шприц объемом 10 мл к игле с 25 калибрами, ведущей к ISM. Наносить положительное давление воздуха из шприца до образования пузырька раствора TMA-Cl; Этот шаг должен выполняться под прямой визуализацией через микроскоп.
- Коснитесь держателя ISM осторожно, чтобы выбить пузырек из наконечника.
- Нанесите раствор хлортриметилсилана на высоту примерно 1500 мкм в кончик ISM, используя отрицательное давление на 10 мл шприц.
- Полностью изгоните раствор хлортриметилсилана с кончика ISM до тех пор, пока на кончике не появится пузырь раствора TMA-Cl ( рисунок 3d ).
- Повторите шаги 3.19 и 3.20 пять раз. Убедитесь, что ровный, непрерывный столбец жидкости втягивается в наконечник каждый раз. Если в наконечник нельзя вставить раствор, проверьте, заблокирована ли трубка, воздушное уплотнение является неполным или кончик ISM заблокирован.
- Вымыть весь раствор хлортриметилсилана из наконечника до тех пор, пока не будет образован пузырь раствора TMA-Cl.
- Поддерживая положительное давление на шприц, удалите ISM из раствора ксилола. Убедитесь, что весь раствор ксилола вытеснен из наконечника ISM, так как избыток ксилола разрушит экстрактКолонка вешалки, созданная на последующих этапах.
- Поместите наконечник ISM в маленький прозрачный контейнер (или тот, в который входит теплообменник, или небольшая кювета), удерживая жидкий ионообменник (LIX) для TMA. Выполните этот шаг под прямой визуализацией, используя настройку горизонтального микроскопа.
- Нанесите небольшое количество отрицательного давления, чтобы нарисовать минимальное количество LIX в наконечник ( т. Е. Как только LIX увидит вход в наконечник, прекратите применение отрицательного давления).
- Отсоедините 10-мл шприц от трубки и позвольте ISM сидеть в течение 5 мин. В течение этого времени LIX войдет в силанизированный наконечник, пока не достигнет состояния равновесия.
- Удалите ISM из LIX. Вытащите трубу из ствола теплообменника (удаляя как можно меньше воска). Поместите хлоридированную серебряную проволоку в небольшое отверстие, созданное на заднем конце ISM. Уплотните проволоку в засыпку ствола теплообменника расплавленным воском.
- Разрешить ISM сидетьВ течение не менее 30 мин. Прикрепите завершенные ISM к внутреннему краю стакана с использованием любого гибкого временного клея.
- Откалибруйте ISM, записав напряжение, измеренное ISM в каждом калибровочном растворе, сделанном на шаге 1.8.
ПРИМЕЧАНИЕ. Калибровку можно выполнить на калибровочной станции (см. Шаг 2.3) или в экспериментальной установке. Эта процедура описана в Приложении B и в Haack et al. 10 . - Если калибровка ISM прошла успешно для нескольких ISM, остановитесь здесь до дня предполагаемого использования. Если нет, создайте больше ISM.
- В день эксперимента снова откалибруйте микроэлектрод (см. Шаг 3.29).

Рисунок 3: Получение ион-селективного микроэлектрода. (А) после того, как ISM зазубрин назад концы капилляра и вытягивать (шаги 3.2-3.6): Один баррель на обоих концах OFa стеклянный капилляр. ISM генерируется путем вытягивания одного двухствольного стеклянного капилляра для создания двух микропипеток с точными наконечниками. ( Б ) ISM после засыпки обоих бочек (шаги 3.7-3.9): Кончик одного ISM отколовается до диаметра 2-5 мкм. Ионоселективный цилиндр засыпается TMA-Cl, а эталонный цилиндр засыпан NaCl. ( C ) ISM перед нанесением хлортриметилсилана (этапы 3.11-3.13): В эталонный цилиндр вставлена прорезь из хлорированного серебра. Трубка из политетрафторэтилена (ПТФЭ) соединена с иглой 25 G и вставлена в ион-селективный цилиндр. С помощью зубного воска создается герметичное уплотнение поверх обоих бочек. ( D ) Покрытие микропипетки хлортриметилсиланом (этапы 3.15-3.26): [Низкое увеличение] ISM суспендировали в хлортриметилсилане в соответствии с горизонтально установленным стереомикроскопом. [Высокое увеличение] Вид через горизонтально установленный стереомикроскопOpe кончика ISM в растворе хлортриметилсилана. После визуализации наконечника через микроскоп небольшое количество раствора TMA-Cl вытесняется из ион-селективного ствола (достаточно для создания небольшого пузырька раствора TMA-Cl). Держатель ISM защелкивается для выпуска пузырька раствора TMA-Cl, а затем хлортриметилсилан вытягивается в наконечник. Этот цикл повторяется несколько раз. После того, как хлортриметилсилан выбрасывается из ISM, ISM помещают в жидкий ионообменник (LIX) для TMA, а LIX втягивают в кончик ионно-селективного цилиндра. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Подготовка микроэлектродов Iontophoresis
ПРИМЕЧАНИЕ: Микроэлектроды Iontophoresis должны быть изготовлены в день эксперимента.
- Потяните двухствольный капилляр из боросиликатного стекла по вертикали или hoГоризонтальный съемник. Определите параметры, чтобы вытащить пипетку, подобную микропипеткам, вытащенные на шаге 3.6 ( рисунок 4a ).
- Поместите микропипетку под сложный микроскоп, использованный на этапе 3.7, и разрежьте наконечник с помощью стеклянного слайда микроскопа, чтобы полученный диаметр был между 2 и 5 мкм ( рис. 4а ).
- Заполните обе бочки раствором 150 мМ TMA-Cl с обратной промывкой, используя 10 мл шприц, прикрепленный к фильтру 0,22 мкм и игле 28 G, 97 мм ( рис. 4a ).
- Аккуратно коснитесь микропипетки, чтобы не осталось пузырьков воздуха в растворе обоих бочек.
- Поместите пробирки из хлорированного серебра в оба ствола микропипетки. Убедитесь, что провода достаточно глубоки в растворах обратной засыпки, чтобы они оставались в контакте с растворами в течение всего эксперимента.
- Уплотните провода в бочки, используя горячий зубной воск. Аккуратно заблокируйте t Он прокручивает их друг вокруг друга (завершенный микроэлектрод, показанный на рисунке 4b ).
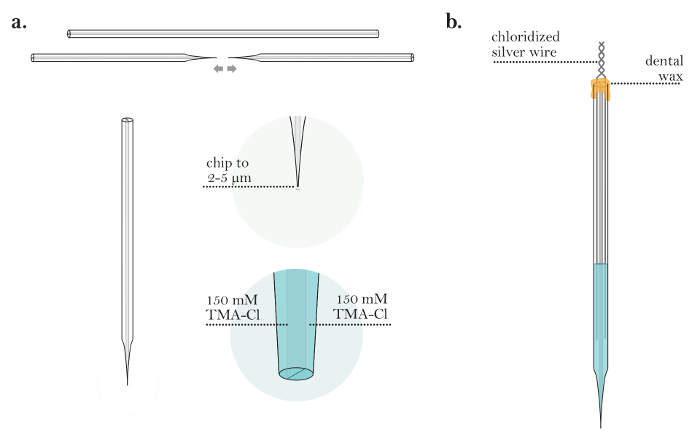
Рисунок 4: Приготовление микроэлектрода Iontophoresis. (А) Электрофорез микроэлектрода после засыпки обоих стволов (шаги 4.1-4.3): ионофорез микроэлектрода вытягивается из капиллярной трубки. Кончик микроэлектрода отщепляется до диаметра 2-5 мкм. Оба бочка ионтофореза микроэлектрода заполнены раствором ТМА-С1. ( Б ) Завершенный микрофонный электрофон с ионофорезом (шаги 4.5-4.6): микроэлектрод с ионтофорезом с двумя прорезями из хлорированного серебра, вставленными в бочки. Бочки микроэлектрода запечатываются воском, а серебряные провода скручены вместе на задней части микроэлектрода./files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этого рисунка.
5. Приготовление искусственной жидкости из целлюлозной жидкости и грызунов
- Подготовьте 1 л искусственной спинномозговой жидкости (ACSF) с композицией, подходящей для эксперимента, и добавьте к ней 0,5 мМ TMA-Cl.
ПРИМЕЧАНИЕ. TMA-Cl необходим для установления фоновой концентрации TMA во время эксперимента. - Подготовьте срезы мозга грызунов толщиной 400 мкм согласно стандартным протоколам 11 , 12 . Используйте ACSF, подготовленный на этапе 5.1, для рассечения и поддержания срезов мозга.
6. Ионтофорез в реальном времени в агарозе
- Включите компьютер с программами Уолтера и Ванды.
ПРИМЕЧАНИЕ. Эти программы доступны по запросу. Хотя это программное обеспечение не является существенным, программирование аналогичныхПрограммного обеспечения или выполнения анализа вручную. - Пропустите ACSF через камеру погружения с соответствующей скоростью ( например, 2 мл / мин). Установите регулятор температуры на желаемую температуру и пузырь ACSF с 95% O 2 /5% CO 2 (или другой подходящей газовой смесью) в течение всего эксперимента.
- Установите равномерный (заземляющий) электрод в подходящий держатель и погрузите наконечник в ACSF, проходящий через камеру погружения. Подключите провод к основанию настройки записи.
- Заполните пористую чашку (сделанную на этапе 1,7) с помощью 0,3% агарозы, приготовленной ранее, и поместите ее в камеру для погружения. Убедитесь, что решение не работает над верхней частью чашки.
- Закрепите калиброванный ISM на держателе пипетки одного микроманипулятора и микроэлектрода с ионтофорезом до второго. Установите держатели под углом, соответствующим настройке ( рис. 5а ).
- соединятьПроводов микропровода ISM и ионтофореза к их соответствующим ступеням головки усилителя записи. В качестве альтернативы, подключайтесь непосредственно к усилителю (в зависимости от настройки).
- Убедитесь, что вес / расположение соединительных проводов или зажимов не вызывает никакого движения микроэлектродов, так как небольшие изменения в позиционировании могут влиять на результаты.
- Включите электронную настройку (с шага 2). Начните Уолтера и Ванду в отдельных случаях.
- В графическом интерфейсе Wanda нажмите «Откалибровать» ( рис. 6a ). В поле «Калибровка» ( рис. 6b ) заполните напряжения, измеренные во время калибровки ISM (шаг 3.29), и нажмите «Установить данные».
ПРИМЕЧАНИЕ. Это позволяет подобрать следующее представление уравнения Никольского (альтернативно подставить уравнение другим способом для получения M и K ):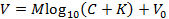
ЕеE, V - измеренное напряжение (mV), M - никольский наклон (mV), C - концентрация иона (mM), K - интерференция (mM), а V 0 - напряжение смещения (mV) 3 . - Нажмите «Принять» в поле «Калибровка», чтобы автоматически передать наклон ( M ) и помехи ( K ), сгенерированные на шаге 6.9, в главный графический интерфейс.
ПРИМЕЧАНИЕ. Здесь K представляет собой интерференцию Na, которая обычно незначительна. - В левой части графического интерфейса убедитесь, что все экспериментальные параметры заданы в соответствующих записях ( рис. 6а ).
- В поле «Метод источника» установите источник в ионтофоретический источник (по умолчанию), «Длительность записи» на «200 с» (по умолчанию), «Пульс начинается» до «10 с» (по умолчанию), «Импульсный конец», До «60 с» (по умолчанию), «Bias Current» - «20 nA» (по умолчанию),«Основной ток» - «100 нА» (по умолчанию), а «Коэффициент конверсии» - соответствующее значение.
- В коробке измерительных электродов установите «Bath C» в концентрацию TMA, содержащуюся в растворе ванны (выраженная в мМ). Установите «Total Gain», «Output Channel», «ISM Channel» и «Ref Channel» на соответствующие значения для используемой системы сбора данных.
ПРИМЕЧАНИЕ. «Коэффициент конверсии» должен быть установлен на соответствующее значение (определенное для используемого ионтофоретического блока). Это значение определяет величину тока, который передается для данного приложенного напряжения от цифрового преобразователя (nA / mV).
- Поместите датчик температуры в чашку агара. Запишите измеренную температуру в позиции «Температура» в поле «Измерительный электрод» в графическом интерфейсе ( рис. 6а ).
- Включите подсветку подэтапа. Если необходимо, включите камеру, прикрепленную к микрофонуRoscope и монитор камеры.
- Опустите микроэлектроды глубиной не менее 1000 мкм в агарозу и центрируйте их в чашке ( рис. 5b ). Визуализируйте их под микроскопом с помощью объектива 10X (цель погружения с водой с большим рабочим расстоянием).
- Сдвиньте напряжение на усилителе до 0 мВ для обоих опорных и ISM-каналов, чтобы установить напряжение, зарегистрированное в агарозе, в качестве базового напряжения.
- На двухканальном усилителе вручную переместите разъем канала ISM на выход вычитания напряжения, чтобы установить вычитание «включено» между опорным и ISM-каналами.
ПРИМЕЧАНИЕ. Вычитание гарантирует, что изменения напряжения в канале ISM отражают изменения концентрации только TMA. - Переместите ISM так, чтобы он касался наконечника микроэлектрода с ионтофорезом. Центрируйте наконечники друг на друга во всех трех направленных направлениях.
- Обнулить относительные положения обоих микроэлектродов наМикроманипулятор. Убедитесь, что микроэлектроды центрированы точно и точно (критически).
- Переместите ИСМ на расстоянии 120 мкм от микроэлектрода ионофореза на одной оси (левая-правая ось, рис. 5b ). Введите это расстояние в поле «Измерительный электрод» в графическом интерфейсе ( рисунок 6a ).
- Начните запись, нажав «Приобрести» в графическом интерфейсе ( рисунок 6a ); Позволяют программе записывать полную запись.
ПРИМЕЧАНИЕ. Микроэлектрод ионофореза получает постоянный ток смещения. После нажатия кнопки «Приобретение» происходит небольшая задержка до того, как основной ток будет применен в течение ограниченной продолжительности. - Повторите шаг 6.20 два-три раза. Подождите, пока сигнал TMA не вернется к исходному уровню, прежде чем приобретать новые записи; Программа сохранит каждую запись для последующего анализа.
- Проверьте расстояние между двумя микроэлектродами, перемещая ISM назад tO нулевая позиция, заданная блоком управления. Если микроэлектроды больше не центрированы, снова центрируйте их, используя ту же стратегию, что и на этапе 6.17. Запишите любые изменения положения электродов.
ПРИМЕЧАНИЕ. Если интервал изменяется более чем на 2%, записи, полученные на этапе 6.19, не могут считаться точными и должны приниматься новые.

Рисунок 5: Настройка для экспериментов в агаре. (А) установка для эксперимента в разбавленном агаре (шаги 6.1-6.5): небольшой контейнер , заполненный пористыма разбавленного агара , помещенном в работающей перфузионной камере. Микроэлектрод ионофореза (левая сторона) и ISM (правая сторона) удерживаются держателями микроэлектрода; Держатели микроэлектрода вставляются в плечи роботизированных микроманипуляторов. Температурный зонд помещают в агаровый гель, а равномерный заземляющий электрод равен plВ камере погружения. ( B ) Увеличенный вид микроэлектродов в агаре: микроэлектрод ионофореза (левая сторона) и ISM (правая сторона) визуализируются в агаре с использованием объектива 10X для погружения в воду (объектив погружен здесь в 150 мМ NaCl). Микроэлектроды позиционируются с использованием микроманипуляторов на глубину 1000 мкм; Расстояние между микроэлектродами составляет 120 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Интерфейс программного обеспечения для компьютеров Wanda. (А) Навигационное Ванда графический пользовательский интерфейс (GUI) , : экран , который появляется после открытия программного обеспечения Ванда. В коробке (1) выбирают подходящую среду, молекулу ионтофореза и метод. (2) Нажмите «Калибровать», чтобы открытьШкала калибровки Ванда. После калибровки ISM (см. Рис. 6b и дополнение B) ISM помещается в агар или головной мозг, как описано в шагах 6 и 8 протокола. В поле (6) вводятся все соответствующие значения для выполняемого эксперимента. (7) Нажмите «Приобретение», чтобы сделать запись; В верхней правой части графического интерфейса Wanda отображается график напряжения и времени. ( B ) Калибровка ISM в Wanda : окно, которое открывается после нажатия (2) «Калибровка» в GUI Wanda. Значения с шага 3.29 вводятся в поле (3), и (4) выбирается «Fit Data». Утверждается, что калибровочная кривая является линейной. (5) Нажмите «Принять», чтобы вернуться в GUID Wanda. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Анализ данных агарозы
- ОткройУолтер на компьютере (ПК). В меню «0. Records From:» нажмите кнопку «Wanda / VOLTORO», чтобы прочитать записи, созданные Wanda ( рисунок 7a ). Если требуется, чтобы выход в электронную таблицу был необходим, откройте соответствующее программное обеспечение. Нажмите «Лист 1,3» в «1. Создать Excel?». Меню ( рисунок 7b ).
- В следующем всплывающем окне выберите запись (записи) для чтения и нажмите «Открыть» ( рисунок 7b ); Обратите внимание, что записи будут автоматически распечатываться. Чтобы начать процедуру подгонки, выполните следующие действия.
- В меню «2. Параметры» нажмите кнопку «выбрать rec». В всплывающем окне « Рисунок 2 » используйте мышь, чтобы переместить перекрестие над первой обработанной записью ( рисунок 7c ); Нажмите кнопку мыши, чтобы выбрать запись.
- Нажмите oN "fit curve" в меню. Выберите желаемое количество итераций фитинга; Используйте по крайней мере 20 итераций фитинга для получения точной подгонки данных.
- В меню выберите «все» для соответствия всем точкам данных и выберите «продолжить»; Программа будет соответствовать отображаемой кривой. Соблюдайте порядок подгонки и сравните экспериментальную запись с наилучшей полученной кривой.
- Выберите вариант, чтобы записать результат в соответствующую электронную таблицу, нажав «Excel» в меню «7. Результаты» ( рисунок 7d ). Запишите (и запишите) следующие критические данные, которые будут использоваться для определения функциональности микроэлектрода ионофореза: « D (E5) », « Ссылка D (E5) », « r_app », номер транспортного средства « n t », « Явная N t '.
ПРИМЕЧАНИЕ: « D (E5) »: коэффициент свободной диффузииTx 10 5 (см 2 / с); « Ссылка D (E5) »: теоретический коэффициент свободной диффузии x 10 5 (см 2 / с). Это значение извлекается из базы данных в Walter на основе иона, среды и входа температуры. « R_app »: явный интервал микроэлектродов (см), рассчитанный на основе измеренного и эталонного D (E5) . « N t »: номер транспортного средства (безразмерный). Это число определяет долю тока ионтофореза, который используется для высвобождения TMA 4 . « Явный n t »: Явный номер транспорта (безразмерный). Это транспортное число, рассчитанное из r_app . Это число должно быть близко к измеренному n t . - Повторите шаги 7.1-7.3 для каждой из записей для выбранной пары микроэлектродов.
- Определите, можно ли использовать микроэлектрод ионофореза, выполняя следующее.
- Сравните « r_app» с фактическим r ( т. Е. 120 мкм); Этот критерий выполняется, если средние значения от всех испытаний находятся в пределах 4% друг от друга.
- Сравните « D (E5)» со ссылкой D (E5) ; Этот критерий выполняется, если средние значения от всех испытаний находятся в пределах 8% друг от друга.
- Сравните « n t » между испытаниями с одним и тем же микроэлектродом; Этот критерий выполняется, если средние значения от всех испытаний находятся в пределах 10% друг от друга.
- Если один из критериев, описанных в шаге 7.5, не был выполнен, устраните неисправность микроэлектрода с ионтофорезом или начните тестирование другого.
- Если микроэлектрод ионофореза считается подходящим для эксперимента, запишите средний транспортный номер из всех испытаний в поле «Транспортное число N» в графическом интерфейсе Wanda ( рисунок 6a ).
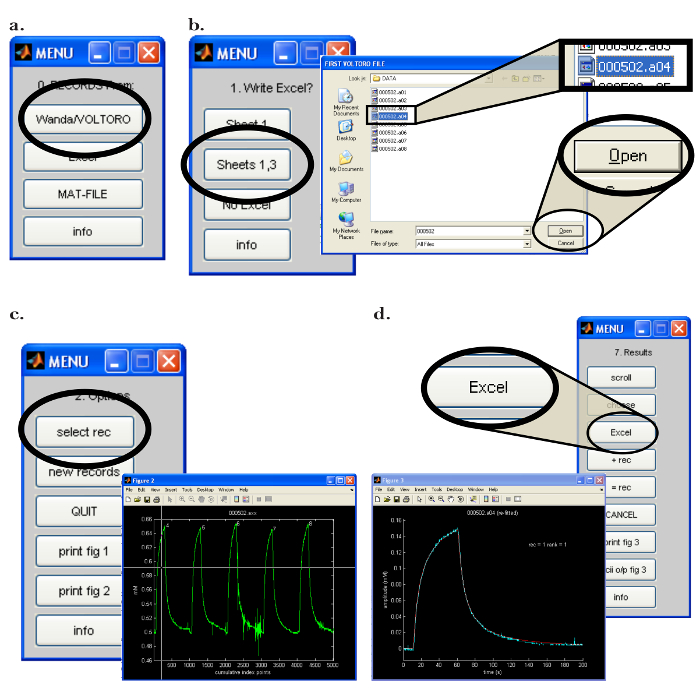
Рисунок 7: Интерфейс программного обеспечения Walter Computer. (А) Выбор программы сбора данных в Уолтере: В «0. Записи из:» открывает меню после запуска программы Вальтера. Выбор загрузки записей, сохраненных Wanda, выбирается нажатием кнопки «Wanda / Voltoro». ( B ) Выбор местоположения вывода данных и данных в Уолтере: [Влево] После открытия соответствующей программы электронных таблиц «Листы 1,3» выбраны для вывода всех данных анализа данных Уолтера на ранее открытую программу электронных таблиц. [Вправо] После выбора местоположения вывода анализа данных открывается всплывающее окно, позволяющее пользователю выбрать первую и последнюю записи, которые будут читать Уолтер. ( C ) Выбор записи для анализа в Уолтере: [Вправо] После выбора файлов для чтения открывается всплывающее окно со всеми выбранными записямиИграл как график (« Рисунок 2 »). [Влево] В меню «2.Options» нажимается «select rec», и мышь используется для перемещения перекрестия для идентификации первой записи для анализа; Либо нажата кнопка мыши, чтобы выбрать запись. ( D ) Экспорт анализа данных из Уолтера в электронную таблицу: после установки данных появится всплывающее окно и меню «7. Результаты». [Слева] График выбранной записи (синий) с установленной кривой диффузии, генерируемой Уолтером (красный). [Вправо] Меню «7. Результаты» позволяет пользователю записывать данные из анализа в программу для работы с электронными таблицами, нажав кнопку «Excel». Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
8. Ионтофорез в реальном времени в срезах мозга
- Поместите мозг толщиной 400 мкмВшей в записывающей камере, гарантируя, что он полностью погружен в поток ACSF. Поместите срез, используя акварельную кисть и аккуратно закрепите его сеткой.
- Переместите как микрофон электрона иона, так и ИСМ над полем интереса на срез мозга. Погрузитесь как в текущем ACSF, так и над срезом.
- Смещение напряжения как для опорного и ионно-зондирования каналов в «0» мВ. Подождите, пока напряжение в обоих каналах стабилизируется. На магнитофоне отметьте напряжение, измеренное на канале ионного зондирования ISM. Используйте это для вычисления базового параметра V в Wanda.
- Поместите ИСМ и ионтофорезный микроэлектрод глубиной 200 мкм в срез и 120 мкм друг от друга. Дождитесь стабилизации сигнала после перемещения микроэлектрода в срез мозга.
ПРИМЕЧАНИЕ. Ток смещения, применяемый к микроэлектрону с ионтофорезом, вызывает небольшое накопление ТМА. Это распространенная ошибкаСлишком рано записывать и недооценивать нарастание сигнала. - На регистраторе диаграммы отметьте стабилизированное напряжение, измеренное в срезе мозга на канале ионного зондирования ISM. Рассчитайте разность напряжений между сигналом TMA, измеренным на шаге 8.3 и шаге 8.4, и введите это значение в поле «Baseline V (mV)» в поле Measureing Electrode в графическом интерфейсе Wanda ( рисунок 6a ).
- В левой части графического интерфейса убедитесь, что все экспериментальные параметры правильно записаны / введены. Установите «Средний» на «Мозг», «Транспортный номер» до среднего значения, рассчитанного для микроэлектрода с ионтофорезом на этапе 7.4, и «Температура» до температуры ванны, содержащей срез.
ПРИМЕЧАНИЕ: V должен быть записан для каждого набора измерений. Базовая линия V будет преобразована Вандой в исходный параметр C (мМ) ( т. Е. Концентрация ТМА в ткани головного мозга). - Начните запись, нажав «Приобрести» и позвольте ей выполнить полную запись. Подождите, пока сигнал TMA не вернется к исходному уровню, прежде чем приобретать новую запись.
- Возьмите две-три последовательные записи перед удалением микроэлектродов из выбранного места расположения мозга. Введите температуру, измеренную в программное обеспечение Wanda, непосредственно перед каждой записью.
- Переместите оба микроэлектрода по диагонали обратно на поверхность среза. Поднимите оба по меньшей мере на 50 мкм над срезом. Используя устройство записи диаграммы, определите любое изменение между измеренным сейчас V и его измерением с шага 8.3.
- Центрируйте концы ISM и ионтофоретических микроэлектродов относительно друг друга в х-, y- и z-осях. Получите изменения расстояния, если таковые имеются, с дисплея блока управления микроманипулятора.
9. Анализ данных мозга
- Откройте новую таблицу для вывода анализа.
- Повторите шаги 7.1-7.4 в Уолтере, чтобы проанализироватьЗаписи, взятые из мозга.
- Запишите данные в программу электронных таблиц, нажав «Excel» в меню Walter. Запишите α , объемную долю мозговой ЭКС; Λ , извилистость ECS головного мозга; И k (s -1 ), неспецифический клиренс.
10. Проверка транспортного номера и калибровки ISM
- Измерьте транспортный номер ISM ( n t ) в конце эксперимента, используя приведенный ниже протокол. Альтернативно, проверьте n t после критических испытаний или когда измерения окажутся аномальными. Тем не менее, проверка n t слишком много раз может привести к травме среза мозга.
- Возьмите новые записи в агарозе. См. Шаги 6.4, 6.11, 6.12, 6.14, 6.15 и 6.17-6.22.
- Повторите шаги 7.1-7.4 в Уолтере, чтобы получить n t из новых записей агарозы. Проверьте таблицу: если n t изменилось большеЧем 10% от n t, полученного до измерений в мозге, данные, полученные с этим ионтофоретическим микроэлектродом, не являются надежными.
- Выполните новую калибровку (см. Шаг 3.29) для ISM после сбора данных о мозге. Используйте вновь полученные данные калибровки ISM в качестве входных данных в окне калибровки Wanda (см. Шаги 6.9 и 6.10) и убедитесь, что значение наклона отличается от предыдущей калибровки менее чем на 10%.
ПРИМЕЧАНИЕ. Данные, полученные с помощью этого ISM, не являются надежными, если значение наклона отличается более чем на 10% от предыдущей калибровки.
Access restricted. Please log in or start a trial to view this content.
Результаты
Полезность метода RTI показана в эксперименте, предназначенном для измерения изменений α и во время гипоосмолярной задачи ( рис. 8 и рис. 9 ). Ранее было показано, что уменьшение осмолярности ECS путем промывки на гипотоническом ACSF прив?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
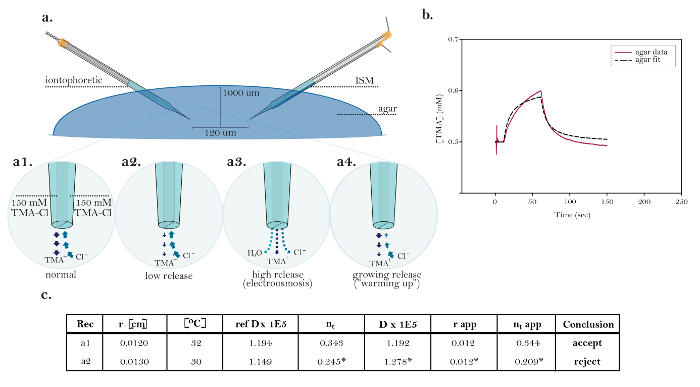
Рисунок 10: Неидеальные данные, демонстрирующие общие технические проблемы. (А) Диаграмма общих технических вопросов с ионофорезом микроэлектродами: Сравнение нормального высвобождения ТМА из функционирования ио?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Работа была поддержана грантом NIH NINDS R01 NS047557.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
Ссылки
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены