É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Itoforese em tempo real com tetrametilamônio para quantificar fração de volume e tortuosidade do espaço extracelular cerebral
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve a iontoforese em tempo real, um método que mede os parâmetros físicos do espaço extracelular (ECS) dos cérebros vivos. A difusão de uma molécula inerte liberada no ECS é utilizada para calcular a fração de volume ECS e tortuosidade. É ideal para estudar alterações reversíveis agudas na ECS cerebral.
Resumo
Esta revisão descreve os conceitos e protocolos básicos para executar o método de iontoforese em tempo real (RTI), o padrão-ouro para explorar e quantificar o espaço extracelular (ECS) do cérebro vivo. O ECS envolve todas as células cerebrais e contém fluido intersticial e matriz extracelular. O transporte de muitas substâncias necessárias para a atividade cerebral, incluindo neurotransmissores, hormônios e nutrientes, ocorre por meio da difusão através do ECS. Mudanças no volume e geometria deste espaço ocorrem durante processos cerebrais normais, como o sono e condições patológicas, como a isquemia. No entanto, a estrutura e a regulação das ECS cerebrais, particularmente em estados doentes, permanecem largamente inexploradas. O método RTI mede dois parâmetros físicos do cérebro vivo: fração volumétrica e tortuosidade. A fração de volume é a proporção de volume de tecido ocupado pela ECS. A tortuosidade é uma medida do impedimento relativo que uma substância encontra ao difundir através de um cérebro reEm comparação com um meio sem obstruções. Em RTI, uma molécula inerte é pulsada a partir de um microeletrodo de origem no ECS do cérebro. À medida que as moléculas se difundem para longe desta fonte, a mudança da concentração do íon é medida ao longo do tempo usando um microeletrodo seletivo de íons, localizado a aproximadamente 100 um de distância. A partir da curva de difusão resultante, tanto a fração de volume quanto a tortuosidade podem ser calculadas. Esta técnica tem sido utilizada em fatias de cérebro de múltiplas espécies (incluindo seres humanos) e in vivo para estudar alterações agudas e crônicas para ECS. Ao contrário de outros métodos, RTI pode ser usado para examinar mudanças reversíveis e irreversíveis no ECS do cérebro em tempo real.
Introdução
O espaço extracelular (ECS) é a rede de canais interligados para todas as células cerebrais e contém fluido intersticial e matriz extracelular ( Figura 1a e Figura 1b ). A distribuição de muitas substâncias necessárias para a função das células cerebrais, incluindo nutrientes, hormônios e neurotransmissores, ocorre por difusão através da ECS. As mudanças nos parâmetros físicos deste espaço, incluindo o volume, a geometria e a matriz extracelular, podem afetar drasticamente a difusão através do ECS e as concentrações de íons locais que banham as células cerebrais, que têm um impacto profundo na função celular 1 , 2 do cérebro.
A iontoforese em tempo real (RTI) é usada para determinar duas características estruturais de uma região do cérebro: fração volumétrica e tortuosidade 3 , 4 ,"Xref"> 5. A fração de volume ( α ) é a proporção de volume de tecido ocupado pelo ECS ( V ECS ) em relação ao volume total de tecido ( tecido V ) em um volume elementar representativo;
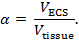
A tortuosidade ( λ ) é o impedimento relativo que uma substância encontra quando se difunde através de uma região do cérebro em comparação com um meio sem obstruções;

Onde D * (cm 2 s -1 ) é o coeficiente de difusão efetivo da substância no cérebro e D (cm 2 s -1 ) é o coeficiente de difusão livre da substância em meio livre, como o gel de agarose diluído.
Hoje, a substância de sonda mais usada para o RO método TI é o pequeno catião tetrametilamônio (TMA). TMA tem um peso molecular de 74 g / mol, dissocia-se completamente em solução e tem uma carga positiva. Os estudos RTI com este íon demonstraram que α  0,2 e λ
0,2 e λ  1.6 1 , 2 . Isso significa que o ECS é aproximadamente 20% do volume total do cérebro e que a difusão de uma molécula pequena e inerte ocorre aproximadamente 2,5 vezes mais devagar no ECS do que em um meio sem obstruções 3 . No entanto, tanto α como λ variam com a idade cerebral, região e estado e em condições patológicas 1 . As alterações desses parâmetros foram ligadas ao desenvolvimento do cérebro, envelhecimento, sono, epilepsia e muitos outros processos e doenças fundamentais do cérebro 1, 6 . Enquanto outras técnicas medem α e λ , RTI pode medir tanto em regiões localizadas de tecido vivo em tempo real. Por esta razão, RTI tornou-se uma ferramenta indispensável para investigar as mudanças em α e λ durante os desafios agudos e reversíveis.
1.6 1 , 2 . Isso significa que o ECS é aproximadamente 20% do volume total do cérebro e que a difusão de uma molécula pequena e inerte ocorre aproximadamente 2,5 vezes mais devagar no ECS do que em um meio sem obstruções 3 . No entanto, tanto α como λ variam com a idade cerebral, região e estado e em condições patológicas 1 . As alterações desses parâmetros foram ligadas ao desenvolvimento do cérebro, envelhecimento, sono, epilepsia e muitos outros processos e doenças fundamentais do cérebro 1, 6 . Enquanto outras técnicas medem α e λ , RTI pode medir tanto em regiões localizadas de tecido vivo em tempo real. Por esta razão, RTI tornou-se uma ferramenta indispensável para investigar as mudanças em α e λ durante os desafios agudos e reversíveis.
A teoria que suporta RTI foi originalmente validada por Nicholson e Phillips, e a técnica tem sido amplamente utilizada desde então 4 , 7 . As experiências que empregam RTI começam com a liberação de um pulso de TMA a partir de um microeletrodo de fonte por iontoforese em um gel de agarose diluído. Uma vez ejetados, os íons se difundem livremente da fonte pontual, escolhendo de um número potencialmente infinito de caminhos aleatórios ( Figura 1d ). A alteração da concentração do íon é medida ao longo do tempo usando um microeletrodo seletivo de íons (ISM) posicionado aproximadamente100 um de distância ( Figura 1c ). As mudanças na concentração de TMA são graficadas e ajustadas a uma curva que permite o cálculo tanto de D como do número de transporte do microeletrodo de iontoforese (parâmetros discutidos no Protocolo). Com estes valores, o procedimento é repetido numa região cerebral de interesse para obter D * e calcular tanto α como λ . O controle do microeletrodo de iontoforese, a coleta de dados, a representação gráfica e o ajuste da curva de concentração de TMA e o cálculo dos parâmetros experimentais são tipicamente realizados pelos programas Wanda e Walter, que foram especificamente projetados para esse fim (o software e seus manuais são Livremente disponível dos autores mediante solicitação).
A seção de protocolo desta revisão descreve os procedimentos básicos necessários para projetar e executar RTI em fatias de cérebro de roedores. A técnica também foi usada em não-hasteent modelos, incluindo fatias de cérebro de humanos e em preparações in vivo cerebrais 1, 4, 6, 8, 9. A seção Resultados representativos fornece resultados ideais e não ideais para destacar nuances na interpretação de dados. Finalmente, a seção de Discussão abrange brevemente as técnicas de solução de problemas, as limitações de RTI, as técnicas alternativas utilizadas para estudar o ECS e as futuras aplicações de RTI.

Figura 1: Diagramas de difusão através de ECS. (A) Diagrama de ECS: Demonstra o tamanho e localização do ECS em uma secção de cérebro normal. Amarelo marca o ECS entre os processos das células cerebrais cinzentas. O volume do ECS é aproximadamente 20% do volume total do tecido ( ou seja, fração volumétrica = 0.2) sob condições fisiológicas. ( B ) Diagrama ampliado do ECS: Destaca os parâmetros físicos que contribuem para a tortuosidade, incluindo a geometria das células cerebrais (cinza) e a matriz extracelular (diagrama como uma malha de glicosaminoglicanos e proteoglicanos multicoloridos). ( C ) Diagrama 3D de difusão a partir de uma fonte pontual: demonstra o movimento líquido de moléculas inertes de uma fonte iontoforética para um ISM. Excluindo barreiras de difusão e absorção celular, as moléculas se difundem para fora em todas as direções, produzindo uma frente de concentração esférica. O ISM quantifica a concentração local das moléculas inertes liberadas da fonte iontoforética. ( D ) Simulação computacional de difusão em ECS do cérebro: [Far left] Configuração para simulação de Monte Carlo; As esferas verdes representam processos de células cerebrais e a cruz vermelha representa uma fonte pontual. Esta configuração modela o tecido cerebral diagramado na Figura 1a . [Imagens do meio] 3 e6 moléculas que realizam movimentos aleatórios à medida que se difundem através do espaço extracelular do cérebro, mostrado em 2 dimensões. [Extremamente à direita] Caminhos aleatórios de muitas moléculas liberadas da fonte pontual. O movimento líquido de todas as moléculas da fonte pontual é para fora como descrito na Figura 1c . Os passeios aleatórios cumulativos descrevem os espaços entre as células ( ou seja, o ECS, veja a referência 5 para mais explicações). Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos de animais, usados para obter amostras de tecido, foram aprovados pelo comitê de ética animal no SUNY Downstate Medical Center.
1. Preparação de soluções e equipamentos
- Prepare uma solução de enchimento de NaCl 150 mM para o barril de referência do ISM. Armazene-o em uma seringa de 10 mL anexada a um filtro de 0,22 μm (para remover bactérias ou partículas).
- Prepare uma solução de aterramento de cloreto de TMA 150 mM (TMA-Cl) para os microeletrodos. Armazene-o em uma seringa de 10 mL anexada a um filtro de 0,22 μm. Prepare as soluções de TMA-Cl (neste protocolo) a partir de uma solução de estoque de fabricante de 5 M para garantir a concentração correta.
- Chloridize pelo menos quatro fios de prata para a fabricação de microeletrodos submergindo os fios em água sanitária (hipoclorito de sódio) por pelo menos 2 h. Remova o excesso de água sanitária com etanol e deixe os fios secar.
- Preparar 50 mL de agarose a 0,3% em NaCl 150 mM e TMA-Cl 0,5 mM num copoE cubra-o. Use agarose que esteja em pó e razoavelmente fresco para garantir boas medidas de difusão.
- Aqueça e misture a solução de agarose com uma barra de agitação para dissolvê-la. Deixe a solução esfriar à temperatura ambiente. Armazene isso a 4 ° C por até 1 semana.
- Prepare um eletrodo indiferente (terra) feito de agarose a 4% em KCl 1 M (instruções no Suplemento A)
- Fabrique um copo pequeno e poroso que possa caber na câmara experimental e que permita a continuidade elétrica entre seu conteúdo e o ambiente externo ( Figura 2a ). Coloque um anel de metal na parte inferior deste copo para evitar que flua quando parcialmente submerso em água.
- Use a diluição em série de um estoque de TMA-Cl de 5 M para fazer cinco soluções TMA-Cl de 100 mL para a calibração dos ISMs. As soluções devem ter concentrações finais de 0,5, 1, 2, 4 e 8 mM de TMA-Cl, tudo em 150 mM de NaCl. Armazene as soluções de calibração em um copo selável para evitar a evaporação.
2. Configuração eletrônica
- Conecte os componentes da configuração experimental RTI de acordo com o diagrama de blocos na Figura 2b ; Incluem um amplificador com dois canais de entrada (um dos quais deve ser de alta impedância para o barril seletivo de íons do ISM), um filtro passa-baixa configurado a 10 Hz, um gravador gráfico, um A / D + D / A Conversor, uma unidade iontoforética (ou um amplificador capaz de fornecer pulsos de corrente constante) e um computador (PC) executando os programas Wanda e Walter. Inspecione a configuração eletrônica para confirmar que todas as conexões estão instaladas.
- Proteja a configuração experimental em um gabinete aterrado (como uma gaiola de Faraday), se necessário, pois os ISMs têm uma alta resistência e são sensíveis aos artefatos criados pelo movimento próximo.
- Crie uma estação de calibração ISM dedicada consistindo em um amplificador de entrada dupla, um gravador de gráfico, um suporte ISM apropriado e um eletrodo de terra indiferente. Se possível,Proteja o gabinete. Ignore este passo se os ISMs estiverem calibrados na configuração experimental (etapa 3.29)

Figura 2: Copa Experimental Porosa e Configuração Eletrônica. (A) copo experimental Poroso: Uma malha porosa é usado para criar um copo experimental que permite a continuidade eléctrica entre a agarose (para dentro) e o fluido do banho experimental (no exterior). Um anel de metal está preso ao fundo do copo para evitar que o copo flua na solução de banho. ( B ) Diagrama de bloco da configuração RTI (passos 2.1 e 2.2): Um ISM está conectado a um amplificador (amplificador). O ISM tem dois barris. Um contém um permutador de íons líquido (LIX) na ponta e gera uma tensão proporcional ao logaritmo da concentração de TMA na ponta juntamente com a tensão ambiente local; ºO caminho do sinal e é representado por uma linha vermelha. O outro barril do ISM é conhecido como o barril de referência e mede a tensão ambiente na ponta do ISM; É conectado por um caminho de sinal azul. O amplificador tem dois chamados estádios de cabeça que se conectam ao ISM; Estas unidades têm um ganho de 1 (x1) e combinam a alta impedância do microeletrodo com a baixa impedância do resto do circuito do amplificador. O estágio da cabeça conectado ao barril seletivo de íons deve ser capaz de combinar uma resistência de entrada de cerca de 1.000 MΩ, enquanto que a resistência do barril de referência é tipicamente de cerca de 10 MΩ. Depois de deixar o estágio da cabeça, a tensão do barril de referência é invertida e subtraída da tensão no barril seletivo de íons usando um amplificador de soma (Σ) para obter a tensão do sinal iônico puro. As saídas do amplificador passam para uma unidade de condicionamento de sinal que fornece amplificação adicional e um filtro de passagem baixa multipolar (≤ 10 Hz, tipicamente um Bessel fiLter), que remove o ruído e evita o aliasing do sinal no conversor analógico-digital (A / D). As saídas do filtro também são exibidas em um gravador de gráfico de faixa. O conversor A / D digitaliza os sinais e os envia para um computador pessoal (PC). O PC também gera um sinal digital que é convertido por um conversor digital-analógico (D / A) para um impulso de tensão analógico que é alimentado para a unidade de iontoforese, que converte a tensão em um pulso atual de amplitude constante e a envia Para o microeletrodo iontoforese. O caminho do sinal de iontoforese é representado por uma linha verde. O sinal de aquisição de dados e iontoforese está sob o controle do programa Wanda, que gera um arquivo de saída para cada registro de difusão sob a forma de uma gravação de tensão versus tempo, juntamente com todos os parâmetros que definem o experimento. Um segundo programa, Walter, lê o arquivo de saída e usa dados de calibração ISM para converter as tensões digitalizadas em concentrações. A concentração éAs curvas de tempo de rsus são então ajustadas em Walter à solução apropriada para a equação de difusão. D e n t são extraídos se o meio é agarose, e λ e α extraídos se o meio é cérebro. Os sinais analógicos são linhas contínuas; Os sinais digitais são linhas pontilhadas. Existe também um eletrodo de terra indiferente (não mostrado) no banho que contém a fatia. Linhas vermelhas = sinal de íons, linhas azuis = sinal de referência, linhas verdes = comando de iontoforese, linhas sólidas = analógico, linhas pontilhadas = digital. Clique aqui para ver uma versão maior desta figura.
3. Preparação e Calibração de Microeletrodos Seletivos de Ion
- Fabricação de ISMs usando o protocolo abaixo de um dia antes da experiência. Faça ISMs em lotes para garantir que pelo menos dois trabalhem no dia da experiência.
NOTA: A maioria dos ISMs são estáveis por um dia oudois. A fabricação de ISM é sensível à umidade e condições atmosféricas. Nem todo microeletrodo irá calibrar com sucesso. - Destrói aproximadamente 0,5 cm de vidro no final de um dos barris de um capilar de vidro de borosilicato de dois canos usando um velho pin de pinças.
- Pule um único barril na extremidade oposta do capilar ( Figura 3a ). Certifique-se de que o septo não está danificado (crítico). Cuidado: Use óculos de proteção para evitar lesões devido ao vidro do projétil.
- Coloque o capilar em uma garrafa de acetona por pelo menos 1 h para remover contaminantes.
- Remova o capilar da acetona e pulso limpa, seca, nitrogênio nitrogênio comprimido ou ar através dele para remover qualquer excesso de acetona. Remova toda a acetona no capilar, uma vez que a acetona residual pode interferir com a silanização (crucial).
- Fabrique a ponta da micropipeta em um extrator vertical ou horizontal. Adapte os parâmetros para puxar uma pipeta com um toque longo ePonta afiada, com cerca de 1 μm ou menos de diâmetro. No final desta etapa, um capilar será transformado em duas pipetas ( Figura 3a ).
- Visualize uma única micropipleta sob um microscópio composto, vertical com um objetivo 10X. Corte a ponta usando uma lâmina de microscópio de vidro para que o diâmetro final da ponta ( ou seja, ambos os tambores) esteja entre 2 e 5 μm ( Figura 3b ). Esta pipeta será chamada de ISM a partir de agora.
- Preencha o barril escorvado do ISM com solução de referência de NaCl 150 mM através da abertura do lado das aspas usando uma seringa de 10 mL anexada a um filtro de 0,22 μm e uma agulha de 28 G, 97 mm ( Figura 3b ). Não preencha o barril após três quartos da altura do barril.
- Preencha o barril não-estilhaçado do ISM com solução de preenchimento TMA-Cl 150 mM. Toque o ISM suavemente para eliminar quaisquer bolhas de ar da solução. Verifique se há bolhas sob o microfoneRoscope usado para cortar a ponta.
- Chama a parte de trás do ISM usando um queimador Bunsen para garantir que nenhuma comunicação da solução de reenchimento se encontre no septo na parte de trás do ISM. Certifique-se de que o primeiro quarto do ISM esteja seco após o incêndio.
- Insira um fio de prata cloridado na solução de referência do ISM e dobre o fio que se projeta do capilar para marcar isso como o barril de referência ( Figura 3c ). Certifique-se de que o fio está submerso na solução de enchimento e permanece em solução durante a duração da experiência.
- Deslize um curto comprimento de tubo de politetrafluoroetileno (cerca de 20 cm de comprimento) sobre a ponta de uma agulha de seringa de 25 G. Coloque a outra extremidade da tubulação na parte traseira do barril seletivo de íons. Certifique-se de que a tubulação esteja no barril, mas acima da solução de enchimento ( Figura 3c ).
- Aqueça uma vara de cera dental com um queimador Bunsen e selar tanto a tubulação quanto o silvEr fio em seus respectivos barris ( Figura 3c ). Certifique-se de que uma vedação de ar completa seja produzida em torno da tubulação de plástico no barril seletivo de íons (crítico).
- Prepare um recipiente de vidro pequeno e transparente (5 mL ou menos) de clorotrimetilsilano a 4% em xileno. Cuidado: Xilenos e silanos são muito perigosos para a saúde; Lidar com ambos os produtos químicos dentro de uma exaustão e descartar adequadamente.
- Posicione o recipiente na frente de um microscópio de dissecção estéreo montado horizontalmente em uma chaminé. Fixe o ISM verticalmente sobre o recipiente usando um micromanipulador ( Figura 3d ).
- Mergulhe a ponta do microeletrodo na solução de clorotrimetilsilano.
- Anexe uma seringa vazia de 10 mL à agulha de calibre 25 que leva ao ISM. Aplique pressão de ar positiva da seringa até formar uma bolha de solução de TMA-Cl; Este passo deve ser realizado sob visualização direta através do microscópio.
- Toque o suporte do ISM suavemente para derrubar a bolha da ponta.
- Desenhe a solução de clorotrimetilsilano a uma altura de aproximadamente 1.500 μm na ponta do ISM usando pressão negativa na seringa de 10 mL.
- Expulsar completamente a solução de clorotrimetilsilano da ponta do ISM até formar uma bolha de solução de TMA-Cl na ponta ( Figura 3d ).
- Repita as etapas 3.19 e 3.20 cinco vezes. Certifique-se de que uma coluna de fluido, ininterrupta e uniforme, seja desenhada na ponta de cada vez. Se nenhuma solução pode ser inserida na ponta, verifique se a tubagem está bloqueada, a vedação de ar está incompleta ou a ponta do ISM está bloqueada.
- Elimine toda a solução de clorotrimetilsilano da ponta até criar uma bolha de solução de TMA-Cl.
- Ao manter a pressão positiva sobre a seringa, remova o ISM da solução de xileno. Certifique-se de que toda a solução de xileno seja expulso da ponta do ISM, pois o excesso de xileno irá arruinar o excColuna de suspensão criada nas etapas subsequentes.
- Coloque a ponta do ISM em um recipiente pequeno e transparente (seja o que o trocador veio ou uma pequena cubeta) segurando o permutador de íons líquidos (LIX) para TMA. Execute esta etapa sob visualização direta usando a configuração do microscópio horizontal.
- Aplique uma pequena quantidade de pressão negativa para desenhar uma quantidade mínima do LIX na ponta ( ou seja, assim que LIX for visto entrando na ponta, pare de aplicar pressão negativa).
- Desconecte a seringa de 10 mL da tubulação e deixe o ISM repousar durante 5 min. Durante esse tempo, o LIX entrará na ponta silanizada até atingir um estado de equilíbrio.
- Remova o ISM do LIX. Puxe a tubulação para fora do cano do permutador (enquanto retira a menor quantidade de cera possível). Coloque um fio de prata clorado na pequena abertura criada na extremidade traseira do ISM. Selar o fio no recheio do cano trocador com cera derretida.
- Permitir que o ISM se senteDurante pelo menos 30 min. Anexe os ISMs completos à borda interna de um copo usando qualquer adesivo flexível e temporário.
- Calibre o ISM registrando a tensão medida pelo ISM em cada solução de calibração feita no passo 1.8.
NOTA: A calibração pode ser realizada em uma estação de calibração (ver passo 2.3) ou na configuração experimental. Este procedimento está descrito no Suplemento B e em Haack et al 10 . - Se a calibração do ISM tiver sido bem sucedida para vários ISM, faça uma pausa até o dia do uso pretendido. Caso contrário, fabrique mais ISMs.
- No dia do experimento, calibre novamente o microeletrodo (ver passo 3.29).

Figura 3: Preparação de um microeletrodo seletivo de íons. (A) ISM após lascar volta das extremidades de um capilar e de tracção (passos 3,2-3,6): Um único tambor em ambas as extremidades oO capilar de vidro fa é desossado. Um ISM é gerado puxando um capilar de vidro de dois canos para gerar duas micropipetas com dicas finas. ( B ) ISM após o preenchimento de ambos os barris (etapas 3.7-3.9): a ponta de um único ISM é cortada para um diâmetro de 2-5 μm. O barril seletivo de íons é preenchido com TMA-Cl, e o barril de referência é preenchido com NaCl. ( C ) ISM antes do revestimento com clorotrimetilsilano (passos 3.11-3.13): um fio de prata cloridado é inserido no barril de referência. O tubo de politetrafluoroetileno (PTFE) é conectado a uma agulha de 25 G e inserido no barril seletivo de íons. Um selo hermético em cima de ambos os barris é criado usando cera dental. ( D ) Revestimento de uma micropipeta com clorotrimetilsilano (passos 3.15-3.26): [Baixa ampliação] Um ISM suspenso em clorotrimetilsilano de acordo com um estereomicroscópio montado horizontalmente. [Ampliação alta] A vista através de uma estereomicrosc de montagem horizontalOpe de uma dica ISM na solução de clorotrimetilsilano. Após a visualização da ponta através de um microscópio, uma pequena quantidade de solução de TMA-Cl é expulso do barril seletivo de íons (o suficiente para gerar uma pequena bolha de solução de TMA-Cl). O suporte ISM é batido para liberar uma bolha de solução de TMA-Cl e, em seguida, clorotrimetilsilano é desenhado na ponta. Este ciclo é repetido várias vezes. Depois que todo o clorotrimetilsilano é ejetado do ISM, o ISM é colocado no permutador de íons líquidos (LIX) para TMA e LIX é empurrado para dentro da ponta do barril seletivo de íons. Clique aqui para ver uma versão maior desta figura.
4. Preparação de microélectrodos de iontoforese
NOTA: Os microeletrodos de iontoforese devem ser fabricados no dia da experiência.
- Puxe um capilar de vidro de borosilicato de dois canos em uma vertical ou hoExtrator rizontal. Adapte os parâmetros para puxar uma pipeta semelhante às micropipetas puxadas no passo 3.6 ( Figura 4a ).
- Coloque a micropipleta sob o microscópio composto usado no passo 3.7 e corte a ponta usando uma lâmina de microscópio de vidro para que o diâmetro resultante esteja entre 2 e 5 μm ( Figura 4a ).
- Preencha ambos os barris com a solução de preenchimento de TMA-Cl 150 mM usando uma seringa de 10 mL unida a um filtro de 0,22 μm e uma agulha de 28 G, 97 mm ( Figura 4a ).
- Toque a micropipleta suavemente para garantir que não haja bolhas de ar na solução de ambos os barris.
- Coloque fios de prata clorados em ambos os barris da micropipeta. Certifique-se de que os fios são suficientemente profundos nas soluções de enchimento para que permaneçam em contato com as soluções durante a duração da experiência.
- Selar os fios nos barris usando cera dental quente. Engula delicadamente t Ele alinha torcendo-os um ao outro (microeletrodo completo mostrado na Figura 4b ).
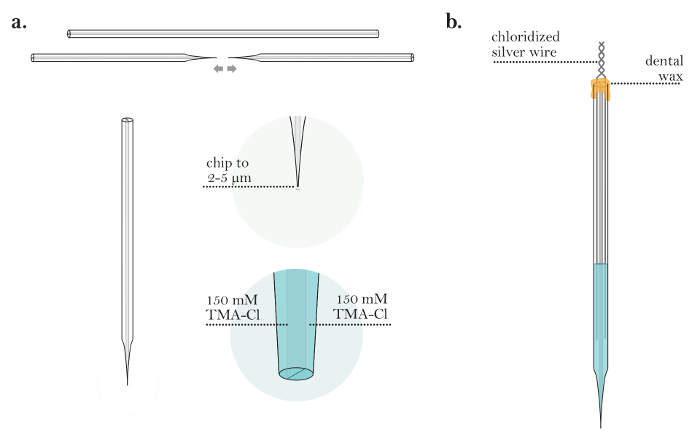
Figura 4: Preparação de um microeletrodo de iontoforese. (A) de microeléctrodos iontoforese após enchimento ambos os barris (passos 4,1-4,3): Um micro-eltrodo de iontoforese é puxada a partir de um tubo capilar. A ponta do microeletrodo é cortada para um diâmetro de 2-5 μm. Ambos os barris do microeletrodo de iontoforese são preenchidos com solução de TMA-Cl. ( B ) Microeletrodo de iontoforese completo (etapas 4.5-4.6): microeletrodo de iontoforese com dois fios de prata clorados inseridos nos barris. Os barris do microeletrodo são selados com cera, e os fios de prata são torcidos juntos na parte traseira do microeletrodo./files/ftp_upload/55755/55755fig4large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
5. Preparação de fatias de tecido cerebral e de cérebro cefalorraquidiano artificial
- Prepare 1 L de líquido cefalorraquidiano artificial (ACSF) com uma composição apropriada para a experiência e adicione 0,5 mM de TMA-Cl a ele.
NOTA: O TMA-Cl é necessário para estabelecer uma concentração de fundo de TMA durante o experimento. - Prepare fatias cerebrais de roedores com uma espessura de 400 μm de acordo com os protocolos padrão 11 , 12 . Use a ACSF preparada no passo 5.1 para a dissecação e manutenção de fatias de cérebro.
6. Itoforese em tempo real em Agarose
- Ligue o computador executando os programas Walter e Wanda.
NOTA: Estes programas estão disponíveis gratuitamente mediante solicitação. Embora este software não seja essencial, a programação é similarSoftware ou realizar a análise à mão seria de outra forma necessário. - Execute a ACSF através da câmara de submersão a uma taxa apropriada ( por exemplo, 2 mL / min). Definir o controlador de temperatura a uma temperatura ACSF e bolha desejado com 95% de O2 / 5% de CO 2 (ou de outra mistura de gás apropriada) para a duração da experiência.
- Monte um eletrodo indiferente (terra) em um suporte adequado e submergir a ponta no ACSF que atravessa a câmara de submersão. Conecte o fio ao chão da configuração da gravação.
- Encha o copo poroso (feito no passo 1.7) com 0,3% de agarose previamente preparada e coloque-a na câmara de submersão. Certifique-se de que a solução não percorre o topo da xícara.
- Proteja um ISM calibrado para o titular da pipeta de um micromanipulador e um microeletrodo de iontoforese para o segundo. Coloque os suportes em um ângulo apropriado para a configuração ( Figura 5a ).
- ConectarOs fios de microeletrodos ISM e iontoforese para os respectivos estádios de cabeça do amplificador de gravação. Alternativamente, conecte-se diretamente ao amplificador (dependendo da configuração).
- Certifique-se de que o peso / posicionamento dos fios ou clipes de conexão não causa qualquer movimento dos microeletrodos, uma vez que pequenas flutuações no posicionamento podem influenciar os resultados.
- Ative a configuração eletrônica (da etapa 2). Comece Walter e Wanda em instâncias separadas.
- Na Wanda GUI, clique em "Calibrar" ( Figura 6a ). Na caixa de Calibração ( Figura 6b ), preencha as tensões medidas durante a calibração ISM (passo 3.29) e clique em "Ajustar Dados".
NOTA: Isso permite ajustar a seguinte representação da equação de Nicolsky (alternativamente, ajustar a equação por outro meio para obter M e K ):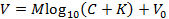
DelaE, V é a tensão medida (mV), M é a inclinação Nicolsky (mV), C é a concentração de íons (mM), K é a interferência (mM) e V 0 é a tensão de deslocamento (mV) 3 . - Clique em "Aceitar" na caixa Calibrar para transferir automaticamente a inclinação ( M ) e a interferência ( K ) geradas no passo 6.9 para a GUI principal.
NOTA: Aqui, K representa a interferência Na, que geralmente é insignificante. - No lado esquerdo da GUI, verifique se todos os parâmetros experimentais estão configurados nas entradas correspondentes ( Figura 6a ).
- Na caixa Método de origem, defina a fonte para a fonte iontoforética (padrão), a "Duração do registro" para "200 s" (padrão), o "Pulso começado" para "10 s" (padrão), o "fim do pulso" Para "60 s" (padrão), a "Corrente de polarização" para "20 nA" (padrão), a"Corrente principal" para "100 nA" (padrão) e "Fator de conversão" para um valor apropriado.
- Na caixa Electrode de medição, ajuste "Bath C" para a concentração de TMA contida na solução do banho (expressa em mM). Defina o "Ganho total", "Canal de saída", "Canal ISM" e "Canal Ref." Para valores apropriados para o sistema de aquisição de dados em uso.
NOTA: O "Fator de Conversão" deve ser configurado para um valor apropriado (específico da unidade iontoforética em uso). Este valor especifica a quantidade de corrente passada para uma dada tensão aplicada a partir do conversor D / A (nA / mV).
- Coloque uma sonda de temperatura no copo de ágar. Registre a temperatura medida na entrada "Temperatura" na caixa "Medição de eletrodo" da GUI ( Figura 6a ).
- Ligue o iluminador de sub-estágio. Se necessário, ligue a câmera ao microfoneRoscope e monitor de câmera.
- Abaixe os microeletrodos de pelo menos 1000 μm de profundidade na agarose e centre-os no copo ( Figura 5b ). Visualize-os no microscópio usando um objetivo 10X (objetivo de imersão em água com longa distância de trabalho).
- Deslocar a tensão no amplificador para 0 mV para os canais de referência e ISM para estabelecer a tensão registrada na agarose como a tensão de linha de base.
- No amplificador de dois canais, mova manualmente o conector do canal ISM para a saída de subtração de tensão para configurar a subtração 'on' entre os canais de referência e ISM.
NOTA: A subtração garante que a tensão muda no canal ISM reflete as mudanças na concentração de TMA sozinha. - Mova o ISM para que ele toque a ponta do microeletrodo de iontoforese. Centralize as dicas entre si nos três eixos direcionais.
- Zero as posições relativas de ambos os microeletrodos noCaixas de controle micromanipulador. Certifique-se de que os microeletrodos estão centrados com precisão e precisão (crítica).
- Mova o ISM 120 μm para longe do microeletrodo de iontoforese em um eixo (o eixo esquerdo-direito, Figura 5b ). Insira esta distância na caixa "Medição de eletrodo" da GUI ( Figura 6a ).
- Inicie uma gravação clicando em "Adquirir" na GUI ( Figura 6a ); Permitir que o programa gravar uma gravação completa.
NOTA: O microeletrodo de iontoforese recebe uma corrente de polarização constante. Depois de clicar em "Adquirir", há uma pequena demora antes que a corrente principal seja aplicada por um período limitado. - Repita o passo 6.20 duas a três vezes mais. Aguarde até o sinal TMA retornar à linha de base antes de adquirir novos registros; O programa irá salvar cada registro para análise posterior.
- Verifique o espaçamento dos dois microeletrodos movendo o ISM de volta tO a posição zero especificada pela caixa de controle. Se os microeletrodos não estiverem mais centrados, centre-os novamente usando a mesma estratégia que no passo 6.17. Registre quaisquer alterações na posição dos eletrodos.
NOTA: se o espaçamento mudar em mais de cerca de 2%, os registros adquiridos no passo 6.19 não podem ser considerados precisos e novos devem ser tomados.

Figura 5: Configuração para experiências em Agar. (A) de configuração para experimento em agar diluído (passos 6,1-6,5): Um pequeno recipiente poroso preenchido com agar diluído colocado numa câmara de perfusão em execução. Um microeletrodo de iontoforese (lado esquerdo) e um ISM (lado direito) são mantidos por suportes de microeletrodos; Os suportes de microeletrodos são instalados nos braços dos micromanipuladores robóticos. Uma sonda de temperatura é colocada em gel de agar, e um eletrodo de terra indiferente é plAcediu dentro da câmara de submersão. ( B ) Visão ampliada de microeletrodos em agar: um microeletrodo de iontoforese (lado esquerdo) e um ISM (lado direito) são visualizados em ágar usando um objetivo de imersão em água de 10X (objetivo imerso aqui em NaCl 150 mM). Os microeletrodos são posicionados usando micromanipuladores até uma profundidade de 1.000 μm; O espaçamento entre microeletrodos é de 120 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Wanda Computer Software Interface. (A) Navegar Wanda interface gráfica de utilizador (GUI): O ecrã que aparece depois de abrir o software Wanda. Na caixa (1), o meio adequado, a molécula de iontoforese e a técnica são selecionados. (2) "Calibrar" é clicado para abrirA caixa de calibração Wanda. Após a calibração do ISM (ver Figura 6b e Suplemento B), o ISM é posicionado em ágar ou cérebro, como descrito nos passos 6 e 8 do protocolo. Na caixa (6), todos os valores apropriados para o experimento que está sendo executado são inseridos. (7) "Acquire" é clicado para fazer uma gravação; Um gráfico de tensão versus tempo aparece na parte superior direita da Wanda GUI. ( B ) Calibração do ISM em Wanda : a janela que se abre depois de clicar em (2) "Calibrar" na Wanda GUI. Os valores da etapa 3.29 são inseridos na caixa (3), e (4) "Ajustar dados" é selecionado. A curva de calibração é confirmada como linear. (5) "Aceptar" é clicado para retornar à GUI da Wanda. Clique aqui para ver uma versão maior desta figura.
7. Análise de Dados Agarose
- Abra oPrograma Walter no computador (PC). No menu "0. Registros de:", clique no botão "Wanda / VOLTORO" para ler os registros gerados por Wanda ( Figura 7a ). Supondo que a saída para uma planilha é necessária, abra o software apropriado. Clique em "Folha 1,3" no "1. Escreva o Excel?" Menu ( Figura 7b ).
- Na próxima janela pop-up, selecione a (s) gravação (s) a ser lida e clique em "Abrir" ( Figura 7b ); Note que os registros serão automaticamente representados graficamente. Para iniciar o procedimento de montagem, execute as seguintes etapas.
- No menu "2. Opções", clique no botão "selecionar rec". Na janela pop-up " Figura 2 ", use o mouse para mover a mira ao longo do primeiro registro a ser processado ( Figura 7c ); Pressione o botão do mouse para escolher o registro.
- Clique em oN "curva de ajuste" no menu. Selecione o número desejado de iterações de montagem; Use pelo menos 20 iterações de montagem para obter um ajuste preciso dos dados.
- No menu, selecione "tudo" para caber todos os pontos de dados e selecione "continuar"; O programa irá caber na curva exibida. Observe o procedimento de montagem e compare o registro experimental com a melhor curva ajustada obtida.
- Selecione a opção para escrever o resultado na planilha apropriada clicando em "Excel" no menu "7. Resultados" ( Figura 7d ). Observe (e registre) os seguintes dados críticos que serão usados para determinar a funcionalidade do microeletrodo de iontoforese: ' D (E5) ', ' Referência D (E5) ', ' R_app ', número de transporte ' n t ', ' Aparente N t '.
NOTA: " D (E5) ": coeficiente de difusão livre medidoTx 10 5 (cm 2 / s); " Referência D (E5) ": coeficiente de difusão teórico livre x 10 5 (cm 2 / s). Esse valor é extraído de um banco de dados dentro de Walter com base no íon, no meio e na entrada de temperatura. " R_app ": espaçamento aparente do microeletrodo (cm), calculado com base na medição e na referência D (E5) . " N t ": número de transporte (sem dimensões). Este número determina a fração da corrente de iontoforese que está sendo usada para liberar TMA 4 . " Aparente n t ": número de transporte aparente (sem dimensões). Este é um número de transporte calculado a partir de r_app . Este número deve estar próximo do n t medido. - Repita as etapas 7.1-7.3 para cada um dos registros para um par escolhido de microeletrodos.
- Determine se o microeletrodo de iontoforese é utilizável fazendo o seguinte.
- Compare " r_app" com o real r ( ou seja, 120 μm); Este critério é cumprido se os valores médios de todos os ensaios estiverem dentro de 4% uns dos outros.
- Compare " D (E5)" com a Referência D (E5) ; Este critério é cumprido se os valores médios de todos os ensaios estiverem dentro de 8% uns dos outros.
- Compare o " n t " entre ensaios com o mesmo microeletrodo; Este critério é cumprido se os valores médios de todos os ensaios estiverem dentro de 10% um do outro.
- Se um dos critérios do passo 7.5 não foi cumprido, solucione o microeletrodo de iontoforese ou comece a testar outro.
- Se o microeletrodo de iontoforese for considerado adequado para o experimento, registre o número médio de transporte de todos os ensaios no campo "Transporte Num N" na GUI de Wanda ( Figura 6a ).
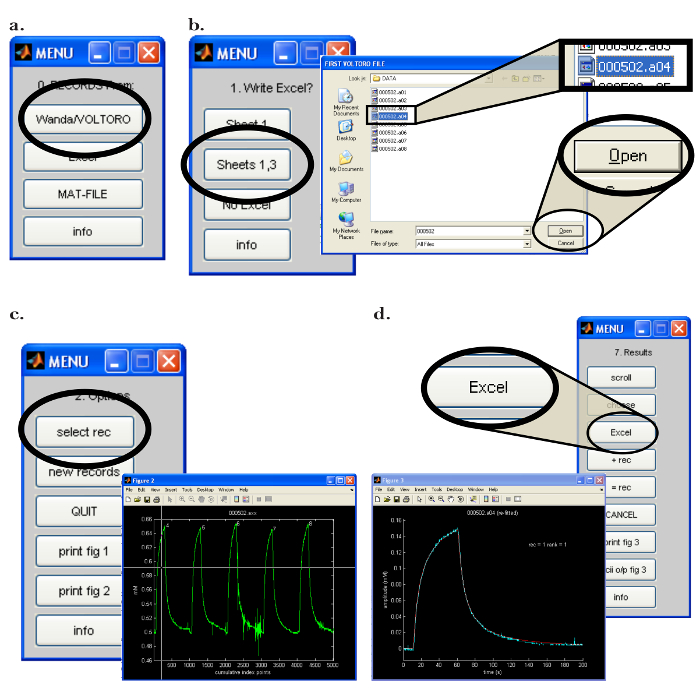
Figura 7: Walter Computer Software Interface. (A) Escolhendo o programa de coleta de dados em Walter: Os "0. Registros De:" do menu abre depois de iniciar o software Walter. A opção para carregar os registros salvos pelo Wanda é selecionada clicando no botão "Wanda / Voltoro". ( B ) Escolhendo o local de saída de análise de dados e dados em Walter: [Esquerda] Depois que o programa de planilha apropriado é aberto, "Folhas 1,3" é escolhida para produzir toda a análise de dados de Walter para o programa de planilhas anteriormente aberto. [Direito] Depois que o local de saída da análise de dados é escolhido, uma janela pop-up é aberta, permitindo que o usuário escolha as primeiras e últimas gravações a serem lidas por Walter. ( C ) Escolhendo a gravação para analisar em Walter: [Direita] Depois que os arquivos para ler forem escolhidos, uma janela pop-up será aberta com todos os registros escolhidos.Jogado como um gráfico (" Figura 2 "). [Esquerda] No menu "2.Opções", é clicado "select rec" e o mouse é usado para mover a mira para identificar a primeira gravação para análise; O botão do mouse é pressionado para escolher a gravação. ( D ) Exportando a análise de dados de Walter para uma planilha: depois de ajustar os dados, aparece uma janela pop-up e o menu "7. Resultados". [Esquerda] Gráfico da gravação selecionada (azul) com a curva de difusão ajustada gerada por Walter (vermelho). [Direito] O menu "7. Resultados" permite ao usuário escrever os dados da análise para uma planilha de planilha clicando no botão "Excel". Clique aqui para ver uma versão maior desta figura.
8. Itoforese em tempo real em fatias de cérebro
- Coloque um cérebro de 400 μm de espessuraPiolhos na câmara de gravação, assegurando que este esteja totalmente submerso na ACSF que flui. Posicione a fatia usando um pincel de aquarela e assegure-o suavemente com uma grade.
- Mova tanto o microeletrodo de iontoforese quanto o ISM acima do campo de interesse na fatia do cérebro. Submergir tanto no ACSF que flui como acima da fatia.
- Desliga a tensão para ambos os canais de referência e sensores de íons para "0" mV. Aguarde a tensão em ambos os canais para se estabilizar. No gravador gráfico, marque a tensão medida no canal de detecção de íons do ISM. Use isso para calcular o parâmetro V basal em Wanda.
- Coloque o ISM e o microeletrodo de iontoforese de 200 μm de profundidade na fatia e 120 μm um do outro. Aguarde a estabilização do sinal depois de mover o microeletrodo na fatia do cérebro.
NOTA: A corrente de polarização aplicada ao microeletrodo de iontoforese causa um pequeno acúmulo de TMA. É um erro comum tomar.Muito cedo e subestima o acúmulo de sinal. - No gravador gráfico, marque a tensão estabilizada medida na fatia do cérebro no canal de detecção de íons do ISM. Calcule a diferença de tensão entre o sinal TMA medido no passo 8.3 e o passo 8.4 e insira esse valor no campo "Baseline V (mV)" na caixa Eletrodo de Medição da GUI de Wanda ( Figura 6a ).
- No lado esquerdo da GUI, certifique-se de que todos os parâmetros experimentais são gravados / inseridos corretamente. Defina "Médio" para "Cérebro", "Número de transporte" para o valor médio calculado para o microeletrodo de iontoforese no passo 7.4 e "Temperatura" para a temperatura do banho contendo a fatia.
NOTA: V deve ser gravado para cada conjunto de medições. A linha de base V será convertida por Wanda no parâmetro C (mM) da linha de base ( ou seja, a concentração de TMA no tecido cerebral). - Inicie a gravação clicando em "Adquirir" e permita que ela faça uma gravação completa. Aguarde até que o sinal TMA regresse à linha de base antes de adquirir uma nova gravação.
- Pegue duas a três gravações sucessivas antes de remover os microeletrodos da localização do cérebro escolhido. Insira a temperatura medida no software Wanda imediatamente antes de cada gravação.
- Mova ambos os microeletrodos diagonalmente de volta para a superfície da fatia. Levante ambos para pelo menos 50 μm acima da fatia. Usando o gravador gráfico, determine qualquer alteração entre o V medido agora e sua medição da etapa 8.3.
- Centre as pontas do ISM e dos microeletrodos iontoforéticos relativos entre si nos eixos x, y e e-z. Obtenha mudanças de espaçamento, se houver, a partir da exibição da caixa de controle do micromanipulador.
9. Análise de dados cerebrais
- Abra uma nova planilha para o resultado da análise.
- Repita as etapas 7.1-7.4 em Walter para analisarE as gravações tiradas do cérebro.
- Escreva os dados no programa de planilha clicando em "Excel" no menu Walter. Registre a fração α , volume do ECS cerebral; Λ , tortuosidade do cérebro ECS; E k (s -1 ), clearance não específico.
10. Verificar número de transporte e calibração ISM
- Medir o número de transporte ISM ( n t ) no final da experiência usando o protocolo abaixo. Alternativamente, verifique n t após ensaios críticos ou quando as medidas parecem anômalas. No entanto, verificar n t muitas vezes pode resultar em trauma na fatia do cérebro.
- Faça novas gravações em agarose. Veja as etapas 6.4, 6.11, 6.12, 6.14, 6.15 e 6.17-6.22.
- Repita as etapas 7.1-7.4 em Walter para obter o n t das novas gravações de agarose. Inspecione a planilha: se o n t mudou maisDo que 10% do n t obtido antes das medições do cérebro, os dados obtidos com este microeletrodo iontoforético não são confiáveis.
- Execute uma nova calibração (ver passo 3.29) para o ISM depois de todos os dados do cérebro terem sido coletados. Use os dados de calibração ISM recém-obtidos como entrada na caixa Wanda Calibrate (veja as etapas 6.9 e 6.10) e verifique se o valor da inclinação difere em menos de 10% da calibração anterior.
NOTA: Os dados obtidos com este ISM não são confiáveis se o valor da inclinação for diferente em mais de 10% da calibração anterior.
Access restricted. Please log in or start a trial to view this content.
Resultados
A utilidade da técnica RTI é demonstrada em um experimento projetado para medir as mudanças em α e durante um desafio hipoosmolar ( Figura 8 e Figura 9 ). Já foi demonstrado que a redução da osmolaridade do ECS por lavagem na ACSF hipotônica produzirá uma diminuição em α e um aumento em λ 13 .
Nesta exper...
Access restricted. Please log in or start a trial to view this content.
Discussão
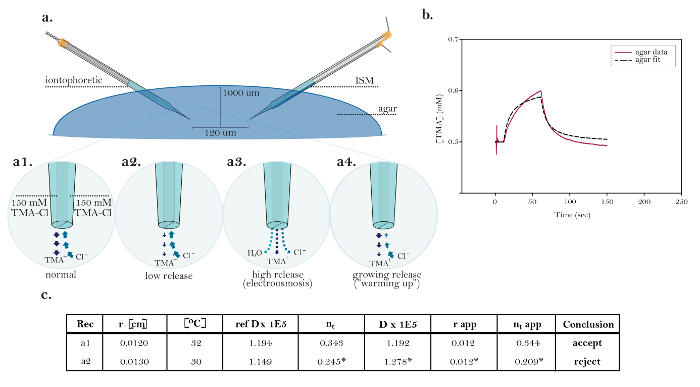
Figura 10: Dados não ideais que demonstram problemas técnicos comuns. (A) Diagramas de problemas técnicos comuns com microeletrodos de iontoforese: Comparação da versão normal do TMA de um microeletrodo funcionamento iontoforese com três fontes demonstrando questões técnicas. [Ampliação alta, a1] A corrente em uma fonte iontoforética ideal é carregada igualmente pela liberação de TMA...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
O trabalho foi apoiado pelo NIH NINDS concessão R01 NS047557.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| A/D and D/A converter | National Instruments Corporation | NI USB-6221 DAQ | The NI USB-6221 is still sold as a 'Legacy' device by NI. They recommend using NI USB-6341 X Series DAQs for new installations, however we have not tested the newer units. We describe the use of the NI USB-6221 with MATLAB and Windows 7 (32-bit). Alternatives: the much older PCI-MIO-16E-4 A/D converter (Used under Windows XP or older OS only) with BNC-2090 BNC connector panel and SH68-68-EP cable. As noted in the Wanda Manual, an experimental MATLAB program to use Axon Binary Files is available. |
| agarose | Lonza | NuSieve GTG Agarose #50081 | to prepare dilute agarose gel for RTI measurements |
| amplifier for ISM | Dagan | Model IX2-700 Dual Intracellular Preamplifier | ion and reference voltage amplifier with N=0.1 (for reference barrel) and N=0.001 (for ion barrel) headstages |
| biological compound miscroscope (with 4x and 10x objective) | for chipping the microelectrode tips and inspecting microelectrodes; various suppliers, e.g. AmScope | ||
| borosilicate theta capillary glass tubing | Harvard Apparatus | Warner Instruments model TG200-4; order #64-0811 | double-barreled glass tubing for ion-selective microelectrodes and iontophoretic microelectrodes; O.D. 2.0 mm, I.D. 1.4 mm, septum 0.2 mm, length 10 cm |
| brush | Winsor & Newton | University Series 233, size 0 | round shoft handle brush, available from Amazon |
| bunsen burner | Fisher | ||
| camera for visualizing micropipettes | Olympus | OLY-150 | requires monitor, IR filter on substage illuminator is optional |
| chart recorder | to record continuously voltages on ion-selective microelectrode during calibration in tetramethylammonium standards and during RTI experiment; e.g. Kipp & Zonen type BD112 dual-cannel chart recorded, available refurbished | ||
| chlorotrimethylsilane, puriss., > 99% | Sigma-Aldrich | catalog # 92360 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, reacts violently with water, see Sigma-Aldrich Safety Information for full description |
| Commercial Software | The MathWorks | MATLAB, Data acquisition toolbox | for data acquisition and analysis using Wanda and Walter programs. Note that an academic license is available. |
| eye protective goggles | Fisher | ||
| fixed-stage compound microscope | Olympus | BX51WI | can use other compound microscopes with fixed stages |
| forceps | Fine Science Tools | #11251-10 | to chip glass capillary; Dumond #5, preferably used and no longer needed for fine work |
| fume hood | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; various supliers, e.g. Captair with approriate filter sold by Erlab | ||
| glass microscope slide | Fisher | #12-550A | to chip microelectrode tips |
| heater/stirrer | Fisher | Corning PC-420D | to prepare dilute agarose gel and stir solutions |
| iontophoretic unit | Dagan | ION-100 and PS-100 | ION-100 is a single channel iontophoresis unit +/- 130 V compliance; PS-100 is an external power supply; alternatives: e.g. Axoprobe-1A made by Axon Instruments (now Molecular Devices), out of production, check for availability of refurbished units (eBay and other sites) |
| liquid ion exchanger (LIX) for tetramethylammonium | World Precision Instruments | IE190 Potassium Ion Exchanger | Note: this is equivalent to the original Corning potassium exchanger 477317 based on tetraphenlyborate - do not confuse with neutral carrier potassium exchanger originating from the laboartory of Dr. Simon, ETH, Zurich, which does not sense tetramethylammonium, and is sold by Fluka. You can also make liquid ion exchanger for tetramethylammonium yourself: 3% by weight potassium tetrakis = (p-chlorophenyl) borate dissolved in 2,3-dimethylnitrobenzene. Buy chemicals from Fluka (now part of Sigma). See Oehme and Simon (1976) Anal. Chim. Acta 86: 21-25; CAUTION: The toxicological properties of this liquid ion exchanger have not been fully determined. Ingestion or contact with the human body may be harmful. Exercise due care! Liquid ion exchangers should be stored in a cool place out of direct sunlight. |
| microelectrode holder | WPI | M3301EH | to hold ion-selective microeletrode prefabricate for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; WPI sells two versions of this holder, clear M3301EH and black M3301EH. In our experience, the clear M3301EH appears to be sturdier then the black M3301EH. |
| micromanipulator | Narishige | MM-3 | to position ion-selective microelectrode prefabricate during silanization and filling the tip of ion-selective barrel with liquid ion exchanger; can be substituted with any three-axis micromanipulator in good working condition |
| micropipette puller | Sutter Instruments | Model P-97 | to pull double-barreled glass tubing; other pullers can be used as long as they can accommodate large diameter double-barreled glass tubing |
| microprobe thermometer | Physiotemp | Model BAT-12R | fine probe of this thermometer is placed close to recording site |
| needle | BD | Syringes and Needles # 305122 (25 gauge) | for silanization; BD PrecisionGlide needles 25 G x 5/8 in (0.5 mm x 16 mm) |
| objective 5X dry | Olympus | MPlan N | |
| objective 10X water immersion | Olympus | UMPlan FL N | 10X objective is water immersion, numerical aperture is 0.3, working distance is 3.3 mm |
| plastic containers (with lids) | Fisher | #14-375-148 | to store tetramethylammonium standard solutions and microelectrodes |
| platform and x-y translation stage for fixed-stage microscope | EXFO | Gibraltar Burleigh | platform holds slice chamber, micromanipulators and accesorries, x-y translational stage moves microscope without compromising recording stability |
| porous minicup | for RTI measurements in a dilute agarose gel; homemade | ||
| reusable adhesive | Bostik | Blu-Tack | for securing microelectrodes to holding vessel and other uses; various suppliers, available from Amazon |
| robotic micromanipulator with precise x,y,z positioning | Sutter Instruments | MP-285 | two mircomanipulators are needed to hold separately ion-selective microelectrode and iontophoretic microelectrode. Also possible to glue micropipettes in a spaced array (see text). |
| signal conditioning unit with low-pass filter | Axon Instruments | CyberAmp 320 or 380 | no longer available from the manufacturer but may be available from E-Bay; alternatives: e.g. FLA-01 Filter/Amplifier from Cygnus Technology. This is a single channel instrument with a minimum cutoff at 10 Hz using a multipole Bessel filter but the company may be willing to modify it for a lower cutoff frequency (2 Hz) if needed. |
| silver wire | A-M Systems | #7830 | diameter 0.015", bare (no coating) |
| slice chamber | Harvard Apparatus | Warner Model RC-27L | this is submersion slice chamber; do not use interface slice chamber |
| stereomicroscope | for silanization and filling the tip of ion-selective barrel with liquid ion exchanger; horizontally mounted; various suppliers | ||
| syringe, 10 mL | BD | Syringes and Needles #309604 | to backfill microelectrodes and for silanization; BD Luer-Lok tip |
| syringe filter 0.22 µm pore | Whatman | #6780-1302 | to filter backfill solutions; available from Fisher |
| syringe needle, 28 gauge, 97mm | World Precision Instruments | MicroFil MF28G-5 | to backfill microelectrodes |
| Teflon (=PTFE) tubing | Component Supply | STT-28 PTFE tube light wall (28 gauge) | for silanization of ion-selective barrel; fits on BD PrecisionGlide needles 25 G x 5/8 in. Note: Teflon is essential, PVC tubing would melt by hot wax. |
| temperature control system | Harvard Apparatus | Warner Models TC-344B and SH-27A | TC-344B is a dual automatic temperature controller, SH-27A is an in-line heater; controller and heater work with Warner slice chambers |
| tetramethyammonium (TMA) chloride | Sigma-Aldrich | T-3411 | 5 M solution; CAUTION: acute toxicity (oral, dermal, inhalation), carcinogenicity, hazardous to the aquatic environment, see Sigma-Aldrich Safety Information for full description |
| vibrating blade microtome | Leica | VT1000S | to cut brain slices |
| xylenes | Fisher | X5-1 | for silanization; CAUTION: flammable, acute toxicity (oral, dermal, inhalation), skin corrosion, eye damage, carcinogenicity, see Fisher Safety Information for full description |
Referências
- Sykova, E., Nicholson, C. Diffusion in brain extracellular space. Physiol Rev. 88 (4), 1277-1340 (2008).
- Nicholson, C. Diffusion and related transport mechanisms in brain tissue. Rep Prog Phys. 64 (7), 815-884 (2001).
- Nicholson, C. Ion-selective microelectrodes and diffusion measurements as tools to explore the brain cell microenvironment. J Neurosci Methods. 48 (3), 199-213 (1993).
- Nicholson, C., Phillips, J. M. Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum. J Physiol. 321, 225-257 (1981).
- Nicholson, C., Sykova, E. Extracellular space structure revealed by diffusion analysis. Trends Neurosci. 21 (5), 207-215 (1998).
- Xie, L. L., et al. Sleep drives metabolite clearance from the adult brain. Science. 342 (6156), 373-377 (2013).
- Hrabetova, S., Nicholson, C. Biophysical properties of brain extracellular space explored with ion-selective microelectrodes, integrative optical imaging and related techniques. Electrochemical Methods for Neuroscience Neuroscience. Michael, A. C., Borland, L. M. , CRC press. 167-204 (2007).
- Rice, M. E., Okada, Y. C., Nicholson, C. Anisotropic and heterogeneous diffusion in the turtle cerebellum: implications for volume transmission. J Neurophysiol. 70 (5), 2035-2044 (1993).
- Vargova, L., et al. Diffusion parameters of the extracellular space in human gliomas. Glia. 42 (1), 77-88 (2003).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. Double-barreled and concentric microelectrodes for measurement of extracellular ion signals in brain tissue. J Vis Exp. (103), (2015).
- Xiao, F., Hrabetova, S. Enlarged extracellular space of aquaporin-4-deficient mice does not enhance diffusion of Alexa Fluor 488 or dextran polymers. Neuroscience. 161 (1), 39-45 (2009).
- Sherpa, A. D., Pvan de Nes,, Xiao, F., Weedon, J., Hrabetova, S. Gliotoxin-induced swelling of astrocytes hinders diffusion in brain extracellular space via formation of dead-space microdomains. Glia. 62 (7), 1053-1065 (2014).
- Kume-Kick, J., et al. Independence of extracellular tortuosity and volume fraction during osmotic challenge in rat neocortex. J Physiol. 542 (Pt 2), 515-527 (2002).
- Saghyan, A., Lewis, D. P., Hrabe, J., Hrabetova, S. Extracellular diffusion in laminar brain structures exemplified by hippocampus. J Neurosci Methods. 205 (1), 110-118 (2012).
- Fedirko, N., Svichar, N., Chesler, M. Fabrication and use of high-speed, concentric H+- and Ca2+-selective microelectrodes suitable for in vitro extracellular recording. J Neurophys. 96 (2), 919-924 (2006).
- Nicholson, C. Diffusion from an injected volume of a substance in brain tissue with arbitrary volume fraction and tortuosity. Brain Res. 333 (2), 325-329 (1985).
- Nicholson, C., Tao, L. Hindered diffusion of high molecular weight compounds in brain extracellular microenvironment measured with integrative optical imaging. Biophys J. 65 (6), 2277-2290 (1993).
- Thorne, R. G., Nicholson, C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proc Natl Acad Sci U S A. 103 (14), 5567-5572 (2006).
- Wolak, D. J., Thorne, R. G. Diffusion of macromolecules in the brain: implications for drug delivery. Mol Pharm. 10 (5), 1492-1504 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados