A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الضوء بوساطة تعديل عكسها من الميتوجين تنشيط كيناز مسار البروتين خلال تمايز الخلايا و
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول استراتيجية أوبتوجينيتيك لتعديل النشاط كيناز البروتين كيناز (مابك) النشاط خلال تمايز الخلايا والتنمية القيطم الجنينية. هذه الطريقة تسمح للتفعيل عكسها من مسار تشوير مابك في ثقافة الخلايا الثدييات وفي الكائنات الحية متعددة الخلايا، مثل أجنة القيطم ، مع قرار المكاني والزماني العالي.
Abstract
نشاط كيناز أمر بالغ الأهمية لعدد كبير من الوظائف الخلوية، بما في ذلك تكاثر الخلايا، والتمايز، والهجرة، وموت الخلايا المبرمج. خلال التطور الجنيني المبكر، نشاط كيناز ديناميكي للغاية وانتشاره عبر الجنين. وتستخدم عادة النهج الدوائية والوراثية للتحقيق في أنشطة كيناز. لسوء الحظ، فإنه من الصعب تحقيق قرار المكاني والزماني متفوقة باستخدام هذه الاستراتيجيات. وعلاوة على ذلك، فإنه ليس من الممكن السيطرة على نشاط كيناز بطريقة عكسها في الخلايا الحية والكائنات متعددة الخلايا. ولا يزال مثل هذا القيد عقبة أمام تحقيق فهم كمي لنشاط كيناز خلال التنمية والتمايز. يقدم هذا العمل استراتيجية أوبتوجينيتيك التي تستفيد من نظام بيسيسترونيك تحتوي على بروتينات فوتواكتفاتابل أرابيدوبسيس ثاليانا كريبتوكروم 2 (CRY2) ومجال N- محطة من كريبتوكروم التفاعل الحلزوني الأساسي حلقة الحلزون (سيبن). ريفيرسيويتحقق تنشيط بلي من كيناز بروتين كيناز (مابك) مسار الإشارات من خلال نقل البروتين بوساطة الضوء في الخلايا الحية. ويمكن تطبيق هذا النهج على الثقافات خلية الثدييات وأجنة الفقاريات الحية. هذا النظام بيسيسترونيك يمكن تعميمها للسيطرة على نشاط كينازاس أخرى مع آليات تفعيل مماثلة ويمكن تطبيقها على أنظمة نموذجية أخرى.
Introduction
وتشارك عوامل النمو في مجموعة واسعة من وظائف الخلية، بما في ذلك الانتشار، والتمايز، والهجرة، وموت الخلايا المبرمج، وتلعب دورا محوريا في العديد من الأحداث البيولوجية، بما في ذلك التطور الجنيني والشيخوخة وتنظيم الحالة النفسية 1 ، 2 ، 3 ، 4 ، 5 . العديد من عوامل النمو إشارة من خلال معقدة شلالات الإشارات داخل الخلايا. وغالبا ما يتم تشغيل هذه الأحداث الإشارات من قبل فسفرة الفوسفوريين عكسها في الأزياء المنظمة بدقة 6 ، 7 . وبالتالي، فإن فهم نتائج الإشارات من كيناز البروتين، والتي هي المسؤولة عن فسفرة البروتين، هو في الأساس المهم.
عوامل النمو المختلفة تعمل من خلال شبكة الإشارات المشتركة بين الخلايا، على الرغم من أنها تحفز ديستالاستجابات الخلوية الداخلية 8 ، 9 . وسطاء داخل الخلايا المشتركة من كينازات مستقبلات تشمل راس، راف، خارج الخلية كيناز تنظيم إشارة (إرك)، كيناز البروتين المنشط الميثان (مابك) / إرك كيناز (ميك)، فوسفهوانوسيتيد 3-كيناز (PI3K)، أكت، والفوسفوليباز C غاما ( 11) . وتشير الأدلة المتراكمة إلى أن تنوع الإشارات وخصوصيتها يعتمدان على التنظيم المكاني والزمني لنشاط التشوير 12 . على سبيل المثال، في خلايا ورم القواتم (PC12)، وتحفيز عامل نمو البشرة (إغف)، مما يؤدي إلى تكاثر الخلايا، ينشط عابرا مسار إرك 9 . من ناحية أخرى، التحفيز مع عامل نمو الأعصاب (نغف)، الأمر الذي يؤدي إلى تمايز الخلايا، ينشط مسار إرك بطريقة مستدامة 9 ، 13 . في مثقف rفي الخلايا العصبية قرن آمون، إشارات عابرة من قبل عامل التغذية العصبية المشتقة من الدماغ (بدف) يعزز نمو نيوريت الابتدائي، في حين أن الإشارات المستمرة يؤدي إلى زيادة نيوريت المتفرعة 14 . خلال التطور الجنيني المبكر، النشاط إرك فوسفهوريلاتد هو ديناميكية مؤقتا وينتشر على نطاق واسع في جميع أنحاء الجنين 6 . وأظهرت شاشة وراثية حديثة خلال وقت مبكر جينوبوس التطور الجنيني أن إرك و أكت يشير شلالات، واثنين من مسارات المصب عامل النمو الأولي، وعرض ملامح التنشيط مرحلة محددة 7 . وبالتالي، فإن فهم نتائج تشوير كيناز يدعو إلى الأدوات التي يمكن أن تحقق الملامح المكانية والزمانية للنشاط كيناز مع قرار كاف.
النهج التجريبية التقليدية للتحقيق في الطبيعة الديناميكية لتنبيه إشارة أثناء التنمية تفتقر إلى القرار المكاني والزماني المرغوب فيه. على سبيل المثال، النهج الدوائية تستخدم الكيماويات الصغيرةجزيئات أو بيولوجية لتحفيز أو قمع تنبيغ الإشارة في الخلايا والأنسجة. الطبيعة المنتشرة لهذه الجزيئات الصغيرة يجعل من الصعب تقييد عملها إلى منطقة معينة من الفائدة 15 . النهج الوراثية (على سبيل المثال، ترانزجينيسيس ، ونظام كري-لوكس، أو الطفرات) غالبا ما تؤدي إلى تفعيل لا رجعة فيه أو قمع التعبير الجيني الهدف أو نشاط البروتين 16 ، 17 ، 18 . يوفر نظام تيت أون / تيت-أوف 19 التحكم الزماني المحسن في النسخ الجيني ولكنه يفتقر إلى التحكم المكاني الصارم لأنه يعتمد على انتشار التتراسيكلين. التطورات الأخيرة في كيميائيا البروتين الناجم ديمريزاتيون 20 أو الصورة-التشبيك 21 ، 22 ، 23 ، 24 قد تعزز إلى حد كبيرإد التحكم الزمني لشبكات الإشارات. ومع ذلك، لا تزال السيطرة المكانية تشكل تحديا بسبب الطبيعة المنتشرة للمواد الكيميائية في قفص.
النهج الحديثة أوبتوجينيتيك الناشئة، التي تسخير قوة الضوء للسيطرة على البروتينات التفاعلات البروتين، تسمح لتشكيل مسارات الإشارات مع دقة المكانية الزمانية العالية وكذلك عكسها. بعد فترة وجيزة من نجاحها الأولي في السيطرة على إطلاق الخلايا العصبية 25 ، 26 ، 27 ، تم توسيع علم البصريات الضوئية للسيطرة على العمليات الخلوية الأخرى، مثل النسخ الجيني، والترجمة، وهجرة الخلايا، والتمايز، وموت الخلايا المبرمج 28 ، 29 ، 30 ، 31 ، 32 ، 33 ، 34 . إستراتيجية باستخدام pتم تطوير البروتين البروتين هوتواكتفاتابل أرابيدوبسيس ثاليانا كريبتوكروم 2 (CRY2) البروتين والنطاق N- محطة من كريبتوكروم التفاعل الحلزون الأساسي حلقة الحلزون (سيبن) مؤخرا للسيطرة على نشاط RF1 كيناز في خلايا الثدييات وأجنة القيطم 35 . CRY2 يربط سيبن على التحفيز الضوء الأزرق، و CRY2 / سيبن مجمع البروتين ينفصل تلقائيا في الظلام 34 . الضوء الأزرق يثير العامل المساعد CRY2، فلافين الأدينين ثنائي النوكليوتيد (فاد)، الأمر الذي يؤدي إلى تغيير التوافقية في CRY2 وملزم لاحق ل سيبن. يمكن أن تنتج النشطات التأسيسية (W374A) و فلافين ناقصة (D387A) المسوخ من CRY2 من خلال الطفرات في جيب ملزم فاد: و CRY2 W374A متحولة يربط سيبن مستقلة عن الضوء، في حين أن CRY2 D387A متحولة لا يرتبط سيبن تحت الأزرق التحفيز الضوء 36 ، 37 . نظام أوبتوجينيتيك وصفها طن هذا البروتوكول يستخدم البرية من نوع CRY2 و سيبن للحث على البروتين بوساطة بوساطة RF1 تفعيل في الخلايا الحية. ومن المعروف أن تجنيد الغشاء من راف 1 يعزز نشاطها 38 . في هذا النظام، وترتكز جنبا إلى جنب وحدة سيبن إلى غشاء البلازما و CRY2-مشيري تنصهر إلى N- محطة من RF1 35 . في غياب الضوء الأزرق، CRY2-مشيري-RF1 يبقى في السيتوبلازم، و RF1 غير نشط. تحفيز الضوء الأزرق يدفع CRY2-سيبن ملزمة وتجند RF1 إلى غشاء البلازما، حيث يتم تنشيط RF1. تنشيط راف يحفز سلسلة تشوير راف / ميك / إرك. يتم ترميز كل من البروتينات CRY2- و سيبن الانصهار في النظام الجيني بيسيترونيك. ويمكن تعميم هذه الاستراتيجية للسيطرة على كينازات أخرى، مثل أكت، التي يمكن تفعيلها الدولة تفعيلها أيضا عن طريق نقل البروتين في الخلايا 39 . يقدم هذا العمل بروتوكولات مفصلة لتنفيذ هذه الاستراتيجية أوبتوجينيتيك في كولتو الخلية الثديياتريس والكائنات متعددة الخلايا.
Access restricted. Please log in or start a trial to view this content.
Protocol
أجريت بحوث الحيوانات وفقا للمبادئ التوجيهية التي وضعتها لجنة رعاية واستخدام الحيوان المؤسسي إلينوي (إاكوك) وجامعة إلينوي قسم الموارد الحيوانية (دار).
1. أوبتوجينيتيك الاستقراء من توطين البروتين في BHK21 ثقافة الخلايا الثدييات
ملاحظة: الخطوات 1.1-1.3 توفر طريقة لتجميع غرفة زراعة الخلايا للتصوير مع أهداف عالية التكبير (على سبيل المثال، 63X أو 100X)، والتي عادة ما يكون مسافات العمل قصيرة. هذه الأهداف تتطلب ساترة الزجاج رقيقة (على سبيل المثال، # 1.5، 170 ميكرون سمك) كما الركيزة التصوير. بدلا من ذلك، يمكن استخدام طبق زجاج خلية أسفل القاع / الشريحة. في مثل هذه الحالة، يمكن تخطي الخطوات 1.1-1.3.
- تنظيف كوفرسليبس الزجاج
- وضع 30 كوفرسليبس الزجاج في حامل ساترة.
- في كوب من البلاستيك 600 مل، إضافة 20 غرام من المنظفات و 400 مل من ماء الحنفية الدافئة. PLACe الكأس على النمام المغناطيسي ويقلب حتى يتم حل جميع المنظفات. إزالة الرغوة باستخدام ورقة الأنسجة.
- استخدام الجزء السفلي من 100 مم × 15 ملم طبق بتري كما فاصل من شريط ضجة وكسطح لحامل ساترة. للحفاظ على تدفق كاف أثناء عملية التنظيف، وجعل 3-4 استنزاف الثقوب في طبق بتري.
- لجعل الثقوب استنزاف، وتسخين الحديد لحام وحرق من خلال البلاستيك في غطاء محرك السيارة تنفيس.
تنبيه: لا تلمس الحديد لحام ساخنة بأيد عارية. - وضع حامل ساترة على طبق بتري في الدورق. يحرك لمدة 2 ساعة إلى بين عشية وضحاها في درجة حرارة الغرفة.
- يغسل ثلاث مرات مع 500 مل من دي المياه في كوب 1000 مل. يمكن إعادة استخدام محلول المنظفات.
- التقاط كوفرسليبس الفردية باستخدام ملقط. تزج كوفرسليبس في 190 واقية (95٪) من الإيثانول لمدة 1 دقيقة.
- تجفيف كوفرسليبس داخل غطاء محرك السيارة العقيمة. تخزين كوفرسليبس في حاوية بلاستيكية معقمة حتى الاستخدام.
- جعل بولي-L- يسين (بل) كوفرسليبس المغلفة
- جعل 0.1 M العازلة بورات عن طريق إذابة 1.24 غرام من حمض البوريك و 1.9 غرام من تيترابوريت الصوديوم في 400 مل من الماء. ضبط درجة الحموضة إلى 8.5 مع 10 M هيدروكسيد الصوديوم.
- حل بل في العازلة بورات إلى تركيز النهائي من 1 ملغ / مل. قسامة الحل بل في 50 مل أنابيب الطرد المركزي العقيمة.
- إضافة 50 مل من محلول طلاء بل إلى 10 سم طبق ثقافة الأنسجة. ضع الطبق في حاضنة 37 درجة مئوية لتسخين حل بل.
- فتح حاوية ساترة (الخطوة 1.1.8) في غطاء محرك السيارة العقيمة.
- تزج كوفرسليبس تنظيف واحدا تلو الآخر في حل بل قبل تحسنت في طبق ثقافة الأنسجة. تجنب تشكيل فقاعة من أجل غمر جميع الأسطح.
- وضع الطبق مع ساترة في 37 درجة مئوية كو 2 حاضنة بين عشية وضحاها. إخراج كل ساترة ووضعه في حامل ساترة معقمة. شطف ثلاث مرات مع الماء عالى النقاء تعقيمها (18.2 MΩ &183؛ سم المقاومة) في كوب 1000 مل في غطاء محرك السيارة العقيمة.
- تجفيف كوفرسليبس في حامل ساترة في غطاء محرك السيارة العقيمة. تخزين كوفرسليبس في حاوية بلاستيكية معقمة حتى الاستخدام.
- تجميع بوليديميثيلزيلوكسان (بدمس) غرف ثقافة الخلية
- في وعاء من البلاستيك، تزن 40 غرام من قاعدة بدمس وإضافة 4 غرام من وكيل علاج لتحقيق 10: 1 ث / ث نسبة بدمس وكيل علاج. مزيج بدمس / وكيل علاج عن طريق التحريك مع طرف ماصة لمدة 2 دقيقة. بدلا من ذلك، استخدم خلاط الطرد المركزي.
- استخدام كوب مع قطر 4 بوصة كقالب لجعل حامل مع قطعة من رقائق الألومنيوم. وضع حامل رقائق الألومنيوم في طبق بتري 15 سم. وضع رقاقة السيليكون 4 بوصة داخل هذا الألومنيوم احباط حامل.
- صب حل بدمس مختلطة في حامل. استخدام قضيب زجاجي رقيقة للمس حافة الرقاقة بلطف. إزالة أي فقاعات الهواء المحاصرين تحت الرقاقة.
- إدراج طبق بتري 15 سم في تشامب فراغr إلى ديغاس الحل بدمس. مواصلة التفريغ لمدة 20 دقيقة، حتى يتم إنشاء أي فقاعات. في هذه الأثناء، سخن الفرن الحراري إلى 65 درجة مئوية.
- ضع بعناية طبق بتري 15 سم في الفرن. احتضان لمدة 2 ساعة.
- إزالة لوحة من الفرن. استخدام قضيب من الزجاج لمس بلطف حافة بدمس وضمان التشابك الكامل. إن لم يكن، احتضان لفترة أطول، حتى بدمس الصلبة وغير لزجة.
- إزالة رقائق الألومنيوم من لوحة وقشر قبالة رقاقة السيليكون. بدءا من الحافة، وقشر بعناية بدمس الشفاء من رقاقة السيليكون.
تنبيه: تجنب تطبيق الكثير من القوة، كما أنه يمكن كسر الرقاقة. - تقليم بدمس إلى 20 مم × 30 مم قطع مستطيلة لتناسب 24 مم × 40 مم ساترة مع شفرة حلاقة.
- استخدام شفرة على شكل إزميل لقطع افتتاح مستطيل من 10 مم × 20 مم من مركز كل قطعة بدمس.
- تنظيف غرف بدمس باستخدام بروتوكول المنظفات وصفها في الخطوة 1.1.
- تجفيف غرف بدمس في غطاء محرك السيارة نظيفة. وضع الغرف الجافة في حاوية أوتوكلافابل مغطاة رقائق الألومنيوم.
- الأوتوكلاف الحاوية باستخدام الجاذبية (121 درجة مئوية، 15 رطل) لمدة 30 دقيقة وتخزين الحاويات في درجة حرارة الغرفة.
- BHK21 زراعة الخلايا وترنسفكأيشن
- جعل 500 مل من المتوسطة لخلية الخلية BHK21 عن طريق خلط 445 مل من دمم مع 50 مل من فبس و 5 مل من 100 × بن ستريب الجلوتامين (10000 U / مل البنسلين، 10 ملغ / مل الستربتومايسين، و 29.2 ملغ / مل L -glutamine). تأكد من أن تركيز النهائي من فبس هو 10٪.
- قسامة 10 مل من غير هيبيس كو 2 -المتوسطة المستقلة للتصوير الخلية الحية.
ملاحظة: كو 2 -المتوسطة يعتمد على دعم نمو الخلايا دون حاضنة كو 2 ومثالية لخلايا التصوير في ظل الظروف الجوية. راجع قائمة المواد للحصول على معلومات تفصيلية. بالإضافة إلى خط خلية BHK21، يجب أن تعطي أنواع أخرى من خلايا الثدييات أيضانتائج مماثلة. - تجميع جهاز زراعة الخلايا عن طريق وضع واحد تعقيمها، غرفة بدمس العقيمة (الخطوة 1.3) على العقيمة بل المغلفة ساترة (الخطوة 1.2) في غطاء محرك السيارة العقيمة.
- وضع كل جهاز في العقيمة طبق بتري 60 ملم.
- استخدام 0.5 مل من التربسين 0.25٪ لفصل الخلايا من بئر واحدة من 12-جيدا لوحة زراعة الأنسجة. عد كثافة الخلية مع عدادة الكريات. لوحة 20،000 خلايا BHK21 في الغرفة (حوالي 10،000 خلية / سم 2 ) مع 200 ميكرولتر من وسط زراعة الخلايا.
- إعداد البلازميد الحمض النووي مع مجموعة إعداد البلازميد (انظر قائمة المواد).
ملاحظة: يتم عرض تصميم وظائف CRY2-مشيري-RF1-2A-2CIBN-غفب-كاكس في الشكل 1A - 1B . - أربعة وعشرين (24) ساعة بعد طلاء الخلية، ترانسفيكت الخلايا مع 50-100 نانوغرام من CRY2-مشيري-RF1-2A-2CIBN-غفب-كاكس البلازميد، وفقا لبروتوكول الشركة المصنعة.
- ثلاث (3) ساعات بعد ترنسفكأيشن، تغيير مإديوم إلى 200 ميكرولتر من وسط الزراعة الطازجة (الخطوة 1.4.1) والسماح للخلايا لاستعادة بين عشية وضحاها من خلال حضانة الثقافة في 37 درجة مئوية، 5٪ كو 2 حاضنة.
- مضان التصوير الخلية الحية
- تشغيل الكمبيوتر، مصدر الضوء، المجهر، وكاميرا. استخدام مجهر مضان متحد البؤر (مجهزة 100X الهدف الغمر النفط) لبقية البروتوكول.
ملاحظة: مجهر إبيفلورزنس مقلوب ويمكن أيضا أن تستخدم. - استبدال وسط زراعة الخلايا مع 200 ميكرولتر من ثاني أكسيد الكربون 2 -المتوسطة المستقلة.
- إعداد بروتوكول الحصول على البيانات قبل وضع الخلايا على المجهر. استخدام 488 نانومتر الإثارة قناة فيتس للتحفيز أوبتوجينيتيك. استخدام 561 نانومتر الإثارة قناة تريتس لتحديد الخلايا ترانزفكتد وتتبع توطين الخلوية من البروتين المسمى مشيري.
- تعيين كسب فيتس وقنوات تريتك كما 120 و 200، على التوالي. استخدام بكسل-- مسكن الوقت من 2.21؛ s وحجم 512 × 512 بكسل.
- قياس قوة الضوء 488 نانومتر عن طريق وضع عداد الطاقة قريبة من نافذة موضوعية. قوة إجمالية قدرها 2 μW (حوالي 10،000 W / سم 2 في التركيز) كافية للحث على جمعية سيبن-CRY2PHR.
- إعداد اكتساب الطابع الزمني مع الفاصل الزمني 5 ثانية ومجموع وقت الاستحواذ من 2 دقيقة.
- تطبيق المواد المناسبة مطابقة الفهرس (زيت الغمر) على نافذة الهدف. استخدام وضع التباين المرحلة للتركيز على الخلايا على سطح ساترة.
- تحديد موقع خلية ترانزفكتد تحت 561 ضوء نانومتر عن طريق تحريك مرحلة المجهر.
تنبيه: تجنب استخدام الضوء الأزرق خلال هذه الخطوة، كما أنه سيتم تنشيط الارتباط بين البروتينات فواكتيفاتابل. - مرة واحدة تقع خلية ترانزفكتد، بدء الحصول على البيانات.
ملاحظة: الخلايا ترانزفكتد بنجاح يجب أن تظهر مضان في كل من فيتس (من 2CIBN-غفب-كاكس) و تريتك (من CRY2-مشيري-RF1) قنوات ( الشكل 1C-D ). - تسجيل سلسلة من الصور ختمها الوقت في كل من القنوات فيتس و تريتك ( الشكل 1D ).
- للتحقيق في التفكك عفوية من مجمع البروتين CRY2-سيبن، تسجيل الطابع الزمني آخر مع قناة تكسرد وحدها لمدة 20 دقيقة، مع فاصل 30 ثانية.
- حفظ صورة ختمها الوقت لتحليل البيانات.
- تشغيل الكمبيوتر، مصدر الضوء، المجهر، وكاميرا. استخدام مجهر مضان متحد البؤر (مجهزة 100X الهدف الغمر النفط) لبقية البروتوكول.
- تحليل الصور
- فتح الصور مع برنامج تحليل الصور التي يمكن استخراج كثافة من صورة 40 .
- حدد لقطتين ممثلتين: واحدة قبل التعرض للضوء الأزرق والتعرض بعد الضوء الأزرق آخر.
- رسم خط عبر الخلية التي تمتد على الخلفية، غشاء البلازما، والسيتوبلازم. مشروع كثافة على طول هذا الخط. حفظ القيم ورسم لهم لمقارنة الفرق قبل وبعد التعرض للضوء ( الشكل 1D ).
- لتحليل حركية جمعية البروتين، سيليكt منطقة تمثيلية واحدة من الفائدة (روي) في غشاء البلازما، وعائد الاستثمار واحد في السيتوبلازم، وعائد الاستثمار واحد في الخلفية.
- الحصول على متوسط شدة غشاء البلازما (I بيإم)، السيتوبلازم (I سيت )، والخلفية (I بكد) لكومة الصورة.
- حساب نسبة غشاء / كثافة عصاري خلوي لكل صورة باستخدام المعادلة التالية:
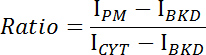
- رسم نسبة مقابل الوقت وتحديد حركية أو تفكك حركية CRY2-سيبن ( الشكل 1E -F ).
2. بناء صفيف ليد لتحفيز الضوء على المدى الطويل في حاضنة كو 2
ملاحظة: يظهر التخطيطي العام من الإعداد التجريبي في الشكل 2A .
- جعل مجموعة ليد عن طريق إدخال 12 المصابيح الزرقاء في اثنين من الخبزدس وربط المقاومات الحالية الحد.
ملاحظة: مع إمدادات الطاقة 30 V، يمكن توصيل أربعة المصابيح في سلسلة، ويمكن التحكم في سطوعها من قبل المقاوم الحد الحالي. - ضع الألواح في صندوق ألومنيوم.
ملاحظة: يجب أن يكون ارتفاع مربع الألومنيوم 2 في. هذا الارتفاع هو الأمثل لإلقاء الضوء على 12-جيدا لوحة زراعة الأنسجة، لأن حجم بقعة الضوء المتباينة هو نفسه كما أن من بئر واحدة. - استخدام اثنين من الأسلاك المعدنية للاتصال إمدادات الطاقة. تأكد من أن طول السلك كاف عندما يتم وضع صندوق الضوء داخل حاضنة كو 2 .
- استخدام الناشر ضوء شفافة كما غطاء مربع الضوء ( الشكل 2C ).
- معايرة انتاج الطاقة من كل ليد في مجموعة من المدخلات الجهد. استخدام قوة 0.2 ميغاواط / سم 2 ل 24 h PC12 فحص تمايز الخلايا. استخدام قوة 5 ميغاواط / سم 2 لأجنة القيطم الحية أو إإكسبلنتسالمقاييس.
3. أوبتوجينيتيك الاستقراء من PC12 الخلية التمايز
- خلية زراعة وترنسفكأيشن
- جعل 500 مل من المتوسطة لقرن الخلايا ورم القواتم (PC12) زراعة الخلايا عن طريق خلط 407.5 مل من F12K مع 75 مل من مصل الحصان + 12.5 مل من فبس + 5 مل من 100 × بن ستريب الجلوتامين (التركيزات النهائية من مصل الحصان و فبس : 15٪ و 2.5٪ على التوالي). جعل المتوسطة المتوسطة منخفضة عن طريق خلط 1 حجم المتوسطة الكاملة في 99 مجلدا من F12K المتوسطة.
- لوحة خلايا PC12 في لوحة 12 جيدا في كثافة 300،000 خلية / جيدا أو 75،000 خلية / سم 2 .
- ترانسفيكت الخلايا مع CRY2-مشيري-RF1-2A-2CIBN-غفب-كاكس 24 ساعة بعد طلاء الخلية (على غرار الخطوة 1.4.7). استخدام 1.2 ميكروغرام من الحمض النووي لكل بئر. السماح للخلايا لاستعادة بين عشية وضحاها في وسط الثقافة في حاضنة 37 درجة مئوية تكمل مع 5٪ كو 2 . تحقق من كفاءة ترنسفكأيشن 16 ساعة بعد ترنسفكأيشن.
ملاحظة: A ترنسفكأيشن 30-50٪وينبغي تحقيق الكفاءة لضمان عدد الخلايا كافية. - تغيير المتوسطة إلى منخفضة المصل المتوسطة 24 ساعة بعد ترنسفكأيشن. استخدام 1 مل من المتوسطة لكل بئر من لوحة 12 جيدا.
- الضوء الناجم عن تمايز الخلايا PC12
- وضع صفيف ليد في حاضنة كو 2 . توصيله إلى إمدادات الطاقة باستخدام زوج من الأسلاك. تعيين قوة الصمام إلى 0.2 ميغاواط / سم 2 . وضع لوحة 12 جيدا تحتوي على خلايا PC12 ترانزفكتد (الخطوة 3.1.3) على نافذة صفيف ليد. تطبيق الإضاءة المستمرة المستمر لمدة 24 ساعة في حاضنة 37 درجة مئوية تكمل مع 5٪ كو 2 .
- مضان التصوير الخلية الحية
- اتبع الخطوات 1.5.1-1.5.4 للمجهر وإعداد العينات.
- إعداد اقتناء البيانات لقطة واحدة. استخدم 200 مللي ثانية لكل من القناة غفب و تكسريد.
- التقاط الصور من الخلايا ترانزفكتد في كل من قنوات غفب و تكسريد. سجل ما يقرب من 200 سيللس لكل حالة. حفظ الملفات لتحليل البيانات.
- تحليل الصور
- حساب النسبة المئوية للخلايا متباينة على العدد الإجمالي للخلايا ترانزفكتد.
- استخدام أي وحدة عد الخلايا في برنامج تحليل الصور لحساب الخلايا.
- عد يدويا خلايا متباينة.
ملاحظة: يتم تعريف خلايا متباينة كما تلك التي نيوريت واحد على الأقل أطول بشكل ملحوظ من الجسم الخلية ( الشكل 3A -3B ). - كرر الخطوة 3.4.3 مع خلايا غير متمايزة.
- احسب نسبة التمايز باستخدام المعادلة التالية:
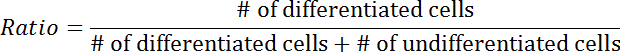
4. أوبتوجينيتيك السيطرة على نشاط كيناز في الأجنة القيطم
- إعداد المخازن المؤقتة
- إعداد 1 لتر من 1X مارك تعديل الجرس (مر): 100 ملمكلوريد الصوديوم، 2 ملي بوكل، 1 ملي مغكل 2 ، 2 ملي كاكل 2 ، و 5 ملي هيبيس. الرقم الهيدروجيني 7.5.
- إعداد مرنا
- هضم CRY2-مشيري-RF1-2A-2CIBN-غفب-كاكس البلازميد الحمض النووي (2 ميكروغرام) مع 1 ميكرولتر من أباي (50 وحدة) عند 37 درجة مئوية لمدة 2 ساعة.
- يعجل الحمض النووي الخطي في 60 ميكرولتر من الايثانول بنسبة 100٪. تدور في 12000 × ز لمدة 5 دقائق في درجة حرارة الغرفة إلى بيليه الحمض النووي. إزالة بعناية طاف وغسل بيليه مرة أخرى مع 60 ميكرولتر من الايثانول 70٪. تدور في 12000 × ز لمدة 5 دقائق أخرى في درجة حرارة الغرفة. إزالة بعناية طاف و ريسوسبيند بيليه الحمض النووي في 6 ميكرولتر من ريبونوكلياز خالية H 2 O.
- إجراء في المختبر النسخ عن طريق احتضان 1 ميكروغرام من الحمض النووي الخطي مع 2 ميكرولتر من SP1 رنا الموردة البلمرة، خليط ريبونوكليوتيد (10 ملم أتب، كتب، و أوتب؛ 2 ملي غتب، و 8 ملي كاب التناظرية)، و 20 ميكرولتر من nuclease- المياه مجانا في درجة حرارة الغرفة لمدة 1 ساعة.
- إزالة Dنا قالب من قبل دناز أنا الهضم عند 37 درجة مئوية لمدة 15 دقيقة على الأقل وتنقية الحمض النووي الريبي توليفها باستخدام عمود تدور غشاء السيليكا.
- وقف رد الفعل ويعجل الحمض النووي الريبي عن طريق إضافة 30 ميكرولتر من نوكليس خالية من المياه و 30 ميكرولتر من محلول هطول الأمطار ليكل. مزيج جيدا والبرد لمدة 30 دقيقة في -20 درجة مئوية.
- أجهزة الطرد المركزي في 4 درجات مئوية لمدة 15 دقيقة في 12000 × ز لبيليه الحمض النووي الريبي.
- إزالة بعناية طاف. غسل الحمض النووي الريبي مرة واحدة مع 1 مل من الايثانول 70٪ و ريسوسبيند في 40 ميكرولتر من نوكليس خالية من المياه.
- تحميل 40 ميكرولتر من الحمض النووي الريبي في عمود الدوران. أجهزة الطرد المركزي في 4 درجات مئوية لمدة 1 دقيقة في 12000 × ز لإزالة النيوكليوتيدات ونيسليوتيدس ونينكوربوراتد.
- الحصاد الأجنة القيطم
- اتبع البروتوكول الذي وصفه سيف وآخرون. 41 للحصول على الأجنة القيطم .
- مرنا ميكروينجكتيون
- صنعالإبر ل ميكروينجكتيون عن طريق سحب الشعيرات الدموية الزجاجية مع مجتذب شعري. تعيين برنامج سحب إلى: الحرارة = 355، قوة سحب = 80، سرعة = 50، والوقت = 100.
- إزالة معطف هلام من الأجنة من خلال معاملتها مع 3٪ السيستين (المخفف في 0.2X مر).
- نقل الأجنة إلى بوليسكروز 3٪ وحلول مر 0.5X ل ميكروينجكتيون. حقن 500 خريج إلى 1 نانوغرام من CRY2-مشيري-RF1-2A-2CIBN-غفب-كاكس رنا في كل جنين.
ملاحظة: حقن جرعة أعلى من 1 نانوغرام يؤدي إلى تفعيل الضوء الأزرق مستقلة من الإشارات مابك.
- التحفيز أوبتوجينيتيك من نشاط كيناز
- الثقافة ميكروينجكتد الأجنة في بوليسوكروس 3٪، حل مر 0.5X في درجة حرارة الغرفة حتى تصل إلى منتصف منتصف المعدة (المرحلة 12). ثم، والثقافة الأجنة في حل مر 0.2X.
- نقل الأجنة أو إكسلانتس إلى لوحة 12 جيدا. ضع لوحة 12 جيدا على مجموعة ليد بنيت المنزل (الخطوة 2.5) ل الأزرق ليغر (475 نانومتر) العلاج.
- وضع مرآة على الجزء العلوي من لوحة 12 جيدا لضمان الإضاءة الزرقاء الضوء الكامل من الأجنة أو إكسلانتس.
- ضبط قوة الضوء الأزرق إلى 5 ميغاواط / سم 2 .
ملاحظة: العلاج الأزرق ضوء يمكن أن يؤديها في أي وقت المطلوب، إما بوليسوكروس 3٪، حل مر 0.5X، أو حل مر 0.2X. - حصاد الأجنة في أي وقت المطلوب. استخدمها للتحليل النسيجي، والغربي، وصمة عار، أو التعبير الجيني.
Access restricted. Please log in or start a trial to view this content.
النتائج
التعبير راتيوميتريك من أزواج البروتين فوتواكتفاتابل: الشكل 1A يظهر تصميم بناء أوبتوجينيتيك بيسيسترونيك، CRY2-مشيري-RF1-P2A-سيبن-سيبن-غفب-كاكس (المشار إليها CRY2-2A-2CIBN)، استنادا إلى الخنازير teschovirum- 1 2A (P2A) الببتيد، مما يدل على أعلى كفاءة تخطي ...
Access restricted. Please log in or start a trial to view this content.
Discussion
عند بناء مربع الضوء، ينبغي قياس قوة المصابيح الفردية. استنادا إلى الخبرة السابقة، يمكن أن تختلف انتاج الطاقة بين المصابيح الفردية بسبب التباين التصنيع. حدد مجموعة من المصابيح التي لديها انتاج الطاقة في غضون 10٪ من بعضها البعض. ويمكن تعديل عدد من المصابيح، المقاوم الح...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن المؤلفون أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
وأيد هذا العمل من قبل جامعة إلينوي في أوربانا شامبين (إيوك) والمعاهد الوطنية للصحة (نيغمس R01GM111816).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Glass coverslip | VWR | 48393 230 | Substrate for live cell imaging |
| Coverslip holder | Newcomer Supply | 6817B | Holder for coverslips |
| Detergent | ThermoFisher | 16 000 104 | For cleaning coverslips |
| Boric acid | Sigma-Aldrich | B6768-500G | For making PLL buffer |
| Disodium tetraborate | Sigma-Aldrich | 71996-250G | For making PLL buffer |
| Plastic beaker | Nalgene | 1201-1000 | For cleaning coverslips |
| Sodium hydroxide | Sigma-Aldrich | 221465-2.5KG | For adjust pH |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P1274-500MG | For coating coverslip |
| Diethylpyrocarbonate (DEPC)-Treated Water | ThermoFisher Scientific | 750024 | For DNA preparation |
| Cover Glass Forceps | Ted Pella | 5645 | Cover glass handling |
| Tissue cutlure dish | Thermofisher | 12565321 | Cell culture dish |
| Sterile centrifuge tubes | ThermoFisher | 12-565-271 | Buffer storage |
| Transfection Reagent | ThermoFisher | R0534 | Transfection |
| CO2-independent medium | ThermoFisher | 18045088 | For live cell imaging |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Form make cell chamber |
| Plasmid Maxiprep kit | Qiagen | 12965 | Plasmid preparation |
| DMEM medium | ThermoFisher | 11965-084 | Cell culturing medium component |
| F12K medium | ThermoFisher | 21127022 | Cell culturing medium component |
| Horse serum | ThermoFisher | 16050122 | Cell culturing medium component |
| Fetal Bovine Serum | Signa-Aldrich | 12303C-500 mL | Cell culturing medium component |
| Penicillin-Streptomycin-Glutamine | ThermoFisher | 10378016 | Cell culturing medium component |
| Trypsin (0.25%), phenol red | ThermoFisher Scientific | 15050065 | For mammalian cell dissociation |
| Agarose | Fisher Scientific | BP1356-100 | For DNA preparation |
| Ficoll PM400 | GE Heathcare Life Sciences | 17-5442-02 | For embryo buffer |
| L-Cysteine hydrochloride monohydrate | Sigma-Aldrich | 1.02839.0025 | Oocyte preparation |
| ApaI | ThermoFisher | FD1414 | For linearization of plasmids |
| Dnase I | ThermoFisher | AM2222 | For removing DNA template in the in vitro transcription assay |
| Index-match materials (immersion oil) | Thorlabs | MOIL-20LN | For matching the index between sample substrate and objective |
| Blue LED | Adafruit | 301 | Light source for optogenetic stimulation |
| Resistor kit | Amazon | EPC-103 | current-limiting resistor |
| Aluminum boxes | BUD Industries | AC-401 | light box |
| BreadBoard | Jekewin | 837654333686 | For making LED array |
| Hook up Wire | Electronix Express | 27WK22SLD25 | For making LED array |
| Relay Module | Jbtek | SRD-05VDC-SL-C | For intermittent light control |
| DC Power Supply | TMS | DCPowerSupply-LW-(PS-305D) | Power supply for LED |
| Silicon Power Head | Thorlabs | S121C | For light intensity measurement |
| Power meter | Thorlabs | PM100D | For light intensity measurement |
| Microscope | Leica Biosystems | DMI8 | For live cell imaging |
| BioSafety Cabinet | ThermoFisher | 1300 Series A2 | For mammalian cell handling |
| CO2 incubator | ThermoFisher | Isotemp | For mammalian cell culturing |
| Stereo microscope | Leica | M60 | For embryo micro-manipulation |
| Microinjector | Narishige | IM300 | For embryo microinjection |
| Micropipette puller | Sutter Instruments | P87 | Needle puller |
| in vitro transcription kit | ThermoFisher | AM1340 | For in vitro transcription. The kit includes nuclease-free water, SP6 RNA Polymerase, ribonucleotide mixture, cap analog, lithium choride precipitation solution, and spin column |
| RNA purfication kit | Qiagen | 74104 | Silica-membrane spin column for purification of synthesized RNA |
| Convection oven | MTI corporation | EQ-DHG-9015 | PDMS curing |
| Centrifugal mixer and teflon container | THINKY | AR310 | For mixing PDMS |
| Silicon wafer | UniversityWafer | 452 | Base for making PDMS devices |
| Blade | Techni Edge | 01-801 | For cutting PDMS |
| Capillary glass | Sutter Instruments | BF100-58-10 | For fabrication of injecting needles. |
References
- Schlessinger, J., Ullrich, A. Growth factor signaling by receptor tyrosine kinases. Neuron. 9 (3), 383-391 (1992).
- Thisse, B., Thisse, C. Functions and regulations of fibroblast growth factor signaling during embryonic development. Dev Biol. 287 (2), 390-402 (2005).
- Perrimon, N., Pitsouli, C., Shilo, B. Z. Signaling mechanisms controlling cell fate and embryonic patterning. Cold Spring Harb Perspect Biol. 4 (8), a005975(2012).
- Salles, F. H., et al. Mental disorders, functional impairment, and nerve growth factor. Psychol Res Behav Manag. 10, 9-15 (2017).
- Basson, M. A. Signaling in cell differentiation and morphogenesis. Cold Spring Harb Perspect Biol. 4 (6), (2012).
- Schohl, A., Fagotto, F. beta-catenin, MAPK and Smad signaling during early Xenopus development. Development. 129 (1), 37-52 (2002).
- Zhang, S. W., Li, J. J., Lea, R., Amaya, E., Dorey, K. A Functional Genome-Wide In Vivo Screen Identifies New Regulators of Signalling Pathways during Early Xenopus Embryogenesis. PloS one. 8 (11), e79469(2013).
- Sweeney, C., et al. Growth factor-specific signaling pathway stimulation and gene expression mediated by ErbB receptors. J Biol Chem. 276 (25), 22685-22698 (2001).
- Marshall, C. J. Specificity of receptor tyrosine kinase signaling: transient versus sustained extracellular signal-regulated kinase activation. Cell. 80 (2), 179-185 (1995).
- Vandergeer, P., Hunter, T., Lindberg, R. A. Receptor Protein-Tyrosine Kinases and Their Signal-Transduction Pathways. Annu Rev Cell Biol. 10, 251-337 (1994).
- Lemmon, M. A., Schlessinger, J. Cell signaling by receptor tyrosine kinases. Cell. 141 (7), 1117-1134 (2010).
- Hunter, T. Signaling--2000 and beyond. Cell. 100 (1), 113-127 (2000).
- Qiu, M. S., Green, S. H. PC12 cell neuronal differentiation is associated with prolonged p21ras activity and consequent prolonged ERK activity. Neuron. 9 (4), 705-717 (1992).
- Ji, Y., et al. Acute and gradual increases in BDNF concentration elicit distinct signaling and functions in neurons. Nat Neurosci. 13 (3), 302-309 (2010).
- Luby-Phelps, K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area. Int Rev Cytol. 192, 189-221 (2000).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods-a Companion to Methods in Enzymology. 14 (4), 381-392 (1998).
- Ling, M. M., Robinson, B. H. Approaches to DNA mutagenesis: an overview. Anal Biochem. 254 (2), 157-178 (1997).
- Gama Sosa, M. A., De Gasperi, R., Elder, G. A. Animal transgenesis: an overview. Brain Struct Funct. 214 (2-3), 91-109 (2010).
- Wanka, F., et al. Tet-on, or Tet-off, that is the question: Advanced conditional gene expression in Aspergillus. Fungal Genet Biol. 89, 72-83 (2016).
- Karginov, A. V., Ding, F., Kota, P., Dokholyan, N. V., Hahn, K. M. Engineered allosteric activation of kinases in living cells. Nat Biotechnol. 28 (7), 743-747 (2010).
- Liu, Q. Y., Deiters, A. Optochemical Control of Deoxyoligonucleotide Function via a Nucleobase-Caging Approach. Accounts of Chemical Research. 47 (1), 45-55 (2014).
- Arbely, E., Torres-Kolbus, J., Deiters, A., Chin, J. W. Photocontrol of tyrosine phosphorylation in mammalian cells via genetic encoding of photocaged tyrosine. J Am Chem Soc. 134 (29), 11912-11915 (2012).
- Gautier, A., Deiters, A., Chin, J. W. Light-activated kinases enable temporal dissection of signaling networks in living cells. J Am Chem Soc. 133 (7), 2124-2127 (2011).
- Nguyen, D. P., et al. Genetic Encoding of Photocaged Cysteine Allows Photoactivation of TEV Protease in Live Mammalian Cells. J Am Chem Soc. 136 (6), 2240-2243 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Banghart, M., Borges, K., Isacoff, E., Trauner, D., Kramer, R. H. Light-activated ion channels for remote control of neuronal firing. Nat Neurosci. 7 (12), 1381-1386 (2004).
- Zhang, K., Cui, B. Optogenetic control of intracellular signaling pathways. Trends in Biotechnology. 33 (2), 92-100 (2015).
- Tischer, D., Weiner, O. D. Illuminating cell signalling with optogenetic tools. Nat Rev Mol Cell Bio. 15 (8), 551-558 (2014).
- Kim, B., Lin, M. Z. Optobiology: optical control of biological processes via protein engineering. Biochemical Society Transactions. 41 (5), 1183-1188 (2013).
- Tucker, C. L. Manipulating cellular processes using optical control of protein-protein interactions. Prog Brain Res. 196, 95-117 (2012).
- Toettcher, J. E., Gong, D. Q., Lim, W. A., Weiner, O. D. Light Control of Plasma Membrane Recruitment Using the Phy-Pif System. Method Enzymol. 497, 409-423 (2011).
- Zoltowski, B. D., Gardner, K. H. Tripping the light fantastic: blue-light photoreceptors as examples of environmentally modulated protein-protein interactions. Biochemistry. 50 (1), 4-16 (2011).
- Kennedy, M. J., et al. Rapid blue-light-mediated induction of protein interactions in living cells. Nat Methods. 7 (12), 973-975 (2010).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Liu, H., et al. Photoexcited CRY2 Interacts with CIB1 to Regulate Transcription and Floral Initiation in Arabidopsis. Science. 322 (5907), 1535-1539 (2008).
- Li, X., et al. Arabidopsis cryptochrome 2 (CRY2) functions by the photoactivation mechanism distinct from the tryptophan (trp) triad-dependent photoreduction. Proc Natl Acad Sci U S A. 108 (51), 20844-20849 (2011).
- Leevers, S. J., Paterson, H. F., Marshall, C. J. Requirement for Ras in Raf Activation Is Overcome by Targeting Raf to the Plasma-Membrane. Nature. 369 (6479), 411-414 (1994).
- Kohn, A. D., Takeuchi, F., Roth, R. A. Akt, a pleckstrin homology domain containing kinase, is activated primarily by phosphorylation. J Biol Chem. 271 (36), 21920-21926 (1996).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Sive, H. L., Grainger, R. M., Harland, R. M. Early Development of Xenopus laevis: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2000).
- Kim, J. H., et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PloS one. 6 (4), e18556(2011).
- Ishimura, A., et al. Oncogenic Met receptor induces ectopic structures in Xenopus embryos. Oncogene. 25 (31), 4286-4299 (2006).
- Zhang, K., et al. Light-Mediated Kinetic Control Reveals the Temporal Effect of the Raf/MEK/ERK Pathway in PC12 Cell Neurite Outgrowth. PloS one. 9 (3), e92917(2014).
- Mohanty, S. K., Lakshminarayananan, V. Optical Techniques in Optogenetics. J Mod Opt. 62 (12), 949-970 (2015).
- Taslimi, A., et al. Optimized second-generation CRY2-CIB dimerizers and photoactivatable Cre recombinase. Nature chemical biology. 12 (6), 425-430 (2016).
- Kawano, F., Suzuki, H., Furuya, A., Sato, M. Engineered pairs of distinct photoswitches for optogenetic control of cellular proteins. Nat Commun. 6, 6256(2015).
- Wang, H., et al. LOVTRAP: an optogenetic system for photoinduced protein dissociation. Nat Methods. 13 (9), 755-758 (2016).
- Chang, K. Y., et al. Light-inducible receptor tyrosine kinases that regulate neurotrophin signalling. Nat Commun. 5, 4057(2014).
- Boulina, M., Samarajeewa, H., Baker, J. D., Kim, M. D., Chiba, A. Live imaging of multicolor-labeled cells in Drosophila. Development. 140 (7), 1605-1613 (2013).
- Liu, H., Gomez, G., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738(2012).
- Buckley, C. E., et al. Reversible Optogenetic Control of Subcellular Protein Localization in a Live Vertebrate Embryo. Dev Cell. 36 (1), 117-126 (2016).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature chemical biology. 10 (3), 196-202 (2014).
- Beyer, H. M., et al. Red Light-Regulated Reversible Nuclear Localization of Proteins in Mammalian Cells and Zebrafish. ACS Synth Biol. 4 (9), 951-958 (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved