Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Светосвязная реверсивная модуляция митоген-активированного пути протеинкиназы при дифференцировке клеток и
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает оптигетную стратегию модуляции активности митоген-активированной протеинкиназы (MAPK) во время клеточной дифференцировки и эмбрионального развития Xenopus . Этот метод позволяет обратимую активацию сигнального пути MAPK в культуре клеток млекопитающих и в многоклеточных живых организмах, таких как эмбрионы Xenopus , с высоким пространственным и временным разрешением.
Аннотация
Киназная активность имеет решающее значение для множества клеточных функций, включая пролиферацию клеток, дифференцировку, миграцию и апоптоз. Во время раннего эмбрионального развития киназная активность очень динамична и широко распространена у эмбрионов. Фармакологические и генетические подходы обычно используются для исследования киназной активности. К сожалению, с помощью этих стратегий сложно достичь превосходного пространственного и временного разрешения. Кроме того, невозможно контролировать активность киназы обратимым образом в живых клетках и многоклеточных организмах. Такое ограничение остается узким местом для достижения количественного понимания активности киназы во время развития и дифференциации. В этой работе представлена оптогенетическая стратегия, в которой используется бицистронная система, содержащая фотоактивируемые белки Arabidopsis thaliana cryptochrome 2 (CRY2) и N-концевой домен взаимодействующей с криптохром базовой спиральной спиральной спирали (CIBN). Реверси(MAPK) сигнальный путь достигается через посредство световой опосредованной транслокации белка в живых клетках. Такой подход может быть применен к культурам клеток млекопитающих и эмбрионам живых позвоночных. Эта бицистронная система может быть обобщена для контроля активности других киназ с аналогичными механизмами активации и может быть применена к другим модельным системам.
Введение
Факторы роста участвуют в широком спектре клеточных функций, включая пролиферацию, дифференцировку, миграцию и апоптоз, играют ключевую роль во многих биологических событиях, включая эмбриональное развитие, старение и регуляцию психического статуса 1 , 2 , 3 , 4 , 5 . Многие факторы роста сигнализируют через сложные внутриклеточные сигнальные каскады. Эти сигнальные события часто управляются обратимым фосфорилированием белка точно регулируемым способом 6 , 7 . Таким образом, понимание сигнальных исходов протеинкиназ, ответственных за фосфорилирование белка, принципиально важно.
Различные факторы роста действуют через довольно распространенную внутриклеточную сигнальную сеть, хотя они стимулируют distInct сотовые ответы 8 , 9 . Обычные внутриклеточные медиаторы рецепторных тирозинкиназ включают Ras, Raf, внеклеточную сигнально-регулируемую киназу (ERK), митоген-активированную протеинкиназу (MAPK) / ERK-киназу (MEK), фосфоинозитид-3-киназу (PI3K), Akt и фосфолипазу C гамма (PLCγ) 10 , 11 . Накопление данных свидетельствует о том, что различение сигналов и их специфичность зависят от пространственного и временного регулирования сигнальной активности 12 . Например, в клетках феохромоцитомы крысы (PC12) стимуляция эпидермального фактора роста (EGF), которая приводит к пролиферации клеток, временно активирует путь ERK 9 . С другой стороны, стимуляция фактором роста нервов (NGF), который приводит к дифференциации клеток, активирует ERK-путь устойчивым образом 9 , 13 . В культуре rУ нейронов гиппокампа переходная сигнализация с помощью нейротрофического фактора мозга (BDNF) способствует первичному вырождению нейритов, в то время как устойчивая сигнализация приводит к увеличению разветвления нейритов 14 . Во время раннего эмбрионального развития фосфорилированная активность ERK является временной динамикой и широко распространена у эмбриона 6 . Недавний генетический экран во время раннего эмбриогенеза Xenopus показал, что каскады сигнализации ERK и Akt, два пучка первичных факторов роста ниже по течению, отображают специфические профили активации 7 . Таким образом, понимание результатов передачи киназы требует инструментов, которые могут определять пространственные и временные особенности киназной активности с достаточным разрешением.
Обычные экспериментальные подходы к исследованию динамического характера передачи сигнала во время развития не имеют желаемого пространственного и временного разрешения. Например, в фармакологических подходах используется небольшая химияИли биологические молекулы для стимуляции или подавления трансдукции сигнала в клетках и тканях. Диффузионный характер этих малых молекул затрудняет ограничение их действия на конкретный интересующий регион 15 . Генетические подходы ( например, трансгенезис, система Cre-Lox или мутагенез) часто приводят к необратимой активации или подавлению экспрессии гена-мишени или активности белка 16 , 17 , 18 . Система 19 Tet-On / Tet-Off предлагает улучшенный временный контроль транскрипции генов, но не имеет строгого пространственного контроля, поскольку она основана на диффузии тетрациклина. Недавние разработки в области химически индуцированной димеризации белка 20 или фотосъемки 21 , 22 , 23 , 24 значительно усиливаютВременного управления сигнальными сетями. Однако пространственный контроль остается сложным из-за диффузионного характера химикатов в клетке.
Недавние новые оптикогенные подходы, которые используют силу света для контроля белково-белковых взаимодействий, позволяют модулировать сигнальные пути с высокой пространственно-временной точностью, а также обратимостью. Вскоре после его первоначального успеха в борьбе с нейрональным обжигом 25 , 26 , 27 была расширена оптогенетика для контроля других клеточных процессов, таких как транскрипция генов, трансляция, миграция клеток, дифференцировка и апоптоз 28 , 29 , 30 , 31 , 32 , 33 , 34 . Стратегия, использующая pНедавно была разработана реакционноспособная гетероактивирующая белковая пара Arabidopsis thaliana cryptochrome 2 (CRY2) и N-концевой домен взаимодействующей с криптохром базовой спиральной спиральной спирали (CIBN) для управления активностью Raf1-киназы в клетках млекопитающих и эмбрионах Xenopus 35 . CRY2 связывается с CIBN при стимуляции синим светом, а белковый комплекс CRY2 / CIBN спонтанно диссоциирует в темноте 34 . Синий свет возбуждает кофактор CRY2, флавин адениндинуклеотид (FAD), что приводит к конформационному изменению CRY2 и его последующему связыванию с CIBN. Устойчивые активные (W374A) и флавин-дефицитные (D387A) мутанты CRY2 могут быть получены посредством мутаций в FAD-связывающем кармане: мутант CRY2 W374A связывается с CIBN независимо от света, тогда как CRY2 D387A- мутант не связывается с CIBN под синим Стимуляция света 36 , 37 . Оптогенетическая система, описанная iВ этом протоколе используются CRY2 дикого типа и CIBN для индуцирования транслокации, опосредованной транслокацией активации Raf1 в живых клетках. Известно, что мембранный набор Raf1 усиливает его активность 38 . В этой системе тандемный модуль CIBN привязан к плазматической мембране, а CRY2-mCherry слит с N-концом Raf1 35 . В отсутствие синего света CRY2-mCherry-Raf1 остается в цитоплазме, а Raf1 неактивен. Синяя стимуляция индуцирует связывание CRY2-CIBN и рекрутирует Raf1 в плазматическую мембрану, где активируется Raf1. Активация Raf стимулирует каскад сигнализации Raf / MEK / ERK. Оба белка CRY2- и CIBN-гибрида кодируются в бицистронной генетической системе. Эта стратегия может быть обобщена для контроля других киназ, таких как Akt, состояние активации которых также может быть включено путем транслокации белка в клетках 39 . В этой работе представлены подробные протоколы для реализации этой оптигенетической стратегии в культуре клеток млекопитающихRes и многоклеточных организмов.
протокол
Исследования животных проводились в соответствии с руководящими принципами, установленными Институтом по уходу и использованию животных в Иллинойсе (IACUC) и Департаментом животноводства Университета штата Иллинойс (DAR).
1. Оптогенетическая индукция локализации белка в культуре клеток млекопитающих BHK21
ПРИМЕЧАНИЕ. Шаги 1.1-1.3 обеспечивают способ сборки камеры для культивирования клеток для изображений с объектами с высоким увеличением ( например, 63X или 100X), которые обычно имеют короткие рабочие расстояния. Эти цели требуют тонкого покровного стекла ( например, # 1,5, толщина 170 мкм) в качестве подложки для формирования изображения. В качестве альтернативы можно использовать блюдо / слайд для культивирования клеток со стеклянным основанием. В этом случае шаги 1.1-1.3 могут быть пропущены.
- Покровные стекла для посуды
- Поместите 30 стеклянных покровных в держатель для покровного стекла.
- В пластиковый стакан емкостью 600 мл добавьте 20 г моющего средства и 400 мл теплой водопроводной воды. ПлацВ стакан на магнитной мешалке и перемешать до полного растворения моющего средства. Удалите пенопласт с помощью салфетки.
- Используйте нижнюю часть чашки Петри 100 мм х 15 мм в качестве проставки из мешалки и в качестве поверхности для держателя покровного стекла. Чтобы поддерживать адекватный поток во время процесса очистки, сделайте 3-4 отверстия для слива в чашке Петри.
- Чтобы сделать отверстия для слива, нагреть паяльник и прожечь пластик в вентилируемом вытяжном шкафу.
ПРЕДОСТЕРЕЖЕНИЕ: Не касайтесь горячего паяльника голыми руками. - Поместите держатель покровного стекла на чашку Петри в стакан. Перемешать в течение 2 часов до ночи при комнатной температуре.
- Промыть три раза 500 мл DI воды в 1000 мл стакане. Моющее средство можно повторно использовать.
- Возьмите отдельные покровные стекла с помощью щипцов. Погрузите покровные стекла в 190-образный (95%) этанол в течение 1 мин.
- Высушите покровные стекла внутри стерильного капюшона. Храните покровные стекла в стерильном пластиковом контейнере до использования.
- Изготовление покрытий из поли-L-лизина (PLL)
- Сделайте 0,1 М боратный буфер, растворяя 1,24 г борной кислоты и 1,9 г тетранабората натрия в 400 мл воды. Отрегулируйте pH до 8,5 с помощью 10 М NaOH.
- Растворить PLL в боратном буфере до конечной концентрации 1 мг / мл. Аликвот раствора PLL в 50 мл стерильных центрифужных пробирках.
- Добавить 50 мл раствора для покрытия PLL в 10-сантиметровую чашку для культивирования ткани. Поместите блюдо в инкубатор на 37 ° C, чтобы разогреть раствор PLL.
- Откройте контейнер для покровного стекла (шаг 1.1.8) в стерильном колпаке.
- Погружайте покровные покровные по одному в предварительно подогретый PLL-раствор в чашку для культивирования тканей. Избегайте образования пузырьков, чтобы погружать все поверхности.
- Поместите блюдо с покровным стеклом в инкубаторе CO 2 на 37 ° C в течение ночи. Выньте покровное и поместите его в стерильный держатель для покровного стекла. Промывайте три раза автоклавированной сверхчистой водой (18,2 MΩ & #183 см) в 1000 мл стакане в стерильном капюшоне.
- Высушите покровные стекла в держателе покровного стекла в стерильном колпаке. Храните покровные стекла в стерильном пластиковом контейнере до использования.
- Сборка камер культивирования клеток полидиметилсилоксана (PDMS)
- В пластиковом контейнере весить 40 г основы PDMS и добавить 4 г отвердителя для достижения 10: 1 вес. / Вес. Отношения PDMS и отвердителя. Смешайте PDMS / отверждающий агент, помешивая кончиком пипетки в течение 2 мин. Альтернативно, используйте центробежный смеситель.
- Используйте стакан с диаметром 4 дюйма в качестве шаблона для изготовления держателя с алюминиевой фольгой. Поместите держатель алюминиевой фольги в чашку Петри 15 см. Поместите кремниевую пластину размером 4 дюйма внутри держателя алюминиевой фольги.
- Вылейте смешанный раствор PDMS в держатель. Используйте тонкий стеклянный стержень, чтобы осторожно прикоснуться к краю пластины. Удалите все пузырьки воздуха, захваченные под пластиной.
- Вставьте 15-сантиметровую чашку Петри в вакуумную камеруR для дегазации решения PDMS. Продолжайте дегазацию в течение примерно 20 минут, пока не образуются пузырьки. Тем временем предварительно разогрейте конвекционную печь до 65 ° C.
- Осторожно положите чашку Петри 15 см в духовку. Инкубируйте в течение 2 часов.
- Извлеките пластину из духовки. Используйте стеклянный стержень, чтобы осторожно прикоснуться к краю PDMS и обеспечить полное сшивание. Если нет, инкубируйте дольше, пока PDMS не станет твердым и нелипким.
- Снимите алюминиевую фольгу с пластины и очистите ее от кремниевой пластины. Начиная с края, тщательно очистите отвержденный PDMS от кремниевой пластины.
ПРЕДУПРЕЖДЕНИЕ. Избегайте применения слишком большого усилия, так как оно может сломать пластину. - Обрежьте PDMS на прямоугольные части размером 20 мм x 30 мм, чтобы поместить 24 мм x 40 мм покровное стекло с помощью бритвенного лезвия.
- Используйте лезвие в форме долота, чтобы разрезать прямоугольное отверстие размером 10 мм x 20 мм от центра каждой части PDMS.
- Очистите камеры PDMS, используя протокол моющего средства, описанный в шаге 1.1.
- Высушите камеры PDMS в чистом капоте. Поместите сухие камеры в автоклавируемый контейнер, покрытый алюминиевой фольгой.
- Автоклавируйте контейнер с использованием силы тяжести (121 ° C, 15 фунтов на квадратный дюйм) в течение 30 минут и храните контейнер при комнатной температуре.
- BHK21 клеточное культивирование и трансфекция
- Получают 500 мл среды для культивирования клеток BHK21 путем смешивания 445 мл DMEM с 50 мл FBS и 5 мл 100 × Penn-Strep-Glutamine (10000 U / мл пенициллина, 10 мг / мл стрептомицина и 29,2 мг / мл L -glutamine). Убедитесь, что конечная концентрация FBS составляет 10%.
- Аликвоту 10 мл не-HEPES CO 2 -независимой среды для визуализации живых клеток.
ПРИМЕЧАНИЕ: CO 2 -независимая среда поддерживает рост клеток без инкубатора CO 2 и идеально подходит для визуализации клеток в атмосферных условиях. Подробную информацию см. В списке материалов. В дополнение к клеточной линии BHK21, другие типы клеток млекопитающих также должны даватьАналогичные результаты. - Соберите устройство для культивирования клеток, поместив одну стерильную стерильную камеру PDMS (этап 1.3) на стерильное покровное покрытие с покрытием с PLL (шаг 1.2) в стерильном капюшоне.
- Поместите каждое устройство в стерильную чашку Петри 60 мм.
- Используйте 0,5 мл 0,25% трипсина для отделения клеток от одной лунки 12-луночного планшета для культуры тканей. Подсчитайте плотность клеток гемоцитометром. Пластина 20 000 клеток BHK21 в камере (около 10000 клеток / см 2 ) с 200 мкл клеточной культуральной среды.
- Подготовьте ДНК-плазмиду с помощью набора для приготовления плазмид (см. Список материалов).
ПРИМЕЧАНИЕ. Конструкция и функциональность CRY2-mCherry-Raf1-2A-2CIBN-GFP-CaaX показаны на рисунке 1A - 1B . - Двадцать четыре (24) ч после клеточного покрытия трансфицируют клетки 50-100 нг плазмиды CRY2-mCherry-Raf1-2A-2CIBN-GFP-CaaX в соответствии с протоколом производителя.
- Через три (3) часа после трансфекции измените mEdium до 200 мкл свежей культуральной среды (этап 1.4.1) и позволяют клеткам восстанавливаться в течение ночи путем инкубации культуры в 37 ° C, 5% CO 2 -инкубаторе.
- Флуоресцентная визуализация живых клеток
- Включите компьютер, источник света, микроскоп и камеру. Для остальной части протокола используйте конфокальный флуоресцентный микроскоп (оснащенный объективом для герметизации 100X).
ПРИМЕЧАНИЕ. Также может использоваться инвертированный эпифлуоресцентный микроскоп. - Замените среду для культивирования клеток 200 мкл независимой от CO 2 среды.
- Настройте протокол сбора данных, прежде чем размещать ячейки на микроскопе. Используйте 488-нм возбуждающий канал FITC для оптико-электронной стимуляции. Используйте 561 нм возбуждающий канал TRITC, чтобы найти трансфицированные клетки и отслеживать клеточную локализацию меченного мерином белка.
- Установите коэффициент усиления каналов FITC и TRITC как 120 и 200 соответственно. Использовать время размещения пикселя 2,21; s и размер 512 x 512 пикселей.
- Измерьте мощность света 488 нм, поставив измеритель мощности близко к объективному окну. Суммарная мощность 2 мкВт (около 10000 Вт / см 2 в фокусе) достаточна для индуцирования ассоциации CIBN-CRY2PHR.
- Настройте получение метки времени с интервалом 5 с и общим временем сбора 2 мин.
- Приложите соответствующий подходящий материал (иммерсионное масло) к объективному окну. Используйте режим фазового контраста, чтобы сфокусироваться на ячейках на поверхности покровного стекла.
- Найдите трансфицированную клетку под светом 561 нм, перемещая ступень микроскопа.
ПРЕДУПРЕЖДЕНИЕ. Избегайте использования синего света во время этого шага, так как он активирует связь между фотоактивируемыми белками. - Как только трансфицированная клетка находится, инициируйте сбор данных.
ПРИМЕЧАНИЕ. Успешно трансфицированные клетки должны показывать флуоресценцию как в каналах FITC (из каналов 2CIBN-GFP-CaaX), так и TRITC (из CRY2-mCherry-Raf1) ( рисунок 1C-D ). - Запишите серию изображений с отметкой времени в каналах FITC и TRITC ( рисунок 1D ).
- Чтобы исследовать спонтанную диссоциацию белкового комплекса CRY2-CIBN, запишите еще одну метку времени с каналом Txred в течение 20 минут с интервалом 30 с.
- Сохраните изображение с отметкой времени для анализа данных.
- Включите компьютер, источник света, микроскоп и камеру. Для остальной части протокола используйте конфокальный флуоресцентный микроскоп (оснащенный объективом для герметизации 100X).
- Анализ изображений
- Откройте изображения с помощью программного обеспечения для анализа изображений, которое может извлечь интенсивность из изображения 40 .
- Выберите два репрезентативных моментальных снимка: один до экспозиции синего света и другую экспозицию после синего света.
- Нарисуйте линию через ячейку, охватывающую фон, плазматическую мембрану и цитоплазму. Проецируйте интенсивность вдоль этой линии. Сохраните значения и постройте их, чтобы сравнить разницу до и после экспозиции ( рисунок 1D ).
- Чтобы проанализировать кинетику ассоциации белка, selecТ. Е. Одна представляющая область интереса (ROI) в плазматической мембране, один ROI в цитоплазме и один ROI в фоновом режиме.
- Приобретите средние интенсивности плазматической мембраны (I PM ), цитоплазмы (I CYT ) и фона (I BKD ) для стека изображений.
- Рассчитайте соотношение интенсивности мембраны / цитозолей для каждого изображения, используя следующее уравнение:
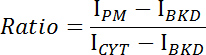
- Определите отношение по времени и определите кинетику связывания или диссоциации CRY2-CIBN ( рисунок 1E- F ).
2. Конструкция светодиодного массива для долговременной стимуляции света в инкубаторе CO 2
ПРИМЕЧАНИЕ. Общая схема экспериментальной установки показана на рисунке 2A .
- Сделайте светодиодную матрицу, вставив 12 синих светодиодов в два бункераDs и подключения токоограничивающих резисторов.
ПРИМЕЧАНИЕ. При питании от 30 В можно подключить четыре светодиода последовательно, а их яркость можно контролировать с помощью токоограничивающего резистора. - Поместите макеты в алюминиевую коробку.
ПРИМЕЧАНИЕ. Высота алюминиевой коробки должна составлять 2 дюйма. Эта высота оптимальна для освещения 12-луночного планшета для культуры тканей, поскольку размер расходящегося светового пятна такой же, как и у одной лунки. - Для подключения к источнику питания используйте два металлических провода. Убедитесь, что длина провода достаточна, когда световая коробка находится внутри инкубатора CO 2 .
- Используйте прозрачный рассеиватель света в качестве крышки световой коробки ( рис. 2C ).
- Откалибруйте выходную мощность каждого светодиода в диапазоне входных напряжений. Используйте для использования в течение 24 часов анализа дифференцировки клеток PC12 мощностью 0,2 мВт / см 2 . Используйте энергию 5 мВт / см 2 для живых эмбрионов Xenopus или эксплантованализы.
3. Оптогенетическая индукция дифференцировки клеток PC12
- Культивирование и трансфекция клеток
- Получают 500 мл среды для культуры клеток крысы феохромоцитомы (PC12) путем смешивания 407,5 мл F12K с 75 мл сыворотки лошади + 12,5 мл FBS + 5 мл 100 × Penn-Strep-глутамина (конечные концентрации лошадиной сыворотки и FBS : 15% и 2,5% соответственно). Сделайте низкосернистую среду, смешав 1 объем полной среды в 99 объемах среды F12K.
- Plate PC12 в 12-луночном планшете с плотностью 300000 клеток / лунку или 75000 клеток / см 2 .
- Трансформируют клетки CRY2-mCherry-Raf1-2A-2CIBN-GFP-CaaX через 24 часа после клеточного покрытия (аналогично шагу 1.4.7). Используйте 1,2 мкг ДНК для каждой лунки. Позвольте клеткам восстанавливаться в течение ночи в культуральной среде в инкубаторе с температурой 37 ° С, дополненном 5% СО 2 . Проверьте эффективность трансфекции через 16 ч после трансфекции.
ПРИМЕЧАНИЕ. Трансфекция 30-50% effНеобходимо достичь достаточности для обеспечения достаточного количества клеток. - Измените среду на низкосернистую среду через 24 часа после трансфекции. Используйте 1 мл среды на лунку 12-луночного планшета.
- Светоиндуцированная дифференциация клеток PC12
- Поместите светодиодную матрицу в инкубатор CO 2 . Подключите его к источнику питания с помощью пары проводов. Установите мощность светодиода на 0,2 мВт / см 2 . Поместите 12-луночный планшет, содержащий трансфицированные клетки PC12 (шаг 3.1.3) в окне светодиодной матрицы. Применяйте непрерывную световую подсветку в течение 24 часов в инкубаторе с температурой 37 ° C с добавлением 5% CO 2 .
- Флуоресцентная визуализация живых клеток
- Выполните шаги 1.5.1-1.5.4 для микроскопа и подготовки образца.
- Настройте сбор данных с одним снимком. Используйте 200 мс для канала GFP и Txred.
- Захват изображений трансфицированных ячеек как в каналах GFP, так и в Txred. Запишите примерно 200 чел.Ls для каждого условия. Сохраните файлы для анализа данных.
- Анализ изображений
- Подсчитайте процент дифференцированных клеток по общему количеству трансфицированных клеток.
- Для подсчета ячеек используйте любой модуль подсчета ячеек в программном обеспечении для анализа изображений.
- Вручную рассчитывайте дифференцированные ячейки.
ПРИМЕЧАНИЕ. Дифференцированные клетки определяются как те, в которых по меньшей мере один нейрит заметно длиннее тела клетки ( рисунок 3А- 3В ). - Повторите шаг 3.4.3 с недифференцированными клетками.
- Рассчитайте коэффициент дифференциации, используя следующее уравнение:
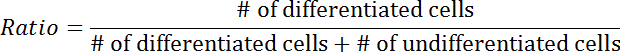
4. Оптогенетический контроль активности киназы в эмбрионах Xenopus
- Подготовка буферов
- Подготовьте 1 L модифицированного рингера 1x Marc (MMR): 100 мМNaCl, 2 мМ KCl, 1 мМ MgCl 2 , 2 мМ CaCl 2 и 5 мМ HEPES; PH 7,5.
- Получение мРНК
- Дайте плазмидную ДНК CRY2-mCherry-Raf1-2A-2CIBN-GFP-CaaX (2 мкг) с 1 мкл ApaI (50 единиц) при 37 ° C в течение 2 часов.
- Осаждающая линеаризованная ДНК в 60 мкл 100% этанола. Спин при 12000 × g в течение 5 мин при комнатной температуре для осаждения ДНК. Осторожно удалить супернатант и снова промыть осадок 60 мкл 70% этанола. Спин при 12000 × g в течение еще 5 мин при комнатной температуре. Тщательно удалите супернатант и ресуспендируйте ДНК-таблетку в 6 мкл ННК, свободной от РНКазы.
- Осуществлять транскрипцию in vitro путем инкубации 1 мкг линеаризованной ДНК с 2 мкл поставленной РНК-полимеразы SP6, рибонуклеотидной смеси (10 мМ АТФ, CTP и UTP, 2 мМ GTP и 8 мМ-аналогов колпачка) и 20 мкл нуклеазо- Свободной воды при комнатной температуре в течение 1 часа.
- Удалить DNA путем расщепления ДНКазой I при 37 ° C в течение по меньшей мере 15 минут и очистки синтезированной РНК с использованием спиновой колонки из кремнеземной мембраны.
- Остановите реакцию и осадите РНК, добавив 30 мкл свободной от нуклеазы воды и 30 мкл осаждающего раствора LiCl. Тщательно перемешать и охладить в течение 30 мин при -20 ° C.
- Центрифуга при 4 ° С в течение 15 мин при 12000 × g для осаждения РНК.
- Осторожно удалите супернатант. Промывают РНК один раз 1 мл 70% этанола и ресуспендируют в 40 мкл воды, свободной от нуклеазы.
- Загрузите 40 мкл РНК в спиновой колонке. Центрифуга при 4 ° С в течение 1 мин при 12000 × g для удаления неинкорпорированных нуклеотидов и колпачков.
- Урожай эмбрионов Xenopus
- Следуйте протоколу, описанному Sive et al. 41 для получения эмбрионов Xenopus .
- Микроинъекция мРНК
- фабриковатьИглы для микроинъекции, вытягивая стеклянные капилляры с помощью капиллярного съемника. Установите программу вытягивания на: heat = 355, сила тяги = 80, скорость = 50 и время = 100.
- Удалите желеобразное покрытие из эмбрионов, обработав их 3% цистеином (разбавленным в 0,2 раза MMR).
- Перенесите эмбрионы на 3% полисухарозу и 0,5x MMR раствор для микроинъекции. Внесите 500 мкг в 1 нг CRY2-mCherry-Raf1-2A-2CIBN-GFP-CaaX РНК в каждый эмбрион.
ПРИМЕЧАНИЕ. Инъекция дозы выше 1 нг приводит к синей не зависящей от света активации сигнализации MAPK.
- Оптогенетическая стимуляция киназной активности
- Культурные микроинъективные эмбрионы в 3% полисухарозе, 0,5х MMR раствор при комнатной температуре до тех пор, пока они не достигнут стадии средней гаструлы (этап 12). Затем культивируйте эмбрионы в растворе 0,2x MMR.
- Перенесите эмбрионы или экспланты в 12-луночный планшет. Поместите 12-луночный планшет на встроенную светодиодную матрицу (шаг 2.5) для синего цветаT (475 нм).
- Поместите зеркало на верхнюю часть 12-луночного планшета, чтобы обеспечить полное синее освещение эмбрионов или эксплантов.
- Настройте мощность синего света на 5 мВт / см 2 .
ПРИМЕЧАНИЕ. Обработка синим светом может быть выполнена в любой желаемый момент времени либо в 3% полисахарозе, 0,5х MMR-растворе, либо в 0,2 раза MMR-растворе. - Урожай эмбрионов в любое нужное время. Используйте их для анализа гистологических, Вестерн-блоттингов или генов.
Результаты
Ратиометрическая экспрессия фотоактивируемых белковых пар: на фиг. 1А показана конструкция бицистронной оптикогенной конструкции CRY2-mCherry-Raf1-P2A-CIBN-CIBN-GFP-CaaX (называемая CRY2-2A-2CIBN) на основе свиного тешовирума- 1 2A (P2A), который показывает самую высокую эффект?...
Обсуждение
При построении световой коробки необходимо измерить мощность отдельных светодиодов. Основываясь на предыдущем опыте, выходная мощность может варьироваться между отдельными светодиодами из-за разницы в производстве. Выберите набор светодиодов, которые имеют выходную мощность в пред...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Университетом штата Иллинойс в Урбане-Шампейн (UIUC) и Национальными институтами здравоохранения (NIGMS R01GM111816).
Материалы
| Name | Company | Catalog Number | Comments |
| Glass coverslip | VWR | 48393 230 | Substrate for live cell imaging |
| Coverslip holder | Newcomer Supply | 6817B | Holder for coverslips |
| Detergent | ThermoFisher | 16 000 104 | For cleaning coverslips |
| Boric acid | Sigma-Aldrich | B6768-500G | For making PLL buffer |
| Disodium tetraborate | Sigma-Aldrich | 71996-250G | For making PLL buffer |
| Plastic beaker | Nalgene | 1201-1000 | For cleaning coverslips |
| Sodium hydroxide | Sigma-Aldrich | 221465-2.5KG | For adjust pH |
| Poly-L-lysine hydrobromide | Sigma-Aldrich | P1274-500MG | For coating coverslip |
| Diethylpyrocarbonate (DEPC)-Treated Water | ThermoFisher Scientific | 750024 | For DNA preparation |
| Cover Glass Forceps | Ted Pella | 5645 | Cover glass handling |
| Tissue cutlure dish | Thermofisher | 12565321 | Cell culture dish |
| Sterile centrifuge tubes | ThermoFisher | 12-565-271 | Buffer storage |
| Transfection Reagent | ThermoFisher | R0534 | Transfection |
| CO2-independent medium | ThermoFisher | 18045088 | For live cell imaging |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Form make cell chamber |
| Plasmid Maxiprep kit | Qiagen | 12965 | Plasmid preparation |
| DMEM medium | ThermoFisher | 11965-084 | Cell culturing medium component |
| F12K medium | ThermoFisher | 21127022 | Cell culturing medium component |
| Horse serum | ThermoFisher | 16050122 | Cell culturing medium component |
| Fetal Bovine Serum | Signa-Aldrich | 12303C-500 mL | Cell culturing medium component |
| Penicillin-Streptomycin-Glutamine | ThermoFisher | 10378016 | Cell culturing medium component |
| Trypsin (0.25%), phenol red | ThermoFisher Scientific | 15050065 | For mammalian cell dissociation |
| Agarose | Fisher Scientific | BP1356-100 | For DNA preparation |
| Ficoll PM400 | GE Heathcare Life Sciences | 17-5442-02 | For embryo buffer |
| L-Cysteine hydrochloride monohydrate | Sigma-Aldrich | 1.02839.0025 | Oocyte preparation |
| ApaI | ThermoFisher | FD1414 | For linearization of plasmids |
| Dnase I | ThermoFisher | AM2222 | For removing DNA template in the in vitro transcription assay |
| Index-match materials (immersion oil) | Thorlabs | MOIL-20LN | For matching the index between sample substrate and objective |
| Blue LED | Adafruit | 301 | Light source for optogenetic stimulation |
| Resistor kit | Amazon | EPC-103 | current-limiting resistor |
| Aluminum boxes | BUD Industries | AC-401 | light box |
| BreadBoard | Jekewin | 837654333686 | For making LED array |
| Hook up Wire | Electronix Express | 27WK22SLD25 | For making LED array |
| Relay Module | Jbtek | SRD-05VDC-SL-C | For intermittent light control |
| DC Power Supply | TMS | DCPowerSupply-LW-(PS-305D) | Power supply for LED |
| Silicon Power Head | Thorlabs | S121C | For light intensity measurement |
| Power meter | Thorlabs | PM100D | For light intensity measurement |
| Microscope | Leica Biosystems | DMI8 | For live cell imaging |
| BioSafety Cabinet | ThermoFisher | 1300 Series A2 | For mammalian cell handling |
| CO2 incubator | ThermoFisher | Isotemp | For mammalian cell culturing |
| Stereo microscope | Leica | M60 | For embryo micro-manipulation |
| Microinjector | Narishige | IM300 | For embryo microinjection |
| Micropipette puller | Sutter Instruments | P87 | Needle puller |
| in vitro transcription kit | ThermoFisher | AM1340 | For in vitro transcription. The kit includes nuclease-free water, SP6 RNA Polymerase, ribonucleotide mixture, cap analog, lithium choride precipitation solution, and spin column |
| RNA purfication kit | Qiagen | 74104 | Silica-membrane spin column for purification of synthesized RNA |
| Convection oven | MTI corporation | EQ-DHG-9015 | PDMS curing |
| Centrifugal mixer and teflon container | THINKY | AR310 | For mixing PDMS |
| Silicon wafer | UniversityWafer | 452 | Base for making PDMS devices |
| Blade | Techni Edge | 01-801 | For cutting PDMS |
| Capillary glass | Sutter Instruments | BF100-58-10 | For fabrication of injecting needles. |
Ссылки
- Schlessinger, J., Ullrich, A. Growth factor signaling by receptor tyrosine kinases. Neuron. 9 (3), 383-391 (1992).
- Thisse, B., Thisse, C. Functions and regulations of fibroblast growth factor signaling during embryonic development. Dev Biol. 287 (2), 390-402 (2005).
- Perrimon, N., Pitsouli, C., Shilo, B. Z. Signaling mechanisms controlling cell fate and embryonic patterning. Cold Spring Harb Perspect Biol. 4 (8), a005975 (2012).
- Salles, F. H., et al. Mental disorders, functional impairment, and nerve growth factor. Psychol Res Behav Manag. 10, 9-15 (2017).
- Basson, M. A. Signaling in cell differentiation and morphogenesis. Cold Spring Harb Perspect Biol. 4 (6), (2012).
- Schohl, A., Fagotto, F. beta-catenin, MAPK and Smad signaling during early Xenopus development. Development. 129 (1), 37-52 (2002).
- Zhang, S. W., Li, J. J., Lea, R., Amaya, E., Dorey, K. A Functional Genome-Wide In Vivo Screen Identifies New Regulators of Signalling Pathways during Early Xenopus Embryogenesis. PloS one. 8 (11), e79469 (2013).
- Sweeney, C., et al. Growth factor-specific signaling pathway stimulation and gene expression mediated by ErbB receptors. J Biol Chem. 276 (25), 22685-22698 (2001).
- Marshall, C. J. Specificity of receptor tyrosine kinase signaling: transient versus sustained extracellular signal-regulated kinase activation. Cell. 80 (2), 179-185 (1995).
- Vandergeer, P., Hunter, T., Lindberg, R. A. Receptor Protein-Tyrosine Kinases and Their Signal-Transduction Pathways. Annu Rev Cell Biol. 10, 251-337 (1994).
- Lemmon, M. A., Schlessinger, J. Cell signaling by receptor tyrosine kinases. Cell. 141 (7), 1117-1134 (2010).
- Hunter, T. Signaling--2000 and beyond. Cell. 100 (1), 113-127 (2000).
- Qiu, M. S., Green, S. H. PC12 cell neuronal differentiation is associated with prolonged p21ras activity and consequent prolonged ERK activity. Neuron. 9 (4), 705-717 (1992).
- Ji, Y., et al. Acute and gradual increases in BDNF concentration elicit distinct signaling and functions in neurons. Nat Neurosci. 13 (3), 302-309 (2010).
- Luby-Phelps, K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area. Int Rev Cytol. 192, 189-221 (2000).
- Sauer, B. Inducible gene targeting in mice using the Cre/lox system. Methods-a Companion to Methods in Enzymology. 14 (4), 381-392 (1998).
- Ling, M. M., Robinson, B. H. Approaches to DNA mutagenesis: an overview. Anal Biochem. 254 (2), 157-178 (1997).
- Gama Sosa, M. A., De Gasperi, R., Elder, G. A. Animal transgenesis: an overview. Brain Struct Funct. 214 (2-3), 91-109 (2010).
- Wanka, F., et al. Tet-on, or Tet-off, that is the question: Advanced conditional gene expression in Aspergillus. Fungal Genet Biol. 89, 72-83 (2016).
- Karginov, A. V., Ding, F., Kota, P., Dokholyan, N. V., Hahn, K. M. Engineered allosteric activation of kinases in living cells. Nat Biotechnol. 28 (7), 743-747 (2010).
- Liu, Q. Y., Deiters, A. Optochemical Control of Deoxyoligonucleotide Function via a Nucleobase-Caging Approach. Accounts of Chemical Research. 47 (1), 45-55 (2014).
- Arbely, E., Torres-Kolbus, J., Deiters, A., Chin, J. W. Photocontrol of tyrosine phosphorylation in mammalian cells via genetic encoding of photocaged tyrosine. J Am Chem Soc. 134 (29), 11912-11915 (2012).
- Gautier, A., Deiters, A., Chin, J. W. Light-activated kinases enable temporal dissection of signaling networks in living cells. J Am Chem Soc. 133 (7), 2124-2127 (2011).
- Nguyen, D. P., et al. Genetic Encoding of Photocaged Cysteine Allows Photoactivation of TEV Protease in Live Mammalian Cells. J Am Chem Soc. 136 (6), 2240-2243 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Banghart, M., Borges, K., Isacoff, E., Trauner, D., Kramer, R. H. Light-activated ion channels for remote control of neuronal firing. Nat Neurosci. 7 (12), 1381-1386 (2004).
- Zhang, K., Cui, B. Optogenetic control of intracellular signaling pathways. Trends in Biotechnology. 33 (2), 92-100 (2015).
- Tischer, D., Weiner, O. D. Illuminating cell signalling with optogenetic tools. Nat Rev Mol Cell Bio. 15 (8), 551-558 (2014).
- Kim, B., Lin, M. Z. Optobiology: optical control of biological processes via protein engineering. Biochemical Society Transactions. 41 (5), 1183-1188 (2013).
- Tucker, C. L. Manipulating cellular processes using optical control of protein-protein interactions. Prog Brain Res. 196, 95-117 (2012).
- Toettcher, J. E., Gong, D. Q., Lim, W. A., Weiner, O. D. Light Control of Plasma Membrane Recruitment Using the Phy-Pif System. Method Enzymol. 497, 409-423 (2011).
- Zoltowski, B. D., Gardner, K. H. Tripping the light fantastic: blue-light photoreceptors as examples of environmentally modulated protein-protein interactions. Biochemistry. 50 (1), 4-16 (2011).
- Kennedy, M. J., et al. Rapid blue-light-mediated induction of protein interactions in living cells. Nat Methods. 7 (12), 973-975 (2010).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Liu, H., et al. Photoexcited CRY2 Interacts with CIB1 to Regulate Transcription and Floral Initiation in Arabidopsis. Science. 322 (5907), 1535-1539 (2008).
- Li, X., et al. Arabidopsis cryptochrome 2 (CRY2) functions by the photoactivation mechanism distinct from the tryptophan (trp) triad-dependent photoreduction. Proc Natl Acad Sci U S A. 108 (51), 20844-20849 (2011).
- Leevers, S. J., Paterson, H. F., Marshall, C. J. Requirement for Ras in Raf Activation Is Overcome by Targeting Raf to the Plasma-Membrane. Nature. 369 (6479), 411-414 (1994).
- Kohn, A. D., Takeuchi, F., Roth, R. A. Akt, a pleckstrin homology domain containing kinase, is activated primarily by phosphorylation. J Biol Chem. 271 (36), 21920-21926 (1996).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Kim, J. H., et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PloS one. 6 (4), e18556 (2011).
- Ishimura, A., et al. Oncogenic Met receptor induces ectopic structures in Xenopus embryos. Oncogene. 25 (31), 4286-4299 (2006).
- Zhang, K., et al. Light-Mediated Kinetic Control Reveals the Temporal Effect of the Raf/MEK/ERK Pathway in PC12 Cell Neurite Outgrowth. PloS one. 9 (3), e92917 (2014).
- Mohanty, S. K., Lakshminarayananan, V. Optical Techniques in Optogenetics. J Mod Opt. 62 (12), 949-970 (2015).
- Taslimi, A., et al. Optimized second-generation CRY2-CIB dimerizers and photoactivatable Cre recombinase. Nature chemical biology. 12 (6), 425-430 (2016).
- Kawano, F., Suzuki, H., Furuya, A., Sato, M. Engineered pairs of distinct photoswitches for optogenetic control of cellular proteins. Nat Commun. 6, 6256 (2015).
- Wang, H., et al. LOVTRAP: an optogenetic system for photoinduced protein dissociation. Nat Methods. 13 (9), 755-758 (2016).
- Chang, K. Y., et al. Light-inducible receptor tyrosine kinases that regulate neurotrophin signalling. Nat Commun. 5, 4057 (2014).
- Boulina, M., Samarajeewa, H., Baker, J. D., Kim, M. D., Chiba, A. Live imaging of multicolor-labeled cells in Drosophila. Development. 140 (7), 1605-1613 (2013).
- Liu, H., Gomez, G., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible Optogenetic Control of Subcellular Protein Localization in a Live Vertebrate Embryo. Dev Cell. 36 (1), 117-126 (2016).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature chemical biology. 10 (3), 196-202 (2014).
- Beyer, H. M., et al. Red Light-Regulated Reversible Nuclear Localization of Proteins in Mammalian Cells and Zebrafish. ACS Synth Biol. 4 (9), 951-958 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены