A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
يعيش خلية Fluorescence مجهرية لمراقبة العمليات الأساسية أثناء نمو الخلايا الميكروبية
In This Article
Summary
فهم وظيفة العمليات الأساسية في البكتيريا هو التحدي. مجهر الأسفار مع صبغات محددة الهدف يمكن أن توفر أفكاراً رئيسية في تطور النمو ودورة الخلية الخلية الجرثومية. هنا، tumefaciens المتبعة بكتيريا نموذجي لتسليط الضوء على أساليب لتصوير الخلايا الحية لوصف العمليات الأساسية.
Abstract
العمليات الخلوية الأساسية مثل تكرار الحمض النووي، والعزل وتخليق البروتين وتخليق جدار الخلية الحيوي وانقسام الخلية تعتمد على وظيفة البروتينات التي ضرورية لبقاء البكتيرية. يمكن استخدام مجموعة من الأصباغ محددة الهدف كما المسابير لتحسين فهم هذه العمليات. التلوين بالأصباغ محبتين يتيح مراقبة بنية الغشاء، والتصور من الدهون ميكرودومينس، والكشف عن غشاء بليبس. يمكن أن تشير إلى استخدام الأحماض الأمينية فلوري د (فداس) للتحقيق في مواقع التركيب الحيوي peptidoglycan العيوب المحتملة في نشوء حيوي جدار الخلية أو الخلايا النمو الزخرفة. وأخيراً، يمكن أن تشير إلى بقع الحمض النووي العيوب المحتملة في فصل النسخ المتماثل أو صبغي الحمض النووي. الحمض النووي سينين البقع تسمية الخلايا الحية، وهي مناسبة للوقت الفاصل بين الفحص المجهري تمكن الملاحظات في الوقت الحقيقي مورفولوجية نوكليويد أثناء نمو الخلايا. يمكن تطبيق البروتوكولات لوسم الخلية على طفرات نضوب البروتين لتحديد العيوب في هيكل غشاء أو جدار الخلية نشوء حيوي أو العزل الصبغي. وعلاوة على ذلك، يمكن استخدام الوقت الفاصل بين الفحص المجهري لرصد التغييرات الشكلية بروتين ضروري إزالة، ويمكن أن توفر أفكاراً إضافية في وظيفة البروتين. على سبيل المثال، نتائج استنزاف البروتينات انقسام الخلية الأساسية في فيلامينتيشن أو المنطق التفريعي، بينما قد يؤدي استنفاد بروتينات الخلية نمو الخلايا لتصبح أقصر أو مستدير. هنا، يتم توفير بروتوكولات لنمو الخلايا، ووسم محددة الهدف، والوقت الفاصل بين الفحص المجهري لمسببات الأمراض النباتية البكتيرية tumefaciens المتبعة. معا، صبغات محددة الهدف والوقت الفاصل بين الفحص المجهري تمكن وصف العمليات الأساسية في tumefaciens أ. وأخيراً، يمكن سهولة تعديل البروتوكولات المقدمة للتحقيق في العمليات الأساسية في بكتيريا أخرى.
Introduction
ويتطلب التقدم خلال دورة الخلية البكتيرية تنسيق العديد من العمليات بما في ذلك تخليق جدار الخلية والغشاء الحيوي وتكرار الحمض النووي والعزل، وانقسام الخلايا. لنفهم تماما تعقيد بيولوجيا الخلايا البكتيرية، من الضروري دراسة هذه الأحداث الأساسية؛ ومع ذلك، هذا مهمة غير عادية منذ صلاحية خلية للخطر عندما يتم موتاجينيزيد المكونات الرئيسية لهذه المسارات. ابيفلوريسسينسي المجهري مقترنة بالأصباغ محددة الهدف نهج قوية للتحقيق في هذه العمليات الأساسية في wildtype والسلالات البكتيرية المسخ.
الأصباغ بيبتيدوجليكان محددة تشمل المضادات الحيوية الفلورسنت (فانكوميسين-فلوريدا، فلوريدا بوسيلين) والأحماض الأمينية فلوري د (على سبيل المثال، 7-هيدروكسيكومارين-3-كاربوكسيليك حمض-3-أمينو-د-ألانين، الهدا؛ 4-chloro-7-nitrobenzofurazan-3-amino-د-ألانين ، ندى؛ تيتراميثيلرهوداميني-3-أمينو-د-ألانين؛ الأنشطة الإرهابية والتخريبية). في بكتيريا إيجابية، تم استخدام التركيزات المقاسة من الفلورسنت النظير المضادات الحيوية للتحقيق في مواقع من peptidoglycan الحيوي استراتيجية فعالة للكشف عن أنماط peptidoglycan الإدراج1،2، 3،4. بينما وسم فانكومايسين الفلورية قد استخدمت لاكتساب نظرة ثاقبة peptidoglycan أنماط الإدراج في بكتيريا سلبية الغرام الثابتة5، الغشاء الخارجي يوفر عموما نفاذية حاجز الذي يمنع استخدام فلوري المضادات الحيوية مجس تخليق peptidoglycan الحيوي في الخلايا الحية. وفي المقابل، نبضات قصيرة من الأحماض الأمينية فلوري د أو الأحماض الأمينية د مع المجموعات الوظيفية بيورثوجونال تساهمي تسمية مناطق الإدراج peptidoglycan الأخيرة في مجموعة واسعة من الخلايا البكتيرية الحية6،7. وتشمل أنماط الإدراج peptidoglycan التي لوحظت مع الأحماض الأمينية د الاصطناعية الشروريه والحاجز (الإشريكيّة القولونية و نجحت Bacillus)، القطبية والحاجز (tumefaciens المتبعة و الليستريه المستوحدة)، الحاجز فقط (المكوّرات العنقودية الذهبية)، وقمي (فنزويلا متسلسلة)6،7. هذه الملاحظات تشير إلى أن البكتيريا معرض أنماط متنوعة من نشوء حيوي جدار الخلية وأن استخدام الأحماض الأمينية د الاصطناعية كمجسات لدراسة الزخرفة النمو قيمة استراتيجية في العديد من البكتيريا.
وتشمل الأصباغ التي تسمية الكروموسومات البكتيرية الموثق الاخدود ثانوية محددة الحمض الخلوي الصبغي (DNA) (4,6-دياميدينو-2-فينيليندولي؛ DAPI) والأصباغ سينين تقارب عالية (الأخضر والبرتقالي؛ انظر قائمة المواد). DAPI تلطيخ الخلايا الثابتة ويساعد في تعداد البكتيريا من عينات بيئية8، بينما DAPI تلطيخ الخلايا الحية تستخدم للإشارة إلى بقاء البكتيرية9. وفي المقابل، سينين الأصباغ مثل البرتقالي والأخضر كثيرا ما يوصف بغشاء الخلية "ميتة" إيمبيرمينت البقع تعداد الخلايا غير قابل للحياة9. بشكل ملحوظ، عندما يتم استخدام هذه الكواشف للتحقيق مورفولوجية نوكليويد البكتيرية أثناء نمو الخلايا، DAPI والبرتقالي، والأخضر كانت كلها تبين أن غشاء بيرمينت وقادرة على تسمية الخلايا الحية10. تعيش خلايا كولاي , DAPI تلطيخ الحمض النووي يظهر منتشر بسبب السيارات-الأسفار من السيتوبلازم والتعرض المتكرر من الخلايا DAPI الملون للأشعة فوق البنفسجية (الأشعة فوق البنفسجية) إزعاجا هيكل نوكليويد10. كولاي المصبوغة أو باء-نجحت مع أورانج يكشف أن هذه الصبغة غشاء بيرمينت ويوفر fluorescence طويلة الأمد عند ربط الحمض النووي في الخلايا الحية دون التأثير على نمو الخلايا أو تكرار الحمض النووي الصبغي العزل10 . هذه الملاحظات تشير إلى أنه يمكن استخدام الأصباغ سينين الحمض النووي لرصد مورفولوجية نوكليويدس أثناء نمو الخلية في العديد من البكتيريا.
فوسفوليبيدسبيسيفيك ستريل الأصباغ مثل N-(3-triethylammoniumpropyl)-4-(6-(4-(diethylamino) فينيل) هيكساترينيل) dibromide بيريدينيوم (4-64؛ انظر قائمة المواد) هي مركبات الأيوني والمنتسبين تفضيلي مع اتهم سلبا فوسفوليبيدات مثل كارديوليبين وفوسفاتيديلجليسيرول11. ولوحظت أنماط متميزة عندما يتم استخدام 4-64 لتسمية غشاء البكتيريا المختلفة. في الإشريكيّة القولونية، 4-64 المخصب في القطبين، في عصابات على طول الجدار الجانبي، وفي مواقع شعبة في وقت متأخر بريديفيسيونال الخلايا12. نجحت عصية، وسم 4-64 يمكن التصور من الدهن اللوالب13. في tumefaciens المتبعة، 4-64 تسميات الغشاء الخارجي، ومن الملاحظ في نمط مميز "حدوة" الذي القطب النمو خالية من العلامات14،15. هذه الملاحظات تشير إلى أن هذه البكتيريا يحمل توزيعات دهن غير متجانسة بسبب الوجود الدهون المجالات التي تسهم في عدم التناظر الخلوية. التغيرات في أنماط 4-64 وضع العلامات مثل وجود وسم منتشر، بليبس أو حويصلات أو إينفاجينيشنز أو انكماش الغشاء يمكن أن تكون مفيدة في وصف طفرات التي تؤثر على توزيع أو تخليق الحيوي من الدهون.
وراء تلطيخ الخلايا، من الضروري تحديد وظيفة البروتينات المشاركة في العمليات الأساسية. توصيف البروتينات الأساسية صعبة من الناحية الفنية لأنه ليس من الممكن حذف الجينات الأساسية ودراسة آثار المظهرية. وهكذا ظهرت النهج البديلة المستنفدة للبروتين. على سبيل المثال، يمكن وضع جينات أساسية الخاضعة لسيطرة مروج إيندوسيبلي بدلاً من المروج الأصلي لها. إيندوسيبلي المروجين استجابة لجزيئات صغيرة مثل؛ الزنك16، الأيزوبروبيل β-د-1-ثيوجالاكتوبيرانوسيدي (إيبتج)17،18،19،،من2021، أرابينوز22،23من فانيلاتي17،، و xylose23، وبالتالي يتوقف نسخ الجينات المستهدفة ونفاد بروتين الفائدة عند إزالة محفز. وتشمل النهج البديلة المستنفدة للبروتينات الأساسية التي تهم ريبوسويتشيس الاصطناعية24 التي تستخدم تفاعلات الجزيئات الصغيرة-الجيش الملكي النيبالي لعرقلة نسخ جينات المستهدفة، كريسبر تدخل25،26 لمنع النسخ من الجينات المستهدفة، والبروتين إيندوسيبلي تدهور27،28 التي تستخدم علامات الببتيد للبروتينات المستهدفة للتدهور بحوزتي كلبكسب. توفير سلالات استنفاد سوى وقت قصير لتوصيف قبل الخلايا تفقد السلامة، ولذلك، التصوير المجهري للخلايا على مر الزمن من خلال استنزاف البروتين نهج قوية لتوصيف. في الواقع، والفحص المجهري للخلايا البكتيرية الحية مكن الباحثين اكتساب نظرة ثاقبة العمليات البيولوجية الأساسية، بما في ذلك الآليات للمحافظة على شكل الخلية وإفراز تجزئة29.
A. tumefaciens هو مسببات الأمراض النباتية البكتيرية30 و31،الهندسة الوراثية الطبيعية32. وهكذا، الآليات ذات الصلة بالقدرة الإمراضية، بما في ذلك المضيف الممرض التفاعلات33،،من3435وإفراز36المضيف تحويل30،31، 37 قد تم التحقيق على نطاق واسع. لتصميم استراتيجيات لمنع المرض A. tumefaciens بوساطة أو تعزيز التحول النبات، العمليات الأساسية لبقاء A. tumefaciens بحاجة إلى فهم أفضل. استخدام الأصباغ محددة الهدف وتطوير استراتيجية استنزاف البروتين A. tumefaciens18 الأخيرة توفر وسيلة للتحقيق في العمليات الأساسية.
هنا، يتم توفير بروتوكولات مفصلة للتحليل المجهري سلالات نضوب wildtype والمسخ والبروتين من توميفاسينس أ . البروتوكولين الأول والثاني وصف كيفية إعداد الخلايا وتسميتها بالأصباغ محددة الهدف. ويوفر البروتوكول الثالث توجيهات خطوة بخطوة لإعداد منصات [اغروس] (الشكل 1)، وتصوير الخلايا البكتيرية (الشكل 2، الشكل 3، الشكل 4). قد تكون هذه البروتوكولات أيضا مناسبة للبكتيريا الأخرى مع إجراء تعديلات إضافية لمراعاة ظروف وسائل الإعلام المختلفة ومعدلات النمو ومتطلبات الأكسجين والهياكل الخلية.
Protocol
1-نمو سلالات A. tumefaciens
-
استزراع سلالات A. tumefaciens
- استخدام تلميح عصا أو بيبيت خشبية عقيمة لتطعيم 1 مل وسائط النمو أتجن (انظر قائمة المواد للوصفة) مع مستعمرة واحدة من السلالة المرغوبة.
ملاحظة: لسلالات استنفاد A. tumefaciens ، أتجن ينبغي أن تتضمن 1 مم إيبتج كمحفز الحفاظ على التركيب الحيوي للبروتين الضروري. - زراعة سلالات A. tumefaciens بين عشية وضحاها في أتجن عند 28 درجة مئوية مع الهز 225 لفة في الدقيقة.
- قياس الكثافة الضوئية للخلايا في 600 نانومتر (OD600) باستخدام جهاز المطياف الضوئي. تمييع ثقافة الخلية إلى OD600 = ~0.2 وتستمر في النمو حتى OD600 = ~0.6 هو الذي تم التوصل إليه. لسلالات الاستنفاد، وتواصل نموها مع محفز حتى OD600 = ~0.6 هو الذي تم التوصل إليه.
- استخدام سلالات A. tumefaciens wildtype والمسخ OD600 = ~0.6 لتلطيخ محددة الهدف و/أو الوقت الفاصل بين الفحص المجهري (انظر القسمين 2 و 3-1). لسلالات نضوب، تغسل محفز (انظر الفرع 1-2).
- استخدام تلميح عصا أو بيبيت خشبية عقيمة لتطعيم 1 مل وسائط النمو أتجن (انظر قائمة المواد للوصفة) مع مستعمرة واحدة من السلالة المرغوبة.
-
إزالة محفز لتوصيف سلالات نضوب البروتين A. tumefaciens
- بيليه 1 مل ثقافة أسي (OD600 = ~0.4-0.6) باستخدام الطرد المركزي في 7,000 س ز لمدة 5 دقائق في سطح مكتب للطرد مركزي في درجة حرارة الغرفة.
- ليغسل، إزالة المادة طافية وريسوسبيند بيليه في وسائط جديدة دون محفز وبيليه الخلايا كما هو موضح أعلاه (1.2.1). تغسل الخلايا إجمالي 3 مرات في وسائط الإعلام الجديدة.
- ريسوسبيند بيليه النهائي في وسائط جديدة وتركيز الخلايا ل التطوير التنظيمي600 = ~0.8 لتلطيخ الفوري مع صبغات محددة الهدف (القسم 2 و الشكل 4B-د) أو الوقت الفاصل بين الفحص المجهري (القسم 3.2 و الشكل 4A) . بدلاً من ذلك، قبل استنزاف الخلايا لمقدار الوقت المطلوب بزراعة الخلايا في وسائل الإعلام دون محفز قبل التلوين والتصوير من الخلايا.
2-خاصة بهدف "تلطيخ" الخلايا A. tumefaciens
-
وصف جدار الخلية الأحماض الأمينية د الفلورسنت
ملاحظة: فداس هي غير سامة الأحماض الأمينية د الفلورسنت التي هي إدماج بسهولة في بيبتيدوجليكان توميفاسينس (أ) . يسبر هذا الإجراء وضع العلامات بسيطة النمو الزخرفة في الخلايا الحية6. بروتوكولات لتوليف فداس الأربعة هي المتاحة38.- بيليه 500 ميليلتر للثقافة الأسية (OD600 = ~0.4-0.6) باستخدام الطرد المركزي في 7,000 س ز لمدة 5 دقائق في الطرد سطح مكتب. ريسوسبيند بيليه الخلية في 100 ميليلتر من وسائط جديدة.
- إضافة 5 ميليلتر من 5 مم فدا لغسلها وتتركز الخلايا واحتضان لمدة 2 دقيقة في الظلام.
ملاحظة: قصر فدا التعرض للضوء. وقت حضانة ستختلف تبعاً لمعدل النمو للسلالة. عادة، ينبغي أن تكون أوقات الاحتضان 5-10% من الوقت مضاعفة6. - بيليه الخلايا بالطرد المركزي وتغسل الكريات الخلية مع الفوسفات مخزنة المالحة (PBS) ثلاث مرات.
- ريسوسبيند بيليه في ~ 50 ميليلتر PBS.
ملاحظة: قد تختلف استناداً إلى حجم بيليه حجم برنامج تلفزيوني المستخدمة لاستثارة. - تطبيق 0.8-1 ميليلتر خلايا إلى لوح [اغروس] والصورة باستخدام الفحص المجهري ابيفلوريسسينسي فورا (انظر الفرعين 3.1 و 3.2).
- وبدلاً من ذلك، وقف المزيد من إدراج التسمية عن طريق تحديد الخلايا مع المثلج 70% إيثانول. ريسوسبيند بيليه الخلية في 1 مل من المثلج 70% إيثانول واحتضان في الثلج لمدة 15 دقيقة.
- جمع الخلايا بالطرد المركزي وريسوسبيند في كمية صغيرة من برنامج تلفزيوني للتصوير في وقت لاحق. تخزين تعليق خلية في 4 درجات مئوية والصورة في غضون 48 ساعة.
-
الحمض النووي تلطيخ مع DAPI أو وصمة عار البرتقالي
ملاحظة: لمراقبة الحمض النووي بنية، تتم تسمية الخلايا مع DAPI أو البرتقالي (خلية ميتة وصمة عار). على الرغم من أن الكلاسيكي توصف بأنها "وصمة عار الميت-خلية"، البرتقالي بيرمينت، فوتوستابل، ولا تؤثر على نمو الخلايا البكتيرية، تمكين خلية يعيش الحمض النووي التصوير10. في توميفاسينس أ، يعمل التوسيم البرتقال جيدا في الخلايا الحية وهي مناسبة للوقت الفاصل بين الفحص المجهري (الشكل 3). وفي المقابل، الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) التعرض للضوء اللازمة للتصوير الملون DAPI الخلايا سمي ضيائي (الشكل 3) وهكذا DAPI تلطيخ الأنسب لتلطيخ الخلايا الحية للتصوير الفوري أو تلطيخ الخلايا الثابتة.- DAPI تلطيخ الخلايا
- بيليه 1 مل ثقافة أسي (OD600 = ~0.4-0.6) باستخدام الطرد المركزي في 7,000 س ز لمدة 5 دقائق في الطرد سطح مكتب.
- بشكل اختياري، لإصلاح الخلايا قبل التلوين، ريسوسبيند بيليه الخلية في 1 مل إيثانول المثلج 70%. تبني على الجليد لجمع الخلايا باستخدام الطرد المركزي كما هو موضح في 2.2.1.1 كحد أدنى 10-15.
- ريسوسبيند بيليه الخلية في 1 مل من برنامج تلفزيوني يحتوي على 1 ميليلتر من حل DAPI الأسهم (1 ملغ/مل؛ انظر الجدول المواد). المزيج بلطف بيبيتينج واحتضان لمدة 5 دقائق في الظلام.
- بيليه الخلايا باستخدام الطرد المركزي في 7,000 س ز لمدة 5 دقائق وريسوسبيند في 1 مل من برنامج تلفزيوني لإزالة الزائدة DAPI. تغسل الخلايا مرتين أخريين وريسوسبيند بيليه في برنامج تلفزيوني 50 ميليلتر أو وسائل الإعلام.
- تطبيق 0.8-1 ميليلتر خلايا إلى لوح [اغروس] والصورة باستخدام الفحص المجهري ابيفلوريسسينسي فورا. راجع المقاطع 3.1 و 3.2.
ملاحظة: هذا البروتوكول ليس الأمثل للوقت الفاصل بين الفحص المجهري لمراقبة ديناميات كروموسوم (الشكل 3). النظر في استخدام تلطيخ البرتقال كبديل (انظر الفرع 2.2.2).
- تلوين البرتقالي للخلايا الحية
- بيليه 1 مل ثقافة أسي (OD600 = ~0.4-0.6) باستخدام الطرد المركزي في 7,000 س ز لمدة 5 دقائق في الطرد سطح مكتب. ريسوسبيند بيليه الخلية في 1 مل من برنامج تلفزيوني يحتوي على 1 ميليلتر من حل الأسهم البرتقالي (انظر قائمة المواد). المزيج بلطف بيبيتينج واحتضان لمدة 5 دقائق في الظلام.
- بيليه الخلايا بالطرد المركزي وريسوسبيند في 1 مل من برنامج تلفزيوني لإزالة اللون البرتقالي الزائدة. تغسل الخلايا مرتين أخريين وريسوسبيند بيليه في 50 ميليلتر PBS.
- تطبيق 0.8-1 ميليلتر خلايا إلى لوح [اغروس] والصورة باستخدام الفحص المجهري ابيفلوريسسينسي فورا. راجع المقاطع 3.1 و 3.2.
ملاحظة: هذا البروتوكول يعمل بشكل جيد مع الخلايا الحية، وهو مناسبة للوقت الفاصل بين الفحص المجهري لمراقبة ديناميات كروموسوم (الشكل 3). إذا لم يكن ملائماً صورة مباشرة، يمكن إصلاح الخلايا في المثلج 70% إيثانول (انظر الفرع 2.2.1.2).
- DAPI تلطيخ الخلايا
-
وصف الغشاء
ملاحظة: صبغة الفلورسنت ستيريل محبتين 4-64 وقد استخدمت على نطاق واسع لمراقبة غشاء الخلايا البكتيرية. خلافا للعديد من البكتيريا، 4-64 المسماة الخلايا توميفاسينس (أ) عدم تسمية موحدة، ولكن بدلاً من ذلك في كثير من الأحيان يحمل14،نمط "حدوة"15. اللافت للنظر القطب النمو تقريبا خاليا من وصمة عار حين مكثف يسمى القطب القديم. وهكذا تمكن 4-64 التصور خلية أنماط النمو وهيكل غشاء في توميفاسينس أ.- أضف FM 4-64 إلى تركيز نهائي 8 ميكروغرام/مل في 1 مل من المرحلة الأسية خلية ثقافة واحتضان في درجة حرارة الغرفة لمدة 5 دقائق في الظلام.
- بيليه الخلايا المسماة بالطرد المركزي في 7,000 س ز لمدة 5 دقائق في سطح مكتب للطرد مركزي وريسوسبيند بيليه الخلية في 1 مل من برنامج تلفزيوني. تغسل الخلايا ما مجموعة ثلاث مرات لإزالة الصبغة الزائدة.
- ريسوسبيند الخلايا في كمية صغيرة من برنامج تلفزيوني وعلى الفور جهاز pad [اغروس] صورة مباشرة. (انظر الفرعين 3.1 و 3.2)
تنبيه: الخلايا يجب تصويرها فورا مراقبة أنماط وضع العلامات المميزة.
3-تصوير الخلايا A. tumefaciens
-
إعداد لوحة [اغروس]
ملاحظة: يشتمل على الشكل 1 تسلسل الصور (لوحة أ) والتخطيطي (فريق ب) من منصة نموذجية [اغروس] أعدت للوقت الفاصل بين الفحص المجهري. وتعد منصات [اغروس] عادة حسب الحاجة.- 3.1.1. استخدم ساترة كدليل وقص الفيلم 22 مم × 22 مم مربع مختبر (انظر قائمة المواد) عن طريق تشغيل مشرط حول الحواف.
- قطع مربع من وسط الفيلم المختبر ترك ~ 2-5 ملم في الحدود بمثابة طوقا اللوحة [اغروس]. تجاهل في الفصل مركز.
- وضع طوقا الفيلم إلى شريحة زجاج (75 مم × 25 مم) تنظيف مع الأمونيا ومنظف خال من الكحول (انظر قائمة المواد) وحرارة حتى ذاب الفيلم قليلاً على الزجاج (الصورة العلوية في الشكل 1A). تذوب الفيلم المختبر، استخدم حافة مجموعة كتلة الحرارة إلى 70 درجة مئوية أو تذوب خفيفا على لهب.
- إعداد الحل [اغروس] عن طريق خلط ~0.075 ز [اغروس] (انظر قائمة المواد) في 5 مل من وسائل الإعلام في قارورة صغيرة. الحرارة الحل في فرن ميكروويف مع دوامات الدوري للمزيج حتى يذوب في [اغروس] والحل واضح. يبقى الحل [اغروس] في 55-70 درجة مئوية، وتستخدم لبناء منصات [اغروس] متعددة في غضون 48 ساعة.
- ماصة الوسائط التي تحتوي على 1.2-1.5% [اغروس] إلى مركز طوقا.
ملاحظة: حجم وسائل الإعلام هو عادة 50-60 ميليلتر ولكن سوف تختلف باختلاف حجم طوقا. إضافة الوسائط إلى شريحة باردة يمكن أن يسبب [اغروس] يصلب بسرعة كبيرة جداً، وبالتالي الشريحة يجب أن تبقى على سطح دافئة. تعيين حافة كتلة الحرارة إلى 70 درجة مئوية يعمل جيدا. ويمكن استخدام المياه [اغروس] أو حلول مخزنة بشكل مؤقت [اغروس] مثل الفوسفات مخزنة المالحة (PBS) بدلاً من الوسائط التي تحتوي على [اغروس] لتطبيقات فيها نمو الخلايا استمرار غير مطلوب. يمكن للتصوير سلالات نضوب، محفز موجودة أو غائبة في وسائل الإعلام. وجود محفز يمكن استخدامها كعنصر تحكم بينما سوف تكشف عن عدم وجود محفز النمط الظاهري نضوب. - ضع ساترة من فوق طوقا توزيعها بالتساوي [اغروس].
- ضع الشريحة على سطح بارد، والمستوى ترسيخ لدقيقة ~ 2 تجنب overdrying لوحة المفاتيح [اغروس] كهذا سيؤدي إلى سطح التجاعيد على لوحة المفاتيح [اغروس] وتجميع تعليق خلية عند تطبيقه على السطح.
- الشريحة بعناية ساترة قبالة لوحة المفاتيح [اغروس].
تنبيه: لا تتعجل هذه الخطوة. يمكن بسهولة المسيل للدموع لوح [اغروس] وجهاز pad متفاوتة [اغروس] يمكن أن يجعل التصوير صعباً. - تسمح لوحة المفاتيح [اغروس] إلى الهواء الجاف لمدة 1-2 دقيقة في درجة حرارة الغرفة حتى يظهر سطح لوحة جافة. استخدام مشرط، إزالة شريط صغير من [اغروس] لخلق جيب هوائي (وسط الصورة، الشكل 1A)؛ جيب الجوي عادة ~ 2 مم × 7-10 مم والخلايا توميفاسينس (أ) تميل إلى أن تنمو أفضل قرب جيب الجوي (الشكل 1).
ملاحظة: لتصوير الخلايا الثابتة أو بموجب الشروط التي لا يتم فيها رصد النمو، جيب هوائي غير ضروري. - بقعة 0.8-1 ميليلتر خلايا على لوح [اغروس] وغطاء مع ساترة جديدة. مكان ساترة بلطف عبر الجزء العلوي من لوحة المفاتيح [اغروس] لتوزيع الخلايا عبر سطح اللوحة [اغروس].
- ختم حواف ساترة استخدام فالاب المذابة (انظر الجدول المواد لوصفه؛ الشكل 1A، أسفل الصورة). يمكن أن يؤدي الفشل في ختم على طول جميع حواف وزوايا ساترة تجفيف لوحة المفاتيح [اغروس]، مما يؤدي إلى الانجراف الخلايا أثناء التصوير. ملاحظة: وضع ختم ساترة فقط مطلوب لتصوير مرور الزمن الطويل الأجل.
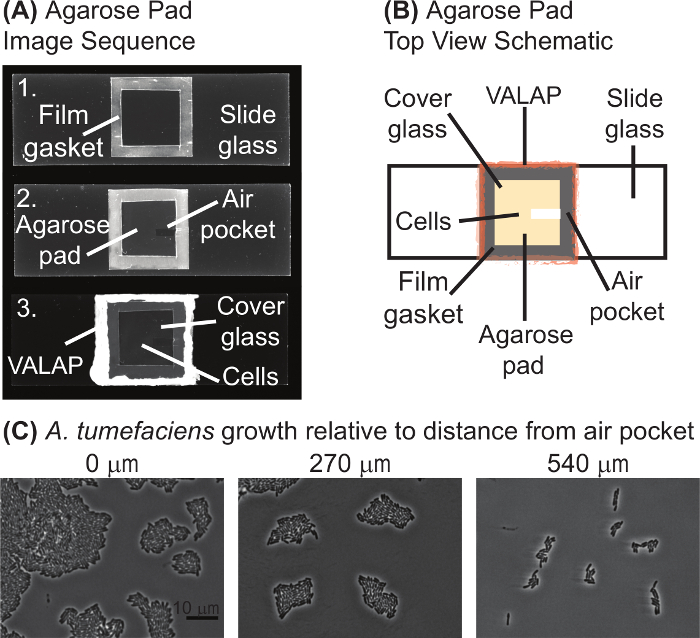
رقم 1: إعداد لوحة [اغروس]- (أ) صورة تسلسل بروتوكول إعداد لوحة [اغروس]. الصورة 1 من شريحة مع طوقا الفيلم المختبر. في الصورة 2، وهي تصور لوح [اغروس] وجيب الجوي. وأخيراً، تظهر لوحة المفاتيح الكاملة [اغروس] مع الخلايا تحت كوفيرجلاس الصورة 3 ومختومة فالاب. (ب) التخطيطي لجهاز pad [اغروس] للفحص المجهري الوقت الفاصل بين يتم توفيرها. الملامح الرئيسية للوحة المفاتيح [اغروس] وصفت في التخطيطي. (ج) جيب الجوي تعزز نمو A. tumefaciens على منصات [اغروس]. تظهر الصور wildtype A. tumefaciens الخلايا المزروعة على منصة [اغروس] لمدة 20 ساعة. تم أخذ صور في مواقع بعيدة متزايدة من جيب الجوي. يتم إظهار المسافة من حافة الصورة الأقرب إلى جيب الجوي فوق كل صورة. شريط المقياس = 10 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
تصوير
ملاحظة: تدخل فرق التباين والتباين المرحلة وتصوير ابيفلوريسسينسي تتم مع مجهر مقلوب مجهزة autofocusing المستندة إلى الأجهزة، مرحلة الآلي، الفلاتر القياسية، مصدر ضوء LED، وغمر النفط X 60 الأهداف (1.4 نا) لمرحلة التباين أو التدخل التفاضلية التباين (DIC)، وكاميرا تهمة-يقترن-جهاز (امككد) ضرب إلكترون ك 1. وينبغي أن توضع المجهر في غرفة التحكم في درجة حرارة. وبدلاً من ذلك، يمكن استخدامها على المرحلة الأكثر دفئا أو الدائرة للحفاظ على درجات الحرارة متسقة أثناء التصوير.- ابيفلوريسسينسي المجهري
ملاحظة: لتصوير صف من الخلايا الحية، من الضروري للحد من عدد الحيازات الصورة وتحسين وقت التعرض للتقليل من فوتوبليتشينج والضيائيه. للتصوير من كل صبغة، من المستحسن للبحث عن وقت تعرض أمثل الذي يوفر الكشف عن الأسفار كافية ولكن لا يؤدي إلى فوتوبليتشينج أو الضيائية. وفي الأرقام 2-4، استخدمت أوقات التعرض لمرض التصلب العصبي المتعدد 200 لجميع الأسفار الصور. لتسلسل الزمن الفاصل هو موضح في الشكل 3، الصور تم الحصول عليها كل 10 دقيقة ح 3.- ضع زيت الغمر على الهدف المنشود ومكان الشريحة مقلوب في حامل الشريحة على المسرح. استخدام المقابض التركيز لإحضار الخلايا إلى التركيز.
- الحصول على الصور في مرحلة (أو DIC) وعامل التصفية المطلوب الأسفار.
ملاحظة: أطوال موجية الإثارة والانبعاثات القصوى للبقع المستخدمة في الشكل 2و الشكل 3و رقم 4 كما يلي: هادا (405/460)، وندي (450/555)، والأنشطة الإرهابية والتخريبية (555/570)، 4-64 (515/640)، DAPI (360/460)، والبرتقال (547/570).
- الوقت الفاصل بين الفحص المجهري
ملاحظة: أثناء الفحص المجهري الوقت الفاصل بين الميزات التالية هي الكمبيوتر التي تسيطر عليها: x و y و z الموقف، الستائر، والأسفار المرشحات. نظام تركيز تلقائي المستندة إلى الأجهزة الأمثل للحفاظ على التركيز خلال الوقت الفاصل بين التصوير. وبدلاً من ذلك، يمكن استخدام حلقة التركيز التلقائي المستندة إلى البرامج.- ضع زيت الغمر على الهدف المنشود ومكان الشريحة مقلوب في حامل الشريحة على المسرح. استخدام المقابض التركيز لإحضار الخلايا إلى التركيز.
- بشكل اختياري: اكتساب متعددة (x, y) مناصب. حدد عشوائياً 10 حقول من الخلايا بالقرب من جيب الجوي منصات [اغروس].
- إعداد وقت اكتساب تسلسل للصورة في المرحلة أو DIC في الفاصل الزمني المطلوب.
ملاحظة: للتسلسل الزمني الفاصل هو مبين في الشكل 4، تم اقتناء الصور DIC مع التعرض 30 مللي ثانية كل 10 دقيقة ح 14. عند استخدام التصوير الأسفار خلال الوقت الفاصل بين الفحص المجهري، ضبط الوقت الفاصل الزمني والتعرض لاقتناء للتقليل من فوتوبليتشينج والضيائيه.
- ابيفلوريسسينسي المجهري
النتائج
وسم من wildtype محددة الهدف A. tumefaciens الخلايا
بغية توضيح ذلك مورفولوجيا الخلايا لا تتأثر خطوات الغسيل أو المعاملة مع [دمس] 1% (والذي يستخدم لتخفيف الأصباغ الفلورية)، تم تصويرها الخلايا مباشرة من الثقافة (الشكل 2A، الفريق أقصى ال...
Discussion
يحتوي هذا البروتوكول على سلسلة من الإجراءات لتحقيق سلالات A. tumefaciens wildtype والمسخ، ونضوب. تجدر الإشارة إلى أن جميع الإجراءات المدرجة في قسم البروتوكول يمكن أن يسهل تكييفها للسلالات البكتيرية الأخرى مع تعديلات إضافية لمراعاة وسائط النمو ودرجات الحرارة، ومعدلات النمو.
اس?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر مايكل فانيووينهزي (جامعة إنديانا) لهدية فداس المستخدمة في الشكل 2 و الشكل 4. ونشكر أعضاء المختبر براون للتغذية المرتدة أثناء إعداد هذه المخطوطة. البحث في مختبر براون على شعبة ونمو الخلايا A. tumefaciens معتمد من قبل "المؤسسة الوطنية للعلوم" (IOS1557806).
Materials
| Name | Company | Catalog Number | Comments |
| Bacterial Strains | |||
| Agrobacterium tumefaciens C58 | ATCC | 33970 | Watson B, Currier TC, Gordon MP, Chilton MD, Nester EW. 1975. Plasmid required for virulence of Agrobacterium tumefaciens. J Bacteriol 123:255-264. |
| Agrobacterium tumefaciens C58ΔtetRA::mini-Tn7T-GM-Ptac-ctrA ΔctrA | Figueroa-Cuilan W, Daniel JJ, Howell M, Sulaiman A, Brown PJB. 2016. Mini-Tn7 insertion in an artificial attTn7 site enables depeltion of the essentail master regulator CtrA in the phytopathogen Agrobacterium tumefaciens. Appl Environ Microbiol. 82:5015-5025. | ||
| Name | Company | Catalog Number | Comments |
| Media Components | |||
| ATGN Minimal Medium | To 1 L of sterilized water add 50 ml 20X Buffer, 50 ml 20X Salts, 12.5 ml 40% glucose. For plates, add 15 g Bacto Agar to 1 L of water and autoclave. Cool to 55 °C and add 50 ml 20X Buffer, 50 ml 20X Salts, 12.5 ml 40% glucose. | ||
| 20X AT Buffer | Add 214 g/L KH2PO4 to water and adjust pH to 7.0 with sodium hydroxide. Autoclave. | ||
| NaOH | Fisher BioReagents | BP359 | |
| KH2PO4 | Fisher Chemical | P288 | |
| 20X AT Salts | Add 40 g/L (NH4)2SO4, 3.2 g/L MgSO4•7H2O, 0.2 g/L CaCl2•2H2O, and 0.024 g/L MnSO4•H2O to water. Autoclave. | ||
| (NH4)2SO4 | Fisher Chemical | A701 | |
| MgSO4•7H2O | Fisher BioReagents | BP213 | |
| CaCl2•2H2O | Fisher BioReagents | BP510 | |
| MnSO4•H2O | Fisher Chemical | M114 | |
| Glucose | Fisher Chemical | D16 | Prepare 40% stock in water. Filter sterilize. |
| Bacto Agar | Fisher BioReagents | BP1423 | Add 15 g to 1 L of water when preparing plates. |
| Name | Company | Catalog Number | Comments |
| Optional Media Additives | |||
| Kanamycin | GoldBio | K-120 | Prepare as a 100 mg/ml stock solution in water and filter sterilize. Use at final concentration of 200 µg/ml. |
| IPTG | GoldBio | I2481C5 | Prepare as a 1 M stock solution in water and filter sterilize. Use at final concentration of 1 mM as needed for induction. |
| Name | Company | Catalog Number | Comments |
| Microscopy Materials | |||
| Microscope Slides | Fisherbrand | 12-550D | 25 X 75 X 1.0 mm. Clean with Sparkle glass cleaner. |
| Microscope Cover Glass | Fisherbrand | 12-541-B | 22 X 22 mm. No. 1.5. Clean with Sparkle glass cleaner. |
| Sparkle Glass Cleaner | Home Depot | 203261385 | Ammonia and alcohol free. |
| Ultra Pure Agarose | Invitrogen | 16500-100 | Add to water, PBS, or media to a final concentration of 1 - 1.5%. Melt in microwave and place on 70 C |
| PBS | Fisher BioReagents | BP399500 | 10X solution to be diluted to 1X with sterile water. |
| Parafilm | Bemis | PM-999 | Laboratory film used as gasket in agarose pad preparation. |
| VALAP | Add equal weights of lanolin, parafin wax, and petroleum jelly to a conical tube. Heat tube in 70 °C dry, bead or water bath to melt and mix. Apply VALAP while still molten. | ||
| Lanolin Butter | SAAQIN | SQ-LAB-R1 | |
| Petroleum Jelly | Target Corp. | 06-17644 | |
| Paraffin Wax | Crafty Candles | 263012 | |
| Name | Company | Catalog Number | Comments |
| Target-specific dyes | |||
| DMSO | Fisher BioReagents | BP231-1 | Use to dilute stock solutions of dyes as needed. |
| FDAAs (NADA, HADA,TADA) | FDAAs can be synthesized or acquired through agreement with Mike VanNieuwenhze (Indiana University). Prepare 100 mM stock solution in DMSO. Use at a final concentration of 5 mM. | ||
| DAPI | ThermoFisher Scientific | 62247 | Prepare 1 mg/ml stock solution in DMSO. Use at final concentration of 1 µg/ml. |
| SYTOX Orange Nucleic Acid Stain | Invitrogen | S11368 | Stock concentration is 5 mM in DMSO. Use at final concentration of 5 µM. |
| FM4-64 | Invitrogen | T3166 | Prepare 8 mg/ml stock solution in DMSO. Use at final concentration of 8 µg/ml. |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Dry bath | Sheldon Manufacturing, Inc. | 52120-200 | |
| Metallic thermal beads | Lab Armor | 42370-002 | |
| Epifluorescence microscope equipped with an EMCDD camera | Nikon Eclipse TiE equipped with a QImaging Rolera em-c2 1K electron-multiplying charge-coupled-device (EMCCD) camera is used in this work. |
References
- Daniel, R. A., Errington, J. Control of cell morphogenesis in bacteria: two distinct ways to make a rod-shaped cell. Cell. 113 (6), 767-776 (2003).
- Tiyanont, K., et al. Imaging peptidoglycan biosynthesis in Bacillus subtilis with fluorescent antibiotics. Proc Natl Acad Sci U S A. 103 (29), 11033-11038 (2006).
- Turner, R. D., et al. Peptidoglycan architecture can specify division planes in Staphylococcus aureus. Nat Commun. 1, 26 (2010).
- Wheeler, R., Mesnage, S., Boneca, I. G., Hobbs, J. K., Foster, S. J. Super-resolution microscopy reveals cell wall dynamics and peptidoglycan architecture in ovococcal bacteria. Mol Microbiol. 82 (5), 1096-1109 (2011).
- Turner, R. D., Hurd, A. F., Cadby, A., Hobbs, J. K., Foster, S. J. Cell wall elongation mode in Gram-negative bacteria is determined by peptidoglycan architecture. Nat Commun. 4, 1496 (2013).
- Kuru, E., et al. In Situ probing of newly synthesized peptidoglycan in live bacteria with fluorescent D-amino acids. Angew Chem Int Ed Engl. 51 (50), 12519-12523 (2012).
- Siegrist, M. S., et al. (D)-Amino acid chemical reporters reveal peptidoglycan dynamics of an intracellular pathogen. ACS Chem Biol. 8 (3), 500-505 (2013).
- Kepner, R. L., Pratt, J. R. Use of fluorochromes for direct enumeration of total bacteria in environmental samples: past and present. Microbiol Rev. 58 (4), 603-615 (1994).
- Johnson, M. B., Criss, A. K. Fluorescence microscopy methods for determining the viability of bacteria in association with mammalian cells. J Vis Exp. (79), (2013).
- Bakshi, S., et al. Nonperturbative imaging of nucleoid morphology in live bacterial cells during an antimicrobial peptide attack. Appl Environ Microbiol. 80 (16), 4977-4986 (2014).
- Barak, I., Muchova, K. The role of lipid domains in bacterial cell processes. Int J Mol Sci. 14 (2), 4050-4065 (2013).
- Fishov, I., Woldringh, C. L. Visualization of membrane domains in Escherichia coli. Mol Microbiol. 32 (6), 1166-1172 (1999).
- Barak, I., Muchova, K., Wilkinson, A. J., O'Toole, P. J., Pavlendova, N. Lipid spirals in Bacillus subtilis and their role in cell division. Mol Microbiol. 68 (5), 1315-1327 (2008).
- Cameron, T. A., Anderson-Furgeson, J., Zupan, J. R., Zik, J. J., Zambryski, P. C. Peptidoglycan synthesis machinery in Agrobacterium tumefaciens during unipolar growth and cell division. MBio. 5 (3), e01219 (2014).
- Zupan, J. R., Cameron, T. A., Anderson-Furgeson, J., Zambryski, P. C. Dynamic FtsA and FtsZ localization and outer membrane alterations during polar growth and cell division in Agrobacterium tumefaciens. Proc Natl Acad Sci U S A. 110 (22), 9060-9065 (2013).
- Eberhardt, A., Wu, L. J., Errington, J., Vollmer, W., Veening, J. W. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-408 (2009).
- Iniesta, A. A., Garcia-Heras, F., Abellon-Ruiz, J., Gallego-Garcia, A., Elias-Arnanz, M. Two systems for conditional gene expression in Myxococcus xanthus inducible by isopropyl-beta-D-thiogalactopyranoside or vanillate. J Bacteriol. 194 (21), 5875-5885 (2012).
- Figueroa-Cuilan, W., Daniel, J. J., Howell, M., Sulaiman, A., Brown, P. J. Mini-Tn7 Insertion in an Artificial attTn7 Site Enables Depletion of the Essential Master Regulator CtrA in the Phytopathogen Agrobacterium tumefaciens. Appl Environ Microbiol. 82 (16), 5015-5025 (2016).
- Jacob, F., Monod, J. Genetic regulatory mechanisms in the synthesis of proteins. J Mol Biol. 3, 318-356 (1961).
- Khan, S. R., Gaines, J., Roop, R. M., Farrand, S. K. Broad-host-range expression vectors with tightly regulated promoters and their use to examine the influence of TraR and TraM expression on Ti plasmid quorum sensing. Appl Environ Microbiol. 74 (16), 5053-5062 (2008).
- Yansura, D. G., Henner, D. J. Use of the Escherichia coli lac repressor and operator to control gene expression in Bacillus subtilis. Proc Natl Acad Sci U S A. 81 (2), 439-443 (1984).
- Guzman, L. M., Belin, D., Carson, M. J., Beckwith, J. Tight regulation, modulation, and high-level expression by vectors containing the arabinose PBAD promoter. J Bacteriol. 177 (14), 4121-4130 (1995).
- Thanbichler, M., Iniesta, A. A., Shapiro, L. A comprehensive set of plasmids for vanillate- and xylose-inducible gene expression in Caulobacter crescentus. Nucleic Acids Res. 35 (20), e137 (2007).
- Topp, S., et al. Synthetic riboswitches that induce gene expression in diverse bacterial species. Appl Environ Microbiol. 76 (23), 7881-7884 (2010).
- Peters, J. M., et al. A Comprehensive, CRISPR-based Functional Analysis of Essential Genes in Bacteria. Cell. 165 (6), 1493-1506 (2016).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Griffith, K. L., Grossman, A. D. Inducible protein degradation in Bacillus subtilis using heterologous peptide tags and adaptor proteins to target substrates to the protease ClpXP. Mol Microbiol. 70 (4), 1012-1025 (2008).
- McGinness, K. E., Baker, T. A., Sauer, R. T. Engineering controllable protein degradation. Mol Cell. 22 (5), 701-707 (2006).
- Schneider, J. P., Basler, M. Shedding light on biology of bacterial cells. Philos Trans R Soc Lond B Biol Sci. 371 (1707), (2016).
- Escobar, M. A., Dandekar, A. M. Agrobacterium tumefaciens as an agent of disease. Trends Plant Sci. 8 (8), 380-386 (2003).
- Gelvin, S. B. Agrobacterium-mediated plant transformation: the biology behind the "gene-jockeying" tool. Microbiol Mol Biol Rev. 67 (1), 16-37 (2003).
- Nester, E. W. Agrobacterium: nature's genetic engineer. Front Plant Sci. 5, 730 (2014).
- Imam, J., Singh, P. K., Shukla, P. Plant Microbe Interactions in Post Genomic Era: Perspectives and Applications. Front Microbiol. 7, 1488 (2016).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front Plant Sci. 5, 322 (2014).
- Yuan, Z. C., Williams, M. A really useful pathogen, Agrobacterium tumefaciens. Plant Cell. 24 (10), (2012).
- Alvarez-Martinez, C. E., Christie, P. J. Biological diversity of prokaryotic type IV secretion systems. Microbiol Mol Biol Rev. 73 (4), 775-808 (2009).
- Pitzschke, A. Agrobacterium infection and plant defense-transformation success hangs by a thread. Front Plant Sci. 4, 519 (2013).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat Protoc. 10 (1), 33-52 (2015).
- Curtis, P. D., Brun, Y. V. Identification of essential alphaproteobacterial genes reveals operational variability in conserved developmental and cell cycle systems. Mol Microbiol. 93 (4), 713-735 (2014).
- Kim, J., Heindl, J. E., Fuqua, C. Coordination of division and development influences complex multicellular behavior in Agrobacterium tumefaciens. PLoS One. 8 (2), e56682 (2013).
- Jong, I. G., Beilharz, K., Kuipers, O. P., Veening, J. W. Live Cell Imaging of Bacillus subtilis and Streptococcus pneumoniae using Automated Time-lapse Microscopy. J Vis Exp. (53), (2011).
- Turnbull, L., et al. Super-resolution imaging of the cytokinetic Z ring in live bacteria using fast 3D-structured illumination microscopy (f3D-SIM). J Vis Exp. (91), e51469 (2014).
- Zeng, L., Golding, I. Following cell-fate in E. coli after infection by phage lambda. J Vis Exp. (56), e3363 (2011).
- Brown, P. J., et al. Polar growth in the Alphaproteobacterial order Rhizobiales. Proc Natl Acad Sci U S A. 109 (5), 1697-1701 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved