A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام ألوان جزيء واحد الحنق لدراسة الترابط بين تفاعلات البروتين
In This Article
Summary
نقدم هنا، وضع بروتوكول للحصول على بيانات ألوان سمفريت وتحليلها مع فرقة 3D نموذج ماركوف المخفي. مع هذا النهج، يمكن استخراج العلماء المعلومات الحركية من نظم البروتين المعقدة، بما في ذلك كوبيراتيفيتي أو التفاعلات المرتبطة.
Abstract
جزيء واحد فورستر الرنين نقل الطاقة (سمفريت) أصبحت تقنية الفيزيائية مستخدمة على نطاق واسع لدراسة ديناميات الجزيئات الحيوية. للعديد من الأجهزة الجزيئية في بروتينات خلية يجب أن تعمل جنبا إلى جنب مع الشركاء التفاعل في دورة وظيفي إنجاز مهمتهم. التمديد اللونين إلى متعدد الألوان سمفريت يجعل من الممكن للتحقيق في وقت واحد أكثر من التفاعل أو تغيير كونفورماشونال. هذا ليس فقط يضيف بعدا جديداً إلى تجارب سمفريت ولكن كما يوفر إمكانية فريدة لمباشرة دراسة تسلسل الأحداث والكشف عن التفاعلات المرتبطة عند استخدام نموذج المعطل تداولها ومن الأسفار انعكاس داخلي الكلي مجهر (تيرفم). ولذلك، سمفريت متعدد الألوان أداة مرنة لدراسة المجمعات الجزيئية البيولوجية بطريقة كمية، وفي تفصيل سابقا لا يمكن تحقيقه.
هنا، نحن توضح كيفية التغلب على التحديات الخاصة لتجارب سمفريت متعدد الألوان على البروتينات. نقدم بروتوكولات مفصلة للحصول على البيانات واستخراج المعلومات الحركية. وهذا يشمل تتبع معايير الاختيار والفصل بين الدولة واستعادة مسارات الدولة من البيانات صاخبة باستخدام فرقة 3D نموذج ماركوف المخفي (هم). مقارنة بالأساليب الأخرى، المعلومات الحركية لا يتم استرداد من يسكن الوقت المدرج الإحصائي ولكن مباشرة من هم. إطار الحد الأقصى لاحتمال يسمح لنا لتقييم النموذج الحركي حاسمة وتوفير أوجه عدم اليقين ذات مغزى للمعدلات.
عن طريق تطبيق أسلوبنا لبروتين الصدمة الحرارة 90 (Hsp90)، نحن قادرون على تشابك الربط النوكليوتيدات والتغيرات العالمية كونفورماشونال من البروتين. وهذا يسمح لنا بمراقبة مباشرة كوبيراتيفيتي بين اثنين النوكليوتيدات ملزمة جيوب ديمر Hsp90.
Introduction
إنجاز العديد من البروتينات وظيفتها في مجمعات دينامية مع جزيئات أخرى، بوساطة التغيرات كونفورماشونال ورابطات عابرة على مجموعة واسعة من المقاييس الزمنية1،،من23. يقترن بمصدر الطاقة خارجي (مثل ATP) يمكن أن يؤدي إلى اتجاه في دورة وظيفي هذه التفاعلات الدينامية وفي النهاية الحفاظ على ثابت-حالة عدم التوازن في خلية، شرطا أساسيا للحياة.
أجل الفهم الكامل لهذه الآلات الجزيئية، وصف ثابتة يسترشد بدراسات الهيكلية غير كافية. وبالإضافة إلى ذلك، من الضروري الحصول على معرفة طراز الحركية الكامنة وتحديد الثوابت معدل الحركية. العديد من الأساليب القائمة السماح للباحثين بدراسة القوى المحركة للتفاعلات الثنائية بين اثنين من جزيئات الفائدة، مثلاً، السطحية مأكل مثل الطحين الرنين، وأساليب الاسترخاء مع قراءات الطيفية (مثلاً، القفز أو توقف تدفق تقنيات)، والرنين المغناطيسي النووي. ومع ذلك، قابليتها للتطبيق في معظم الحالات يقتصر على أنظمة الدولتين بسيطة (مثلاً، واحد محدد وإحدى الدول غير المنضمة) بسبب متوسط الملازمة للجزء الأكبر من التجارب. في الحالات التي تنطوي على مزيد من الدول أو وسيطة، أنها تعطي فقط خليط معقد من الثوابت معدل. يمكن استرداد طرق جزيء واحد مثل الملقط ضوئية أو مغناطيسية أو اللونين سمفريت و أي جهة مانحة و fluorophore يقبلون واحد، مع عينة المعطل تداولها سطح الثوابت معدل للجميع لاحظ التغييرات كونفورماشونال. ومع ذلك، عندما يتعلق الأمر بالتفاعلات التي تؤثر على موقع ربط واحد أو أكثر، هذه الأساليب لا تزال محدودة والمعلومات المتعلقة بالتفاعلات العلاقة المحتملة للاثنين (أو أكثر) سيكون متاحاً عن طريق الاستنتاجات غير المباشرة من مجموعة من التجارب فقط.
سمفريت متعدد الألوان4،5،،من67،،من89 يتيح الفرصة لدراسة التفاعل بين هذه المكونات مباشرة، في الوقت الحقيقي، وتحت 10من شروط قرب الفسيولوجية. وهذا يسمح أحد للتحقيق على سبيل المثال، ربط تعتمد على تكيف يجند أو البروتين8،،من911. النهج العام للمقدمة هنا لتسمية protein(s) الفائدة في مواقف محددة، تعلق بروتين واحد على سطح الدائرة بالقياس، وتتبع شدة الأسفار على مر الزمن في تيرفم نوع المنشور (للتفاصيل انظر 9 , 12). يمكن تحديده بالقرب المكاني من صبغات مختلفة ثم من نقل الطاقة بين البلدين. تصنيف استراتيجيات تختلف من البروتين للبروتين (استعرض في 13) وتوجد مبادئ توجيهية لتجنب القطع الأثرية في القياسات سمفريت14.
منذ صبغة الجهات مانحة قد نقل الطاقة إلى الأصباغ يقبلون مختلفة في تجربة سمفريت متعدد ألوان، الموضع النسبي لجميع الأصباغ غير قابل للوصول من الإثارة لصبغ واحد وحدها15،16. ولكن في تركيبة مع التناوب الإثارة الليزر (أليكس17، و استعرضت في 18) يوفر هذا الأسلوب جميع المعلومات الزمانية في الثانية الفرعية والقرار الفرعي نانومتر.
في رأس مال، حساب عالية الدقة يمكن أن يتحقق من المعلومات الهيكلية باستخدام المسافات بين صبغ من الجمع بين جميع الأسفار الكثافات في تجربة سمفريت متعدد ألوان مع أليكس. ومع ذلك، نركز هنا على تحديد هوية الدولة والانفصال، فضلا عن استخراج النماذج الحركية، حيث سمفريت متعدد الألوان أمر لا غنى عنه. عندما المطلوب هو "فقط" هيكل التصميم بالتثليث، مجموعة من التجارب سمفريت اللونين أبسط مع نسبة الإشارة إلى الضوضاء عالية يمكن أداء12،19.
ونحن نستخدم fluorescence جزئي ( ) كوكيل لنقل الطاقة بين اثنين فلوروفوريس7. PF يحسب من الأسفار كثافة مماثلة لكفاءة الحنق تجربة اللونين:
) كوكيل لنقل الطاقة بين اثنين فلوروفوريس7. PF يحسب من الأسفار كثافة مماثلة لكفاءة الحنق تجربة اللونين:

فيها، 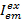 الكثافة في الانبعاثات قناة م بعد الإثارة مع اللون السابق، وهو ج يقبلون مع الطول الموجي الأطول. وتمثل قنوات الكشف عن نفس الموقف في الدائرة عينة ولكن سجل نطاقات طيفية مختلفة من الضوء الفلورية. يتم استخدام نفس المعرف للإثارة والانبعاثات في هذا البروتوكول (أي، "الأزرق"، "الخضراء"، و "أحمر").
الكثافة في الانبعاثات قناة م بعد الإثارة مع اللون السابق، وهو ج يقبلون مع الطول الموجي الأطول. وتمثل قنوات الكشف عن نفس الموقف في الدائرة عينة ولكن سجل نطاقات طيفية مختلفة من الضوء الفلورية. يتم استخدام نفس المعرف للإثارة والانبعاثات في هذا البروتوكول (أي، "الأزرق"، "الخضراء"، و "أحمر").
بسبب قصور تجريبية تعتمد كثافة fluorescence يقاس ليس فقط في نقل الطاقة ولكن أيضا على خصائص فلوروفوري والإعداد. بغية الحصول على كفاءة نقل الطاقة الحقيقية بين هذين فلوروفوريس، قد كثافات المقاسة ينبغي تصحيحها. يستند الإجراء التالي على المرجع9. عوامل التصحيح للتسرب الظاهر (lk، أي مكان مخصص للكشف عن الفوتونات من فلوروفوري في قناة لصبغ آخر) وغاما الظاهر (ag، أي العائد الكم الأسفار من الصبغة الكشف عن كفاءة القناة) تم الحصول عليها من آثار جزيء واحد تظهر يقبلون تبيض الحدث.
تسرب الصبغة المانحين في كل قناة يقبلون ممكن يتم حسابها من كافة نقاط البيانات في آثار fluorescence مسجل فيها مقصور صبغ يقبلون لكن الجهة المانحة لا تزال الفلورسنت (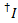 ):
):
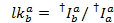
الوسيط للرسم البياني التسرب كعامل التسرب الظاهر. بعد التصحيح للتسرب، يتم تحديد معامل جاما الظاهر من نفس المجموعة من آثار. فإنه يحسب بقسمة تغير الأسفار في قناة يقبلون على التغيير للأسفار في قناة المانحين على تبييض لصبغ يقبلون:

حيث c هو مرة أخرى قناة كشف يقبلون مع الطول الموجي الأطول. الوسيط لتوزيع الناتج كعامل التصحيح الظاهر.
يتم الحصول على كثافة تصحيحها في كل قناة من:
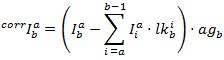
ثم يتم حساب الجبهة الوطنية استناداً إلى:

يمكن فصل مختلف قطاعات السكان في الفضاء المتعدد الأبعاد موزعة حسب PFs. الموقف وعرض كل دولة يتحدد باحتواء البيانات مع وظائف الضبابي متعدد الأبعاد. التحسين اللاحقة من هم عالمي واحد استناداً إلى جميع آثار PF يوفر وصفاً كمياً للحركية الملحوظة. حتى التغيرات الصغيرة معدلات قابلة للاكتشاف.
هممس توفر طريقة لاستنتاج نموذج دولة من مجموعة من آثار الوقت صاخبة. هذا النظام يعتبر أن في واحدة من مجموعة منفصلة، الدول المخفية في أي وقت من الأوقات والمراقبة الفعلية (أي الانبعاثات) دالة احتمالية لهذه الدولة الخفية20. في حالة البيانات سمفريت تيرفم، الانبعاثات الاحتمالات بأنا كل دولة وأنا يمكن أن تكون على غرار بوظائف مستمرة الكثافة الاحتمالية الضبابي. في نقاط زمنية منفصلة متباعدة بشكل منتظم، يمكن أن يحدث الانتقال من واحد إلى دولة أخرى وفقا لاحتمال انتقال الثابتة على الوقت ويعتمد فقط على الحالة الراهنة. مصفوفة الانتقال A يحتوي على هذه الاحتمالات الانتقال ij بين جميع الدول المخفية. توزيع الدولة الأولى  يعطي على الاحتمالات الخاصة بالدولة
يعطي على الاحتمالات الخاصة بالدولة 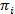 لأول مرة نقطة تتبع الوقت. استخدام نهج الحد الأقصى-احتمال، يمكن تحسين هذه المعلمات لأفضل وصف البيانات مع الأمام-للخلف واوم-ولش خوارزميات20،21. وهذا ينتج المقدرات الحد الأقصى لاحتمال (MLE). وأخيراً، يمكن الاستدلال على تسلسل الدولة التي أنتجت على الأرجح مسار الملاحظات مع خوارزمية Viterbi. خلافا لغيرها من التحليلات هم سمفريت البيانات24،،من25إلى26 نحن لا نستخدم هم كمجرد "تجانس" من البيانات ولكن استخراج نموذج الدولة الحركية من مجموعة البيانات بدون الحاجة لتركيب الوقت يسكن 27من رسوم بيانية. ويتم تحليل هم مع البرامج النصية الداخلية باستخدام برو إيغور. ويستند تنفيذ المدونة مرجع21. نحن توفير مجموعة البرمجيات والبيانات النموذجية على لدينا صفحة ويب كي تتبع القسمين 5 و 6 من هذا البروتوكول (https://www.singlemolecule.uni-freiburg.de/software/3d-fret). البرنامج الكامل متاح عند الطلب.
لأول مرة نقطة تتبع الوقت. استخدام نهج الحد الأقصى-احتمال، يمكن تحسين هذه المعلمات لأفضل وصف البيانات مع الأمام-للخلف واوم-ولش خوارزميات20،21. وهذا ينتج المقدرات الحد الأقصى لاحتمال (MLE). وأخيراً، يمكن الاستدلال على تسلسل الدولة التي أنتجت على الأرجح مسار الملاحظات مع خوارزمية Viterbi. خلافا لغيرها من التحليلات هم سمفريت البيانات24،،من25إلى26 نحن لا نستخدم هم كمجرد "تجانس" من البيانات ولكن استخراج نموذج الدولة الحركية من مجموعة البيانات بدون الحاجة لتركيب الوقت يسكن 27من رسوم بيانية. ويتم تحليل هم مع البرامج النصية الداخلية باستخدام برو إيغور. ويستند تنفيذ المدونة مرجع21. نحن توفير مجموعة البرمجيات والبيانات النموذجية على لدينا صفحة ويب كي تتبع القسمين 5 و 6 من هذا البروتوكول (https://www.singlemolecule.uni-freiburg.de/software/3d-fret). البرنامج الكامل متاح عند الطلب.
الوقت النقاط في البيانات مع الجبهة الوطنية <-1 أو PF > يتم تعيين 2 في أي قناة الكشف عن احتمال انبعاث الحد الأدنى لجميع الدول (10-200). وهذا ما يمنع التحولات المصطنعة في نقاط البيانات هذه.
يتم الحصول على المعلمات لاحتمالات الانبعاثات من تناسب الرسم البياني PF 3D مع وظائف الضبابي كما هو موضح في الخطوة 5، 7. وتحفظ هذه المعلمات ثابتة خلال الاستغلال الأمثل هم.
في النهج الذي قدم، تستخدم مصفوفة الانتقال وناقلات توزيع الدولة الأولى عالمياً لوصف فرقة كاملة من آثار. يتم تحديثها استناداً إلى جميع الجزيئات N من مجموعة البيانات وفقا لمرجعية27.
يتم تحديد معلمات البدء لتوزيع الدولة الأولى من إسقاطات 2D من الرسم البياني PF (الخطوة 5، 3) واحتمالات الانتقال يتم تعيين إلى 0.05 استثناء الاحتمالات البقاء في الدولة نفسها، التي يتم اختيار هذه أن احتمال مغادرة دولة معينة هو تطبيع للوحدة.
يتم استخدام أسلوب تنميط احتمال إعطاء فواصل الثقة (رابطة الدول المستقلة) لكل مرحلة انتقالية معدلات21،22، التي تكون بمثابة تقديرات ذات مغزى لعدم اليقين. لحساب حدود كاريتاس الدولية لمعدل معين، هو ثابت احتمال انتقال الاهتمام إلى قيمة أخرى MLE. وهذا ينتج λ نموذج اختبار '. اختبار نسبة (LR) احتمال من احتمالات 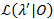 نظراً لمجموعة البيانات تتم 0 استناداً إلى:
نظراً لمجموعة البيانات تتم 0 استناداً إلى:
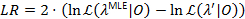
الثقة 95% ملزمة للتوصل إلى المعلمة عندما يتجاوز LR 3.841، كانتيل 95% من س2-التوزيع مع واحد من22،درجة من الحرية23.
هو أظهرت قوة الأسلوب باستخدام في Hsp90. هذا البروتين وفيرة وجدت في البكتريا، وحقيقيات النوى، وهو جزء من استجابة الإجهاد الخلوية28. وهدف المخدرات واعدة في علاج السرطان29. Hsp90 هوموديمير مع جيب ملزم النوكليوتيدات واحدة في المجال الطرفي ن لكل وحدة فرعية30. أنه يمكن أن يخضع للتحولات بين اثنين على الأقل والتشكلات متميزة على الصعيد العالمي، واحدة مغلقة و أحد الطرفي ن تكيف مفتوحة، على شكل V،19،31،32. طبيعة dimeric مباشرة يثير مسألة التفاعل بين هذين الموقعين النوكليوتيدات ملزمة في Hsp90.
في ما يلي، نقدم بروتوكول خطوة بخطوة للحصول على البيانات وتحليلها لتجربة ألوان سمفريت الخميرة Hsp90 والنوكليوتيدات. ربط تعتمد على تكيف PNP أمبير المسمى فلوريسسينتلي (PNP أمبير *، النظير غير هيدروليزابل من ATP) يتم تحليل. تطبيق الإجراء وصف تصاريح دراسة الربط النوكليوتيدات، وفي نفس الوقت التغييرات كونفورماشونال من Hsp90 ومما يكشف عن كوبيراتيفيتي بين اثنين النوكليوتيدات ملزمة جيوب Hsp90.
Protocol
1-الإعداد والشروط المسبقة
- إجراء القياسات سمفريت متعدد الألوان على تيرفم نوع المنشور. وصف إعداد اللونين كما يرد منشور جوف مرجع12.
- بناء تيرفم متعدد ألوان. بالتفصيل تخطيط عام في 9.
- استخدام التحويل، ضخ صمام ثنائي ليزر الحالة الصلبة موجات مستمرة، مما يغني عن استخدام مصاريع الميكانيكية في مسارات الإثارة.
- توظيف المنشور غير المتماثلة، وممدود يمنع انعكاس شعاع الإثارة من الجانب الخلفي لإدخال الهدف مرة أخرى.
- استخدام عدسات والسليكا فوسيد اللاصقة متعامي 2 بوصة في مسارات الكشف الذي جمع الكثير من الضوء قدر الإمكان ومنع السيارات-الأسفار والانحرافات، مثلاً، من التشوهات في مناطق خارج مركز الصورة.
- تركز كل مسار الكشف على الرقاقة امككد مع عدسة منفصلة. يسمح هذا التركيز الأمثل لكل قناة الكشف.
تنبيه: تستخدم فئة 3B أشعة الليزر في تيرفم. وهذا يعني أنها خطرة إذا العين يتم كشفها مباشرة، ولكن الأفكار المتفرقة غير ضارة. ضمان الامتثال لليزر احتياطات السلامة وفقا للوائح الحكومية المحلية قبل أن يتم تشغيل النظام.
- تحديد عوامل التصحيح لخصائص الإعداد و fluorophore مسبقاً باستخدام عينات دسدنا.
- استخدام عينة دسدنا الحنق عالية واحدة لكل صبغة في تركيبة مع يقبلون وجود الطول الموجي الإثارة أطول (للإعداد المقدمة: Atto488-Atto647N، Atto550-Atto647N، Atto594-Atto647N). تأكد من أن بالإضافة إلى ذلك يتم تعديل الحمض النووي مع بيوتين.
- تمييع العينة إلى 5 نانومتر مع تنم المخزن المؤقت (5 ملم تريس pH 7.5، 5 ملم كلوريد الصوديوم، 20 مم مجكل2) و 2 مم ترولوكس (استخدم هذا المخزن المؤقت أيضا للقياس).
- شل دسدنا كما هو موضح ل Hsp90 في الخطوات 2.5 و 2.7.
- حساب عوامل تصحيح التسرب الظاهر (lk) وجاما (ag) الظاهر من آثار جزيء واحد تظهر حدث تبيض يقبلون.
- بناء حجرة تدفق شطيرة شريحة الكوارتز تخميلها الوتد/البيوتين-شماعة، طبقة رقيقة هو مادة لاصقة على كلا الجانبين، وكشف الغطاء. لتفاصيل البروتوكولات لتنظيف الكوارتز الشرائح والتخميل انظر المرجع9.
- مرو سميكة (3 مم) استخدام الشرائح لمنع هندسيا جمع ضوء الليزر المنتشرة في الواجهة الكوارتز-الجلسرين-الكوارتز بين المنشور والشريحة الكوارتز فونكتيوناليزيد.
- استخدام رقيقة (40 ميكرومتر) ختم الفيلم الذي يتم رشها بمادة لاصقة على الجانب غير لاصقة. الفيلم رقيقة يقلل المسافة بين جزيئات السطح-المرفقة والهدف. الحرارة إلى 80 درجة مئوية ثم اضغط على.
- ضع بكشف الغطاء في الأعلى. الحرارة إلى 80 درجة مئوية ثم اضغط على. استخدم قطره والغليسيرول عند وضع الدائرة تدفق على المنشور.
ملاحظة: المواد المنشور والشرائح الكوارتز، فضلا عن والغليسيرول الفهرس المطابقة.
- وأعرب عن Hsp90 من Saccharomyces cerevisiae في شكل طفرات نقطة سيستين واحد اثنين في المواقف التي D61 أو Q385. إضافة فكرة لفائف ملفوف ج--المحطة طرفية لمنع تفكك ديمر تركيزات بيكومولار. تسمية بروتينات متحولة كل على حدة وتبادل مونومرات للحصول على هيتيروديميرس المسمى Atto488 في موقف من الأحماض الأمينية 61 و Atto550 في الحمض الأميني موقف 3859.
2-قياس
- بدء تشغيل برنامج الكاميرا وتعيين معلمات التصوير كما هو موضح أدناه:
- ضبط درجة حرارة لاستشعار التبريد منخفضا قدر الإمكان (-95 درجة مئوية مع تبريد المياه الخارجية) لتقليل الضوضاء الحالية الظلام.
- استخدام إعدادات الكاميرا التي هي الأمثل لتسجيل جزيء واحد: 3.3 المايكروثانيه سرعة الانتقال الرأسي، الجهد العادي عمودي على مدار الساعة، 17 ميغا هرتز 16 بت أفقي تلا، قبل التضخيم كسب 3، اكتساب إلكترون مضاعف 1,000.
- قم بتحريك للحصول على "الخارجية" ووقت التعرض للسيدة 70 سجل الأفلام بطول 750 اقتناء دورات.
ملاحظة: إيقاف تشغيل ضوء الغرفة عندما يتم الحصول على الكاميرا لمنع تشبع من أجهزة الاستشعار امككد.
- قم بإنشاء مجلد على فرقة محلية للقياس. في البرنامج تذهب إلى رايدر < الحفظ التلقائي > إعدادات وتمكين الحفظ التلقائي < > واختر تنسيق ملف "المشاجرة" للحصول على الفيلم. حدد مجلد على فرقة كموقع الحفظ التلقائي.
- بدء تشغيل البرامج التي مصاريع عامل تصفية الانضباطي المراقبة البصرية أكوستو (أوتف)، والبرنامج الذي يتحكم في العملية الليزر والبرنامج المشغل يقوم بمزامنة الليزر، أوتف، في الكشف عن المسار، والكاميرات. ضبط السلطة الليزر مع أوتف (ca. 3 ميغاواط قبل إدخال منظور) وتحميل نمط تحريك الصحيح.
- جبل صاحب العينة مع المنشور وقاعة تدفق وإرفاق الأنابيب ووضع أنابيب مدخل في كأس ميكروسينتريفوجي وتوصيل الأنابيب منفذ لمضخة الحقن. مسح الدائرة مع حوالي 150 ميليلتر العازلة، ومحاذاة الإثارة شعاع، والتركيز. بليتش أي ملوثات الفلورسنت على السطح التي تتحرك ببطء على الكشف عن كامل نطاق الشريحة مع قوة ليزر حوالي 10 ميغاواط لكل أجهزة الليزر. وهذا يأخذ حوالي 1 ساعة.
ملاحظة: إذا لم ينص على خلاف ذلك، يحتوي المخزن المؤقت المستخدمة 40 مم هيبيس درجة الحموضة 7.5، 150 مم بوكل، و 10 مم مجكل2. - تدفق ما يقرب من 300 ميليلتر لحل نيوترافيدين (0.25 مغ/مل في المخزن المؤقت) في الدائرة واحتضانها للحد الأدنى 1 تدفق خارج نيوترافيدين غير منضم مع ميليلتر المخزن المؤقت وتدفق ما يقرب من 300 من حل جيش صرب البوسنة (0.5 ملغ/مل في المخزن المؤقت) عن طريق الدائرة.
ملاحظة: هذه الكتلة المتبقية الروغان السطحية العيوب من الامتزاز غير محدد لجيش صرب البوسنة إلى السطح. - شل العينة عن طريق تحميل الدائرة تدفق مع حوالي 150 ميليلتر من بيوتينيلاتيد والمسمى Hsp90 في ارتفاع تركيزات (مخففة في المخزن المؤقت + 0.5 ملغ/مل جيش صرب البوسنة) حتى يتم التوصل إلى كثافة سطحية كافية، وهي عادة ما تكون الحالة بتركيز من 5-10:00 م. تغسل البروتين غير منضم مع حوالي 300 ميليلتر العازلة + 0.5 ملغ/مل جيش صرب البوسنة.
- تدفق في 150 ميليلتر من 25 نانومتر PNP أمبير * في المخزن المؤقت + 0.5 ملغ/مل جيش صرب البوسنة. وليكن احتضانها لمدة 5 دقائق وكرر هذه الخطوة مرة واحدة لضمان تركيز النوكليوتيدات الصحيح.
ملاحظة: لإجراء التجارب على حضور إضافية، غير مسمى PNP أمبير، أيضا إضافة ميكرومتر 250 أمبير PNP. - تبدأ بالحصول على البيانات. لمبلغ مناسب للبيانات الحصول على حوالي 20 الأفلام التي تأخذ حوالي 1.5 ساعة.
- نقل موضع قاعة نموذج عمودي على شعاع الإثارة مع السائر بيزو لتغيير مجال الرؤية.
- ضبط التركيز مع z-بيزو يتحكم ارتفاع الهدف إذا لزم الأمر. يجب أن لا يكون هذا ضروريا في كثير من الأحيان عندما شنت قاعة القياس دون الميل.
- إعداد تسجيل الكاميرات بالضغط على < "تأخذ إشارة" > برنامج الكاميرا وبدء دورات الإثارة/اقتناء استخدام الزر < ابدأ > في البرنامج المشغل. ويبدأ هذا الحصول على كثافة الأسفار.
- إجراء تسجيل قناة بتسجيل أول فيلم مع الخرز الفلورسنت التي تظهر الأسفار الانبعاثات في النطاق الطيفي لجميع قنوات الكشف عن برنامج الإعداد. ثم الكشف عن مواقف حبة في الفيلم المعايرة عن طريق البحث عن البقع ألمع وتحديد موقف وسط من ضبابي تلائم الشخصية كثافة. حفظ إحداثيات الخرز التي تم العثور عليها في جميع القنوات وتناسب كلا تعيين الإزاحة في العاشر--وفي اتجاه-ص مع متعدد حدود 2D من درجة ثلاثة9.
3-اختيار آثار جزيء واحد
- ويتم تحليل البيانات مع البرامج النصية الداخلية باستخدام برو إيغور. تحميل كافة البرامج النصية الضرورية عن طريق فتح "iniTIRF.ipf"، وحدد النوع الصحيح من التجربة.
ملاحظة: في ما يلي، < الزر > تحديد عناصر قابلة للنقر في القائمة أو في واجهة المستخدم. يتم الإشارة إلى استدعاءات دالة في علامات اقتباس، مثل "طباعة" Hello World "". يمكن لصق هذه الأوامر في سطر الأوامر للمحترفين إيغور (بدون علامات اقتباس مضمنة). - تأكد من أن يتم تحميل المعلمات لتسجيل القناة الكشف.
- بدء تشغيل واجهة المستخدم الرسومية بواسطة النقر فوق < سمفريت جديدة | تحليل واجهة المستخدم الرسومية >.
- تحميل الأفلام (أي تسلسل الإطارات مع 512 × 512 بكسل مخزنة كرزمة TIFF 16 بت) التي تعقد الكثافة في القنوات الخاصة بكل منها. القيام بذلك بالضغط على الزر < "تحميل الفيلم" > وتحديد الملفات من الكاميرات ما يسمى "سيد" و "الرقيق" واحداً تلو الآخر.
- تحديد مواقف الجزيئات الوحيدة المحتملة عن طريق البحث عن البقع ألمع في مجموع الإطارات الخمسة الأولى في الكشف عن قناة معينة. حساب مواقف المقابلة في جميع قنوات الكشف عن غيرها من تعيين القناة. للحصول على تتبع كثافة الأسفار، مجموع كثافة بكسل مربعا حول المكانة المركزية لكل إطار. القيام بذلك عن طريق الضغط على الزر < "العثور على آثار" > في واجهة المستخدم الرسومية.
ملاحظة: طول الجانب على الساحة (بكسل) وترد عليه: 2 * < مجموع Pxs > + 1. - لكل جزيء، حساب تتبع كثافة خام مشتركة كمجموع لجميع آثار هذا المكان بنفس لون الإثارة. تقييم الشخصية كثافة جزيء في جميع القنوات للمعايير التالية:
- هضبة مسطحة تقريبا في كثافة الخام مشتركة وتبيض واحدة خطوة لجميع ألوان الإثارة، والسلوك أنتيكوريلاتيد في قنوات الكشف الملائمة، والكشف عن ومضان أحمر (تشير إلى الحنق على أمبير-PNP منضم *) مرة واحدة على الأقل داخل تتبع، وأية خطوات متعددة في ومضان أحمر، مما يدل على وجود اثنين PNP أمبير * منضمة إلى واحد Hsp90 ديمر.
- حفظ آثار fluorescence الحال لمزيد من التحليل في حالة الوفاء بهذه المعايير. القيام بذلك بتحديد التتبع مع المؤشر ثم الضغط على الزر < حفظ > في الرسم البياني "الجدول الزمني". يدوياً فحص آثار كثافة في جميع قنوات الكشف عن ثلاثة بعد الإثارة الأزرق لحوالي 200 من الجزيئات للفيلم الواحد.
4-حساب لآثار Fluorescence جزئي
- عرض كل آثار شدة الأسفار لواحدة من الجزيئات المحفوظة. استخدام المؤشرات في الرسم البياني لتحديد النطاقات الزمنية.
- حدد فترة الزمنية حيث يتم المبيضة fluorophores جميع فعلا. كثافة الخلفية يعني يحسب من هذا النطاق وطرح من التتبع كثافة في كل قناة. القيام بذلك عن طريق الضغط على الزر < الخلفية >.
- حدد نطاق الكفاءة الحنق، حيث يقل كلا الأصباغ تعلق على Hsp90 (Atto488 و Atto550) موجودة. تأكد من استبعاد آثار تحتوي على حدث وامض (انظر الشكل 3). هذه الأحداث تتميز كثافة fluorescence المقحمة في قناة واحدة دون حدوث زيادة مصاحبة في أي قناة أخرى.
- حساب آثار PF . القيام بذلك عن طريق الضغط على الزر < احسب PF >. يتم تطبيق عوامل تصحيح المعرفة مسبقاً للتسرب الظاهر (lk) وغاما الظاهر (ag) لكثافة الخام بغية تصحيح للصورة المادية وإعداد خصائص.
5-السكان اختيار وتركيب الرسم البياني ثلاثي الأبعاد
- إزالة الجزيئات التي تظهر نسبة الإشارة إلى الضوضاء منخفضة في آثار PF . تتم إزالة الجزيئات التي تتجاوز الفاصل الزمني [-1؛ 2] في أي تتبع PF لأكثر من 10% الإطارات من مجموعة البيانات. القيام بذلك قبل تنفيذ "RemoveTracesLowSNR()" من "إطار الأوامر".
- حساب الإسقاطات 2D إهمال البيانات PF . الأرض
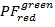 على
على 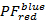 و
و 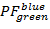 على
على 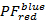 في النطاق [-0.5؛ 1.5] مع قرار سلال 100 × 100. للقيام بذلك، تنفيذ:
في النطاق [-0.5؛ 1.5] مع قرار سلال 100 × 100. للقيام بذلك، تنفيذ:- "HistFret2D (" r_b "،" r_g "، بينهيست = 100)"
- "HistFret2D (" r_b "،" g_b "، بينهيست = 100)؛ 553.5 MoveWindow، 42.5، 1055.25، 508.25 "
- تحديد السكان النسبي لكل دولة يمكن تمييزها في 2D الإسقاطات.
- إحضار الرسم البياني المناسب إلى الأمام وتنفيذ "panelHist2DCount()".
- اضغط على الزر < Init > ورسم مضلع خالية من ناحية حول الذروة.
- انقر فوق الزر < Count >. يتم طباعة عدد نقاط البيانات في المضلع، والعدد الإجمالي لنقاط البيانات في الإسقاط في "إطار الأوامر".
- إعداد رسم بياني ثلاثي الأبعاد للبيانات الجبهة الوطنية المنفذة "HistFret3D (" g_b "،" r_b "،" r_g ")".
- تطبيع الرسم البياني ثلاثي الأبعاد ليتجزأ 1. تنفيذ ما يلي:
- "Fit0 نيوداتافولدير/S"
- "مكررة/س:: بكى: Hist3D، Hist3D"
- "Div/G متغير = sum(Hist3D)*(DimDelta(Hist3D,0)) ^ 3"
- "Hist3D/= div؛ شعبة الطباعة "
- توفر المعلمات الأولية غاوسي 3D تناسب وإعداد هياكل البيانات اللازمة.
- تنفيذ "Gauss3D_initParam()؛ تحرير W_coef_old ".
- إضافة سكان الدولة إلى نهاية الموجه المعلمة.
- تنفيذ "Gauss3D_prepareFit()."
ملاحظة: W_coef_old هو موجه الذي يحمل المعلمات الأولية للاحتواء. وهذا يعني كل دولة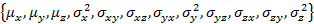 وسكان الدولة، التي هي متصلاً بنهاية الموجه. تأكد من أن مصفوفة التباين المشترك متماثل.
وسكان الدولة، التي هي متصلاً بنهاية الموجه. تأكد من أن مصفوفة التباين المشترك متماثل.
- تتناسب مع مجموع وظائف غاوسي 3D S إلى الرسم البياني PF 3D، مع S يجري العدد الدول يمكن تمييزها.
- تنفيذ "do3D()." وهذا قد يستغرق ساعة أو أكثر في مكتب عادي PC، اعتماداً على نوعية المعلمات الأولية.
- تنفيذ "postprocessFitMultiGauss3D()؛ evalFitMultiGauss3D()؛ تحرير W_coef ".
- عرض النتيجة مناسباً. لكل من هاتين 2D الإسقاطات، استخدم الأوامر التالية:
- "contourPF3D_new(0)؛ contourPF3D_new(1)؛ contourPF3D_new(2)؛ contourPF3D_new(3)؛ contourPF3D_new(4) "
- "contourPF3D_colorize()"
6-الحركية التحليل مع فرقة 3D هم
- إعداد فرقة هم تشغيل لاستخراج المعلومات الحركية. هم واحد هو الأمثل من جميع الجزيئات في مجموعة البيانات. استخدام المعلومات التي تم الحصول عليها في الخطوة السابقة لتحديد الموقف وعرض كل دولة في الفضاء PF 3D.
- تهيئة واجهة المستخدم هم (< هم | Init هم >) واختر العدد المناسب من الدول (وهذا يعني في حالة البيانات Hsp90 < نومستاتيس > = 5)، وعدد من الأبعاد لإشارة الإدخال (< نومديمس > = 3)، ونوع المدخلات (< "نوع الإدخال" > = "الحنق bgr 3D").
- تحسين المعلمات هم بترك البرنامج تتلاقى احتمال هم (تنفيذ "prepENS_CONVERGE_gB(GetDataFolder(1)،-14)") حتى يقع التغيير في مصفوفة الانتقال بالمقارنة مع التكرار السابق عن عتبة (10-14 مجموع التغير المطلق لكل احتمال انتقال). وهذا ينتج MLE لاحتمالات الانتقال في حوالي ساعة في مكتب الكمبيوتر عادي.
- كرر اختيار السكان وتركيب الضبابي، والتحسين هم مجموعات فرعية البيانات (على سبيل المثال، 75% من مجموعة البيانات بالكامل). إذا تم دمج مجموعة البيانات بالكامل من تجارب مختلفة، كرر التحسين أيضا لكل من هذه التجارب واحدة. ويسمح تحليل لمجموعات فرعية لتقدير عدم التيقن من التحديد اليدوي السكان والتباين داخل مجموعة البيانات.
- حساب كاريتاس الدولية لاحتمالات الانتقال، تقرير عن عدم تجانس مجموعة البيانات والدقة في هم.
- الحصول على تقدير تقريبي لحدود CI المنفذة "القرص المضغوط $(الجذر: path3Dimport +" هم ")؛ loop_getCI_estimate_limits(). "
- حساب حدود الضبط من كاريتاس الدولية المنفذة:
- "loop_getCI_HMM_converge(1)"
- "CIresults_conv_new()"
- "مؤتمر نزع السلاح:: HMM_CIresult؛ reportCI_conv() "
- "مؤتمر نزع السلاح:: cmp_CI_conv؛ CI_plot2 ("هم"، دوابيند = 0) "
- تلخيص المعلومات المتاحة لتبسيط التفسير الحركية.
- جمع معلومات حول الوقت النوكليوتيدات مسمى يبقى منضم إلى Hsp90. القيام بذلك بانهيار الدول المنضمة للحزب الوطني التقدمي أمبير * (أي، ق1وق2 وق3، انظر أيضا الشكل 2)، وتجميع الرسم البياني الوقت يسكن. تنفيذ "القرص المضغوط $(الجذر: path3Dimport +" هم ")؛ collapse_states_get_DT({0,1,1,1,0}) "، الذي يجمع بين يسكن من الدول S0 و S4 ، فضلا عن ق1وق2ق3.
- استخراج الأوقات يسكن من المسار Viterbi لكل دولة للفائدة ومقارنة الرسم البياني الوقت يسكن الناتجة عن ظروف تجريبية مختلفة. تنفيذ "plot_collapsed_DT_Hist (wDTo_01110_record1)."
- بالنسبة لصورة أكثر تفصيلاً، انهيار الدول التي متميزة PF لكن متطابقة وظيفيا لتسهيل مواصلة تحليل البيانات، مثلاً، في حالة تجربة ألوان مع المسمى Hsp90 والنوكليوتيدات والدول S2 S 3 يمكن أن تكون مطوية. تنفيذ "collapse_states_get_DT({0,1,2,2,4})."
النتائج
تسمح القياسات سمفريت متعدد الألوان مباشرة الكشف عن العلاقة المتبادلة بين اثنين أو أكثر من مواقع التفاعل متميزة. وهذا يجعل التقنية فريدة من نوعها للتحقيق في نظم متعددة العناصر، مثل مجمعات البروتين. علينا أن نركز على عرض تجربة ألوان سمفريت هنا، هو بمثابة مثال توضيحي.
Discussion
نقدم الإجراءات التجريبية للحصول على بيانات ألوان سمفريت لنظام معقد من بروتين، ووصف خطوة بخطوة لتحليل هذه القياسات. ويوفر هذا النهج إمكانية فريدة لتقييم العلاقة بين عدة مواقع التفاعل أو التغييرات conformational مباشرة.
من أجل الحصول على بيانات جزيء واحد متعدد الألوان مناسبة على ا...
Disclosures
الكتاب يعلن لا تضارب في المصالح.
Acknowledgements
وتمول هذا العمل مؤسسة البحوث الألمانية (أنست 39/969-1) ومجلس البحوث الأوروبية من خلال "منسق الإغاثة الطارئة المنحة" نون 681891.
Materials
| Name | Company | Catalog Number | Comments |
| Setup | |||
| vibration-damped optical table | Newport, Irvine, CA, USA | RS2000 | |
| OBIS 473nm LX 75mW LASER | Coherent Inc, Santa Clara, CA, USA | 1185052 | |
| OBIS 532nm LS 50mW LASER | Coherent Inc, Santa Clara, CA, USA | 1261779 | |
| OBIS 594nm LS 60mW LASER | Coherent Inc, Santa Clara, CA, USA | 1233470 | |
| OBIS 637nm LX 140mW LASER | Coherent Inc, Santa Clara, CA, USA | 1196625 | |
| laser control unit | Coherent Inc, Santa Clara, CA, USA | 1234465 | Scientific Remote |
| aspheric telescope lenses | Thorlabs Inc, Newton, New Jersey, USA | d=25.4mm, f=50mm and f=100mm | |
| CF ex1 | AHF analysentechnik AG, Tübingen, Germany | ZET 473/10 | cleanup filter excitation |
| CF ex2 | AHF analysentechnik AG, Tübingen, Germany | ZET 532/10 | cleanup filter excitation |
| CF ex3 | AHF analysentechnik AG, Tübingen, Germany | ZET 594/10 | cleanup filter excitation |
| CF ex4 | Thorlabs Inc, Newton, New Jersey, USA | FL635-10 | cleanup filter excitation |
| DM ex1 | AHF analysentechnik AG, Tübingen, Germany | ZQ594RDC | dichroic mirror excitation |
| DM ex2 | AHF analysentechnik AG, Tübingen, Germany | 570DCXR | dichroic mirror excitation |
| DM ex3 | AHF analysentechnik AG, Tübingen, Germany | ZQ491RDC | dichroic mirror excitation |
| AOTFnC-Vis | AA Opto-Electronic, Orsay, France | ||
| λ/4 plate | Thorlabs Inc, Newton, New Jersey, USA | AQWP05M-600 | |
| CFI Apo TIRF 100x | Nikon Instruments Inc, Melville, NY, USA | high-NA objective | |
| piezo focus positioner MIPOS 250 CAP | piezosystem jena GmbH, Jena, Germany | Piezo Controller NV 40/1 CLE | |
| piezo stepper | Newport, Irvine, CA, USA | PZA12 | PZC200-KT NanoPZ Actuator Kit |
| achromatic aspheric lenses | Qioptiq Photonics GmbH & Co. KG, Göttingen, Germany | G322-304-000 | d=50mm, f=200mm |
| adjustable optical slit | Owis GmbH, Staufen i. Br., Germany | 27.160.1212 | max. aperture 12 x 12 mm |
| DM det1 | AHF analysentechnik AG, Tübingen, Germany | T 600 LPXR | dichroic mirror detection |
| DM det2 | AHF analysentechnik AG, Tübingen, Germany | H 560 LPXR superflat | dichroic mirror detection |
| DM det3 | AHF analysentechnik AG, Tübingen, Germany | HC BS R635 | dichroic mirror detection |
| BP det1 | AHF analysentechnik AG, Tübingen, Germany | 525/40 BrightLine HC | bandpass filter detection |
| BP det2 | AHF analysentechnik AG, Tübingen, Germany | 586/20 BrightLine HC | bandpass filter detection |
| BP det3 | AHF analysentechnik AG, Tübingen, Germany | 631/36 BrightLine HC | bandpass filter detection |
| BP det4 | AHF analysentechnik AG, Tübingen, Germany | 700/75 ET Bandpass | bandpass filter detection |
| optical shutters detection | Vincent Associates, Rochester, NY, USA | Uniblitz VS25S2T0 | |
| EMCCD iXon Ultra 897 | Andor Technology Ltd, Belfast, Northern Ireland | ||
| digital I/O card, PCIe-6535 | National Instruments, Austin, Texas, USA | ||
| syringe pump | Harvard Apparatus, Holliston, MA, USA | PHD22/2000 | |
| Name | Company | Catalog Number | Comments |
| Flow chamber | |||
| quartz slides | G. Finkenbeiner Inc, Waltham, MA, USA | Spectrosil2000, h=3mm | |
| TEGADERM film | 3M Deutschland GmbH, Neuss, Germany | 1626W | 10 x 12cm |
| spray adhesive | 3M Deutschland GmbH, Neuss, Germany | Photo Mount 050777 | |
| glycerol | Carl Zeiss AG, Oberkochen, Germany | Immersol G | |
| immersion oil | OLYMPUS EUROPA SE & CO. KG, Hamburg, Germany | IMMOIL-F30CC | |
| prism | Vogelsberger Quarzglastechnik GmbH, Hauzenberg, Germany | Suprasil1 | |
| aluminium prism holder | custom built | ||
| hollow setscrews | Thorlabs Inc, Newton, New Jersey, USA | with custom drilling | |
| Tygon S3 E-3603 tubing | neoLab Migge GmbH, Heidelberg, Germany | 2-4450 | ACF00001 |
| PTFE tubing | Bohlender GmbH, Grünsfeld, Germany | S1810-08 | |
| Name | Company | Catalog Number | Comments |
| Sample | |||
| yeast Hsp90 D61C, Q385C_biotin | UniProt ID P02829 | ||
| Maleimide derivatives of Atto488, Atto550 | ATTO-TEC GmbH, Siegen, Germany | ||
| AMP-PNP* | Jena Bioscience, Jena, Germany | γ-[(6-Aminohexyl)-imido]-AMP-PNP-Atto647N | |
| Fluospheres | Thermo Fisher Scientific, Waltham, MA, USA | F8764 | amine-modified, 0.2 μm, yellow-green fluorescent |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Andor Solis | Andor Technology Ltd, Belfast, Northern Ireland | version 4.30 | |
| LabVIEW | National Instruments, Austin, Texas, USA | version 2012, 32bit; misc. hardware control | |
| MDS control software | AA Opto-Electronic, Orsay, France | version 2.03a | |
| Coherent Connection | Coherent Inc, Santa Clara, CA, USA | version 3 | |
| Igor Pro | WaveMetrics Inc, Portland, OR, USA | version 6.37 |
References
- Nooren, I. M. A., Thornton, J. M. Diversity of protein-protein interactions. EMBO J. 22 (14), 3486-3492 (2003).
- Marsh, J. A., Teichmann, S. A. Structure, dynamics, assembly, and evolution of protein complexes. Annu Rev Biochem. 84, 551-575 (2015).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Hohng, S., Joo, C., Ha, T. Single-Molecule Three-Color FRET. Biophys J. 87 (2), 1328-1337 (2004).
- Person, B., Stein, I. H., Steinhauer, C., Vogelsang, J., Tinnefeld, P. Correlated movement and bending of nucleic acid structures visualized by multicolor single-molecule spectroscopy. ChemPhysChem. 10 (9-10), 1455-1460 (2009).
- Lee, J., Lee, S., Ragunathan, K., Joo, C., Ha, T., Hohng, S. Single-molecule four-color FRET. Angew Chem Int Ed. 49 (51), 9922-9925 (2010).
- Ratzke, C., Berkemeier, F., Hugel, T. Heat shock protein 90's mechanochemical cycle is dominated by thermal fluctuations. Proc Natl Acad Sci U S A. 109 (1), 161-166 (2012).
- Ratzke, C., Hellenkamp, B., Hugel, T. Four-colour FRET reveals directionality in the Hsp90 multicomponent machinery. Nat Commun. 5, 4192 (2014).
- Götz, M., Wortmann, P., Schmid, S., Hugel, T. A Multicolor Single-Molecule FRET Approach to Study Protein Dynamics and Interactions Simultaneously. Methods Enzymol. 581, 487-516 (2016).
- Yengo, C. M., Berger, C. L. Fluorescence anisotropy and resonance energy transfer: Powerful tools for measuring real time protein dynamics in a physiological environment. Curr Opin Pharmacol. 10 (6), 731-737 (2010).
- Wortmann,P , ., Götz M, ., Hugel T , . Cooperative Nucleotide Binding in Hsp90 and Its Regulation by Aha1. Biophys J. 113, 1711-1718 (2017).
- Dörfler, T., Eilert, T., Röcker, C., Nagy, J., Michaelis, J. Structural Information from Single-molecule FRET Experiments Using the Fast Nano-positioning System. J Vis Exp. (120), e54782 (2017).
- Stephanopoulos, N., Francis, M. B. Choosing an effective protein bioconjugation strategy. Nature chemical biology. 7 (12), 876-884 (2011).
- Sánchez-Rico, C., Voith von Voithenberg, L., Warner, L., Lamb, D. C., Sattler, M. Effects of Fluorophore Attachment on Protein Conformation and Dynamics Studied by spFRET and NMR Spectroscopy. Chemistry (Weinheim an der Bergstrasse, Germany). , (2017).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nat Methods. 5 (6), 507-516 (2008).
- Lee, N. K., et al. Three-color alternating-laser excitation of single molecules: monitoring multiple interactions and distances. Biophys J. 92 (1), 303-312 (2007).
- Kapanidis, A. N., Lee, N. K., Laurence, T. A., Doose, S., Margeat, E., Weiss, S. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proc Natl Acad Sci U S A. 101 (24), 8936-8941 (2004).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chem Soc Rev. 43 (4), 1156-1171 (2014).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nat Methods. 14, 174-180 (2017).
- Rabiner, L. R. A tutorial on hidden Markov models and selected applications in speech recognition. Proc IEEE. 77 (2), 257-286 (1989).
- Fink, G. A. . Markov Models for Pattern Recognition. , (2014).
- Giudici, P., Ryden, T., Vandekerkhove, P. Likelihood-Ratio Tests for Hidden Markov Models. Biometrics. 56 (3), 742-747 (2000).
- Visser, I., Raijmakers, M. E. J., Molenaar, P. C. M. Confidence intervals for hidden Markov model parameters. Br J Math Stat Psychol. 53 (2), 317-327 (2000).
- McKinney, S. A., Joo, C., Ha, T. Analysis of Single-Molecule FRET Trajectories Using Hidden Markov Modeling. Biophys J. 91 (5), 1941-1951 (2006).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L., Wiggins, C. H. Learning Rates and States from Biophysical Time Series: A Bayesian Approach to Model Selection and Single-Molecule FRET Data. Biophys J. 97 (12), 3196-3205 (2009).
- Greenfeld, M., Pavlichin, D. S., Mabuchi, H., Herschlag, D. Single Molecule Analysis Research Tool (SMART): an integrated approach for analyzing single molecule data. PLoS ONE. 7 (2), e30024 (2012).
- Schmid, S., Götz, M., Hugel, T. Single-Molecule Analysis beyond Dwell Times: Demonstration and Assessment in and out of Equilibrium. Biophys J. 111 (7), 1375-1384 (2016).
- Taipale, M., Jarosz, D. F., Lindquist, S. HSP90 at the hub of protein homeostasis: emerging mechanistic insights. Nat Rev Mol Cell Biol. 11 (7), 515-528 (2010).
- Trepel, J., Mollapour, M., Giaccone, G., Neckers, L. Targeting the dynamic HSP90 complex in cancer. Nat Rev Cancer. 10 (8), 537-549 (2010).
- Wayne, N., Bolon, D. N. Dimerization of Hsp90 is required for in vivo function. Design and analysis of monomers and dimers. J Biol Chem. 282 (48), 35386-35395 (2007).
- Ali, M. M. U., et al. Crystal structure of an Hsp90-nucleotide-p23/Sba1 closed chaperone complex. Nature. 440 (7087), 1013-1017 (2006).
- Southworth, D. R., Agard, D. A. Species-dependent ensembles of conserved conformational states define the Hsp90 chaperone ATPase cycle. Mol Cell. 32 (5), 631-640 (2008).
- Blanchard, S. C., Kim, H. D., Gonzalez, R. L., Puglisi, J. D., Chu, S. tRNA dynamics on the ribosome during translation. Proc Natl Acad Sci U S A. 101 (35), 12893-12898 (2004).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophys J. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
- Rognoni, L., Stigler, J., Pelz, B., Ylänne, J., Rief, M. Dynamic force sensing of filamin revealed in single-molecule experiments. Proc Natl Acad Sci U S A. 109 (48), 19679-19684 (2012).
- Okumus, B., Wilson, T. J., Lilley, D. M. J., Ha, T. Vesicle encapsulation studies reveal that single molecule ribozyme heterogeneities are intrinsic. Biophys J. 87 (4), 2798-2806 (2004).
- Boukobza, E., Sonnenfeld, A., Haran, G. Immobilization in Surface-Tethered Lipid Vesicles as a New Tool for Single Biomolecule Spectroscopy. J Phys Chem B. 105 (48), 12165-12170 (2001).
- Levene, M. J., Korlach, J., Turner, S. W., Foquet, M., Craighead, H. G., Webb, W. W. Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299 (5607), 682-686 (2003).
- Panaretou, B., et al. ATP binding and hydrolysis are essential to the function of the Hsp90 molecular chaperone in vivo. EMBO J. 17 (16), 4829-4836 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved