A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس ديفورمابيليتي وعدم تجانس الخلايا الحمراء في الدم من اكتاسيتوميتري
* These authors contributed equally
In This Article
Summary
وهنا يقدم تقنيات لقياس ديفورمابيليتي الخلايا الحمراء وعدم تجانس الخلوية اكتاسيتوميتري. هذه التقنيات قابلة للتطبيق للتحقيقات العامة من ديفورمابيليتي الخلايا الحمراء وتحقيقات محددة من أمراض الدم التي تتميز بوجود كل جامدة وتشوه الخلايا الحمراء في الدورة الدموية، مثل الأنيميا المنجلية.
Abstract
ديفورمابيليتي انخفاض الأحمر الخلية من سمات العديد من الاضطرابات. وفي بعض الحالات، يمكن التنبؤ بمدى ديفورمابيليتي عيب شدة المرض أو حدوث مضاعفات خطيرة. اكتاسيتوميتري استخدامات الليزر فيسكوميتري الحيود لقياس ديفورمابيليتي خلايا الدم الحمراء رهنا بزيادة إجهاد القص أو تدرج التناضحي في قيمة ثابتة لإجهاد القص المطبقة. قياسات ديفورمابيليتي المباشر غير يصعب تفسيره عند قياس ايربان الدم التي تتميز بوجود خلايا الأحمر جامدة وتشوه على حد سواء. وهذا بسبب عدم قدرة الخلايا جامدة لمحاذاة بشكل صحيح في استجابة لإجهاد القص والنتائج في نمط حيود مشوهة تميزت بانخفاض مبالغ فيها في الظاهر ديفورمابيليتي. قياس درجة التشويه توفر مؤشرا لعدم تجانس الكريات الحمراء في الدم. في الأنيميا المنجلية، وهذا يرتبط بالنسبة المئوية للخلايا صلبة، مما يعكس تركيز الهيموغلوبين وتكوين الهيموغلوبين الكريات الحمراء. بالإضافة إلى قياس ديفورمابيليتي، اكتاسيتوميتري التدرج ناضح يوفر معلومات حول هشاشة ناضح وترطيب مركز الكريات الحمراء. وتعكس هذه المعلمات أيضا تكوين الهيموغلوبين في خلايا الدم الحمراء من مرضى فقر الدم المنجلي. اكتاسيتوميتري تدابير ديفورمابيليتي في سكان خلايا الحمراء ولا، ولذلك، تقديم معلومات عن ديفورمابيليتي أو الخواص الميكانيكية للكريات الحمراء الفردية. بغض النظر، هدف الأساليب الموصوفة في هذه الوثيقة توفير وسيلة ملائمة وموثوق بها لقياس ديفورمابيليتي وعدم تجانس الخلوية للدم. قد تكون هذه التقنيات مفيدة لرصد التغيرات الزمنية، فضلا عن تطور المرض والاستجابة للتدخل العلاجي في العديد من الاضطرابات. الأنيميا المنجلية مثال تتسم جيدا. وتشمل الاضطرابات المحتملة الأخرى فيها القياسات ديفورمابيليتي الخلية الحمراء و/أو عدم التجانس لمصلحة تخزين الدم والسكري وعدوى المتصورة ، ونقص الحديد وفقر الدم الانحلالي سبب عيوب الغشاء.
Introduction
اكتاسيتوميتري توفر قدرا ملائماً من ديفورمابيليتي الخلايا الحمراء في الاستجابة إلى تغييرات في إجهاد القص (يتم قياسها في بسكالس (السلطة الفلسطينية)) أو تعليق osmolality المتوسطة. تتضمن معلمات ذات الصلة من ديفورمابيليتي الخلايا الحمراء مؤشر أقصى استطالة (الصناعات الاستخراجية كحد أقصى)، وتدبير ديفورمابيليتي الحد الأقصى من خلية الأحمر ردا على تزايد إجهاد القص، وإجهاد القص ½ (SS ½)، إجهاد القص المطلوبة لتحقيق النصف الأعلى ديفورمابيليتي. 1 اكتاسيتوميتري التدرج ناضح له العديد من المعلمات الزاخر بالمعلومات. وتشمل هذه الفهرس الاستطالة الدنيا (الصناعات الاستخراجية دقيقة)، ومقياس لنسبة السطح إلى الحجم و osmolality الذي يحدث (س دقيقة)، وهو مقياس لهشاشة ناضح. ماكس الصناعات الاستخراجية و osmolality الذي يحدث ذلك (س (الصناعات الاستخراجية كحد أقصى)) معلومات عن المساحة السطحية غشاء خلية والمرونة. ويمثل نصف الاستطالة القصوى في الذراع مكثف التدرج ناضح فرط الصناعات الاستخراجية. الصناعات الاستخراجية فرط و osmolality الذي يحدث، يا المفرط، توفر معلومات حول اللزوجة داخل الخلايا الحمراء الخلية التي يتم تحديدها بواسطة تركيز الهيموغلوبين. 2 , 3 قياس ديفورمابيليتي في الدم ايربان يعقدها كون الخلايا جامدة، مثل خلايا الدم الحمراء المنجلية، لا تتم محاذاة بشكل صحيح مع اتجاه تدفق مثل تشوه الخلايا استجابة لزيادة إجهاد القص. بدلاً من إنتاج صورة حيود اهليلجية مميزة، إنتاج خلايا جامدة نمط كروي الذي ينتج نمط حيود على شكل الماس عند تراكب على القطع الناقص التي تنتجها خلايا تشوه. 4 , 5 , 6 قد تبين نمط كروي لتتوافق مع الخلايا المنجلية لا رجعة فيه بأداء اكتاسيتوميتري الكسور معزولة من الخلايا بعد الطرد المركزي الكثافة. 6 حساب الرقم القياسي لاستطالة يشمل تدابير لكلا من محور الطويلة والقصيرة للقطع الناقص؛ ولذلك تنتج شكل الماس انخفاض واضح في استطالة بزيادة عرض المحور قصيرة. 7 وقد سبق ثبت أن درجة التشويه نمط حيود يرتبط ارتباطاً بالنسبة المئوية الهيموغلوبين فقر الدم المنجلي (HbS) والنسبة المئوية للخلايا المنجلية في الدم من المرضى الذين يعانون من الأنيميا المنجلية. يمكن الحصول على 5 درجة التشويه نمط حيود بالتحليلات الرياضية المعقدة. 8 فإنه يمكن أيضا الحصول على عن طريق ضبط فتح فتحه الكاميرا اكتاسيتوميتير أو مستوى البرنامج المناسب لتغيير ارتفاع نمط حيود الرمادية. 5 بيد أن التفاصيل المتعلقة بكيفية ضبط مستوى الرمادية ليست محددة تحديداً جيدا وفتحه الكاميرا ليست متاحة على أحدث جيل من اكتاسيتوميتير المتاحة تجارياً. للالتفاف حول هذه المسائل، يمكن استخدام كسب الكاميرا الوصول إليها بسهولة لضبط نمط حيود مرتفعات. 9 باستخدام هذا الأسلوب لتقدير عدم تجانس الخلوية، يمكن الربط بين درجة التشويه نمط حيود مع النسبة المئوية الهيموغلوبين الجنيني في الدم لدى المرضى الذين يعانون من الأنيميا المنجلية. 10 ترتبط العديد من المعلمات اكتاسيتوميتري التدرج ناضح وبالمثل بالنسبة المئوية للجنين أو المنجل الهيموغلوبين في الدم من المرضى الذين يعانون من الأنيميا المنجلية. حيود نمط تشويه العلاقات المتبادلة المحتمل يعكس مساهمة تكوين الهيموغلوبين إلى النسبة المئوية للخلايا جامدة، غير تشوه. من فوائد إضافية، يخضع الشخصية كاملة اكتاسيتوميتري التدرج ناضح ثنائية الطور التغييرات التي تتوافق مع النسبة المئوية للخلايا كثيفة في الدورة الدموية خلال أزمة الخلايا المنجلية. 11
اكتاسيتوميتري أيضا مفيدة في دراسة العديد من الاضطرابات الأخرى. اكتاسيتوميتري التدرج التناضحي التشخيص لاضطرابات غشاء الخلية الحمراء الموروثة، مثل وراثي spherocytosis ووراثية اليبتوسيتوسيس بيروبويكيلوسيتوسيس وراثية. 3 , 12 , 13 , 14 ديفورمابيليتي انخفاض يحدث في نقص الحديد. 15 استخدمت وصف "الآفة التخزين" للدم اكتاسيتوميتري والدراسات المستقبلية التي تحقق كلا طبيعة الآفة والتدخلات لمنع تشكيلها أثناء التخزين الدم راهن من المرجح أن تستفيد من التقنيات المعروضة هنا. 16 أيضا قد يرتبط انخفاض الخلية الحمراء ديفورمابيليتي مع المرض ميكروفاسكولار في مرض السكري. 17 دراسات حديثة تربط ارتفاع السكر في الدم، تركيزات اسكوربات الخلايا الحمراء وهشاشة ناضح توحي هذه العوامل يمكن أن تكون هامة في تطور المرض ميكروفاسكولار. 18 اكتاسيتوميتري والدراسات تجري حاليا للتحقيق في هذه الفرضية (بارو ليفين، بيانات غير منشورة). الدم مرحلة عدوى الملاريا سبيلاً آخر للاهتمام من التحقيقات ديفورمابيليتي الخلايا الحمراء. ديفورمابيليتي الخلوية المنجلية إصابة خلايا الدم الحمراء يقلل جذريا خلال 48 ساعة نضوج الطفيلي من خاتم مرحلة إلى مرحلة شيزونت داخل الخلايا. وتشير الأدلة إلى أن يتم عكس هذا ديفورمابيليتي انخفاض عند نضوج الطفيلي. العكس يتزامن مع إطلاق سراح خلايا الحمراء المصابة في الدورة الدموية. ويعتقد ديفورمابيليتي انخفض وساطة من البروتينات المتصورة التي تروج لتنحية الخلية الحمراء. 19 هذه الدراسات تمثل عينة صغيرة من الشروط المهمة سريرياً حيث قياس كرات الدم الحمراء ديفورمابيليتي والمعلمات التدرج التناضحي ذات الصلة. وتوجد عدة مجالات إضافية للدراسة.
وتشمل تقنيات بديلة لقياس ديفورمابيليتي الخلايا الحمراء ملاقط بصرية (المعروف أيضا بالفخاخ الليزر) التي تستخدم الخصائص الفيزيائية للفوتونات على امتداد الخلايا الحمراء واحدة في اتجاه واحد أو أكثر. 20 هذا الأسلوب يتميز بقياس ديفورمابيليتي من الكريات الحمراء واحدة، ولكن قد أنتجت بعض عدم اليقين في معايرة القوة تقلب كبير عبر الدراسات 21 وتحليل البيانات يمكن أن تكون كثيفة العمالة ما لم الآلي. 22 تطلع ميكروبيبيتي، الذي يستخدم الضغط السلبي لنضح كرات الدم الحمراء في ميكروبيبيتي، كما استخدمت لقياس ديفورمابيليتي للخلايا الحمراء. 7 , 23 قياسات متعددة، مثل الضغط اللازم لنضح الخلية الحمراء، ممكن مع كل تدبير لتحديد الخصائص المختلفة للخلية الحمراء. 23 مجهر القوة الذرية هو تقنية عالية دقة أن تدابير تصلب الغشاء بالتحديد الكمي لانحراف شعاع الليزر كمؤشر لانحراف ناتئ على طول السطح الخلية الحمراء. 24 هذه التقنيات توفر معلومات حول الكريات الحمراء الفردية، وهي لا تتكيف بسهولة لقياس التغيرات في سكان خلايا الدم الحمراء، و بشكل عام، تتطلب قدرا كبيرا من الخبرة الفنية.
الرغبة في عينة كل من الفرد والسكان من الخلايا في وقت واحد أدى إلى التقدم في مجال التشغيل الآلي للمكاتب وتطوير ميكروفلويديكس والأساليب المستندة إلى الصفيف. مثل اكتاسيتوميتري، رهيوسكوبي يقيس ديفورمابيليتي كدالة لإجهاد القص ولكن الصور يتم الحصول عليها مباشرة عن طريق المجهر. 25 لأعلى من خلال وضع تحليلات، استخدمت التصوير الآلي الخلية لإنتاج التوزيعات ديفورمابيليتي استخدام روسكوب. 26 التغايرية الخلوية يمكن قياسها كمياً باستخدام هذه الطريقة في حالة توفر البيانات من موضوع مراقبة صحية. 27 ميكروفلويديكس تقنيات تسمح أيضا للتحليلات من خلال وضع عالية من خلايا مفردة؛ تصاميم متعددة باستخدام تكييفات للترشيح،28 خلية تحليل المرور العابر،29 الذي يقيس الوقت اللازم لتدفق كرات الدم الحمراء عن طريق ميكروبوري، والبدائل التي تقيس الضغط اللازم لعبور كرات الدم الحمراء بدلاً وقد تم وضع من الساعة 30 . منصة أخرى عالية عن طريق وضع تحليل للخلايا الفردية هو رقاقة الصفيف ميكروتشامبير خلية مفردة، الذي له ميزة إضافية للسماح لتوصيف المتلقين للمعلومات المستندة إلى صف من الخلايا. 31 على الرغم من أن كل من هذه التقنيات يمكن أن تكون مفيدة وقد تكون متفوقة لتطبيقات معينة، تشمل المزايا النسبية اكتاسيتوميتري الحساسية وسهولة الاستخدام، والدقة. 32 أحدث جيل من اكتاسيتوميتيرس المتاحة تجارياً كما تمتلك براعة كبيرة في عدد الاختبارات التي يمكن أن يؤديها.
Access restricted. Please log in or start a trial to view this content.
Protocol
جميع المواضيع في هذه الدراسة أعطى الموافقة الخطية وفقا "إعلان هلسنكي" و "معاهد للصحة المؤسسية استعراض المجلس الوطني" الموافقة على البروتوكولات.
1. تشغيل في اكتاسيتوميتير
- قم بتوصيل الأنابيب من محلول التنظيف الحلول بوفيدون (PVP) أوسمولار المنخفضة والعالية. كن حذراً لتوصيل أنبوب أوسمولار 0 لحل أوسمولار منخفضة وأنبوب أوسمولار 500 لحل أوسمولار عالية.
ملاحظة: حل حماية الأصناف النباتية أوسمولار منخفضة ينبغي أن يكون أوسمولاليتي بين 35 و 55 ميليوسموليس للكيلوغرام الواحد (موسم/كغ)، درجة الحموضة من 7.25-7.45 عند 25 درجة مئوية، واللزوجة بين سينتيبويسي 27.0 و 33.0 (cP) في 37.0 ± 0.5 درجة مئوية. ينبغي أن يكون الحل حماية الأصناف النباتية عالية أوسمولار أوسمولاليتي بين 764 و 804 موسم/كغ، والرقم الهيدروجيني من 7.25-7.45 عند 25 درجة مئوية ومقياس لزوجة من cP 27.0 33.0 في 37.0 ° 0.5 درجة مئوية. - ضمان أن بوب هو خفض تماما في كوب. بدء تشغيل البرنامج ورئيس الجهاز ("التحقق من الأجهزة" | صك آيو). تسمح أداة لإكمال دورة فتيلة. بمجرد اكتمال الدورة، رفع بوب الخروج من الكأس وجاف تماما بوب والكأس مع لنت منخفضة تنظيف الأنسجة.
ملاحظة: المياه المتبقية سوف الخلايا الحمراء، المنتجة للتدخل.
2-قياس ديفورمابيليتي كدالة لزيادة إجهاد القص
- الحصول على الدم (أقل من 1 مل كافية لأداء هذه التقنيات مع يتطابق) في قنينة المتضمن تخثر الدم مناسبة.
ملاحظة: يدتا المفضل على الهيبارين لأنها أقل تأثيراً على المعلمات هيمورهيولوجيكال. 33 رسم الدم تبقى في درجة حرارة الغرفة إذا كانت القياسات يتم تنفيذها خلال 6 ساعات دم. - مزيج عينة الدم كله بلطف قبل إجراء الاختبار بعكس القنينة عدة مرات. إضافة 25 ميليلتر من الدم كله إلى 5 مل من محلول حماية الأصناف النباتية iso-أوسمولار من بيبيتينج وكاب القنينة وتخلط بلطف بعكس عدة مرات. حل حماية الأصناف النباتية iso-أوسمولار ينبغي أن يكون أوسمولاليتي بين 284 و 304 موسم/كغ والرقم الهيدروجيني من 7.3-7.4 عند 25 درجة مئوية ولزوجته من cP 27.0 33.0 في 37.0 ± 0.5 درجة مئوية.
- في البرنامج اختر ديفورمابيليتي من القائمة الرئيسية. تحليل جديد لإنشاء وإضافة تفاصيل التجريبية (ديفورمابيليتي | إضافة التفاصيل المطلوبة | حسنا).
- رفع غطاء اكتاسيتوميتير، تحقق من أن بوب هو خفض تماما في كأس، وهو تحول الكأس.
- أضف 1 مل من محلول الدم حماية الأصناف النباتية في الفضاء بين كأس وبوب قبل بيبيتينج.
- رفع بوب قليلاً لإسقاط العينات. انتظر حتى تحركت جميع فقاعات الخروج من الحل، ثم أغلق الغطاء إلى اكتاسيتوميتير. إذا لزم الأمر، اضغط على زر تطلع للمساعدة على إزالة الفقاعات.
- ضبط المكاسب إلى 200 بتحريك السهم على طول شريط التمرير على البرنامج (انظر الملاحظة). عند درجة حرارة ثابتة عند 37 درجة مئوية وصورة الحيود مستقرة، ابدأ الصحافة (ابدأ).
ملاحظة: للعديد من الدراسات، يمكن الحصول على صورة حيود جيدة من صحة الدم (الهيموغلوبين تركيز > 12.0 غ/دل، متوسط حجم corpuscular fL 80-96 والهيموغلوبين corpuscular متوسط تركيزات من 33-36 غ/دل) مع اكتساب الكاميرا تعيين 200. للدراسات المتعلقة بالدم من الأنيميا المنجلية، وقد اقترح ضبط كسب الكاميرا توليد صورة حيود 4.5 سم كإعداد افتراضي للسماح بمقارنة النتائج عبر الدراسات والمختبرات. 9 - مراقبة أنماط الحيود كما تقدم اقتناء البيانات لضمان أن تظل دائري، بيضاوي أو على شكل الماس. عند الانتهاء من الحصول على البيانات، حفظ أو طباعة التقرير (الملف | حفظ أو ملف | الطباعة). ماكس الصناعات الاستخراجية و SS ½ القيم الافتراضية ستبلغ تلقائياً، جنبا إلى جنب مع مؤشرات الاستطالة المقابلة المحددة من قبل المستخدم أو القص تؤكد. سيتم أيضا حفظ البيانات تلقائياً من البرنامج.
- في النهاية، اضغط خيار نظيفة في مربع الحوار على شاشة الكمبيوتر (نظيف). بعد أن يستنشق العينة، شطف المساحة بين كأس وبوب بالتدفق المياه في الفضاء بينما يظل هذا الصك في دورة نظيفة. بمجرد اكتمال دورة نظيفة، رفع بوب الخروج من الكأس وجاف تماما بوب والكأس مع لنت منخفضة تنظيف الأنسجة (الحرجة: المياه المتبقية سوف الخلايا الحمراء، المنتجة للتدخل).
- انقر فوق الزر "القائمة الرئيسية" في البرنامج للعودة إلى الصفحة الرئيسية (القائمة الرئيسية).
3-قياس التغاير الخلوية
- مزيج عينة الدم كله بلطف قبل إجراء الاختبار بعكس القنينة عدة مرات. بيبيت 25 ميليلتر دم كله إلى قنينة 5 مل جديدة من حل حماية الأصناف النباتية iso-أوسمولار، كاب القنينة وتخلط بلطف بعكس حتى يصبح الخليط متجانس.
- اختر ديفورمابيليتي من القائمة الرئيسية. تحليل جديد لإنشاء وإضافة تفاصيل التجريبية (ديفورمابيليتي | إضافة التفاصيل المطلوبة | حسنا).
- رفع غطاء اكتاسيتوميتير، تحقق من أن بوب هو خفض تماما في كأس، وهو تحول الكأس.
- بيبيت 1 مل الحل الدم حماية الأصناف النباتية في الفضاء بين كأس وبوب.
- انتظر حتى تحركت جميع فقاعات الخروج من الحل، ثم أغلق الغطاء إلى اكتاسيتوميتير.
- تأكد من أن صورة حيود مستقرة موجودة على الشاشة. ضبط المكاسب الكاميرا بتحريك السهم على طول شريط التمرير على البرنامج حتى أنها تنتج حيود 3.8 سم ارتفاع. استخدم مسطرة للتحقق من ارتفاع الصورة على شاشة الكمبيوتر.
- عند درجة حرارة ثابتة عند 37 درجة مئوية وصورة الحيود مستقرة، ابدأ الصحافة (ابدأ).
- مراقبة أنماط الحيود كما تقدم اقتناء البيانات ضمان أن تبقى دائرية أو بيضاوية أو على شكل الماس. عند الانتهاء من الحصول على البيانات، حفظ أو طباعة التقرير (الملف | حفظ أو ملف | الطباعة).
- في النهاية، اضغط خيار نظيفة في مربع الحوار على شاشة الكمبيوتر (نظيف). بعد أن يستنشق العينة، شطف المساحة بين كأس وبوب بالتدفق المياه من زجاجة بخ إلى أنه بينما يظل هذا الصك في دورة نظيفة. بمجرد اكتمال دورة نظيفة، رفع بوب الخروج من الكأس وجاف تماما بوب والكأس مع لنت منخفضة تنظيف الأنسجة (الحرجة: المياه المتبقية سوف الخلايا الحمراء، المنتجة للتدخل).
- كرر الخطوات من 2.1-2.5 وضبط كسب الكاميرا للحصول على ارتفاع نمط حيود 4.5 سم (الخطوة 2، 2).
- كرر الخطوات من 2.1-2.5 وضبط كسب الكاميرا للحصول على ارتفاع نمط حيود 5.4 سم (الخطوة 2، 2).
- في النهاية، انقر فوق الزر القائمة الرئيسية للعودة إلى الصفحة الرئيسية للبرنامج (القائمة الرئيسية).
- لتحديد درجة التشويه نمط حيود استناداً إلى "ماكس الصناعات الاستخراجية" كنسبة مئوية، استخدم المعادلة التالية (المعادلة نفسها يمكن أن يؤديها مع البيانات من نمط حيود 4.5 سم الارتفاع إذا رغبت في ذلك):
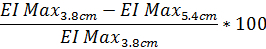
- وبالمثل، تحديد درجة الحيود تشويه نمط استناداً إلى SS1/2 استخدام المعادلة نفسها مع قيمة SS1/2 تم الإبلاغ عنها:
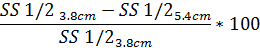
4-ناضح اكتاسيتوميتري التدرج
- الحصول على عينة كما هو موضح في 1-1. مزيج عينة الدم كله بلطف قبل إجراء الاختبار بعكس عدة مرات. إضافة 250 ميليلتر من الدم كله إلى القنينة حماية الأصناف النباتية iso-أوسمولار 5 مل من بيبيتينج وكاب القنينة وتخلط بلطف بعكس حتى يصبح الخليط متجانس.
- اختر أوسموسكان من القائمة الرئيسية (أوسموسكان). مكان القنينة التي تحتوي على الدم حل حماية الأصناف النباتية تحت الإبرة على الجانب الأيسر من الجهاز. أقل الإبرة حتى أنها تمس أسفل القنينة. تأكد من أنابيب متصل بشكل صحيح إلى الحلول أوسمولار المنخفضة والعالية لإنتاج التدرج. إغلاق الغطاء إلى اكتاسيتوميتير، وفتح الباب على النصف السفلي بحيث يمكنك مشاهدة الدم أدخل الأنبوب.
- اضغط على تحليل جديد ونوع في تفاصيل التجريبية (أوسموسكان | تحليل جديدة | أدخل التفاصيل المطلوبة | حسنا). ضبط المكاسب الكاميرا إلى 200 بتحريك السهم بالسيطرة عليها في البرنامج والسماح للجهاز تشغيل حتى الدم يعتبر دخول الكأس من الأنابيب تحت هذا الصك.
- متى دخل الدم في الكأس وصورة نمط حيود مستقرة على شاشة الكمبيوتر، تبدأ الحصول على البيانات عن طريق الضغط البدء الآن زر في مربع الحوار (البدء الآن).
- السماح اكتاسيتوميتير الحصول على بيانات تصل إلى حوالي 500 موسم/كغ، ثم توقف هذا الصك. حفظ أو طباعة التقرير (الملف | حفظ أو ملف | الطباعة). كما سيتم حفظ البيانات تلقائياً.
- إزالة قنينة الدم حماية الأصناف النباتية القديمة. استبدالها بقنينة نظيفة تحتوي على المياه. وضعه تحت الإبرة وإحضار الإبرة بحيث أنها تمس أسفل القنينة واضغط على زر الشطف في مربع الحوار شطف نظام التدرج (شطف).
- بمجرد اكتمال الشطف، اضغط خيار نظيفة في مربع الحوار على شاشة الكمبيوتر (نظيف). بمجرد اكتمال دورة نظيفة، رفع بوب الخروج من الكأس وجاف تماما بوب والكأس مع لنت منخفضة تنظيف الأنسجة (الحرجة: المياه المتبقية سوف الخلايا الحمراء، المنتجة للتدخل).
ملاحظة: ويقدم التقرير أوسموسكان الأرقام القياسية لاستطالة عبر التدرج التناضحي. O (الصناعات الاستخراجية كحد أقصى)، ماكس الصناعات الاستخراجية، الصناعات الاستخراجية فرط، دقيقة بالصناعات الاستخراجية، س (الصناعات الاستخراجية دقيقة) ويا فرط يتم إنشاؤه تلقائياً والمدرجة في التقرير. مجموعة المعلمات اكتاسيتوميتري التدرج التناضحي التي تم الحصول عليها من الدم من المتطوعين صحية 9: "الصناعات الاستخراجية دقيقة" 0.12-0.196 وحدات التعسفي (a.u.)؛ موسم "يا دقيقة" 117-144/كغ؛ الصناعات الاستخراجية ماكس 0.551 0.573 a.u.؛ يا موسم 272-312 (الصناعات الاستخراجية كحد أقصى)/كغ؛ الصناعات الاستخراجية فرط 0.278-0.286؛ موسم "يا فرط" 454-505/كغ.
5-إيقاف تشغيل في اكتاسيتوميتير
- تنظيف الصك بشكل صحيح قبل أن يتم إيقاف تشغيله.
- للقيام بذلك، الاتصال الأنابيب من الحلول أوسمولار المنخفضة والعالية بمحول y المؤدية إلى محلول التنظيف. ضع قنينة تحتوي على محلول التنظيف أسفل الإبرة على الجانب الأيسر من الجهاز وانخفاض الإبرة حتى أنها تمس أسفل القنينة. ضمان أن بوب هو خفض تماما في كوب.
- إغلاق البرامج، والصحافة تبدأ في نهاية مربع الحوار تنظيف اليوم على شاشة الكمبيوتر (إغلاق | بدء تشغيل). تسمح أداة للتنقل من خلال تنظيف تماما.
- قطع الأنبوب بزجاجة النفايات وإزالتها من هذا الصك للتخلص من النفايات. جاف بوب تماما. إيقاف تشغيل الجهاز.
Access restricted. Please log in or start a trial to view this content.
النتائج
يمكن استخدام نتائج اكتاسيتوميتري الموصوفة في هذه المخطوطة لقياس ديفورمابيليتي الخلايا الحمراء في أي ظرف. ويرد في الشكل 1تخطيطي لمجموعة عامة تصل اكتاسيتوميتير. سوف تنتج السكان متجانسة من الكريات الحمراء نمط حيود اهليلجية استجابة لزيادة إجهاد القص التي ي...
Access restricted. Please log in or start a trial to view this content.
Discussion
اكتاسيتوميتري التقنيات الموضحة مباشرة وكذلك الآلي، ضمان نتائج صحيحة واستنساخه. ومع ذلك، توجد بعض الخطوات الهامة. من المهم مراقبة درجة الحرارة المناسبة للدم. قد يؤثر على التخزين في درجة حرارة الغرفة لأكثر من ثماني ساعات SS ½ القيم. 34 ضمان أن درجة حرارة الجهاز مستقر عند 37 درجة مئ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل "برنامج البحوث الداخلية" للمعاهد الوطنية لمرض السكري، والجهاز الهضمي، وأمراض الكلي والوطنية القلب والرئة والدم معهد من "معاهد الصحة الوطنية". الآراء التي أعرب عنها هنا هي المسؤولة الوحيدة عن المؤلفين ولا تمثل بالضرورة وجهات النظر الرسمية "المعاهد الوطنية للصحة".
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| LoRRca MaxSis standard version | Mechatronics | LORC109000 | |
| LoRRca MaxSis Osmoscan | Mechatronics | LORC109001 | |
| Polyvinylpyrrolidone solution (PVP) 0mOsm | Mechatronics | QRR030910 | |
| Polyvinylpyrrolidone solution (PVP) 500mOsm | Mechatronics | QRR030930 | |
| Polyvinylpyrrolidone solution (PVP) 5mL vials | Mechatronics | QRR030901 | |
| X clean | Mechatronics | QRR010946 | |
| P1000 | MilliporeSigma | Z646555 | |
| P200 | MilliporeSigma | Z646547 | |
| P200 filter tips | MidSci | AV200-H | |
| P1250 filter tips | MidSci | AV1250-H | |
| Kimwipes | MidSci | 8091 | |
| 1.5 mL eppendorf tubes | MidSci | AVSS1700 | |
| 15 mL conical vial | MidSci | C15R |
References
- Bessis, M., Mohandas, N., Feo, C. Automated ektacytometry: a new method of measuring red cell deformability and red cell indices. Blood Cells. 6 (3), 315-327 (1980).
- Clark, M. R., Mohandas, N., Shohet, S. B. Osmotic gradient ektacytometry: comprehensive characterization of red cell volume and surface maintenance. Blood. 61 (5), 899-910 (1983).
- Da Costa, L., et al. Diagnostic tool for red blood cell membrane disorders: Assessment of a new generation ektacytometer. Blood Cells Mol Dis. 56 (1), 9-22 (2016).
- Clark, M. R., Mohandas, N., Shohet, S. B. Deformability of oxygenated irreversibly sickled cells. J Clin Invest. 65 (1), 189-196 (1980).
- Rabai, M., et al. Deformability analysis of sickle blood using ektacytometry. Biorheology. 51 (2-3), 159-170 (2014).
- Bessis, M., Mohandas, N. Laser Diffraction Patterns of Sickle Cells in Fluid Shear Fields. Blood Cells. 3, 229-239 (1977).
- Kim, Y., Kim, K., Park, Y. Blood Cell - An Overview of Studies in Hematology. Moschandreou, T. E. , InTech. (2012).
- Streekstra, G. J., Dobbe, J. G., Hoekstra, A. G. Quantification of the fraction poorly deformable red blood cells using ektacytometry. Opt Express. 18 (13), 14173-14182 (2010).
- Renoux, C., et al. Importance of methodological standardization for the ektacytometric measures of red blood cell deformability in sickle cell anemia. Clin Hemorheol Microcirc. 62 (2), 173-179 (2016).
- Parrow, N. L., et al. Measurements of red cell deformability and hydration reflect HbF and HbA2 in blood from patients with sickle cell anemia. Blood Cells Mol Dis. 65, 41-50 (2017).
- Ballas, S. K., Smith, E. D. Red blood cell changes during the evolution of the sickle cell painful crisis. Blood. 79 (8), 2154-2163 (1992).
- Johnson, R. M., Ravindranath, Y. Osmotic scan ektacytometry in clinical diagnosis. J Pediatr Hematol Oncol. 18 (2), 122-129 (1996).
- Mohandas, N., Clark, M. R., Jacobs, M. S., Shohet, S. B. Analysis of factors regulating erythrocyte deformability. J Clin Invest. 66 (3), 563-573 (1980).
- Lazarova, E., Gulbis, B., Oirschot, B. V., van Wijk, R. Next-generation osmotic gradient ektacytometry for the diagnosis of hereditary spherocytosis: interlaboratory method validation and experience. Clin Chem Lab Med. 55 (3), 394-402 (2017).
- Anderson, C., Aronson, I., Jacobs, P. Erythrocyte Deformability is Reduced and Fragility increased by Iron Deficiency. Hematology. 4 (5), 457-460 (1999).
- Reinhart, W. H., et al. Washing stored red blood cells in an albumin solution improves their morphologic and hemorheologic properties. Transfusion. 55 (8), 1872-1881 (2015).
- Shin, S., et al. Progressive impairment of erythrocyte deformability as indicator of microangiopathy in type 2 diabetes mellitus. Clin Hemorheol Microcirc. 36 (3), 253-261 (2007).
- Tu, H., et al. Low Red Blood Cell Vitamin C Concentrations Induce Red Blood Cell Fragility: A Link to Diabetes Via Glucose, Glucose Transporters, and Dehydroascorbic Acid. EBioMedicine. 2 (11), 1735-1750 (2015).
- Tiburcio, M., et al. A switch in infected erythrocyte deformability at the maturation and blood circulation of Plasmodium falciparum transmission stages. Blood. 119 (24), e172-e180 (2012).
- Henon, S., Lenormand, G., Richert, A., Gallet, F. A new determination of the shear modulus of the human erythrocyte membrane using optical tweezers. Biophys J. 76 (2), 1145-1151 (1999).
- Mills, J. P., Qie, L., Dao, M., Lim, C. T., Suresh, S. Nonlinear elastic and viscoelastic deformation of the human red blood cell with optical tweezers. Mech Chem Biosyst. 1 (3), 169-180 (2004).
- Moura, D. S., et al. Automatic real time evaluation of red blood cell elasticity by optical tweezers. Rev Sci Instrum. 86 (5), 053702(2015).
- Evans, E. A. New membrane concept applied to the analysis of fluid shear- and micropipette-deformed red blood cells. Biophys J. 13 (9), 941-954 (1973).
- Chen, X., Feng, L., Jin, H., Feng, S., Yu, Y. Quantification of the erythrocyte deformability using atomic force microscopy: correlation study of the erythrocyte deformability with atomic force microscopy and hemorheology. Clin Hemorheol Microcirc. 43 (3), 243-251 (2009).
- Musielak, M. Red blood cell-deformability measurement: review of techniques. Clin Hemorheol Microcirc. 42 (1), 47-64 (2009).
- Dobbe, J. G., Streekstra, G. J., Hardeman, M. R., Ince, C., Grimbergen, C. A. Measurement of the distribution of red blood cell deformability using an automated rheoscope. Cytometry. 50 (6), 313-325 (2002).
- Dobbe, J. G., et al. Analyzing red blood cell-deformability distributions. Blood Cells Mol Dis. 28 (3), 373-384 (2002).
- Kikuchi, Y., Arai, T., Koyama, T. Improved filtration method for red cell deformability measurement. Med Biol Eng Comput. 21 (3), 270-276 (1983).
- Moessmer, G., Meiselman, H. J. A new micropore filtration approach to the analysis of white cell rheology. Biorheology. 27 (6), 829-848 (1990).
- Guo, Q., et al. Microfluidic analysis of red blood cell deformability. J Biomech. 47 (8), 1767-1776 (2014).
- Doh, I., Lee, W. C., Cho, Y. H., Pisano, A. P., Kuypers, F. A. Deformation measurement of individual cells in large populations using a single-cell microchamber array chip. Appl Phys Lett. 100 (17), 173702-173703 (2012).
- Baskurt, O. K., et al. Comparison of three commercially available ektacytometers with different shearing geometries. Biorheology. 46 (3), 251-264 (2009).
- Baskurt, O. K., et al. New guidelines for hemorheological laboratory techniques. Clin Hemorheol Microcirc. 42 (2), 75-97 (2009).
- Uyuklu, M., et al. Effects of storage duration and temperature of human blood on red cell deformability and aggregation. Clin Hemorheol Microcirc. 41 (4), 269-278 (2009).
- Uyuklu, M., Meiselman, H. J., Baskurt, O. K. Effect of hemoglobin oxygenation level on red blood cell deformability and aggregation parameters. Clin Hemorheol Microcirc. 41 (3), 179-188 (2009).
- Embury, S. H., Clark, M. R., Monroy, G., Mohandas, N. Concurrent sickle cell anemia and alpha-thalassemia. Effect on pathological properties of sickle erythrocytes. J Clin Invest. 73 (1), 116-123 (1984).
- von Tempelhoff, G. F., et al. Correlation between blood rheological properties and red blood cell indices(MCH, MCV, MCHC) in healthy women. Clin Hemorheol Microcirc. 62 (1), 45-54 (2016).
- Da Costa, L., Galimand, J., Fenneteau, O., Mohandas, N. Hereditary spherocytosis, elliptocytosis, and other red cell membrane disorders. Blood Rev. 27 (4), 167-178 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved