このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
変形能と赤血球による血液中赤血球の不均一性を測定
* これらの著者は同等に貢献しました
要約
赤血球赤血球変形能と細胞の不均一性を測定する技術をご紹介します。これらのテクニックは、赤血球変形能の一般的な調査および鎌状細胞貧血症などの循環の両方の剛性と変形赤血球の存在によって特徴づけられる血液の疾患の特定の調査に適用されます。
要約
減少した赤血球変形能は、いくつかの疾患の特徴です。いくつかのケースで欠陥のある変形の程度は疾患の重症度や重篤な合併症の発生を予測できます。赤血球を使用してレーザー回折粘度測定増加せん断応力やせん断応力の定数値で浸透圧勾配の対象と赤血球の変形能を測定します。ただし、直接変形測定が両方の剛性と変形赤血球の存在によって特徴付けられる異種血を測定する場合の解釈が難しい。これは剪断応力および明白な変形の誇張された減少によって特徴づけられる歪んだ回折パターンで結果に応答を正しく合わせるという堅い細胞ができないのためにです。歪み度の測定は、血液中の赤血球の不均一性の指標を提供します。鎌状赤血球貧血でヘモグロビン濃度と赤血球のヘモグロビン合成を反映する堅い細胞の割合と相関しているこれ。変形能を測定するだけでなく浸透圧勾配赤血球浸透圧脆弱性と赤血球の水和状態に関する情報を提供します。これらのパラメーターは、鎌状赤血球の患者の赤い血球のヘモグロビン組成も反映されます。赤血球は赤血球の変形能を測定し、そのため、情報を提供しない変形または個々 の赤血球の機械的性質。関係なく、記載方法の目的は、変形と血液の細胞の不均一性を測定する便利で信頼できる方法を提供します。これらの技術は、一時的な変更と同様、病気の進行といくつかの疾患の治療への応答を監視するために役立ちます。鎌状赤血球貧血は、1 つのよ特徴付けられた例です。血の記憶域、糖尿病、マラリア原虫感染症、鉄欠乏、および膜欠陥による溶血性貧血、赤血球変形能や不均一性の測定が関心のある他の潜在的な疾患が含まれます。
概要
赤血球は、赤血球変形能せん断応力 (パスカル (Pa) 単位) や中断中の浸透圧の変化への応答の便利な測定を提供します。赤血球変形能の関連パラメーターは、最大伸長インデックス (EI 最大)、(SS ½) 増加のせん断応力とせん断応力 ½ への応答の赤いセルの最大変形能の測定、半分の最大を達成するために必要な剪断応力変形。1浸透圧勾配赤血球有益ないくつかのパラメーターがあります。最低伸びインデックス (EI 分)、表面・体積比の測定 (O 分) を発生する浸透圧などのこれら浸透圧脆弱性の尺度であります。EI Max と (O (EI マックス)) が発生した浸透圧膜の柔軟性とセル面積に関する情報を提供します。浸透圧勾配の高張の腕の半分の最大伸長は、EI ハイパーで表されます。ハイパー EI と浸透圧で発生した O ハイパー、ヘモグロビン濃度によって決定される赤血球の細胞内の粘度についての情報を提供します。2,3異種血液測定変形能は sickled 赤血球など、硬質のセルは正しくなどの剪断応力の増加への応答変形細胞の流れの方向と一致しないという事実によって複雑になります。特徴的な楕円形回折画像を生成ではなく剛細胞は、ダイヤモンド形回折パターン変形細胞によって生成される楕円に重ねたとき、球状パターンを生成します。4,5,6密度遠心分離の後で細胞の隔離された分画に赤血球を実行することによって不可逆的 sickled のセルに対応する球状のパターンが示されています。6 には伸び指数計算には、楕円のロングとショートの両方の軸の対策が含まれますダイヤモンドの形は、したがって短い軸の幅を増やすことで伸長量の明白な減少を生成します。7以前使用されている回折パターン歪みの度合いは鎌状ヘモグロビン (HbS) の割合と鎌状赤血球貧血患者から血液中の sickled 細胞の割合と相関していること。5回折パターン歪みの度合いは、複雑な数学的な分析によって取得できます。8それもすることによって、ektacytometer のカメラの絞りの開口部や回折パターンの高さを変更する継ぎ手ソフトウェアの灰色レベルを調整します。5灰色のレベルを調整する方法についての詳細はよく定義されていませんし、市販の ektacytometer の最新世代のカメラの絞り値は容易にアクセスできません。これらの問題を回避するために簡単にアクセスできるカメラのゲインを使用して回折パターンの高さを調整できます。9細胞異質性を推定するこのメソッドを使用して、回折パターン歪みの度合いは鎌状細胞貧血症の患者の血中の胎児のヘモグロビンの割合と関連付けることができます。10は浸透圧勾配赤血球パラメーターがいくつか、胎児の割合と相関同様に鎌鎌状細胞貧血症の患者の血液中のヘモグロビンや。回折パターン歪みの相関関係は、剛性、非変形細胞の割合にヘモグロビン組成の貢献度を反映しています。追加の関心は、全体の浸透圧勾配赤血球プロファイルは鎌状細胞の危機の間に循環の密な細胞の割合に対応する相性変化を受けます。11
赤血球は、同様に他のいくつかの疾患の研究に役立ちます。浸透圧勾配赤血球は継承された赤細胞の膜障害、遺伝性球状赤血球症、遺伝性 elliptocytosis 遺伝性 pyropoikilocytosis などの診断です。3,12,13,14鉄欠乏性減少変形が発生します。15血の「ストレージ病変」の特性は赤血球と病変の両方の性質を調べて今後研究を採用している、バンク血液の貯蔵の間にその形成を防ぐために介入から利益を得る可能性が高い、ここで紹介する手法。16減少赤血球変形能と糖尿病の血管疾患とも相関しています。17最近の研究高血糖をリンク、赤血球アスコルビン酸濃度と浸透圧脆弱性示唆これらの要因は血管疾患の開発に重要かもしれない。18赤血球の研究が現在進行中であるこの仮説を調査する (プロセスとレヴァイン、未発表のデータ)。血段階マラリア感染は、赤血球変形能調査の別の興味深い通りです。熱帯熱マラリア原虫の細胞の変形性感染シゾントにリング段階から寄生虫の細胞成熟の 48 時間の間に劇的に赤の血液細胞が減少します。証拠は、この減らされた変形は寄生虫の成熟の時に逆にことを示します。逆転は循環に感染した赤血球のリリースと一致します。減らされた変形は、赤血球の貯留を促進するマラリア原虫蛋白質によって仲介されると考えられます。19これらの研究は、赤血球変形能の測定および浸透圧勾配パラメーターが関連する臨床的に重要な条件の一部を表しています。研究のいくつかの追加エリアが存在します。
赤血球の変形能を測定するための代替技術には、光子の物理的なプロパティを使用して、1 つまたは複数の方向の単一の赤い細胞を伸ばす光ピンセット (レーザー トラップとも呼ばれます) が含まれます。20この手法が単一の赤血球の変形能を測定の利点が力調整のいくつかの不確実性は、研究21間でかなり変動を生産しているし、データ分析労力を必要としない限り、自動化されています。22マイクロ ピペット吸引負圧を使用して、マイクロ ピペットに赤血球を吸引するは赤血球の変形能を測定するためにも使用されています。7,23赤セルのさまざまな特性を定義する各メジャーの赤い細胞を吸引に必要な圧力など、複数の計測が可能です。23原子間力顕微鏡は、赤血球の表面に沿ってカンチレバーのたわみ量の指標としてレーザー ビーム偏向を定量化することで膜剛性を測定する高解像度技術。24これらの技術は個々 の赤血球に関する情報を提供、赤血球の個体数の変化を測定し、一般的には、かなりの技術的な専門知識を必要と簡単に適用されません。
同時に両方の個人やセルの人口をサンプルへの欲求は、オートメーションとマイクロ流体システムとアレイ ・ ベースの方法の開発の進歩につながっています。赤血球のような rheoscopy は、せん断応力の関数として変形を測定しますが、顕微鏡を通して直接画像を取得します。25高いスループット分析のため自動細胞イメージングは、平行円板型レオスコープを用いた変形分布を生成に採用されています。26携帯電話の不均一性は、健康な対照被験者からのデータが利用できる場合、このメソッドによって定量化します。27マイクロ流体技術では、単一セルの高スループット解析ろ過、28セル トランジット アナライザー、29 、細孔における赤血球流れに必要な時間を計測してむしろ赤血球通過に必要な圧力を測定する選択肢の適応を使用して複数の設計時間30よりも開発されています。個々 のセルの高スループット分析のための別のプラットフォームは、セルの下流の蛍光ベースの評価ができるという付加的な利点を持っている単一のセル マイクロチャンバ アレイ チップです。31 には赤血球の比較優位には: 各技術の役立つ可能性が、特定のアプリケーションに対して優位である可能性が、感度、操作性、精度が含まれています。32市販 ektacytometers の最新の世代はまた、実行できるアッセイの数のかなりの多様性を所有しています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
本研究ではすべての科目は、ヘルシンキ宣言と国家機関の健康機関評価委員会承認プロトコルに従って書面によるインフォームド コンセントを与えた。
1 オンにする、ektacytometer
- 洗浄液から低および高浸透ポリビニルピロリドン (PVP) ソリューションにチューブを接続します。高浸透ソリューションへ低浸透ソリューションを 0 浸透管と 500 の浸透管の接続に注意してください。
注:7.25-7.45 25 ° C での pH と 37.0 ± 27.0 と 33.0 センチポアズ (cP) の間の粘度低浸透 PVP ソリューションの浸透圧 (mOsm/kg) あたり 35 と 55 milliosmoles 間が必要 0.5 の ° c.高浸透 PVP 溶液は 37.0 ° 764 と 804 mOsm/kg、25 ° C で 7.25 7.45 pH 27.0 33.0 cP の粘度測定の浸透圧を有するべきである 0.5 の ° c. - ボブがカップに完全に下がることを確認します。ソフトウェアを起動し、首相のマシン (ハードウェアをチェック |計測器 IO)。プライミング サイクルの完了を許可します。サイクルが完了すると、ボブをカップから持ち上げて、この組織を洗浄低リントとボブとカップを完全に乾燥します。
注:残留水が赤血球、干渉を生産を溶解させます。
2. 剪断応力の増加の関数として変形の測定
- 適切な抗凝固剤を含むバイアルで血 (1 mL は、これらの技術を実行する十分な未満がレプリケートされます) を取得します。
注:EDTA は、血液粘度パラメーターに以下の影響力をもっているために、ヘパリンより優先されます。33血の 6 時間以内の測定を行う場合の部屋の温度で維持血液を描画します。 - 優しく数回バイアルを反転でテストする前に全血のサンプルをミックスします。ピペッティングして iso 浸透 PVP 溶液 5 mL に 25 μ L の全血を追加、バイアルのキャップ、数回を反転して軽く混ぜます。Iso 浸透 PVP 溶液は 37.0 ± 284, 304 mOsm/kg、25 ° C で 7.3 7.4 pH 27.0 33.0 cP の粘度と浸透圧を有するべきである 0.5 の ° c.
- ソフトウェアのメイン メニューから変形を選択します。新しい分析を作成し、追加実験詳細 (変形 |必要な詳細を追加 |さて)。
- Ektacytometer の蓋を持ち上げ、ボブに完全に低下させるカップに、カップを回していることを確認します。
- ピペッティングでカップとボブの間空間に PVP 血溶液の 1 mL を追加します。
- 少しサンプルをダウンさせるボブを持ち上げます。ソリューションは、すべての泡の転入まで待機し、ektacytometer のカバーを閉じます。必要な場合は、気泡を除去するために吸引ボタンを押します。
- ソフトウェアのスクロール バーの矢印を動かすことによって 200 にゲインを調整 (注を参照)。温度は 37 ° C で安定と回折像は安定して、プレスを開始 (開始)。
注:多くの研究のため、良い回折像は、200 に設定されてカメラのゲインと健康な血液 (ヘモグロビン濃度 > 12.0 g/dL が、80-96 fL の平均赤血球容積、平均赤血球ヘモグロビン濃度 33 36 g/dL) から取得できます。鎌状赤血球貧血からの血液の研究は、研究所間の結果の比較を許可するように既定の設定として 4.5 cm 回折イメージを生成するカメラのゲインを調整することを示唆されています。9 - 彼らは円形、楕円形を維持できるようにデータ集録の進行または菱形の回折パターンを観察します。データ集録が完了したら、保存またはレポートを印刷 (ファイル |保存またはファイル |印刷)。EI マックスと SS 値伸び指数ユーザー指定に対応すると共に、自動的に報告、または既定の ½ せん断応力。データは、ソフトウェアによって自動的に保存されます。
- 最後に、コンピューターのモニター (クリーン) ダイアログ ボックスできれいなオプションを押します。サンプルを吸引すると後、は、楽器がクリーン サイクルのまま、空間に脱イオン水を噴出させ、カップとボブ間のスペースをすすいでください。クリーン サイクルが完了すると、カップのボブを持ち上げ、低リント組織を洗浄とボブとカップを完全に乾燥 (重要: 残留水は干渉を生産、赤血球を溶解させます)。
- (メイン メニュー) のメインのページに戻るにはソフトウェアのメイン メニューのボタンをクリックします。
3. 携帯電話の不均一性の測定
- 優しく数回バイアルを反転でテストする前に全血のサンプルをミックスします。ピペット 25 μ L の全血 iso 浸透 PVP 溶液の新しい 5 mL バイアルにバイアルのキャップ、混合物が均一になるまでを反転して軽く混ぜます。
- メイン メニューから変形を選択します。新しい分析を作成し、追加実験詳細 (変形 |必要な詳細を追加 |さて)。
- Ektacytometer の蓋を持ち上げ、ボブに完全に低下させるカップに、カップを回していることを確認します。
- カップとボブの間空間に PVP 血溶液の 1 mL をピペットで移しなさい。
- ソリューションは、すべての泡の転入まで待機し、ektacytometer のカバーを閉じます。
- 安定した回折イメージが画面上に存在ことを確認します。それは 3.8 cm 回折高さを生成するまでソフトウェアのスクロール バーに沿って矢印を動かすことによってカメラのゲインを調整します。ルーラーを使用して、コンピューターの画面上のイメージの高さを確認します。
- 温度は 37 ° C で安定と回折像は安定して、プレスを開始 (開始)。
- 彼らは円形、楕円形または菱形を維持できるようにデータ取得が進むにつれて回折パターンを観察します。データ集録が完了したら、保存またはレポートを印刷 (ファイル |保存またはファイル |印刷)。
- 最後に、コンピューターのモニター (クリーン) ダイアログ ボックスできれいなオプションを押します。サンプルを吸引すると後、クリーン サイクルの中の楽器、それにホヤの瓶から脱イオン水を噴出させ、ボブとカップ間のスペースをすすいでください。クリーン サイクルが完了すると、カップのボブを持ち上げ、低リント組織を洗浄とボブとカップを完全に乾燥 (重要: 残留水は干渉を生産、赤血球を溶解させます)。
- 手順 2.1 2.5、4.5 cm の回折パターンの高さ (手順 2.2) を取得するカメラのゲインを調整します。
- 手順 2.1 2.5、5.4 cm 回折パターン高さ (手順 2.2) を取得するカメラのゲインを調整します。
- 最後に、ソフトウェア (メイン メニュー) のメインのページに戻るにはメイン メニューのボタンをクリックします。
- EI の最大パーセンテージに基づく回折パターン歪みの度合いを調べるには、(必要な場合、同じ方程式は回折パターン縦 4.5 cm からデータでも実行できる) 次の式を使用します。
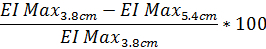
- 同様に、回折の程度を判断するパターン歪み SS1/2 の使用に基づいて、報告値は SS1/2 同じ方程式。
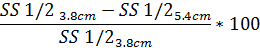
4. 浸透圧勾配赤血球
- 1.1 で説明したように、サンプルを取得します。優しく数回の反転によってテストする前に全血のサンプルをミックスします。ピペット 5 mL iso 浸透 PVP バイアルに 250 μ L の全血を追加、バイアルのキャップ、混合物が均一になるまでを反転して軽く混ぜます。
- メイン メニュー (Osmoscan) から osmoscan を選択します。PVP ソリューション マシンの左側の針の下に血液の入った小瓶を置きます。下まで針がバイアルの底に触れます。チューブはグラデーションの生産のための低と高浸透ソリューションに正しく接続されていることを確認します。Ektacytometer にふたを閉じ、下半分にドアを開き、チューブを入力して血を見ることができます。
- 実験詳細で新しい分析と型を押す (Osmoscan |新しい分析 |必要な詳細を入力 |さて)。ソフトウェアで制御する矢印を移動することによって 200 にカメラのゲインを調整し、楽器の下にチューブからカップに入る血液が見られるまでを実行するコンピューターを許可します。
- 一度血がカップに入っている安定した回折パターン画像がコンピューターの画面には、データ集録の開始を (今すぐ開始)] ダイアログ ボックスのボタン今スタートを押すことによって。
- 約 500 mOsm/kg までのデータを取得する ektacytometer を許可し、装置を停止します。レポートを印刷または保存 (ファイル |保存またはファイル |印刷)。データも自動的に保存されます。
- 古い PVP 血のガラスびんを削除します。脱イオン水を含むきれいなバイアルに置き換えます。針の下に配置、バイアルの底に接するように、針をダウンさせる、グラデーション システム (リンス) を洗浄する] ダイアログ ボックスですすぎボタンを押します。
- すすぎが完了したら、コンピューターのモニター (クリーン) ダイアログ ボックスできれいなオプションを押します。クリーン サイクルが完了すると、カップのボブを持ち上げ、低リント組織を洗浄とボブとカップを完全に乾燥 (重要: 残留水は干渉を生産、赤血球を溶解させます)。
注:Osmoscan レポートは、浸透圧勾配にわたって伸び指数を提供します。EI 分 O (EI 分)、EI Max、O (EI 最大)、EI ハイパー O ハイパーが自動的に生成され、レポートに含まれているとします。健常者 9 名からの血液から得られる浸透圧勾配赤血球パラメーターの範囲は: EI 分 0.12 0.196 任意の単位 (a.u.);O 分 117-144 mOsm/kg;EI Max 0.551 0.573 a.u.;O (EI 最大) 272 312 mOsm/kg;EI ハイパー 0.278 0.286;O ハイパー 454 505 mOsm/kg。
5、ektacytometer をオフにします。
- それがシャット ダウンする前に正しく楽器をきれい。
- これを行うには、洗浄液につながる y アダプターに低および高浸透ソリューションからチューブを接続します。マシンの左側にある針下洗浄液バイアルを置き、それがバイアルの底に触れるまで針を下げ。ボブがカップに完全に下がることを確認します。
- コンピューターのモニターに一日きれいなダイアログ ボックスの側でのソフトウェア、およびプレスの起動すぐ (すぐ |開始)。完全にクリーニングを順番に計測器を許可します。
- 廃棄物のボトルにチューブを外し、廃棄物を破棄するよう計測器から取り外します。ボブを完全に乾燥させます。マシンをオフにします。
Access restricted. Please log in or start a trial to view this content.
結果
本稿で説明した赤血球結果は、任意の条件での赤血球変形能を測定する使用できます。図 1に、ektacytometer の一般的なセットアップの模式図を示します。赤血球の同質な人口のせん断応力は図 2に示すように、伸長インデックスを計算に使用することができますを拡大する楕円の回折パターンが生成されます。剛体赤血球は?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
簡単な説明赤血球手法は、よく自動で有効で再現性のある結果を確保します。それにもかかわらず、いくつかの重要な手順が存在します。血液の適切な温度管理が重要です。8 時間以上室温で保管 SS ½ に影響を与える可能性があります値。34機の温度は 37 ° C で安定確保も重要です、中断中の粘度は温度に依存。血液は、これらの興味の実験的パラメーターでない限り、非?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
この作品は、国立研究所糖尿病、消化器・腎臓病、国立心臓、肺血国立衛生研究所の学内研究プログラムによって支えられました。意見が発現記載は作者の唯一の責任し、健康の国民の協会の公式の見解を必ずしも表さない。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| LoRRca MaxSis standard version | Mechatronics | LORC109000 | |
| LoRRca MaxSis Osmoscan | Mechatronics | LORC109001 | |
| Polyvinylpyrrolidone solution (PVP) 0mOsm | Mechatronics | QRR030910 | |
| Polyvinylpyrrolidone solution (PVP) 500mOsm | Mechatronics | QRR030930 | |
| Polyvinylpyrrolidone solution (PVP) 5mL vials | Mechatronics | QRR030901 | |
| X clean | Mechatronics | QRR010946 | |
| P1000 | MilliporeSigma | Z646555 | |
| P200 | MilliporeSigma | Z646547 | |
| P200 filter tips | MidSci | AV200-H | |
| P1250 filter tips | MidSci | AV1250-H | |
| Kimwipes | MidSci | 8091 | |
| 1.5 mL eppendorf tubes | MidSci | AVSS1700 | |
| 15 mL conical vial | MidSci | C15R |
参考文献
- Bessis, M., Mohandas, N., Feo, C. Automated ektacytometry: a new method of measuring red cell deformability and red cell indices. Blood Cells. 6 (3), 315-327 (1980).
- Clark, M. R., Mohandas, N., Shohet, S. B. Osmotic gradient ektacytometry: comprehensive characterization of red cell volume and surface maintenance. Blood. 61 (5), 899-910 (1983).
- Da Costa, L., et al. Diagnostic tool for red blood cell membrane disorders: Assessment of a new generation ektacytometer. Blood Cells Mol Dis. 56 (1), 9-22 (2016).
- Clark, M. R., Mohandas, N., Shohet, S. B. Deformability of oxygenated irreversibly sickled cells. J Clin Invest. 65 (1), 189-196 (1980).
- Rabai, M., et al. Deformability analysis of sickle blood using ektacytometry. Biorheology. 51 (2-3), 159-170 (2014).
- Bessis, M., Mohandas, N. Laser Diffraction Patterns of Sickle Cells in Fluid Shear Fields. Blood Cells. 3, 229-239 (1977).
- Kim, Y., Kim, K., Park, Y. Blood Cell - An Overview of Studies in Hematology. Moschandreou, T. E. , InTech. (2012).
- Streekstra, G. J., Dobbe, J. G., Hoekstra, A. G. Quantification of the fraction poorly deformable red blood cells using ektacytometry. Opt Express. 18 (13), 14173-14182 (2010).
- Renoux, C., et al. Importance of methodological standardization for the ektacytometric measures of red blood cell deformability in sickle cell anemia. Clin Hemorheol Microcirc. 62 (2), 173-179 (2016).
- Parrow, N. L., et al. Measurements of red cell deformability and hydration reflect HbF and HbA2 in blood from patients with sickle cell anemia. Blood Cells Mol Dis. 65, 41-50 (2017).
- Ballas, S. K., Smith, E. D. Red blood cell changes during the evolution of the sickle cell painful crisis. Blood. 79 (8), 2154-2163 (1992).
- Johnson, R. M., Ravindranath, Y. Osmotic scan ektacytometry in clinical diagnosis. J Pediatr Hematol Oncol. 18 (2), 122-129 (1996).
- Mohandas, N., Clark, M. R., Jacobs, M. S., Shohet, S. B. Analysis of factors regulating erythrocyte deformability. J Clin Invest. 66 (3), 563-573 (1980).
- Lazarova, E., Gulbis, B., Oirschot, B. V., van Wijk, R. Next-generation osmotic gradient ektacytometry for the diagnosis of hereditary spherocytosis: interlaboratory method validation and experience. Clin Chem Lab Med. 55 (3), 394-402 (2017).
- Anderson, C., Aronson, I., Jacobs, P. Erythrocyte Deformability is Reduced and Fragility increased by Iron Deficiency. Hematology. 4 (5), 457-460 (1999).
- Reinhart, W. H., et al. Washing stored red blood cells in an albumin solution improves their morphologic and hemorheologic properties. Transfusion. 55 (8), 1872-1881 (2015).
- Shin, S., et al. Progressive impairment of erythrocyte deformability as indicator of microangiopathy in type 2 diabetes mellitus. Clin Hemorheol Microcirc. 36 (3), 253-261 (2007).
- Tu, H., et al. Low Red Blood Cell Vitamin C Concentrations Induce Red Blood Cell Fragility: A Link to Diabetes Via Glucose, Glucose Transporters, and Dehydroascorbic Acid. EBioMedicine. 2 (11), 1735-1750 (2015).
- Tiburcio, M., et al. A switch in infected erythrocyte deformability at the maturation and blood circulation of Plasmodium falciparum transmission stages. Blood. 119 (24), e172-e180 (2012).
- Henon, S., Lenormand, G., Richert, A., Gallet, F. A new determination of the shear modulus of the human erythrocyte membrane using optical tweezers. Biophys J. 76 (2), 1145-1151 (1999).
- Mills, J. P., Qie, L., Dao, M., Lim, C. T., Suresh, S. Nonlinear elastic and viscoelastic deformation of the human red blood cell with optical tweezers. Mech Chem Biosyst. 1 (3), 169-180 (2004).
- Moura, D. S., et al. Automatic real time evaluation of red blood cell elasticity by optical tweezers. Rev Sci Instrum. 86 (5), 053702(2015).
- Evans, E. A. New membrane concept applied to the analysis of fluid shear- and micropipette-deformed red blood cells. Biophys J. 13 (9), 941-954 (1973).
- Chen, X., Feng, L., Jin, H., Feng, S., Yu, Y. Quantification of the erythrocyte deformability using atomic force microscopy: correlation study of the erythrocyte deformability with atomic force microscopy and hemorheology. Clin Hemorheol Microcirc. 43 (3), 243-251 (2009).
- Musielak, M. Red blood cell-deformability measurement: review of techniques. Clin Hemorheol Microcirc. 42 (1), 47-64 (2009).
- Dobbe, J. G., Streekstra, G. J., Hardeman, M. R., Ince, C., Grimbergen, C. A. Measurement of the distribution of red blood cell deformability using an automated rheoscope. Cytometry. 50 (6), 313-325 (2002).
- Dobbe, J. G., et al. Analyzing red blood cell-deformability distributions. Blood Cells Mol Dis. 28 (3), 373-384 (2002).
- Kikuchi, Y., Arai, T., Koyama, T. Improved filtration method for red cell deformability measurement. Med Biol Eng Comput. 21 (3), 270-276 (1983).
- Moessmer, G., Meiselman, H. J. A new micropore filtration approach to the analysis of white cell rheology. Biorheology. 27 (6), 829-848 (1990).
- Guo, Q., et al. Microfluidic analysis of red blood cell deformability. J Biomech. 47 (8), 1767-1776 (2014).
- Doh, I., Lee, W. C., Cho, Y. H., Pisano, A. P., Kuypers, F. A. Deformation measurement of individual cells in large populations using a single-cell microchamber array chip. Appl Phys Lett. 100 (17), 173702-173703 (2012).
- Baskurt, O. K., et al. Comparison of three commercially available ektacytometers with different shearing geometries. Biorheology. 46 (3), 251-264 (2009).
- Baskurt, O. K., et al. New guidelines for hemorheological laboratory techniques. Clin Hemorheol Microcirc. 42 (2), 75-97 (2009).
- Uyuklu, M., et al. Effects of storage duration and temperature of human blood on red cell deformability and aggregation. Clin Hemorheol Microcirc. 41 (4), 269-278 (2009).
- Uyuklu, M., Meiselman, H. J., Baskurt, O. K. Effect of hemoglobin oxygenation level on red blood cell deformability and aggregation parameters. Clin Hemorheol Microcirc. 41 (3), 179-188 (2009).
- Embury, S. H., Clark, M. R., Monroy, G., Mohandas, N. Concurrent sickle cell anemia and alpha-thalassemia. Effect on pathological properties of sickle erythrocytes. J Clin Invest. 73 (1), 116-123 (1984).
- von Tempelhoff, G. F., et al. Correlation between blood rheological properties and red blood cell indices(MCH, MCV, MCHC) in healthy women. Clin Hemorheol Microcirc. 62 (1), 45-54 (2016).
- Da Costa, L., Galimand, J., Fenneteau, O., Mohandas, N. Hereditary spherocytosis, elliptocytosis, and other red cell membrane disorders. Blood Rev. 27 (4), 167-178 (2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved