È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione di deformabilità e l'eterogeneità delle cellule rosse nel sangue di ektacitometria
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui vi presentiamo le tecniche per misurare la deformabilità del globulo rosso ed eterogeneità cellulare di ektacitometria. Queste tecniche sono applicabili a indagini generali di deformabilità del globulo rosso e indagini specifiche di malattie del sangue caratterizzate dalla presenza di globuli rossi sia rigidi sia deformabili in circolazione, quali anemia falciforme.
Abstract
Deformabilità del globulo rosso in diminuzione è caratteristica di parecchi disordini. In alcuni casi, nella misura di deformabilità difettoso può predire la gravità della malattia o la comparsa di gravi complicazioni. Ektacitometria usi laser viscosimetria di diffrazione per misurare la deformabilità dei globuli rossi soggetto a crescente sollecitazione di taglio o un gradiente osmotico ad un valore costante di sollecitazione di taglio applicata. Tuttavia, misurazioni di deformabilità diretto sono difficili da interpretare durante la misurazione sangue eterogeneo che si caratterizza per la presenza di globuli rossi sia rigidi che deformabili. Ciò è dovuto l'incapacità delle cellule rigide per allineare correttamente in risposta alla sollecitazione di taglio e risultati in un pattern di diffrazione distorta contrassegnato da un'esagerata diminuzione apparente deformabilità. Misurazione del grado di distorsione fornisce un indicatore dell'eterogeneità degli eritrociti nel sangue. Nell'anemia falciforme, ciò è correlata con la percentuale di cellule rigide, che riflette la concentrazione di emoglobina e la composizione dell'emoglobina degli eritrociti. Oltre a misurare la deformabilità, gradiente osmotico ektacitometria fornisce informazioni circa la fragilità osmotica e lo stato di idratazione degli eritrociti. Questi parametri anche riflettano la composizione dell'emoglobina dei globuli rossi dai pazienti delle cellule di falce. Ektacitometria misura deformabilità nelle popolazioni delle cellule rosse e non, pertanto, fornire informazioni sulla deformabilità o proprietà meccaniche dei singoli eritrociti. Indipendentemente da ciò, l'obiettivo delle tecniche descritte nel presente documento è fornire un metodo conveniente e affidabile per misurare la deformabilità e l'eterogeneità cellulare del sangue. Queste tecniche possono essere utile per monitorare i cambiamenti temporali, come pure la progressione di malattia e la risposta all'intervento terapeutico in parecchi disordini. Anemia falciforme è un esempio ben caratterizzato. Altri potenziali disturbi quando sono misurazioni di deformabilità del globulo rosso e/o eterogeneità di interesse includono la conservazione del sangue, diabete, infezione Plasmodium , carenza di ferro e le anemie emolitiche dovuto i difetti della membrana.
Introduzione
Ektacitometria fornisce una misura comoda di deformabilità del globulo rosso in risposta ad alterazioni nella sollecitazione di taglio (misurata in Pascal (Pa)) o sospendendo osmolarità media. Pertinenti parametri di deformabilità del globulo rosso sono l'indice di allungamento massimo (EI Max), una misura della massima deformabilità del globulo rosso in risposta alla crescente sollecitazione di taglio e shear stress ½ (SS ½), la sollecitazione di taglio necessaria per raggiungere metà maximal deformabilità. 1 ektacitometria gradiente osmotico ha diversi parametri informativi. Questi includono l'indice di allungamento minimo (EI Min), una misura del rapporto superficie-volume e l'osmolalità in cui esso si verifica (O Min), che è una misura della fragilità osmotica. EI Max e il osmolality in cui esso si verifica (O (EI Max)) è possibile fornire informazioni sull'area di superficie della membrana delle cellule e di flessibilità. Allungamento massimo mezza nel braccio ipertonico del gradiente osmotico è rappresentato da EI iper. EI iper e il osmolality in cui esso si verifica, O iper, forniscono informazioni circa la viscosità intracellulare del globulo rosso che è determinata dalla concentrazione nell'emoglobina. 2 , 3 misurazione deformabilità nel sangue eterogeneo è complicata dal fatto che cellule rigide, come globuli rossi falciformi, non sia ben allineata con la direzione del flusso ad esempio cellule deformabile in risposta alla crescente sollecitazione di taglio. Piuttosto che produrre un'immagine di diffrazione ellittica caratteristica, rigide cellule producono un modello sferico che si traduce in un pattern di diffrazione a forma di diamante quando sovrapposte sull'ellisse prodotta dalle cellule deformabile. 4 , 5 , 6 il modello sferico è stato indicato per corrispondono alle cellule irreversibilmente sickled eseguendo ektacitometria sulle frazioni isolate delle cellule dopo la centrifugazione di densità. 6 il calcolo di indice di allungamento include misure dell'asse lungo e breve dell'ellisse; forma di diamante, di conseguenza, produce un'apparente diminuzione in allungamento aumentando la larghezza dell'asse corto. 7 è stato precedentemente dimostrato che il grado di distorsione del reticolo di diffrazione è correlato con la percentuale di emoglobina falciforme (HbS) e la percentuale delle cellule falciformi nel sangue dai pazienti con anemia falciforme. 5 il grado di distorsione del reticolo di diffrazione può essere ottenuto da analisi matematiche complesse. 8 può essere ottenuto anche regolando l'apertura del diaframma della fotocamera sul ektacytometer o il livello di grigio del raccordo software per modificare l'altezza del reticolo di diffrazione. 5 tuttavia, dettagli riguardo alle modalità di regolare il livello di grigio non sono ben definiti e l'apertura della fotocamera non è facilmente accessibile sull'ultima generazione dell'ektacytometer disponibili in commercio. Per ovviare a questi problemi, il guadagno di fotocamera facilmente accessibile consente di regolare l'altezza del reticolo di diffrazione. 9 utilizzo di questo metodo per stimare l'eterogeneità cellulare, il grado di distorsione del reticolo di diffrazione può essere correlato con la percentuale di emoglobina fetale nel sangue dei pazienti con anemia falciforme. 10 diversi parametri di ektacitometria gradiente osmotico similarmente sono correlati con la percentuale di fetale o emoglobina nel sangue dai pazienti con anemia di cellule di falce. Correlazioni di distorsione di reticolo diffrazione probabilmente riflettono il contributo di una composizione di emoglobina per la percentuale di cellule rigide, indeformabile. Di interesse supplementare, il profilo intero ektacitometria gradiente osmotico subisce cambiamenti di bifase che corrispondono alla percentuale di cellule dense nella circolazione durante crisi falcemica. 11
Ektacitometria è similarmente utile nello studio di parecchi altri disordini. Ektacitometria gradiente osmotico è diagnostico per i disturbi di membrana ereditato delle cellule rosse, come sferocitosi ereditaria, elliptocytosis ereditario e Piropoichilocitosi ereditaria. 3 , 12 , 13 , 14 ridotta deformabilità si verifica nella carenza di ferro. 15 caratterizzazione della lesione"deposito" di sangue ha impiegato ektacitometria e futuri studi che studiano sia la natura della lesione e gli interventi per impedire la sua formazione durante la conservazione del sangue versato sono suscettibili di beneficiare della tecniche qui presentate. 16 deformabilità eritrocitaria in diminuzione è stata correlata anche con malattia microvascolare in diabete. 17 recenti studi che collegano l'iperglicemia, concentrazioni nel globulo rosso dell'ascorbato e fragilità osmotica suggeriscono che questi fattori possono essere importanti nello sviluppo della malattia microvascolare. 18 ektacitometria studi sono attualmente in corso per studiare questa ipotesi (Perow e Levine, dati non pubblicati). Fase di infezione malarica del sangue è un altro interessante viale delle indagini di deformabilità del globulo rosso. Cellulare deformabilità del Plasmodium falciparum infetti globuli rossi diminuisce drammaticamente durante le 48 ore di maturazione intracellulare del parassita dalla fase di anello alla fase schizonte. La prova indica che questa diminuzione deformabilità è invertito al momento di maturazione del parassita. L'inversione coincide con rilascio di globuli rossi infetti nella circolazione. Deformabilità in diminuzione è pensato per essere mediato dalle proteine del Plasmodium che promuovono il sequestro del globulo rosso. 19 questi studi rappresentano un piccolo campione delle condizioni clinicamente importanti dove la misurazione deformabilità eritrocitaria e parametri gradienti osmotici sono rilevanti. Esistono diverse altre aree di studio.
Tecniche alternative per la misurazione di deformabilità del globulo rosso sono pinzette ottiche (note anche come trappole laser) che utilizzano le proprietà fisiche dei fotoni per allungare le singole cellule rosse in una o più direzioni. 20 questa tecnica ha il vantaggio di misurare la deformabilità degli eritrociti singoli, ma qualche incertezza in forza calibrazione ha prodotto una notevole variabilità attraverso studi 21 e analisi dei dati può essere laborioso a meno che non automatizzato. 22 aspirazione micropipetta, che utilizza la pressione negativa per aspirare un eritrociti in una micropipetta, è stato utilizzato anche per misurare la deformabilità dei globuli rossi. 7 , 23 misure multiple, ad esempio la pressione necessaria per aspirare il globulo rosso, sono possibili con ogni misura definisce le caratteristiche differenti di globulo rosso. 23 la microscopia a forza atomica è una tecnica di alta risoluzione che misura la rigidità della membrana quantificando la deflessione del fascio laser come un indicatore di deflessione a sbalzo lungo la superficie del globulo rosso. 24 queste tecniche forniscono informazioni individuali degli eritrociti, non sono facilmente adattati per misurare i cambiamenti nelle popolazioni dei globuli rossi e, in generale, richiedono una notevole competenza tecnica.
Il desiderio di assaggiare sia individuali che popolazioni di cellule contemporaneamente ha portato a progressi in automazione e lo sviluppo della microfluidica e metodi basati su matrice. Come ektacitometria, rheoscopy misura deformabilità in funzione della sollecitazione di taglio ma immagini vengono acquisite direttamente tramite microscopio. 25 per maggiore analisi attraverso-metta, formazione immagine automatizzata delle cellule è stata impiegata per produrre distribuzioni di deformabilità utilizzando il rheoscope. 26 eterogeneità cellulare può essere quantificata da questo metodo se sono disponibili dati da un oggetto di controllo in buona salute. 27 microfluidica tecniche permettono anche di alte fino analisi di singole cellule; disegni multipli usando adattamenti di filtrazione, analizzatori di transito cella28 ,29 , che misura il tempo richiesto per un flusso dell'eritrocito attraverso un microporo e alternative che misurano la pressione necessaria per il transito dell'eritrocito piuttosto oltre tempo 30 sono stati sviluppati. Un'altra piattaforma per alto fino analisi delle singole celle è il chip di matrice microchamber singola cella, che ha l'ulteriore vantaggio di consentire per la caratterizzazione di fluorescenza-basata a valle delle cellule. 31 anche se ognuna di queste tecniche è potenzialmente utile e può essere superiore per applicazioni particolari, i vantaggi comparativi di ektacitometria include sensibilità, facilità d'uso e precisione. 32 l'ultima generazione di ektacytometers disponibili in commercio anche possieda una notevole versatilità del numero di analisi che possono essere eseguite.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti i soggetti in questo studio hanno dato consenso informato in conformità con la dichiarazione di Helsinki e i protocolli nazionali istituti di salute Institutional Review Board approvato.
1. Accendere il ektacytometer
- Collegare la tubazione dalla soluzione di pulizia per le soluzioni di polivinilpirrolidone (PVP) osmolar basso e alto. Fare attenzione a collegare il tubo osmolar 0 alla soluzione osmolar basso e il tubo osmolar 500 alla soluzione alta osmolar.
Nota: La soluzione PVP osmolar basso dovrebbe avere un'osmolalità tra 35 e 55 milliosmoles per chilogrammo (mOsm/kg), un pH di 7,25-7.45 a 25 ° C e una viscosità tra 27.0 e 33.0 centipoise (cP) a 37.0 ± 0,5 ° C. La soluzione PVP osmolar alta dovrebbe avere un'osmolalità tra 764 e 804 mOsm/kg, un pH di 7,25-7.45 a 25 ° C e una misura di viscosità di 27.0-33.0 cP a 37,0 ° 0,5 ° C. - Assicurarsi che il bob è abbassato completamente nella tazza. Avviare il software e la macchina di prima (Verifica Hardware | Strumento IO). Consentire allo strumento completare il ciclo di adescamento. Una volta che il ciclo è completo, sollevare il bob fuori dalla Coppa e asciugare completamente il bob e la Coppa con un basso residuo di stoffa tessuto di pulizia.
Nota: Acqua residua sarà lisare cellule rosse, produrre interferenze.
2. misurazione della deformabilità in funzione della sollecitazione di taglio in aumento
- Ottenere sangue (meno di 1 mL è sufficiente per eseguire queste tecniche con replica) nel flaconcino contenente un anticoagulante appropriato.
Nota: EDTA è preferibile eparina perché ha meno influenza sui parametri hemorheological. Prelievo del sangue di tenere a temperatura ambiente se le misurazioni vengono effettuate entro 6 ore di sangue del 33 . - Mescolare delicatamente il campione di sangue intero prima della prova capovolgendo il flacone diverse volte. Aggiungere 25 µ l di sangue intero a 5 mL di soluzione di PVP iso-osmolari pipettando, tappo del flacone e agitare delicatamente capovolgendo più volte. La soluzione PVP iso-osmolari dovrebbe avere un'osmolalità tra 284 e 304 mOsm/kg, un pH 7,3-7,4 a 25 ° C e una viscosità di 27.0-33.0 cP a 37.0 ± 0,5 ° C.
- Il software scegliere deformabilità dal menu principale. Create una nuova analisi e aggiungere dettagli sperimentali (deformabilità | Aggiungere dettagli desiderate | OK).
- Sollevare il coperchio per ektacytometer, verificare che il bob è completamente abbassato in Coppa e la Coppa si sta trasformando.
- Aggiungere 1 mL di soluzione di PVP sangue nello spazio tra la Coppa e il peso di pipettaggio.
- Sollevare il bob leggermente per portare i campioni. Attendere fino a quando tutte le bolle sono spostati fuori la soluzione, quindi chiudere il coperchio per il ektacytometer. Se necessario, premere il pulsante di aspirazione per rimuovere le bolle.
- Regolare il guadagno a 200 spostando la freccia lungo la barra di scorrimento sul software (Vedi nota). Quando la temperatura è stabile a 37 ° C e l'immagine di diffrazione è stabile, premere start (avvio).
Nota: Per molti studi, un immagine di buona diffrazione può essere ottenuta dal sangue sano (emoglobina concentrazione > 12,0 g / dL, volume corpuscolare medio di 80-96 fL e concentrazioni di emoglobina corpuscolare media di 33-36 g/dL) con il guadagno di fotocamera impostato su 200. Per gli studi di sangue da anemia falciforme, la regolazione del guadagno di fotocamera per generare un'immagine di diffrazione di 4,5 cm è stato suggerito come l'impostazione predefinita per consentire il confronto dei risultati tra studi e laboratori. 9 - Osservare i modelli di diffrazione come progredisce di acquisizione dati per garantire che essi rimangano circolare, ellittica o a forma di diamante. Al termine dell'acquisizione dati, salvare o stampare il report (File | Salva o File | Stampa). EI Max e SS ½ valori saranno riportati automaticamente, insieme agli indici di allungamento corrispondente specificato dall'utente o predefinite shear stress. Dati verranno anche salvati automaticamente dal software.
- Al termine, premere l'opzione clean nella finestra di dialogo sul monitor del computer (pulite). Dopo che il campione è aspirato, sciacquare lo spazio tra la Coppa e bob spruzzando acqua deionizzata nello spazio, mentre lo strumento è ancora nel ciclo di pulizia. Una volta completato il ciclo di pulizia, sollevare il bob fuori dalla Coppa e asciugare completamente il bob e la Coppa con un basso residuo di stoffa tessuto di pulizia (critico: acqua residua sarà lisare cellule rosse, producendo interferenze).
- Fare clic sul pulsante Menu principale sul software per tornare alla pagina principale (Main Menu).
3. misurazione della eterogeneità cellulare
- Mescolare delicatamente il campione di sangue intero prima della prova capovolgendo il flacone diverse volte. Dispensare 25 µ l di sangue intero per un nuovo flaconcino da 5 mL di soluzione di PVP di iso-osmolari, tappo del flaconcino e miscelare delicatamente capovolgendo fino a quando l'impasto è omogeneo.
- Scegliere deformabilità dal menu principale. Create una nuova analisi e aggiungere dettagli sperimentali (deformabilità | Aggiungere dettagli desiderate | OK).
- Sollevare il coperchio per ektacytometer, verificare che il bob è completamente abbassato in Coppa e la Coppa si sta trasformando.
- Pipettare 1 mL della soluzione PVP sangue nello spazio tra la Coppa e bob.
- Attendere fino a quando tutte le bolle sono spostati fuori la soluzione, quindi chiudere il coperchio per il ektacytometer.
- Assicurarsi che un'immagine di diffrazione stabile è presente sullo schermo. Regolare il guadagno di fotocamera spostando la freccia lungo la barra di scorrimento sul software fino a produrre un altezza di diffrazione di 3,8 cm. Usare un righello per verificare l'altezza dell'immagine sullo schermo del computer.
- Quando la temperatura è stabile a 37 ° C e l'immagine di diffrazione è stabile, premere start (avvio).
- Osservare diffrazione come progredisce di acquisizione dati per garantire che essi rimangano circolare, ellittica o a forma di diamante. Al termine dell'acquisizione dati, salvare o stampare il report (File | Salvare o File | Stampa).
- Al termine, premere l'opzione clean nella finestra di dialogo sul monitor del computer (Clean). Dopo che il campione è aspirato, sciacquare lo spazio tra la Coppa e bob spruzzando acqua deionizzata da una spruzzetta in esso, mentre lo strumento è ancora nel ciclo di pulizia. Una volta completato il ciclo di pulizia, sollevare il bob fuori dalla Coppa e asciugare completamente il bob e la Coppa con un basso residuo di stoffa tessuto di pulizia (critico: acqua residua sarà lisare cellule rosse, producendo interferenze).
- Ripetere i passaggi da 2.1-2.5 e regolare il guadagno di fotocamera per ottenere un'altezza di reticolo di diffrazione di 4,5 cm (punto 2.2).
- Ripetere i passaggi da 2.1-2.5 e regolare il guadagno di fotocamera per ottenere un'altezza di reticolo di diffrazione di 5,4 cm (punto 2.2).
- Al termine, fare clic sul pulsante menu principale per tornare alla pagina principale del software (Menu principale).
- Per determinare il grado di distorsione di reticolo di diffrazione basato su EI Max in percentuale, utilizzare la seguente equazione (l'equazione stessa può essere eseguita con i dati dall'altezza di reticolo di diffrazione 4,5 cm se desiderato):
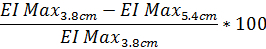
- Analogamente, per determinare il grado di diffrazione distorsione del modello basato su SS1/2 uso la stessa equazione con il valore riportato SS1/2:
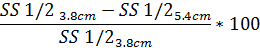
4. osmotico pendenza ektacitometria
- Ottenere il campione come descritto in 1.1. Mescolare delicatamente il campione di sangue intero prima della prova capovolgendo più volte. Aggiungere 250 µ l di sangue intero al flaconcino da 5 mL iso-osmolari PVP pipettando, tappo del flacone e agitare delicatamente capovolgendo fino a quando l'impasto è omogeneo.
- Scegliere osmoscan dal menu principale (Osmoscan). Collocare il flaconcino contenente il sangue soluzione di PVP sotto l'ago sul lato sinistro della macchina. Abbassare l'ago fino a toccare il fondo del flaconcino. Assicurarsi di tubazione è collegata correttamente alle soluzioni osmolar alta e bassa per la produzione di gradiente. Chiudere il coperchio per la ektacytometer e aprire la porta sulla metà inferiore, in modo che è possibile guardare il sangue entrare il tubo.
- Premere nuova analisi e digitare dettagli sperimentali (Osmoscan | Nuova analisi | Inserite i dati desiderati | OK). Regolare il guadagno di fotocamera a 200 spostando la freccia controllarlo sul software e permettono alla macchina di eseguire fino a quando il sangue è visto entrare la Coppa dal tubo sotto lo strumento.
- Una volta che il sangue è entrato la Coppa e un'immagine del reticolo di diffrazione stabile è sullo schermo del computer, avviare acquisizione dati premendo inizio ora pulsante nella finestra di dialogo (Start Now).
- Consentire l'ektacytometer di acquisire dati fino a circa 500 mOsm/kg, quindi spegnere lo strumento. Salvare o stampare report (File | Salva o File | Stampa). Dati anche salverà automaticamente.
- Rimuovere il vecchio flacone di PVP-sangue. Sostituirlo con un flacone pulito contenente acqua deionizzata. Posizionarlo sotto l'ago, portare l'ago verso il basso in modo che tocchi il fondo del flaconcino e premere il tasto di risciacquo nella finestra di dialogo per sciacquare il sistema di sfumatura (risciacquo).
- Una volta completato il risciacquo, premere l'opzione clean nella finestra di dialogo sul monitor del computer (pulite). Una volta completato il ciclo di pulizia, sollevare il bob fuori dalla Coppa e asciugare completamente il bob e la Coppa con un basso residuo di stoffa tessuto di pulizia (critico: acqua residua sarà lisare cellule rosse, producendo interferenze).
Nota: La relazione di osmoscan fornisce indici di allungamento attraverso il gradiente osmotico. EI Min, O (EI Min), EI Max, O (EI Max), EI iper iper O sono generati automaticamente e inclusi nel report. La gamma di parametri ektacitometria gradiente osmotico ottenuto da sangue da 9 volontari sani è: EI Min 0.12-0,196 unità arbitrarie (UA); O Min 117-144 mOsm/kg; EI Max 0.551-0.573 a.u.; O (EI Max) 272-312 mOsm/kg; EI 0,278 iper-0.286; O iper 454-505 mOsm/kg.
5. Spegnere il ektacytometer
- Pulire lo strumento correttamente prima che venga arrestato.
- Per effettuare questa operazione, è necessario collegare il tubo dalle soluzioni osmolar basso e alto per adattatore a y che conduce alla soluzione di pulizia. Posizionare un flaconcino contenente la soluzione di pulizia sotto l'ago sul lato sinistro della macchina e abbassare l'ago fino a toccare il fondo del flaconcino. Assicurarsi che il bob è abbassato completamente nella tazza.
- Nelle vicinanze il software e premere Avvia il fine del dialogo pulito giorno sul monitor del computer (nelle vicinanze | Avviare). Consentire allo strumento scorrere di pulizia completamente.
- Scollegare il tubo per la bottiglia degli scarti e rimuoverlo dallo strumento di disfarsi dei rifiuti. Asciugare completamente il bob. Spegnere la macchina.
Access restricted. Please log in or start a trial to view this content.
Risultati
I risultati di ektacitometria descritti in questo manoscritto utilizzabile per misurare la deformabilità del globulo rosso in qualsiasi condizione. Un disegno schematico del generale set up di un ektacytometer è illustrato nella Figura 1. Popolazioni omogenee di eritrociti produrrà un pattern di diffrazione ellittica in risposta alla crescente sollecitazione di taglio che può essere utilizzato per calcolare l'indice di allungamento come mostrato nella
Access restricted. Please log in or start a trial to view this content.
Discussione
Le tecniche di ektacitometria descritte sono semplici e ben automatizzata, garantendo risultati validi e riproducibili. Tuttavia, esistono alcuni passaggi critici. Controllo di temperatura adeguato del sangue è importante. Stoccaggio a temperatura ambiente per più di otto ore può interessare SS ½ valori. 34 assicurando che la temperatura della macchina è stabile a 37 ° C è importante, anche come viscosità del mezzo sospendente è dipendente dalla temperatura. Sangue dovrebbe essere complet...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal programma di ricerca intramurale del istituti nazionali di diabete, digestivo e malattie del rene e cuore nazionale, polmone e sangue Institute of National Institutes of Health. Le opinioni espresse nel presente documento sono di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del National Institutes of Health.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| LoRRca MaxSis standard version | Mechatronics | LORC109000 | |
| LoRRca MaxSis Osmoscan | Mechatronics | LORC109001 | |
| Polyvinylpyrrolidone solution (PVP) 0mOsm | Mechatronics | QRR030910 | |
| Polyvinylpyrrolidone solution (PVP) 500mOsm | Mechatronics | QRR030930 | |
| Polyvinylpyrrolidone solution (PVP) 5mL vials | Mechatronics | QRR030901 | |
| X clean | Mechatronics | QRR010946 | |
| P1000 | MilliporeSigma | Z646555 | |
| P200 | MilliporeSigma | Z646547 | |
| P200 filter tips | MidSci | AV200-H | |
| P1250 filter tips | MidSci | AV1250-H | |
| Kimwipes | MidSci | 8091 | |
| 1.5 mL eppendorf tubes | MidSci | AVSS1700 | |
| 15 mL conical vial | MidSci | C15R |
Riferimenti
- Bessis, M., Mohandas, N., Feo, C. Automated ektacytometry: a new method of measuring red cell deformability and red cell indices. Blood Cells. 6 (3), 315-327 (1980).
- Clark, M. R., Mohandas, N., Shohet, S. B. Osmotic gradient ektacytometry: comprehensive characterization of red cell volume and surface maintenance. Blood. 61 (5), 899-910 (1983).
- Da Costa, L., et al. Diagnostic tool for red blood cell membrane disorders: Assessment of a new generation ektacytometer. Blood Cells Mol Dis. 56 (1), 9-22 (2016).
- Clark, M. R., Mohandas, N., Shohet, S. B. Deformability of oxygenated irreversibly sickled cells. J Clin Invest. 65 (1), 189-196 (1980).
- Rabai, M., et al. Deformability analysis of sickle blood using ektacytometry. Biorheology. 51 (2-3), 159-170 (2014).
- Bessis, M., Mohandas, N. Laser Diffraction Patterns of Sickle Cells in Fluid Shear Fields. Blood Cells. 3, 229-239 (1977).
- Kim, Y., Kim, K., Park, Y. Blood Cell - An Overview of Studies in Hematology. Moschandreou, T. E. , InTech. (2012).
- Streekstra, G. J., Dobbe, J. G., Hoekstra, A. G. Quantification of the fraction poorly deformable red blood cells using ektacytometry. Opt Express. 18 (13), 14173-14182 (2010).
- Renoux, C., et al. Importance of methodological standardization for the ektacytometric measures of red blood cell deformability in sickle cell anemia. Clin Hemorheol Microcirc. 62 (2), 173-179 (2016).
- Parrow, N. L., et al. Measurements of red cell deformability and hydration reflect HbF and HbA2 in blood from patients with sickle cell anemia. Blood Cells Mol Dis. 65, 41-50 (2017).
- Ballas, S. K., Smith, E. D. Red blood cell changes during the evolution of the sickle cell painful crisis. Blood. 79 (8), 2154-2163 (1992).
- Johnson, R. M., Ravindranath, Y. Osmotic scan ektacytometry in clinical diagnosis. J Pediatr Hematol Oncol. 18 (2), 122-129 (1996).
- Mohandas, N., Clark, M. R., Jacobs, M. S., Shohet, S. B. Analysis of factors regulating erythrocyte deformability. J Clin Invest. 66 (3), 563-573 (1980).
- Lazarova, E., Gulbis, B., Oirschot, B. V., van Wijk, R. Next-generation osmotic gradient ektacytometry for the diagnosis of hereditary spherocytosis: interlaboratory method validation and experience. Clin Chem Lab Med. 55 (3), 394-402 (2017).
- Anderson, C., Aronson, I., Jacobs, P. Erythrocyte Deformability is Reduced and Fragility increased by Iron Deficiency. Hematology. 4 (5), 457-460 (1999).
- Reinhart, W. H., et al. Washing stored red blood cells in an albumin solution improves their morphologic and hemorheologic properties. Transfusion. 55 (8), 1872-1881 (2015).
- Shin, S., et al. Progressive impairment of erythrocyte deformability as indicator of microangiopathy in type 2 diabetes mellitus. Clin Hemorheol Microcirc. 36 (3), 253-261 (2007).
- Tu, H., et al. Low Red Blood Cell Vitamin C Concentrations Induce Red Blood Cell Fragility: A Link to Diabetes Via Glucose, Glucose Transporters, and Dehydroascorbic Acid. EBioMedicine. 2 (11), 1735-1750 (2015).
- Tiburcio, M., et al. A switch in infected erythrocyte deformability at the maturation and blood circulation of Plasmodium falciparum transmission stages. Blood. 119 (24), e172-e180 (2012).
- Henon, S., Lenormand, G., Richert, A., Gallet, F. A new determination of the shear modulus of the human erythrocyte membrane using optical tweezers. Biophys J. 76 (2), 1145-1151 (1999).
- Mills, J. P., Qie, L., Dao, M., Lim, C. T., Suresh, S. Nonlinear elastic and viscoelastic deformation of the human red blood cell with optical tweezers. Mech Chem Biosyst. 1 (3), 169-180 (2004).
- Moura, D. S., et al. Automatic real time evaluation of red blood cell elasticity by optical tweezers. Rev Sci Instrum. 86 (5), 053702(2015).
- Evans, E. A. New membrane concept applied to the analysis of fluid shear- and micropipette-deformed red blood cells. Biophys J. 13 (9), 941-954 (1973).
- Chen, X., Feng, L., Jin, H., Feng, S., Yu, Y. Quantification of the erythrocyte deformability using atomic force microscopy: correlation study of the erythrocyte deformability with atomic force microscopy and hemorheology. Clin Hemorheol Microcirc. 43 (3), 243-251 (2009).
- Musielak, M. Red blood cell-deformability measurement: review of techniques. Clin Hemorheol Microcirc. 42 (1), 47-64 (2009).
- Dobbe, J. G., Streekstra, G. J., Hardeman, M. R., Ince, C., Grimbergen, C. A. Measurement of the distribution of red blood cell deformability using an automated rheoscope. Cytometry. 50 (6), 313-325 (2002).
- Dobbe, J. G., et al. Analyzing red blood cell-deformability distributions. Blood Cells Mol Dis. 28 (3), 373-384 (2002).
- Kikuchi, Y., Arai, T., Koyama, T. Improved filtration method for red cell deformability measurement. Med Biol Eng Comput. 21 (3), 270-276 (1983).
- Moessmer, G., Meiselman, H. J. A new micropore filtration approach to the analysis of white cell rheology. Biorheology. 27 (6), 829-848 (1990).
- Guo, Q., et al. Microfluidic analysis of red blood cell deformability. J Biomech. 47 (8), 1767-1776 (2014).
- Doh, I., Lee, W. C., Cho, Y. H., Pisano, A. P., Kuypers, F. A. Deformation measurement of individual cells in large populations using a single-cell microchamber array chip. Appl Phys Lett. 100 (17), 173702-173703 (2012).
- Baskurt, O. K., et al. Comparison of three commercially available ektacytometers with different shearing geometries. Biorheology. 46 (3), 251-264 (2009).
- Baskurt, O. K., et al. New guidelines for hemorheological laboratory techniques. Clin Hemorheol Microcirc. 42 (2), 75-97 (2009).
- Uyuklu, M., et al. Effects of storage duration and temperature of human blood on red cell deformability and aggregation. Clin Hemorheol Microcirc. 41 (4), 269-278 (2009).
- Uyuklu, M., Meiselman, H. J., Baskurt, O. K. Effect of hemoglobin oxygenation level on red blood cell deformability and aggregation parameters. Clin Hemorheol Microcirc. 41 (3), 179-188 (2009).
- Embury, S. H., Clark, M. R., Monroy, G., Mohandas, N. Concurrent sickle cell anemia and alpha-thalassemia. Effect on pathological properties of sickle erythrocytes. J Clin Invest. 73 (1), 116-123 (1984).
- von Tempelhoff, G. F., et al. Correlation between blood rheological properties and red blood cell indices(MCH, MCV, MCHC) in healthy women. Clin Hemorheol Microcirc. 62 (1), 45-54 (2016).
- Da Costa, L., Galimand, J., Fenneteau, O., Mohandas, N. Hereditary spherocytosis, elliptocytosis, and other red cell membrane disorders. Blood Rev. 27 (4), 167-178 (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon