Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерения деформируемости и неоднородность эритроцитов в крови, Ektacytometry
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем методы оценки деформируемости эритроцитов и гетерогенность клеточных ektacytometry. Эти методы применяются для общего исследования деформируемости эритроцитов и конкретные исследования заболеваний крови, характеризуется наличием жесткой и деформируемого красных клеток в обращении, как серповидно-клеточная анемия.
Аннотация
Снижение эритроцитов деформируемости характерно несколько расстройств. В некоторых случаях масштабы дефектных деформируемости может предсказать тяжести заболевания или возникновения серьезных осложнений. Ektacytometry использует Лазерный дифракционный вискозиметрия измерить деформируемость эритроцитов при условии увеличения напряжения сдвига или осмотический градиент на постоянное значение приложенного напряжения сдвига. Однако измерения прямого деформируемости трудно интерпретировать при измерении разнородные крови, которое характеризуется наличием жесткой и деформируемого красных клеток. Это обусловлено жесткой клеток неспособность правильно согласовать в ответ касательное напряжение и результаты в искаженной дифракционный рисунок отмечен преувеличенные снижением очевидной деформируемости. Измерение степени искажения обеспечивает показатель гетерогенности эритроцитов в крови. В серповидно-клеточная анемия это связано с доля жесткой клеток, который отражает концентрацию гемоглобина и состав гемоглобина в эритроцитах. Помимо измерения деформируемости, осмотический градиент ektacytometry предоставляет сведения о осмотической хрупкости и гидрации эритроцитов. Эти параметры также отражать состав гемоглобин красных кровяных клеток от Серп клеток пациентов. Ektacytometry меры деформируемости популяции красных клеток и, таким образом, представлять информацию о деформируемости или механических свойств отдельных эритроцитов. Независимо от того методов, описанных в данном документе призвана обеспечить удобный и надежный способ для измерения деформируемости и клеточных неоднородность крови. Эти методы могут быть полезны для мониторинга временных изменений, а также прогрессирования заболевания и реакции для терапевтической интервенции в несколько расстройств. Серповидноклеточная анемия является одним из хорошо известных примеров. Другие потенциальные расстройств, где измерения деформируемости эритроцитов и/или неоднородности представляют интерес включают хранения крови, диабет, инфекции Plasmodium , дефицит железа и гемолитической анемии вследствие дефектов мембраны.
Введение
Ektacytometry обеспечивает удобный мера деформируемости эритроцитов в ответ на изменения в касательное напряжение (измеряется в паскалях (ПА)) или приостановления средних осмотического давления. Соответствующие параметры деформируемости эритроцитов включают индекс Максимальное удлинение (EI Макс), мера максимального деформируемость эритроцитов в ответ на растущее напряжение сдвига и напряжение сдвига ½ (SS ½), касательное напряжение, необходимых для достижения половину максимального деформируемости. 1 осмотический градиент ektacytometry имеет несколько информативных параметров. Они включают минимальный индекс удлинения (EI мин), мера отношение поверхности к объему и осмотического давления, при котором это происходит (O мин), которая является мерой осмотической хрупкости. EI Макс и осмотического давления, при котором это происходит (O (EI Макс)) представить информацию о площади поверхности мембраны гибкость и клеток. Половина Максимальное удлинение в гипертонический руку осмотического градиента представлена EI гипер. EI гипер и осмотического давления, при котором это происходит, O гипер, предоставить информацию о внутриклеточной вязкость эритроцитов, которая определяется концентрация гемоглобина. 2 , 3 измерение деформируемости в гетерогенных крови осложняется тем, что жесткие клеток, таких как sickled красных кровяных клеток, не правильно выровнять с направлением потока например деформируемого клетки в ответ на увеличение напряжения сдвига. А не производя характерный эллиптической дифракции изображения, жесткой клетки производят сферические шаблон, который приводит в ромбовидной дифракционный рисунок при наложении на эллипс, производимые деформируемые ячейки. 4 , 5 , 6 сферической модели было показано, чтобы соответствовать необратимо sickled клетки, выполняя ektacytometry на отдельные фракции после центрифугирования плотность клеток. 6 расчет индекса удлинение включает меры, длинной и короткой оси эллипса; ромб поэтому производит очевидное снижение относительного удлинения, увеличивая ширину короткой оси. 7 ранее показано, что степень искажения модели дифракции соотносится с процент гемоглобина серпа (ХБС) и доля sickled клеток в крови пациентов с серповидно-клеточная анемия. 5 степень искажения модели дифракции может быть получено сложного математического анализа. 8 она может быть также получена путем корректировки открытия диафрагмы на ektacytometer или серый уровень установку программного обеспечения, чтобы изменить высоту модели дифракции. 5 однако, подробности о том, как настроить уровень серого не хорошо определены и диафрагмы не является легко доступной на последнего поколения коммерчески доступных ektacytometer. Чтобы обойти эти проблемы, легко доступные камеры выгоды может использоваться для регулировки высоты картина дифракции. 9 использование этого метода для оценки сотовой неоднородность, степень искажения модели дифракции может быть соотнесена с процентом фетального гемоглобина в крови больных с серповидно-клеточная анемия. 10 несколько параметров осмотический градиент ektacytometry также коррелируют с долей плода или серп гемоглобина в крови у больных с серповидно-клеточная анемия. Дифракционной картины искажения корреляции вероятно отражают вклад состав гемоглобина процент жесткая, не деформируемым клеток. Дополнительный интерес весь осмотический градиент ektacytometry профиль подвергается двухфазный изменения, которые соответствуют процент плотной клеток в обращении во время кризиса Серповидноклеточная. 11
Ektacytometry также полезны в изучении нескольких других расстройств. Осмотический градиент ektacytometry диагностики для унаследованного эритроцитарной мембраны расстройств, таких как наследственной сфероцитоза, наследственный elliptocytosis и наследственной pyropoikilocytosis. 3 , 12 , 13 , 14 деформируемости сокращение происходит в железодефицитной анемии. 15 характеристика «хранения поражения» крови использовала ektacytometry и будущих исследований, изучения как характер поражения и вмешательства для предотвращения его формирования во время хранения накренился крови могут извлечь выгоду из представленные здесь методики. 16 Уменьшившийся деформируемости эритроцитов также были коррелирует с микрососудистой заболевания диабета. 17 недавних исследований, связывающих гипергликемии, концентрации аскорбата эритроцитов и осмотической хрупкости предлагаю эти факторы могут быть важным в развитии микрососудистой болезни. 18 Ektacytometry исследования ведутся в настоящее время расследовать эту гипотезу (Parrow и Левин, неопубликованные данные). Крови стадии малярийные инфекции является еще один интересный авеню расследований деформируемости эритроцитов. Сотовый деформируемость Plasmodium falciparum инфицированных красных кровяных клеток снижается резко в течение 48 часов внутриклеточных созревания паразита от кольцевой этап Шизонт сцену. Данные свидетельствуют, что это снижение деформируемости восстанавливается после созревания паразита. Реверсирование совпадает с выпуска инфицированных эритроцитов в кровоток. Считается, что снижение деформируемости опосредовано Plasmodium белки, которые способствуют связыванию красных клеток. 19 эти исследования представляют собой небольшой выборки клинически важные условия, где измерения деформируемость эритроцитов и осмотический градиент параметры актуальны. Существует несколько дополнительных областей исследования.
Альтернативные методы для измерения деформируемости эритроцитов включают в себя Оптический пинцет (также известный как лазерные ловушки), которые используют физические свойства фотонов растянуть единый эритроцитов в одном или нескольких направлениях. 20 эта техника имеет преимущество измерения деформируемость эритроцитов одной, но некоторая неопределенность в силу Калибровка производится значительная изменчивость через исследования 21 и анализ данных может быть трудоемкой если автоматизированы. 22 микропипеткой стремление, которое использует отрицательное давление аспирационная эритроцитов в микропипеткой, также используются для измерения деформируемости эритроцитов. 7 , 23 несколько измерений, таких как давление, необходимое для аспирационная эритроцитов, возможны с каждой меры, определяющие различные характеристики эритроцитов. 23 атомно-силовой микроскопии — это метод высоким разрешением, что меры жесткость мембраны количественной лазерного луча прогиб как индикатор отклонения кантилевера вдоль поверхности эритроцитов. 24 эти методы предоставляют информацию об отдельных эритроцитов, легко не приспособлены для измерения изменений в популяциях красных кровяных клеток и, в целом, требуют значительных технических знаний.
Желание попробовать как индивидуальных, так и популяции клеток одновременно привело к достижения в области автоматизации и развитие микрофлюидика и методов на основе массива. Как ektacytometry rheoscopy меры деформируемость как функция касательное напряжение, но образы приобретаются непосредственно через микроскоп. 25 , выше через путь анализа автоматизированных клеток был нанят производить деформируемости распределений, используя rheoscope. 26 сотовой неоднородность может быть определена количественно этот метод если доступны данные от здорового управления субъекта. 27 микрофлюидика методы позволяют также для высокой через положить анализ единичных клеток; несколько образцов, с помощью фильтрации,28 ячеек транзита анализаторы,29 , который измеряет время, необходимое для эритроцитов потока через своих и альтернатив, которые измеряют давление, необходимое для транзита эритроцитов скорее чем время 30 были разработаны. Другую платформу для высокой через положить анализ отдельных клеток является одной ячейки microchamber массив чип, который имеет дополнительное преимущество, позволяя для вниз по течению на основе флуоресценции характеристика клеток. 31 хотя каждый из этих методов является потенциально полезным и может быть лучше для конкретных приложений, сравнительные преимущества ektacytometry включает чувствительность, простоты использования и точности. 32 последнего поколения коммерчески доступных ektacytometers также имеют значительную гибкость в количество анализов, которые могут быть выполнены.
Access restricted. Please log in or start a trial to view this content.
протокол
Все предметы в этом исследовании дал письменного информированного согласия в соответствии с Хельсинкской декларации и национальных институтов из здравоохранения институционального обзора Совет утвердил протоколов.
1. Точение на ektacytometer
- Подключите труб из моющего раствора к низкой и высокой osmolar поливинилпирролидона (ПВП) решения. Будьте осторожны, чтобы подключить к высоким osmolar раствор 0 osmolar трубки в низкой osmolar решение и 500 osmolar трубки.
Примечание: Низкая osmolar PVP раствор должен иметь осмотического давления между 35 и 55 milliosmoles за килограмм (мОсм/кг), pH 7,25-7,45 при 25 ° C и вязкость между centipoise (cP) 27.0 и 33.0 37.0 ± 0.5 ° C. Высокая osmolar PVP решение должен иметь осмотического давления между 764 и 804 мОсм/кг, рН 7,25-7,45 при 25 ° C и определенную вязкость 27,0-33,0 cP 37.0 ° 0,5 ° C. - Убедитесь, что Боб полностью опущенной в чашку. Запуск программного обеспечения и премьер-машина (, проверить оборудование | IO документа). Разрешить инструмент для завершения цикла грунтовки. После завершения цикла поднять Боб из Кубка и полностью высушите Боб и Кубок с низкой lint очистки ткани.
Примечание: Остатки воды будет лизируют красных клеток, производство вмешательства.
2. Измерение деформируемость как функция увеличения напряжения сдвига
- Получение крови (менее 1 мл достаточно для выполнения этих методов с реплицирует) во флаконе, содержащий антикоагулянт соответствующие.
Примечание: ЭДТА отдается предпочтение перед гепарина, потому что она имеет меньше влияния на hemorheological параметры. 33 крови держать при комнатной температуре, если измерения проводятся в течение 6 часов крови обратить. - Осторожно Смешайте образцов цельной крови перед началом тестирования путем переворачивать флакон несколько раз. 25 мкл цельной крови по 5 мл раствора iso-osmolar PVP, дозирование, Крышка флакона и осторожно перемешать путем переворачивать несколько раз. Iso-osmolar PVP решение должен иметь осмотического давления между 284 и 304 мОсм/кг, pH 7,3-7,4 при 25 ° C и вязкость 27,0-33,0 cP 37.0 ± 0.5 ° C.
- О программном обеспечении выберите деформируемости из главного меню. Создайте новый анализ и добавьте экспериментальные данные (деформируемости | Добавьте требуемый детали | Хорошо).
- Поднимите крышку ektacytometer, убедитесь, что Боб полностью опускают в Кубок и Кубок превращается.
- Добавьте 1 мл раствора крови PVP в пространство между Кубок и Боб, закупорить.
- Поднимите Боб слегка, чтобы принести образцы вниз. Подождите, пока все пузырьки переехали из раствора, а затем закройте крышку для ektacytometer. При необходимости нажмите кнопку аспирации для удаления пузырьков.
- Отрегулируйте усиление до 200, перемещая стрелку вдоль полосы прокрутки на программное обеспечение (см. Примечание). Когда температура стабильна при 37 ° C и дифракционные изображения является стабильным, нажмите Пуск, (Начало).
Примечание: Для многих исследований хороший дифракционного изображения могут быть получены здоровой крови (гемоглобин концентрации > 12,0 г / дл, средний объем эритроцитов 80-96 ФЛ и Средняя корпускулярная гемоглобина концентрации 33-36 г/дл) с получить камеру, равным 200. Для исследования крови от серповидно-клеточная анемия регулировка усиления камеры для создания изображения дифракции 4,5 см было предложено как значение по умолчанию для сравнения результатов различных исследований и лабораторий. 9 - Соблюдайте дифракционные текстуры как прогрессирует приобретение данных для обеспечения циркулярный, эллиптические или ромбовидной формы. После завершения сбора данных, сохранить или распечатать отчет (файл | Сохранить или файла | Печать). EI Макс и СС ½ значения будет сообщаться автоматически, а также удлинение индексов, соответствующий определяемый пользователем или по умолчанию сдвиг подчеркивает. Данные будут также сохранены автоматически программным обеспечением.
- В конце концов нажмите чистый вариант в диалоговом окне на экране компьютера (Clean). После того, как образец будет придыханием, промойте пространство между Кубок и Боб, брызгали обессоленной воды в пространство инструмент остается в чистой цикла. После завершения цикла чистой поднять Боб из Кубка и полностью высушите Боб и Кубок с низким волокна, платки для очистки (Критический: остатки воды будет лизируют красных клеток, производство вмешательства).
- Нажмите на кнопку Главное меню на программное обеспечение, чтобы вернуться на главную страницу (Главное меню).
3. Измерение гетерогенность клеточных
- Осторожно Смешайте образцов цельной крови перед началом тестирования путем переворачивать флакон несколько раз. Накапайте 25 мкл цельной крови на новой 5 мл флакон раствора PVP iso-osmolar, Крышка флакона и смешайте нежно переворачивать до тех пор, пока смесь не станет однородной.
- В главном меню выберите деформируемости. Создайте новый анализ и добавьте экспериментальные данные (деформируемости | Добавьте требуемый детали | Хорошо).
- Поднимите крышку ektacytometer, убедитесь, что Боб полностью опускают в Кубок и Кубок превращается.
- Накапайте 1 мл раствора крови PVP в пространство между Кубок и Боб.
- Подождите, пока все пузырьки переехали из раствора, а затем закройте крышку для ektacytometer.
- Убедитесь, что стабильная дифракции изображение присутствует на экране. Настройте камеры выгоды, перемещая стрелку вдоль полосы прокрутки на программное обеспечение до тех пор, пока он производит 3.8 см Высота дифракции. Использование линейки для проверки высоты изображения на экране компьютера.
- Когда температура стабильна при 37 ° C и дифракционные изображения является стабильным, нажмите Пуск, (Начало).
- По мере приобретения данных чтобы они оставались в круговой, эллиптические или ромбовидным наблюдать дифракционные текстуры. После завершения сбора данных, сохранить или распечатать отчет (файл | Сохранить или файл | Печать).
- В конце концов нажмите чистый вариант в диалоговом окне на экране компьютера (Clean). После того, как образец будет придыханием, промойте пространство между Кубок и Боб, брызгали деионизированной воды из бутылки шприц в нее инструмент остается в чистой цикла. После завершения цикла чистой поднять Боб из Кубка и полностью высушите Боб и Кубок с низким волокна, платки для очистки (Критический: остатки воды будет лизируют красных клеток, производство вмешательства).
- Повторите шаги 2.1-2.5 и регулировка усиления камеры для получения высота 4,5 см по дифракции шаблон (шаг 2.2).
- Повторите шаги 2.1-2.5 и регулировка усиления камеры для получения высота 5,4 см по дифракции шаблон (шаг 2.2).
- В конце концов нажмите на кнопку главного меню, чтобы вернуться на главную страницу программного обеспечения (главное меню).
- Чтобы определить степень искажения дифракции шаблон, основанный на Макс EI в процентах, используйте следующее уравнение (же уравнение может быть выполнена с данными из 4,5 см Высота дифракции шаблон по желанию):
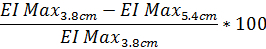
- Аналогично для определения степени дифракции искажения шаблон на основе SS1/2 использования же уравнение с заявленной стоимостью SS1/2:
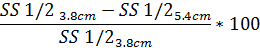
4. осмотический градиент ektacytometry
- Получение выборки, как описано в 1.1. Осторожно Смешайте образцов цельной крови перед началом тестирования путем переворачивать несколько раз. Добавить 250 мкл цельной крови в PVP iso-osmolar в 5 мл во флаконе, дозирование, Крышка флакона и осторожно перемешать путем переворачивать до тех пор, пока смесь не станет однородной.
- Выберите osmoscan в главном меню (Osmoscan). Место флакон, содержащий крови PVP решения под иглу на левой стороне машины. Опустите иглу, пока он не коснется нижней части флакона. Убедитесь, что трубка правильно подключен к низкой и высокой osmolar решения для градиента производства. Закройте крышку для ektacytometer и открыть дверь на нижней половине, так что вы можете смотреть введите трубки крови.
- Нажмите новый анализ и тип экспериментальные данные (Osmoscan | Новый анализ | Введите требуемый детали | Хорошо). Настроить камеры получить до 200, перемещая стрелку, контролировать его на программное обеспечение и позволить машину работать до тех пор, пока кровь рассматривается ввода Кубок из труб под инструмент.
- После того, как кровь вступил Кубок и стабильной дифракции шаблон изображение на экране компьютера, Начните сбор данных, нажав Пуск теперь кнопка в диалоговом окне (начать сейчас).
- Дайте ektacytometer для получения данных до приблизительно 500 мОсм/кг, а затем остановить инструмент. Сохранить или распечатать отчет (файл | Сохранить или файла | Печать). Данные также будут автоматически сохранены.
- Удалите старый флакон крови PVP. Замените его с чистой флакон, содержащий обессоленной воды. Поместите его под иглу, принести иглу вниз так, что она коснется нижней части флакона и нажмите кнопку промывки в диалоговом окне чтобы промыть систему градиента (полоскание).
- После завершения промывки нажмите чистый вариант в диалоговом окне на экране компьютера (Clean). После завершения цикла чистой поднять Боб из Кубка и полностью высушите Боб и Кубок с низким волокна, платки для очистки (Критический: остатки воды будет лизируют красных клеток, производство вмешательства).
Примечание: В докладе osmoscan обеспечивает удлинение индексы осмотический градиент. EI гипер, EI мин, EI Макс, O (EI Макс), O (EI мин) и O гипер генерируются автоматически и включены в отчет. Спектр осмотический градиент ektacytometry параметры, полученные из крови от 9 здоровых добровольцев: EI мин 0,12-0.196 условные единицы (а.е.); O мин 117-144 мОсм/кг; EI макс 0.551-0,573 а.е.; O (EI Макс) 272-312 мОсм/кг; EI гипер 0,278-0.286; O гипер 454-505 мОсм/кг.
5. Отключение ektacytometer
- Очистите инструмент правильно, прежде чем он завершает работу.
- Для этого подключите труб от низкого и высокого osmolar решений к y адаптер, ведущих к чистящим раствором. Место флакон с чистящим раствором ниже иглы на левой стороне машины и опустите иглу, пока он не коснется нижней части флакона. Убедитесь, что Боб полностью опущенной в чашку.
- Закрыть программного обеспечения и нажмите начать на конце дня чистой диалогового окна на мониторе компьютера (Close | Начало). Разрешить инструмент для циклического перебора очистки полностью.
- Отсоедините трубку к бутылке, отходов и извлеките его из инструмента отказаться от отходов. Боб насухо. Выключите машину.
Access restricted. Please log in or start a trial to view this content.
Результаты
Ektacytometry результаты, описанные в этой рукописи может использоваться для измерения деформируемости эритроцитов в любом состоянии. Схематическое изображение общего набора до ektacytometer показано на рисунке 1. Однородное население эритроцитов будет производ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Ektacytometry методы, описанные простой и хорошо автоматизированных, обеспечение действительны и воспроизводимые результаты. Тем не менее существуют некоторые важные шаги. Контроль правильной температуры крови имеет важное значение. Хранения при комнатной температуре более восьми часов м?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана интрамуральных исследовательской программы национальных институтов диабета, пищеварительной и заболеваний почек и Национальный сердца, легких и крови института национальных институтов здоровья. Мнения, высказанные здесь, являются предметом ответственности авторов и не обязательно отражают официальную точку зрения национальных институтов здоровья.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| LoRRca MaxSis standard version | Mechatronics | LORC109000 | |
| LoRRca MaxSis Osmoscan | Mechatronics | LORC109001 | |
| Polyvinylpyrrolidone solution (PVP) 0mOsm | Mechatronics | QRR030910 | |
| Polyvinylpyrrolidone solution (PVP) 500mOsm | Mechatronics | QRR030930 | |
| Polyvinylpyrrolidone solution (PVP) 5mL vials | Mechatronics | QRR030901 | |
| X clean | Mechatronics | QRR010946 | |
| P1000 | MilliporeSigma | Z646555 | |
| P200 | MilliporeSigma | Z646547 | |
| P200 filter tips | MidSci | AV200-H | |
| P1250 filter tips | MidSci | AV1250-H | |
| Kimwipes | MidSci | 8091 | |
| 1.5 mL eppendorf tubes | MidSci | AVSS1700 | |
| 15 mL conical vial | MidSci | C15R |
Ссылки
- Bessis, M., Mohandas, N., Feo, C. Automated ektacytometry: a new method of measuring red cell deformability and red cell indices. Blood Cells. 6 (3), 315-327 (1980).
- Clark, M. R., Mohandas, N., Shohet, S. B. Osmotic gradient ektacytometry: comprehensive characterization of red cell volume and surface maintenance. Blood. 61 (5), 899-910 (1983).
- Da Costa, L., et al. Diagnostic tool for red blood cell membrane disorders: Assessment of a new generation ektacytometer. Blood Cells Mol Dis. 56 (1), 9-22 (2016).
- Clark, M. R., Mohandas, N., Shohet, S. B. Deformability of oxygenated irreversibly sickled cells. J Clin Invest. 65 (1), 189-196 (1980).
- Rabai, M., et al. Deformability analysis of sickle blood using ektacytometry. Biorheology. 51 (2-3), 159-170 (2014).
- Bessis, M., Mohandas, N. Laser Diffraction Patterns of Sickle Cells in Fluid Shear Fields. Blood Cells. 3, 229-239 (1977).
- Kim, Y., Kim, K., Park, Y. Blood Cell - An Overview of Studies in Hematology. Moschandreou, T. E. , InTech. (2012).
- Streekstra, G. J., Dobbe, J. G., Hoekstra, A. G. Quantification of the fraction poorly deformable red blood cells using ektacytometry. Opt Express. 18 (13), 14173-14182 (2010).
- Renoux, C., et al. Importance of methodological standardization for the ektacytometric measures of red blood cell deformability in sickle cell anemia. Clin Hemorheol Microcirc. 62 (2), 173-179 (2016).
- Parrow, N. L., et al. Measurements of red cell deformability and hydration reflect HbF and HbA2 in blood from patients with sickle cell anemia. Blood Cells Mol Dis. 65, 41-50 (2017).
- Ballas, S. K., Smith, E. D. Red blood cell changes during the evolution of the sickle cell painful crisis. Blood. 79 (8), 2154-2163 (1992).
- Johnson, R. M., Ravindranath, Y. Osmotic scan ektacytometry in clinical diagnosis. J Pediatr Hematol Oncol. 18 (2), 122-129 (1996).
- Mohandas, N., Clark, M. R., Jacobs, M. S., Shohet, S. B. Analysis of factors regulating erythrocyte deformability. J Clin Invest. 66 (3), 563-573 (1980).
- Lazarova, E., Gulbis, B., Oirschot, B. V., van Wijk, R. Next-generation osmotic gradient ektacytometry for the diagnosis of hereditary spherocytosis: interlaboratory method validation and experience. Clin Chem Lab Med. 55 (3), 394-402 (2017).
- Anderson, C., Aronson, I., Jacobs, P. Erythrocyte Deformability is Reduced and Fragility increased by Iron Deficiency. Hematology. 4 (5), 457-460 (1999).
- Reinhart, W. H., et al. Washing stored red blood cells in an albumin solution improves their morphologic and hemorheologic properties. Transfusion. 55 (8), 1872-1881 (2015).
- Shin, S., et al. Progressive impairment of erythrocyte deformability as indicator of microangiopathy in type 2 diabetes mellitus. Clin Hemorheol Microcirc. 36 (3), 253-261 (2007).
- Tu, H., et al. Low Red Blood Cell Vitamin C Concentrations Induce Red Blood Cell Fragility: A Link to Diabetes Via Glucose, Glucose Transporters, and Dehydroascorbic Acid. EBioMedicine. 2 (11), 1735-1750 (2015).
- Tiburcio, M., et al. A switch in infected erythrocyte deformability at the maturation and blood circulation of Plasmodium falciparum transmission stages. Blood. 119 (24), e172-e180 (2012).
- Henon, S., Lenormand, G., Richert, A., Gallet, F. A new determination of the shear modulus of the human erythrocyte membrane using optical tweezers. Biophys J. 76 (2), 1145-1151 (1999).
- Mills, J. P., Qie, L., Dao, M., Lim, C. T., Suresh, S. Nonlinear elastic and viscoelastic deformation of the human red blood cell with optical tweezers. Mech Chem Biosyst. 1 (3), 169-180 (2004).
- Moura, D. S., et al. Automatic real time evaluation of red blood cell elasticity by optical tweezers. Rev Sci Instrum. 86 (5), 053702(2015).
- Evans, E. A. New membrane concept applied to the analysis of fluid shear- and micropipette-deformed red blood cells. Biophys J. 13 (9), 941-954 (1973).
- Chen, X., Feng, L., Jin, H., Feng, S., Yu, Y. Quantification of the erythrocyte deformability using atomic force microscopy: correlation study of the erythrocyte deformability with atomic force microscopy and hemorheology. Clin Hemorheol Microcirc. 43 (3), 243-251 (2009).
- Musielak, M. Red blood cell-deformability measurement: review of techniques. Clin Hemorheol Microcirc. 42 (1), 47-64 (2009).
- Dobbe, J. G., Streekstra, G. J., Hardeman, M. R., Ince, C., Grimbergen, C. A. Measurement of the distribution of red blood cell deformability using an automated rheoscope. Cytometry. 50 (6), 313-325 (2002).
- Dobbe, J. G., et al. Analyzing red blood cell-deformability distributions. Blood Cells Mol Dis. 28 (3), 373-384 (2002).
- Kikuchi, Y., Arai, T., Koyama, T. Improved filtration method for red cell deformability measurement. Med Biol Eng Comput. 21 (3), 270-276 (1983).
- Moessmer, G., Meiselman, H. J. A new micropore filtration approach to the analysis of white cell rheology. Biorheology. 27 (6), 829-848 (1990).
- Guo, Q., et al. Microfluidic analysis of red blood cell deformability. J Biomech. 47 (8), 1767-1776 (2014).
- Doh, I., Lee, W. C., Cho, Y. H., Pisano, A. P., Kuypers, F. A. Deformation measurement of individual cells in large populations using a single-cell microchamber array chip. Appl Phys Lett. 100 (17), 173702-173703 (2012).
- Baskurt, O. K., et al. Comparison of three commercially available ektacytometers with different shearing geometries. Biorheology. 46 (3), 251-264 (2009).
- Baskurt, O. K., et al. New guidelines for hemorheological laboratory techniques. Clin Hemorheol Microcirc. 42 (2), 75-97 (2009).
- Uyuklu, M., et al. Effects of storage duration and temperature of human blood on red cell deformability and aggregation. Clin Hemorheol Microcirc. 41 (4), 269-278 (2009).
- Uyuklu, M., Meiselman, H. J., Baskurt, O. K. Effect of hemoglobin oxygenation level on red blood cell deformability and aggregation parameters. Clin Hemorheol Microcirc. 41 (3), 179-188 (2009).
- Embury, S. H., Clark, M. R., Monroy, G., Mohandas, N. Concurrent sickle cell anemia and alpha-thalassemia. Effect on pathological properties of sickle erythrocytes. J Clin Invest. 73 (1), 116-123 (1984).
- von Tempelhoff, G. F., et al. Correlation between blood rheological properties and red blood cell indices(MCH, MCV, MCHC) in healthy women. Clin Hemorheol Microcirc. 62 (1), 45-54 (2016).
- Da Costa, L., Galimand, J., Fenneteau, O., Mohandas, N. Hereditary spherocytosis, elliptocytosis, and other red cell membrane disorders. Blood Rev. 27 (4), 167-178 (2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены