Method Article
تحليل الجريان خارج الخلية عزل وتوصيف وإنتاجية عالية للماوس الأساسي كلوي أنبوبي الخلايا الظهارية
In This Article
Summary
يوفر هذا البروتوكول نهج فعال من حيث التكلفة لعزل وتحديد خصائص الماوس الأساسي كلوي أنبوبي الخلايا التي يمكن بعد ذلك شبه مثقف لتقييم الوظائف البيولوجية الكلوي السابقين فيفو، بما في ذلك الاستقلاب المتقدرية.
Abstract
خلل الميتوكوندريا في الخلايا الظهارية الأنبوبي الكلوي (تيكس) يمكن أن تؤدي إلى التليف الكلوي، وسببا رئيسيا لأمراض الكلي المزمنة (كد). ولذلك، قد يوفر تقييم الوظيفة المتقدرية في الابتدائي تيكس نظرة متعمقة في حالة الطاقة البيولوجية للخلايا، وتوفير نظرة ثاقبة في الفسيولوجيا المرضية لكد. في حين هناك عدد من البروتوكولات المعقدة المتاحة لعزل وتنقية من الأنابيب الدانية في الأنواع المختلفة، المجال يفتقر إلى أسلوب فعال من حيث التكلفة الأمثل لعزل الخلية أنبوبي دون الحاجة لتنقية. هنا، نحن نقدم بروتوكولا عزلة التي تسمح للدراسات التي تركز على المرحلتين الابتدائية الماوس تيكس الكلوية القريبة والبعيدة. بالإضافة إلى كواشف فعالة من حيث التكلفة والإجراءات الحيوان الحد الأدنى المطلوب في هذا البروتوكول، الحفاظ على مستويات عالية من الطاقة بعد عزل الخلايا المعزولة ويمكن أن يكون شبه مثقف ما يصل إلى أربعة مقاطع، مما يسمح للدراسات المستمرة. وعلاوة على ذلك، استخدام محلل الجريان خارج الخلية إنتاجية عالية، علينا أن نقيم التنفس المتقدرية مباشرة في تيكس معزولة في صفيحة 96-البئر الذي نحن نقدم توصيات للتحسين من كثافة الخلية وتركيز المركب. وتشير هذه الملاحظات إلى أنه يمكن استخدام هذا البروتوكول للدراسات الأنبوبي الكلوي فيفو السابقين مع إنتاج تيكس الكلوي متسقة وموحدة جيدا. قد يكون هذا البروتوكول أوسع التطبيقات المستقبلية لدراسة خلل mitochondrial المرتبطة باضطرابات الكلي لاكتشاف المخدرات أو لأغراض تحديد خصائص المخدرات.
Introduction
وظيفة الخلية الظهارية الأنبوبي الكلوي (TEC) يرتبط ارتباطاً قويا بالحالة الصحية العامة للكلى. الإشارات المرضية في الكلي يسبب ديديفيرينتييشن تيكس، الذي يلعب دوراً رئيسيا في التليف الكلي والكلى المزمن المرض (كد)1،2. كهيئة نشطة جداً، الكلي الثاني فقط للقلب في استهلاك الأكسجين، أساسا من خلال الفسفرة المتقدرية3. كشفت دراسات المجهر الإلكتروني وجود ترابط إيجابي المتقدرية التغيرات المورفولوجية للأحداث المرضية الكلوية4. خلل mitochondrial في تيكس تسبب التليف الكلوي خلال المرحلة الانتقالية الظهارية للوسيطة5 و أكسدة الأحماض الدهنية المعيبة6. التليف هو علم أمراض كلوية تقدمية التي ينتج عنها كد. ولذلك، فهم حالة نشطة من تيكس الكلوي ضرورة لكشف الفسيولوجيا المرضية لكد.
وهناك أنواع الخلية > 20 في الكلي الكبار7. لدراسة وظيفة تيكس، هناك حاجة إلى ثقافة الأولية للخلايا الظهارية الكلوي كمنصة لتطبيقات البيولوجيا الجزيئية مثل العلاجات الكيميائية والتلاعبات الجينية. الأهم من ذلك، يمكن أن يتم التلاعب الجيني في فيفو في الفئران عن طريق ترانسجينيسيس أو باستخدام تقنيات إيصال الجينات في إف8 حيث أن الفعل التلاعب الخلايا الابتدائية معزولة وراثيا. عزل خلايا أنبوبي كلوي الأولية من الفئران9،10والفئران11،،من1213والانياب14،15،الأرانب16والبشر17 ،18 تم الإبلاغ عن مع خطوات تنقية تسفر عن خلايا أنبوبية الدانية نقية. في هذه البروتوكولات المنشورة سابقا التي تركز على عزل خلايا أنبوبية الدانية، والطرد المركزي التدرج والفرز تجارب أجريت ل أغراض تنقية19. في حين أن هذه البروتوكولات قيمة لدراسة الأنابيب الدانية، فغير كافية عندما الأنابيب الدانية والبعيدة على حد سواء، تحتاج إلى دراسة. على سبيل المثال، كشفت دراستنا على متلازمة ألبرت الكلوية القريبة والبعيدة على السواء دوراً هاما في تطور المرض20، و ولذلك ينبغي التحقيق في كلا النوعين من الكلوية في الثقافة. وأظهرت دراسة أجريت مؤخرا عن السمية الكلوية فلوريد أيضا أن حدثت تغيرات باثولوجية في كلا من الأنابيب الدانية والبعيدة21. ولذلك، تصميم هذا البروتوكول العزلة والأمثل لخلايا أنبوبية القريبة والبعيدة على حد سواء من الكليتين الماوس بتكلفة أدنى من الكواشف وإجراءات بسيطة. بدلاً من ذلك، يمكن أن المحققين لا يزال يتبع البروتوكول حتى الخطوة 3.1 وإضافة خطوات تنقية9 من هذه النقطة إلى الأمام لعزل خلايا أنبوبية الدانية نقية.
يقدم مستويات عالية حيوية الخلايا المعزولة والحفاظ على الخصائص الظهارية الكلوي بعد الثقافات الفرعية للممرات 4. استخدام محلل الجريان خارج الخلية إنتاجية عالية، نقوم بتقييم التنفس المتقدرية مباشرة في تيكس معزولة في لوحة 96-جيدا، الأمر الذي يؤدي إلى مزيد من الإيضاحات في الخلية كثافة الأمثل. هذه الملاحظات تشير إلى أنه يمكن تطبيق هذا البروتوكول للدراسات الأنبوبي الكلوي فيفو السابقين مع إنتاج تيكس الكلوي متسقة وموحدة جيدا. أهمية إضافية من هذا البروتوكول هو استخدام مجدية كأداة إنتاجية عالية للتوصيف السابقين فيفو الاستقلاب الميتوكوندريا في الخلايا الأنبوبي الكلوي القريبة والبعيدة. ولذلك، يمكن بمثابة منصة لاكتشاف العقاقير أو المخدرات توصيف أغراض اضطرابات الكلي.
Protocol
جميع التجارب التي تنطوي على الحيوانات بموافقة لجنة الاستخدام في جامعة ميامي، تتسق مع المبادئ التوجيهية للمعاهد الوطنية للصحة ورعاية الحيوان المؤسسية.
1-لوحة طلاء وإعداد الكواشف
- إعداد طلاء الكولاجين:
- إضافة ميكروليتر 35 الكولاجين الأول إلى 2 مل حل حامض الخليك تمت تصفيتها قبل 20 ملم على طبق بيتري 60 ملم واحد. احتضانها في درجة حرارة الغرفة ح 1، أيردري عليه، وتعريضه للأشعة فوق البنفسجية.
- أغسل الطلاء x 3 مع برنامج تلفزيوني لإزالة أي بقايا حمض وحفظه في 37 درجة مئوية CO2-حاضنة الثقافة الخلية الحرة حتى الخلايا على استعداد للبذر. يكون التركيز النهائي للطلاء الكولاجين 5 ميكروغرام/سم2.
- إعداد المخزن المؤقت التروية: إضافة 300 ميكروليتر من البنسلين-ستربتوميسين (P/S) إلى 30 مل من برنامج تلفزيوني والاحماء المخلوط في حمام مائي 37 درجة مئوية حتى تبدأ العزلة.
- إعداد المخزن المؤقت الهضم: حل 3.9 ملغم نوع كولاجيناز 2 إلى 30 مل من برنامج تلفزيوني، وتصفية الحل من خلال عامل تصفية أعلى زجاجة 0.2 ميكرومتر والاحماء في حمام مائي عند 37 درجة مئوية حتى تبدأ العزلة.
- تعد وسائل الإعلام ثقافة الخلية:
- إحضار الملاحق إلى درجة حرارة الغرفة. دون الترشيح، وإضافة الملحق (0.05 مل مصل العجل الجنين، 10 نانوغرام/مل من عامل نمو البشرة، 5 ميكروغرام/مل من الأنسولين، 0.5 ميكروغرام/مل من أدرينالين، 36 نانوغرام/مليلتر الهيدروكورتيزون و 5 ميكروغرام/مل من ترانسفيرين 4 بيكوغرام/مل من triiodo-L-ثيرونيني) إلى 500 مل من كلوي 2 الخلايا الظهارية نمو متوسطة القاعدية.
- الاحماء وسائط الإعلام في حمام مائي 37 درجة مئوية حتى تصبح جاهزة للاستخدام.
- إعداد المركبات: إعداد 50 مم فككب، والروتينون 10 مم، 10 مم أوليجوميسين وأنتيميسين 10 مم أ، 50 مم ل carnitine واتوموكسير 50 ملم المخزون الحلول في [دمس]، الكوة كل منها، وتخزين المركبات عند-20 درجة مئوية.
- إعداد palmitate الصوديوم 2.5 ملم في 220 مل محلول كلوريد الصوديوم 150 مم والاحماء الحل في حمام مائي 75 درجة مئوية حتى يذوب بالميتاتي الكامل.
- إعداد ألبومين المصل البقري (BSA): إعداد مم 0.34 خالية من الدهون جيش صرب البوسنة في 250 مل من 150 مم كلوريد الصوديوم. سيطرة جيش صرب البوسنة بمثابة عنصر تحكم سلبية للحل النخلة-جيش صرب البوسنة الذي يمكن أن تعده الخطوة التالية 1.8.
- متزاوجة palmitate لجيش صرب البوسنة (النخيل-جيش صرب البوسنة):
- إضافة حل palmitate تدريجيا إلى حل جيش صرب البوسنة في حين أنها لا تزال ساخنة. ثم ضبط ال pH إلى 7.4 ومزجها في 37 درجة مئوية على الأقل 1 ح لإكمال على تصريف.
- عندما يتم الانتهاء من التصريف، إضافة 150 مل أخرى من كلوريد الصوديوم 150 مم إلى الحل ومزجها جيدا، وحفظ مختبرين في-20 درجة مئوية. الحل النهائي يحتوي على 1 مم الصوديوم palmitate و 0.17 ملم جيش صرب البوسنة وستستخدم كركيزة الأحماض الدهنية للخلايا في مقايسة الجريان خارج الخلية المستندة إلى الأحماض الدهنية.
- تحضير الجريان خارج الخلية القاعدية المقايسة الوسائط:
- إضافة 1 كيس من مسحوق دميم و 20 مل من 200 ملم لام الجلوتامين (النهائي 4 ملم) إلى 1 لتر من يعقم dH2س ومزجها بلطف.
- في يوم التجربة الاستقلاب، إضافة 100 ميكرومتر الصوديوم بيروفات إلى وسائط الإعلام القاعدية استعدادا للأعمال التحضيرية اللاحقة للتمويه خارج الخلية مقايسة وسائط الإعلام لاستخدامها في مقايسة أساس تنفس الجلوكوز أو الأحماض الدهنية.
- تحضير الوسائط المستندة إلى الجلوكوز:
- لقياس القدرة على التنفس الخلوي من خلال تحلل، إضافة مسحوق الجلوكوز 17.5 ملم و 100 ميكرومتر مراقبة جيش صرب البوسنة (كما هو موضح في الخطوة 1، 7) 20 ميكرومتر اتوموكسير (تمنع أكسدة الأحماض الدهنية) إلى وسائط الإعلام القاعدي المذكورة أعلاه في الخطوة 1، 9.
- الاحماء في وسائط الإعلام على 37 درجة مئوية، وضبط ال pH إلى 7.4 ويبقيه في حمام الماء 37 درجة مئوية حتى يتم استخدامه في مقايسة الجريان خارج الخلية.
- تحضير الوسائط المستندة إلى الأحماض الدهنية:
- لقياس القدرة على التنفس الخلوي من خلال أكسدة الأحماض الدهنية، إضافة 10 مم 2D-الجلوكوز مسحوق (التناظرية تمنع تحلل الجلوكوز)، 100 ميكرومتر النخيل-جيش صرب البوسنة (كما هو موضح في الخطوة 1.8)، و 100 ميكرومتر ل carnitine لوسائل الإعلام القاعدي المذكورة أعلاه في الخطوة 1، 9.
- الاحماء في وسائط الإعلام على 37 درجة مئوية وضبط درجة الحموضة إلى 7.4 ويبقيه في حمام الماء 37 درجة مئوية حتى يتم استخدامه في تحليل الجريان خارج الخلية.
2-نضح والهضم والكلى الحصاد من الفئران
- تخدير الماوس مع تدفق isoflurane وإصلاحه في موقف ضعيف. تأكد من أن يبدأ العزلة إلا بعد أن يفقد الحيوان ردود الفعل رايتينج وعمق مخدر ترصدها تقييمات رشة باستخدام الملقط أتروماتيك قبل وأثناء الإجراء22.
- إزالة الفراء، استخدام كريم مزيل الشعر، من الصدر الماوس إلى منطقة البطن وتطهير أنه مع اليود، ومسح بقايا مادة اليود.
- إجراء شق في الصدر وقطع الجلد لفتح منطقة البطن كله، وتكشف عن القلب والكليتين.
- إقامة مضخة التروية في 32 مل/دقيقة، وإزالة أي فقاعات في الأنابيب قبل البدء في التروية.
- إدراج إبرة 27-ز في البطين الأيسر من خلال قمة القلب بمجرد امتلاء المخزن المؤقت القلب، وكزه الاذين الأيمن لإنشاء مخرج حتى المخزن المؤقت نضح يدور كمضخات القلب ويحصل على إزالتها في نهاية المطاف من الخروج الاذين الأيمن.
- بعد نضح، التبديل سرعة المضخة إلى 30 مل/دقيقة الهضم.
- بعد 20 مل هضم هو perfused المخزن المؤقت من خلال ذروة، وإزالة كلا الكليتين لعزل خلايا أنبوبية.
3-تجهيز الأنسجة والابتدائية أنبوبي عزل الخلايا
- إزالة كبسولات الكلوية ولب وفرم كلا الكليتين إلى قطع صغيرة، واحتضان لهم في 10 مل من المخزن المؤقت الهضم في فرن 37 درجة مئوية مع تناوب لطيف لمدة 5 دقائق.
- قم بإزالة أي أنسجة الكلي عسر الهضم بتمرير المخزن المؤقت من خلال عامل تصفية 70 ميكرومتر. أضف 10 مل وسائط الثقافة لوقف عملية الهضم.
- جمع الخلايا أنبوبي، الطرد المركزي تعليق الخلية التي تم تصفيتها في 50 س ز لمدة 5 دقائق لجمع بيليه الأول. نقل المادة طافية إلى أنبوب جديد وإضافة 5 مل من ثقافة الإعلام، أجهزة الطرد المركزي في 50 س ز لمدة 5 دقائق لضمان جميع خلايا أنبوبية التي تم جمعها إلى بيليه الثاني.
يتم استخدام الطرد المركزي بسرعة أقل المقام الأول بيليه الأنابيب الثقيلة. في وقت لاحق، بعد استعادة الخلايا من العزلة، هو فصل ثقافة أنبوبي نقية بسرعة أكبر خلال الثقافات الفرعية. - ريسوسبيند بيليه الأول في 20 مل وسائط الثقافة والطرد المركزي أنه في 50 س ز لمدة 5 دقائق لجمع بيليه الثالثة.
- ريسوسبيند الكريات الثانية والثالثة في 1 مل وسائط الثقافة. تحميل ميكس 10 ميليلتر من تعليق خلية مع 10 ميليلتر تريبان الأزرق، المخلوط في الدائرة بالعد الشريحة، وسجل خلية بقاء الخلية من التلقائية مضادة (انظر الجدول للمواد).
- بذور ما يصل إلى 107 خلايا (عدد سكان غير متجانسة) على طبق 60 ملم واحد المغلفة مسبقاً مع الكولاجين وترك الخلايا أنبوبي إرفاق بين عشية وضحاها.
4-الابتدائية أنبوبي خلايا الثقافة الفرعية وتوصيف
- في اليوم الأول بعد العزلة، جمع وسائل الإعلام الثقافة والطرد المركزي أنه في 50 س ز لمدة 5 دقائق بيليه أي الأنابيب العائمة. إزالة المادة طافية وريسوسبيند بيليه الخلية في 4 مل من لوحة مرة أخرى على نفس الطبق الثقافة ووسائل الإعلام ثقافة جديدة.
- في اليوم الرابع بعد العزلة، قم بإزالة وسائط الثقافة القديمة وإضافة وسائط جديدة.
- في يوم 7 بعد العزلة، فصل الخلايا التي تفرخ لهم عند 37 درجة مئوية في 2 مل من 0.25% التربسين-يدتا للحد الأدنى 5 أضف 3 مل من ثقافة وسائل الإعلام التوقف عن رد فعل وجمع الخلايا باستخدام الطرد المركزي في 250 g x لمدة 5 دقائق.
- بدون ثقافة وتميز الخلايا من P0 إلى P1، المغلفة خلايا البذور 5,000 كل بئر على طبق من ذهب 24-جيدا مع الكولاجين أنا كما هو موضح أعلاه.
- 24 ساعة بعد الخطوة 4، 4، إصلاح الخلايا في P1 مع 4% منهاج العمل لمدة 10 دقائق، بيرميبيليزي منها بنسبة 0.2 في المائة X-100 تريتون لمدة 3 دقائق، ومنعها مع 10% حمار المصل (DS) ح 1 في درجة حرارة الغرفة.
- تمييع، إلى 1: 100 في المائة 10 س، وكل من البروتينات التالية: علامات أنبوبي الدانية angiotensinogen (AGT) وأكوابورين 1 (AQP1)؛ علامة الأنبوبي القاصي ه-كادهيرين؛ علامة ميسانجيال CD90/Thy1؛ ومستقبلات هرمون الميوسين تشبه علامات مماثلة مثل الوحدة النمطية التي تحتوي على بلعم-مثل 1 (F4/80) ومجموعة من التمايز 68 (CD68)، واحتضان لهم مع الخلايا بين عشية وضحاها في 4 درجات مئوية.
- في اليوم التالي، الكشف عن أي تلطيخ استخدام 1: 200 أرنب المضادة أو الماوس لمكافحة الفئران لمكافحة الفلورسنت الثانوي الأجسام المضادة لمدة 45 دقيقة. التقاط صور تحت المجهر [كنفوكل] لتأكيد التعبير عن العلامات، كما هو مبين في الشكل 2 ألف.
- في اليوم الثالث بعد ثقافة الفرعي P1، فصل الخلايا للثقافة الفرعية وتوصيف في P2 تلطيخ علامات أنبوبي، ميسانجيال، وبلعم هو موضح في الخطوة 4، 5. صورة تلطيخ تحت المجهر [كنفوكل] لتأكيد التعبير عن العلامات، كما هو مبين في الشكل 2 ألف.
- في اليوم الثالث بعد ثقافة فرعية P2، فصل الخلايا للثقافة الفرعية وتوصيف في P3 تلطيخ علامات أنبوبي، ميسانجيال، وبلعم هو موضح في الخطوة 4، 5. صورة تلطيخ تحت المجهر [كنفوكل] لتأكيد التعبير عن العلامات، كما هو مبين في الشكل 2 ألف.
- إعداد تلطيخ الأنسجة:
- أيردري البرية من نوع المجمدة وشرائح الكلي Col4a3-/- 1 ساعة في درجة حرارة الغرفة وإصلاحها مع 4% بيرميبيليزي منهاج عمل بيجين للحد الأدنى 10 منهم بنسبة 0.2 في المائة X-100 تريتون لمدة 10 دقائق ومنعها مع 10% حمار المصل (DS) ح 1 في درجة حرارة الغرفة. إضافة أضداد البروتينات ماركر الموضحة في الخطوة 4، 5 في 1: 200 واحتضانها لهم عند 4 درجة مئوية بين عشية وضحاها.
- في اليوم التالي، الكشف عن أي تلطيخ مع 1: 200 أرنب المضادة أو الماوس لمكافحة الفئران لمكافحة الفلورسنت الثانوي الأجسام المضادة لمدة 45 دقيقة. التقاط صور تحت مجهر [كنفوكل] لتأكيد التعبير عن العلامات، كما هو مبين في الأرقام 2 و 2 ج.
5-الميتوكوندريا الاستقلاب الإنزيم
- البذور P1 خلايا أنبوبية في 20,000، 30000، أو خلايا 40,000 كل بئر في 100 ميكروليتر من وسائط الثقافة على جهاز ميكروسكوبية 96-جيدا قبل المغلفة مع 5 ميكروغرام/سم2 الكولاجين أنا اليوم قبل فحوصات الجريان خارج الخلية.
- للماء خرطوشة الاستشعار، رفع خرطوشة الاستشعار وملء كل جيدا اللوحة مع 200 ميكروليتر من حل المعايرة. تحميل الخرطوشة بعناية مرة أخرى إلى غمر أجهزة الاستشعار في الحل المعايرة. ضع الخرطوشة في فرن 37 درجة مئوية دون CO2 على الأقل 7 ح قبل الاستخدام.
للحصول على أفضل النتائج، ينصح بترطيب خرطوشة بين عشية وضحاها. - إعداد المركبات: إعداد 8 أوليجوميسين ميكرومتر و 9 ميكرون فككب 20 ميكرومتر والروتينون/أنتيميسين A خليط الجلوكوز (كما هو موضح في الخطوة 1، 10) والأحماض الدهنية (هو موضح في الخطوة 1.11) الجريان خارج الخلية مقايسة وسائط الإعلام.
- تغيير الوسائط: نضح وسائل الإعلام ثقافة الخلية، إضافة 175 ميليلتر من وسائط فحص الجلوكوز أو الأحماض الدهنية (اعتماداً على المجمع أن يجري العمل في، راجع الخطوة 5.3)، واحتضان لهم ح 1 في 37 درجة مئوية CO2-حاضنة مجاناً.
- تحميل المنافذ خرطوشة مع 25 ميليلتر من المركبات التالية: 8 ميكرو أوليجوميسين لمنفذ أ لتحقيق تركيز نهائي من 1 ميكرومتر (ملاحظة: ككل سوف تحتوي على 175 ميليلتر لوسائل الإعلام، المجمع سوف تحصل على 8 المخفف x)، 9 ميكرو فككب في الميناء ب لتحقيق تركيز نهائي 1 ميكرومتر (ملاحظة: ككل أيضا سيحتوي 175 ميليلتر لوسائل الإعلام بالإضافة إلى 25 ميليلتر من الحل حقن من المنفذ A، المجمع سوف تحصل على 9 المخفف x)، و 20 ميكرومتر والروتينون/أنتيميسين A في ميناء ج لتحقيق تركيز نهائي 2 ميكرومتر لكل مجمع (ملاحظة : ككل أيضا سيحتوي 175 ميليلتر لوسائل الإعلام بالإضافة إلى 50 ميليلتر من الحل حقن من منافذ A و B، المجمع سوف تحصل على 10 إضعاف x).
- إضافة المياه إلى جميع الآبار في ميناء د وكافة المنافذ الأخرى من الآبار الخلفية (لا الخلايا). احتضان الخرطوشة في 37 درجة مئوية CO2-حاضنة مجاناً لمدة 10 دقائق.
- قم بتشغيل محلل الجريان خارج الخلية والمراقب المالي.
- فتح "برنامج محلل" وإدخال البروتوكول التالي:
- اختر الفحص القياسية. اضغط على معالج بالانزيم. باستخدام علامة التبويب المركبات ، تعيين تخطيط مركب واستخدام علامة التبويب المجموعات وتسميات لتسمية المجموعات التجريبية. تذكر أن تقوم بتعيين الآبار فارغة (بدون خلايا) كخلفية.
- ضمن علامة التبويب بروتوكول , تعيين دورتي ميكس والتدبير التالي باستخدام الأوامر المتوفرة كما هو مبين في الجدول 1: معايرة، المزيج لمدة 2 دقيقة، وانتظر 2 دقيقة، والتدبير لمدة 3 دقائق (كرر هذه الدورة x 2-3)؛ حقن منفذ أ، المزيج لمدة 2 دقيقة، وانتظر 2 دقيقة، بالتدبير لمدة 3 دقائق (كرر هذه الدورة x 2-3)؛ حقن المنفذ B، يخلط لمدة 2 دقيقة، وانتظر 2 دقيقة، بالتدبير لمدة 3 دقائق (كرر هذه الدورة x 2-3)؛ حقن ميناء ج، المزيج لمدة 2 دقيقة، وانتظر 2 دقيقة، بالتدبير لمدة 3 دقائق (كرر هذه الدورة x 2-3). اضغط نهاية المعالج. من الممكن أيضا لحفظ القالب الحالي لاستخدامها في المستقبل.
- اضغط على بدء لبدء المعايرة. المحلل ثم تلقائياً إخراج صاحب لوحة ويسأل عن لوحة خرطوشة لإدراجها.
- عندما يتم إجراء هذه الخطوة المعايرة (عادة في 20-25 دقيقة)، اضغط الأمر prompt تغيير لوحة خرطوشة للوحة الخلية ويستمر التشغيل.
- عندما يتم الانتهاء من التشغيل، نقل البيانات، وإزالة لوحة 96-جيدا. أضف هويشت (1:1، 000) إلى كل من الآبار المقايسة واحتضانها لهم لمدة 5 دقائق عند 37 درجة مئوية. تطبيع البيانات التعرف الضوئي على الحروف لعدد الخلايا عن طريق قياس fluorescence هويشت القراءة إثارة 355-شمال البحر الأبيض المتوسط وانبعاثات 460 نانومتر.
النتائج
نضح الكلي والهضم تسفر عن الخلايا الظهارية أنبوبي عالية قابلة للتطبيق:
الخلايا الظهارية الأنبوبي الكلوي الماوس تم عزل اتباع الخطوات الموضحة في الأقسام 1-3 من البروتوكول، المذكورة أعلاه.
بعد ديجيسشنز، كانت مطلية بعدد سكان غير متجانسة من خلايا الكلي والأنابيب غير كامل الهضم، وغيرها من الحطام الأنسجة أصغر من 70 ميكرومتر على الطبق الثقافة يوم عزلة. تغييرات من اليوم 0 يوم 1 بعد العزلة من المتوقع عادة أن ينظر فقط في المرفق الخلية بدلاً من نمو الخلايا. ابحث عن طريق السكان المتباينين عائم، أرفقت إلا بضع خلايا أنبوبية في يوم 1 (الشكل 1A). إعادة مجموعة من الخلايا في اليوم الأول، الطرد المركزي، وإعادة طلاء ساعد على إزالة الحطام الخفيفة وتسوية قطع أنبوب صغير للإفراج عن خلية أنبوبية. من اليوم الأول إلى اليوم الثالث، ومن المتوقع تغييرات ليس فقط في ارتباط خلية أفضل ولكن أيضا في معدل نمو خلايا تحسن ملحوظ الذي لوحظ بكثافة خلية ثلاثة إضعاف بالمقارنة مع يوم 1 (الشكل 1A). في مرحلة النمو الأولى، شكلت عدة مستعمرات الخلايا والمأهولة بالسكان حول المستعمرات. من هذه النقطة إلى الأمام، وقد تعافي تماما الخلايا المعزولة وعرض انتشار صحية. يوم 5، كانت الخلايا في كونفلوينسي 80-90 ٪ في طبق بتري 60 ملم مع بعض المسافات بين خلية إلى خلية ومستعمرة لمستعمرة (الشكل 1A).
الثقافة الفرعية وتوصيف الخلايا أنبوبي المعزولة:
كانت شبه مثقف الخلايا الظهارية الأنبوبي الكلوي معزولة لتوصيف التالية الخطوات المذكورة في القسم 4 من البروتوكول الموصوفة أعلاه.
من يوم 5، الخلايا المستردة من العزلة تماما وبدأت تنتشر بقوة. أسبوع واحد بعد العزلة، نمت الخلايا إلى كونفلوينسي في طبق بتري 60 ملم. بعد أسبوع واحد في ثقافة على المرور 0، الخلايا على استعداد لتكون شبه مثقف لمرور 1، ومن ثم لمقاطع أكثر من 2. أنماط النمو مشابهة لوحظت في المرور 1 والمرور 2. عادة ما يستغرق أقل من أسبوع للخلايا في المقطع 1 و 2 ليصل إلى كونفلوينسي لمزيد من الثقافات الفرعية (الشكل 1B). ثقافة مستمرة من الخلايا المتلاقية من سن 0 إلى مركز مرور 2 أظهر قبة واسعة تشكيل23،24 (الشكل 1B)، مما يوحي بالحفاظ على الخلايا المعزولة صحة جيدة حيث أنها تفرز سوائل مماثلة إلى حالة في فيفو . وهذا سبب أحادي الطبقة الخلايا لرفع قبالة اللوحة ولكن البقاء على اتصال عبر تقاطعات ضيق.
لتمييز الخلايا في الثقافة، أجرينا تلطيخ إيمونوفلوريسسينت في الخلايا المستزرعة من مرور 1 عن طريق مرور 4، وكذلك في مراقبة خلية خط إنسان الدانية كلوي هونج كونج-2 خلايا الظهارية. علامات أنبوبي الدانية، أقوابورين 1 (AQP1)25 و angiotensinogen (AGT)9، ه-كادهيرين ماركر الأنبوبي القاصي25، علامة الظهارية العضلات الملساء أكتين (SMA)26،،من2728، بلعم علامات F4/8029 و CD6830، ومستضد التمايز ثيموسيتي ماركر mesangial 1 (Thy1/CD90) واستخدمت9 دراسات التوصيف. وأعرب كلا البروتينات أنبوبي الدانية AQP1 و AGT دائماً درجة عالية في خلايا أنبوبية معزولة من مرور 1 إلى مرور 4 كذلك كما هو الحال مراقبة إيجابية هونج كونج-2 الدانية الخلايا الظهارية (الشكل 2A). بروتين أنبوبي القاصي ه-كادهيرين أعرب في خلايا أنبوبية معزولة عن طريق مرور 4 وقد لوحظ أيضا في هونج كونج--2 الخلايا (الشكل 2A). وأعرب SMA تماما في خلايا أنبوبية المعزولة وفي الخلايا التحكم هونج كونج--2، تتسق مع التقارير المنشورة26،27. من ناحية أخرى، ميسانجيال البروتين Thy1 والبروتين بلعم F4/80 كانت غائبة في خلايا أنبوبية معزولة والخلايا التحكم 2 دولار هونج كونج (الشكل 2A). أظهر تعبير الحد أدنى في هونج كونج--2 الخلايا CD68 وأصبح غير قابل للكشف من مرور 3 عن طريق مرور 4 (الشكل 2A) في خلايا أنبوبية معزولة في مرور 1 والممر 2، ومن ثم التعبير عن. وتشير النتائج إلى أن الخلايا المعزولة عقب هذا البروتوكول مزيج خلايا أنبوبي القريبة والبعيدة. لمقارنة التعبيرات عن هذه العلامة البروتينات في فيفو، أجرينا تلطيخ في أنسجة الكلي المجمدة. بما في ذلك البروتين AQP1 AGT، وهاء-كادهيرين وميسانجيال Thy1 تم العثور على علامات أنبوبي، أعرب عاليا في الكليتين حصادها من ماوس صحية البرية من نوع (الشكل 2). لاحظ في الكليتين البرية من نوع التعبيرات انخفاض F4/80 و CD68 لكن المعرب عنها على نطاق واسع في الكليتين حصادها من ماوس-/- Col4a3 التي وضعت الفشل الكلوي مع بلعم تسلل20،31 ( الشكل 2).
المقايسة الاستقلاب الميتوكوندريا في خلايا أنبوبية الأولية المعزولة:
الخطوات المقايسة التنفس المتقدرية هي المذكورة في المادة 5 من البروتوكول، المذكورة أعلاه.
التنفس المتقدرية خلايا أنبوبية الأولية المعزولة يقاس بتحليل الجريان خارج الخلية لمعدل استهلاك الأوكسجين (OCR) كثافات مختلفة والطلاء. إلى تيتراتي كثافة الطلاء، 20,000، 000 30، و 40,000 تيكس الابتدائية الواحدة وكذلك كانت تبذر على ميكروسكوبية XF96 96-جيدا في اليوم السابق (حوالي 20 ساعة قبل) مقايسة الجريان خارج الخلية (الشكل 3A). عقب تحليل الجريان خارج الخلية، ثم تم تطبيع القياسات التعرف الضوئي على الحروف لعدد خلايا بإجراء تقييم كمي لتلطيخ هويشت. تصفيح تيكس 000 20 شخص، 30,000، أو 40,000 الخلايا/البئر أسفرت OCR القاعدية متوسط 25 أو 45 أو 50 pmol/دقيقة، على التوالي (الشكل 3A). وعلاوة على ذلك، كشفت الصور المجهرية للخلايا مطلي أن 40,000 الخلايا/بئر تغطي كامل السطح من الجزء السفلي من الآبار الميكروسكوبية أفضل من كثافة الطلاء الأخرى (الشكل 3B). حتى ولو لم يزد OCR القصوى باستخدام خلايا 40,000 مقارنة بكثافة الخلايا 30,000، نوصي بكثافة خلية البالغ حوالي 000 40 خلايا/جيدا للتفاعل الأمثل بين الخلايا والمركبات.
وعلاوة على ذلك، في تجاربنا، تبين تركيز المركبات المثبطة/أونكوبلير الأمثل لتكون 1 ميكرومتر أوليجوميسين و 1 ميكرومتر فككب 2 ميكرومتر والروتينون/أنتيميسين-A (البروتوكولات المقايسة الجريان خارج الخلية وحقن منفذ مذكورة في الجدول 1 ; تجارب التحسين لا تظهر). ومع ذلك، من المستحسن لكافة المستخدمين بتشغيل اختبار أولى بتركيزات مختلفة من هذه المركبات، من الناحية المثالية أقل وأعلى من القيم التي تم نشرها، تضمن أفضل النتائج.
غلة مقايسة الجريان خارج الخلية عدد من المعالم الهامة لتقييم الاستقلاب تيكس الكلوي. على سبيل المثال، كما هو مبين في أكسدة الأحماض الدهنية على وجه التحديد معيبة في تيكس، يمكن أن تخدم استخدام الوسائط التي تحتوي على الأحماض الدهنية الركازة (بالميتاتي) جنبا إلى جنب مع مثبط لتحلل (المديرية العامة 2) كأداة مفيدة لتقييم مباشرة أكسدة الأحماض الدهنية في تيكس في الفقرات 1 و 2 (الشكل 3). في حالة التليف الكلوي، تنفس القدرة الشاملة للخلايا من المتوقع أن يكون أقل من الكلي صحية على الرغم من أن وسائل الإعلام على أساس الجلوكوز قد لا تكشف عن أي اختلافات.
أخذت معا، يمكن أن تستخدم مقايسة الجريان خارج الخلية، لا سيما لتقييم قدرة أكسدة الأحماض الدهنية، كتدبير من تدابير مفيدة لتقييم حالة نشطة من تيكس الكلوية في التغيرات المرضية التي تؤثر على لعب الشخصية الاستقلاب دور رئيسي في الانتقال إلى الفشل الكلوي والتليف الكلوي.
| الخطوات | الوقت (دقيقة) |
| معايرة | |
| حجته: | 00:12:00 |
| قياس 1 | 3 حلقات |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| حقن المنفذ (أوليجوميسين 1 ميكرومتر) | الحلقات 2 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| حقن منفذ ب (فككب 1 ميكرومتر) | الحلقات 2 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| حقن ميناء ج (2 ميكرومتر روتينون/أنتيميسين) | الحلقات 2 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
| ميكس | 00:02:00 |
| انتظري | 00:02:00 |
| قياس | 00:03:00 |
الجدول 1. توحيد تحليل الجريان خارج الخلية يستخدم البروتوكول الأمثل التعرف الضوئي على الحروف القياسات في خلايا أنبوبية الأولية.
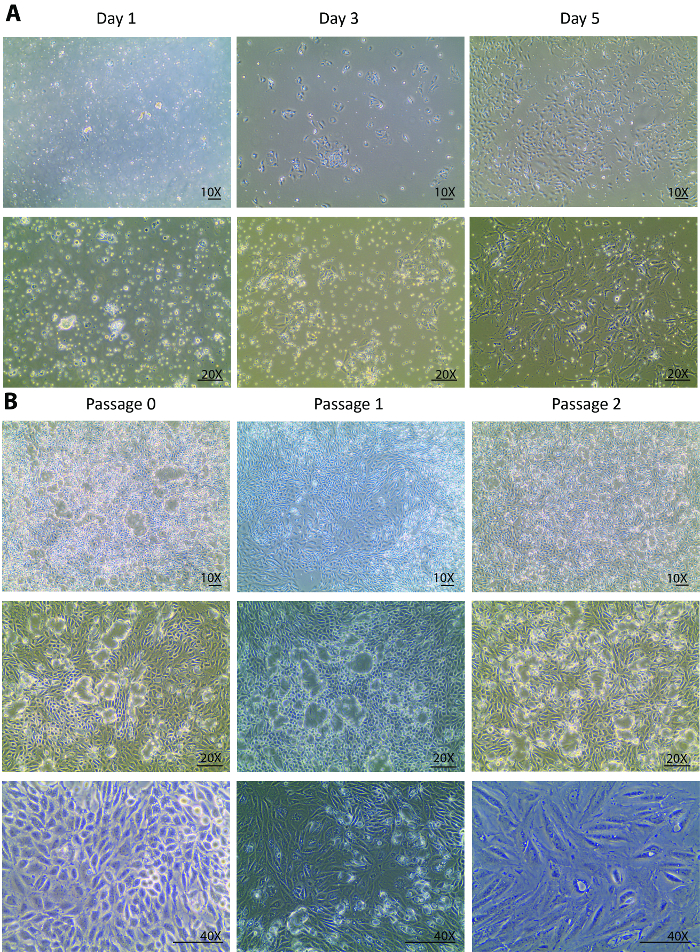
رقم 1. خلية ثقافة معزولة خلايا أنبوبية الأولية. (أ) خلايا أنبوبية الأولية المعزولة إرفاق في وقت مبكر من يوم 1 وتنمو بقوة من يوم 3 إلى يوم 5. وتؤخذ الصور تحت 10 X و 20 X أهداف. (ب) هذا الفريق يظهر ثقافة فرعية معزولة خلايا أنبوبية الأولية من مرور 0 لمرور 3. وتؤخذ الصور تحت 10 X وأهداف X 20 لرؤى القباب الخلية، وتحت هدف X 40 لرؤية التغييرات الشكلية من خلال الممرات. سكليبر = 100 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
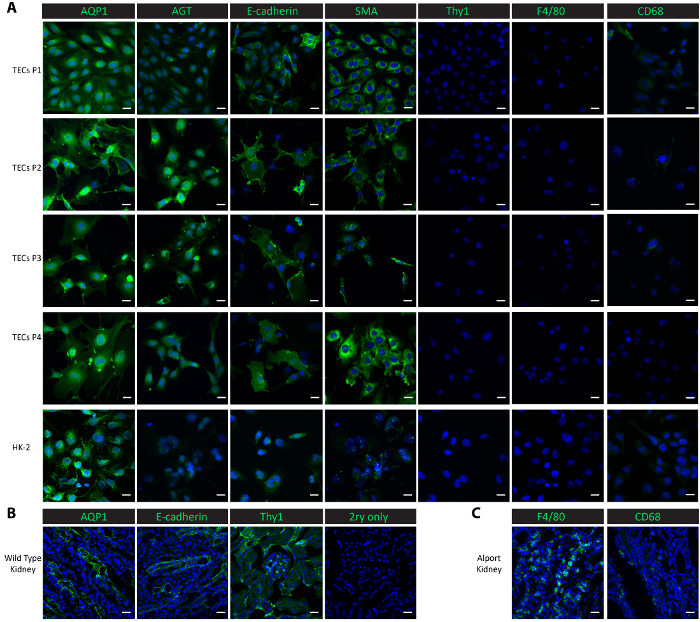
رقم 2. وصف خلايا أنبوبية الأولية المعزولة. إيمونوستينينج (A) مع الأجسام المضادة ضد الدانية البروتينات أنبوبي (AQP1، AGT) وبروتين أنبوبي القاصي (E-كادهيرين) وبروتين الظهارية (SMA)، وبروتين ميسانجيال (Thy1) والبروتينات بلعم (F4/80، CD68) تبين أن الابتدائي معزول خلايا أنبوبية والثقافات الفرعية اللاحقة محض خلايا أنبوبية القريبة والبعيدة. (ب) يظهر هذا الفريق تلطيخ أنبوب الدانية وأنبوب القاصي، والبروتينات ميسانجيال في أنسجة الكلي من ماوس البرية من نوع صحية كعنصر إيجابي وعنصر تحكم سلبية الأولية لا. (ج) يظهر هذا الفريق تلطيخ البروتينات بلعم F4/80 و CD68 في أنسجة الكلي التي تم جمعها من ماوس Col4a3-/- كعنصر إيجابي. سكليبر = 20 ميكرومتر. DAPI يظهر باللون الأزرق. البروتينات علامة تظهر باللون الأخضر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
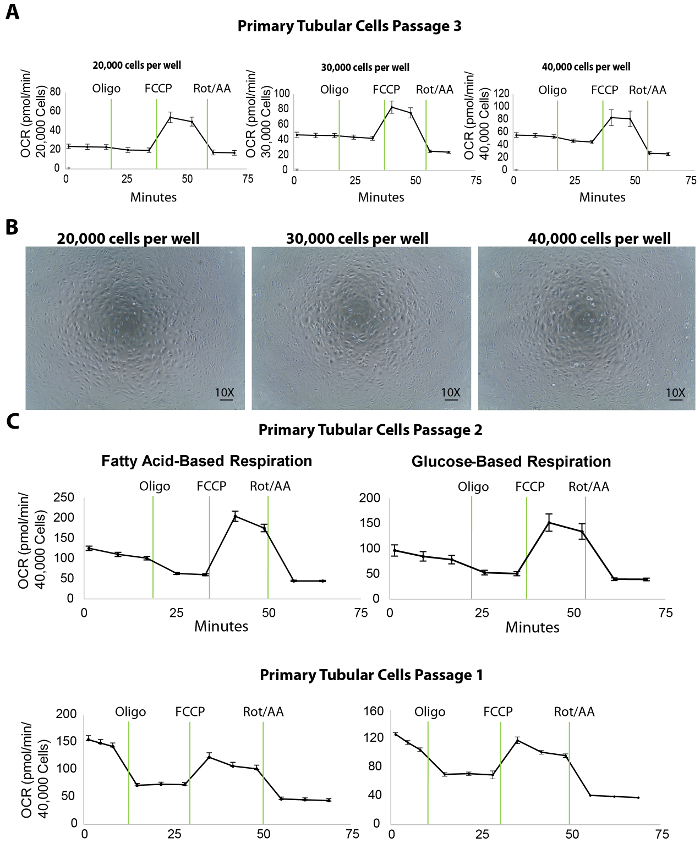
الشكل 3. تحليل الجريان خارج الخلية في خلايا أنبوبية الأولية المعزولة كثافات مختلفة والطلاء- (أ) زيادة الخلوية تصفيح كثافة يعزز مستويات التنفس القاعدية في خلايا أنبوبية أولية، اختبرت في مرور 3. (ب) هذا الفريق توضح الصور المجهرية لخلايا أنبوبية الابتدائي مثقف على ميكروسكوبية XF96 المصنف في 20,000، 30,000، وكثافة الخلايا/بئر 40,000. سكليبر = 100 ميكرومتر. (ج) هذا الفريق يظهر مقايسة الجريان خارج الخلية على أساس الأحماض الدهنية أو الجلوكوز في خلايا أنبوبية أولية في الفقرات 2 و 1. هو البيانات يعني ± sem. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
ونحن الأمثل بروتوكول يسمح لكفاءة عزل الماوس الخلايا الظهارية الأنبوبي الكلوي (تيكس) وأظهرت أن الخلايا يمكن أن تكون مثقف الفرعي لتحليل تدفق خارج الخلية لتقييم التنفس المتقدرية حضور الأحماض الدهنية- و/أو الركازات المستندة إلى الجلوكوز. هذا البروتوكول مصمم للدراسات التي تركز على خلايا أنبوبية القريبة والبعيدة على حد سواء، وتعمل كإطار لبناء تجارب أكثر تعقيداً لفهم الأمراض المرتبطة بأمراض الكلي والمجلس التنفيذي الانتقالي. بالمقارنة مع البروتوكولات المنشورة سابقا9،،من1019، هذا الأسلوب لا يتطلب التدرج فصل بالطرد المركزي في أوقات طويلة أو استخدام جسم وافرة للفرز و، ولذلك يقدم أكثر دليل كفاءة والأمثل للباحثين العاملين في ميدان الأيضية الأنبوبي الكلوي. وهناك العديد من الخطوات الهامة في هذا البروتوكول، بما في ذلك الهضم، وإعادة جمع، وكثافة الطلاء ومجمع الأمثل للمقايسة الجريان خارج الخلية.
اختيار النوع الصحيح من كولاجيناز وتركيز الأمثل هو مفتاح الهضم الناجحة، وتفكك خلايا أنبوبية من أنسجة الكلي. بالمقارنة مع أنواع أخرى من collagenases، كولاجيناز نوع 2 يحتوي على مستويات أعلى نسبيا من نشاط البروتياز، قادرة على الناي بهياكل الكلوي المدمجة. لتقليل احتمالات التلوث نتيجة التروية المطول ووقت الهضم، كان perfused كولاجيناز نوع 2 0.013% في 30 مل/دقيقة. تمت إزالة الكبسولة الكلوي إلا بعد أن تحصد من الحيوان كلا الكليتين وتحويلها إلى غطاء ثقافة خلية معقمة. الكلي كانت مفروم إلى قطع صغيرة واستمر الحضانة مع 10 مل الهضم المخزن المؤقت لآخر 5 دقائق الهضم الكامل وإطلاق سراح القصوى من خلايا أنبوبية.
وعلى الرغم من بعد الهضم، يتم تمرير تعليق الأنسجة من خلال عامل تصفية 70 ميكرون لإزالة قطعة النسيج كبيرة جداً، ستكون هناك عسر الهضم من الأنابيب التي تمر من خلال المرشح والبقاء داخل تعليق خلية والحصول على مطلي على الطبق الثقافة. يستغرق وقتاً أطول من المعتاد لهذه الأنابيب للإفراج عن خلايا أنبوبية ونعلق بثبات إلى الطبق الثقافة. ولذلك، من المهم بدلاً من جمع تعليق خلية والطرد المركزي لبيليه فاتحة الأنابيب وخلايا في اليوم الثاني بعد طلاء الخلية. هذه الخطوة الطرد المركزي ذات سرعة منخفضة كذلك إزالة أنواع الخلايا الأخرى التي أخف من خلايا أنبوبية ويسمح لخلايا أنبوبية والأنابيب فاتحة لتسوية.
تحديد كثافة الخلايا الصحيح هو الخطوة الأولى والأساسية مقايسة الجريان خارج الخلية ناجح. وأظهرت النتائج أن الخلايا 40,000 كل بئر في ميكروسكوبية XF96 مثالي لخلايا أنبوبية أولية في كل من الأحماض الدهنية ومقايسة تنفس المستندة إلى الجلوكوز (الشكل 3). في هذا البروتوكول، استخدمت خلايا أنبوبية معزولة للمقايسة الجريان خارج الخلية في الفقرات 1 و 2. الخلايا شبه مثقف لمرور 3، على الرغم من أنها تعبير عن علامات أنبوبي (الشكل 2) وأداء كريمة في فحوصات الاستقلاب (الشكل 3A)، وأظهرت مستويات التنفس القاعدية انخفض بالمقارنة مع مرور 2 (كما هو موضح بمقارنة التعرف الضوئي على الحروف في لوحات الموجود في أقصى اليسار من الشكل 3 ألف الرقم 3). قد لا يؤثر هذا الانخفاض على خلايا أنبوبية صحية كبيرة (على سبيل المثال، تلك المعزولة من الشباب البرية من نوع الفئران). بيد لدراسات على خلايا معزولة من كد الماوس النماذج التي لديها بالفعل تنفس المتقدرية تقلص، الممرات ارتفاع الخلايا قد يسبب انخفاض زيادة في التنفس القاعدية التي ستؤثر على نتائج الفحص الجريان خارج الخلية. في الدراسات التي أجريت هنا، الخلايا من مرور 1 والممر 2 أظهر ارتفاع مستويات التنفس القاعدية. ولذلك، في أعقاب هذا البروتوكول، نوصي باستخدام هذه الممرات اثنين في وقت مبكر للدراسات التنفس المتقدرية مع الخلايا المعزولة من الحيوانات السليمة والمريضة على حد سواء. خلايا من مرور 2 ينبغي أن لا تزال تؤخذ في الاعتبار إذا كانت الثقافة الفرعية مرور 1 لا تسفر عن خلايا كافية للمقايسة التمويه. بالإضافة إلى دراسات الاستقلاب، تبين ابحاثنا السابقة أن تيكس الأولية في مرور 3 يمكن أن تكون مفيدة للغاية للعلاجات مع المركبات التي يتبعها البروتين ودراسات الحمض النووي الريبي (البيانات لا تظهر). ومع ذلك، فإننا نقترح أن المحققين باستخدام هذا البروتوكول لعزل خلايا أنبوبية يجب أن تختار بعناية مرور الأمثل للتطبيقات البحثية المختلفة.
يستند مبدأ عمل تحليل الجريان خارج الخلية التفاعلات بين مركبات حقن ومجمعات سلسلة التنفس وأثر أونكوبلير. أوليجوميسين هو المانع الخامس المعقدة (ATP synthase) ويستخدم للتمييز بين استهلاك الأكسجين ترتبط ATP واستهلاك الأوكسجين المطلوب للتغلب على تسرب بروتون العادية عبر غشاء داخلي المتقدرية32. فككب uncouples استهلاك الأوكسجين من إنتاج ATP بتعطيل غشاء الميتوكوندريا المحتملة. وهكذا، ويوفر مقياسا لقدرة التنفس القصوى كما أنها تلتف القدرة المحدودة ل efflux أيون بروتون واسطة ATP synthase بالسماح نقل بروتون من خلال الغشاء. أنتيميسين-أ، مثبط الثالث معقدة، ووالروتينون، ومجمع أنا مانع، تستخدم في تركيبة لإيقاف التنفس المتقدرية كامل يسمح لتفريق بين mitochondrial مقابل استهلاك الأكسجين غير المتقدرية في الخلايا. ينبغي دائماً أن تكون تيتراتيد هذه المركبات لنوع خلية محددة قبل الفحص الجريان خارج الخلية لتحديد التركيزات المثلى التي تسفر عن المنحنيات التعرف الضوئي على الحروف الأمثل. هنا، نحن نوصي ميكرومتر 1 أوليجوميسين و 1 ميكرومتر من فككب 2 ميكرومتر من والروتينون/أنتيميسين A للمقايسة الجريان خارج الخلية في تيكس الأولية.
وفي الختام، يوفر هذا البروتوكول بطريقة بسيطة وفعالة من حيث التكلفة لعزل الكلوية الأولية الدانية والبعيدة أنبوبي الخلايا الظهارية التي يمكن استخدامها لتقييم الاستقلاب المتقدرية السابقين فيفو. بينما هذا البروتوكول يمكن أن تكون مفيدة في مجموعة واسعة من دراسات البيولوجيا الجزيئية استكشاف الوظيفة البيولوجية للخلايا الظهارية الأنبوبي الكلوي، نعترف بقصوره عند تطبيقه على الدراسات التي تحتاج إلى الأنابيب الدانية أو البعيدة نقية. على سبيل المثال، تتطلب دراسات بشأن متلازمة لوي، انتقائية خلل أنبوبي الدانية33، أو دراسات بشأن القاصي الحماض الأنبوبي الكلوي، خلل أنبوبي القاصي34، بروتوكول أكثر تطورا لعزل الخلية و تنقية. ومع ذلك، لمعظم الدراسات التي تقارن بين الأنابيب مقابل جلوميرولي، ودراسات الشاشة المنظمين التنفس المتقدرية المحتملة في خلايا أنبوبية بصورة عامة، ينص البروتوكول نهجاً عمليا إنتاجية عالية. ولذلك، قد يكون هذا البروتوكول تطبيقات واسعة النطاق لدراسة خلل mitochondrial المرتبطة باضطرابات الكلي لأغراض التحقق من اكتشاف أو الهدف المخدرات.
Disclosures
الكتاب ليس لها علاقة بإعلان.
Acknowledgements
هذا العمل كان يدعمها المنح التالية إلى لينا ألف شحادة: المعهد الوطني للصحة (R56HL132209 و 1R01HL140468) ومعهد بحوث القلب في ميامي.
Materials
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
References
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750(2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997(2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40(2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908(2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231(2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved