Method Article
Analyse de Flux extracellulaire isolement, caractérisation et un débit élevé de souris primaire tubulaire les cellules épithéliales rénales
Dans cet article
Résumé
Ce protocole prévoit une approche rentable pour isoler et caractériser les souris primaire les cellules tubulaires rénales qui peuvent ensuite être Sub cultivées afin d’évaluer les fonctions biologiques rénales ex vivo, y compris bioénergétique mitochondriale.
Résumé
Dysfonctionnement mitochondrial dans les cellules épithéliales tubulaires rénales (TECs) peut conduire à une fibrose rénale, des principales causes d’insuffisance rénale chronique (IRC). Donc, évaluer la fonction mitochondriale chez TECs primaires peut fournir des précieuses informations sur l’État bioénergétique des cellules, donnant un aperçu dans la physiopathologie du CKD. Alors qu’il existe un certain nombre de protocoles complexes pour l’isolement et la purification des tubules proximaux chez différentes espèces, le champ n’est pas une méthode rentable, optimisée pour l’isolement des cellules tubulaires sans besoin de purification. Ici, nous fournissons un protocole d’isolement, permettant des études portant sur les deux primaires de souris TECs rénales proximales et distales. En plus des réactifs rentables et des procédures animaux minimales requis dans le présent protocole, les cellules isolées maintiennent de hauts niveaux d’énergie après l’isolement et peuvent être sous – cultivées jusqu'à quatre passages, ce qui permet des études continues. En outre, à l’aide d’un analyseur de flux extracellulaire à haut rendement, nous évaluons la respiration mitochondriale directement dans les TECs isolés dans une plaque de 96 puits, pour lesquelles nous fournissons des recommandations pour l’optimisation de la densité cellulaire et de la concentration en composé. Ces observations suggèrent que ce protocole peut être utilisé pour des études avec une production cohérente et bien standardisée de TECs rénales tubulaire rénale ex vivo . Ce protocole peut avoir des applications futures plus étendues pour étudier le dysfonctionnement mitochondrial associé à des désordres rénaux fins de découverte de médicaments ou drogues caractérisation.
Introduction
Fonction de cellules épithéliales tubulaires rénales (TEC) est fortement liée à l’état de santé général du rein. La signalisation pathologique dans le rein provoque la dédifférenciation des TECs, qui joue un rôle majeur dans la fibrose rénale et insuffisance rénale chronique (IRC) de la maladie1,2. Comme un organe très énergique, le rein est le deuxième seulement à coeur la consommation d’oxygène, principalement par le biais de la phosphorylation oxydative mitochondriale3. Des études au microscope électronique ont montré une corrélation positive des changements morphologiques mitochondriales aux manifestations pathologiques dans les tubules rénaux4. Dysfonctionnement mitochondrial dans TECs provoque la fibrose rénale par transition épithéliale à mésenchymateuses5 et d’oxydation des acides gras défectueux6. La fibrose est une pathologie rénale progressive qui se traduit par CKD. Comprendre le statut énergétique de TECs rénales est donc une nécessité pour découvrir la pathophysiologie de l’IRC.
Il y a > 20 types de cellules du rein adulte7. Pour étudier la fonction des TECs, une culture primaire de cellules épithéliales rénales est nécessaire comme une plate-forme pour les applications de la biologie moléculaire telles que les traitements chimiques et des manipulations génétiques. Ce qui est important, des manipulations génétiques peuvent se faire in vivo chez la souris via la transgénèse ou en utilisant AAV gène livraison techniques8 afin que les cellules isolées de primaire aurait déjà être génétiquement manipulés. Isoler les cellules tubulaires rénales primaires de souris9,10, rats11,12,13, canines14, lapins15,16et les humains17 ,,18 ont été signalés avec les étapes de purification pour produire des cellules tubulaires proximales pures. Dans ces protocoles précédemment publiés qui mettent l’accent sur l’isolement des cellules tubulaires proximales, centrifugation en gradient et tri des expériences effectuées à des fins de purification19. Alors que ces protocoles sont précieux pour l’étude des tubules proximaux, ils ne sont pas suffisants lorsque les tubules proximaux et distaux sont requis pour être étudié. Par exemple, notre étude sur le syndrome d’Alport a révélé que les tubules rénaux proximaux et distaux jouent un rôle important dans la progression de la maladie20, et donc les deux types des tubules rénaux devront être étudiés dans la culture. Une récente étude sur la toxicité rénale fluorure a également montré que des changements pathologiques ont eu lieu dans les deux les tubules proximaux et distaux21. Par conséquent, ce protocole d’isolement est conçu et optimisé pour les cellules tubulaires proximales et distales des reins de souris avec un coût minime des réactifs et des procédures simples. Alternativement, les enquêteurs peuvent toujours suivre le protocole jusqu'à l’étape 3.1 et ajouter purification étapes9 à partir de ce moment pour l’isolement des cellules tubulaires proximales pures.
Les cellules isolées présentent des niveaux énergétiques élevés et de maintiennent les caractéristiques épithéliales rénales après les sous-cultures à 4 passages. À l’aide d’un analyseur de flux extracellulaire à haut rendement, nous évaluons la respiration mitochondriale directement dans les TECs isolés dans une plaque à 96 puits, ce qui conduit à nouvelles perspectives dans l’optimisation de la densité cellulaire. Ces observations suggèrent que ce protocole peut être appliqué à des études avec une production cohérente et bien standardisée de TECs rénales tubulaire rénale ex vivo . Une importance accrue du présent protocole est son utilisation possible comme un outil à haut débit pour la caractérisation ex vivo de bioénergétique mitochondriale dans les cellules tubulaires rénales proximales et distales. Par conséquent, il peut servir comme plate-forme pour la découverte de médicaments ou drogues caractérisation des troubles rénaux.
Protocole
Toutes les expériences impliquant des animaux ont été approuvées par le Comité en urbanisme à l’Université de Miami, conformes aux lignes directrices des NIH et d’institutionnels animalier.
1. plaque de revêtement et préparation des réactifs
- Préparer l’enduit de collagène :
- Ajouter 35 μL de collagène I de 2 mL d’une solution d’acide acétique préfiltrée 20 mM sur une seule boîte de Pétri 60mm. Il incuber à température ambiante pendant 1 h, il sécher à l’air et l’exposer aux UV.
- Lavez le revêtement 3 x avec PBS pour enlever tout résidu acide et enregistrez-le dans un 37 ° C CO2-incubateur de culture de cellules libres jusqu'à ce que les cellules sont prêtes pour l’amorçage. La concentration finale de l’enduit de collagène est de 5 μg/cm2.
- Préparer le tampon de perfusion : ajouter 300 μL de pénicilline-streptomycine (P/S) dans 30 mL de PBS et chauffer le mélange dans un bain-marie à 37 ° C jusqu'à ce que l’isolement commence.
- Préparer le tampon de la digestion : dissoudre 3,9 mg de collagénase de type 2 dans 30 mL de PBS, filtrer la solution sur un filtre de flacon de 0,2 μm et réchauffer au bain-marie à 37 ° C jusqu'à ce que l’isolement commence.
- Préparation des milieux de culture cellulaire :
- Apporter les compléments à la température ambiante. Sans filtration, ajouter le supplément (0,05 mL de sérum de veau foetal, 10 ng/mL de facteur de croissance épidermique, 5 μg/mL d’insuline, 0,5 μg/mL d’épinéphrine, 36 ng/mL d’hydrocortisone, 5 μg/mL de transferrine et 4 pg/mL de triiodo-L-thyronine) à 500 mL de rénal cellules épithéliales basales milieu 2.
- Réchauffer les médias dans un bain d’eau de 37 ° C jusqu'à ce qu’il est prêt à l’emploi.
- Préparer les composés : préparer 50 mM FCCP, roténone 10 mM, 10 mM l’oligomycine, 10 mM l’antimycine A, 50 mM de L-carnitine et etomoxir 50 mM leur stock des solutions tout en DMSO, aliquote et stockent les composés à-20 ° C.
- Préparer le palmitate de sodium 2,5 mM à 220 mL d’une solution de NaCl 150 mM et réchauffer la solution dans un bain d’eau de 75 ° C jusqu'à ce que le palmitate est entièrement dissous.
- Préparer l’albumine sérique bovine (BSA) : préparer des BSA de 0,34 mM sans gras dans 250 mL de NaCl 150 mM. Le contrôle BSA sert comme témoin négatif pour la solution de palm-BSA qui peut être obtenu en suivant l’étape 1.8.
- Conjuguer le palmitate de BSA (Palm-BSA) :
- Ajouter progressivement la solution palmitate dans la solution de BSA lorsqu’elle est encore chaude. Ensuite, ajuster le pH à 7,4 et mélangez-les à 37 ° C pendant au moins 1 h compléter la conjugaison.
- Lorsque la conjugaison est terminée, ajoutez un autre 150 mL de NaCl 150 mM à la solution, mélanger bien et enregistrer les aliquotes à-20 ° C. La solution finale contient 1 mM sodium palmitate et 0,17 mM BSA et sera utilisée comme un substrat acide gras pour les cellules dans un test de flux extracellulaire à base d’acide gras.
- Préparer les flux extracellulaire dosage basal milieux :
- Ajouter 1 sachet de poudre DMEM et 20 mL de 200 mM de L-glutamine (finale de 4 mM) à 1 L d’autoclavés dH2O et mélanger doucement.
- Le jour de l’expérience de la bioénergétique, ajoute les supports préparés basale pour les préparations ultérieures des médias de flux extracellulaire dosage à utiliser lors d’un test de respiration basée glucose - ou acide gras - pyruvate de sodium 100 µM.
- Préparer les milieux à base de glucose :
- Pour mesurer la capacité de respiration cellulaire par l’intermédiaire de la glycolyse, ajouter la poudre de glucose 17,5 mM, 100 µM contrôle BSA (tel que décrit à l’étape 1.7) et 20 µM etomoxir (pour inhiber l’oxydation des acides gras) pour le milieu de base décrit ci-dessus dans l’étape 1.9.
- Réchauffer les médias à 37 ° C, ajuster le pH à 7,4 et rangez-le dans le bain-marie à 37 ° C jusqu'à ce qu’il est utilisé dans un essai de flux extracellulaire.
- Préparer les médias axés sur les acides gras :
- Pour mesurer la capacité de respiration cellulaire grâce à l’oxydation des acides gras, ajouter 10 mM 2D-glucose en poudre (glucose analogique pour inhiber la glycolyse), 100 µM Palm-BSA (comme décrit dans étape 1.8) et 100 µM L-carnitine pour le milieu de base décrit ci-dessus dans l’étape 1.9.
- Réchauffer les médias à 37 ° C, ajuster le pH à 7,4 et gardez-le dans le bain-marie à 37 ° C jusqu'à ce qu’il est utilisé dans l’analyse de flux extracellulaire.
2. perfusion, de Digestion et de récolte des reins chez des souris
- Anesthésier la souris avec un débit de l’isoflurane et le fixer en position couchée. Vérifiez que l’isolement commence seulement après que l’animal perd ses réflexes de redressement et de la profondeur anesthésique est surveillée par des évaluations de pincement à l’aide de pince atraumatique, avant et Pendant la procédure22.
- Enlever la fourrure, à l’aide d’une crème dépilatoire, de la poitrine de la souris dans sa région abdominale, désinfecter avec de l’iode et essuyer les résidus d’iode.
- Faire une incision dans la poitrine, couper la peau pour ouvrir la zone abdominale ensemble et exposer le cœur et les reins.
- Mettre en place une pompe à perfusion à 32 mL/min et éliminez les bulles dans le tuyau avant de commencer la perfusion.
- Insérer une aiguille de 27 G dans le ventricule gauche par l’intermédiaire de l’apex cardiaque dès que le tampon se remplit le cœur et piquez l’oreillette droite pour créer une sortie pour le tampon de perfusion circule comme les pompes cardiaques et obtient finalement retiré de la sortie de l’oreillette droite.
- Après la perfusion, passer la vitesse de la pompe à 30 mL/min pour la digestion.
- Après que 20 mL de tampon de digestion est perfusée par l’apex, enlever les deux reins pour l’isolement de cellules tubulaires.
3. tissu traitement et primaire tubulaire cellules d’isolement
- Retirer les capsules rénales et la moelle, émincer les deux reins en petits morceaux et les incuber dans 10 mL de tampon digestion dans un four avec rotation douce pendant 5 min à 37 ° C.
- Enlever les tissus rénaux non digérées en passant le tampon par un filtre 70 μm. Ajouter 10 mL de milieu de culture pour arrêter la digestion.
- Pour prélever des cellules tubulaires, centrifuger la suspension de cellules filtrées à 50 x g pendant 5 min recueillir la première pastille. Transférer le surnageant dans un nouveau tube et ajouter 5 mL de milieu de culture, centrifugeuse à 50 x g pendant 5 min pour s’assurer que toutes les cellules tubulaires sont collectés par le plomb de deuxième.
La centrifugation est à une vitesse inférieure pour granuler principalement des tubules lourds. Plus tard, après que les cellules de recouvrement de l’isolement, la culture pure tubulaire est centrifugée à une vitesse plus élevée pendant les sous-cultures. - Resuspendre le culot premier dans 20 mL de milieu de culture et il centrifuger à 50 x g pendant 5 min recueillir le culot de troisième.
- Remettre en suspension les deuxième et troisième boulettes dans 1 mL de milieu de culture. Mix 10 µL de la suspension cellulaire avec 10 µL de bleu de Trypan, charger le mélange dans la Chambre A un comptage diapositive, et enregistrement la viabilité des cellules de la boîte automatique de cellules encontre (voir Table des matières).
- Graine de jusqu'à 107 cellules (une population hétérogène) sur un seul plat 60 mm préalablement recouvertes de collagène et laisse les cellules tubulaires à joindre toute la nuit.
4. primaire tubulaire des cellules de sous-culture et caractérisation
- Jour 1 après l’isolement, recueillir des milieux de culture et il centrifuger à 50 x g pendant 5 min granuler les tubules flottants. Retirez le surnageant et Resuspendre le culot dans 4 mL de milieux de culture fraîche et plaque de nouveau à la même boîte de Petri.
- Jour 4 après l’isolement, retirez le support de culture ancien et ajouter des supports neufs.
- Jour 7 après l’isolement, détacher les cellules par incuber à 37 ° C dans 2 mL de 0,25 % de trypsine-EDTA pour 5 min. Ajouter 3 mL de milieu de culture pour arrêter la réaction et de recueillir les cellules par centrifugation à 250 x g pendant 5 min.
- Pour la culture secondaire et caractériser les cellules de P0 à P1, cellules 5 000 graines / puits sur une plaque de 24 puits recouvert de collagène j’ai comme décrit ci-dessus.
- 24h après l’étape 4.4, fixer les cellules à P1 avec 4 % PFA pendant 10 min, leur permeabilize avec 0,2 % Triton X-100 pendant 3 min et les bloquer avec 10 % de sérum d’âne (DS) pendant 1 h à température ambiante.
- Diluer, à 1/100 à 10 % DS, chacune des protéines suivantes : l’angiotensinogène marqueurs tubulaire proximale (l’AGT) et aquaporine 1 (AQP1) ; le marqueur tubulaire distal E-cadhérine ; le marqueur mésangiales CD90/Thy1 ; et le récepteur d’hormone semblable à la mucine de marqueurs EGF-like module contenant macrophage-comme 1 (F4/80) et cluster de différenciation 68 (CD68) et incuber les cellules durant la nuit à 4 ° C.
- Le lendemain, détecter un marquage à l’aide de 1 : 200 anti-lapin, anti-souris ou anti-rat Anticorps secondaires fluorescents pendant 45 min. Prendre des images en microscopie confocale pour confirmer l’expression des marqueurs, comme illustré à la Figure 2 a.
- Jour 3 après la sous-culture de P1, détacher les cellules pour une sous culture et de la caractérisation en P2 par une coloration des marqueurs tubulaires, mésangiales et macrophages indiqués au point 4.5. Image de la coloration en microscopie confocale pour confirmer l’expression des marqueurs, comme illustré à la Figure 2 a.
- Jour 3 après la sous-culture de P2, détacher les cellules pour une sous-culture et la caractérisation au P3 par une coloration des marqueurs tubulaires, mésangiales et macrophages indiqués au point 4.5. Image de la coloration en microscopie confocale pour confirmer l’expression des marqueurs, comme illustré à la Figure 2 a.
- Préparer la coloration de tissus :
- Sécher à l’air sauvage surgelé et Col4a3- / - diapositives de rein pendant 1 h à température ambiante et fixez-les avec 4 % PFA pendant environ 10 minutes les Permeabilize avec 0,2 % Triton X-100 pendant 10 min et les bloquer avec 10 % de sérum d’âne (DS) pendant 1 h à température ambiante. Ajouter des anticorps dirigés contre les protéines de marqueur décrits à l’étape 4.5 au 1 : 200 et les incuber pendant la nuit à 4 ° C.
- Le lendemain, détecter toute coloration avec 1 : 200 anti-lapin, anti-souris ou anti-rat Anticorps secondaires fluorescents pendant 45 min. Prendre des photos sous un microscope confocal pour confirmer l’expression des marqueurs, comme illustré dans les Figures 2 b et 2C.
5. mitochondries bioénergétique Assay
- Cellules tubulaires de semences P1 à 20 000, 30 000 ou 40 000 cellules par puits dans 100 μl de milieux de culture sur une microplaque 96 puits préalablement recouvert de collagène de2 μg/cm 5 j’ai la veille les dosages de flux extracellulaire.
- Pour l’hydratation de la cartouche de sonde, sortez la cartouche de capteur et remplir chaque puits de la plaque avec 200 μL d’une solution d’étalonnage. Soigneusement charger la cartouche dos de submerger les capteurs dans la solution d’étalonnage. Placez la cartouche dans un four à 37 ° C sans CO2 pendant au moins 7 h avant son utilisation.
Pour des résultats optimaux, une nuit hydratation cartouche est recommandée. - Préparer les composés : préparer 8 µM l’oligomycine, 9 µM FCCP et mélange de roténone / l’antimycine A 20 µM en glucose (décrit à l’étape 1.10) et de médias de dosage acide gras (décrit dans étape 1.11) flux extracellulaire.
- Modifier les médias : aspirer les milieux de culture cellulaire, ajouter 175 µL de médias de dosage de glucose ou d’acides gras (dépend de l’enceinte qui est en cours d’élaboration, voir étape 5.3) et les incuber pendant 1 heure à 37 ° C CO2-incubateur gratuit.
- Charger les ports cartouche et 25 µL des composés suivants : 8 μM oligomycine pour port A obtenir une concentration finale de 1 µM (Remarque : comme chacun contiendra bien 175 µL des médias, le composé aurez dilué 8 x), 9 μM FCCP au port B pour obtenir une concentration finale de 1 µM (Remarque : comme chacun contiendra bien 175 µL de médias plus 25 µL de la solution injectée de port A, le composé aurez dilué 9 x) et 20 µM roténone/antimycine A Port C pour obtenir une concentration finale de 2 µM de chaque composé (note : comme chacun contiendra bien 175 µL de médias plus 50 µL de la solution injectée des ports A et B, le composé aurez dilué 10 x).
- Ajouter de l’eau à tous les puits dans le port D et tous les autres ports des puits de fond (pas de cellules). Incuber la cartouche dans un 37 ° C CO2-incubateur gratuit pendant 10 min.
- Mettre l’analyseur de flux extracellulaire et le contrôleur.
- Ouvrez le logiciel de l’analyseur et d’entrée le protocole suivant :
- Choisir l’essai normalisé. Cliquez sur Assistant de dosage. À l’aide de l’onglet composés , affecter la disposition composée, utilisez l’onglet groupes et Labels d’étiqueter les groupes expérimentaux. N’oubliez pas d’attribuer les puits vides (sans cellules) comme toile de fond.
- Sous l’onglet protocole , réglez les cycles suivants de mélange et de la mesure en utilisant les commandes disponibles, comme indiqué dans le tableau 1: calibrer, mélanger pendant 2 min, attente pendant 2 min et mesure pendant 3 min (répéter ce cycle x 2-3) ; injecter le port A, mélanger pendant 2 min, attendre 2 mn, mesure pendant 3 min (répéter ce cycle x 2-3) ; injecter le port B, mélanger pendant 2 min, attendre 2 mn, mesure pendant 3 min (répéter ce cycle x 2-3) ; injecter le port C, mélanger pendant 2min, attendre 2 mn, mesure pendant 3 min (répéter ce cycle 2-3 x). Cliquez sur l’Assistant fin. Il est également possible d’enregistrer le modèle actuel pour une utilisation future.
- Appuyez sur Démarrer pour commencer l’étalonnage. L’analyseur alors automatiquement éjecte le support de plaque et demande à la plaque de la cartouche à insérer.
- L’étape de calibrage est faite (habituellement en 20-25 min), appuyez sur la commande prompt à changer la plaque de la cartouche pour la plaque cellulaire et continuer la course.
- Lorsque la course est terminée, transférer les données et enlever la plaque de 96 puits. Ajouter Hoechst (1:1, 000) dans chaque puits assay et les incuber pendant 5 min à 37 ° C. Normaliser les données OCR pour la numération des cellules par une mesure de la fluorescence de Hoechst lecture à une excitation 355 nm et une émission de 460 nm.
Résultats
La digestion et la Perfusion rénale le rendement des cellules épithéliales tubulaires très Viable :
Cellules épithéliales tubulaires rénales de souris ont été isolés en suivant les étapes décrites dans les sections 1 à 3 du protocole décrit ci-dessus.
Après les digestions, une population hétérogène de cellules de rein, tubules incomplètement digérés et autres débris tissulaires qui est inférieur à 70 µm ont été ensemencés sur la boîte de Petri jour d’isolement. Passe du jour 0 au jour 1 après l’isolement devraient habituellement être vu seulement dans la fixation des cellules plutôt que dans la croissance cellulaire. Regardant à travers la population hétérogène flottante, seules quelques cellules tubulaires ont été attachés au jour 1 (Figure 1 a). Une nouvelle collection des cellules au jour 1, une centrifugation et une modification des plaques a aidé à enlever les débris légers et régler les morceaux de petits tubules pour la libération des cellules tubulaires. Du jour 1 au jour 3, les changements étaient attendus non seulement dans une meilleure fixation des cellules, mais aussi un taux de croissance de cellule remarquablement amélioré qui a été observée avec une densité cellulaire triplé par rapport au jour 1 (Figure 1 a). Dans la phase initiale de croissance, les cellules forment plusieurs colonies et peuplées autour des colonies. À ce stade, les cellules isolées ont été recouvrées et affichent une prolifération en bonne santé. Au jour 5, les cellules ont été à une confluence de 80 à 90 % dans une boîte de Pétri 60 mm avec quelques espaces entre cellule à cellule et la colonie à la colonie (Figure 1 a).
Sous-culture et la caractérisation des cellules tubulaires isolés :
Les cellules épithéliales tubulaires rénales isolées ont été cultivés sous pour une suite de caractérisation les étapes décrites à l’article 4 du protocole décrit ci-dessus.
Jour 5, les cellules entièrement récupéré de l’isolement et ont commencé à proliférer vigoureusement. Une semaine après l’isolement, les cellules ont augmenté à confluence dans un plat de Pétri de 60 mm. Après 1 semaine dans une culture au passage 0, les cellules étaient prêts à être sous – cultivée au passage 1 et, par la suite, pour des passages plus 2. Des profils de croissance similaires ont été observés au passage 1 et 2 de passage. Habituellement, cela prend moins d’une semaine pour les cellules au passage 1 et 2 de croître à la confluence des autres sous-cultures (Figure 1 b). La culture continue de cellules confluentes de passage 0 au statut de passage 2 a montré un vaste dôme formation23,24 (Figure 1 b), ce qui suggère que les cellules isolées maintiennent un environnement sain où ils ont excrété liquides similaires à une situation in vivo . Cela a provoqué la couche des cellules à décoller de la plaque, mais restez connecté par l’intermédiaire des jonctions serrées.
Afin de caractériser les cellules dans la culture, nous avons effectué la coloration par immunofluorescence dans les cellules cultivées de passage 1 passage 4, ainsi que dans un contrôle cellule ligne-homme proximale HK-2 les cellules épithéliales rénales. Les marqueurs tubulaires proximales, aquaporine 1 (AQP1)25 et angiotensinogène (AGT)9, la E-cadhérine de repère tubulaire distale25, les marqueurs épithéliaux muscle lisse actine (SMA)26,27,28, macrophages marqueurs F4/8029 et CD6830et l’antigène de différenciation de thymocytes mésangiales marqueur 1 (Thy1/CD90)9 ont été utilisés pour les études de caractérisation. Les deux protéines tubulaires proximales AQP1 et l’AGT ont été systématiquement fortement exprimées dans les cellules tubulaires isolés de passage 1 passage 4 ainsi que dans les cellules épithéliales contrôle positif HK-2 proximales (Figure 2 a). La protéine tubulaire distale E-cadhérine est exprimée dans les cellules tubulaires isolés par passage 4 et a été également observée dans les cellules de HK-2 (Figure 2 a). SMA a été abondamment exprimé dans les cellules tubulaires isolés et dans les cellules de contrôle HK-2, conformes aux rapports publiés26,27. En revanche, la protéine mésangiales Thy1 et la protéine macrophage F4/80 étaient absents dans les cellules tubulaires isolés tant les cellules contrôle HK-2 (Figure 2 a). CD68 ont montré une expression minimale dans les cellules de HK-2 et dans les cellules tubulaires isolés au passage 1 et 2 de passage, puis son expression est devenu indétectable de passage 3 passage 4 (Figure 2 a). Les résultats suggèrent que les cellules isolées suite à ce protocole sont un mélange de cellules tubulaires proximales et distales. Pour comparer les expressions de ces marqueurs protéines in vivo, nous avons réalisé une coloration dans les tissus du rein congelés. Tubes marqueurs, y compris les protéines AQP1, l’AGT a et E-cadhérine et mésangiales Thy1 trouvées fortement exprimé dans les reins récoltées sur une souris saine de type sauvage (Figure 2 b). Expressions faibles du F4/80 et CD68 ont été observées dans les reins sauvage mais largement exprimées dans les reins récoltées sur une souris Col4a3- / - qui a développé une insuffisance rénale avec un macrophage infiltration20,31 ( Figure 2).
Analyse bioénergétique mitochondriale sur les cellules tubulaires primaires isolées :
Les étapes de test de la respiration mitochondriale sont énoncées à l’article 5 du protocole décrit ci-dessus.
La respiration mitochondriale des cellules tubulaires primaires isolées est mesurée par une analyse de flux extracellulaire du taux de consommation d’oxygène (OCR) à placage à différentes densités. Pour titrer la densité de l’électrodéposition, 20 000, 30 000 et 40 000 TEC primaire / puits ont été ensemencées sur une microplaque de 96 puits XF96 la veille (environ 20 h avant) l’analyse de flux extracellulaire (Figure 3 a). Suite à l’analyse de flux extracellulaire, les mesures de l’OCR ont été ensuite normalisées pour le nombre de cellules par une quantification de la coloration de Hoechst. Plaquant le TEC à 20 000, 30 000 ou 40 000 cellules/puits a entraîné un OCR basale moyenne de 25, 45 ou 50 pmol/min, respectivement (Figure 3 a). En outre, des images microscopiques des cellules plaqués a révélé que 40 000 cellules/puits couvert toute la surface du fond de la microplaque mieux que les autres densités d’électrodéposition (Figure 3 b). Même si l’OCR maximale n’a pas augmenté à l’aide de 40 000 cellules par rapport à la densité des 30 000 cellules, nous recommandons une densité cellulaire d’environ 40 000 cellules/puits d’interaction optimale entre les cellules et les composés.
Par ailleurs, dans nos expériences, la concentration optimale des composés inhibiteurs/découpleur s’est avérée être de 1 µM oligomycine, 1µm FCCP et 2 µM roténone / l’antimycine-A (les protocoles de l’analyse de flux extracellulaire et les injections de port sont énumérés dans tableau 1 ; les expériences d’optimisation ne sont pas affichés). Toutefois, il est recommandé pour tous les utilisateurs d’effectuer un test préliminaire avec différentes concentrations de ces composés, idéalement inférieures et supérieures aux valeurs publiées, pour justifier les meilleurs résultats.
Une analyse de flux extracellulaire donne un certain nombre de paramètres importants pour l’évaluation de la bioénergétique de TECs rénales. Par exemple, comme l’oxydation des acides gras indique spécifiquement défectueux du TEC, l’utilisation des médias contenant des acides gras de substrat (palmitate) ainsi que de l’inhibiteur de la glycolyse (2 DG) peut servir comme un outil utile pour évaluer directement oxydation des acides gras en TEC au passages 1 et 2 (Figure 3). Dans le cas de la fibrose rénale, la capacité globale de la respiration des cellules devrait être inférieure à celle d’un rein en bonne santé, même si les médias à base de glucose peuvent ne révèlent aucune différence.
Pris ensemble, l’analyse de flux extracellulaire, en particulier d’évaluer la capacité d’oxydation de l’acide gras, peut être utilisé titre informatif pour évaluer l’état énergétique de TECs rénales dans quels changements pathologiques qui affectent le jeu de profil bioénergétique un rôle majeur dans la fibrose rénale et la progression vers l’insuffisance rénale.
| Mesures | Temps (min) |
| Calibrer | |
| Équilibrer : | 00:12:00 |
| Mesure 1 | 3 boucles |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Injecter un (1 μM oligomycine) le Port | 2 boucles |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Injecter le Port B (FCCP 1 μM) | 2 boucles |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Injecter le Port C (2 μM Rotenon / l’antimycine) | 2 boucles |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
| Mix | 00:02:00 |
| Attendre | 00:02:00 |
| Mesure | 00:03:00 |
Le tableau 1. Normalisés selon l’analyse de flux extracellulaire exécutant le protocole pour les mesures de OCR optimales dans les cellules tubulaires primaires.
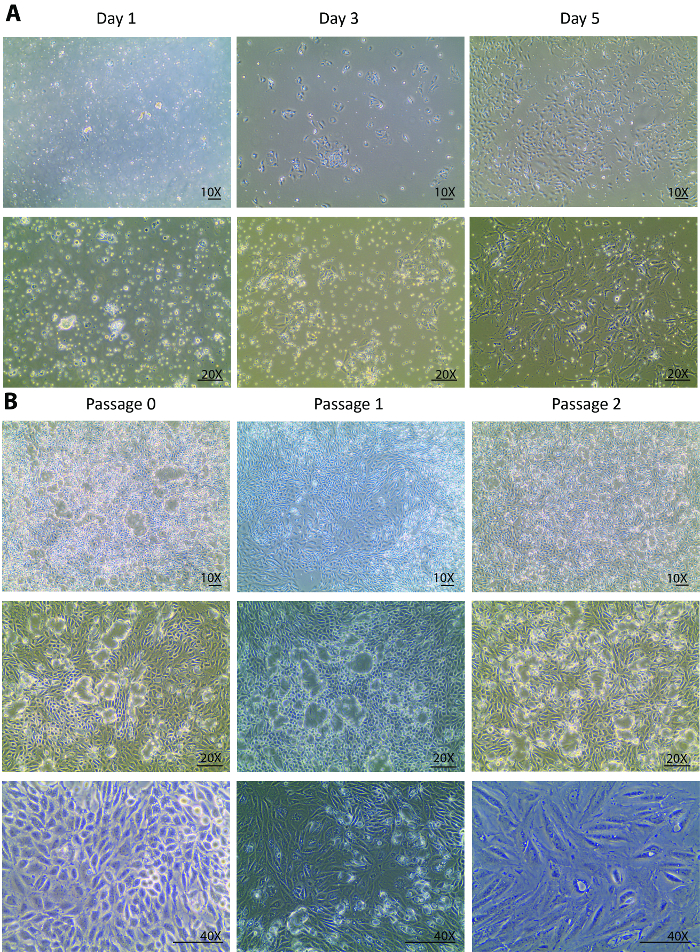
Figure 1. Culture de cellules tubulaires primaires isolées cellulaire. (A) les cellules tubulaires primaires isolés attacher au début au jour 1 et croître robustement du jour 3 au jour 5. Les images sont prises sous 10 X et 20 X objectifs. (B), ce panneau indique une sous-culture des cellules tubulaires primaires isolées de passage 0 au passage 3. Les images sont prises sous 10 X et 20 X objectifs pour les visions des dômes cellulaire et dans un objectif de 40 X pour une vision des changements morphologiques à travers les passages. L’échelle = 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
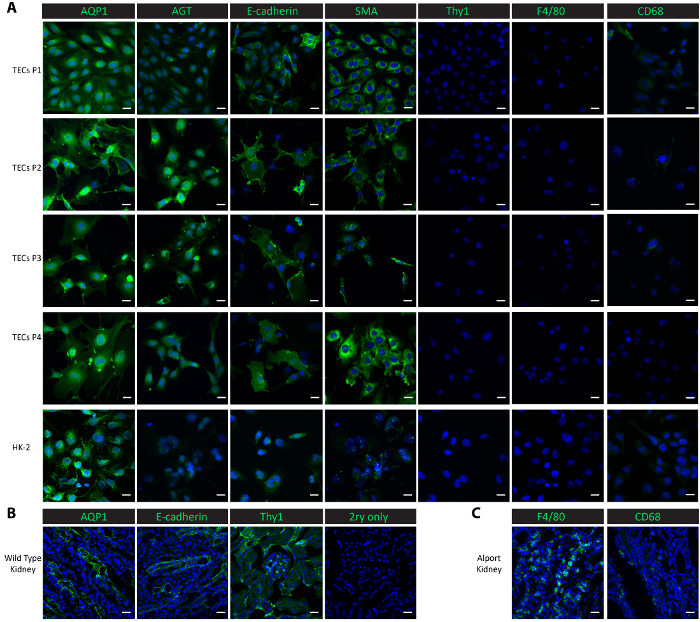
Figure 2. Caractérisation des cellules tubulaires primaires isolées. (A) immunohistochimie avec des anticorps dirigés contre les protéines tubulaires proximales (AQP1, l’AGT), une protéine tubulaire distale (E-cadhérine), une protéine épithéliale (SMA), une protéine mésangiales (Thy1) et protéines de macrophages (F4/80, CD68) montrent que le principal isolé les cellules tubulaires et les sous-cultures sont pures cellules tubulaires proximales et distales. (B) ce panneau montre une coloration du tubule proximal, tubule distal et mésangiales protéines dans les tissus du rein d’une souris sauvage saine comme témoin positif et un témoin négatif non primaire. (C) ce panneau montre une coloration des protéines macrophage F4/80 et CD68 dans les tissus rénaux prélevés dans une souris Col4a3- / - comme témoin positif. Échelle d’une = 20 µm. Le DAPI est affiché en bleu. Les protéines marqueurs apparaissent en vert. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
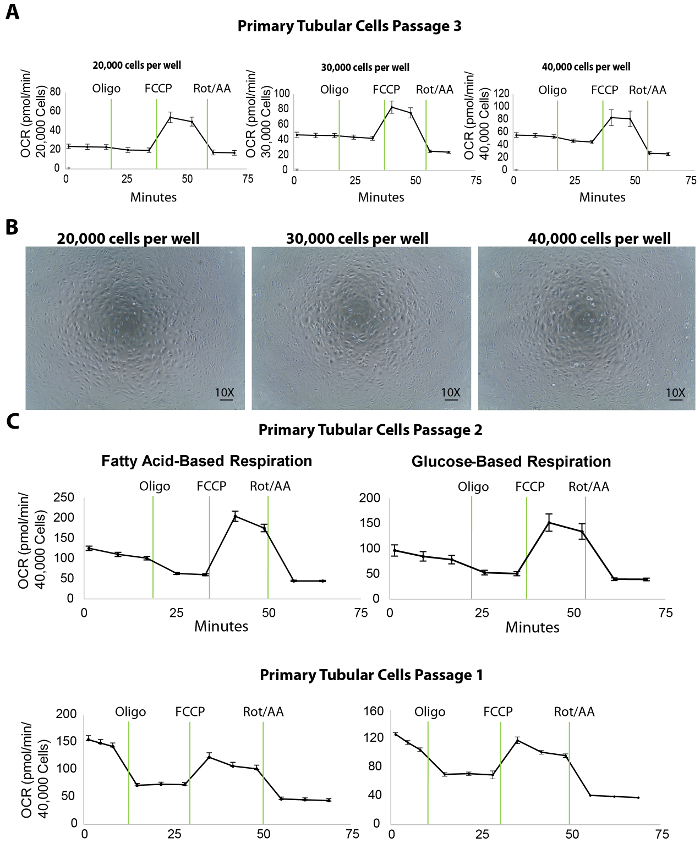
Figure 3. Analyse de flux extracellulaire dans les cellules tubulaires primaires isolées à placage à différentes densités. (A) augmentation cellulaire placage densité améliore les niveaux de la respiration de base dans les cellules tubulaires primaires, testé au passage 3. (B) ce panneau montre les images microscopiques de cellules tubulaires primaires cultivés sur une microplaque XF96 injectée à 20 000, 30 000 et 40 000 cellules/puits densités. Échelle d’une = 100 µm. (C), ce panneau montre un test de flux extracellulaire acide gras ou à base de glucose dans les cellules tubulaires primaires à passages 2 et 1. Les données sont moyenne ± SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous avons optimisé un protocole qui permet l’isolement efficace des souris cellules tubulaires rénales épithéliales (TECs) et a montré que les cellules peuvent être cultivées sous pour une analyse de flux extracellulaire évaluer la respiration mitochondriale en présence d’acide gras- et/ou substrats à base de glucose. Ce protocole est conçu pour les études portant sur les cellules tubulaires proximales et distales et constitue un cadre permettant de construire des expériences plus complexes pour la compréhension des maladies associées à la pathologie rénale TEC. Par rapport aux protocoles publiés précédemment9,10,19, cette méthode ne nécessite pas de séparations dégradées avec longs temps de centrifugation ou l’utilisation d’un anticorps amplement pour le tri et, donc, offre une plus guide efficace et optimisé pour les chercheurs travaillant dans le domaine métabolique tubulaire rénal. Il y a plusieurs étapes cruciales dans le présent protocole, y compris la digestion, la nouvelle collection et la densité de placage et l’optimisation composée pour le dosage de flux extracellulaire.
Choisir le bon type de collagénase et concentration optimale est la clé pour une digestion réussie et la dissociation des cellules tubulaires de tissus rénaux. Par rapport à d’autres types de collagénases, collagénase de type 2 contient relativement plus élevés d’activité de la protéase, capable de dissocier les structures rénales compacts. Pour réduire les risques de contamination en raison d’une perfusion prolongée et l’heure de la digestion, collagénase de type 2 de 0,013 % a été perfusé à 30 mL/min. La capsule rénale a été supprimée seulement après que les deux reins ont été récoltées sur l’animal et transférés dans une hotte de culture cellulaire stérilisé. Les reins ont été hachées en petits morceaux et ont continué leur incubation avec 10 mL de tampon digestion pendant 5 min pour une digestion complète et libération maximale des cellules tubulaires.
Bien que, après la digestion, la suspension de tissu est passée à travers un filtre de 70 µm pour enlever les morceaux de tissus très large, il y aura encore des tubules non digérés qui passent par le filtre et restent au sein de la suspension cellulaire et obtenir ensemencés sur la boîte de Pétri. Il prend plus de temps que la normale pour ces tubules libérer les cellules tubulaires et attacher fermement à la boîte de Pétri. Par conséquent, il est plutôt important de recueillir la suspension cellulaire et centrifuger à pellet les cellules et les tubules seules le deuxième jour après le placage de la cellule. Cette étape de centrifugation à basse vitesse plus supprime les autres types de cellules qui sont plus légers que les cellules tubulaires et permet seules les tubules et cellules tubulaires à régler.
L’identification de la densité cellulaire appropriée est la première étape clée pour un dosage de flux extracellulaire réussie. Les résultats ont montré que 40 000 cellules / puits sur une microplaque XF96 est idéal pour les cellules tubulaires primaires en un acide gras et un test de respiration à base de glucose (Figure 3). Dans ce protocole, des cellules tubulaires isolés ont été utilisées pour le dosage de flux extracellulaire à passages 1 et 2. Les cellules cultivées sous pour 3, bien qu’ils ont maintient une expression de marqueurs tubulaires (Figure 2) et un rendement décent dans les essais de la bioénergétique (Figure 3 a) et ont montré des niveaux de respiration de base a diminué par rapport au passage 2 (montré en comparant OCR dans les panneaux à droite de la Figure 3 a de la Figure 3). Cette diminution ne peut-être affecter les cellules tubulaires substantiellement saines (par exemple, ceux isolés de jeunes souris de type sauvage). Cependant, des études sur des cellules isolées de modèles murins CKD qui ont déjà une diminution de la respiration mitochondriale, passages supérieurs des cellules peuvent causer une diminution supplémentaire de la respiration de base qui aurait une incidence sur les résultats de l’analyse de flux extracellulaire. Dans les études menées ici, les cellules de passage 2 a montré la grande respiration de base niveau tant de passage 1. Donc, suite à ce protocole, nous recommandons d’utiliser ces deux passages de début d’études de la respiration mitochondriale avec cellules isolées d’animaux sains et malades. Cellules de passage 2 devraient toujours prendre en considération si la sous-culture de passage 1 ne donne pas de cellules suffisants pour l’analyse de flux. En plus des études de bioénergétique, nos recherches antérieures montre que les TECs primaires au passage 3 peuvent être extrêmement utiles pour les traitements avec des composés suivies de protéine et études RNA (données non présentées). Cela étant dit, nous suggérons que les chercheurs utilisant ce protocole pour isoler les cellules tubulaires devraient choisir soigneusement le passage optimal pour les applications de recherche différents.
Le principe de fonctionnement de l’analyse de flux extracellulaire est basé sur les interactions entre les composés injectés et les complexes de chaîne de la respiration et l’effet de découpleur. L’oligomycine est un inhibiteur du complexe V (ATP synthase) et est utilisé pour distinguer la consommation d’oxygène liée à l’ATP et la consommation d’oxygène nécessaire pour surmonter la fuite régulière de protons à travers une membrane interne mitochondriale32. FCCP découple la consommation d’oxygène résultant de la production d’ATP en perturbant le potentiel de membrane mitochondrial. Ainsi, il fournit une mesure de la capacité de respiration maximale car il contourne la capacité limitée d’un efflux de protons ion par l’ATP synthase en permettant un transport de protons à travers la membrane. A l’antimycine, inhibiteur du complex III et la roténone, un complexe j’ai blocker, sont utilisés en combinaison pour arrêter la respiration mitochondriale ensemble permettant une différenciation entre les mitochondries contre la consommation d’oxygène non-mitochondriale dans les cellules. Ces composés devraient toujours être titrés pour un type de cellule spécifique avant le dosage de flux extracellulaire déterminer les concentrations optimales qui donnent des courbes de OCR optimales. Ici, nous vous recommandons de 1 µM de l’oligomycine, 1 µM de FCCP et 2 µM de roténone / l’antimycine A pour le dosage de flux extracellulaire sur TECs primaires.
En conclusion, ce protocole fournit une manière simple et rentable d’isoler primaires proximales et distales cellules tubulaires rénales épithéliales qui peuvent être utilisés pour l’évaluation de bioénergétique mitochondriale ex vivo. Ce protocole peut être utile dans un large éventail d’études de biologie moléculaire sur la fonction biologique des cellules épithéliales tubulaires rénales, nous reconnaissons ses limites lors de l’application aux études qui ont besoin des tubules proximales ou distales pures. Par exemple, des études sur le Syndrome de Lowe, un dysfonctionnement tubulaire proximal sélective33ou études sur l’acidose tubulaire rénale distale, une dysfonction tubulaire distale34, nécessiterait un protocole plus sophistiqué pour l’isolement cellulaire et purification. Toutefois, pour la majorité des études qui comparent les tubules vs glomérules et études cribler des régulateurs de la respiration mitochondriale potentiels dans les cellules tubulaires en général, le protocole prévoit une approche faisable à haut débit. Par conséquent, ce protocole peut-être avoir des applications larges pour étudier le dysfonctionnement mitochondrial associé à des désordres rénaux pour fins de validation découverte ou cibles de drogue.
Déclarations de divulgation
Les auteurs n’ont rien à déclarer.
Remerciements
Ce travail a été soutenu par les subventions suivantes à Lina A. Shehadeh : l’Institut National de santé (R56HL132209 et 1R01HL140468) et l’Institut de recherche de coeur de Miami.
matériels
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
Références
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750(2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997(2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40(2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908(2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231(2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon