Method Article
小鼠原发性肾管上皮细胞的分离、鉴定及高通量的细胞外流量分析
摘要
该协议提供了一种经济高效的方法, 以分离和表征小鼠原发性肾管细胞, 随后可以进行亚培养, 以评估肾脏生物学功能, 包括线粒体生物能学。
摘要
肾小管上皮细胞线粒体功能障碍 (TECs) 可能导致肾纤维化, 这是慢性肾脏疾病 (CKD) 的主要病因。因此, 对原发性 TECs 线粒体功能的评估可以为细胞的 bioenergetic 状态提供有价值的洞察力, 提供对 CKD 病理生理学的洞察力。虽然有许多复杂的协议, 以分离和纯化的近端小管在不同的物种, 该领域缺乏一个经济有效的方法, 优化管状细胞隔离, 而不需要净化。在这里, 我们提供了一个隔离协议, 允许研究集中在主鼠近端和远端肾 TECs。除了本议定书所要求的具有成本效益的试剂和最小的动物程序外, 隔离细胞在分离后保持了较高的能量水平, 可以分培养到四通道, 允许持续研究。此外, 利用高通量胞外流量分析仪, 我们直接评估了96井板中孤立 TECs 的线粒体呼吸, 为优化细胞密度和复方浓度提供了建议。这些观察表明, 该协议可用于肾小管体外研究与一致, 标准化生产的肾脏 TECs。该协议可能有更广泛的未来应用研究与肾脏疾病相关的线粒体功能障碍的药物发现或药物表征目的。
引言
肾小管上皮细胞 (TEC) 功能与肾脏的整体健康状况密切相关。肾脏病理信号引起 TECs 的分化, 在肾脏纤维化和慢性肾脏疾病 (CKD)1,2中起着重要作用。作为一个高度精力充沛的器官, 肾脏是仅次于心脏在氧气消耗量, 主要通过线粒体氧化磷酸化3。电镜研究显示, 肾小管4的线粒体形态学改变与病理事件呈正相关。TECs 线粒体功能障碍导致肾纤维化通过上皮间质转移5和缺陷脂肪酸氧化6。纤维化是一种渐进性肾脏病理学, 导致 CKD。因此, 了解肾脏 TECs 的能量状态是揭示 CKD 的病理生理学的必要。
有 > 20 细胞类型在成人肾脏7。为了研究 TECs 的功能, 需要将肾上皮细胞的原代培养作为分子生物学应用的平台, 如化学治疗和基因处理。重要的是, 基因操作可以通过转基因或使用 AAV 基因传递技术在小鼠体内进行 ,从而使分离的主要细胞已经被基因操纵。小鼠9,10, 大鼠11,12,13, 犬齿14, 兔15,16, 和人的原发性肾管状细胞的分离17 ,18已被报告纯化步骤, 以产生纯近端管状细胞。在这些先前发表的协议中, 聚焦于近端管状细胞的分离, 进行了梯度离心和分选实验, 用于净化目的19。虽然这些协议对研究近端小管有很高的价值, 但当需要研究近端和远端小管时, 它们是不够的。例如, 我们对 Alport 综合征的研究表明, 近端和远端肾小管在20的疾病进展中起着重要作用, 因此在培养中应研究两种肾小管。最近一项关于肾氟中毒的研究还表明, 近端和远端小管21均发生了病理改变。因此, 该隔离协议的设计和优化的近端和远端管状细胞从小鼠肾脏与最低的试剂成本和简单的程序。另外, 调查人员仍然可以遵循该协议, 直到步骤 3.1, 并添加净化步骤9从这一点前, 以隔离纯近端管状细胞。
分离细胞呈现高能量水平, 在亚文化后保持肾上皮特征为4通道。利用高通量胞外流量分析仪, 对96井板分离 TECs 中的线粒体呼吸进行直接评估, 从而进一步深入研究细胞密度优化问题。这些观察表明, 该协议可以应用于肾小管体外研究与一致, 标准化生产的肾脏 TECs。该协议的一个附加意义是它作为高通量工具在肾近端和远端管状细胞中线粒体生物能学的体外鉴定中的可行性应用。因此, 它可以作为药物发现或药物表征的目的, 为肾脏疾病的一个平台。
研究方案
所有涉及动物的实验都得到了迈阿密大学机构动物护理和使用委员会的批准, 符合 NIH 的指导方针。
1. 板材涂层和试剂的制备
- 制备胶原涂层:
- 添加 35 ul 的胶原 i 到2毫升的预过滤20毫米醋酸溶液到一个单一的60毫米培养皿。在室温下孵化1小时, 风干, 然后暴露在紫外线下。
- 用 PBS 清洗3x 涂层, 去除任何酸性残留物, 并将其保存在37°c2游离细胞培养孵化器中, 直到细胞准备播种。胶原涂层的最终浓度为5微克/厘米2。
- 准备灌注缓冲: 添加 300 ul 的青霉素-链霉素 (P/秒) 到30毫升的 PBS 和温暖的混合物在37°c 水浴, 直到隔离开始。
- 准备消化缓冲剂: 将3.9 毫克的胶原酶2型溶入 PBS 30 毫升, 通过0.2 微米的瓶顶过滤器过滤溶液, 在37摄氏度的水浴中加热, 直到隔离开始。
- 准备单元格区域性媒体:
- 把补品带到室温。没有过滤, 添加补充 (0.05 毫升胎儿小牛血清, 10 毫升的表皮生长因子, 5 微克/毫升胰岛素, 0.5 微克/毫升肾上腺素, 36 ng/毫升的氢化, 5 微克/毫升的转铁蛋白, 4 pg/毫升的 triiodo-thyronine) 到 500 mL 肾上皮细胞生长基部中等2。
- 在37摄氏度的水浴中加热介质, 直到它准备好使用。
- 准备化合物: 准备50毫米 FCCP, 10 毫米鱼藤酮, 10 毫米寡霉素, 10 毫米 antimycin A, 50 毫米 l-肉碱, 50 毫米 etomoxir 库存解决方案所有在亚砜, 整除他们, 并存储化合物在-20 摄氏度。
- 在220毫升的150毫米氯化钠溶液中准备2.5 毫米棕榈酸钠, 在75摄氏度的水浴中加热溶液, 直到棕榈酸完全溶解为止。
- 制备牛血清白蛋白 (bsa): 在250毫升150毫米氯化钠中制备0.34 毫米无脂 BSA。控制 BSA 作为对 palm bsa 解决方案的负控制, 可通过以下步骤1.8 进行准备。
- 将棕榈酸酯与 bsa (棕榈 bsa) 共轭:
- 将棕榈酸溶液逐渐添加到 BSA 溶液中, 而它仍然是热的。然后, 调整 pH 值为 7.4, 并将其混合在37摄氏度, 至少1小时完成共轭。
- 当共轭完成后, 再添加150毫升的150毫米氯化钠溶液, 搅拌均匀, 并将整除数保存在-20 摄氏度。最后的解决方案包含1毫米棕榈酸钠和0.17 毫米 BSA, 并将作为脂肪酸基板的细胞在脂肪酸的胞外通量检测。
- 制备胞外通量测定基底介质:
- 添加1袋 DMEM 粉和20毫升200毫米 l-谷氨酰胺 (4 毫米最终) 到 1 L 的蒸压 dH2O 和混合他们轻轻。
- 在生物能学实验当天, 将100µM 丙酮酸钠添加到所制备的基底培养基中, 用于随后制备的胞外通量测定介质, 用于葡萄糖或脂肪酸基呼吸试验。
- 制备葡萄糖基介质:
- 通过糖酵解来测量细胞呼吸能力, 添加17.5 毫米葡萄糖粉, 100 µM 控制 BSA (如步骤1.7 所述), 20 µM etomoxir (抑制脂肪酸氧化) 到上述步骤1.9 中所述的基底介质。
- 将介质预热37摄氏度, 将 pH 值调整为 7.4, 将其保持在37摄氏度的水浴中, 直到用于胞外通量检测。
- 制备脂肪酸基介质:
- 为了通过脂肪酸氧化来测量细胞呼吸能力, 添加10毫米 2 d-葡萄糖粉 (葡萄糖模拟抑制糖酵解), 100 µM 棕榈 BSA (如步骤1.8 所述), 100 µM l-肉碱的基础媒体上所述的步骤1.9。
- 将介质预热37摄氏度, 将 pH 值调整为 7.4, 并将其保持在37°c 水浴中, 直到用于胞外通量测定。
2. 小鼠肾脏的灌注、消化和采集
- 麻醉的老鼠与异氟醚的流动和修复它的仰卧位。确保隔离只在动物失去其矫正反射后开始, 麻醉深度是通过使用非创伤性钳在程序22之前和过程中的捏评估来监测的。
- 去除毛皮, 使用脱毛奶油, 从鼠标的胸部到其腹部区域, 用碘消毒, 并清除碘残留物。
- 切开胸部, 切开皮肤, 打开整个腹部, 露出心脏和肾脏。
- 在开始灌注前, 在32毫升/分钟内设置灌注泵, 并清除油管中的任何气泡。
- 一旦缓冲区填满心脏, 将一根27克的针插入左心室, 然后在右心房上戳出一个出口, 这样, 灌注缓冲就会随着心脏泵循环, 最终从右房出口中移除。
- 灌注后, 将泵速调至30毫升/分钟即可进行消化。
- 20毫升消化缓冲液通过先端灌注后, 将两个肾脏移除, 用于管状细胞分离。
3. 组织处理和原发性管状细胞分离
- 取出肾胶囊和髓质, 将两个肾脏切成小块, 并在37摄氏度的烤箱中孵育10毫升的消化缓冲液, 温和旋转5分钟。
- 通过70微米的过滤器通过缓冲液去除未消化的肾脏组织。添加10毫升培养基以停止消化。
- 收集管状细胞, 离心过滤细胞悬浮在 50 x g 5 分钟收集第一粒。将上清液转移到新管上, 加入5毫升培养基, 将其离心 50 x 克5分钟, 以确保所有管状细胞被收集到第二颗粒中。
离心是以较低的速度主要颗粒重管。之后, 细胞从隔离中恢复后, 纯管培养在亚文化中离心的速度更高。 - 并用重悬20毫升培养基中的第一颗粒, 离心机以 50 x g 为5分钟收集第三颗粒。
- 并用重悬1毫升培养基中的第二和第三粒。将10µL 的细胞悬浮物与10µL 的台盼蓝混合, 将混合物装入计数滑块的 a 室, 并从自动细胞计数器记录细胞的生存能力 (见材料表)。
- 种子多达 107细胞 (一个异质种群) 到一个60毫米的盘子预先涂上胶原蛋白, 让管状细胞在一夜之间附加。
4. 原发性管状细胞亚培养和表征
- 在1天的隔离后, 收集培养基和离心机, 在 50 x g 5 分钟, 以颗粒任何浮动小管。取出上清液, 并用重悬4毫升新鲜培养基中的细胞颗粒, 并将其板回同一培养皿中。
- 在4天隔离后, 删除旧的文化媒体, 并添加新鲜的媒体。
- 在隔离后的7天, 分离细胞通过孵化他们在37°c 2 毫升0.25% 胰蛋白酶-EDTA 为5分钟. 添加3毫升培养基以停止反应, 并通过离心在 250 x g 的5分钟来收集细胞。
- 到亚文化和特征的细胞从 P0 到 P1, 种子5000细胞每井到一个24井板涂上胶原蛋白 I 如上文所述。
- 24 h 在步4.4 以后, 固定细胞在 P1 与4% 煤灰为10分钟, permeabilize 他们与0.2% 海卫 X-100 为3分钟, 并且阻拦他们与10% 驴子血清 (DS) 为 1 h 在室温下。
- 稀释, 到1:100 在 10% DS, 以下蛋白质: 近端管状标记原 (AGT) 和水通道 1 (AQP1);远端管状标记 e-钙黏蛋白;系膜标记 CD90/Thy1;和巨噬细胞标记表皮生长因子样的模块包含黏蛋白样的激素受体, 如 1 (F4/80) 和分化 68 (CD68), 并孵化他们与细胞过夜4摄氏度。
- 第二天, 检测任何染色使用1:200 抗兔, 抗鼠, 或抗鼠荧光继发抗体45分钟。在共聚焦显微镜下拍摄图像, 以确认标记的表达式, 如图 2A所示。
- 在 P1 亚文化之后的3天, 通过对步骤4.5 中描述的管状、系膜和巨噬细胞标记的染色, 将细胞分离为亚文化, 并在 P2 中进行表征。图像的染色在共焦显微镜下, 以确认标记的表达, 如图 2A所示。
- 在 P2 亚文化之后的3天, 通过对步骤4.5 中描述的管状、系膜和巨噬细胞标记的染色, 将细胞分离为亚文化, 并在 P3 中进行表征。图像的染色在共焦显微镜下, 以确认标记的表达, 如图 2A所示。
- 准备组织染色:
- 空气干燥冷冻野生型和Col4a3/ 肾切片在室温下1小时, 并修复他们与4% 粉煤灰10分钟 Permeabilize 他们与0.2% 海卫 X-100 10 分钟, 并阻止他们与10% 驴血清 (DS) 1 小时的室温。添加抗体对步骤4.5 中描述的标记蛋白在1:200 和孵化他们在4°c 过夜。
- 第二天, 检测任何染色与1:200 抗兔, 抗鼠, 或抗鼠荧光继发抗体45分钟。在共聚焦显微镜下拍摄图像, 以确认标记的表达式, 如图 2B和2C所示。
5. 线粒体生物能学测定
- 种子 P1 管状细胞在 2万, 3万, 或4万细胞每井 100 ul 培养基上的 96-井微板块预涂有5微克/cm2胶原蛋白 i 前一天的细胞外通量测定。
- 对于传感器墨盒的水化, 提起传感器墨盒, 并用 200 ul 校准解决方案填充该板的每个井。小心地将墨盒装回, 将传感器浸入校准溶液中。在使用前至少7小时将墨盒放在37摄氏度烤箱中, 不加2 。
为取得最佳效果, 建议隔夜墨盒水化。 - 准备化合物: 准备8µM 寡霉素, 9 µM FCCP, 20 µM 鱼藤酮/antimycin 混合葡萄糖 (在步骤 1.10) 和脂肪酸 (描述在步骤 1.11) 胞外通量测定介质。
- 更改介质: 吸入细胞培养基, 添加175µL 葡萄糖或脂肪酸测定介质 (依赖于正在工作的化合物, 见步骤 5.3), 并在37摄氏度 CO2免费孵化器中孵化1小时。
- 用以下化合物的25µL 加载墨盒端口: 8 微米寡霉素为端口 a 达到最后浓度1µM (注: 由于每个井将包含175µL 的介质, 该化合物将得到稀释 8x), 9 微米 FCCP 在港 B 达到最终浓度1µM (注: 由于每个井将包含175µL 介质加上25µL 的溶液注入从端口 A, 化合物将得到稀释 9x), 20 µM 鱼藤酮/antimycin A 在港 C, 以达到最终浓度2µM 为每个化合物 (注: 由于每一个井将包含175µL 的介质加上50µL 的溶液注入从端口 A 和 B, 该化合物将得到稀释 10x)。
- 将水添加到 D 港的所有水井和背景井的所有其他端口 (无单元格)。在37°c2免费孵化器孵化墨盒10分钟。
- 打开胞外通量分析仪和控制器。
- 打开分析器软件并输入以下协议:
- 选择标准化验。按化验向导。使用 "化合物" 选项卡, 分配复合布局并使用 "组和标签" 选项卡对实验组进行标记。记住将空井 (不带单元格) 指定为背景。
- 在 "协议" 选项卡下, 使用表 1中所示的可用命令设置以下组合和度量周期: 校准, 混合2分钟, 等待2分钟, 并测量3分钟 (重复这个周期 2-3x);注入端口 A, 混合2分钟, 等待2分钟, 测量3分钟 (重复这个周期 2-3x);注入端口 B, 混合2分钟, 等待2分钟, 测量3分钟 (重复这个周期 2-3x);注入端口 C, 混合 2min, 等待2分钟, 测量3分钟 (重复这个周期 2-3x)。按End 向导。还可以保存当前模板以供将来使用。
- 按开始开始校准。分析仪然后自动弹出板持有人, 并要求插入墨盒板。
- 校准步骤完成后 (通常为 20-25 分钟), 按提示命令将墨盒板更改为电池板并继续运行。
- 当运行完成后, 传输数据, 并卸下96井板。添加赫斯特 (1:1, 000) 到每一个化验井和孵化他们5分钟在37摄氏度。通过测量 355 nm 激发和 460 nm 发射的赫斯特荧光读数, 将 OCR 数据规范化为单元格计数。
结果
肾脏灌注和消化产生高度可行的管状上皮细胞:
在上文所述议定书 1-3 节概述的步骤下, 小鼠肾管上皮细胞被隔离。
消解后, 在隔离日将一组不同数量的肾细胞、未完全消化的小管和其他小于70µm 的组织碎片镀到培养皿中。在隔离后0天到1天的变化通常只能在细胞附着而不是细胞生长中看到。通过对漂浮的异质种群的观察, 1 天只有少数管状细胞被附着 (图 1A)。重新收集的细胞在1天, 一个离心, 和重新电镀有助于清除光碎片, 并解决小管块, 以管道细胞释放。从1天到3天, 预期不仅在一个更好的细胞附着, 而且在一个显著改善的细胞生长率, 被观察到与1天 (图 1A) 更高的细胞密度。在最初的生长阶段, 细胞形成了几个殖民地并且居住在殖民地附近。从这一点上说, 隔离细胞完全恢复, 并显示出健康的增殖。到了5天, 细胞在60毫米培养皿中处于 80-90% 融合, 细胞与细胞之间有空间, 菌落之间有空隙 (图 1A)。
分离的管状细胞的亚培养和表征:
根据上文所述的《议定书》4节概述的步骤, 对孤立的肾小管上皮细胞进行了亚培养。
从5天起, 细胞完全从隔离中恢复, 并开始大力增殖。隔离后的一周内, 细胞生长在一个60毫米的培养皿中融合。经过1周的文化在通道 0, 细胞已经准备好被分培养到 1, 随后, 2 多通道。在1和2段中观察到类似的生长模式。通常, 通过1和2的细胞生长到融合进一步的亚文化 (图 1B) 需要不到一周的时间。从通道0到通道2的汇合细胞的连续培养显示了一个广泛的圆顶形成23,24 (图 1B), 表明隔离细胞保持健康的状态, 他们排泄液体类似到体内状态。这导致细胞的单层从板上抬起, 但通过紧密连接保持联系。
为了对培养的细胞进行表征, 我们在1至4通道的培养细胞中进行了免疫荧光染色, 并在控制细胞线-人近端肾上皮 HK-2 细胞中进行。近端管状标记, 水通道蛋白 1 (AQP1)25和原 (AGT)9, 远端管状标记 e-钙粘蛋白25, 上皮标记平滑肌肌动蛋白 (SMA)26,27,28,巨噬细胞标记 F4/8029和 CD6830, 并将系膜标记胸腺分化抗原 1 (Thy1/CD90)9用于表征研究。近端管状蛋白 AQP1 和 AGT 在1至4通道的孤立管状细胞和近端上皮细胞的正控制 HK-2 中均有高度表达 (图 2A)。远端管状蛋白 e-钙黏素表达在孤立的管状细胞通过通道 4, 也观察到 HK-2 细胞 (图 2A)。SMA 在分离的管状细胞和控制 HK-2 细胞中表达丰富, 与发表的报告26,27一致。另一方面, 分离的管状细胞和控制 HK-2 细胞中均缺乏系膜蛋白 Thy1 和巨噬细胞蛋白 F4/80 (图 2A)。CD68 在 HK-2 细胞和在通道1和通道2的孤立管状细胞中表现出极小的表达, 然后它的表达从通道3通过 4 (图 2A) 中无法探测到。结果表明, 本协议所隔离的细胞是近端和远端管状细胞的混合体。为了比较这些标记蛋白在体内的表达, 我们在冷冻肾组织中进行了染色。AQP1、AGT 和 e-钙黏蛋白等管状标志物和系膜蛋白质 Thy1 在野生型健康小鼠肾脏中被发现高度表达 (图 2B)。F4/80 和 CD68 的低表达在野生型肾脏观察, 但广泛表达在肾功能衰竭的 Col4a3/小鼠, 以巨噬细胞浸润20,31 (图 2C)。
分离的原发性管状细胞线粒体生物能学测定:
上文所述的《议定书》5节概述了线粒体呼吸试验步骤。
通过对不同镀层密度下氧耗率 (OCR) 的细胞外通量分析, 测定分离的原发性管状细胞的线粒体呼吸。为了滴定电镀密度, 2万, 3万和4万主要 TECs 每井被播种到96井 XF96 微板块前一天 (大约 20 h 之前) 细胞外通量测定 (图 3A)。在细胞外通量分析之后, 通过对赫斯特染色的量化, 将 OCR 测量规范化为细胞计数。电镀 TECs 在 2万, 3万, 或4万细胞/以及导致平均基底 OCR 的 25, 45, 或 50 pmol/分钟 (图 3A)。此外, 被镀细胞的显微图像显示, 4万细胞/井覆盖了微板块井底部的整个表面, 比其他电镀密度好 (图 3B)。虽然最大的 OCR 没有增加使用4万细胞相比, 3万细胞的密度, 我们建议一个细胞密度约4万细胞/良好的细胞和化合物之间的最佳相互作用。
此外, 在我们的实验中, 抑制/uncoupler 化合物的最佳浓度被证明是1µM 寡霉素, 1 µM FCCP, 2 µM 鱼藤酮/antimycin-A (细胞外通量测定的协议和端口注射列于表1中。;优化实验不显示)。然而, 建议所有用户运行一个初步测试, 这些化合物的各种浓度, 理想地低和高于公布的价值, 以保证最好的结果。
细胞外通量测定为评估肾 TECs 生物能学提供了一些重要的参数。例如, 由于脂肪酸氧化在 TECs 中表现出特殊的缺陷, 使用含有脂肪酸基质 (棕榈酸) 的培养基以及糖酵解抑制剂 (2DG) 可以作为直接评价 TECs 脂肪酸氧化的有用工具。在段落1和 2 (图 3C)。在肾纤维化的情况下, 细胞的整体呼吸能力预计会低于健康的肾脏, 即使基于葡萄糖的培养基可能不会显示任何差异。
同时, 细胞外通量检测, 特别是评价脂肪酸氧化能力, 可作为一种信息性的措施, 以评估肾 TECs 的能量状态, 其中病理改变影响生物能学剖面发挥肾纤维化的主要作用及肾功能衰竭的进展。
| 步骤 | 时间 (分钟) |
| 校准 | |
| 平衡 | 00:12:00 |
| 测量1 | 3环路 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 注入端口 A (1 微米寡霉素) | 2环路 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 注入端口 B (1 微米 FCCP) | 2环路 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 注射端口 C (2 微米 Rotenon/Antimycin) | 2环路 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
| 混合 | 00:02:00 |
| 等 | 00:02:00 |
| 措施 | 00:03:00 |
表1。标准的细胞外通量分析运行协议的最佳 OCR 测量的主要管状细胞。
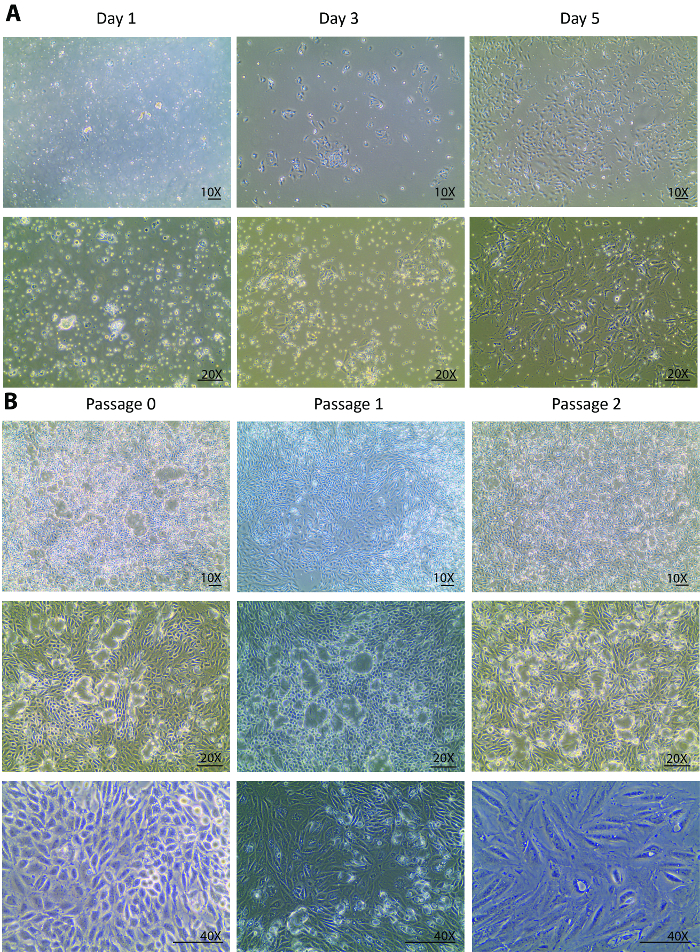
图1。分离的原发性管状细胞的细胞培养.(A) 孤立的主要管状细胞在1天早期附着, 并从3天到5天强健地生长。图像是在10X 和20X 目标下拍摄的。(B) 本小组显示由0至3段的隔离主要管状细胞的亚文化。图像是根据10X 和20X 目标的细胞圆顶的愿景, 并在40X 的目标, 以视觉的形态学变化通过通道。比例条 = 100 µm.请点击这里查看这个数字的大版本.
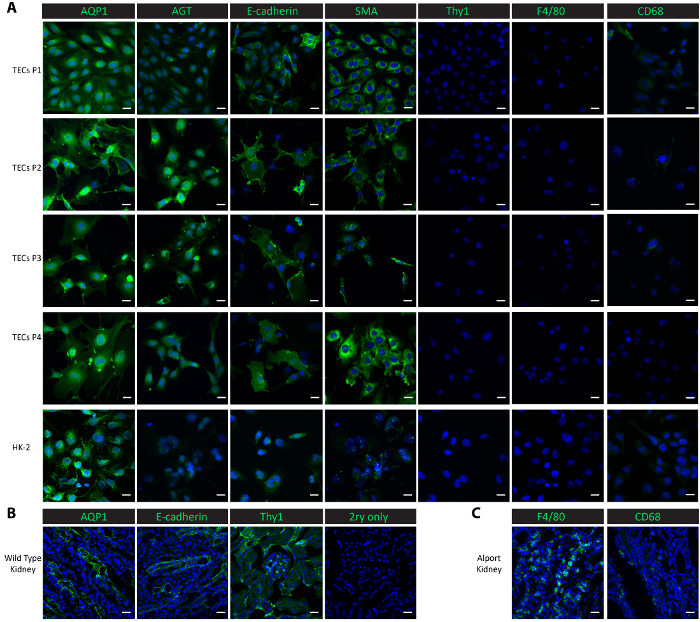
图2。分离的原发性管状细胞的表征.(A) 染色对近端管状蛋白 (AQP1、AGT)、远端管状蛋白 (e-钙黏素)、上皮蛋白 (SMA)、系膜蛋白 (Thy1) 和巨噬细胞蛋白 (F4/80、CD68) 的抗体, 表明分离的主要管状细胞和随后的亚文化是纯近端和远端管状细胞。(B) 本小组展示了一种健康野鼠肾脏组织的近端小管、远端管和系膜蛋白的染色, 作为阳性对照和无主阴性对照。(C) 本小组显示了从Col4a3/ 老鼠收集的肾组织中巨噬细胞蛋白 F4/80 和 CD68 的染色作为阳性对照。比例条 = 20 µm。DAPI 以蓝色显示。标记蛋白以绿色显示。请单击此处查看此图的较大版本.
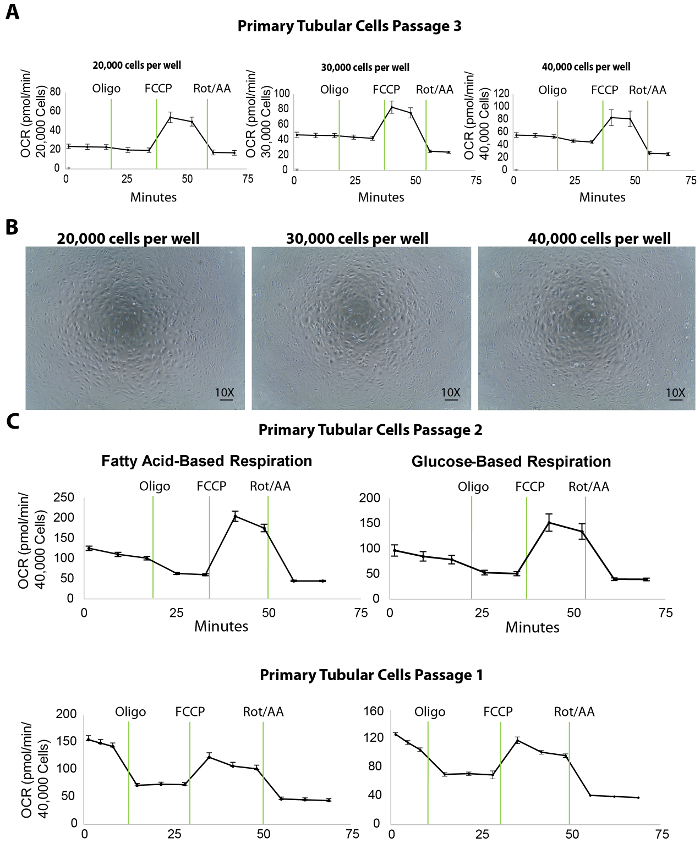
图3。不同镀层密度下分离的原发管细胞胞外通量的测定.(A) 增加细胞的电镀密度能提高初级管状细胞的基本呼吸水平, 在3段测试。(B) 本小组显示了在2万、3万和4万细胞/井密度下培养的 XF96 微板块的主要管状细胞的显微图像。比例条 = 100 µm. (C) 本小组在2和1段中显示了主要管状细胞中的脂肪酸或葡萄糖为基础的胞外通量测定。数据是有意义的.请点击这里查看这个数字的大版本.
讨论
我们优化了一个协议, 允许有效地隔离小鼠肾脏管状上皮细胞 (TECs), 并表明细胞可以进行亚培养的细胞外通量分析, 以评估线粒体呼吸的存在脂肪酸-和/或葡萄糖基基质。本协议的目的是研究聚焦在近端和远端管状细胞, 并作为一个框架, 以建立更复杂的实验, 以了解与疾病病理相关的肾病。与以前发布的协议9、10、19相比, 此方法不需要具有长时间离心时间的渐变分离或大量的抗体使用来进行排序, 因此提供了更为肾小管代谢领域的研究人员提供高效、优化的指导。该协议有几个关键步骤, 包括消化, 再收集, 电镀密度和复合优化的细胞外通量测定。
选择正确的胶原酶类型和最佳浓度是成功消化和分离肾组织管状细胞的关键。与其他类型的胶原酶相比, 2 型胶原酶含有相对较高的蛋白酶活性, 能够游离致密的肾脏结构。为了尽量减少由于长期灌注和消化时间造成的污染的几率, 0.013% 2 型胶原酶在30毫升/分钟内灌注。肾脏胶囊只有在两个肾脏从动物身上收获并转移到一个消毒细胞培养罩后才被除去。肾脏被切成小块, 并继续他们的孵化与10毫升的消化缓冲5分钟, 完全消化和最大释放的管状细胞。
虽然, 消化后, 组织悬浮通过一个 70-µm 过滤器, 以去除非常大的组织片断, 仍然会有未消化的小管通过过滤器, 并留在细胞悬浮, 并得到镀到培养皿。这些小管要花较长的时间, 才能释放细胞, 并牢牢附着在培养皿上。因此, 在细胞电镀后的第二天, 收集细胞悬浮液和离心机对未连接的小管和细胞进行颗粒分离是相当重要的。这种低速离心步骤进一步去除比管状细胞更轻的其他细胞类型, 并允许不连接的小管细胞和管子干细胞沉淀。
正确细胞密度的鉴定是成功的细胞外通量测定的第一步和关键步骤。结果表明, XF96 微板块上的4万个细胞在脂肪酸和葡萄糖基呼吸试验中都是理想的原发性管状细胞 (图 3C)。在本协议中, 分离的管状细胞用于1和2通道的胞外通量测定。细胞亚培养到通过 3, 虽然他们保持了管状标记的表示 (图 2) 和一个体面的表现在生物能学化验 (图 3A), 并且显示了基本的呼吸水平减少了与段落2相比(通过将图 3A最右边的面板中的 OCR 与图 3C进行比较来显示)。这种减少可能不会影响实质上健康的管状细胞 (例如, 孤立于年轻的野生型小鼠)。然而, 对于已经减少了线粒体呼吸的 CKD 小鼠模型进行的研究, 更高的细胞通道可能导致基础呼吸的进一步下降, 这将影响细胞外通量测定的结果。在这里进行的研究中, 1 和2段的细胞都显示出高的基底呼吸水平。因此, 遵循这一协议, 我们建议使用这两个早期通道的线粒体呼吸研究与细胞分离的健康和患病的动物。如果通过1次亚文化不产生足够的细胞进行通量测定, 则2通道中的细胞仍应考虑在内。除了生物能学的研究, 我们以前的研究表明, 在3通道的初级 TECs 可以非常有用的治疗后, 蛋白质和 RNA 研究 (数据没有显示)。这样说, 我们建议使用此协议隔离管状细胞的研究者应该仔细选择不同研究应用的最佳通道。
细胞外通量分析的工作原理是基于注入化合物与呼吸链复合物的相互作用以及 uncoupler 的作用。寡霉素是一种复合 V (atp 合酶) 抑制剂, 用于区分 ATP 连接的氧气消耗和氧消耗, 以克服线粒体内膜32中的常规质子泄漏。FCCP uncouples 氧消耗从 ATP 生产通过扰乱线粒体膜电位。因此, 它提供了一个测量最大的呼吸能力, 因为它绕过了有限的能力, 质子离子外流的 ATP 合成酶通过允许质子传输通过膜。Antimycin, 一个复杂的 III 抑制剂, 和鱼藤酮, 一个复杂的 I 阻滞剂, 被用来组合关闭整个线粒体呼吸允许分化之间的线粒体与非线粒体氧消耗的细胞。在细胞外通量测定前, 这些化合物应始终滴定特定细胞类型, 以确定最佳的 OCR 曲线的最优浓度。在这里, 我们建议1µM 的寡霉素, 1 µM 的 FCCP, 2 µM 的鱼藤酮/antimycin A 的细胞外通量测定的主要 TECs。
总之, 该协议提供了一种简单和经济有效的方法, 以隔离肾原体近端和远端管状上皮细胞, 可用于评估线粒体生物能学的体外。虽然本议定书可以在广泛的分子生物学研究中发挥作用, 探讨肾小管上皮细胞的生物学功能, 但我们承认它的局限性, 当它应用于需要单纯的近端或远端小管的研究。例如, 研究罗氏综合征, 选择性近端管状功能障碍33, 或研究远端肾小管性酸中毒, 远端管功能障碍34, 将需要一个更复杂的协议, 细胞隔离和净化。然而, 对于比较小管与肾小球的大多数研究, 以及对于筛查一般细胞中潜在的线粒体呼吸调节器的研究, 该协议提供了一种可行的高通量方法。因此, 本议定书可能有广泛的应用研究与肾脏疾病相关的线粒体功能障碍的药物发现或目标验证目的。
披露声明
作者没有什么要申报的。
致谢
这项工作得到以下赠款的支持: Shehadeh (R56HL132209 和 1R01HL140468) 和迈阿密心脏研究所。
材料
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
参考文献
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750(2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997(2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40(2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908(2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231(2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。