Method Article
Изоляция, характеристики и высокую пропускную способность внеклеточного Flux анализ мышь первичной почечной трубчатых эпителиальных клеток
В этой статье
Резюме
Этот протокол обеспечивает экономически эффективный подход к изоляции и характеризуют мышь первичной почечной трубчатых клетки, которые впоследствии югу культивированный оценить биологические функции почек ex vivo, включая митохондриальной биоэнергетики.
Аннотация
Митохондриальной дисфункции почек трубчатых эпителиальных клеток (СППП) может привести к почечной фиброз, основной причиной хронической почечной недостаточности (CKD). Таким образом оценки функции митохондрий в первичной тик может обеспечить ценную информацию о биоэнергетических статус клеток, обеспечивая понимание патофизиологии CKD. Хотя есть ряд сложных протоколов для изоляции и очистки проксимальных канальцев в разных видов, поле отсутствует эффективный метод, оптимизированный для трубчатых ячейки изоляции без необходимости очистки. Здесь мы предоставляем протокол изоляции, что позволяет проводить исследования, посвященные начальных мыши проксимальных и дистальных почечных тик. В дополнение к экономически эффективных реагентов и минимальным животных процедур, необходимых в этом протоколе изолированных клеток поддерживать высокий уровень энергии после изоляции и может быть югу культивируемых до четырех проходов, позволяя для непрерывного исследования. Кроме того с помощью анализатора внеклеточного поток высокой пропускной способности, мы оцениваем митохондриальное дыхание непосредственно в изолированных тик в 96-луночных пластины, для которого мы предоставляем рекомендации по оптимизации плотность клеток и составные концентрации. Эти наблюдения предполагают, что этот протокол может использоваться для почечной трубчатых ex vivo исследований с последовательным, хорошо стандартизованной производства почечной тик. Этот протокол может иметь более широкие будущих приложений для изучения митохондриальной дисфункции, связанные с почечной расстройств, для целей квалификации наркотиков или лекарственных препаратов.
Введение
Функции почек трубчатых эпителиальных клеток (TEC) прочно ассоциируется с общее состояние здоровья почек. Патологических сигнализации в почках приводит к дифференцировке тик, который играет важную роль в фиброз почек и хронической почечной болезни (CKD)1,2. Как весьма энергичный орган функции почек второй только к сердцу потребления кислорода, главным образом через Митохондриальные Оксидативное фосфорилирование3. Микроскопии исследования показали положительная корреляция митохондриальной морфологические изменения патологические события в почечных канальцев4. Митохондриальной дисфункции в тик вызывает фиброз почек через переходного эпителия в мезенхимальных5 и дефектных жирные кислоты окислением6. Фиброз является прогрессивным почечной патологии, что приводит к CKD. Таким образом понимание энергичный состояние почечной Тик является необходимость раскрыть патофизиологии CKD.
Существуют типы клеток > 20 взрослых почек7. Для изучения функции тик, основной культуры эпителиальных клеток почек необходима как платформа для приложений молекулярной биологии, например химических обработок и генетических манипуляций. Главное генетических манипуляций может быть сделано в естественных условиях у мышей через трансгенез или с помощью AAV гена доставки техники8 так, что бы уже генетически манипулировать изолированных клеток первичной. Изоляция первичной почечной трубчатых клетки мышей9,10, крыс11,12,13, клыки14, кролики15,16и люди17 ,18 было сообщено с очистки шаги дают чисто проксимальной трубчатых клетки. В этих ранее опубликованные протоколы, которые сосредоточены на изоляции проксимальной трубной клеток градиентного центрифугирования и сортировка эксперименты проводились для очистки целей19. Хотя эти протоколы являются ценными для изучения проксимальных канальцев, они не являются достаточными, когда проксимальных и дистальных канальцев нужно быть изучены. Например наше исследование на синдром Алпорт показал, что проксимальных и дистальных почечных канальцев играют важную роль в прогрессировании заболевания20, и поэтому оба вида почечных канальцев должны быть расследованы в культуре. Недавнее исследование почек фторид токсичности, также показали, что патологические изменения произошли в проксимальных и дистальных канальцев21. Таким образом этот Протокол изоляции создан и оптимизирован для проксимальных и дистальных трубчатых клетки мыши почки с минимальными затратами реагентов и простых процедур. Кроме того следователи можно по-прежнему следовать протоколу до шаг 3.1 и добавить очистки шаги9 из этой точки вперед для изоляции чистого проксимальной трубной клеток.
Изолированных клеток представляют высокий энергетический уровень и поддерживать почечной эпителиальных характеристики после суб-культур до 4 ходов. С помощью анализатора внеклеточного поток высокой пропускной способности, мы оцениваем митохондриальное дыхание непосредственно в изолированных тик в 96-луночных пластины, что приводит к более глубоко в оптимизации плотности клеток. Эти наблюдения предполагают, что этот протокол может применяться к почечной трубчатых ex vivo исследований с последовательным, хорошо стандартизованной производства почечной тик. Дополнительное значение этого протокола является его возможно использование как инструмент высокой пропускной способности для ex vivo характеристика митохондриального биоэнергетики клетках почечных проксимальном и дистальном трубчатых. Таким образом он может служить в качестве платформы для лекарств или наркотиков характеристика целей болезней почек.
протокол
Все эксперименты с участием животных были утверждены институциональный уход животных и использования Комитетом в Университете Майами, соблюдать руководящие принципы НИЗ.
1. плиты покрытия и подготовка реагентов
- Подготовьте коллаген покрытия:
- Добавить 35 мкл коллагена I к 2 мл раствора уксусной кислоты предварительно отфильтрованной 20 мм на одной чашке Петри 60-мм. Инкубации при комнатной температуре в течение 1 ч, просушите его и подвергать УФ.
- Мыть покрытие 3 x с PBS для удаления остатков кислоты и сохранить его в 37 ° C CO2-инкубатор культуры свободную ячейку до тех пор, пока клетки готовы для посева. Конечная концентрация покрытия коллаген — 5 мкг/см2.
- Подготовить перфузии буфера: добавить 300 мкл пенициллин стрептомицином (P/S) 30 мл PBS и согреться смеси в ванну воды 37 ° C, до тех пор, пока изоляции начинается.
- Подготовить пищеварение буфера: распустить 3,9 мг коллагеназы типа 2 в 30 мл PBS, фильтровать решение через фильтр верхней бутылки 0,2 мкм и его разогреть на водяной бане при 37 ° C, до тех пор, пока изоляции начинается.
- Подготовка клетки культуры средств массовой информации:
- Принесите добавки до комнатной температуры. Без фильтрации добавьте дополнения (0,05 мл сыворотки плода теленка, 10 нг/мл эпидермального фактора роста, 5 мкг/мл инсулина, 0,5 мкг/мл эпинефрина, 36 нг/мл гидрокортизон, 5 мкг/мл трансферрина и 4 пг/мл triiodo-L-thyronine) в 500 мл почек эпителиальных клеток роста базальной среднего 2.
- Разминка СМИ в ванну воды 37 ° C, до тех пор, пока он готов к использованию.
- Подготовить соединений: подготовка 50 мм FCCP, ротенон 10 мм, 10 мм oligomycin, antimycin A 10 мм, 50 мм L-карнитин и 50 мм etomoxir складе решений все в ДМСО, аликвота их и хранить соединений при-20 ° C.
- Подготовить пальмитат натрия 2,5 мм в 220 мл раствора NaCl 150-мм и согреться решение в водяной бане 75 ° C, пока пальмитата полностью не растворится.
- Подготовить бычьим сывороточным альбумином (БСА): подготовка 0,34 мм обезжиренного BSA в 250 мл 150 мм NaCl. Элемент управления BSA служит отрицательный контроль для palm-BSA решения, которое может быть подготовлен, выполнив шаг 1.8.
- Конъюгат пальмитата в BSA (Palm-BSA):
- Добавьте пальмитата раствор постепенно в раствор BSA, пока она еще горячая. Затем скорректировать рН 7,4 и смешивать их при 37 ° C для по крайней мере 1 час для завершения спряжения.
- Когда завершена спряжение, добавьте еще 150 мл 150 мм NaCl в решение, хорошо перемешать и сохранять аликвоты при-20 ° C. Окончательное решение содержит натрия 1 мм 0.17 мм и пальмитата BSA и будет использоваться как субстрат жирных кислот для ячеек в assay внеклеточного потока на основе жирных кислот.
- Подготовьте внеклеточного потока пробирного базальной СМИ:
- Добавить 1 Л газобетона dH2O 1 пакетик порошка DMEM и 20 мл 200 мм L-глютамин (окончательный 4 мм) и осторожно перемешать.
- В день эксперимента биоэнергетики добавьте 100 мкм пируват натрия в подготовленный базальной СМИ для последующих препаратов внеклеточного потока пробирного СМИ использоваться в глюкозы - или жирные кислоты - assay основанный дыхания.
- Подготовьте на основе глюкозы СМИ:
- Для измерения клеточное дыхание потенциала путем гликолиза, добавьте базальной СМИ, описано выше в шаге 1.9 17,5 мм глюкозы порошок, 100 мкм управления BSA (как описано в шаге 1.7) и 20 мкм etomoxir (для ингибирования окисления жирных кислот).
- Разогреть СМИ при 37 ° C, скорректировать рН 7,4 и держать его в ванну воды 37 ° C, до тех пор, пока он используется в assay внеклеточного потока.
- Подготовьте на основе жирных кислот СМИ:
- Чтобы измерить клеточное дыхание потенциала путем окисления жирных кислот, добавить порошок 10 мм 2D-глюкоза (глюкозы аналоговые подавляют гликолиз), 100 мкм Palm-BSA (как описано в разделе Шаг 1.8) и 100 мкм L-карнитина в базальной СМИ описано выше в шаге 1.9.
- Разогреть СМИ при 37 ° C, скорректировать рН 7,4 и держать его в ванну воды 37 ° C, до тех пор, пока он используется в assay внеклеточного потока.
2. перфузии, пищеварение и заготовки почек от мышей
- Анестезировать мышь с потоком изофлюрановая и исправить ее в лежачем положении. Убедитесь, что изоляции только начинается после того, как животное теряет ее восстанавливающих рефлексов и глубины анестезии контролируется щепотку оценок с использованием атравматической щипцы, до и во время процедуры22.
- Удаление меха, используя для удаления волос крем, от груди мыши в брюшной области, лечить с йодом и уничтожить остатки йода.
- Сделать надрез в грудь, вырезать кожу, чтобы открыть весь брюшной области и разоблачить сердце и почки.
- Настройка перфузионного насоса в 32 мл/мин и удалите любые пузыри в трубке перед началом перфузии.
- Вставьте иглу 27-G в левого желудочка через верхушки сердца, как только буфер заполняется сердце и тыкать правого предсердия для создания выхода, чтобы буфер перфузии циркулирует как сердце насосов и в конечном итоге получает удален от съезда правого предсердия.
- После перфузии перейдите скорость насоса до 30 мл/мин для пищеварения.
- После того, как 20 мл буфера пищеварения увлажненную через верхушки, удалите обе почки для трубчатых ячейки изоляции.
3. ткань обработки и начальных трубчатые клетки изоляции
- Удаление почки капсулы и продолговатого мозга, фарш обеих почек на мелкие кусочки и инкубировать их в 10 мл буфера пищеварение в 37 ° C духовке с нежным вращение 5 мин.
- Удалите любые непереваренных почечной ткани, передав буфер через фильтр 70 мкм. Добавьте 10 мл культуры средств массовой информации, чтобы остановить пищеварение.
- Чтобы собрать трубчатых клетки, центрифуги суспензию отфильтрованных клеток на 50 g x 5 минут собрать первый Пелле. Супернатант передать новой трубки и добавьте 5 мл культуры средств массовой информации, центрифуги, она на 50 g x 5 мин для обеспечения все трубчатые клетки собраны в втором Пелле.
Центрифугирование находится на более низкой скорости в основном Пелле тяжелых трубочки. Позднее после того, как клетки оправиться от изоляции, чистой трубчатых культуры является центрифугируется на более высокой скорости в суб-культуры. - Ресуспензируйте первый гранул в 20 мл культуры средств массовой информации и центрифуги на 50 g x 5 минут собрать третий Пелле.
- Ресуспензируйте второй и третий гранул в 1 мл культуры средств массовой информации. Смесь 10 мкл суспензии клеток с 10 мкл Трипановый синий, загрузить смеси в камеру A подсчета слайдов, и запись жизнеспособность клеток от автоматического мобильных счетчика (см. Таблицу материалы).
- Семян до 107 клеток (гетерогенные населения) на одно блюдо 60-мм предварительно покрытием с коллагеном и пусть трубчатых клетки придают на ночь.
4. начальное трубчатых клетки суб-культуры и характеристика
- На 1 день после изоляции собирать культуру СМИ и центрифуги на 50 x g за 5 мин до Пелле любые плавающие трубочки. Удалить супернатант и Ресуспензируйте Пелле клеток в 4 мл свежего культуры средств массовой информации и его обратно в том же культуры блюдо тарелку.
- На 4 день после изоляции удалите старые средства массовой информации культуры и добавить свежие средства массовой информации.
- День 7 после изоляции отсоедините клетки, инкубации их при 37 ° C в 2 мл 0,25% трипсина ЭДТА для 5 минут добавить 3 мл культуры средств массовой информации для остановки реакции и собирать клетки центрифугированием на 250 g x 5 мин.
- К югу культуры и характеризуют клетки от P0 до P1, 5000 клеток семян на также на 24-ну пластину с покрытием коллаген я как описано выше.
- 24 ч после шага 4.4, исправить клетки на P1 с 4% PFA для 10 мин, разрушения их с 0,2% Тритон X-100 на 3 мин и блокировать их с 10% осла сыворотки (DS) за 1 ч при комнатной температуре.
- Разбавить, плече в 10% DS, каждый из следующих белков: проксимальной трубной маркеры таким (AGT) и Аквапорин 1 (AQP1); Дистальная трубчатых маркер E-Кадгерины; Мезангиальный маркер CD90/Thy1; и макрофагов маркеры EGF-как модуль содержащих гормон муцина как рецептор-как 1 (F4/80) и Кластер дифференцировки 68 (CD68) и инкубировать их с клетки на ночь при 4 ° C.
- Следующий день, обнаружить любые окрашивание с помощью 1: 200 анти кролик, анти мыши или крысы анти флуоресцентные вторичные антитела для 45 мин. Возьмите изображения под confocal микроскопии для подтверждения выражение маркеров, как показано на рисунке 2А.
- На 3 день после суб-культуры P1 отсоедините клетки для суб-культуры и характеристика в P2, окрашивание трубчатые, Мезангиальный и макрофагов маркеров, описанный в шаге 4.5. Изображения, окрашивание под confocal микроскопии для подтверждения выражение маркеров, как показано на рисунке 2А.
- На 3 день после суб-культуры P2 отсоедините клетки для суб-культуры и характеристика на P3, окрашивание трубчатые, Мезангиальный и макрофагов маркеров, описанный в шаге 4.5. Изображения, окрашивание под confocal микроскопии для подтверждения выражение маркеров, как показано на рисунке 2А.
- Подготовьте окрашивания тканей:
- Просушите замороженных одичал тип и Col4a3- / - слайды почек на 1 ч при комнатной температуре и исправить их с 4% PFA для 10 min. разрушения их с 0,2% Тритон X-100 10 мин и блокировать их с 10% осла сыворотки (DS) за 1 ч при комнатной температуре. Добавить антитела против белков маркер, описанный в шаге 4.5 на 1: 200 и инкубировать их в 4 ° C на ночь.
- Следующий день, обнаружить любой окраски с 1: 200 анти кролик, анти мыши или крысы анти флуоресцентные вторичные антитела для 45 мин. Фотографировать под Конфокальный микроскоп для подтверждения выражение маркеров, как показано в цифры 2B и 2 C.
5. митохондрии Биоэнергетика Assay
- Семя P1 трубчатых клетки на 20000, 30000 или 40 000 ячеек на скважину в 100 мкл культуры средств массовой информации на 96-луночных микропланшетов предварительно с покрытием 5 мкг/см2 коллаген я за день до внеклеточного потока анализов.
- Для гидратации датчик картриджа, Поднимите картридж датчик и заполнить каждый хорошо из пластины с 200 мкл калибровочных раствора. Тщательно загрузить картридж обратно в погружать датчик в калибровочный раствор. Установите картридж в 37 ° C духовке без CO2 для по крайней мере 7 h до использования.
Для достижения наилучших результатов рекомендуется ночи картридж гидратации. - Подготовьте соединений: подготовка 8 мкм oligomycin, 9 мкм FCCP и 20 мкм ротенон/antimycin A смесь глюкозы (описано в шаге 1.10) и жирных кислот (описано в шаге 1.11) внеклеточной потока пробирного СМИ.
- Изменить СМИ: аспирационная СМИ культуры клеток, 175 мкл глюкозы или жирные кислоты пробирного СМИ (зависит от комплекса, который работал в, см. шаг 5.3) и проинкубируйте 1 ч в 37 ° C CO2-бесплатные инкубатора.
- Загрузка картриджа порты с 25 мкл следующих соединений: 8 мкм oligomycin для порта A для достижения конечной концентрации 1 мкм (Примечание: как каждый хорошо будет содержать 175 мкл средств массовой информации, соединение будет получить разреженных 8 x), 9 мкм FCCP в порт B для достижения конечной концентрации 1 Мкм (Примечание: как каждый хорошо будет содержать 175 мкл СМИ плюс 25 мкл раствора вводят от порта, соединение будет получить разреженных 9 x) и 20 мкм ротенон/antimycin A в порту C для достижения конечной концентрации 2 мкм, для каждого соединения (Примечание : как каждый хорошо будет содержать 175 мкл СМИ плюс 50 мкл раствора вводят от портов A и B, соединение будет получить разреженных 10 x).
- Добавьте воду все скважины в порту D и все остальные порты фон скважин (без клетки). Инкубировать патрон в 37 ° C CO2-бесплатные инкубатор для 10 мин.
- Включите анализатор внеклеточного потока и контроллер.
- Откройте анализатор программного обеспечения и ввод следующий протокол:
- Выбор стандартного анализа. Нажмите пробирного мастера. Используя вкладку соединений , назначьте составного макета и используйте вкладку группы и этикетки для обозначения экспериментальных групп. Не забудьте присвоить пустую скважин (без клетки) как фон.
- На вкладке протокол , задайте следующие смеси и мера циклов, с использованием доступных команд, как указано в таблице 1: калибровка, смесь на 2 мин, подождите 2 минуты, а мера 3 мин (повторять этот цикл 2-3 x); придать порт A, смесь на 2 мин, подождите 2 минуты, мера 3 мин (повторять этот цикл 2-3 x); придать порта B, смесь на 2 мин, подождите 2 минуты, мера 3 мин (повторять этот цикл 2-3 x); придать порта C, смесь для 2 мин, подождите 2 минуты, мера 3 мин (повторять этот цикл 2-3 x). Нажмите клавишу End мастера. Это также можно сохранить текущий шаблон для использования в будущем.
- Нажмите кнопку начать , чтобы начать калибровку. Затем анализатор автоматически извлекает пластина держателя и просят пластину картридж вставляется.
- Когда калибровка шаг делается (обычно в 20-25 мин.), нажмите проворную команду изменить картридж пластины на пластину клеток и продолжить запуск.
- По завершении выполнения передачи данных и удалить пластину 96-луночных. Добавить "Хёхст" (1:1, 000) для каждого пробирного скважин и инкубировать их на 5 минут при 37 ° C. Нормализовать данные распознавания клеток путем измерения флуоресценции Hoechst, чтение на 355 Нм возбуждения и 460 Нм выбросов.
Результаты
Перфузия почек и пищеварение дают весьма жизнеспособной трубчатых эпителиальных клеток:
Почечной трубчатых эпителиальные клетки мыши были выделены следующие шаги, описанные в разделах 1-3 протокола, описанных выше.
После пищеварения гетерогенных населения почечных клеток, неполностью переваренной трубочки и другие ткани мусора, что меньше, чем 70 мкм были позолоченными на культуры блюдо на день изоляции. Изменяется от день 0 на 1 день после того, как обычно, ожидается, что изоляции будут рассматриваться только в приложении ячейки, а не в рост клеток. Глядя через плавающий разнородные населения, только несколько трубчатых клетки были прикреплены в день 1 (рис. 1A). Повторного сбора клеток в день 1, центрифугирования, и повторное покрытие помогли удалить мусор, света и урегулировать небольшой трубочку пьес для выпуска трубчатых ячейки. От 1 дня до 3 день изменения должны были не только в лучшее вложение клеток, но и темпов роста удивительно Улучшенная ячейка, которая наблюдалась с плотностью клеток в три раза по сравнению с 1-й день (рис. 1A). В стадии первоначального роста клетки формируется несколько колоний и заполняется вокруг колоний. С этого момента вперед изолированные клетки были полностью восстановлены и отображается здорового распространения. День 5 клетки были в 80-90% confluency в чашке Петри 60-мм с некоторыми пробелами между в ячейке и колонии в колонии (рис. 1A).
Суб-культуры и характеристика изолированных трубчатых клеток:
Изолированные почечной трубчатых эпителиальные клетки были югу культивированный характеристика следующие шаги, описанные в разделе 4 протокола, описанных выше.
День 5 клетки полностью оправился от изоляции и начал активно размножаться. Через одну неделю после изоляции, клетки выросла до confluency в чашке Петри 60-мм. После 1 недели в культуре в проход 0 клетки были готовы быть югу культивировали проход 1 и, впоследствии, на 2 больше ходов. Аналогичные тенденции роста наблюдались в прохода 1 и прохода 2. Обычно это занимает меньше чем через неделю для ячеек на проход 1 и 2 вырастет до confluency для дальнейшего суб-культур (рис. 1B). Непрерывное культуры клеток вырожденная от прохода 0 до прохода 2 показал большой купол формирования23,24 (Рисунок 1B), предполагая, что изолированных клеток сохранить здоровое состояние где они экскретируется аналогичных жидкостей статус в естественных условиях . Это вызвало монослое клеток поднимите пластину, но оставаться на связи через плотные соединения.
Для характеристики клеток в культуре, мы провели, immunofluorescent окрашивание в культивируемых клеток от прохода 1 проходная 4, а также управления клеток линии человека проксимальных почечных HK-2 клетки эпителия. Проксимальной трубной маркеры, Аквапорин 1 (AQP1)25 и таким (AGT)9, E-Кадгерины дистальной трубчатых маркер25, эпителиальные маркер гладких мышц актина (SMA)26,27,28, макрофагов маркеры F4/8029 и30CD68 и Мезангиальный маркер тимоцитов дифференциация антиген 1 (Thy1/CD90)9 были использованы для исследования характеристик. Оба проксимальном трубчатые белки AQP1 и АГТ последовательно высоки были выражены в изолированных трубчатых клеток от прохода 1 проезд 4, а также как положительный контроль HK-2 Проксимальная эпителиальных клеток (рис. 2A). Дистальная трубчатые белки E-Кадгерины была выражена в изолированных трубчатых клеток через проход 4 и наблюдалось также в HK-2 клеток (рис. 2A). SMA была выражена совершенно в изолированных трубчатых клетки и клетки управления HK-2, в соответствии с опубликованными отчетами26,27. С другой стороны, отсутствовали Мезангиальный белка Thy1 и макрофагов белка F4/80 в изолированных трубчатых клетки и клетки управления HK-2 (рисунок 2A). CD68 показан минимальный выражение в HK-2 клетки и в изолированных трубчатых клеток в проход 1 и проход 2, а затем его выражение стало обнаружить от 3 прохождение проход 4 (рис. 2A). Результаты показывают, что изолированные клетки после этого протокола являются смесью проксимальном и дистальном трубчатых клеток. Для сравнения выражения этих маркер белков в естественных условиях, мы провели, пятнать в замороженных почечной ткани. Трубчатые маркеры, включая AQP1, AGT и E-Кадгерины и Мезангиальный белка Thy1 были найдены сильно выражена в почках, добываемых из здоровой мыши одичал типа (рис. 2B). Низкая выражения F4/80 и CD68 были наблюдается в почках одичал типа, но широко выражено в почках, добываемых из Col4a3- / - мышь, которая разработала почечной недостаточности с макрофагов проникновения20,31 ( Рисунок 2 c).
Assay митохондриальной биоэнергетики на изолированных клеток первичного трубчатые:
Митохондриальное дыхание пробирного шаги изложены в разделе 5 протокола, описанных выше.
Митохондриальное дыхание изолированных трубчатых первичных клеток измеряется внеклеточного потока анализ скорости потребления кислорода (OCR) на покрытие различных плотностей. К Титруйте плотности покрытия, 20000, 30000 и 40000 первичной тик на хорошо были посеяны на 96-луночных микропланшетов XF96 за день до (примерно 20 h перед) пробирного внеклеточного потока (рис. 3A). После анализа внеклеточного потока OCR измерения были затем нормализуется до клеток путем количественной оценки Hoechst окрашивания. Покрытие Тик на 20000, 30000, или 40 000 клеток/также привело к средний базальной OCR 25, 45 или 50 пмоль/мин, соответственно (рис. 3A). Кроме того микроскопических изображений покрытием клеток показало, что 40 000 клеток/также охватывает всю поверхность нижней части Гонав скважин, лучше, чем другие плотности покрытия (рисунок 3B). Даже несмотря на то, что максимальная OCR не увеличивается с использованием 40 000 ячеек по сравнению с плотностью 30 000 клеток, мы рекомендуем плотность клеток около 40000 клеток/хорошо для оптимального взаимодействия между клетками и соединений.
Кроме того в наших экспериментах, оптимальная концентрация соединений тормозной/uncoupler было показано 1 мкм oligomycin, 1 мкм FCCP и 2 мкм ротенон/antimycin-A (протоколов assay внеклеточного потока и порт инъекции, перечислены в таблицы 1 ; оптимизации эксперименты не отображаются). Однако рекомендуется для всех пользователей выполнять предварительный тест с различных концентраций этих соединений, идеально ниже и выше, чем опубликованного значения, чтобы гарантировать самые лучшие результаты.
Внеклеточные потока assay дает ряд важных параметров для оценки биоэнергетике тик почек. К примеру как окисление жирных кислот показана специально дефектными в тик, использование средств массовой информации, содержащие жирные кислоты субстрата (пальмитата) наряду с ингибитора гликолиза (2 ГД) может служить полезным инструментом для непосредственно оценить окисление жирных кислот в тик в ходы 1 и 2 (рис. 3 c). В случае почечной фиброз общий потенциал дыхание клеток, как ожидается, будет меньше, чем здоровые почки, даже несмотря на то, что СМИ на основе глюкоза не может выявить каких-либо различий.
Вместе взятые, пробирного внеклеточного потока, особенно в том, чтобы оценить потенциал окисления жирных кислот, могут быть использованы как информативные меры для оценки энергичный состояние почечной тик в которых патологических изменений, затрагивающих играть профиль биоэнергетики важную роль в почечной фиброз и прогрессии к почечной недостаточности.
| Шаги | Время (мин) |
| Калибровка | |
| Сбалансировать: | 00:12:00 |
| Измерение 1 | 3 петли |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Придать порт (1 мкм Oligomycin) | 2 петли |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Придать порта B (1 мкм FCCP) | 2 петли |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Придать порта C (2 мкм Rotenon/Antimycin) | 2 петли |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
| Микс | 00:02:00 |
| Подождите | 00:02:00 |
| Мера | 00:03:00 |
Таблица 1. Стандартизированные внеклеточного потока анализа работает протокол для оптимального распознавания измерений в первичной трубчатых клеток.
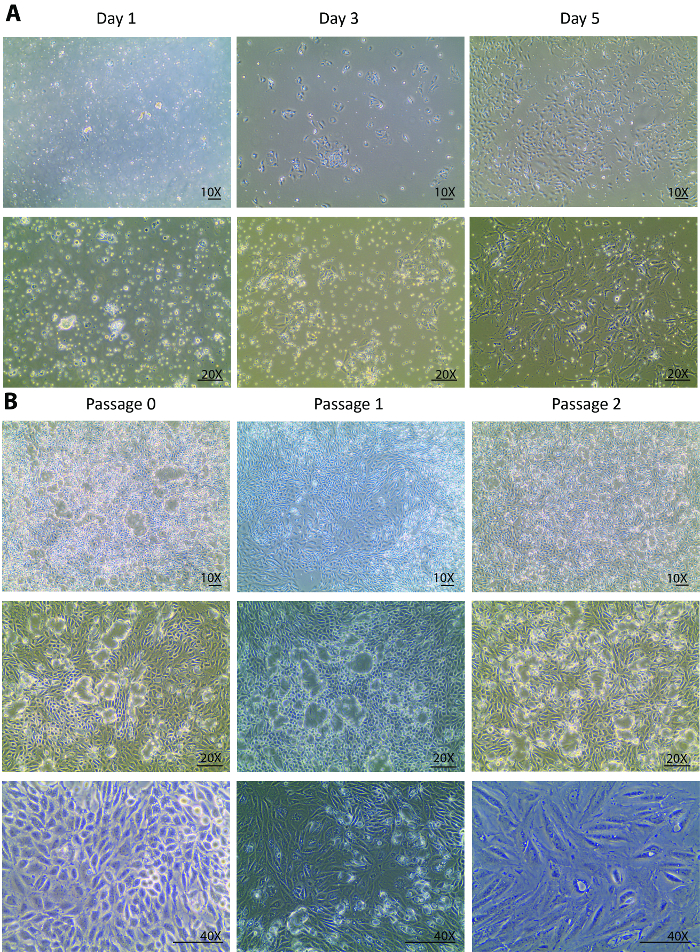
Рисунок 1. Клеточные культуры изолированных клеток первичного трубчатых. (A) изолированные первичной трубчатых клетки придают рано в день 1 и расти решительно от 3 день к день 5. Изображения взяты под 10 X и 20 X целей. (B) Эта группа показывает суб-культуры изолированных первичной трубчатых клеток от прохода 0 проезд 3. Изображения взяты под 10 X и 20 X целей видения купола клетки и под 40 X цель для видения морфологических изменений через проходы. Scalebar = 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
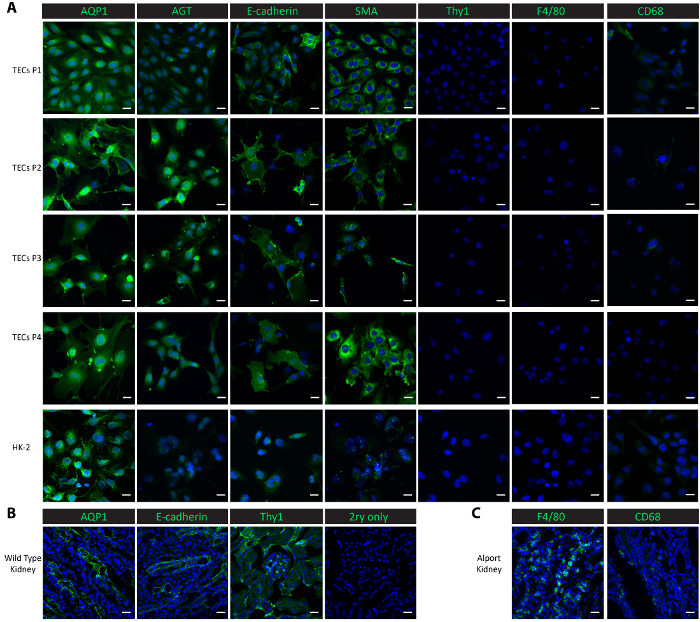
Рисунок 2. Характеристика изолированных клеток первичного трубчатых. (A) иммуноокрашивания с антителами против проксимальной трубчатые белки (AQP1, AGT), дистальных трубчатые белки (E-Кадгерины), эпителиальные белка (SMA), Мезангиальный белка (Thy1) и макрофагов протеинов (F4/80, CD68) показывают, что изолированные начальных трубчатые клетки и последующим суб-культур являются чисто проксимальном и дистальном трубчатых клетки. (B) этой группы показывает, пятнать проксимальных канальцах, дистальных канальцах и Мезангиальный белков в тканях почек от здоровой мыши одичал тип как позитивные элементы управления и без первичный отрицательные. (C) Эта группа показывает, окрашивание макрофагов белков F4/80 и CD68 в почечной ткани, собранных из Col4a3- / - мышь как позитивный элемент управления. Scalebar = 20 мкм. DAPI показаны синим цветом. Белки маркер показаны зеленым цветом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
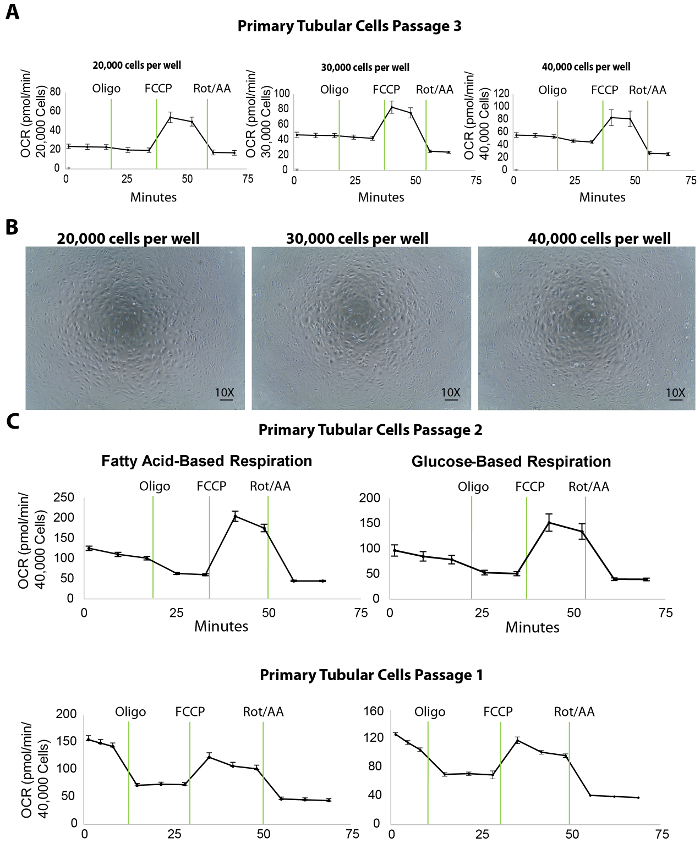
Рисунок 3. Пробирного внеклеточного потока в изолированных клеток первичного трубчатых на покрытие различных плотностей. (A) повышение клеточной покрытие плотность повышает уровень базальной дыхания в первичной трубчатых клеток, испытания на прохождение 3. (B) Эта группа показывает микроскопических изображений первичных клеток трубчатых культивированный на XF96 Гонав посеян на 20000, 30000 и 40000 плотности клеток/хорошо. Scalebar = 100 µm. (C) Эта группа показывает на основе жирных кислот и глюкозы пробирного внеклеточного потока в первичной трубчатых клеток в 2 и 1. Данные является среднее ± SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Мы оптимизированный протокол, который позволяет для эффективной изоляции почечной трубчатых эпителиальных клеток мыши (СППП) и показали, что клетки могут югу культивированный внеклеточного потока анализа для оценки митохондриальное дыхание при наличии жирных кислот- и/или на основе глюкозы субстратов. Этот протокол предназначен для исследования, посвященные проксимальном и дистальном трубчатых клетки и служит основой для построения более сложных экспериментов для понимания TEC-ассоциированной патологии почек. По сравнению с ранее опубликованные протоколы9,10,19, этот метод не требует градиента цветоделение с длительное время центрифугирования или использование достаточно антител для сортировки и, таким образом, предлагает более эффективный и оптимизированный руководство для исследователей, работающих в области почек трубчатых метаболизма. Существует несколько важных шагов в этом протоколе, включая пищеварение, повторного сбора и плотность покрытия и составные оптимизации для assay внеклеточного потока.
Выбор правильного типа коллагеназы и оптимальной концентрации является ключом к успешной переваривание и диссоциации трубчатых клеток от почечной ткани. По сравнению с другими типами коллагеназы, 2 типа коллагеназы содержит сравнительно более высокие уровни активности протеаз, способный отделения компактный почечной структур. Чтобы свести к минимуму вероятность загрязнения в результате длительной перфузии и время пищеварения, 0,013% 2 типа коллагеназы был увлажненную в 30 мл/мин. Капсула почек был удален только после того, как обе почки были заготавливаемым от животного и переведены в стерилизованные клетки культуры капот. Почки были фарша на мелкие кусочки и продолжил их инкубации с 10 мл пищеварение буфера для еще 5 минут для полного переваривания и максимальный выпуск трубчатых клеток.
Хотя после переваривания, ткань подвеска передается через 70 мкм фильтр для удаления куски ткани очень большой, по-прежнему будет непереваренных трубочки, которые проходят через фильтр и оставаться в пределах суспензию клеток и получить покрытие на культуры блюдо. Она занимает больше времени, чем обычно для эти трубочки выпуск трубчатых клетки и прочно прикрепить к культуре блюдо. Таким образом это довольно важно для сбора суспензии клеток и центрифуги его Пелле неприсоединенной трубочки и клетки на второй день после ячейки покрытия. Этот шаг низкая скорость центрифугирования далее удаляет другие типы клеток, которые легче, чем трубчатые клетки и позволяет неприсоединенной трубочки и трубчатых клетки урегулировать.
Определение плотности надлежащего клеток является первый и ключевой шаг для успешной внеклеточного потока assay. Результаты показали, что 40 000 ячеек на колодец на XF96 Гонав является идеальным для первичного трубчатых клетки в жирные кислоты и анализа на основе глюкозы дыхания (рис. 3 c). В этом протоколе изолированных трубчатых клетки были использованы для assay внеклеточного потока на 1 и 2. Клетки, югу культивировали для прохода 3, хотя они поддерживали выражение трубчатых маркеров (рис. 2) и достойной производительности в биоэнергетике анализов (Рисунок 3А) и показал снижение базальной дыхания уровней по сравнению с прохода 2 (показано сравнение OCR в правой панели Рисунок 3А на рис. 3 c). Это снижение не может повлиять на существенно здоровые трубчатых клетки (например, те, изолированные от молодых мышей дикого типа). Однако для исследования на клетки изолированы от CKD мыши модели, которые уже есть уменьшилась митохондриальное дыхание, выше отрывков клеток может вызвать дальнейшее снижение базальной дыхания, что бы повлиять на результаты анализа внеклеточного потока. В исследованиях провели здесь, клетки от прохода 1 и проход 2 показал высокий базальный дыхания уровнях. Таким образом после этого протокола, мы рекомендуем, использовать эти два ранних пассажей митохондриальное дыхание исследований с клетками, изолированных от здоровых и больных животных. Следует по-прежнему учитываться клетки от прохода 2, если проход 1 суб-культуры не дают достаточных клетки для анализа потока. Помимо исследования биоэнергетики наши предыдущие исследования показывает, что основной тик на проход 3 может быть чрезвычайно полезным для лечения с соединениями, следуют белка и РНК исследований (данные не показаны). Это, как говорится, мы предлагаем, что следователи, используя этот протокол, чтобы изолировать трубчатых клетки следует тщательно выбирать оптимальное прохождение для приложений различных научно-исследовательских.
Принцип работы внеклеточного потока анализа основана на взаимодействие между вводят соединений и цепных комплексов дыхания и эффект uncoupler. Oligomycin является ингибитором сложных V (АТФ-синтазы) и используется для различения потребления АТП связаны кислорода и потребление кислорода, который необходим для преодоления регулярные Протон утечки через внутреннюю мембрану митохондрий32. FCCP разъединяет потребление кислорода от производства АТФ, нарушая потенциал митохондриальной мембраны. Таким образом она обеспечивает измерение емкости максимальное дыхания, как он обходит ограниченные возможности измеряем Ион Протон, АТФ-синтазы, позволяя транспорт протонов через мембрану. Antimycin-A, ингибитор комплекс III и ротенон, комплекс я блокатор, используются в сочетании, чтобы выключить весь митохондриальной дыхания, позволяя дифференциация между митохондриальной против потребления не митохондриальной кислорода в клетки. Эти соединения всегда быть титруемая для конкретной ячейки типа перед пробирного внеклеточного потока для определения оптимальной концентрации, которые дают оптимального распознавания кривых. Здесь мы рекомендуем 1 мкм, oligomycin, 1 мкм FCCP и 2 мкм ротенон/antimycin A для assay внеклеточного потока на первичной тик.
В заключение этот протокол обеспечивает простой и экономически эффективный способ изолировать почечной первичной проксимальном и дистальном трубчатых эпителиальные клетки, которые могут быть использованы для оценки митохондриальной Биоэнергетика ex vivo. Хотя этот протокол может быть полезным в широком диапазоне молекулярной биологии исследований, изучения биологической функции почек трубчатых эпителиальных клеток, мы признаем ее ограничения при применении его к исследования, требующие чистых проксимальных и дистальных канальцев. Например, исследования по синдрома Lowe, селективный проксимальной трубчатых дисфункции33или исследования на дистальном почечный ацидоз трубчатые, дистальных трубчатых дисфункции34, потребует более сложный протокол для изоляции клеток и очистки. Однако для большинства исследований, которые сравнивают трубочки против клубочков и для исследования на экран потенциальных митохондриальное дыхание регуляторы в трубчатых клетки в целом, протокол обеспечивает подход возможно высокой пропускной способности. Таким образом этот протокол может иметь широкое применение для изучения митохондриальной дисфункции, связанные с лечения болезней почек для целей проверки обнаружения или целевой наркотиков.
Раскрытие информации
Авторы не имеют ничего объявить.
Благодарности
Эта работа была поддержана следующие гранты для Lina A. Шехаде: Национальный институт здравоохранения (R56HL132209 и 1R01HL140468) и Майами сердца исследовательского института.
Материалы
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
Ссылки
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750(2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997(2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40(2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908(2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231(2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618(2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены