Method Article
Isolierung, Charakterisierung und hohem Durchsatz extrazelluläre Flux-Analyse der Maus primäre renale tubuläre Epithelzellen
In diesem Artikel
Zusammenfassung
Dieses Protokoll bietet eine kostengünstige Möglichkeit zu isolieren und zu charakterisieren Maus primäre renale tubuläre Zellen, die anschließend südlich kultiviert werden können, um renale biologischen Funktionen ex Vivo, einschließlich der mitochondrialen Bioenergetik zu beurteilen.
Zusammenfassung
Mitochondriale Dysfunktion in die renale tubulären Epithelzellen (TECs) führt zu Nierenversagen Fibrose, eine der Hauptursachen für chronische Niereninsuffizienz (CNI). Daher kann die Beurteilung der Funktion der Mitochondrien im primären TECs wertvolle Einblicke in den bioenergetischen Status der Zellen, die Einblicke in die Pathophysiologie der CKD vorsehen. Während für die Isolierung und Reinigung der proximalen Tubuli in verschiedenen Arten gibt es eine Reihe von komplexen Protokollen, fehlt das Feld eine kosteneffektive Methode für röhrenförmige Zellen isoliert ohne die Notwendigkeit der Reinigung optimiert. Hier bieten wir eine Isolation-Protokoll, die Studium mit Schwerpunkt auf beiden primären proximalen und distalen renal TECs Maus ermöglicht. Neben kostengünstigen Reagenzien und minimale Tier Verfahren, die in diesem Protokoll erforderlich können die isolierten Zellen halten hohen Energieniveaus nach Isolierung und Sub kultiviert bis zu vier Durchgängen, kontinuierliche Studien ermöglichen. Darüber hinaus bewerten mit einem hohen Durchsatz extrazelluläre Flussmittel Analyzer, wir die mitochondriale Atmung direkt in den isolierten TECs in eine 96-Well-Platte, für die wir Empfehlungen für die Optimierung der Zelldichte und compoundkonzentration versehen. Diese Beobachtungen legen nahe, dass dieses Protokoll für renale tubuläre Ex Vivo -Studien mit einer konsistenten, gut standardisierte Produktion von renal TECs verwendet werden kann. Dieses Protokoll möglicherweise breitere zukünftige Anwendungen, mitochondriale Dysfunktion mit Nierenerkrankungen für Arzneimittelforschung oder Medikament Charakterisierung Zwecke zu studieren.
Einleitung
Renale tubuläre Epithelzelle (TEC) Funktion ist stark verbunden mit den allgemeinen Gesundheitszustand der Niere. Pathologische Signalgebung in der Niere bewirkt, dass die Entdifferenzierung von TECs, die spielt eine wichtige Rolle in der Niere Fibrose und chronische Niere-Krankheit (CKD)1,2. Als eine hochenergetische Organ ist die Niere nur noch von Herzen in Sauerstoffverbrauch, in erster Linie durch Mitochondrien Oxidative Phosphorylierung3. Elektronenmikroskopie-Studien haben eine positive Korrelation von mitochondrialen morphologische Veränderungen auf pathologische Ereignisse in den Nierentubuli4gezeigt. Mitochondriale Dysfunktion bei TECs verursacht renal Fibrose durch epitheliale, Mesenchymale Transition5 und defekte Fettsäure-Oxidation6. Fibrose ist eine progressive Niereninsuffizienz Pathologie, die der CKD führt. Daher ist das Verständnis des energetischen Status der renalen TECs eine Notwendigkeit, die Pathophysiologie der CKD aufzudecken.
> 20 Zelltypen gibt es in den Erwachsenen Niere7. Um die Funktion der TECs zu studieren, braucht man eine Primärkultur der renalen epithelialen Zellen als Plattform für Molekularbiologie Anwendungen wie chemische Behandlungen und genetische Manipulationen. Wichtig ist, können genetische Manipulationen erfolgen in Vivo in Mäusen über Transgenese oder mit AAV gen Lieferung Techniken8 , so dass die isolierte primäre Zellen bereits genetisch manipuliert werden würde. Die Isolation der primären renal röhrenförmigen Zellen von Mäusen9,10, Ratten11,12,13, Eckzähne14, Kaninchen15,16und17 Menschen ,18 wurde berichtet mit Reinigungsschritte, reine proximale röhrenförmige Zellen ergeben. In diesen zuvor veröffentlichten Protokollen, die sich auf die Isolierung der proximalen röhrenförmigen Zellen, wurden für Reinigung Zwecke19Steigung Zentrifugierung und Sortierung Experimente durchgeführt. Während diese Protokolle für das Studium der proximalen Tubuli wertvoll sind, sind sie nicht ausreichend, wenn proximalen und distalen Tubuli erforderlich sind, untersucht werden. Zum Beispiel hat unsere Studie über das Alport-Syndrom ergeben, dass proximalen und distalen Nierentubuli spielen eine wichtige Rolle in der Krankheit Fortschreiten20, und beide Arten von den Nierentubuli in Kultur untersucht werden sollten. Eine aktuelle Studie über die renale Fluorid Toxizität zeigte auch, dass krankhafte Veränderungen in beiden der proximalen und distalen Tubuli21stattfand. Daher ist diese Isolierung Protokoll entworfen und optimiert für proximalen und distalen röhrenförmigen Zellen aus Maus Nieren mit minimalen Kosten von Reagenzien und einfache Verfahren. Alternativ können die Ermittler noch folgen das Protokoll erst Schritt 3.1 und Reinigung Schritte9 ab diesem Zeitpunkt für die Isolation der reinen proximalen röhrenförmigen Zellen hinzufügen.
Die isolierten Zellen hohe energetische Ebenen zu präsentieren und pflegen renalen epitheliale Eigenschaften nach der Sub-Kulturen auf 4 stellen. Mit einem hohen Durchsatz extrazelluläre Flussmittel Analyzer, bewerten wir die mitochondriale Atmung direkt in den isolierten TECs in einer 96-Well-Platte, die weitere Einblicke in die Zelle Dichte Optimierung führt. Diese Beobachtungen legen nahe, dass dieses Protokoll auf renale tubuläre Ex Vivo -Studien mit einer konsistenten, gut standardisierte Produktion von renal TECs angewendet werden kann. Eine weitere Bedeutung dieses Protokolls ist seine machbar Verwendung als ein hoher Durchsatz-Tool für die ex-Vivo Charakterisierung der mitochondrialen Bioenergetik im proximalen und distalen röhrenförmigen Nierenzellen. Daher kann es als Plattform für Arzneimittelforschung oder Medikament Charakterisierung von Nierenerkrankungen dienen.
Protokoll
Alle Experimente mit Tieren stimmten die institutionellen Animal Care und Use Committee an der University of Miami, NIH-Richtlinien entsprechen.
1. Platte Beschichtung und Vorbereitung der Reagenzien
- Bereiten Sie Kollagen-Beschichtung:
- Fügen Sie 35 μL von Kollagen I bis 2 mL einer vorgefilterten 20 mM-Essigsäure-Lösung auf einer einzigen 60-mm-Petrischale. Bei 1 h bei Raumtemperatur inkubieren, es an der Luft trocknen und UV-Strahlung aussetzen.
- Waschen Sie die Beschichtung 3 X mit PBS sauren Rückstände entfernen und speichern es in einem 37 ° C CO2-freie Zelle Kultur Inkubator bis die Zellen für die Aussaat bereit sind. Die Endkonzentration der Kollagen-Beschichtung ist 5 μg/cm2.
- Vorbereiten der Perfusion Puffer: 30 mL PBS 300 μL von Penicillin-Streptomycin (P/S) hinzu und erwärmen die Mischung in einem 37 ° C Wasserbad bis die Isolation beginnt.
- Vorbereitung der Verdauung Puffer: 3,9 mg Kollagenase Typ 2 in 30 mL PBS zu lösen, die Lösung durch einen 0,2 μm Flaschenverschluss Filter Filtern und es in einem Wasserbad bei 37 ° C erwärmen, bis die Isolation beginnt.
- Zellkulturmedien vorbereiten:
- Die Ergänzungen auf Raumtemperatur zu bringen. Ohne Filtration fügen Sie den Zuschlag (0,05 mL fetalen Kälberserum, 10 ng/mL des epidermal Growth Factor, 5 μg/mL Insulin, Adrenalin, 36 ng/mL Hydrocortison, 5 μg/mL von Transferrin und 4 Pg/mL Triiodo-L-Thyronine 0,5 μg/mL hinzu) bis 500 mL der renalen Epithelzelle basale Wachstumsmedium 2.
- Wärmen Sie die Medien in einem 37 ° C Wasserbad bis es einsatzbereit ist.
- Bereiten Sie Verbindungen: bereiten Sie 50 mM FCCP, Rotenon 10 mM, 10 mM Oligomycin 10 mM Antimycin A, 50 mM L-Carnitin und 50 mM Etomoxir Lager Lösungen in DMSO, aliquoten sie und speichern Sie die Verbindungen bei-20 ° C.
- 2,5 mM Natrium-Palmitat in 220 mL einer 150 mM NaCl Lösung vorbereiten und Aufwärmen der Lösung im Wasserbad 75 ° C bis die Palmitat vollständig aufgelöst ist.
- Bereiten Sie Rinderserumalbumin (BSA): 0,34 mM fettfreie BSA in 250 mL 150 mM NaCl vorzubereiten. Das BSA-Steuerelement dient als Negativkontrolle für die Palm-BSA-Lösung, die durch folgende Schritt 1,8 vorbereitet werden kann.
- Konjugat-Palmitat, BSA (Palm-BSA):
- Ergänzen Sie die Projektmappe Palmitat allmählich in die BSA-Lösung, solange es noch heiß ist. Dann stellen Sie den pH-Wert auf 7,4 und mischen sie bei 37 ° C für mindestens 1 h um die Konjugation zu vervollständigen.
- Nach Abschluss der Konjugation fügen Sie eine weitere 150 mL 150 mm NaCl der Projektmappe hinzu, mischen Sie gut und speichern Sie die Aliquote bei-20 ° C. Die endgültige Lösung enthält 1 mM Natrium-Palmitat und 0,17 mM BSA und wird als Fettsäure-Substrat für Zellen in einem Fettsäure-basierte extrazelluläre Flux-Assay verwendet werden.
- Bereiten Sie extrazelluläre Flussmittel Assay basale Medien:
- 1 L autoklaviert dH2O 1 Beutel DMEM Pulver und 20 mL 200 mM L-Glutamin (4 mM final) hinzufügen und vorsichtig mischen.
- Am Tag des Experiments Bioenergetik fügen Sie 100 µM Natrium Pyruvat zu den vorbereiteten basalen Medien für nachfolgende Vorbereitungen der extrazellulären Flussmittel Assay Medien in einem Glukose- oder Fettsäure - basierte Atmung Assay verwendet werden hinzu.
- Glukose-basierte Medien vorbereiten:
- Zur Messung der Kapazität der Zellatmung durch Glykolyse fügen Sie 17,5 mM Glukose Pulver, 100 µM Kontrolle BSA (wie beschrieben im Schritt 1,7) und 20 µM Etomoxir (um die Fettsäureoxidation hemmen hinzu), die basalen Medien beschriebenen Schritt 1,9.
- Die Medien bei 37 ° C erwärmen, den pH auf 7,4 einstellen und halten Sie es in das 37 ° C-Wasserbad, bis es in eine extrazelluläre Flux-Assay verwendet wird.
- Fettsäure-basierte Medien vorbereiten:
- Zur Messung der Kapazität der Zellatmung durch Fettsäureoxidation fügen Sie 10 mM 2D-Glukose-Pulver (Glukose analoge Glykolyse zu hemmen), 100 µM Palm-BSA (wie in beschrieben Schritt 1,8) und 100 µM L-Carnitin zu den basalen Medien beschriebenen Schritt 1,9.
- Die Medien bei 37 ° C erwärmen, den pH-Wert 7,4 einstellen und halten Sie es in das 37 ° C-Wasserbad, bis es in die extrazelluläre Flux-Assay verwendet wird.
(2) Durchblutung, Verdauung und Ernte Nieren von Mäusen
- Die Maus mit einer Isofluran Strömung zu betäuben und in Rückenlage zu beheben. Sicherstellen Sie, dass die Isolation beginnt erst, nachdem das Tier seine aufrichtendes Reflexe verliert und die Narkose Tiefe von Prise Bewertungen mit atraumatische Pinzette vor und während der Prozedur22überwacht wird.
- Fell, mit einer Enthaarungscreme von der Maus Brust zu ihren Bauchbereich zu entfernen, mit Jod desinfizieren und wischen Sie die Jod-Rückstände.
- Machen Sie einen Einschnitt in der Brust, schneiden Sie die Haut um den gesamten Bauchbereich zu öffnen und setzen Sie das Herz und die Nieren.
- Richten Sie eine Perfusion Pumpe mit 32 mL/min und entfernen Sie Luftblasen in den Schlauch vor dem Start der Perfusion.
- Nadel 27-G in den linken Ventrikel durch das Herz Apex, sobald der Puffer das Herz füllt, und stecken Sie den rechten Vorhof um einen Ausgang zu erstellen, damit die Perfusion Puffer als das Herz pumpt zirkuliert und wird schließlich von der rechten Vorhof Ausfahrt entfernt.
- Nach der Perfusion wechseln Sie die Pumpendrehzahl bis 30 mL/min für die Verdauung.
- Nach 20 mL der Verdauung Puffer durch die Apex durchblutet ist, entfernen Sie beide Nieren für die röhrenförmigen Zelle Isolierung.
(3) Gewebe Verarbeitung und primäre röhrenförmigen Zellen isoliert
- Entfernen Sie die Nieren Kapseln und Medulla, beide Nieren in kleine Stücke hacken und sie in 10 mL Verdauung Puffer in einem 37 ° C Ofen mit sanften Drehung für 5 min inkubieren.
- Entfernen Sie unverdauten Nieren-Gewebe durch die Übergabe des Puffers durch einen 70-μm-Filter. Fügen Sie 10 mL von Nährmedien, die Verdauung zu stoppen.
- Zum Sammeln von röhrenförmiger Zellen Zentrifugieren der gefilterten Zellsuspension bei 50 X g für 5 min, die erste Tablette zu sammeln. Übertragen Sie den überstand zu, zu einem neuen Schlauch und 5 mL Nährmedien, Zentrifuge, die es bei 50 X g für 5 min um alle röhrenförmigen Zellen zu gewährleisten sind in die zweite Tablette gesammelt.
Die Zentrifugation ist mit einer geringeren Geschwindigkeit, vor allem schwere Tubuli pellet. Später, nachdem die Zellen aus der Isolation zu erholen, wird röhrenförmige in Reinkultur mit einer höheren Geschwindigkeit während der Subkulturen zentrifugiert. - Aufschwemmen der erste Pellet in 20 mL Nährmedien und Zentrifugieren sie 50 X g für 5 min, die dritte Tablette zu sammeln.
- Die zweite und dritte Pellets in 1 mL der Nährmedien aufzuwirbeln. Mischung 10 µL Zellsuspension mit 10 µL Trypan blau, laden Sie die Mischung in Kammer A eine Zählung Folie und die Zellviabilität aus dem automatischen cell counter (siehe Tabelle der Materialien).
- Samen bis zu 107 Zellen (einer heterogenen Bevölkerung) auf ein einziges Gericht 60 mm vorbeschichtet mit Kollagen und lassen Sie die röhrenförmigen Zellen über Nacht legen.
4. primäre röhrenförmigen Zellen Subkultur und Charakterisierung
- Am 1. Tag nach der Isolierung sammeln Sie, Kultur, Medien und bei 50 X g für 5 min zu einer schwimmenden Tubuli Pellets Zentrifugieren. Entfernen des Überstands und Aufschwemmen der Zelle Pellet in 4 mL frische Kultur, Medien und es zurück zu der gleichen Kulturschale Platte.
- Am 4. Tag nach der Isolierung entfernen Sie die alte Kultur Medien und fügen Sie neue Medien hinzu.
- Am 7. Tag nach der Isolierung lösen Sie die Zellen, indem sie Inkubation bei 37 ° C in 2 mL Trypsin-EDTA 0,25 % für 5 min. Add 3 mL Kulturmedien, die Reaktion zu stoppen und die Zellen durch Zentrifugation bei 250 X g für 5 min zu sammeln.
- Sub-Kultur und charakterisieren die Zellen von P0, P1, beschichtet 5.000 Samenzellen pro Bohrloch auf einer 24-Well-Platte mit Kollagen ich wie oben beschrieben.
- 24 h nach Schritt 4.4, beheben die Zellen am P1 mit 4 % PFA für 10 min, permeabilize sie mit 0,2 % Triton x-100 für 3 min, und blockieren sie mit 10 % Esel Serum (DS) für 1 h bei Raumtemperatur.
- Verdünnen, bis 1: 100 in 10 % DS, jede der folgenden Proteine: die proximalen röhrenförmigen Marker Angiotensinogen (AGT) und Aquaporin-1 (AQP1); der distale tubuläre Marker E-Cadherin; der mesangialen Marker CD90/Thy1; und der Makrophagen Marker EGF-Like Modul-haltigen Mucin-ähnliches Hormon-Rezeptor-1 (F4/80) und Cluster der Differenzierung 68 (CD68), wie sie mit Zellen über Nacht bei 4 ° c inkubieren
- Am nächsten Tag erkennen jede Färbung mit 1: 200 Anti-Kaninchen, Anti-Maus oder Anti-Ratte fluoreszierende Sekundärantikörper für 45 Minuten. Nehmen Sie Bilder unter konfokalen Mikroskopie, den Ausdruck der Marker, zu bestätigen, wie in Abbildung 2Agezeigt.
- Am 3. Tag nach der Subkultur der P1 lösen Sie die Zellen für eine Subkultur und Charakterisierung bei P2 durch eine Färbung der röhrenförmigen, mesangialen und Makrophagen Marker im Schritt 4.5 beschrieben. Bild die Färbung unter konfokalen Mikroskopie, den Ausdruck der Marker, zu bestätigen, wie in Abbildung 2Agezeigt.
- Am 3. Tag nach der Subkultur von P2 nehmen Sie die Zellen für eine Subkultur und Charakterisierung auf P3 durch eine Färbung der röhrenförmigen, mesangialen und Makrophagen Marker im Schritt 4.5 beschrieben ab. Bild die Färbung unter konfokalen Mikroskopie, den Ausdruck der Marker, zu bestätigen, wie in Abbildung 2Agezeigt.
- Bereiten Sie die Gewebe Färbung:
- Gefrorene Wildtyp und Col4a3- / - Niere-Folien für 1 h bei Raumtemperatur an der Luft trocknen und fixieren Sie diese mit 4 % PFA für 10 min. Permeabilize sie mit 0,2 % Triton x-100 für 10 min und mit 10 % Esel Serum (DS) für 1 h bei Raumtemperatur zu blockieren. Fügen Sie Antikörper gegen die markerproteine im Schritt 4.5 bei 1: 200 beschrieben und inkubieren sie über Nacht bei 4 ° C.
- Erkennen Sie am nächsten Tag jede Färbung mit 1: 200 Anti-Kaninchen, Anti-Maus oder Anti-Ratte fluoreszierende Sekundärantikörper für 45 Minuten. Nehmen Sie Bilder unter einem confocal Mikroskop, den Ausdruck der Marker, zu bestätigen, wie in den Figuren 2 b und 2 Cgezeigt.
(5) Mitochondrien Bioenergetik Assay
- Samen P1 röhrenförmige Zellen bei 20.000, 30.000 oder 40.000 Zellen pro Bohrloch in 100 μL der Nährmedien auf einer 96-Well-Mikrotestplatte vorbeschichtet mit 5 μg/cm2 Kollagen ich am Vortag die extrazelluläre Flux-Assays.
- Für die Hydratation der sensorkassette, heben Sie die Sensor-Patrone und füllen jeweils auch der Platte mit 200 μl einer Kalibrierung-Lösung. Laden Sie sorgfältig die Patrone wieder an die Sensoren in der Kalibrierlösung Tauchen. Setzen Sie die Patrone in einem 37 ° C Ofen ohne CO2 für mindestens 7 h vor Gebrauch.
Für die besten Ergebnisse wird über Nacht Patrone Flüssigkeitszufuhr empfohlen. - Bereiten Sie die Verbindungen: 8 µM Oligomycin, 9 µM FCCP und 20 µM Rotenon/Antimycin A Mischung in Glukose (siehe Schritt 1.10) und Fettsäure (beschrieben in Schritt 1.11) extrazelluläre Flussmittel Assay Medien vorbereiten.
- Wechseln Sie das Medium: Aspirieren der Zellkulturmedien, fügen Sie 175 µL Glukose oder Fettsäure-Assay-Medien (abhängig von der Verbindung, die gearbeitet, siehe Schritt 5.3) und inkubieren sie für 1 h bei 37 ° C CO2-frei Inkubator.
- Laden Sie die Patrone Ports mit 25 µL der folgenden Verbindungen: 8 μM Oligomycin für Port A, eine Endkonzentration von 1 µM zu erreichen (Hinweis: wie jeder gut 175 µL Medien enthält, erhalten die Verbindung verdünnten 8 X), 9 μM FCCP in Port B, eine Endkonzentration von 1 zu erreichen µM (Hinweis: da jeder gut 175 µL Medien plus 25 µL der Lösung injiziert von Port A enthält, erhalten die Verbindung verdünnten 9 X), und 20 µM Rotenon/Antimycin A in Port C, eine Endkonzentration von 2 µM für jede Verbindung (Hinweis zu erreichen : wie jeder gut 175 µL Medien plus 50 µL der Lösung injiziert von Ports A und B enthält, erhalten die Verbindung verdünnten 10 X).
- Alle Brunnen im Port D und alle anderen Ports der Hintergrund Brunnen (keine Zellen) Wasser hinzufügen. Inkubieren Sie die Patrone in einem 37 ° C CO2-frei Inkubator für 10 Minuten.
- Schalten Sie den extrazellulären Flux-Analyzer und dem Controller.
- Öffnen Sie die Analyzer-Software und geben Sie das folgende Protokoll:
- Wählen Sie Standard-Assay. Drücken Sie Test-Assistenten. Verwenden die Registerkarte " Verbindungen ", weisen Sie das zusammengesetzte Layout zu und verwenden Sie die Registerkarte Gruppen und Etiketten , um die experimentellen Gruppen zu kennzeichnen. Denken Sie daran, die leeren Brunnen (ohne Zellen) als Hintergrund zuweisen.
- Legen Sie unter der Registerkarte " Protokoll " folgenden Mischung und Maßnahme Zyklen mit den verfügbaren Befehlen, wie in Tabelle 1angegeben: kalibrieren, Mix für 2 min, 2 min warten und Messen für 3 min (wiederholen Sie diesen Zyklus 2-3 X); Spritzen Anschluss A, Mix für 2 min, 2 min, Maß für 3 min warten (dieses Zyklus 2-3 X wiederholen); Port B Spritzen, mix für 2 min, 2 min, Maß für 3 min warten (dieses Zyklus 2-3 X wiederholen); Port C zu injizieren, mix für 2min, 2 min, Maß für 3 min warten (wiederholen Sie diesen Zyklus 2-3 X). Drücken Sie die Ende-Assistenten. Es ist auch möglich, die aktuelle Vorlage für die spätere Verwendung zu speichern.
- Drücken Sie Start , um die Kalibrierung zu beginnen. Der Analyzer dann automatisch ausgeworfen wird der Kennzeichenhalter und bittet um die Patrone Platte eingefügt werden soll.
- Wenn die Kalibrierung (in der Regel in 20-25 min) fertig ist, drücken Sie die prompten-Befehl die Patrone-Platte auf der Zellplatte ändern und Fortsetzen der Ausführung.
- Nach Abschluss des Laufs die Daten übertragen, und 96-Well-Platte zu entfernen. Jeder der Assay Brunnen Hoechst (1:1 000) hinzu und inkubieren sie 5 min bei 37 ° c Die OCR-Daten zur Anzahl der Zellen durch eine Messung der Hoechst Fluoreszenz Lesung auf eine Anregung von 355 nm und einem Ausstoß von 460 nm zu normalisieren.
Ergebnisse
Niere Durchblutung und Verdauung ergeben sehr tragfähige tubuläre Epithelzellen:
Renale tubuläre Epithelzellen Maus wurden isoliert das Wiederherstellungsprogramm in den Abschnitten 1 bis 3 des genannten Protokolls.
Nach der Verdauung eine heterogene Bevölkerung von Nierenzellen, unvollständig verdaute Tubuli und andere Gewebe Ablagerungen, die kleiner als 70 µm wurden auf der Kulturschale auf Isolierung Tag überzogen. Ändert sich von Tag 0, Tag 1 nach die Isolation sollen in der Regel nur in der Zelle-Anlage nicht in das Zellwachstum gesehen werden. Blick durch die schwimmenden heterogenen Bevölkerung, waren nur wenige röhrenförmige Zellen am Tag 1 (Abbildung 1A) befestigt. Eine erneute Sammlung der Zellen am 1. Tag, eine Zentrifugation und eine erneute Beschichtung dazu beigetragen, leichte Verschmutzungen entfernen und die kleinen Röhrchen Stücke für die röhrenförmigen Zelle Freisetzung zu begleichen. Von Tag 1 bis Tag 3 wurden Änderungen erwartet, nicht nur in eine bessere Befestigung der Zelle, sondern auch in einer bemerkenswert verbesserter Zelle Wachstumsrate, die mit einem verdreifacht Zelldichte im Vergleich zu Tag 1 (Abbildung 1A) beobachtet wurde. In der ersten Wachstumsphase die Zellen mehrere Kolonien gegründet und um die Kolonien bevölkert. Von diesem Punkt vorwärts die isolierten Zellen wurden vollständig erholt und eine gesunde Verbreitung angezeigt. 5. Tag waren die Zellen auf eine 80-90 % Konfluenz in einer 60 mm Petrischale mit einigen Räumen von Zelle zu Zelle und Kolonie, Kolonie (Abbildung 1A).
Subkultur und Charakterisierung der isolierten röhrenförmigen Zellen:
Die isolierte renale tubulären Epithelzellen wurden für eine Charakterisierung nach Sub kultiviert die Schritte in Abschnitt 4 des Protokolls oben beschriebenen erläutert.
Ab Tag 5 die Zellen vollständig erholt aus der Isolation und fing an kräftig vermehren. Eine Woche nach der Isolierung, wuchs die Zellen zur Konfluenz in einer Petrischale 60 mm. Nach 1 Woche in einer Kultur, in der Passage 0 waren die Zellen bereit, Sub-Passage 1 und anschließend für 2 Weitere Passagen kultiviert werden. Ähnlichen Wachstumsmustern wurden in Abschnitt 1 und Abschnitt 2 beobachtet. In der Regel dauert es weniger als eine Woche für Zellen in der Passage 1 und 2 zur Konfluenz für weitere Sub-Kulturen (Abbildung 1 b) wachsen. Die kontinuierliche Kultur konfluierende Zellen aus Abschnitt 0 Durchgang 2 zeigte eine umfangreiche Kuppel Bildung23,24 (Abbildung 1 b), was darauf hindeutet, dass die isolierten Zellen eines gesunden beibehalten Status wo sie Flüssigkeiten ähnlich ausgeschieden eine in-Vivo -Status. Dies verursacht die Monoschicht der Zellen, um die Platte abheben aber durch tight Junctions miteinander verbunden bleiben.
Zur Charakterisierung der Zellen in der Kultur, führten wir immunofluorescent Färbung in kultivierten Zellen aus 1 Durchgang Durchgang 4 sowie in eine Kontrolle Zelle Linie-menschlichen proximaler renal HK-2 Epithelzellen. Proximalen röhrenförmigen Marker, Aquaporin-1 (AQP1)25 und Angiotensinogen (AGT)9, die distale tubuläre Marker E-Cadherin25, der epitheliale Marker Glattmuskel Aktin (SMA)26,27,28 Makrophagen Marker F4/8029 und CD6830und der mesangialen Marker Thymocyte Differenzierung Antigen 1 (Thy1/CD90)9 wurden für die Charakterisierung Studien verwendet. Beide proximalen röhrenförmigen Proteine AQP1 und AGT waren durchweg hoch in den isolierten röhrenförmigen Zellen aus Durchgang 1 Passage 4 ebenso wie in der Positivkontrolle HK-2 proximalen Epithelzellen (Abbildung 2A) zum Ausdruck gebracht. Das distale tubuläre Protein E-Cadherin drückte sich in den isolierten röhrenförmigen Zellen durch Passage 4 und wurde auch in den HK-2-Zellen (Abbildung 2A) beobachtet. SMA wurde reichlich in den isolierten röhrenförmigen Zellen und in der HK-2 Kontrollzellen, Einklang mit veröffentlichten Berichten26,27ausgedrückt. Auf der anderen Seite der mesangialen Thy1 und Makrophagen Protein F4/80 fehlten in den isolierten röhrenförmigen Zellen und der Kontrollzellen HK-2 (Abbildung 2A). CD68 zeigten einen minimalen Ausdruck in den HK-2-Zellen und in den isolierten röhrenförmigen Zellen auf Durchgang 1 Durchgang 2 und dann seinen Ausdruck wurde aus 3 Durchgang Durchgang 4 (Abbildung 2A) nicht nachweisbar. Die Ergebnisse deuten darauf hin, dass die Zellen isoliert nach diesem Protokoll eine Mischung der proximalen und distalen röhrenförmigen Zellen. Um die Ausdrücke der diese Markierung Proteine in Vivozu vergleichen, haben wir die Färbung in gefrorenen Niere Gewebe durchgeführt. Röhrenförmige Markierungen, einschließlich AQP1, AGT, und E-Cadherin und mesangialen Protein Thy1 fanden sich hoch in Nieren, geerntet von Wildtyp gesunde Maus (Abb. 2 b) ausgedrückt. Niedrigen Ausdrücke von F4/80 und CD68 waren in Wildtyp Nieren beobachtet aber ausführlich ausgedrückt in Nieren, geerntet von Col4a3- / - Maus, die Niereninsuffizienz mit einem Makrophagen Infiltration20,31 ( entwickelt Abbildung 2).
Mitochondriale Bioenergetik Assay auf isolierte primäre röhrenförmigen Zellen:
Die mitochondriale Atmung Assay Schritte sind in Abschnitt 5 des genannten Protokolls aufgeführt.
Die mitochondriale Atmung der isolierte primäre röhrenförmigen Zellen wird durch eine extrazelluläre Flussmittel Analyse der Sauerstoff-Verbrauch (OCR) bei verschiedenen Beschichtung dichten gemessen. Um die Dichte Beschichtung titrieren, 20.000, 30.000 und 40.000 primäre TECs pro Bohrloch wurden ausgesät auf einer 96-Well XF96 Mikrotestplatte am Vortag (ca. 20 h vor) der extrazellulären Flux-Assay (Abb. 3A). Nach der extrazellulären Flux-Analyse wurden die OCR-Messungen dann auf die Zellzahlen durch eine Quantifizierung der Hoechst Färbung normalisiert. Beschichtung der TECs bei 20.000, 30.000 oder 40.000 Zellen/gut führte zu einer durchschnittlichen basale OCR 25, 45 oder 50 Pmol/min, bzw. (Abb. 3A). Darüber hinaus ergaben mikroskopische Aufnahmen der vergoldeten Zellen, dass 40.000 Zellen/gut die gesamte Oberfläche des unteren Rands der Mikrotestplatte Brunnen besser als die anderen Beschichtung dichten (Abb. 3 b bedeckt). Obwohl die maximale OCR mit 40.000 Zellen im Vergleich zu der Dichte von 30.000 Zellen nicht erhöhen, empfehlen wir eine Zelldichte von etwa 40.000 Zellen/gut für optimale Interaktion zwischen Zellen und Verbindungen.
Darüber hinaus wurde in unseren Experimenten, die optimale Konzentration der hemmenden/Entkuppler Verbindungen gezeigt 1 µM Oligomycin, 1 µM FCCP und 2 µM Rotenon/Antimycin-A (die Protokolle der extrazellulären Flux-Test und die Port-Injektionen werden in Tabelle 1 aufgelistet sein ; die Optimierung Experimente werden nicht angezeigt). Es wird jedoch für alle Benutzer ein Vorversuch mit verschiedenen Konzentrationen dieser Verbindungen, im Idealfall niedriger und höher als die veröffentlichten Werte ausführen empfohlen, um die besten Ergebnisse zu rechtfertigen.
Ein extrazelluläre Flux-Test liefert eine Reihe von wichtigen Parameter für die Beurteilung der Bioenergetik renal TECs. Zum Beispiel kann Fettsäureoxidation angezeigt wird, speziell bei TECs defekt sein, die Verwendung von Medien, die Fettsäure-Substrat (Palmitat) zusammen mit der Inhibitor der Glykolyse (2DG) als ein nützliches Instrument zur Fettsäureoxidation in TECs direkt auswerten dienen an Stellen 1 und 2 (Abbildung 3). Bei renal Fibrose soll die Gesamtkapazität der Atmung der Zellen geringer als bei einer gesunden Niere sein, obwohl die Glukose-basierte Medien keine Unterschiede offenbaren können.
Zusammengenommen, extrazelluläre Flux-Test, vor allem für die Fettsäure-Oxidation Fähigkeit, bewerten kann genutzt werden, als eine informative Maßnahme, um den energetischen Zustand des renalen TECs in die pathologischen Veränderungen der Bioenergetik Profil spielen eine wichtige Rolle bei der renalen Fibrose und die Progression zu Nierenversagen.
| Schritte | Zeit (min) |
| Kalibrieren | |
| Equilibrate: | 00:12:00 Uhr |
| Messung 1 | 3 Schleifen |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Injizieren Port ein (1 μM Oligomycin) | 2 Schlaufen |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Port B (1 μM FCCP) injizieren | 2 Schlaufen |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Injizieren von Port C (2 μM Rotenon/Antimycin) | 2 Schlaufen |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
| Mix | 00:02:00 |
| Warte | 00:02:00 |
| Maßnahme | 00:03:00 |
Tabelle 1. Standardisierte extrazelluläre Flussmittel Analyse Protokoll für optimale OCR-Messungen im primären röhrenförmigen Zellen laufen.
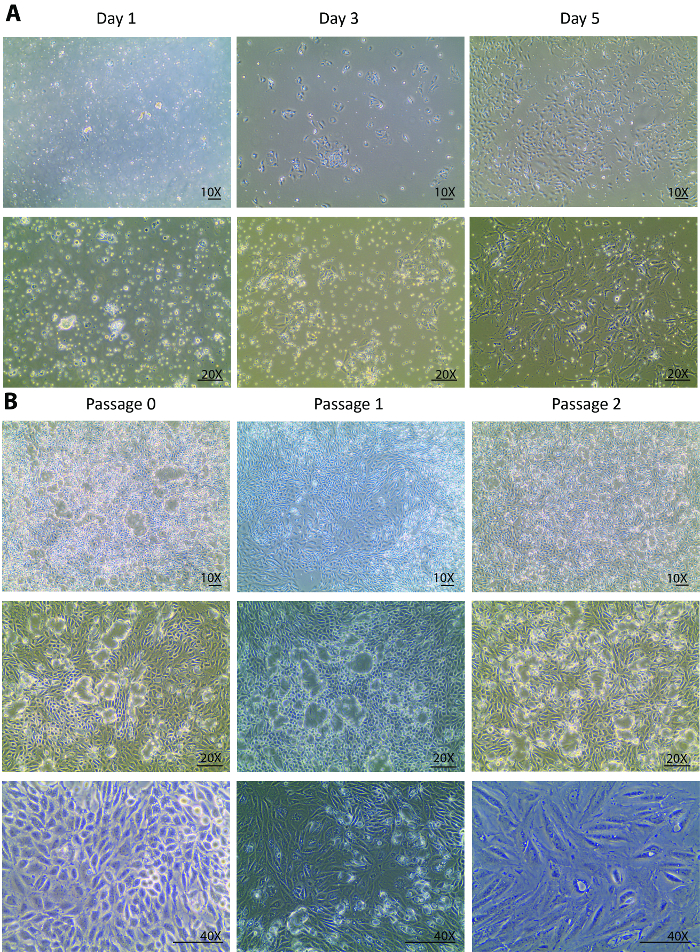
Abbildung 1: Isolierte primäre röhrenförmigen Zellen Zellkultur. (A) die isolierten primäre röhrenförmigen Zellen legen früh am Tag 1 und robust wachsen von Tag 3 bis Tag 5. Die Bilder sind unter 10 X und 20 X Ziele getroffen. (B) dieses Panel zeigt eine Subkultur der isolierte primäre röhrenförmigen Zellen aus Abschnitt 0 Passage 3. Die Bilder werden unter 10 X und 20 X Ziele für die Visionen der Zelle Kuppeln und unter einem 40 X Objektiv für eine Vision von den morphologischen Veränderungen durch die Gänge. Die Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
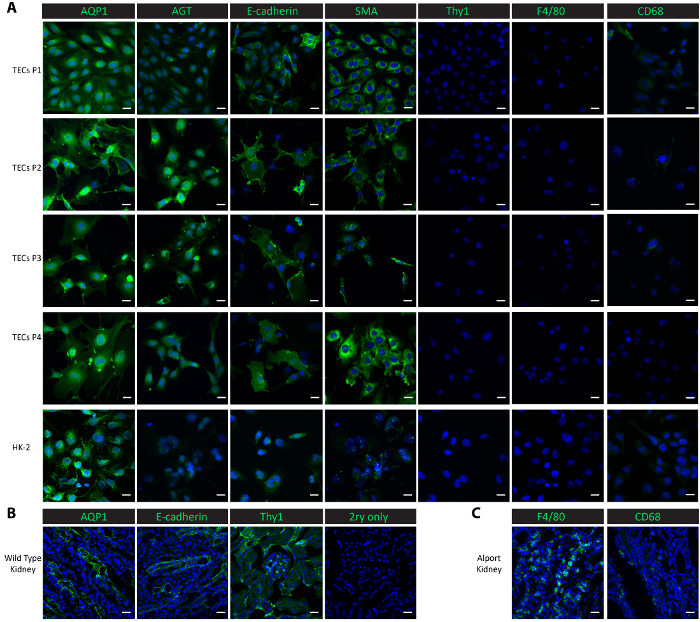
Abbildung 2: Charakterisierung der isolierte primäre röhrenförmigen Zellen. (A) Immunostaining mit Antikörpern gegen proximalen röhrenförmigen Proteine (AQP1, AGT), eine distale tubuläre Protein (E-Cadherin), einer epithelialen Protein (SMA), ein mesangialen Protein (Thy1) und Makrophagen Proteine (F4/80, CD68) zeigen, dass die isolierte primäre röhrenförmigen Zellen und anschließende Subkulturen sind reine proximalen und distalen röhrenförmigen Zellen. (B) zeigt dieses Fenster eine Färbung des proximalen Röhrchen, distale Röhrchen und mesangialen Proteine in Nieren-Gewebe aus einer gesunden Wildtyp Maus als Positivkontrolle und eine Negativkontrolle keine-Grundschule. (C) zeigt dieses Fenster eine Anfärbung der Proteine Makrophagen F4/80 und CD68 im nierengewebe von Col4a3- / - Maus als Positivkontrolle gesammelt. Maßstabsleiste = 20 µm. Das DAPI wird blau dargestellt. Die Marker-Proteine sind in grün dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
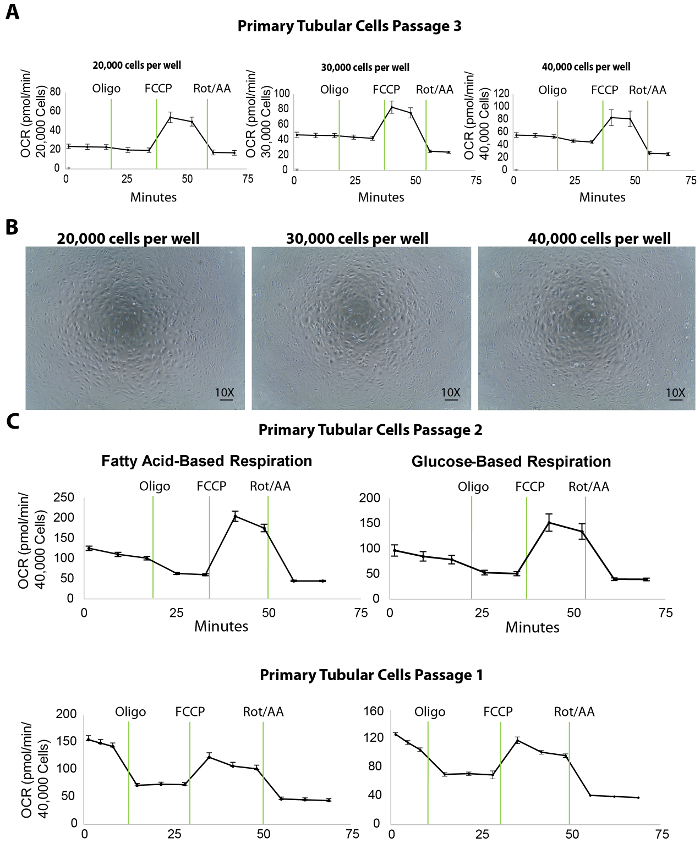
Abbildung 3. Extrazelluläre Flussmittel Assay in isolierte primäre röhrenförmigen Zellen bei verschiedenen Beschichtung dichten. (A) zunehmende zelluläre Dichte Beschichtung erhöht die basalen Atmung Ebenen in primären röhrenförmigen Zellen in der Passage 3 getestet. (B) zeigt dieses Panel mikroskopische Aufnahmen von primären röhrenförmigen Zellen kultiviert auf einer XF96 Mikrotestplatte bei 20.000, 30.000 und 40.000 Zellen/gut dichten ausgesät. Maßstabsleiste = 100 µm (C) dieses Panel zeigt eine Fettsäure oder Glukose-basierten extrazelluläre Flux-Assay in primären röhrenförmigen Zellen bei Passagen 2 und 1. Die Daten sind Mittelwert ± SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.
Diskussion
Wir ein Protokoll, das ermöglicht die effiziente Isolierung der Maus renale tubuläre Epithelzellen (TECs) optimiert und zeigten, dass die Zellen für eine extrazelluläre Flux-Analyse, bewerten die mitochondriale Atmung im Beisein von Fettsäure - Sub kultiviert werden können und/oder Glukose-basierte Substrate. Dieses Protokoll ist für Studien mit Schwerpunkt auf proximalen und distalen röhrenförmigen Zellen konzipiert und dient als Rahmen, um komplexere Experimente für das Verständnis der TEC Pathologie-assoziierten Nierenerkrankungen zu bauen. Im Vergleich zu früher veröffentlichten Protokolle9,10,19, diese Methode erfordert keine Steigung Trennungen mit langen Zentrifugation Zeiten oder eine ausreichend Antikörper-Nutzung für die Sortierung und bietet daher mehr effizienten und optimierten Leitfaden für Forscher im renale tubuläre metabolischen Bereich tätig. Es gibt mehrere wichtige Schritte in diesem Protokoll einschließlich der Verdauung, erneute Sammlung und Dichte Beschichtung und zusammengesetzte Optimierung für die extrazelluläre Flux-Assay.
Wahl der richtigen Art von Kollagenase und optimale Konzentration ist der Schlüssel zu einer erfolgreichen Verdauung und Dissoziation der röhrenförmigen Zellen von renal Gewebe. Im Vergleich zu anderen Arten von Collagenases, enthält Typ2 Kollagenase relativ höhere Ebenen der Protease-Aktivität, in der Lage, kompakte renale Strukturen aufzulösen. Um die Chancen einer Kontamination durch eine längere Durchblutung und Verdauung Zeit zu minimieren, wurde bei 30 mL/min 0,013 % Typ 2 Kollagenase durchblutet. Die renale Kapsel wurde nur entfernt, nachdem beide Nieren wurden vom Tier geerntet und in eine sterilisierte Zelle Kultur Kapuze übertragen. Die Nieren wurden in kleine Stücke gehackt und setzte ihre Inkubation mit 10 mL der Verdauung Puffer für weitere 5 Minuten für eine vollständige Verdauung und maximale Freisetzung von röhrenförmigen Zellen.
Obwohl nach der Verdauung, die Gewebe-Aufhängung durch einen 70-µm-Filter um sehr große Gewebe zu entfernen übergeben wird, wird noch sein unverdaute Tubuli, die durch den Filter passieren und bleiben innerhalb der Zellsuspension und bekommen auf der Kulturschale überzogen. Es dauert länger als normal für diese Tubuli röhrenförmige Zellen und der Kulturschale fest zuordnen. Daher ist es eher wichtig, sammeln die Zellsuspension und Zentrifugieren um ungebunden Tubuli und Zellen am zweiten Tag nach der Zelle Beschichtung pellet. Dieser langsame Zentrifugationsschritt weiter entfernt andere Zelltypen, die heller sind als röhrenförmigen Zellen und ermöglicht für ungebundene Tubuli und röhrenförmigen Zellen zu begleichen.
Die Identifizierung der richtigen Zelldichte ist der erste und wichtige Schritt für einen erfolgreichen extrazelluläre Flux-Assay. Die Ergebnisse zeigten, dass 40.000 Zellen pro Bohrloch auf einem XF96 Mikrotestplatte ist ideal für primäre röhrenförmigen Zellen in einer Fettsäure und einem Glukose-basierte Atmung-Assay (Abbildung 3). In diesem Protokoll wurden isolierte röhrenförmige Zellen für die extrazelluläre Flux-Assay an Stellen 1 und 2 verwendet. Die Zellen Sub kultiviert um 3, passage, obwohl sie einen Ausdruck der röhrenförmigen Marker (Abbildung 2) und eine ordentliche Leistung in der Bioenergetik-Assays (Abbildung 3A) gepflegt und verringerte Atmung basalen Ebenen im Vergleich zu Durchgang 2 zeigten (dargestellt durch den Vergleich von OCR in die am weitesten rechts liegenden Paneele der Abbildung 3A , Abbildung 3). Dieser Rückgang kann im wesentlichen gesunde röhrenförmige Zellen (z. B. solche, die von jungen Wildtyp Mäusen isoliert) nicht beeinträchtigen. Höheren Passagen der Zellen können jedoch für Studien an Zellen isoliert von CKD-Maus-Modellen, die bereits über eine verminderte mitochondriale Atmung, einen weiteren Rückgang der basalen Atmung führen, die Ergebnisse der extrazellulären Flux-Test beeinflussen würde. In die Studien durchgeführt, die Zellen von Abschnitt 1 und Abschnitt 2 zeigte hohe basale Atmung Ebenen. Daher wird empfohlen im Anschluss an dieses Protokoll mit diesen beiden frühen Passagen für mitochondriale Atmung Studien mit Zellen von gesunden und erkrankten Tieren isoliert. Zellen aus Abschnitt 2 sollte noch berücksichtigt werden, wenn die Durchgang 1 Subkultur nicht genügende Zellen für die Flux-Assay erbringt. Neben Bioenergetik Studium zeigt unserer bisherigen Forschung, dass primäre TECs in der Passage 3 äußerst nützlich für die Behandlungen mit Verbindungen gefolgt von Proteinen und RNA Studien (Daten nicht gezeigt). Abgesehen davon, empfehlen wir, dass Ermittler unter Verwendung dieses Protokolls, um röhrenförmige Zellen zu isolieren sorgfältig, die optimale Passage für verschiedene Anwendungen auswählen sollte.
Das Prinzip der extrazellulären Flussmittel Analyse basiert auf die Interaktionen zwischen den injizierten Substanzen und die Atmung Kette komplexe und die Wirkung der Entkuppler. Oligomycin ist ein Inhibitor der Komplex V (ATP-Synthase) und wird verwendet, um ATP-linked Sauerstoffverbrauch und den Sauerstoffverbrauch, der erforderlich ist, um das regelmäßige Proton Leck über eine innere Mitochondrien-Membran32überwinden zu unterscheiden. FCCP entkoppelt Sauerstoffverbrauch aus der ATP-Produktion durch die mitochondriale Membranpotential stören. So bietet es ein Maß für die maximale Atmung Kapazität, da es die begrenzte Kapazität der ein Proton Ionen-Efflux von ATP-Synthase umgeht, dadurch, dass einen PROTONENTRANSPORT durch die Membran. Antimycin A, ein Komplex III-Hemmer, und Rotenon, ein Komplex ich Blocker, werden in Kombination verwendet, um die gesamte mitochondriale Atmung ermöglicht einer Differenzierung zwischen mitochondrialen vs. nicht-mitochondriale Sauerstoffverbrauch in Herunterfahren die Zellen. Diese Verbindungen sollten immer titriert werden, für einen bestimmten Zelltyp vor der extrazellulären Flux-Test die optimalen Konzentrationen bestimmen, die die optimale OCR-Kurven ergeben. Hier empfehlen wir 1 µM Oligomycin, 1 µM FCCP und 2 µM Rotenon/Antimycin A zum extrazellulären Flux-Test auf primäre TECs.
Zusammenfassend, bietet dieses Protokoll eine einfache und kostengünstige Möglichkeit, renale primäre proximale und distal tubuläre Epithelzellen zu isolieren, die für die Beurteilung der mitochondrialen Bioenergetik ex Vivoverwendet werden können. Während dieses Protokoll in eine Vielzahl von molekularbiologischen Studien erforschen die biologische Funktion der renale tubuläre Epithelzellen nützlich sein kann, erkennen wir seine Grenzen, wenn es auf Studien benötigen reine proximalen oder distalen Tubuli anwenden. Zum Beispiel Studien über die Lowe-Syndrom, eine selektive proximale tubuläre Dysfunktion33oder Studien auf distale renale tubuläre Azidose, eine distale tubuläre Dysfunktion34, müsste ein anspruchsvoller Protokoll für Zelle isoliert und Reinigung. Für die Mehrheit der Studien, die Tubuli vs. Glomeruli zu vergleichen und für Studien mögliche mitochondriale Atmung Regulierungsbehörden in röhrenförmigen Zellen im Allgemeinen auf den Bildschirm sieht das Protokoll einen machbaren Hochdurchsatz-Ansatz. Dieses Protokoll müssen daher breite Anwendungen, mitochondriale Dysfunktion mit Nierenerkrankungen Entdeckung oder Ziel Validierungszwecken Droge zu studieren.
Offenlegungen
Die Autoren haben nichts zu verzollen.
Danksagungen
Diese Arbeit wurde durch die folgenden Zuschüsse an Lina A. Shehadeh unterstützt: das National Institute of Health (R56HL132209 und 1R01HL140468) und Miami Heart Research Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
Referenzen
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750(2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997(2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40(2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908(2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231(2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten