Method Article
تحليل البروتين أبنية ومجمعات البروتين-يجند بالتكامل الهيكلي الكتلي
In This Article
Summary
الطيف الكتلي (MS) برز كأداة هامة للتحقيق في بنية وديناميات الجزيئات التجميعات. هنا، نحن إدماج النهج المستندة إلى MS استجواب تشكيل البروتين المعقدة وملزم يجند.
Abstract
البروتينات هي فئة هامة من الجزيئات البيولوجية التي تلعب أدواراً رئيسية كثيرة في الوظائف الخلوية بما في ذلك التعبير الجيني، تحفيز التفاعلات الأيضية وإصلاح الحمض النووي والنسخ المتماثل. ولذلك، فهم مفصل لهذه العمليات يوفر معلومات هامة حول كيفية الخلايا الدالة. أساليب MS هيكلية تكاملية توفر المعلومات الهيكلية والديناميكية في الجمعية البروتين المعقدة والربط المعقدة، stoichiometry وحدة فرعية، أوليجوميريزيشن البروتين وملزم يجند. وأتاحت التطورات الحديثة في التكامل الهيكلي MS توصيف النظم البيولوجية الصعبة بما في ذلك كبير الحمض النووي ملزم البروتينات وبروتينات الغشاء. ويصف هذا البروتوكول كيفية دمج البيانات MS متنوعة مثل الأصلية مرض التصلب العصبي المتعدد وأيون التنقل-قياس الطيف الكتلي (إيم-MS) مع ديناميات الجزيئية المحاكاة اكتساب نظرة ثاقبة الحمض النووي هيليكاز-نوكلاس إصلاح البروتين المعقدة. النهج الناتجة عن ذلك الذي يوفر إطارا لدراسات تفصيلية ليجند ملزمة للمجمعات البروتين الأخرى المشاركة في العمليات البيولوجية الهامة.
Introduction
أصلي والمطيافيه الجماعية من البروتينات سليمة وبها مجمعات يجري تحليل استخدام اليكتروسبراي والتاين نانو-اليكتروسبراي (نيسي)، التي تحافظ على طي البروتين والتفاعلات غير التساهمية خلال عملية التأين1، 2. في MS الأصلي، يتم الاحتفاظ ببنية البروتينات وهذه المجمعات في حالة قرب أصلي في3،الغاز-المرحلة4. الأصلية مرض التصلب العصبي المتعدد بالكشف عن أيونات مشحونة بالبروتين متعددة، يتم فصله بحسب كتلتها تهمة نسبة (m/z) يسمح لكتلة البروتين أو البروتين-يجند معقدة حسابها. هذه المعلومات يمكن تحديد ستويتشيوميتري البروتين سليمة وتشكيل وحدة فرعية وملزم يجند والتفاعل شبكات3،4،،من56. MS الأصلي مزايا عديدة مقارنة بتقنيات أخرى مثل هذه البلورات بالأشعة السينية والرنين المغناطيسي النووي الطيفي5. أولاً، الأصلية مرض التصلب العصبي المتعدد تقنية سريعة وحساسة للغاية، تتطلب سوى بضعة ميكروليتيرس (2-3 ميليلتر) من عينة تركيزات المعقدة النهائية منخفضة نسبيا في نانومتر عالية ميكرومتر منخفض النطاق6. ثانيا، يمكن استخدام MS الأصلي استجواب عينات البروتينات غير المتجانسة مما يجعل من الممكن لتحليل البروتينات والدول أوليجوميريك متعددة في وقت واحد. وثالثاً، لا تتطلب الأصلية مرض التصلب العصبي المتعدد عينات البروتين تعديل قبل التحليل بواسطة crosslinking الكيميائية أو وضع العلامات البروتين. جعلت هذه المزايا الهيكلية مرض التصلب العصبي المتعدد أداة قوية للتحقيق الهيكلية في مجمعات البروتين.
يمكن أن يقترن الأصلية مرض التصلب العصبي المتعدد أيون التنقل (IM)، أسلوب الذي يقيس الوقت تحيط أيون بروتين السفر عبر مجال الكهربائي، تمكين المقطع العرضي الاصطدامية (قانون الأحوال المدنية) على أن يحدد. ويوفر احتجاز ثاني أكسيد الكربون منخفضة الدقة من المعلومات الهيكلية، التي تمكن الطوبولوجيا والمعلومات conformational التباين البروتينات الحصول على. وعلاوة على ذلك، فإنه يسمح فحص البروتين النماذج الهيكلية التي تم إنشاؤها بواسطة النهج الحسابية.
البروتين الغاز-مرحلة الاستقرار يمكن أن يحقق استخدام الاصطدام المتعمد التي تتكشف (سو) تقاس إيم--مرض التصلب العصبي المتعدد. أثناء عملية سيو، تسارع أيونات البروتين وتفعيلها من خلال اصطدام تسارع زيادة مع غاز خامل المخزن مؤقت داخل مطياف كتلة7،،من89. يؤدي هذا عملية التنشيط الاصطدامية البروتين تتكشف جزئيا، الذي يترجم إلى زيادة في احتجاز ثاني أكسيد الكربون. يمكن أن يكون هذا التغيير في احتجاز ثاني أكسيد الكربون والطاقة اللازمة تتكشف البروتين يقاس هذا النهج "استخدام" الدردشة-السيدة، أثر ملزم يجند في الاستقرار البروتين يمكن أن يقاس10. يمكن أن تتولد سوبكومبليكسيس في الحل باستخدام أساليب الاضطراب في حل مثل إضافة المذيبات العضوية لرصد أصلي مثل طبولوجيا من البروتين المجمعات. تعطيل لمجمعات البروتين أساسا بسبب تعطل التفاعلات البينية غير التساهمي. والحفاظ على طبولوجيا أصلي مثل المجمعات الفرعية، عند الكشف عن مرض التصلب العصبي المتعدد، تكشف عن معلومات حول الاتصال بين وحدة فرعية.
النهج التكاملي في علم الأحياء الهيكلية الجمع بين الأساليب المتنوعة لدراسة بنية وديناميات البروتينات وبها مجمعات3،4،،من56. الأصلية مرض التصلب العصبي المتعدد ومرض التصلب العصبي المتعدد--إيم قد استخدمت للكشف عن تفاصيل تحدي النظم البيولوجية الجزيئية. وكانت هناك عدة أمثلة للتطبيقات بما في ذلك دراسة البروتين الجمعية مسارات11،12،13،14، دراسة شبكات التفاعل البروتين-بروتين15 , 16 , 17والغشاء البروتينات6،،من1819،،من2021، وتفاعلات البروتين-يجند مثل الأحماض النووية22،23 ،24.
ومع ذلك، قد الأصلية مرض التصلب العصبي المتعدد أيضا حدودها. غالباً ما تتم الأصلية مرض التصلب العصبي المتعدد القياسات في مخازن متقلبة مثل خلات الأمونيوم المائية التي لن تحتفظ بعض البروتينات على3،الدولة الأصلية مطوية25. ومع ذلك فقد أظهرت الأعمال الأخيرة أنه يمكن التغلب على هذا التحديد الأمثل للرش إبرة نصيحة قطرها (النصائح 0.5 مم) مثل أن البروتين والبروتين أيونات معقدة يمكن أن تتكون مباشرة من المخازن المؤقتة غير متغير مع عالية القوة الأيونية على أفضل تحاكي البيئة الفسيولوجية26. بالإضافة إلى ذلك، تستخدم MS الأصلي اليكتروسبراي تتأين ونقل التجميعات غير التساهمية من الحل إلى الطور الغازي؛ ولذلك، الوفرة النسبية لمجمعات المكتشفة قد لا كلياً يمثل أن في حل5،27. وعلاوة على ذلك، بالمقارنة مع الحل، التفاعلات مسعور المرحلة الغاز تصبح أضعف والتفاعلات الالكتروستاتيكي تصبح أقوى ومن ثم يفضل3،28.
في هذه المقالة، نحن نقدم البروتوكولات وتحليل البيانات وتفسيرها لتحديد البروتين ويجند ملزم باستخدام الأصلية مرض التصلب العصبي المتعدد، مرض التصلب العصبي المتعدد--إيم، سو، اختلال في الحل، ووضع النماذج. ويستخدم المجمع إصلاح الحمض النووي، هيرا-نورا، كنظام نموذجي. الحمض النووي المزدوج-الذين تقطعت بهم السبل فواصل (دسبس) أحد النماذج الأكثر السامة للخلايا وضارة من ضرر الحمض النووي، مما يؤدي إلى عدم الاستقرار الوراثي وتطور السرطان في البشر في نهاية المطاف. جزئ مثلى هو إصلاح الآلية التي تستأصل دسبس، عملية التي هي مدبرة من قبل هيرا-نورا المعقدة، ATP يعتمد هيليكاز-نوكلاس22.
يسمح الجمع بين الأصلية مرض التصلب العصبي المتعدد ومرض التصلب العصبي المتعدد--إيم الاختبارات الوظيفية ونمذجة التحقيق: ط) دور نورا في الجمعية، والمطابقة، والاستقرار في المجمع، والثاني) التفاعل بين دسدنا والمعقدة وتأثيره على مجمل استقرار المجمع، والثالث) ستويتشيوميتري وأثر ملزم ATP في الجمعية22. عموما، هذا العمل أدى إلى تحسين فهم الأساس الجزيئي لمجمع هيرا-نورا بربط التغييرات البروتين conformational المعقدة والاستقرار مع النوكليوتيدات ملزمة. هذا البروتوكول عام لأي complex(es) البروتين الذي يتفاعل مع واحد أو العديد من أنواع ligand(s).
Protocol
1-نموذج إعداد الأصلية مرض التصلب العصبي المتعدد من البروتين والبروتين-يجند المجمعات
ملاحظة: للحصول على فهم الأساس الجزيئي للبروتين المعقدة ويجند الربط باستخدام MS الأصلي، إعداد نموذج مناسب هو المفتاح. والهدف من هذا الفرع هو تسليط الضوء على خطوات إعداد نموذج أساسي قبل تحليل مرض التصلب العصبي المتعدد باستخدام مجمع هيرا-نورا الذي يربط الحمض النووي والنيوكليوتيدات كمثال.
- إعداد 20 ميليلتر مختبرين لتركيز البروتين المنقي (عادة 15-30 ميكرومتر) في أنبوب 1.5 مل.
-
لتحليل ملزمة ATP أو شرطة أبوظبي
ملاحظة: إضافة التركيزات المتزايدة غير هيدروليزابل ATP أدينوسين التناظرية 5 '-O-(3-thiotriphosphate)، تيتراليثيوم الملح (ATP-γ-S) أو الادينوسين 5-diphosphate (ADP). عدم هيدروليزابل ATP المشتقات تولد مستقر معقدة التي ستمكن البروتين ATP زمنياً لالتقاطها. وتشمل سائر نظائرها ATP غير هيدروليسابل التي يمكن أن تختبر PNP أمبير و ATP-γ-S-Mg2 +.- الدراسات نورا هيرا، مزيج من 5 ميكرومتر من البروتين المنقي مع ATP-γ-S وشرطة أبوظبي بتركيزات تتراوح بين 0-1 مم.
- لالتقاط المتزامنة ATP-γ-S وشرطة أبوظبي الملزمة، إضافة كلا النيوكليوتيدات بتركيزات مختلفة أو نفسها.
- إضافة 2 مم مجكل2 واحتضان عند 25 درجة مئوية في حاضنة حمام جافة ح 1.
ملاحظة: تحليل النوكليوتيدات ملزمة باستخدام نيسي الأصلية مرض التصلب العصبي المتعدد يمكن أن ينتج أرتيفاكتوال ملزم بتركيزات عالية، ولذلك الربط غير محددة يجب أن تؤخذ في الاعتبار29. للتحقيق غير محددة ملزمة، إضافة تركيز أعلى من النيوكليوتيدات بين 2-5 مم).
-
لتحليل الحمض النووي ملزم
- مزيج البروتين والحمض النووي بنسبة مولى الذي يسمح بتشكيل معقد البروتين-الحمض النووي. هيرا ونورا هيرا، مزيج 5 ميكرون من البروتين المنقي مع الحمض النووي بنسبة 1:1.
- احتضان هيرا-نورا أو هيرا-خليط الحمض النووي لمدة 30 دقيقة عند 25 درجة مئوية في حاضنة حمام جافة حتى تصل إلى التوازن. قد تختلف مدة ودرجة حرارة الحضانة البروتين قيد التحقيق.
- المخزن المؤقت لتبادل عينات البروتين للمخازن المؤقتة متوافق مع مرض التصلب العصبي المتعدد. عادة، يتم استخدام الحل خلات الأمونيوم مائي بين 5 ملم-1 م في درجة الحموضة 7-8. وتشمل مخازن متوافقة أخرى MS اثيلينيديامونيوم اسيتات (إيدا) وتريثيلامونيوم اسيتات (تا)30. الدراسات نورا هيرا، استخدم 200 ملم خلات الأمونيوم الهيدروجيني 7.
ملاحظة: هناك عدة طرق لتبادل المخزن المؤقت قبل التحليل بمرض التصلب العصبي المتعدد مثل استخدام مركز دوران أو أعمدة اللوني. MS الأصلي يقتصر معظمها نوعية العينة مثل المخازن و adducts المستخدمة أثناء تنقية. ولذلك، من الضروري إجراء الملحي كافية للحصول على الحدود القصوى لحل. - هيرا-نورا يجند ملزمة الدراسات، المخزن المؤقت تبادل عينات 6-8 مرات في خلات الأمونيوم 200 ملم باستخدام مركز. على الرغم من أن هذا الأسلوب أكثر مضيعة للوقت، ويضمن أن تحل تحقيق قمم ويسمح بتحديد شامل دقيق للأنواع منضم ATP/ADP.
2. الأصلية مرض التصلب العصبي المتعدد اقتناء وتحليل للتحقيق في مجمعات البروتين والبروتين-يجند المجمعات
ملاحظة: ينبغي أن يكون الأمثل ظروف مرض التصلب العصبي المتعدد لتحقيق قمم عالية حلها لتمكين دقة القياسات الشامل. تفاصيل هذا المقطع الأمثل المعلمات على ف-ToF مطياف شامل مع الرباعي m/z حد أعلى ك 32.
- تعد الشعيرات الدموية الداخلية لنانو-اليكتروسبراي وتنفيذ الصك الشامل المعايرة لقياسات دقيقة الشامل كما هو مفصل كيرشنباوم et al. 1.
- تحديد أوضاع TOF التنقل والحصول على أيون إيجابية وحساسية.
- دورة عن غازات فخ، API ونظام الرصد الدولي. لفصل إيم، استخدام النتروجين (60 مل/دقيقة) وارغون (8.4 مل/دقيقة لمنطقة فخ) كنقطة انطلاق وقم بضبط.
- تعيين مجموعة اقتناء m/z مناسبة. لبروتين غير معروف، يجب استخدام الخطوات الأولية الأمثل واسعة مثل م 500-32,000/z.
- تحميل 2-3 ميليلتر من حل البروتين معقدة يمكن تحليلها إلى الشعرية مغلفة الذهب وأدخله في حامل شعرية.
- بلطف تشديد الشعرية ومكان شعري في مرحلة المصدر اليكتروسبراي والشريحة المرحلة إلى موقف للبدء في الحصول على بيانات.
- تطبيق ضغط الغاز نانو-التدفق المنخفض (0.00-0.05 بار) حتى يتم تشكيل قطره في تلميح شعري. يمكن ثم إفلات ضغط التدفق نانو حتى يتم الاحتفاظ بالرش.
- ضبط الشعرية فيما يتعلق بالمخروط بالانتقال الشعرية x، y، z المواقف ورصد أيون الحالية لتحقيق أيون مستقرة حاليا. تطبيق جهد شعرية في حدود 0.9-1.6 kV.
- تعيين مخروط أخذ العينات (50-120 V)، وإزاحة المصدر (60.0)، مصدر حرارة (25 درجة مئوية) وتدفق الغاز مخروط (0.0 لتر في الساعة). واقترحت هذه الشروط الأولية يمكن تعديلها.
- للحصول على طيف كتلة حل جيد وتعظيم انتقال أيون، ضبط معلمات مرض التصلب العصبي المتعدد ورصد التغير الناتج في الأطياف. وهذه تشمل ضبط تدفق الغاز في فخ (2-8 مل/دقيقة)، وأنه خلية (180 مل/دقيقة) وخلية نظام الرصد الدولي (90 مل/دقيقة) لتحقيق الانفصال أفضل في الإرسال القصوى.
- ضبط طاقات فخ الاصطدام في حالة عدم كفاية الجهد للإزاحة. نقطة انطلاق أمثل بين 10-50 الخامس.
ملاحظة: زيادة الطاقة فخ يمكن إزالة غير تساهمي ملزمة adducts. ومع ذلك، الحرص على تفادي الاصطدام الناجم عن تفكك وتتكشف المجمع البروتين-يجند. إجراء قياسات التنقل أيون للتحقق إذا كانت شروط الصك الاحتفاظ بالبروتين في الدولة الأصلية مطوية (الخطوة 3). - تحسين ديسولفيشن عن طريق تحسين الجهد فخ التحيز. نقطة انطلاق أمثل هو الخامس 20-45.
- تحسين سرعة الموجه، وارتفاع الأمواج تحقيق أفضل حركة الانفصال. الشرح المفصل والبروتوكول ويمكن الاطلاع على هنا31. الدراسات نورا هيرا، استخدام سرعة موجه من 40 (m/s) وارتفاع الأمواج من 550-650 (V).
- استخدام كافة المعلمات الأخرى كقيم افتراضية في الصك.
- إعداد عينة خالية من يجند للتحليل كعنصر تحكم لتشغيل كل (الشكل 1). ليجند ملزم التجارب، إجراء قياسات مستقلة ثلاثة على الأقل.
- استخدام البرمجيات ماسلين لقياس الجماهير من الأنواع التي تم إنشاؤها وتحديد ملزم يجند، مثل ربط ATP و ADP والدول oligomeric (الشكل 2 و 3). وتشمل البرامج الأخرى المتاحة أونيديك32و33 من نباض و Amphitrite34.
- لتحديد مقدار الوفرة النسبية للأنواع، استخدام كثافات أيون المقابل لوحظ في أي إس أي--مرض التصلب العصبي المتعدد الأطياف الخام (على سبيل المثال يجند ملزمة، ليغومرات مختلفة، إلخ.). وبدلاً من ذلك، إجراء القياس الكمي باستخدام البرمجيات المتخصصة مثل أونيديك ومسن35 (الشكل 1 و 3 ).
3-اكتساب وتحليل إيم--مرض التصلب العصبي المتعدد
ملاحظة: الدردشة--مرض التصلب العصبي المتعدد يفصل الأيونات في الطور الغازي على أساس الحجم (الكتلة)، والشكل والمسؤول. كل ميزة حلها في الطيف m/z يرتبط بتوزيع وقت انجراف. إيم--مرض التصلب العصبي المتعدد تدابير الانجراف--وقت أيون التي يمكن استخدامها لحساب المقطع العرضي الاصطدام (قانون الأحوال المدنية). قياس قيم الوقت الانجراف من التراسل الفوري--مرض التصلب العصبي المتعدد باستخدام البيانات التي يحصل عليها انجراف أنبوب يمكن أن تكون مرتبطة ارتباطاً خطيا باحتجاز ثاني أكسيد الكربون القيم36. للسفر الموجه إيم--مرض التصلب العصبي المتعدد (تومس) القياسات، يتطلب حساب قيم تخزينه منحنى معايرة التي تم الحصول عليها من مستويات البروتين مع القيم المعروفة في احتجاز ثاني أكسيد الكربون37. هياكل ضغط السفر أسرع من تمديد أو تقليص الهياكل ممدود نظراً للتفاعلات مع الغاز المخزن في الخلية تنقل38. ولذلك، يمكن استخدام الدردشة--مرض التصلب العصبي المتعدد للكشف إذا كان هيكل مطوية الأصلية قد أبقى في39،مرحلة الغاز40. يوضح هذا القسم كيفية قياس إيم--مرض التصلب العصبي المتعدد وحساب احتجاز ثاني أكسيد الكربون البروتين باستخدام تومس.
- بعد تحسين شروط الصك لانتقال مستقرة (الخطوة 2)، تخفيض الطاقة الاصطدامية ومخروط أخذ العينات منخفضة قدر الإمكان رغم احتفاظها الأطياف جيدة النوعية.
- استخدام سرعة الموجه الأمثل، وارتفاع الأمواج إلى اكتساب إيم--مرض التصلب العصبي المتعدد (الخطوة 2).
- قياس الانجراف أيون الوقت مع مرض التصلب العصبي المتعدد--إيم في ثلاث سرعات موجه مختلفة (مثلاً، 550، 600 و 650 م/ث) مع الحفاظ على نفس موجه الارتفاع (مثلاً 40 الخامس).
- لتحديد البروتين الأيونات احتجاز ثاني أكسيد الكربون، قياس البروتين كاليبرانتس تحت نفس الظروف أداة تستخدم للبروتين قيد التحقيق. معايرة الانجراف-الوقت الأمثل يتطلب قياس البروتينات مع تخزينه المعروفة.
- حدد كاليبرانتس الأربعة، اثنان مع كتلة أعلاه واثنان مع كتلة أقل من البروتين تحت التحقيق37. الأهم من ذلك، تأكد من أن ارتفاع الأمواج وسرعة الموجه هي نفسها كتلك التي سجلت للبروتين قيد التحقيق.
- حساب تخزينه يدوياً41 أو استخدام برمجيات متخصصة مثل نباض33 و34 Amphitrite (الشكل 5).
- للتحقق مما إذا كان البروتين الأصلي-كما هو الحال في المرحلة الغازية، تخزينه مقارنة تجريبية لاحتجاز ثاني أكسيد الكربون النظرية الحصول من هياكل عالية الدقة. هيرا-نورا، حساب النظرية احتجاز ثاني أكسيد الكربون باستخدام أسلوب الإسقاط تقريب (السلطة الفلسطينية) المستخدمة في موبكال42. وتشمل أساليب أخرى مسار الأسلوب (TM)42 والمجال الصعب الدقيق نثر (EHS)43.
4. في حل تعطل البروتين المجمعات الأصلية مرض التصلب العصبي المتعدد ومرض التصلب العصبي المتعدد--إيم أدى تصميم الهيكل
ملاحظة: البروتين المجمعات الفرعية يمكن في بعض الحالات تحديد من نفس الحل كمجمع سليمة. ومع ذلك، يمكن أن يتحقق المزيد من المعلومات الهيكلية مثل الربط بين وحدة فرعية والجمعية معقدة من تعطيل تفاعلات البروتين في الحل، إلى نموذج المجمعات الفرعية. هذا يمكن أن يتحقق بعدة طرق مثل إضافة المذيبات العضوية، زيادة قوام القوة الأيونية أو التلاعب بدرجة الحموضة. إلى التبصر في اتصال فرعية معقدة هيرا-نورا والجمعية المعقدة، تولدت المجمعات الفرعية في الحل بإضافة المذيبات التي التشويش التفاعلات وحدة فرعية.
- إعداد تبادل العينات والمخزن المؤقت البروتين في خلات الأمونيوم كما هو موضح في الخطوة 1.
- إضافة 10-40% المذيبات في تزايدات 10 في المائة. المذيبات المستخدمة عادة هي الميثانول (ميوه) أو ثنائي ميثيل سلفوكسيد ([دمس]) الاسيتو الانيتريل (ACN).
ملاحظة: هذا يمكن أن يؤديها داخل أنبوب ميكروسينتريفوجي البولي بروبلين. - احتضان هذا الخليط على الجليد ح 1.
- الحصول طيف إيم--مرض التصلب العصبي المتعدد لكل شرط (الخطوات 2 و 3) (الشكل 4).
- استخدم برنامج القمة44 لتعيين البروتين المجمعات الفرعية وإنشاء شبكات التفاعل البروتين. وبدلاً من ذلك، يدوياً إنشاء قائمة جماهير نظرية الأنواع المتوقعة.
- للتأكد من يتم طي سوبكومبليكسيس، حساب القيم احتجاز ثاني أكسيد الكربون التجريبي للمجمعات الفرعية ومقارنة للنظرية احتجاز ثاني أكسيد الكربون كما هو موضح في الخطوة 3 (الجدول 1و الشكل 5 الشكل 6).
5-تحقق "الاستقرار معقد" البروتين استخدام الاصطدام الناجم عن تطور (سو)
ملاحظة: يمكن استخدام سو التحقيق الاستقرار الهيكلي للبروتينات، وهذه المجمعات على ملزم يجند. يمكن استخدام حزم برامج متخصصة مثل نباض33، Amphitrite34 و جناح سو9 ثم طراز تتكشف المرحلة الغازية من البروتين قيد التحقيق مع أو بدون [ليغند]. على سبيل مثال، يوضح هذا القسم الداخلي لرصد المرحلة الغازية تتكشف المسارات وتحقق الاستقرار أثر ربط الحمض النووي و ATP في مجمع هيرا-نورا.
- تسجيل بيانات التراسل الفوري--مرض التصلب العصبي المتعدد بينما زيادة الجهد تسارع فخ من 10 الخامس إلى 200 V تزايدات الخامس 2-10 تتكشف تدريجيا البروتين في الطور الغازي.
ملاحظة: تسجيل نتائج زيادات أصغر حجماً في ملفات البيانات أكثر عملية، ولكن هذا النهج يوفر حل أكثر المؤامرة تتكشف، هو أمر مهم لتحليل نقاط الانتقال بين الأنواع مطوية تكشفت. - تحليل البيانات المستقاة من استخدام نباض33، Amphitrite34 أو سو جناح9 وتوليد ثنائي الأبعاد من المؤامرات التي تتكشف في وحدات لاحتجاز ثاني أكسيد الكربون كدالة للتعجيل بالجهد (الخطوة 3). لكل دولة المسؤول، يتم إنشاء هذا بالتكدس تخزينه توزيعات الكثافة--تطبيع على كل الجهد المتسارع (الشكل 7 أ-بي).
- توليد مؤامرة تتكشف نظرية باستخدام واحدة من حزم البرمجيات. وسوف تجهز البيانات إلى نموذج تتكشف. وهذا يجعل من الممكن لقياس الطاقة الاصطدامية التي تحدث التحولات الجارية وتحديد مدى استقرار البروتينات مع أو بدون يغاندس منضم33. مرحلة انتقالية تتكشف عند التحولات الأنواع من دولة واحدة (استناداً إلى قيمها احتجاز ثاني أكسيد الكربون التجريبي) إلى دولة أخرى مع أكبر من قانون الأحوال المدنية.
- كوانتيتاتي التحولات، حساب midpoint(s) الانتقالية بين الدول التي تستخدم خوارزميات وبرمجيات مثل نباض33. وهذا يقال عادة كالسيرة الذاتية50، الذي هو قيمة الجهد الاصطدام (فخ) الذي زف 50% دولة معينة.
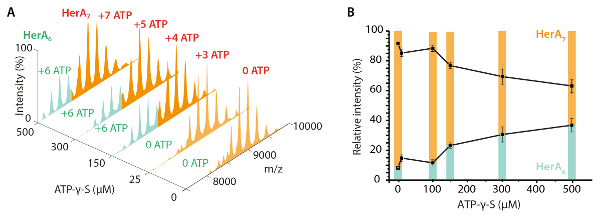
- استخدام القيمة50 السيرة الذاتية، حساب مجموع الطاقة الداخلية لايون استخدام الطاقة (كهCOM) مركز للإعلام الاصطدام45. كهCOM يتم تعريف بواسطة مجموع الطاقة الداخلية المتاحة للمرحلة الانتقالية التي تتكشف في أيون ويحسب من الطاقة الحركية والجماهير من الشركاء الاصطدام (أيون البروتين وغاز محايد) كما هو موضح في المعادلة (1)10
كيكوم (eV) =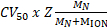 (المعادلة 1).
(المعادلة 1).
من حيث ع هو المسؤول عن أيون، كتلة الغاز المحايد ومأيون هو كتلة أيون البروتين.
ملاحظة: هذا سبب سيو للبروتينات هو المسؤول dependent46، 47. من المستحسن القيام بتحليل كهكوم للدولة تهمة واحدة أو أكثر ( الشكل 7أخي).
6. النمذجة الإجراءات "التفاضلية الجزيئية ديناميات المحاكاة" المستخدمة في MS تكاملية
ملاحظة: باستخدام نماذج من مفارز البروتين أو المجمعات مثل من هياكل الكريستال، يمكن استخدام MD التفاضلية المحاكاة (بروتين معقدة مع أو بدون [ليغند]) تحديد الآثار المترتبة على سبيل المثال يجند الوجود في بنية البروتين والديناميات. هذا المقطع تفاصيل سير عمل والأدوات اللازمة لوضع نماذج لاتخاذ الإجراءات اللازمة لإنشاء التفاضلية الجزيئية ديناميات المحاكاة.
- تحديد الوحدات الفرعية التي يؤلف المجمع (الشكل 8أ، في الخطوات 2 و 3). مصدر النماذج الحالية للوحدات الفرعية، مثل الكريستال هياكل من بنك البيانات ركسب (https://www.rcsb.org). أونيبروت دخول البروتين سوف تحتوي على قائمة بمعرفة هياكل بلورية/الرنين المغناطيسي النووي (http://www.uniprot.org). إذا لم تكن هذه متوفرة، يمكن إدخال تسلسل النظرية للانفجار لتحديد القوالب المناسبة لوضع نماذج التماثل (http://blast.ncbi.nlm.nih.gov/).
- تجميع المجمع في طبولوجيا الصحيح (الشكل 8أ-ثانيا). يمكن أن يتم ذلك من خلال أساليب مختلفة. يمكن تركيبها في خرائط الميكروسكوب الإلكتروني متاح الاطلاع على بنك المعلومات الوحدات الفرعية الفردية لتجميع المجمع سليمة (https://www.ebi.ac.uk/pdbe/emdb/). يمكن الاطلاع على البرنامج تعليمي لتركيب بدبس في خرائط م استخدام الجزيئية ديناميات مرنة المناسب (مدف) هنا: http://www.ks.uiuc.edu/Training/Tutorials/science/mdff/tutorial_mdff-html/.
- تحديد مناطق مفقودة من المجمع (8 الشكلألف-ثالثا). تنفيذ محاذاة التسلسل متعددة (MSA) بين PDB وتسلسل النظرية لتحديد البقايا التي قد تكون الخصور في هياكل الكريستال، أو أية طفرات الموروث من تجارب بلورية. يمكن أن يؤديها بدل استخدام مزودات الويب مثل تي-القهوة (http://tcoffee.crg.cat/apps/tcoffee/do:regular).
- تجديد بقايا المفقودين عن طريق التماثل نمذجة (8 الشكلألف-رابعا). بقايا البروتين المعقدة في عداد المفقودين يمكن أن يبني باستخدام برنامج مصمم نماذج (https://salilab.org/modeller/). مصمم نماذج يمكن إخراج فرقة نماذج ن في تكوينات مختلفة المجددة. ويمكن تحديد نماذج جيدة استناداً على نقاط منفصلة الأمثل بروتين الطاقة (المخدر). ويرد برنامج تعليمي شامل على موقع البرنامج (https://salilab.org/modeller/tutorial/).
- أداء المحاكاة ديناميات الجزيئية التفاضلية (MD) من البروتين المعقدة (الشكل 8ب) لتحديد مناطق بروتينات التي تستجيب لتغير البيئي خاصة، مثلاً، وجود يجند. في هذه المحاكاة، معلمات السلوكية من محاكاة A (البروتين فقط) الذي يعمل كمرجع، هو طرح من "محاكاة ب" (بروتين + [ليغند]). يمكن إبلاغ تقلب التفاضلية جذر متوسط مربع (رمسف) المحسوب بين المحاكاة أ وب في مناطق البروتين وزيادة أو نقصان في المرونة في طريقة تعتمد يجند.
- أداء المحاكاة MD وتحليل المتلقين للمعلومات باستخدام جروماكس (http://www.gromacs.org). ويمكن الاطلاع على البرنامج تعليمي في: http://www.bevanlab.biochem.vt.edu/Pages/Personal/justin/gmx-tutorials/Lysozyme/index.html. Elimate نموذج التحيز، يجب إنشاء هيكل المجمع يجند زمنياً أولاً. ثم يتم نسخ البروتين من هذا دون يجند، أن تسفر عن نموذج بروتين مطابق للمجمع يجند زمنياً.
النتائج
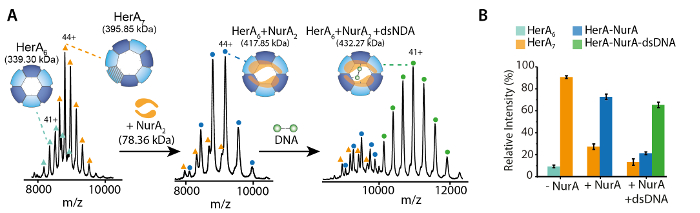
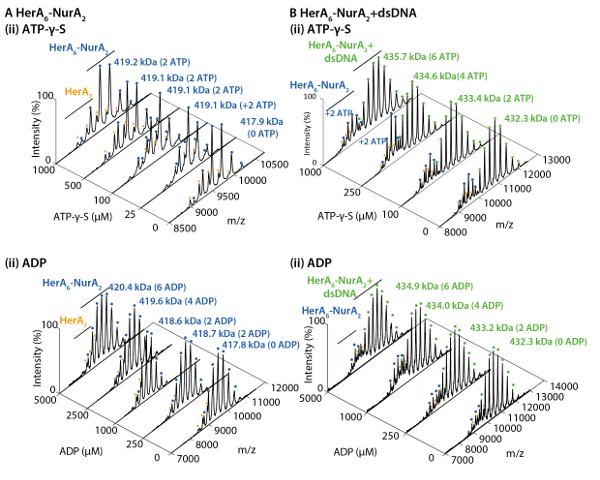
وكشفت نتائج MS الأصلي أوليجوميريك الدولة وتكوين طبولوجيا مجمع هيرا-نورا (الشكل 1). كما يتم الحفاظ على التفاعلات غير التساهمي في الطور الغازي، الأصلية مرض التصلب العصبي المتعدد ATP-γ-S وتجارب المعايرة ADP تحديد الربط النوكليوتيدات العشوائية إلى هيرا-نورا (الشكل 2)، وأن زيادة تركيز ATP-γ-S الزيادات النسبية كثافة هيكساميريك هيرا (الشكل 3). المعلومات الهيكلية فيما يتعلق التفاعلات بين وحدة فرعية تم الحصول عليها من اضطراب بالحل تليها الأصلية مرض التصلب العصبي المتعدد، وتم الاتفاق مع والجماهير النظرية (الشكل 4 والجدول 1).
القيم احتجاز ثاني أكسيد الكربون التجريبي من البروتينات وعلى مجمعات مستمدة من تجارب إيم--مرض التصلب العصبي المتعدد (الشكل 5). هذه القيم هي المرحلة الغازية التناوب متوسط حسابات مستعرضة الشكل الجزيئي، وتصف حالة الأبعاد للبروتين. قيم احتجاز ثاني أكسيد الكربون مقارنة بالقياسات النظرية من علم البلورات بالأشعة السينية، وتستدل على اتفاق جيد على الاحتفاظ بالشكل الأصلي في المرحلة الغازية (الجدول 1). وهذا التحقق من صحة استخدام قيم احتجاز ثاني أكسيد الكربون لبناء نماذج ذات الدقة المنخفضة ل البروتين الجمعية48.
ويمكن حساب CCSs التجريبية لكل أيون الدولة المسؤول. قد تثير الامتثال بروتين الأصلي مثل تكليف أيونات الدولة بقيم مماثلة في احتجاز ثاني أكسيد الكربون. غير أن زيادة أيونات الدولة رسوم أعلى ريبولسيونس كولومبيك مما قد يؤدي إلى البروتين المرحلة الغازية التي تتكشف وأكبر احتجاز ثاني أكسيد الكربون القيم CCSs النظرية بالمقارنة. استخدام قيمة تخزينه للدولة مقابل أدنى الأيونات يتم ذلك عادة49. هيرا-نورا، دفعت تجارب الاضطراب في الحل في هيرا ونورا هيرا مع أو بدون الحمض النووي توليد طريقا الجمعية بدءاً من مونومرات ثم تشكيل hexameric كامل هيرا (هيرا6)-ديميريك نورا (نورا2) مجمع مع الحمض النووي (الشكل 6).
تحديد الاختلافات في المؤامرات التي تتكشف سو بين الاشتقاق (خالية من يجند) ويجند ملزمة التغيير في الاستقرار المعقدة عند ملزم يجند. أعلى السيرة الذاتية50 أو قيمة كهكوم يعني أيون أكثر استقرار في الطور الغازي. وكشف تحليلكوم سو وكه ربط الحمض النووي هيرا-نورا أكثر استقرارا من المجمع خالية من الحمض النووي (الشكل 7أخي). من تحليل سو--مرض التصلب العصبي المتعدد في الدول المعنية ملزمة ATP، استقرار الدولة المنضمة أربعة-ATP-γ-S انخفاض الاستقرار المعقدة في الطور الغازي والدولة ملزمة-ATP-γ-S ستة فيها جميع المواقع تشغل أكثر (الشكل 7Bii). يمكن أن تكشف الأصلية مرض التصلب العصبي المتعدد النوكليوتيدات منفصلة الملزمة للدول من هيرا؛ ومع ذلك، لا يمكن التمييز بين مفارز هيرا التي هي ملزمة ATP والتي يحدث فيها هذا الربط. يمكن أن تستمد هذه المعلومات الصريحة المحاكاة MD المذيبات هيكساميريك هيرا وهيرا-نورا بعد سير العمل الموجز (الشكل 8).
الشكل 1. استجواب oligomeric الدولة وتكوين طبولوجيا المجمع غير التساهمية هيرا-نورا. (أ) كتلة الأطياف هيرا، هيرا-نورا ونورا هيرا حضور الحمض الخلوي الصبغي (DNA مزدوج-الذين تقطعت بهم السبل bp كاتشين 15.4 25). مجمع هيرا الفرعي موجود هيكسامير وهيبتامير. يربط ديمر نورا وإلى هيكسامير هيرا فرض التحويل أوليجوميريك. الحمض النووي يربط المجمع هيرا-نورا شكلت (النتائج مقتبس من أهداش Z. et al.، 201722). (ب) تحسب كثافة النسبية للأنواع التي تم تحديدها باستخدام أونيديك32. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الرقم 2. ESI-MS الأصلي يكشف إليه النوكليوتيدات ملزمة لنورا هيرا. الشامل الأطياف (A) هيرا-نورا و (ب) هيرا-نورا-الحمض النووي مع زيادة تركيزات (ط) ATP-γ-S و (ثانيا) ADP. الجماهير يقاس مقارنة بالجماهير النظرية وكمية ATP-γ-S أو مصممون ADP ملزمة. ترد الجماهير المقاسة وعدد النيوكليوتيدات المنضم على الأطياف. تحدد تجارب المعايرة ATP-γ-S وشرطة الربط النوكليوتيدات العشوائية هيرا-نورا وحدها، وعندما تكون في مجمع مع الحمض النووي تشير إلى إليه رد فعل دورية (النتائج مقتبس من أهداش Z. et al.، 201722). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الشكل 3. قياس أثر زيادة تركيزات ATP-γ-S في هيرا أوليجوميريك الدولة. (أ) كتلة أطياف هيرا في زيادة تركيزات ATP-γ-س. (ب) الرسم البياني عرض الشدة النسبية للأنواع المختلفة من MS الأصلي محسوبة باستخدام البرمجيات deconvolution أونيديك32. كما يزيد من تركيز ATP-γ-S، كما يزيد كثافة نسبية hexameric هيرا. يبين عدد جزيئات ATP-γ-S ملزمة على الأطياف (النتائج مقتبس من أهداش Z. et al.، 201722). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
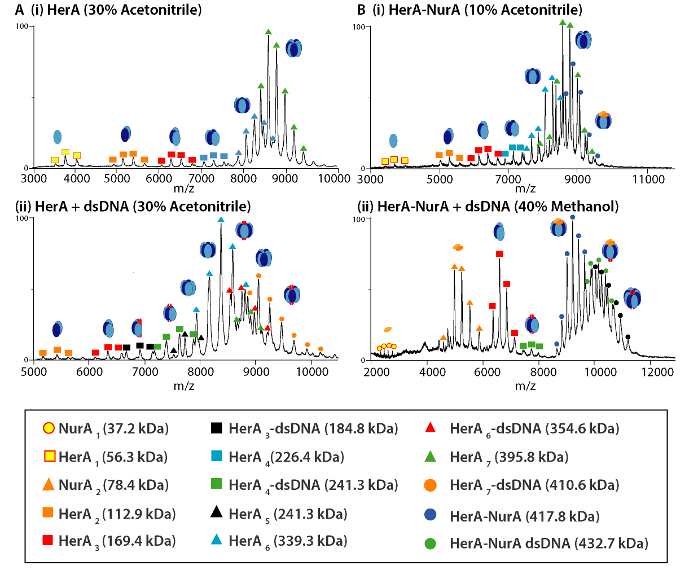
الشكل 4. الجماعي الأطياف ومنتجات التفكك شبه معقدة من هيرا (أ) و (ب) هيرا-نورا (ط) وحدها وحضور التالية (ثانيا) الحمض النووي من الاضطراب بالحل. أجريت تجارب الاضطراب في الحل باستخدام 10-40% من الاسيتو الانيتريل، والميثانول (ميوه) أو ثنائي ميثيل سلفوكسيد ([دمس]) وأسفرت عن تشكيل سوبكومبليكسيس مختلفة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
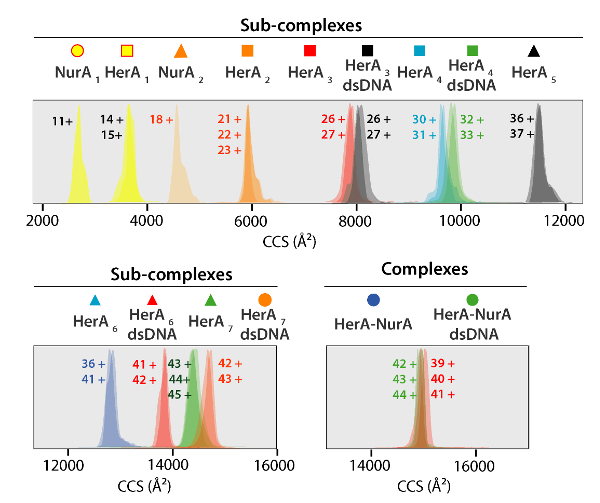
الشكل 5. أيون التنقل توزيعات وقت وصول على محور لاحتجاز ثاني أكسيد الكربون للمجمعات والمجمعات الفرعية التي تم إنشاؤها. رمز لكل ربط شبه معقدة مع أولئك المشروح في الأطياف في الشكل 4. ترد في الجدول 1 التي أظهرت اتفاقا بين القيم التجريبية والمحسوبة (بعد النظر في عدم اليقين نموذجية في قرار السفر أيون موجه الجماهير التجريبية والمحسوبة والقيم احتجاز ثاني أكسيد الكربون من المجمعات الفرعية التنقل الكتلي لدقة ± 5-8%37). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
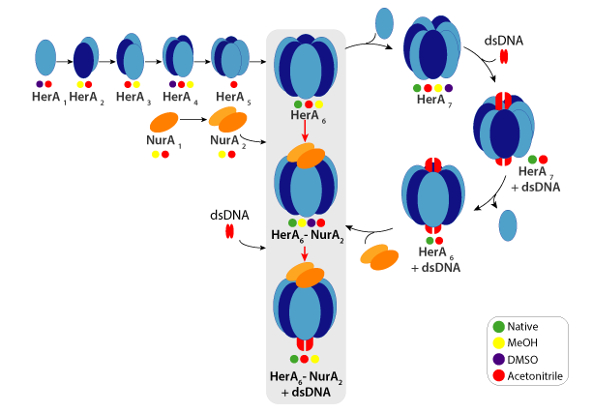
الشكل 6. مسار الجمعية مجمع هيرا-نورا المتولدة من الاضطراب بالحل الأصلية مرض التصلب العصبي المتعدد والدردشة-السيدة الملونة الدوائر تشير إلى الشروط التي لوحظ فيها كل مجمع الفرعية: أصلي (الأخضر، قبل انقطاع)، والميثانول (أصفر)، [دمس] (أرجواني) أو الاسيتو الانيتريل (أحمر). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 7. وتحقق الاستقرار أثر الحمض النووي (أ) على هيرا-نورا وملزمة (ب (ATP هيرا-نورا-الحمض النووي. (ط) مؤامرات المرحلة الغازية سو--مرض التصلب العصبي المتعدد والاصطدام (ثانيا) مركز للإعلام حساب الطاقات (كيكوم) تبين أن أن وجود دسدنا تستقر مجمع هيرا-نورا وأن ستة ATP-γ-S ملزمة الدولة هو الأكثر استقرارا. ويبين تحقيق الاستقرار للدول رسوم مختلفة. قطع تم إنشاؤها باستخدام نباض 33. النتائج من (أ) مقتبس من أهداش Z. et al.، 201722. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
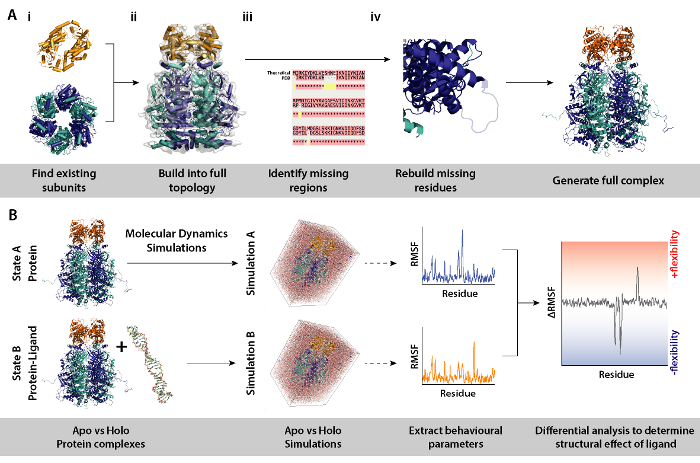
الرقم 8. سير العمل لنمذجة إجراءات التفاضلية الجزيئية ديناميات المحاكاة. (أ) توليد المجمع قيد التحقيق ببناء الطبولوجيا من القائمة الوحدات الفرعية وإعادة المخلفات مفقود. (ب) سير العمل لتشغيل محاكاة ديناميات الجزيئية على البروتين معقدة مع أو بدون [ليغند]. ركض ديناميات الجزيئية محاكاة للبروتين الذي يعمل كمرجع فقط والذي مطروح من محاكاة للبروتين بالإضافة إلى [ليغند]. وهذا تبعتها حساب تقلبات التفاضلية جذر متوسط مربع (رمسف) بين عمليات المحاكاة وتحديد أثر ملزم يجند. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| مجمع/شبه معقدة | النظرية الجماهيرية (كاتشين) | كتلة التجريبية (كاتشين) | النظرية احتجاز ثاني أكسيد الكربون (Å2) | التجريبية احتجاز ثاني أكسيد الكربون (Å2) [رسوم] | شرط حماد |
| هيرا6-نورا2 | 416.22 | 417.85 | 14531 | 14577 [42 +] 14599 [43 +] 14608 [44 +] 14637 [45 +] | 10-20% تزاول، [دمس] 10-40 ٪، 10 ٪ ميوه |
| هيرا6-نورا2-دسدنا | 431.72 | 432.27 | - | 14661 [39 +] 14728 [40 +] 14781 [41 +] 14837 [42 +] | تزاول 10 ٪، 10 ٪ ميوه |
| نورا1 | 39.12 | 38.18 | 3254 | 2618 [10 +] 2746 [11 +] 2878 [12 +] | 10-40% تزاول، ميوه 10%، 20-40 ٪ [دمس] |
| نورا2 | 78.24 | 78.36 | 4890 | 4903 [16 +] 4614 [17 +] 4537 [18 +] 4666 [19 +] | 10-40% ميوه، 20-40 ٪ [دمس] |
| هيرا1 | 56.33 | 56.32 | 4131 | 3647 [14 +] 3792 [15 +] 3950 [16 +] | 10-40% تزاول، 40% [دمس] |
| هيرا2 | 112.66 | 112.95 | 6475 | 5648 [20 +] 5747 [21 +] 5842 [22 +] 5996 [23 +] | 40% المنهجيات، تزاول 10-40% |
| هيرا3 | 168.99 | 169.39 | 8607 | 7501 [25 +] 7616 [26 +] 7717 [27 +] 7867 [28 +] | 10-40% ميوه، يمكن 10-40%، 40% [دمس] |
| هيرا3 + الحمض النووي | 183.99 | 184.976 | - | 7655 [26 +] 7990 [27 +] 8107 [28 +] | 10-30% تزاول |
| هيرا4 | 225.32 | 226.2 | 10477 | 9205 [30 +] 9287 [31] 9493 [32 +] 9961 [33 +] | 10-40% ميوه، تزاول 10-40% |
| هيرا4 + الحمض النووي | 240.82 | 241.33 | - | 9637 [31 +] 9756 [32 +] 9830 [33 +] | 10-30% تزاول |
| هيرا5 | 281.65 | 282.75 | 11853 | 10847 [36 +] 10958 [37 +] 11161 [38 +] | 30-40% تزاول |
| هيرا6 | 337.98 | 339.3 | 12517 | 12335 [38 +] 12386 [39 +] 12498 [40 +] 12590 [41 +] 12676 [42 +] 13019 [43 +] | 10-40% ميوه، تزاول 10-40% |
| هيرا6 + الحمض النووي | 353.48 | 354.626 | - | 12890 [40 +] 13081 [41 +] 13184 [42 +] 13273 [43 +] 13463 [44 +] 13576 [45 +] | تزاول 30% |
| هيرا7 | 394.3 | 395.85 | 13901 | 14154 [42 +] 14219 [43 +] 14261 [44 +] 14285 [45 +] 14335 [46 +] | 10-40% ميوه، تزاول 10-40 ٪، 10-40% [دمس] |
| هيرا7 + الحمض النووي | 409.8 | 410.62 | - | 14414 [41 +] 14510 [42 +] 14558 [43 +] 14598 [44 +] 14630 [45 +] 14641 [46 +] | تزاول 10% |
الجدول 1- الجماهير التجريبية والمحسوبة والقيم تخزينه هيرا-نورا وفي المجمعات الفرعية التي تم إنشاؤها دراسات الاضطراب في حل النموذج.
Discussion
مرض التصلب العصبي المتعدد يلعب دوراً متزايد أهمية في وصف ستويتشيوميتري والتفاعلات وبنية وحدة فرعية من البروتين المجمعات. يمكن استخدام البيانات التراسل الفوري--مرض التصلب العصبي المتعدد لتحديد ترتيبات طوبولوجي من وحدات فرعية داخل مجمعات متعددة المكونات. مقارنة بالأساليب الأخرى الأحياء الهيكلية القائمة، مرض التصلب العصبي المتعدد له العديد من المزايا. الأصلية مرض التصلب العصبي المتعدد هو أسلوب السريع وحساسة للغاية، ويمكن استخدامها لسبر عينات البروتين غير متجانسة. عندما يقترن مع تجارب الاضطراب في الحل، يمكن رصد مسارات التفكك للبروتين التجميعات. جنبا إلى جنب مع هياكل الكريستال أو نماذج التماثل، المعلومات التي تتيحها الهيكلي MS يوفر أداة للتحقيق في تفاعلات البروتين-يجند وتقديم نماذج قرب أصلي و مسارات الجمعية11.
هنا، نحن تصف الإجراءات التجريبية اللازمة لتحليل ستويتشيوميتري وتكوين البروتين-يجند التفاعلات، مع يغاندس واحدة أو أكثر، باستخدام MS التكاملية. وهذا يشمل إعداد نموذج MS والحصول على البيانات، وتحليل البيانات وتكامل البيانات MS باستخدام أدوات حسابية. للقيام بذلك، استخدمنا البروتين الحمض النووي-بتر هيرا-نورا هترو oligomeric المعقدة، منضمة إلى ثلاثة يغاندس (الحمض النووي و ATP و ADP)، كنظامنا النموذجي. ويظهر البروتوكول استخدام البرمجيات المتاحة حاليا للمساعدة في تحليل البيانات وعرضها.
الحصول على الأطياف عالية الجودة مهم لتحليل ملزم يجند، ولذلك، خطوات إعداد عينة حذراً الحرجة، بما في ذلك تنقية البروتين ومعايرة يجند exchange المخزن المؤقت. واحد الحد نيسي MS الأصلي عند دراسة ملزم يجند ربط غير محددة. الملزمة الخاصة بعدم حدوث أثناء ديسولفيشن الحبرية طوال عملية اليكتروسبراي. وهذا يزيد تركيزات يجند وذلك يغير نسبة البروتين/يجند29. ويؤدي ربط النيوكليوتيدات فرق جماعية صغيرة نسبيا بين الاشتقاق والبروتين النوكليوتيدات زمنياً الذي لا يغير من50،الكفاءة التأين51.
استخدمنا النظام سينت G2-سي "مرض التصلب العصبي المتعدد" لعملنا، ولكن البروتوكولات قابلة للتطبيق لمختلف التحقيقات الأخرى مجمعات البروتين-يجند استخدام مطيافات الشامل الأخرى المتاحة تجارياً نانو-اليكتروسبراي. التكامل الهيكلي MS متزايدة يلعب دوراً هاما في معالجة المشاكل البيولوجية لدرجة أكبر من التعقيد. سير العمل والأساليب الموصوفة هنا مناسبة تماما لفهم آثار هيكلية وبناء آليات البروتينات المعقدة وتشكيل البروتين-يجند التي يصعب إلا بدراسة استخدام تقنيات الهيكلية التقليدية .
Disclosures
وأعلن لا تضارب في المصالح.
Acknowledgements
نود أن نشكر هوفنر كارل-بيتر وروبرت توماس بيرن يرجى توفير هيرا ونورا هيرا بروتين العينات ومساعدتهم مع التصميم التجريبي. كما نشكر الدكتور إيمون القراءة لاستعراضه المخطوطة. ونعترف مع الامتنان لدينا هيئات التمويل: مؤسسة ويلكوم ترست [109854/Z/15/Z] والجمعية الملكية [RG150216 إلى أ فب].
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-(3-thiotriphosphate) tetralithium salt | Merck Millipore | 119120-25MG | |
| Adenosine 5′-diphosphate | Sigma-Aldrich | 20398-34-9 | |
| Ammonium acetate solution | Sigma-Aldrich | A2706 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 7326204 | |
| Vivaspin concentrator | Sartorius | Z614041-25EA | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 246964 | |
| Water TraceSelect | Sigma-Aldrich | 95305 | |
| Borosilicate Capillaries | Harvard Apparatus | 300060 |
References
- Wilm, M., Mann, M. Analytical Properties of the Nanoelectrospray Ion Source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Fenn, J. B., Mann, M., Meng, C. K., Wong, S. F., Whitehouse, C. M. Electrospray ionization for mass spectrometry of large biomolecule. Science. 246 (4926), 64-71 (1989).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nature Protocols. 2 (3), 715-726 (2007).
- Heck, A. J., Van Den Heuvel, R. H. Investigation of intact protein complexes by mass spectrometry. Mass Spectrom Review. 23 (5), 368-389 (2004).
- Boeri Erba, E., Petosa, C. The emerging role of native mass spectrometry in characterizing the structure and dynamics of macromolecular complexes. Protein Science. 24 (8), 1176-1192 (2015).
- Laganowsky, A., Reading, E., Hopper, J. T. S., Robinson, C. V. Mass spectrometry of intact membrane protein complexes. Nature. 8 (4), 639-651 (2013).
- Benesch, J. L. Collisional activation of protein complexes: picking up the pieces. Journal of the American Society for Mass Spectrometry. 20 (3), 341-348 (2009).
- Tian, Y., Han, L., Buckner, A. C., Ruotolo, B. T. Collision Induced Unfolding of Intact Antibodies: Rapid Characterization of Disulfide Bonding Patterns, Glycosylation, and Structures. Analytical Chemistry. 87 (22), 11509-11515 (2015).
- Eschweiler, J. D., Rabuck-Gibbons, J. N., Tian, Y., Ruotolo, B. T. CIUSuite: A Quantitative Analysis Package for Collision Induced Unfolding Measurements of Gas-Phase Protein Ions. Analytical Chemistry. 87 (22), 11516-11522 (2015).
- Hopper, J. T., Oldham, N. J. Collision induced unfolding of protein ions in the gas phase studied by ion mobility-mass spectrometry: the effect of ligand binding on conformational stability. Journal of the American Society for Mass Spectrometry. 20 (10), 1851-1858 (2009).
- Politis, A., et al. Topological models of heteromeric protein assemblies from mass spectrometry: application to the yeast eIF3:eIF5 complex. Chemical Biology. 22 (1), 117-128 (2015).
- Morgner, N., et al. Hsp70 forms antiparallel dimers stabilized by post-translational modifications to position clients for transfer to Hsp90. Cell Reports. 11 (5), 759-769 (2015).
- Lai, Y. T., et al. Structure of a designed protein cage that self-assembles into a highly porous cube. Nature Chemistry. 6 (12), 1065-1071 (2014).
- Levy, E. D., Boeri Erba, E., Robinson, C. V., Teichmann, S. A. Assembly reflects evolution of protein complexes. Nature. 453 (7199), 1262-1265 (2008).
- Sharon, M., et al. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Jurneczko, E., Barran, P. E. How useful is ion mobility mass spectrometry for structural biology? The relationship between protein crystal structures and their collision cross sections in the gas phase. Analyst. 136 (1), 20-28 (2011).
- Politis, A., Schmidt, C. Structural characterisation of medically relevant protein assemblies by integrating mass spectrometry with computational modelling. Journal of Proteomics. 175, 34-41 (2017).
- Zhou, M., et al. Mass spectrometry of intact V-type ATPases reveals bound lipids and the effects of nucleotide binding. Science. 334 (6054), 380-385 (2011).
- Barrera, N. P., Booth, P. J., Robinson, C. V. Micelles Protect Membrane Complexes from Solution to Vacuum. Science. 321 (5886), 243-246 (2008).
- Konijnenberg, A., et al. Global structural changes of an ion channel during its gating are followed by ion mobility mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 17170-17175 (2014).
- Schmidt, C., Beilsten-Edmands, V., Mohammed, S., Robinson, C. V. Acetylation and phosphorylation control both local and global stability of the chloroplast F1 ATP synthase. Scientific Reports. 7, 44068 (2017).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Research. 45 (20), 12025-12038 (2017).
- Pagel, K., Natan, E., Hall, Z., Fersht, A. R., Robinson, C. V. Intrinsically disordered p53 and its complexes populate compact conformations in the gas phase. Angewandte Chemie. 52 (1), 361-365 (2013).
- Afonso, J. P., et al. Insights into the structure and assembly of the Bacillus subtilis clamp-loader complex and its interaction with the replicative helicase. Nucleic Acids Research. 41 (9), 5115-5126 (2013).
- van Duijn, E. Current limitations in native mass spectrometry based structural biology. Journal of the American Society for Mass Spectrometry. 21 (6), 971-978 (2010).
- Susa, A. C., Xia, Z., Williams, E. R. Native Mass Spectrometry from Common Buffers with Salts That Mimic the Extracellular Environment. Angewandte Chemie. 56 (27), 7912-7915 (2017).
- Breukera, K., McLafferty, F. W. Stepwise evolution of protein native structure with electrospray into the gas phase, 10 to 10 s. Proceedings of the National Academy of Sciences of the United States of America. 105 (47), 18145-18152 (2008).
- Robinson, C. V., et al. Probing the Nature of Noncovalent Interactions by Mass Spectrometry. A Study of Protein-CoA Ligand Binding and Assembly. Journal of the American Chemical Society. 118 (36), 8646-8653 (1996).
- Shimon, L., Sharon, M., Horovitz, A. A method for removing effects of nonspecific binding on the distribution of binding stoichiometries: application to mass spectroscopy data. Biophysical Journal. 99 (5), 1645-1649 (2010).
- Dyachenko, A., Gruber, R., Shimon, L., Horovitz, A., Sharon, M. Allosteric mechanisms can be distinguished using structural mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 110 (18), 7235-7239 (2013).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. Journal of Visualized Experiments. 19 (40), (2010).
- Marty, M. T., et al. Bayesian deconvolution of mass and ion mobility spectra: from binary interactions to polydisperse ensembles. Analytical Chemistry. 87 (8), 4370-4376 (2015).
- Allison, T. M., et al. Quantifying the stabilizing effects of protein-ligand interactions in the gas phase. Nature Communications. 6, 8551-8561 (2015).
- Sivalingam, G. N., Yan, J., Sahota, H., Thalassinos, K. Amphitrite: A program for processing travelling wave ion mobility mass spectrometry data. International Journal of Mass Spectrometry. 345-347, 54-62 (2013).
- Morgner, N., Robinson, C. V. Massign: an assignment strategy for maximizing information from the mass spectra of heterogeneous protein assemblies. Analytical Chemistry. 84 (6), 2939-2948 (2012).
- Bush, M. F., et al. Collision Cross Sections of Proteins and Their Complexes: A Calibration Framework and Database for Gas-Phase Structural Biology. Analytical Chemistry. 82, 9557-9565 (2010).
- Ruotolo, B. T., Benesch, J. L., Sandercock, A. M., Hyung, S. J., Robinson, C. V. Ion mobility-mass spectrometry analysis of large protein complexes. Nature Protocols. 3 (7), 1139-1152 (2008).
- Lanucara, F., Holman, S. W., Gray, C. J., Eyers, C. E. The power of ion mobility-mass spectrometry for structural characterization and the study of conformational dynamics. Nature Chemistry. 6 (4), 281-294 (2014).
- Wyttenbach, T., Bowers, M. T. Structural stability from solution to the gas phase: native solution structure of ubiquitin survives analysis in a solvent-free ion mobility-mass spectrometry environment. Journal of Physical Chemistry B. 115 (42), 12266-12275 (2011).
- Marcoux, J., Robinson, C. V. Twenty years of gas phase structural biology. Structure. 21 (9), 1541-1550 (2013).
- Michaelevski, I., Kirshenbaum, N., Sharon, M. T-wave ion mobility-mass spectrometry: basic experimental procedures for protein complex analysis. Journal of Visualized Experiments. (41), (2010).
- Mesleh, M. F., Hunter, J. M., Shvartsburg, A. A., Schatz, G. C., Jarrold, M. F. Structural Information from Ion Mobility Measurements: Effects of the Long-Range Potential. Journal of Physical Chemistry A. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chemical Physics Letters. 261, 86-91 (1996).
- Taverner, T., Hernández, H., Sharon, M., Ruotolo, B. T., Matak-Vinković, D., Devos, D., Russell, R. B., Robinson, C. V. Subunit Architecture of Intact Protein Complexes from Mass Spectrometry and Homology Modeling. Accounts of Chemical Research. 41 (5), 617-627 (2008).
- Wysocki, V. H., Joyce, K. E., Jones, C. M., Beardsley, R. L. Surface-induced dissociation of small molecules, peptides, and non-covalent protein complexes. Journal of the American Society for Mass Spectrometry. 19 (2), 190-208 (2008).
- Hall, Z., Politis, A., Bush, M. F., Smith, L. J., Robinson, C. V. Charge-state dependent compaction and dissociation of protein complexes: insights from ion mobility and molecular dynamics. Journal of the American Chemical Society. 134 (7), 3429-3438 (2012).
- Hyung, S. J., Robinsons, C. V., Ruotolo, B. T. Gas-Phase Unfolding and Disassembly Reveals Stability Differences in Ligand-Bound Multiprotein Complexes. Chemistry & Biology. 16, 382-390 (2009).
- Hall, Z., Politis, A., Robinson, C. V. Structural modeling of heteromeric protein complexes from disassembly pathways and ion mobility-mass spectrometry. Structure. 20 (9), 1596-1609 (2012).
- Woods, L. A., Radford, S. E., Ashcroft, A. E. Advances in ion mobility spectrometry-mass spectrometry reveal key insights into amyloid assembly. Biochimica et Biophysica Acta. 1834 (6), 1257-1268 (2013).
- Daubenfeld, T., Bouin, A. P., van der Rest, G. A deconvolution method for the separation of specific versus nonspecific interactions in noncovalent protein-ligand complexes analyzed by ESI-FT-ICR mass spectrometry. J Am Soc Mass Spectrom. 17 (9), 1239-1248 (2006).
- Loo, J. A. Studying noncovalent protein complexes by electrospray ionization mass spectrometry. Mass Spectrometry Reviews. 16, 1-23 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved