Method Article
Анализ архитектуры белка и белка Ligand комплексов по интегративной структурных масс-спектрометрии
В этой статье
Резюме
Масс-спектрометрия (МС) стала важным инструментом для исследования структуры и динамики макромолекулярных сборок. Здесь мы интегрировать подходы на основе MS допросить комплекс формирования белков и Связывание лиганда.
Аннотация
Белки являются важным классом биологических макромолекул, которые играют многие ключевую роль в клеточных функций, включая экспрессии генов, катализирующих метаболических реакций, репарации ДНК и репликации. Таким образом, глубокое понимание этих процессов обеспечивает критически важную информацию о том, как функции клеток. Интегративная структурные методы MS предлагают структурных и динамичная информация о белка комплекс Ассамблеи, сложные соединения, субъединицы стехиометрии, олигомеризации протеина и Связывание лиганда. Последние достижения в интегративной структурных МС позволили для описания сложных биологических систем, включая большие протеины дна binding и мембранных белков. Этот протокол описывает интеграцию разнообразных данных MS, такие, как родной MS и ионной подвижности масс-спектрометрии (IM-МС) с моделирования молекулярной динамики, чтобы получить понимание ДНК helicase нуклеиназы ремонт комплекс белков. Результате подход обеспечивает рамки для детального изучения лигандом привязки других белковых комплексов, участвует в важных биологических процессах.
Введение
Родной масс-спектрометрических анализ интакт белками и их комплексов осуществляется с помощью электроспрей и нано электроспрей ионизации (Неси), которые сохранили сворачивание белков и non ковалентные взаимодействий во время процесса ионизации1, 2. В родной МС в состоянии почти родной в газовой фазе3,4сохраняются структура белков и их комплексов. Родной MS обнаруживает несколько заряженных белков ионов, которые разделены согласно их массы для зарядки соотношение (m/z) позволяет масса белка или белка лиганд комплекс рассчитывается. Эта информация позволяет определение стехиометрии интактных белков, субъединицы композиции, Связывание лиганда и взаимодействия сетей3,4,5,6. Родной MS имеет ряд преимуществ по сравнению с другими методами такие рентгеноструктурного анализа и ядерного магнитного резонанса спектроскопии5. Во-первых родной MS методика быстро и чувствительный, требуя лишь несколько микролитров (2-3 мкл) образца при относительно низких концентрациях окончательный комплекс в высокой Нм до низкой мкм диапазон6. Во-вторых родной MS может использоваться допросить образцы гетерогенных белков, что позволяет анализировать несколько белков и олигомерные государств одновременно. В-третьих родной MS не требуют образцы протеина быть изменен до анализа химической сшивки или белка маркировки. Эти преимущества сделали структурных MS мощный инструмент для структурной расследования белковых комплексов.
Родной MS может сочетаться с ионной подвижности (IM), техника, которая измеряет время, необходимое для путешествия через электрическое поле, белок-Ион, позволяя Столкновительное поперечного сечения (CCS), которые будут определены. CCS предоставляет разрешением структурную информацию, которая позволяет топологии и конформационные неоднородности информации белков, которые могут быть получены. Кроме того он позволяет изучение структурных моделей белков порожденных вычислительной подходы.
Белка газовой фазы стабильности могут расследоваться столкновения, индуцированных разворачивается (КИУ) измеряется с помощью IM-MS. Во время процесса ОРЖ белок ионы ускорился и активирована через повышение ускорения столкновения с инертной буферного газа в масс-спектрометр7,8,9. Этот процесс Столкновительное активации вызывает белок частично разворачиваться, что приводит к увеличению в уху. Это изменение в уху и энергия, необходимая для разворачиваться белка может быть измерено с использованием IM-г-жа этот подход, эффект привязки лигандов на стабильность белков может быть измеренной10. Субкомплексы могут создаваться в решения с помощью нарушения в решение методы, такие как добавление органических растворителей для мониторинга топологии родной как белковых комплексов. Срыв белковых комплексов в основном за счет нарушения non ковалентные взаимодействий внутри. Суб комплексы сохранить родной как топологий и, при обнаружении MS, раскрыть информацию о межучрежденческой подгруппы подключения.
Интеграционные подходы в структурной биологии комбинировать различные методы изучения структуры и динамики белков и их комплексов3,4,5,6. Родной MS и IM-MS использовались раскрыть молекулярных детали сложных биологических систем. Там было несколько примеров приложений, включая изучение белков Ассамблеи пути11,12,13,14, изучая сетей взаимодействия протеин15 , 16 , 17, мембранные белки6,18,19,20,21и белка лиганд взаимодействиями, такими как нуклеиновые кислоты22,23 ,24.
Однако родной МС также имеет свои ограничения. Родной MS измерения часто выполняются в летучих буферов как водный аммония ацетат, в котором некоторые белки не сохранит их сложить родного государства3,25. Тем не менее последние исследования показали, что это ограничение можно преодолеть путем оптимизации распыления диаметра кончика иглы (0,5 мм советы), таким образом, что белка и протеина сложного ионов может быть сформирован непосредственно из энергонезависимой буферов с высокой ионной силы, которые лучше имитации физиологической среды26. Кроме того родной MS использует электроспрей ионизировать и передачи non ковалентные сборок из раствора в газовой фазе; Таким образом относительное обилие обнаруженных комплексов может не представлять полностью, в раствор5,27. Кроме того в сравнении к в растворе, газовой фазы гидрофобных взаимодействий становятся слабее и электростатического взаимодействия становятся сильнее и поэтому выступает за3,28.
В этой статье мы предоставляем протоколы, анализа данных и интерпретации для идентификации белков и привязка с использованием родного MS, IM-MS, КИУ, срыв в раствор и моделирования лигандов. Ремонт комплекса ДНК, Гера-Нура, используется в качестве модели системы. Двуцепочечные разрывы ДНК (DSBs) являются одним из самых цитотоксических и пагубных форм повреждения ДНК, что приводит к генетической нестабильности и возможного развития рака в организме человека. Гомологичная рекомбинация является ремонт механизма, которая искореняет DSBs, процесс, который руководил комплекс, Гера-Нура СПС зависимых helicase нуклеиназы22.
Комбинируя родной MS и IM-MS с функциональных анализов и моделирования позволили расследование: i) роль Нура в Ассамблее, конформация и стабильности комплекса, ii) взаимодействия между dsDNA и комплекса и его влияние на общий стабильность комплекса и iii) стехиометрии и воздействия СПС привязки на Ассамблее22. В целом эта работа привели к улучшению понимания молекулярные основы комплекса HerA-Нура, связывая комплекс конформационные изменения протеина и стабильности с привязкой нуклеотидов. Этот протокол является универсальным для любого белка complex(es), который взаимодействует с одним или несколькими типами ligand(s).
протокол
1. Пробоподготовка для родной MS белка и протеина Ligand комплексов
Примечание: Чтобы получить понимание молекулярных основе комплекс белков и лигандом привязку, используя родной MS, подготовка подходящих образца является ключом. Целью этого раздела является выделить шаги подготовки необходимых образцов до MS анализ с использованием комплекса HerA-Нура, который связывает ДНК и нуклеотидов в качестве примера.
- Подготовка 20 мкл аликвоты концентрированный очищенный протеин (обычно 15-30 мкм) в 1,5 мл.
-
Для анализа АТФ и АДФ привязки
Примечание: Добавить увеличение концентрации не гидролизуется АТФ аденозин аналоговый 5′-O-(3-thiotriphosphate), tetralithium соли (АТФ γ-S) или 5′ аденозиндифосфат (ADP). Non гидролизуется СПС производные генерировать стабильный комплекс, который позволит СПС прыгните белка, чтобы быть захвачен. Другие не hydrolysable аналогов СПС, которые могут быть опробованы включают AMP-PNP и АТФ γ-S-Mg2 +.- Для исследования Гера-Нура, смесь 5 мкм очищенный протеин с АТП γ-S и ADP в концентрациях от 0-1 мм.
- Чтобы захватить одновременной привязки АТФ γ-S и ADP, добавьте оба нуклеотидов в одной или разных концентрациях.
- Добавить 2 мм MgCl2 и инкубировать при 25 ° C в инкубаторе сухой ванна на 1 ч.
Примечание: Анализ нуклеотидных привязки с помощью Неси родной MS может привести к артефакта привязки при высоких концентрациях, поэтому неспецифической привязки необходимо учитывать счет29. Расследовать без конкретной привязки, добавьте более высокую концентрацию нуклеотидов между 2-5 мм).
-
Для анализа ДНК привязки
- Mix белков и ДНК в молярное соотношение, которое позволяет для формирования сложных белков ДНК. Гера и Гера-Нура Смешайте 5 мкм очищенный протеин с ДНК в соотношении 1:1.
- Инкубируйте HerA-Нура или Гера - ДНК смесь для 30 мин при 25 ° C в инкубатор сухой ванны до тех пор, пока он достигает равновесия. Продолжительность и температура инкубации может варьироваться в зависимости от белков под следствием.
- Буфер обмена белков образцы MS совместимы буферы. Часто используются водные аммония ацетат раствор между мм-1, 5м при рН 7-8. Другие совместимые буферов MS включают ethylenediammonium диацетата (Эдда) и Triethylammonium ацетат (TEAA)30. Для исследования Гера-Нура используйте 200 мм аммония ацетат рН 7.
Примечание: Есть несколько методов для буфера обмена до анализа MS например используя концентратор спина или хроматографии столбцы. Родной MS ограничивается главным образом качество образца, такие как буферы и аддукты использован во время очистки. Таким образом важно выполнять достаточно обессоливания для получения разрешения пиков. - Гера-Нура лигандом привязки исследований буфера обмена образцами 6 - 8 раз в 200 мм аммония ацетат, используя концентратор. Хотя этот метод занимает больше времени, он гарантирует, что решить, что достичь вершины и позволяет для точного определения массы связанных видов СПС/ADP.
2. родной MS сбора и анализа данных для изучения белковых комплексов и комплексов протеина лиганд
Примечание: MS условия должны быть оптимизированы для достижения весьма решена пиков для точных измерений массы. Этот раздел детали оптимизированы параметры на Q-ToF масс-спектрометр с 32 k квадрупольного m/z верхний предел.
- Подготовка внутренних капилляров для нано электроспрей и массового калибровки инструмента для точных измерений массы, как подробно указано в Киршенбаум et al. 1.
- Выберите чувствительность, приобретение положительных ионов и мобильность TOF режимы.
- Включите газы ловушку, API и IMS. Для разделения IM использовать азот (60 мл/мин) и аргон (8.4 мл/мин для региона ловушки) в качестве отправной точки, а затем настроить.
- Установите диапазон приобретения соответствующей m/z. Для неизвестного протеина, оптимизации первоначальные шаги следует использовать широкий диапазон например 500-32000 m/z.
- Загрузка 2-3 мкл белка комплексное решение быть проанализированы в золото покрытием капилляров и вставить его в капиллярной держатель.
- Аккуратно завинтите капилляра и место капилляра в стадии источник электроспрей и слайд сцену в состоянии начать получение данных.
- Применить давление газа низкого нано потока (0.00-0,05 бар) до тех пор, пока капля формируется на кончике капилляра. Нано-напорной затем может быть удален до тех пор, пока сохраняется спрей.
- Отрегулировать капилляров в отношении конуса, перемещая капилляра x, y, z позиции и контролировать ионный ток для достижения стабильного Ион текущей. Применить капиллярного напряжения в диапазоне от 0,9-1,6 кв.
- Установите конус выборки (50-120 V), смещением источника (60.0), источник температурой (25 ° C) и конус газового потока (0.0 Л/ч). Эти предлагаемые исходные условия может быть скорректирована.
- Приобрести хорошо решен массовых спектр и увеличить Ион передачи, настроить параметры MS и контролировать изменение в спектрах. Среди них регулируя поток газа в ловушку (2-8 мл/мин), он клеток (180 мл/мин) и IMS клеток (90 мл/мин) для достижения лучших разделения на максимальной передачи.
- Настройте ловушки столкновения энергий, если напряжение смещения являются недостаточными. Оптимальной отправной точкой составляет 10-50 V.
Примечание: Увеличение энергии ловушки можно удалить не ковалентно связанными аддукты. Однако Позаботьтесь, чтобы избежать столкновения индуцированной диссоциации и разворачивается комплекса белков лиганд. Выполнения измерений Ион мобильности для проверки, если инструмент условия сохраняют белка в родной сложенном состоянии (шаг 3). - Улучшение desolvation, оптимизируя напряжения смещения ловушку. Оптимальной отправной точкой является 20-45 V.
- Оптимизируйте скорость волны и волны высотой до достижения лучших мобильности разделения. Подробное объяснение и протокола можно найти здесь31. Для исследования HerA-Нура используйте скорость волны 40 (m/s) и высота волны 550-650 (V).
- Используйте все другие параметры как инструмент по умолчанию значения.
- Подготовка лиганд бесплатные образцы для анализа как элемент управления для каждого запуска (Рисунок 1). Для экспериментов Связывание лиганда выполните по крайней мере три независимых измерений.
- Используйте программное обеспечение Masslynx для измерения массы созданных видов и идентифицировать лигандом привязки, например АТФ и АДФ привязки и олигомерные государств (рис. 2 и 3). Другие программного обеспечения включают в себя UniDec32, PULSAR33 и34Амфитрита.
- Чтобы подсчитать относительное обилие видов, используйте соответствующее интенсивности Ион, наблюдается в сырье ESI-МС спектры (например лигандом связан, различные олигомеров и т.д.). Кроме того выполните количественную оценку, с помощью специализированного программного обеспечения, как UniDec и Massign35 (рис. 1 и 3 ).
3. получение и анализ IM-MS
Примечание: IM-MS отделяет ионов в газовой фазе, основанные на их размер (массы), форма и заряд. Каждая функция решены в спектре m/z связан с распределением времени дрейфа. IM-MS измеряет время дрейфа ионов, который может использоваться для расчета сечения столкновения (CCS). Значения смещения времени измеряется от IM-MS полученные данные с помощью Дрифт трубка может быть линейно соотнесена CCS значения36. Для путешествия волны IM-мс (TWIMS) измерения, расчета значений CCS требует калибровочной кривой, полученной от стандартов протеина с известными CCS значения37. Компактный структур путешествовать быстрее, чем расширенный или удлиненные структур из-за сокращения взаимодействия с буферного газа в мобильности ячейки38. Таким образом IM-MS может использоваться для обнаружения, если родной складчатые структуры была сохранена в газовой фазе39,40. В этом разделе описывается, как измерить IM-MS и рассчитать CCS протеина используя TWIMS.
- После оптимизации инструмент условий для стабильной передачи (Шаг 2), уменьшите Столкновительное энергии и выборки конус как можно более низкой сохраняя качество хорошее спектров.
- Используйте оптимизированные волны скорость и высота волны приобрести IM-мс (Шаг 2).
- Ионный дрейф измерить время с IM-МС на три различные волны скорости (например, 550, 600 и 650 м/с) при сохранении той же высоте волны (например, 40 V).
- Для определения белков ионы CCS, мера белка calibrants на тех же условиях инструмент используется для белков под следствием. Оптимальной калибровки Дрифт время требует измерения белков с известными CCS.
- Выберите четыре calibrants, два с массой выше и два с массой ниже белков под расследования37. Самое главное убедитесь, что высота волны и скорость волны являются такими же, как записаны для белков под следствием.
- Вычисление вручную CCS41 или с помощью специализированного программного обеспечения таких как Пульсар33 и Амфитрита34 (рис. 5).
- Чтобы проверить, является ли белок родной как в газовой фазе, сравнение экспериментальных УХУ для теоретической CCS получены высоким разрешением структур. Гера-Нура Рассчитайте теоретическую CCS, используя метод проекции аппроксимации (PA), используемый в MOBCAL42. Другие методы включают траектории метод (TM)42 и точное жесткий сферы, рассеяние (EHS)43.
4. решение нарушение белковых комплексов для родной MS и IM-MS привело определения структуры
Примечание: Подпункт комплексы протеина можно в некоторых случаях определить от то же решение, что нетронутыми комплекс. Однако далее структурной информации, такие как межучрежденческого подразделения связи и сложные Ассамблеи можно достигнуть от нарушения взаимодействия протеина в растворе, в форме суб комплексов. Это может быть достигнуто несколькими способами, например, добавление органических растворителей, увеличивая ионной силы или манипулирования pH. Чтобы разобраться в HerA-Нура Субблок подключения и сложных Ассамблеи, суб комплексы были созданы в растворе путем добавления растворителей, которые возмущают Субблок взаимодействий.
- Подготовьте белка образца и буфер обмена в Ацетат аммония, как описано в шаге 1.
- Добавьте 10-40% растворителя с шагом в 10%. Обычно используются растворители являются метанол (метанола), диметилсульфоксида (ДМСО) или Ацетонитрил (АКС).
Примечание: Это может быть проведена в пределах Трубы полипропиленовые microcentrifuge. - Инкубируйте смесь на льду за 1 час.
- Приобрести IM-МС спектра для каждого условия (шаги 2 и 3) (рис. 4).
- Используйте программное обеспечение саммита44 назначать суб комплексы протеина и создания сетей взаимодействия протеина. Кроме того вручную создайте список теоретической массы ожидаемых видов.
- Чтобы убедиться, что Субкомплексы сложены, рассчитать экспериментальные значения УХУ для суб комплексов и сравнить с теоретической CCS, как описано в шаге 3 (Таблица 1, Рисунок 5 и Рисунок 6).
5. расследование комплекс стабильность белков с помощью столкновения индуцированной разворачивалась (КИУ)
Примечание: ОРЖ может использоваться зонд структурную стабильность белков и их комплексов на Связывание лиганда. Специалист программных пакетов как Пульсар33, Амфитрита34 и CIU люкс9 может затем использоваться для моделирования разворачивается газовой фазы белка под следствием с и без лиганда. В качестве примера в этом разделе описаны процедуры для контроля газовой фазы разворачивается траекторий и стабилизирующее влияние ДНК и АТФ привязки на комплексе HerA-Нура.
- IM-MS данные записи во время увеличения ловушки ускорение напряжение с напряжением от 10 до 200 V в 2-10 V постепенно разворачиваться белка в газовой фазе.
Примечание: Запись небольших приращений результаты в нескольких файлах данных для обработки, однако такой подход обеспечивает более решена разворачивается сюжет, который имеет важное значение для анализа точки перехода между сложить/развернулась видов. - Анализ данных, полученных с помощью PULSAR33, Амфитрита34 или CIU люкс9 и генерировать двумерные разворачивающейся участков в единицах УХУ как функция ускорения напряжения (Шаг 3). Для каждого состояния заряда это создается путем укладки интенсивности-нормированный CCS дистрибутивов на каждом ускоряющего напряжения (рис. 7 A-Би).
- Генерировать теоретической разворачивается сюжет, используя один из пакетов программного обеспечения. Данные будут устанавливаться разворачивается модели. Это делает возможным количественно Столкновительное энергии, на котором разворачивается переходы происходят и определяют стабильность белков с и без связанных лигандов33. Разворачивающихся переход при видов переходы из одного состояния (на основе их экспериментальных величин CCS) другому государству с большей CCS.
- Чтобы quantitate переходы, вычислить переходного midpoint(s) между государствами, используя алгоритмы и программное обеспечение, такие как «Пульсар»33. Это обычно сообщается как CV50, который является значением напряжения столкновения (ловушка), в котором обедненный 50% конкретного государства.
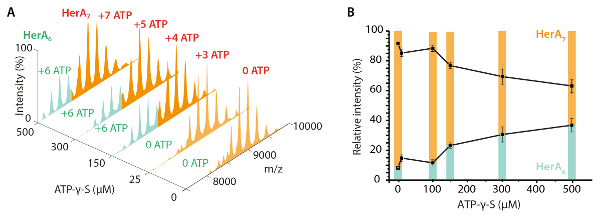
- Используя значение50 CV, вычислить общее внутренней энергии ионов, с использованием центра масс столкновения энергию KE (COM)45. KECOM определяется общей внутренней энергии для разворачивающихся перехода ионов и рассчитывается от кинетической энергии и массы столкновения партнеров (Ион белка и нейтрального газа), как описано в уравнение (1)10
KEcom (eV) =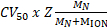 (уравнение 1).
(уравнение 1).
Где Z -заряд иона,N M — масса нейтрального газа и MИон -масса белка-иона.
Примечание: Это потому, что КИУ белков является заряд dependent46, 47. Рекомендуется для выполнения анализа KECOM для более чем одного состояние заряда (Aii Рисунок 7).
6. Моделирование процедуры для дифференциальной молекулярной динамики моделирования, используемых в интегративной MS
Примечание: Использование модели субблоков протеина или комплексы такие как из кристаллических структур, дифференциальной MD моделирования (белкового комплекса, с и без лигандом) может использоваться для определения последствий например лигандом присутствия на структуры белков и динамику. В этом разделе описывается рабочий процесс и инструменты, необходимые для моделирования процедуры, необходимые для настройки моделирования дифференциального молекулярной динамики.
- Определение подразделений, составляющих комплекс (рис. 8A, шаги 2 и 3). Источник существующие модели подразделения, например, кристаллические структуры от RCSB банка данных (https://www.rcsb.org). UniProt, которую вход белка будет содержать список знаю кристаллографических/NMR структуры (http://www.uniprot.org). Если они не доступны, теоретической последовательности могут быть введены для взрыва определить подходящие шаблоны для моделирования гомологии (http://blast.ncbi.nlm.nih.gov/).
- Соберите комплекс в правильной топологии (Рисунок 8A-ii). Это может быть сделано с помощью различных методов. Отдельные подразделения могут быть установлены в карты доступна электронная микроскопия, найдены на EMDB собрать нетронутыми комплекс (https://www.ebi.ac.uk/pdbe/emdb/). Учебник для установки PDBs в EM карты с использованием молекулярной динамики гибкий монтаж (MDFF) можно найти здесь: http://www.ks.uiuc.edu/Training/Tutorials/science/mdff/tutorial_mdff-html/.
- Определите недостающие регионах комплекса (Рисунок 8A-iii). Выполните несколько выравнивание последовательностей (MSA) между PDB и теоретической последовательности для выявления остатков, которые могут быть неспособным в кристаллических структур, или каких-либо мутаций, унаследованные от кристаллографических экспериментов. MSA может производиться с использованием серверы как T-кофе (http://tcoffee.crg.cat/apps/tcoffee/do:regular).
- Восстановите отсутствующие остатков через гомологии моделирования (Рисунок 8A-iv). Недостающие остатки комплекс белков может быть построен с помощью программы MODELLER (https://salilab.org/modeller/). МОДЕЛЬЕР может выводить ансамбль n моделей в различных конфигурациях регенерированный. Хорошие модели могут быть определены на основе их оценка дискретной оптимизации белка энергии (ДОПИНГ). Всеобъемлющее руководство предоставляется на веб-сайте программного обеспечения (https://salilab.org/modeller/tutorial/).
- Осуществлять дифференцированный молекулярной динамики (MD) моделирование комплекс белков (рис. 8B) для идентификации регионов белков, которые реагируют на конкретного изменения окружающей среды, например, наличие лиганда. В таких моделирования, поведенческих параметров от моделирования A (только белок) который выступает в качестве ссылки, вычитается из моделирования B (белок + лигандом). Дифференциальной Среднее квадратическое колебания (RMSF), рассчитанное в интервале между A и B моделирование может сообщить на регионы белка, увеличение или уменьшение гибкости лигандом зависимым образом.
- Выполните моделирование MD и ниже по течению анализа с использованием GROMACS (http://www.gromacs.org). Учебник можно найти на: http://www.bevanlab.biochem.vt.edu/Pages/Personal/justin/gmx-tutorials/Lysozyme/index.html. Elimate модель пристрастие сначала должны создаваться структура комплекса лиганд прыгните. Белок затем копируется из этого без лиганд, приносить белка модель идентична комплекса лиганд прыгните.
Результаты
Родной MS результаты показали олигомерных государства, состав и топологии комплекса HerA-Нура (рис. 1). Как non ковалентные взаимодействия сохранились в газовой фазе, родной MS АТФ γ-S и ADP титрования экспериментов определяется попарных нуклеотидов привязки Гера-Нура (рис. 2) и что повышение концентрации ATP-γ-S увеличивает относительный интенсивность hexameric Гера (рис. 3). Структурная информация относительно Субблок взаимодействия были получены от нарушения-решение, следуют родной MS и были согласны с и теоретической массы (рис. 4 и таблица 1).
Экспериментальные значения УХУ белков и их комплексов была получена от IM-MS экспериментов (рис. 5). Эти ценности вращательно усредненной газовой фазы поперечного сечения расчеты молекулярных фигуры и описать состояние мерных белка. CCS значения сравниваются с теоретических измерений от рентгеноструктурного анализа и хорошее соглашение выводит, что родной фигуру в сохранить в газовой фазе (таблица 1). Это проверяет, используя CCS значения для построения моделей с низким разрешением белка Ассамблеи48.
Экспериментальная ККСС могут быть рассчитаны для каждого иона состояние заряда. Конформером родной как белка может привести к возникновению для зарядки состояние ионов с аналогичными значениями CCS. Однако высокий заряд состояние ионов увеличилось кулоновских repulsions, которые могут привести к белка газовой фазы разворачивается и больше CCS значения по сравнению с теоретическим ККСС. CCS значение низкий заряд ионов, поэтому обычно используется в49. Для HerA-Нура, срыв в решение эксперименты на Гера и Гера-Нура и без ДНК побудило поколения Ассамблее путь, начиная с мономеров, то формирование весь hexameric Гера (6Гера)-комплекс димерной Нура (2Нура) с ДНК (рис. 6).
Различия в разворачивающихся участков CIU АПО (лигандом бесплатно) и связанными лиганда определить изменения в сложных стабильности на Связывание лиганда. Выше резюме50 или KECOM значение подразумевает более стабилизированный Ион в газовой фазе. CIU и KECOM анализ показал, что ДНК прыгните Гера-Нура является более стабильным, чем ДНК бесплатный комплекс (AiiРисунок 7). Из анализа ГРЖ-MS в соответствующих государствах АТФ привязки четыре АТФ γ-S связанного состояния, уменьшение комплекс стабильность в газовой фазе и шести -АТФ-γ-S связанного состояния, где находятся все места заняты был наиболее стабильных (BiiРисунок 7). Родной MS может выявить дискретных нуклеотидов привязки государства Гере; Однако он не может отличить которые Гера подразделения являются обязательными СПС и где происходит эта привязка. Эта информация может быть получена от явного моделирования растворителей MD hexameric Гера и Гера-Нура после обобщенных рабочего процесса (рис. 8).
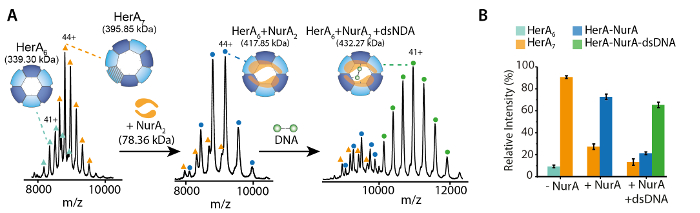
Рисунок 1. Допрос олигомерных государства, состав и топологии HerA-Нура non ковалентные комплекса. (A) массовые спектры HerA, Гера-Нура и Гера-Нура присутствии ДНК (15,4 кДа 25 bp двуцепочечной ДНК). Субкомплекс HerA существует как hexamer и гептамер. Связывает Нура димер и Гера hexamer введении олигомерных преобразования. ДНК связывается сформированное комплекс Гера - Нура (адаптировано из Z. Ahdash et al., 201722результаты). (B) относительной интенсивности выявленных видов рассчитываются с использованием UniDec32. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
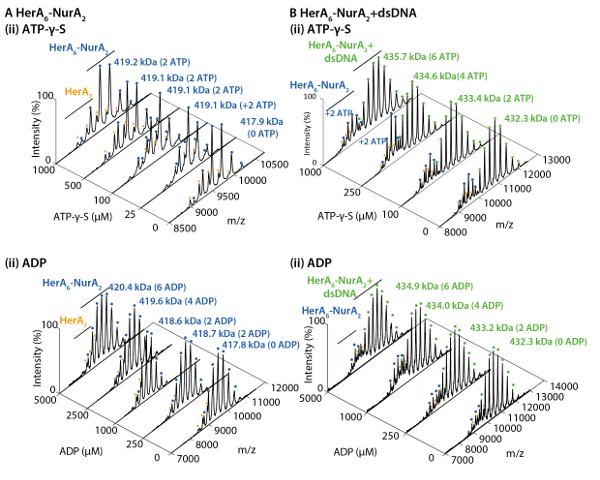
Рисунок 2. Родной ESI-MS раскрывает механизм привязки нуклеотидов, Гера-Нура. Массовые спектры Гера-Нура (A) и (B) Гера-Нура-ДНК с увеличением концентрации (i) СПС γ-S и (ii) ADP. Измеренной массы по сравнению с теоретической массы и количество АТФ γ-S или ADP связаны определяются. Измерения массы и количество связанных нуклеотидов указаны на спектры. ATP-γ-S и ADP титрования эксперименты определяется попарных нуклеотидов привязки Гера-Нура самостоятельно и в комплексе с ДНК, указывающее механизм циклического реакции (адаптировано из Z. Ahdash et al., 201722результаты). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
На рисунке 3. Измерение эффект увеличения концентрации ATP-γ-S на HerA олигомерных государства. (A) массовые спектры Геры на повышение концентрации ATP-γ-S. (B) график, показывающий относительных интенсивностей различных видов из родной MS, рассчитанных с использованием UniDec свёртки программного обеспечения32. С увеличением концентрации ATP-γ-S, относительная интенсивность hexameric Гера также увеличивается. Количество молекул АТФ γ-S связаны показана на спектрах (адаптировано из Z. Ahdash et al., 201722результаты). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
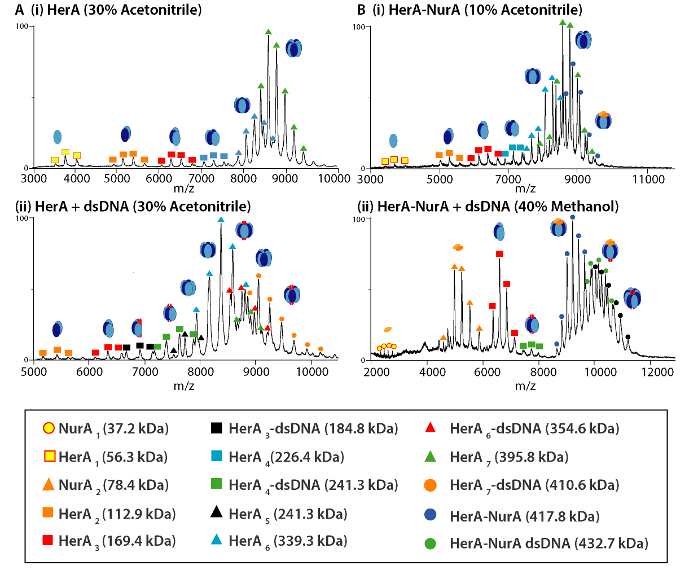
Рисунок 4. Массовые спектры и югу комплекс диссоциации продуктов HerA (A) и (B) Гера-Нура (i) самостоятельно и в присутствии ниже (ii) ДНК-решение нарушения. В решение нарушения были эксперименты с использованием 10-40% ацетонитриле, метанол (метанола) или диметилсульфоксида (ДМСО) и привели к формированию различных Субкомплексы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
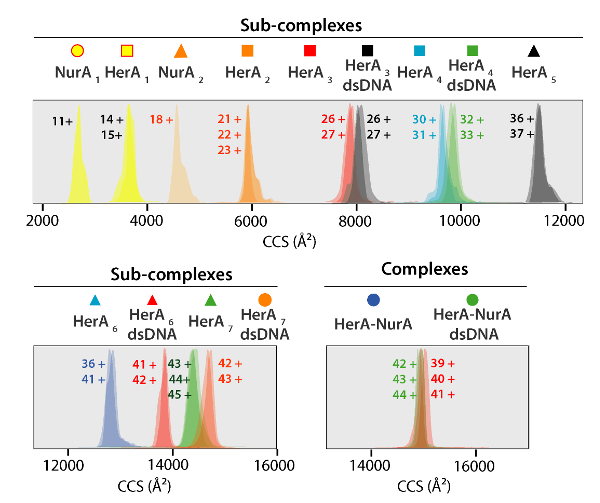
Рисунок 5. Ион мобильности прибытия время распределение показано на оси УХУ для комплексов и сгенерированный суб комплексов. Значок для каждого югу комплекс соотносятся с теми комментариями на спектры на рисунке 4. Экспериментальные и расчетные массы и CCS значения суб комплексов, перечислены в таблице 1 , все из которых показал, что соглашение между экспериментальных и расчетных значений (после рассмотрения типичных неопределенности в резолюции путешествия волны Ион мобильности масс-спектрометрия37± 5 - 8%). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
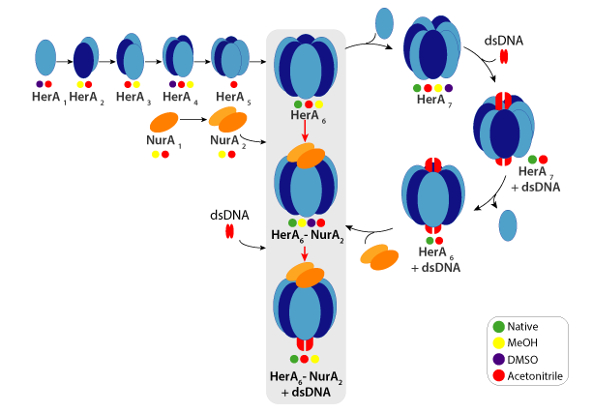
Рисунок 6. Путь сборки комплекса HerA-Нура, образующиеся-решение нарушением родной MS и IM-г-жа цветные круги обозначают условия, где каждый субкомплекс было отмечено: родной (зеленый, ранее нарушения), метанол (желтый), ДМСО (фиолетовый) или Ацетонитрил (красный). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7. Расследование стабилизирующий эффект (A) ДНК на HerA-Нура и (B) СПС связывание Гера-Нура-ДНК. (i) газ фаза ГРЖ-MS участки и (ii) центр массы столкновения энергий (KEcom) вычисления показывают, что присутствие dsDNA стабилизирует комплекс HerA-Нура и что шесть АТФ γ-S государства является наиболее стабильным. Показано стабилизации для заряда различных государств. Участки были созданы с помощью «Пульсар» 33. Результаты от (A) взято из Z. Ahdash et al., 201722. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
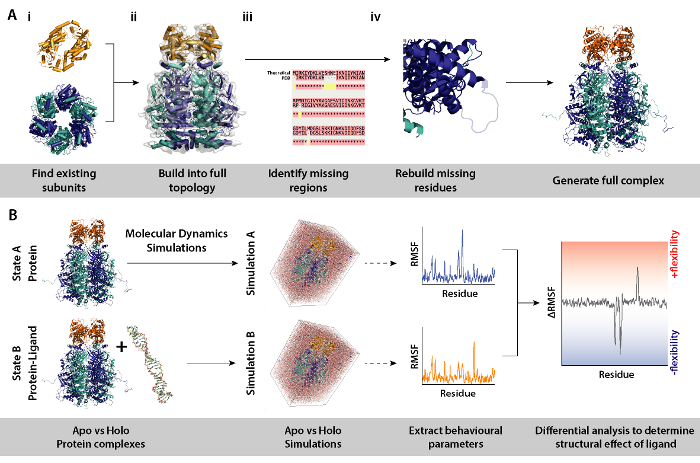
Рисунок 8. Рабочий процесс для процедур моделирования для дифференциальной молекулярной динамики. (A) создание комплекса под следствием путем создания топологии из существующих подразделений и восстановления отсутствующих остатков. (B) рабочий процесс для запуска моделирования молекулярной динамики на комплекс с и без лигандом белков. Молекулярной динамики, что моделирование побежал для белок только который действует как ссылка и которая вычитается из моделирования белка плюс лиганда. Это сопровождается расчета колебаний дифференциального квадратного корня (RMSF) между моделирования и определения эффект Связывание лиганда. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Комплекс / югу комплекс | Теоретическая масса (кДа) | Экспериментальный масса (кДа) | Теоретические CCS (Å2) | Экспериментальный CCS (Å2) [бесплатно] | Условие HN |
| Гера6- Нура2 | 416.22 | 417,85 | 14531 | 14577 [42 +] 14599 [43 +] 14608 [44 +] 14637 [45 +] | 10-20% ACN, 10-40% ДМСО, 10% метанола |
| Гера6- Нура2- dsDNA | 431.72 | 432.27 | - | 14661 [39 +] 14728 [40 +] 14781 [41 +] 14837 [42 +] | ACN на 10%, 10% метанола |
| Нура1 | 39.12 | 38.18 | 3254 | 2618 [10 +] 2746 [11 +] 2878 [12 +] | 10-40% ACN, 10% метанола, 20-40% ДМСО |
| Нура2 | 78.24 | 78.36 | 4890 | 4903 [16 +] 4614 [17 +] 4537 [18 +] 4666 [19 +] | 10-40% метанола, 20-40% ДМСО |
| 1 Гера | 56.33 | 56,32 | 4131 | 3647 [14 +] 3792 [15 +] 3950 [16 +] | ACN НА 10-40%, 40% ДМСО |
| Гера2 | 112.66 | 112.95 | 6475 | 5648 [20 +] 5747 [21 +] 5842 [22 +] 5996 [23 +] | 40% meth, 10-40% ACN |
| Гера3 | 168.99 | 169.39 | 8607 | 7501 [25 +] 7616 [26 +] 7717 [27 +] 7867 [28 +] | 10-40% метанола, может 10-40%, 40% ДМСО |
| Гера3 + ДНК | 183.99 | 184.976 | - | 7655 [26 +] 7990 [27 +] 8107 [28 +] | 10-30% ACN |
| HerA4 | 225.32 | 226.2 | 10477 | 9205 [30 +] 9287 [31] 9493 [32 +] 9961 [33 +] | 10-40% метанола, 10-40% ACN |
| HerA4 + ДНК | 240.82 | 241.33 | - | 9637 [31 +] 9756 [32 +] 9830 [33 +] | 10-30% ACN |
| Гера5 | 281.65 | 282.75 | 11853 | 10847 [36 +] 10958 [37 +] 11161 [38 +] | 30-40% ACN |
| Гера6 | 337.98 | 339,3 | 12517 | 12335 [38 +] 12386 [39 +] 12498 [40 +] 12590 [41 +] 12676 [42 +] 13019 [43 +] | 10-40% метанола, 10-40% ACN |
| Гера-6 + ДНК | 353.48 | 354.626 | - | 12890 [40 +] 13081 [41 +] 13184 [42 +] 13273 [43 +] 13463 [44 +] 13576 [45 +] | 30% ACN |
| Гера7 | 394.3 | 395.85 | 13901 | 14154 [42 +] 14219 [43 +] 14261 [44 +] 14285 [45 +] 14335 [46 +] | 10-40% метанола, АКС 10-40%, 10-40% ДМСО |
| Гера7 + ДНК | 409,8 | 410.62 | - | 14414 [41 +] 14510 [42 +] 14558 [43 +] 14598 [44 +] 14630 [45 +] 14641 [46 +] | 10% ACN |
Таблица 1. Экспериментальные и расчетные массы и CCS значения Гера-Нура и его подпункта комплексов создается форма в решение срыв исследований.
Обсуждение
МС играет все более важную роль в характеристике стехиометрии, взаимодействий и архитектура Субблок белковых комплексов. IM-MS данные могут использоваться для определения топологических мероприятий подразделений в многокомпонентных комплексов. По сравнению с другими существующими методами структурной биологии, MS имеет несколько преимуществ. Родной MS-это способ быстро и чувствительный и может использоваться для проверки образцов гетерогенных белков. При сочетании с экспериментов в решение нарушения, может контролироваться диссоциации пути сборки белков. Вместе с кристаллические структуры или модели гомологии информации, предлагаемые структурные MS предлагает инструмент для изучения взаимодействий протеин лиганда и обеспечивают почти родной модели и Ассамблеи пути11.
Здесь мы описываем экспериментальных процедур, необходимых для анализа стехиометрии и состав взаимодействий протеин лиганд, с одного или нескольких лигандов, используя интегративной MS. Это включает в себя MS пробоподготовки, сбор данных, анализ данных и интеграции данных MS, с использованием вычислительных средств. Для этого мы использовали ДНК резекция Гера-Нура гетеро олигомерных комплекс белков, обязан три лигандами (ДНК, АТФ и АДФ), как наша модель системы. Протокол показывает использование имеющихся в настоящее время программное обеспечение для анализа и представления данных.
Приобретение спектры высокого качества имеет важное значение для анализа Связывание лиганда, поэтому, тщательно образца подготовительные шаги являются критическими, включая очищение протеина, лигандом титрования и буфера обмена. Одно ограничение Неси родной МС при изучении Связывание лиганда является неспецифической привязки. Неспецифическая привязки возникает во время капелька desolvation на протяжении всего процесса электроспрей. Это увеличивает концентраций лигандов и таким образом изменяет соотношение белка/лигандом29. Связывание нуклеотидов приводит к относительно небольшой массовой разницей между АПО и нуклеотидов прыгните белка, которая не изменяет50,эффективность ионизации51.
Мы использовали систему Synapt G2-Si MS для нашей работы, но протоколы применяются для различных расследований других белков лиганд комплексов с использованием других коммерчески доступных нано электроспрей масс-спектрометров. Интегративной структурных MS играет все более важную роль в решении проблем биологии большей сложности. Рабочий процесс и методы, описанные здесь хорошо подходят для понимания структурных последствий и создания механизмов комплекс белков и белка лиганд формирования, которые иначе трудно исследования с использованием обычных методов структурного .
Раскрытие информации
Отсутствие конфликта интересов объявил.
Благодарности
Мы хотели бы поблагодарить Карл-Петер Hopfner и Роберт Томас Бирн, любезно предоставление образцов белка Гера и Гера-Нура и за их помощь с экспериментальным дизайном. Мы также благодарим д-р Имонн чтения для его рассмотрения рукописи. Мы с благодарностью признаем наши финансирующие органы: Уэллком траст [109854/Z/15/Z] и Королевского общества [RG150216 а.п.].
Материалы
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-(3-thiotriphosphate) tetralithium salt | Merck Millipore | 119120-25MG | |
| Adenosine 5′-diphosphate | Sigma-Aldrich | 20398-34-9 | |
| Ammonium acetate solution | Sigma-Aldrich | A2706 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 7326204 | |
| Vivaspin concentrator | Sartorius | Z614041-25EA | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 246964 | |
| Water TraceSelect | Sigma-Aldrich | 95305 | |
| Borosilicate Capillaries | Harvard Apparatus | 300060 |
Ссылки
- Wilm, M., Mann, M. Analytical Properties of the Nanoelectrospray Ion Source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Fenn, J. B., Mann, M., Meng, C. K., Wong, S. F., Whitehouse, C. M. Electrospray ionization for mass spectrometry of large biomolecule. Science. 246 (4926), 64-71 (1989).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nature Protocols. 2 (3), 715-726 (2007).
- Heck, A. J., Van Den Heuvel, R. H. Investigation of intact protein complexes by mass spectrometry. Mass Spectrom Review. 23 (5), 368-389 (2004).
- Boeri Erba, E., Petosa, C. The emerging role of native mass spectrometry in characterizing the structure and dynamics of macromolecular complexes. Protein Science. 24 (8), 1176-1192 (2015).
- Laganowsky, A., Reading, E., Hopper, J. T. S., Robinson, C. V. Mass spectrometry of intact membrane protein complexes. Nature. 8 (4), 639-651 (2013).
- Benesch, J. L. Collisional activation of protein complexes: picking up the pieces. Journal of the American Society for Mass Spectrometry. 20 (3), 341-348 (2009).
- Tian, Y., Han, L., Buckner, A. C., Ruotolo, B. T. Collision Induced Unfolding of Intact Antibodies: Rapid Characterization of Disulfide Bonding Patterns, Glycosylation, and Structures. Analytical Chemistry. 87 (22), 11509-11515 (2015).
- Eschweiler, J. D., Rabuck-Gibbons, J. N., Tian, Y., Ruotolo, B. T. CIUSuite: A Quantitative Analysis Package for Collision Induced Unfolding Measurements of Gas-Phase Protein Ions. Analytical Chemistry. 87 (22), 11516-11522 (2015).
- Hopper, J. T., Oldham, N. J. Collision induced unfolding of protein ions in the gas phase studied by ion mobility-mass spectrometry: the effect of ligand binding on conformational stability. Journal of the American Society for Mass Spectrometry. 20 (10), 1851-1858 (2009).
- Politis, A., et al. Topological models of heteromeric protein assemblies from mass spectrometry: application to the yeast eIF3:eIF5 complex. Chemical Biology. 22 (1), 117-128 (2015).
- Morgner, N., et al. Hsp70 forms antiparallel dimers stabilized by post-translational modifications to position clients for transfer to Hsp90. Cell Reports. 11 (5), 759-769 (2015).
- Lai, Y. T., et al. Structure of a designed protein cage that self-assembles into a highly porous cube. Nature Chemistry. 6 (12), 1065-1071 (2014).
- Levy, E. D., Boeri Erba, E., Robinson, C. V., Teichmann, S. A. Assembly reflects evolution of protein complexes. Nature. 453 (7199), 1262-1265 (2008).
- Sharon, M., et al. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Jurneczko, E., Barran, P. E. How useful is ion mobility mass spectrometry for structural biology? The relationship between protein crystal structures and their collision cross sections in the gas phase. Analyst. 136 (1), 20-28 (2011).
- Politis, A., Schmidt, C. Structural characterisation of medically relevant protein assemblies by integrating mass spectrometry with computational modelling. Journal of Proteomics. 175, 34-41 (2017).
- Zhou, M., et al. Mass spectrometry of intact V-type ATPases reveals bound lipids and the effects of nucleotide binding. Science. 334 (6054), 380-385 (2011).
- Barrera, N. P., Booth, P. J., Robinson, C. V. Micelles Protect Membrane Complexes from Solution to Vacuum. Science. 321 (5886), 243-246 (2008).
- Konijnenberg, A., et al. Global structural changes of an ion channel during its gating are followed by ion mobility mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 17170-17175 (2014).
- Schmidt, C., Beilsten-Edmands, V., Mohammed, S., Robinson, C. V. Acetylation and phosphorylation control both local and global stability of the chloroplast F1 ATP synthase. Scientific Reports. 7, 44068 (2017).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Research. 45 (20), 12025-12038 (2017).
- Pagel, K., Natan, E., Hall, Z., Fersht, A. R., Robinson, C. V. Intrinsically disordered p53 and its complexes populate compact conformations in the gas phase. Angewandte Chemie. 52 (1), 361-365 (2013).
- Afonso, J. P., et al. Insights into the structure and assembly of the Bacillus subtilis clamp-loader complex and its interaction with the replicative helicase. Nucleic Acids Research. 41 (9), 5115-5126 (2013).
- van Duijn, E. Current limitations in native mass spectrometry based structural biology. Journal of the American Society for Mass Spectrometry. 21 (6), 971-978 (2010).
- Susa, A. C., Xia, Z., Williams, E. R. Native Mass Spectrometry from Common Buffers with Salts That Mimic the Extracellular Environment. Angewandte Chemie. 56 (27), 7912-7915 (2017).
- Breukera, K., McLafferty, F. W. Stepwise evolution of protein native structure with electrospray into the gas phase, 10 to 10 s. Proceedings of the National Academy of Sciences of the United States of America. 105 (47), 18145-18152 (2008).
- Robinson, C. V., et al. Probing the Nature of Noncovalent Interactions by Mass Spectrometry. A Study of Protein-CoA Ligand Binding and Assembly. Journal of the American Chemical Society. 118 (36), 8646-8653 (1996).
- Shimon, L., Sharon, M., Horovitz, A. A method for removing effects of nonspecific binding on the distribution of binding stoichiometries: application to mass spectroscopy data. Biophysical Journal. 99 (5), 1645-1649 (2010).
- Dyachenko, A., Gruber, R., Shimon, L., Horovitz, A., Sharon, M. Allosteric mechanisms can be distinguished using structural mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 110 (18), 7235-7239 (2013).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. Journal of Visualized Experiments. 19 (40), (2010).
- Marty, M. T., et al. Bayesian deconvolution of mass and ion mobility spectra: from binary interactions to polydisperse ensembles. Analytical Chemistry. 87 (8), 4370-4376 (2015).
- Allison, T. M., et al. Quantifying the stabilizing effects of protein-ligand interactions in the gas phase. Nature Communications. 6, 8551-8561 (2015).
- Sivalingam, G. N., Yan, J., Sahota, H., Thalassinos, K. Amphitrite: A program for processing travelling wave ion mobility mass spectrometry data. International Journal of Mass Spectrometry. 345-347, 54-62 (2013).
- Morgner, N., Robinson, C. V. Massign: an assignment strategy for maximizing information from the mass spectra of heterogeneous protein assemblies. Analytical Chemistry. 84 (6), 2939-2948 (2012).
- Bush, M. F., et al. Collision Cross Sections of Proteins and Their Complexes: A Calibration Framework and Database for Gas-Phase Structural Biology. Analytical Chemistry. 82, 9557-9565 (2010).
- Ruotolo, B. T., Benesch, J. L., Sandercock, A. M., Hyung, S. J., Robinson, C. V. Ion mobility-mass spectrometry analysis of large protein complexes. Nature Protocols. 3 (7), 1139-1152 (2008).
- Lanucara, F., Holman, S. W., Gray, C. J., Eyers, C. E. The power of ion mobility-mass spectrometry for structural characterization and the study of conformational dynamics. Nature Chemistry. 6 (4), 281-294 (2014).
- Wyttenbach, T., Bowers, M. T. Structural stability from solution to the gas phase: native solution structure of ubiquitin survives analysis in a solvent-free ion mobility-mass spectrometry environment. Journal of Physical Chemistry B. 115 (42), 12266-12275 (2011).
- Marcoux, J., Robinson, C. V. Twenty years of gas phase structural biology. Structure. 21 (9), 1541-1550 (2013).
- Michaelevski, I., Kirshenbaum, N., Sharon, M. T-wave ion mobility-mass spectrometry: basic experimental procedures for protein complex analysis. Journal of Visualized Experiments. (41), (2010).
- Mesleh, M. F., Hunter, J. M., Shvartsburg, A. A., Schatz, G. C., Jarrold, M. F. Structural Information from Ion Mobility Measurements: Effects of the Long-Range Potential. Journal of Physical Chemistry A. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chemical Physics Letters. 261, 86-91 (1996).
- Taverner, T., Hernández, H., Sharon, M., Ruotolo, B. T., Matak-Vinković, D., Devos, D., Russell, R. B., Robinson, C. V. Subunit Architecture of Intact Protein Complexes from Mass Spectrometry and Homology Modeling. Accounts of Chemical Research. 41 (5), 617-627 (2008).
- Wysocki, V. H., Joyce, K. E., Jones, C. M., Beardsley, R. L. Surface-induced dissociation of small molecules, peptides, and non-covalent protein complexes. Journal of the American Society for Mass Spectrometry. 19 (2), 190-208 (2008).
- Hall, Z., Politis, A., Bush, M. F., Smith, L. J., Robinson, C. V. Charge-state dependent compaction and dissociation of protein complexes: insights from ion mobility and molecular dynamics. Journal of the American Chemical Society. 134 (7), 3429-3438 (2012).
- Hyung, S. J., Robinsons, C. V., Ruotolo, B. T. Gas-Phase Unfolding and Disassembly Reveals Stability Differences in Ligand-Bound Multiprotein Complexes. Chemistry & Biology. 16, 382-390 (2009).
- Hall, Z., Politis, A., Robinson, C. V. Structural modeling of heteromeric protein complexes from disassembly pathways and ion mobility-mass spectrometry. Structure. 20 (9), 1596-1609 (2012).
- Woods, L. A., Radford, S. E., Ashcroft, A. E. Advances in ion mobility spectrometry-mass spectrometry reveal key insights into amyloid assembly. Biochimica et Biophysica Acta. 1834 (6), 1257-1268 (2013).
- Daubenfeld, T., Bouin, A. P., van der Rest, G. A deconvolution method for the separation of specific versus nonspecific interactions in noncovalent protein-ligand complexes analyzed by ESI-FT-ICR mass spectrometry. J Am Soc Mass Spectrom. 17 (9), 1239-1248 (2006).
- Loo, J. A. Studying noncovalent protein complexes by electrospray ionization mass spectrometry. Mass Spectrometry Reviews. 16, 1-23 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены