Method Article
단백질 구조와 통합 구조 질량 분석, 단백질-리간드 단지 분석
요약
질량 분석 (MS)는 구조 조사와 고분자 어셈블리의 역학에 대 한 중요 한 도구로 떠오르고 있다. 여기, 우리는 단백질 복잡 한 형성과 ligand 바인딩이 MS 기반 접근을 통합 합니다.
초록
단백질은 유전자 발현, catalyzing 신진 대사 반응, DNA 복구 및 복제를 포함 하 여 세포질 기능에 많은 주요 역할을 재생 하는 생물학 고분자의 중요 한 클래스. 이러한 프로세스에 대 한 자세한 이해 방법에 대 한 중요 한 정보를 제공 하는 따라서, 세포 기능. 통합 구조 MS 메서드 구조와 역 동에 단백질 복잡 한 어셈블리, 복잡 한 연결, 소 단위 산출할, 단백질 oligomerization ligand 바인딩 정보를 제공합니다. 통합 구조 MS의 최근 발전은 큰 DNA 묶는 단백질 및 막 단백질을 포함 하 여 어려운 생물 학적 시스템의 특성에 대 한 수 있다. 이 프로토콜에서는 네이티브 MS 및 이온 이동성-질량 분석 (MS 메신저) 분자 동역학 시뮬레이션으로 helicase nuclease DNA에 대 한 통찰력을 얻기 위해 단백질 복잡 한 수리 같은 다양 한 MS 데이터를 통합 하는 방법을 설명 합니다. 결과 접근 중요 한 생물 학적 과정에 관련 된 다른 단백질 복합물에 ligand 바인딩의 상세한 연구에 대 한 프레임 워크를 제공합니다.
서문
그대로 단백질 그리고 그들의 복합물의 네이티브 대량 spectrometric 분석 실시 하는 이온화 과정1, 동안 분무 및 나노 분무 이온화 (nESI), 단백질 폴딩 유지 및 비-공유 상호 작용을 사용 하 여 2. 네이티브 MS, 단백질 그리고 그들의 복합물의 구조3,4가스 단계에서에서 네이티브에 가까운 상태에 유지 됩니다. 네이티브 MS 검색 여러 청구 단백질 이온 충전 비 (m/z) 단백질 또는 단백질-리간드의 질량을 수 있도록 그들의 질량에 따라 구분 되는 복잡 한 계산. 이 정보는 그대로 단백질의 산출할, 소 단위 구성, ligand 바인딩 및 상호 작용 네트워크3,4,,56의 결정을 수 있습니다. 네이티브 MS는 다른 기술에 비해 몇 가지 장점이 같은 엑스레이 결정학 및 핵 자기 공명 분광학5. 첫째, 네이티브 MS는 신속 하 고 매우 중요 한 기술입니다, 요구 하는 단지 약간 microliters (µ L 2-3) 낮은 µ M 범위6높은 nM에서 상대적으로 낮은 최종 복잡 한 농도에서 샘플의. 둘째, 네이티브 MS 이종 단백질 샘플 여러 단백질과 oligomeric 상태를 동시에 분석 하는 게 가능 하가 사용할 수 있습니다. 셋째, 네이티브 MS는 화학 가교 또는 단백질 라벨 분석 전에 수정할 단백질 견본을 필요 하지 않습니다. 이러한 장점을 구조 MS 단백질 복합물의 구조상 조사 위한 강력한 도구를 만들었습니다.
네이티브 MS 이온 이동성 (IM), 단백질 이온 전기 분야를 통해 여행 하는 데 걸리는 시간을 측정 하는 기술 collisional 횡단면 (CCS) 결정 될 수 있도록 결합할 수 있습니다. CCS는 저해상도 구조 정보를, 토폴로지 및 얻을 수 단백질의 구조적이 정보를 제공 합니다. 또한, 그것은 계산 방법에 의해 생성 된 단백질 구조 모델의 시험이 있습니다.
단백질-기체 안정성 수 조사 충돌 유도 전개 (CIU) 측정을 사용 하 여 IM MS에 의해. CIU 과정 단백질 이온 가속 하 고 질량 분 서 계7,,89내에서 불활성 버퍼 가스로 증가 가속 충돌을 통해 활성화. 이 collisional 활성화 과정 하면 CCS 증가 변환 부분적으로 펼쳐, 단백질. CCS와 단백질을 전개 하는 데 필요한 에너지에이 변경 될 수 있습니다이 이렇게 임 씨를 사용 하 여 측정, ligand 바인딩 단백질 안정성에의 효과 측정된10일 수 있다. Subcomplexes는 단백질 복합물의 기본-같은 토폴로지를 모니터링 하는 유기 용 제의 추가 같은 솔루션에 중단 방법을 사용 하 여 솔루션에서 생성할 수 있습니다. 단백질 복합물의 주로 내부 공유 비 상호 작용의 인 이다. 하위 단지 네이티브 같은 토폴로지를 유지 하 고, MS 검출 시 간 소 단위 연결에 대 한 정보를 공개.
구조 생물학에 통합 접근 결합 구조 단백질과 그들의 단지3,4,,56의 역학을 공부 하 고 다양 한 방법. 네이티브 MS 및 MS 메신저 도전 생물 학적 시스템의 분자 정보를 밝히기 위해 사용 되었습니다. 단백질 어셈블리 경로11,12,13,14, 단백질 단백질 상호 작용 네트워크15 를 공부 하 고 연구를 포함 하 여 응용 프로그램의 몇 가지 예제 되었습니다. , 16 , 17, 막 단백질6,,1819,20,21및 핵 산22,23 같은 단백질-리간드 상호작용 ,24.
그러나, 네이티브 MS는 또한 한계가 있다. 네이티브 MS 측정 종종 일부 단백질의 접힌된 네이티브 상태3,25를 유지 하지 것입니다 수성 염화 아세테이트 등 휘발성 버퍼에서 수행 됩니다. 그럼에도 불구 하 고, 최근 일이이 제한 단백질과 단백질 복잡 한 이온 더 높은 이온 강도 비 휘발성 버퍼에서 직접 형성 될 수 있다 그런 바늘 팁 직경 (0.5 m m 팁) 분사의 최적화에 의해 극복 될 수 있다 보이고 있다 생리 적인 환경을26모방. 또한, 네이티브 MS를 사용 하 여 분무 이온화 솔루션에서 가스 단계; 비 공유 어셈블리를 전송 따라서, 검색 된 단지의 관계 되는 풍부 수 있습니다 전적으로 대표 하지는 솔루션5,27에서. 또한, 솔루션에서에 비해, 가스 단계 소수 성 상호 작용 약한 되 고 정전기 상호 작용 해지고 따라서 선호 하는3,28.
이 문서에서는, 우리 제공 프로토콜, 데이터 분석 및 해석 단백질 식별 및 ligand 바인딩을 사용 하 여 네이티브 MS, 메신저-MS, CIU, 솔루션에서 중단, 그리고 모델링 합니다. 헤 라-NurA, DNA 복구 복잡 한 모델 시스템으로 사용 됩니다. DNA 이중 가닥 틈 (DSBs) 유전 불안정성 및 인 간에 있는 암의 최종 개발 결과로, DNA 손상의 가장 세포 독성과 해로운 형태 중 하나입니다. 동종 재결합 DSBs, ATP 의존 helicase nuclease 복잡 한, 헤 라 NurA22에 의해 조정 하는 과정을 eradicates는 복구 메커니즘입니다.
네이티브 MS와 MS 메신저 기능 분석 실험 결합 및 모델링 허용의 조사: i) 어셈블리, 나 란, 그리고 복잡 한, ii) dsDNA 사이의 복잡 한 상호 작용 및 전체에 미치는 영향의 안정성에서 NurA의 역할 단지, 안정성 및 iii) 산출할와 ATP 바인딩 어셈블리22에 영향. 전반적으로,이 작품은 뉴클레오티드 바인딩과 함께 단백질 복잡 한 구조적 변화와 안정성을 연결 하 여 헤 라 NurA 복합물의 분자 기준의 향상 된 이해를 지도 했다. 이 프로토콜은 하나 또는 여러 개의 ligand(s) 종류와 상호 작용 하는 어떤 단백질 complex(es)에 대 한 일반.
프로토콜
1. 단백질 및 단백질-Ligand 복합물의 네이티브 ms 샘플 준비
참고: 복잡 한 단백질의 분자 기준의 이해 및 ligand 바인딩 기본 MS를 사용 하 여 얻을, 적합 한 샘플 준비 열쇠입니다. 이 섹션의 목표는 MS 분석 예를 들어 DNA와 뉴클레오티드 묶는 헤 라 NurA 복잡 한을 사용 하 여 이전 필수 샘플 준비 단계를 강조 하는.
- 1.5 mL 튜브에 집중된 순화 된 단백질 (일반적으로 15-30 µ M)의 20 µ L aliquots를 준비 합니다.
-
ATP 또는 ADP 바인딩 분석에 대 한
참고: 추가 증가 농도 비 hydrolyzable ATP 아날로그 아데노신 5 '-O-(3-thiotriphosphate), tetralithium 소금 (ATP-γ-S) 또는 아데노신 5 '-diphosphate (ADP). 비 hydrolyzable ATP 파생 ATP-바인딩 단백질 캡처할 수 있게 안정적인 복잡 한 생성 합니다. 테스트할 수 있는 다른 비 hydrolysable ATP 아날로그 앰프 PNP 및 ATP γ S Mg2 +포함 됩니다.- 헤 라-NurA 연구, 순화 된 단백질의 5 µ M로 혼합 ATP-γ-S ADP 0-1에서 배열 하는 농도에서 m m.
- 동시 ATP-γ-S와 ADP 바인딩을 잡으려고 같은 또는 다양 한 농도에서 모두 뉴클레오티드를 추가 합니다.
- 2 mM MgCl2 를 추가 하 고 1 시간에 대 한 건조 목욕 인큐베이터에서 25 ° C에서 품 어.
참고: 뉴클레오티드 바인딩 nESI 네이티브 MS artefactual 바인딩 높은 농도에서 발생할 수 있습니다를 사용 하 여 분석, 따라서 일반적인 바인딩 해야 합니다 찍은 계정29. 일반적인 바인딩 조사, 추가 2-5 m m 사이 뉴클레오티드의 높은 농도).
-
DNA 바인딩 분석에 대 한
- 단백질-DNA 복잡 한 대형을 허용 하는 어 금 니 비율에 단백질과 DNA를 혼합. 헤 라, 헤 라 NurA에 대 한 1:1 비율로 5 µ M의 순화 된 단백질의 dna 혼합.
- 헤 라-NurA 또는 헤 라-평형에 도달할 때까지 건조 목욕 인큐베이터에서 25 ° C에서 30 분 동안 DNA 혼합물을 품 어. 기간 및 외피의 온도 조사 단백질에 따라 달라질 수 있습니다.
- MS 호환 버퍼를 버퍼 교환 단백질 샘플입니다. 일반적으로, 5 m m-1 M에서 pH 7-8 사이 수성 염화 아세테이트 솔루션 사용 됩니다. 기타 MS 호환 버퍼 ethylenediammonium diacetate (EDDA) 등 Triethylammonium 아세테이트 (TEAA)30. 헤 라-NurA에 200mm 암모늄 아세테이트 pH 7을 사용 합니다.
참고: 스핀 집중 장치 또는 크로마토그래피 열을 사용 하 여 MS 분석 전에 버퍼 교환에 대 한 몇 가지 방법이 있다. 네이티브 MS 버퍼링 adducts 등 정화 하는 동안 사용 하는 샘플의 품질에 의해 주로 제한 됩니다. 따라서, 충분 한 담 해결된 봉우리를 수행 하기 위해 필수적 이다. - 헤 라-NurA ligand 바인딩 연구, 버퍼 교환 샘플 6-8 시간 집중 장치를 사용 하 여 200 m m 염화 아세테이트로. 이 메서드는 더 많은 시간이 소요, 그 봉우리를 달성 하는 해결을 보장 하 고 ATP/ADP 바인딩된 종의 정확한 대량 결심을 허용.
2. 기본 MS 수집 및 단백질 복합물 및 단백질-Ligand 복합물 조사 분석
참고: MS 조건 정확한 질량 측정에 높은 해결된 봉우리를 달성 하기 위해 최적화 되어야 합니다. 이 섹션 정보를 32 k 상한 m/z 4 중 극과 Q ToF 질량 분석기에 매개 변수 최적화.
- 나노-분무에 대 한 사내 모세를 준비 하 고 Kirshenbaum 외. 여 자세한 정확한 질량 측정을 위한 계측 질량 보정을 수행 1.
- 감도, 긍정적인 이온 수집 및 이동성 TOF 모드를 선택 합니다.
- 트랩, API 및 IMS 가스를 켭니다. 메신저 분리에 대 한 시작 지점으로 질소 (60 mL/min)와 아르곤 (트랩 영역에 대 한 8.4 mL/min)를 사용 하 고 조정 합니다.
- 적절 한 m/z 수집 범위를 설정 합니다. 알 수 없는 단백질에 대 한 초기 최적화 단계 500-32000 m 같은 넓은 범위를 사용 해야 합니다/z.
- 골드 코팅된 모 세관으로 분석 및 모 세관 홀더로 삽입 단백질 복잡 한 솔루션의 2-3 µ L을 로드 합니다.
- 부드럽게 모 세관 강화 하 고 모 세관 분무 소스 단계에서 장소와 위치 데이터 획득을 시작으로 무대를 슬라이드.
- 낮은 나노-흐름 가스 압력 (0.00-0.05 바) 한 방울 모 세관의 끝에 형성 될 때까지. 나노-흐름 압력 스프레이 유지 때까지 삭제할 수 있습니다.
- X, y는 모 세관을 이동 하 여 원뿔에 관하여 모 세관을 조정, z 위치와 안정적인 이온 현재를 달성 하기 위해 현재 이온을 모니터링. 0.9 1.6의 범위에서 모 세관 전압 적용 kV.
- 샘플링 콘 (50-120 V), 소스 오프셋 (60.0), 소스 온도 (25 ° C)와 콘 가스 흐름 (0.0 L/h)를 설정 합니다. 이러한 초기 조건 조정 될 수 있다 제안 했다.
- 잘 해결된 질량 스펙트럼을 취득 하 고 이온 전송을 극대화 하기 위해, MS 매개 변수를 조정 하 고 스펙트럼에서 결과 변화를 모니터링. 최대 전송에서 최고의 분리를 달성 하는 트랩 (2-8 mL/min), 그 셀 (180 mL/min) 및 IMS 셀 (90 mL/min)에 가스 흐름을 조정 포함 됩니다.
- 전압 오프셋 충분 하지 않은 경우 트랩 충돌 에너지를 조정 합니다. 최적의 출발점은 10-50 V 사이 이다.
참고: 트랩 에너지 증가 제거 비 covalently 바인딩된 adducts 수 있습니다. 그러나, 충돌 유도 된 분리 및 단백질-리간드 복합체의 전개를 피하기 위해 주의. 이온 이동성 측정 악기 조건 보유 네이티브 접힌된 상태 (단계 3)에 단백질 확인을 수행 합니다. - Desolvation 트랩 바이어스 전압을 최적화 하 여 향상. 최적의 출발점은 20-45 V 이다.
- 파 속도 최고의 이동성 분리를 달성 하기 위해 파도 높이 최적화 합니다. 자세한 설명과 프로토콜 찾을 수 있습니다 여기31. 헤 라-NurA 연구 40 (m/s)의 파 속도 550-650 (V)의 파도 높이 사용 하 여.
- 다른 모든 매개 변수를 사용 하 여 악기 기본 값으로.
- (그림 1) 각 실행에 대 한 제어로 분석에 대 한 리간드-무료 샘플을 준비 합니다. Ligand 바인딩 실험에 대 한 적어도 3 개의 독립적인 측정을 수행 합니다.
- Masslynx 소프트웨어를 사용 하 여 생성 된 종의 질량 측정 ligand 바인딩 ATP 그리고 ADP 바인딩 등 oligomeric 상태 (그림 2 및 3)을 식별 하는 데. 사용할 수 있는 다른 소프트웨어 등 UniDec32, 펄서33 Amphitrite34.
- 종의 상대적인 풍부 계량 (예 ligand 바인딩, 다른 올리고, 등.) 원시 ESI MS 스펙트럼에서 관찰 해당 이온 농도 사용 합니다. 또는, UniDec 및 Massign35 (그림 1 및 3 ) 같은 전문된 소프트웨어를 사용 하 여 정량화를 수행 합니다.
3. 인수 및 메신저 MS 분석
참고: 메신저-MS 그들의 크기 (질량), 모양 및 요금에 따라 가스 단계에서 이온을 분리 합니다. 모든 기능을 m/z 스펙트럼에서 해결 드리프트 시간 분포와 연결 됩니다. 메신저-MS 충돌 크로스 섹션 (CCS)를 계산 하는 데 사용할 수 있는 이온의 드리프트-시간을 측정 합니다. 드리프트 시간 값 측정에서 IM MS 인수 사용 하 여 데이터 드리프트 튜브 CCS 값36선형 상관 될 수 있다. 여행 파 메신저 MS (TWIMS) 측정, 보정 곡선 알려진된 CCS 값37단백질 기준에서 얻은 필요 CCS 값을 계산 합니다. 컴팩트한 구조 확장 보다는 빨리 여행 또는 길쭉한 구조 때문에 감소 이동성 셀38버퍼 가스와의 상호 작용. 따라서, 메신저-MS 가스 단계39,40에 네이티브 접힌된 구조 계속 유지 되어 경우 감지 사용할 수 있습니다. 이 섹션에는 메신저-MS를 측정 하 고 TWIMS를 사용 하 여 단백질의 CCS를 계산 하는 방법을 설명 합니다.
- 안정적인 전송 (2 단계)에 대 한 악기 조건 최적화, 후 좋은 스펙트럼 품질을 유지 하는 동안 collisional 에너지와 가능한 한 낮게 샘플링 콘을 줄일.
- 최적화 된 파 속도 파도 높이 사용 하 여 IM-MS (2 단계)를 취득.
- 이온 드리프트를 측정 시간 메신저-MS와 3 개의 다른 파 속도 (예를 들어, 550, 600, 650 m/s) 같은 파도 높이 (예를 들어, 40 V)를 유지 하는 동안.
- 단백질 이온 CCS, 측정 단백질 calibrants 단백질 조사 사용 같은 악기 조건 하에서 결정 합니다. 최적의 드리프트-시간 교정 알려진된 CCS와 단백질의 측정을 요구 한다.
- 4 calibrants, 2 위의 질량 및 아래 조사37에서 단백질의 질량을 가진 2를 선택 합니다. 가장 중요 한 것은, 파도 높이 파 속도 동일 조사에서 단백질에 대 한 기록 된 확인 하십시오.
- 계산 수동으로41 CCS 또는 펄서33 및 Amphitrite34 (그림 5)와 같은 전문된 소프트웨어를 사용 하 여.
- 단백질 인지 확인 하려면 가스 단계에서 네이티브 같은 이론적인 CCS 비교 실험 CCS 고해상도 구조에서 얻은. 헤 라-NurA, 이론적인 CCS MOBCAL42에 사용 되는 투영 근사 (PA) 방법을 사용 하 여 계산 합니다. 다른 방법 궤적 메서드 (TM)42 등 정확한 하드 영역 (EHS)43비 산.
4. 솔루션 중단 단백질 복합물의 네이티브 MS와 MS 메신저에 대 한 Led 구조 결정
참고: 단백질 하위 단지 어떤 경우에 확인할 수 있습니다 그대로 복합물으로 동일한 솔루션에서. 그러나, 간 소 단위 연결 및 복잡 한 어셈블리 솔루션 양식 하위 복합물에서에서 단백질 상호 작용을 방해에서 달성 될 수 있다와 같은 구조 정보를 추가 했다. 이 유기 용 매, 이온 강도 증가 또는 pH 조작의 추가 같은 여러 가지 방법으로 달성 될 수 있다. 헤 라-NurA 복잡 한 소 단위 연결 및 복잡 한 어셈블리에 대 한 통찰력을 얻으려면, 하위 단지 소 단위 상호 작용을 교란 하는 용 매를 추가 하 여 솔루션에서 생성 되었습니다.
- 1 단계에서에서 설명한 대로 암모늄 아세테이트로 단백질 샘플 및 버퍼 exchange를 준비 합니다.
- 10% 단위로 솔벤트의 10-40%를 추가 합니다. 일반적으로 사용 하는 용 매는 메탄올 (MeOH), 디 메 틸 sulfoxide (DMSO) 또는 이기 (ACN).
참고:이 폴 리 프로필 렌 microcentrifuge 튜브 내에서 수행할 수 있습니다. - 1 시간에 대 한 얼음에 혼합물을 품 어.
- 각 조건 (단계 2와 3) (그림 4)에 대 한 IM MS 스펙트럼을 취득 합니다.
- 정상 소프트웨어44 를 사용 하 여 할당 단백질 하위 복합물 단백질 상호 작용 네트워크를 생성 하. 양자 택일로, 수동으로 예상 종의 이론 질량의 목록을 생성 합니다.
- Subcomplexes는 접어 되도록 하위 단지에 대 한 실험 CCS 값을 계산 하 고 단계 3 (표 1, 그림 5 와 그림 6)에서 설명한 이론적 CCS를 비교.
5. 충돌 유도 전개 (CIU)를 사용 하 여 단백질 복잡 한 안정성 조사
참고: CIU에 사용 될 수 있다 단백질 그리고 그들의 복합물 ligand 바인딩 시의 구조적 안정성을 조사. 펄서33, Amphitrite34 , CIU 스위트9 전문 소프트웨어 패키지 다음 조사와 ligand 없이 단백질의 가스 단계 전개 모델링 하는 데 사용할 수 있습니다. 예를 들어,이 섹션 가스 단계를 모니터링 하기 위한 절차를 설명 궤적을 전개 하 고 헤 라 NurA 복잡 한에 DNA와 ATP 바인딩의 안정화 효과 조사.
- 기록 IM MS 데이터를 점진적으로 가스 단계에서 단백질을 펼쳐 2-10 V 단위로 200 V 10 V에서에서 트랩 가속 전압을 증가 하는 동안.
그러나 참고: 처리,이 방법은 더 해결된 전개 플롯을 제공 하는 더 많은 데이터 파일에서 작은 단위로 결과 기록 하는 접혀 펼쳐 종 사이 전환 포인트를 분석 중요 합니다. - 펄서33, Amphitrite34 또는 CIU 스위트9 를 사용 하 여 수집한 데이터를 분석 하 고 가속 전압 (3 단계)의 기능으로 CCS의 단위에서 2 차원 전개 플롯을 생성. 각 충전 상태에 대 한이 각 가속 전압 (그림 7 A-Bi)에서 강도-정규화 CCS 배포판 스태킹 하 여 만들어집니다.
- 소프트웨어 패키지 중 하나를 사용 하 여 이론적 전개 플롯을 생성 합니다. 데이터 전개 모델에 장착 될 것입니다. 이는 전개 전환 발생 하 고 바인딩된 ligands33없이 단백질의 안정성을 결정 collisional 에너지 계량 가능 하 게. 펼쳐진 전환 때 종 전환 (그들의 실험적인 CCS 값에 따라) 한 상태에서 더 큰 CCS와 다른 상태로.
- 전환을 quantitate 알고리즘 및 펄서33같은 소프트웨어를 사용 하 여 상태 사이 과도 적인 midpoint(s)를 계산 합니다. 이것은 일반적으로 이력서50, 특정 국가의 50% 고갈 충돌 (트랩) 전압 값으로 보고 됩니다.
- 이력서50 값을 사용 하 여, 질량 중심 충돌 에너지 KE (COM)45를 사용 하 여 이온의 총 내부 에너지를 계산 합니다. 애COM 는 이온의 펼쳐진 전환에 사용할 수 있는 총 내부 에너지에 의해 정의 되 고 방정식 (1)10 에 설명 된 대로 운동 에너지와 충돌 파트너 (단백질 이온 및 중성 가스)의 대 중에서 계산
KEcom (eV) =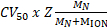 (식 1).
(식 1).
Z 가 이온 충전 MN 은 중립 가스의 질량 그리고 M이온 은 단백질 이온의 질량.
참고: 이것은 때문에 단백질의 CIU 요금 dependent46, 47입니다. 하나 이상의 충전 상태로 ( 그림 7좋아) 애COM 분석을 수행 하는 것이 좋습니다.
6. 통합 MS에서 사용 하는 차동 분자 역학 시뮬레이션 모델링 절차
참고: 단백질 소 단위 또는 크리스탈 구조에서와 같은 단지의 모델을 사용 하 여, 차동 MD 시뮬레이션 (ligand 없이 복잡 한 단백질) 단백질 구조와 역학에 예 리간드 존재의 효과 결정 하기 위해 사용할 수 있습니다. 이 섹션에는 워크플로 및 차동 분자 동역학 시뮬레이션을 설정 하는 데 필요한 절차를 모델링에 필요한 도구 자세히 설명 합니다.
- 복잡 한 (그림 8A, 단계 2와 3)를 작성 하는 소 단위를 식별 합니다. 소스 하위 단위, 예를 들어, 크리스탈 구조 RCSB 뱅크 (https://www.rcsb.org)에서 기존 모델. 단백질의 항목의 목록이 포함 됩니다 UniProt 결정학 또는 NMR 구조 (http://www.uniprot.org)을 알고 있다. 이러한 사용할 수 없는 경우, 호몰로지 모델링 (http://blast.ncbi.nlm.nih.gov/)에 대 한 적합 한 서식 파일을 식별 하는 폭발을 이론적인 시퀀스를 입력할 수 있습니다.
- 올바른 토폴로지 (그림 8A ii)에서 복잡 한 조립. 이것은 다양 한 방법을 통해 행 해질 수 있다. 개별 하위 단위 그대로 복잡 한 (https://www.ebi.ac.uk/pdbe/emdb/)를 사용할 수 있는 전자 현미경 지도 EMDB에 발견에 적합 수 있다. 피팅 Pdb 분자 역학 유연한 피팅 (MDFF)를 사용 하 여 그들을 지도 대 한 자습서를 여기에서 찾을 수 있습니다: http://www.ks.uiuc.edu/Training/Tutorials/science/mdff/tutorial_mdff-html/.
- 복잡 한 (그림 8A iii)의 누락 된 영역을 식별 합니다. 크리스탈 구조, 또는 결정학 실험에서 상속 어떤 돌연변이에 장착 될 수 있는 잔류물을 식별 하는 PDB 및 이론적 시퀀스 사이의 여러 시퀀스 맞춤 (MSA)을 수행 합니다. MSA T-커피 (http://tcoffee.crg.cat/apps/tcoffee/do:regular)와 같은 웹 서버를 사용 하 여 수행할 수 있습니다.
- (그림 8A-iv)를 모델링 하는 homology 통해 누락 된 잔류물을 다시 생성 합니다. 복잡 한 단백질의 잔류물을 누락은 모델러 프로그램 (https://salilab.org/modeller/)를 사용 하 여 만들 수 있습니다. 모델러는 다른 재생된 구성에서 n 모델의 앙상블을 출력할 수 있습니다. 그들의 이산 최적화 단백질 에너지 (마약) 점수에 따라 좋은 모델을 확인할 수 있습니다. 포괄적인 자습서는 소프트웨어 웹사이트 (https://salilab.org/modeller/tutorial/)에서 제공 됩니다.
- 특정 환경 변화, 예를 들어, 는 ligand의 존재에 반응 하는 단백질의 영역을 식별 하기 위해 (그림 8B) 복잡 한 단백질의 차동 분자 역동성 (MD) 시뮬레이션을 수행 합니다. 이러한 시뮬레이션에서 행동에서 매개 변수 시뮬레이션 A (단백질만) 시뮬레이션 B (단백질 + ligand)에서 뺍니다는 참고로, 역할. 시뮬레이션 A와 B 사이 계산 차동 제곱 평균 변동 (RMSF) 단백질의 증가 또는 ligand 의존 방식으로 유연성 감소 지역에 알릴 수 있습니다.
- MD 시뮬레이션 GROMACS (http://www.gromacs.org)를 사용 하 여 다운스트림 분석을 수행 합니다. 튜토리얼에서 찾을 수 있습니다: http://www.bevanlab.biochem.vt.edu/Pages/Personal/justin/gmx-tutorials/Lysozyme/index.html. Elimate 모델 바이어스에 ligand 바인딩 복합물의 구조를 먼저 생성 되어야 합니다. 단백질은 리간드 ligand 바인딩 복잡 한 동일한 단백질 모델 항복 하지 않고이 다음 복사 됩니다.
결과
네이티브 MS 결과 밝혀 oligomeric 상태, 구성 및 토폴로지 헤 라 NurA 단지 (그림 1). 비 공유 상호 작용 가스 단계에서 보존, ATP-γ-S 및 ADP titrations 실험의 기본 MS 없음을 뉴클레오티드 바인딩 헤 라-NurA (그림 2)을 결정 하 고 ATP-γ-S 농도 증가 비례하여 증가 hexameric 헤 라 (그림 3)의 강도. 구조에 관한 소 단위 상호 작용 다음 네이티브 MS 솔루션에 중단에서 가져온와 함께 동의 했다 정보와 이론 대 중 (그림 4 및 표 1).
단백질 그리고 그들의 복합물의 실험적인 CCS 값 메신저 MS 실험 (그림 5)에서 파생 되었다. 이러한 값은 회전 평균된 기체 분자 도형의 단면 계산 고 단백질의 차원 상태를 기술 한다. 엑스레이 결정학에서 이론적인 측정 CCS 값을 비교 하 고 좋은 계약 유추에 기본 도형 (표 1)가스 단계에서에서 유지. 이 단백질 어셈블리48의 저해상도 모델을 구축 하기 위한 CCS 값을 사용 하 여 확인 합니다.
각 충전 상태 이온에 대 한 실험적인 CCSs는 계산할 수 있습니다. 네이티브-처럼 단백질 conformer 유사한 CCS 값으로 상태 이온 충전을 야기할 수 있습니다. 그러나, 더 높은 충전 상태 이온 coulombic repulsions 단백질 가스 단계 전개 및 큰 CCS 값 이론적인 CCSs에 비해 이어질 수 증가. 이온은 따라서 일반적으로 낮은 충전 상태에 대 한 CCS 값49사용. 헤 라-NurA에 대 한 솔루션에서 중단 실험 헤 라 헤 라 NurA에 DNA 없이 메시지가 어셈블리 경로 단위체로 시작 후 전체 hexameric HerA (헤 라6) 형성의 세대-dimeric NurA (NurA2) 복잡 한 DNA (그림 6).
Apo (ligand 무료)와 ligand 바인딩 CIU 전개 플롯에 차이 ligand 바인딩 시 복잡 한 안정성에 변화를 정의 합니다. 더 높은 CV50 또는 애COM 값 가스 단계에서 더 안정된 이온을 의미합니다. CIU와 애COM 분석 DNA 바인딩 헤 라-NurA DNA 무료 복잡 한 (그림 7좋아) 보다 더 안정입니다 밝혔다. CIU MS 각각 ATP 바인딩 상태 분석에서 4-ATP-γ-S 바인딩된 상태 가스 단계에 점유는 어디 모든 사이트는 6-ATP-γ-S 바인딩된 상태 감소 복잡 한 안정성은 가장 안정 (그림 7Bii). 네이티브 MS 개별 뉴클레오티드 바인딩 헤 라;의 상태를 계시 할 수 있다 그러나, 그것은 수 없습니다 구별 어떤 헤 라 소 단위 ATP를 바인딩하는이 바인딩이 수행. 이 정보는 hexameric 헤 라 헤 라-NurA 요약된 워크플로 (그림 8) 다음에 명시적 용 MD 시뮬레이션에서 파생 될 수 있습니다.
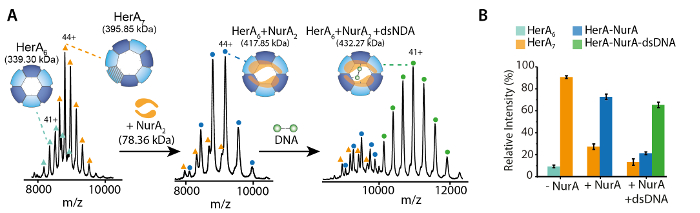
그림 1. Oligomeric 상태, 구성 및 토폴로지 헤 라 NurA 비 공유 복잡 한 질문. (헤 라, 헤 라 NurA 및 헤 라-NurA DNA (15.4 kDa 25 bp 이중 가닥 DNA) 존재의 스펙 하 트 A) 대량 라 헤 라 서브 복잡 한 hexamer와는 heptamer로 존재합니다. NurA 이합체 바인딩합니다 및 헤 라 hexamer oligomeric 변환 부과 하. DNA 형성된 된 헤 라-NurA 복잡 한 (Z. Ahdash 그 외 여러분, 201722에서 적응 결과)에 바인딩합니다. (확인 된 종 B) 상대 농도 UniDec32를 사용 하 여 계산 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
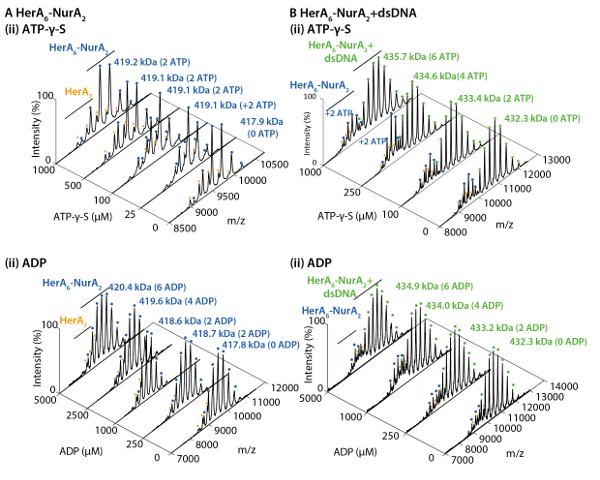
그림 2. 네이티브 ESI-MS의 헤 라 NurA에 뉴클레오티드 바인딩 메커니즘을 보여준다. 질량 스펙트럼 (A) 헤 라 NurA 및 (B) 헤 라 NurA DNA ATP-γ-S 및 (ii) ADP (i)의 농도 증가 함께. 측정 된 질량 이론적인 대 중 및 ATP-γ-S의 금액에 비해 또는 ADP 바인딩된 결정 됩니다. 측정 된 질량 및 바인딩된 뉴클레오티드의 수는 스펙트럼에 표시 됩니다. ATP-γ-S와 ADP titrations 실험 결정 헤 라-NurA 혼자 하 고 인덱스도 뉴클레오티드 바인딩 때 복잡 한 순환 반응 메커니즘 (Z. Ahdash 그 외 여러분, 201722에서 적응 결과)을 나타내는 dna. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
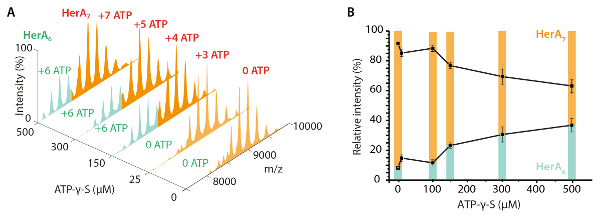
그림 3. 헤 라 oligomeric 상태에 ATP-γ-S 농도 증가의 효과 측정. (ATP-γ-미의 농도 증가에 헤 라의 A) 질량 스펙트럼 (B) UniDec deconvolution 소프트웨어32를 사용 하 여 계산 하는 기본 MS에서 다른 종족의 상대 농도 보여주는 그래프. ATP-γ-S 농도 증가, hexameric 헤 라의 상대 강도 또한 증가 합니다. 바인딩된 ATP-γ-S 분자의 수는 스펙트럼 (Z. Ahdash 그 외 여러분, 201722에서 적응 결과)에 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
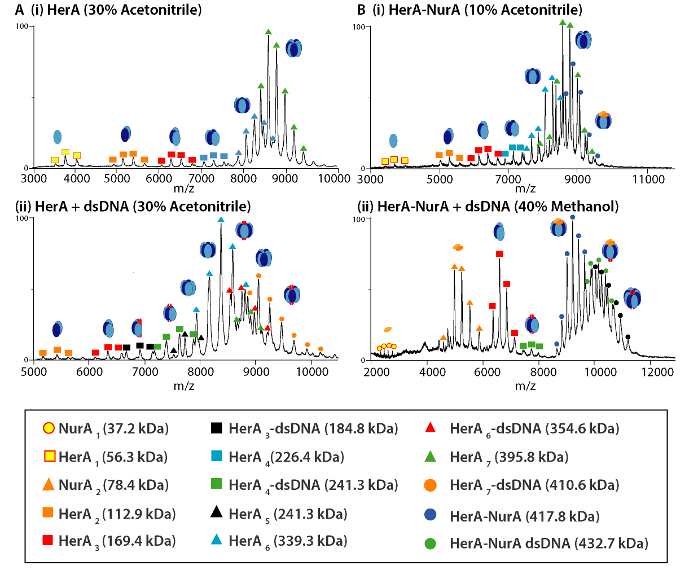
그림 4. 질량 스펙트럼 및 헤 라 (A)와 (B) 헤 라-NurA (i)의 하위 복잡 한 분리 제품 혼자 및 (ii) DNA 다음 솔루션에 장애의 존재. 솔루션에서 중단 실험 이기의 10-40%를 사용 하 여 수행 했다 메탄올 (MeOH) 또는 디 메 틸 sulfoxide (DMSO) 및 다양 한 subcomplexes의 대형 귀착되 었 다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
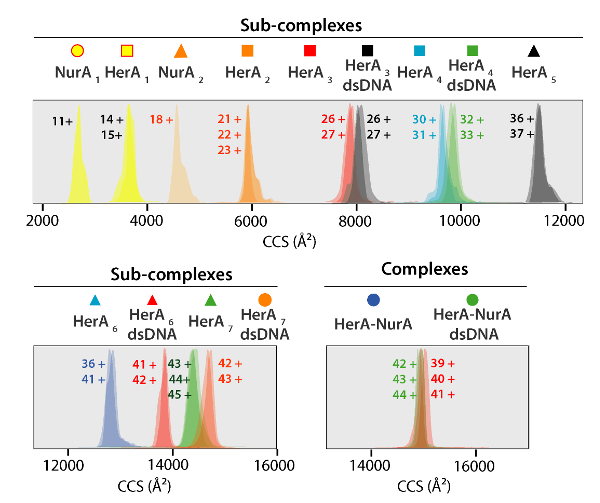
그림 5. 이온 이동성 도착 시간 분포는 생성 된 하위 단지 및 단지에 대 한 CCS 축에 표시 된. 그림 4에서 스펙트럼에 주석이 그 각 하위 복잡 한 상관에 대 한 아이콘입니다. 실험 및 계산 대 중 및 하위 단지의 CCS 값 모두 보여주었다 (여행 파 이온의 해결책에서 일반적인 불확실성을 고려한 후 실험 및 계산 된 값 사이의 계약 표 1 에 나열 된 이동성 질량 분석의37% ± 5-8). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
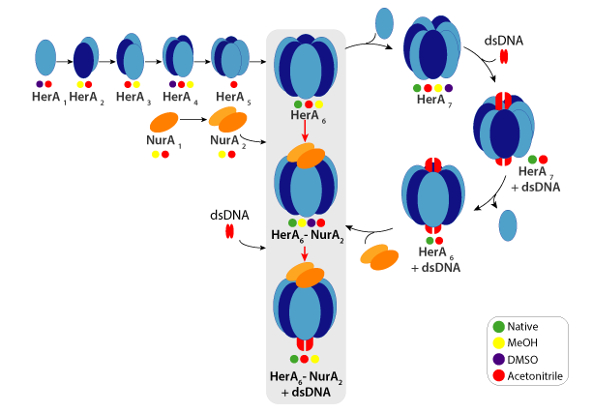
그림 6. 헤 라-NurA 복잡 한 솔루션에서 중단 네이티브 MS, 임 양 색 동그라미 표시 각 하위 복잡 한 관찰 되었다 조건에서에서 생성 된 어셈블리 경로: 기본 (녹색, 중단 하기 전에), 메탄올 (노란색), DMSO (자주색) 또는 이기 (레드)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 7. 헤 라-NurA에 헤 라-NurA-dna (B) ATP 바인딩 (A) DNA의 안정화 효과 조사. (i) 가스 단계 CIU MS 음모 그리고 (ii) 질량의 중심 충돌 에너지 (KEcom) 계산 쇼 dsDNA의 존재 헤 라 NurA 복잡 한 안정화 하 고 6 개의 ATP-γ-S 상태 바인딩된 가장 안정적입니다. 다른 충전 상태에 대 한 안정화 표시 됩니다. 플롯은 펄서 33를 사용 하 여 생성 했다. Z. Ahdash 그 외 여러분, 201722에서 적응 (A)에서 결과. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
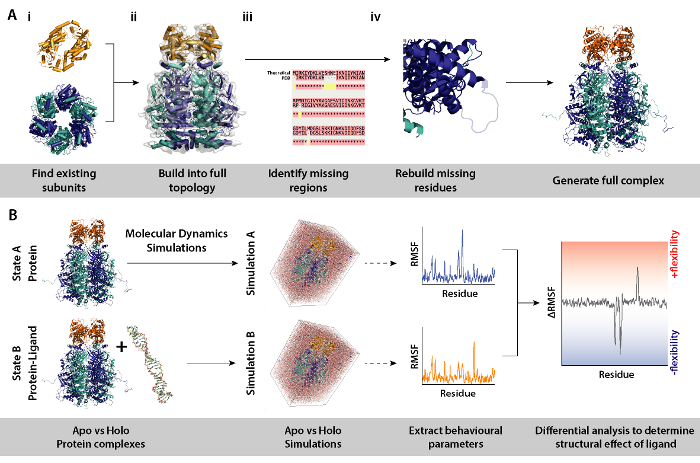
그림 8. 차동 분자 동역학 시뮬레이션 모델링 절차에 대 한 워크플로. (A) 기존 하는 소 단위 및 누락 된 잔류물 재건에서 토폴로지를 구축 하 여 복잡 한 조사를 생성 합니다. (B)와 ligand 없이 복잡 한 단백질에서 분자 동역학 시뮬레이션을 실행 하기 위한 워크플로. 분자 동역학 시뮬레이션은 단백질에 대 한 실행만 기준으로 작동 하 고 있는 단백질 ligand의 시뮬레이션에서 뺍니다. 이것은 시뮬레이션 사이의 차동 제곱 평균 변동 (RMSF)를 계산 하 고 ligand 바인딩의 효과 결정 옵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 복잡 한/하위 복잡 한 | 이론적인 질량 (kDa) | 실험 집단 (kDa) | 이론적인 CCS (Å2) | 실험적 CCS (Å2) [충전] | 조건 HN |
| 헤 라6-NurA2 | 416.22 | 417.85 | 14531 | 14577 [42 +] 14599 [43 +] 14608 [44 +] 14637 [45 +] | 10-20 %ACN, 10-40% DMSO 10% MeOH |
| 헤 라6-NurA2-dsDNA | 431.72 | 432.27 | - | 14661 [39 +] 14728 [40 +] 14781 [41 +] 14837 [42 +] | 10 %ACN, 10% MeOH |
| NurA1 | 39.12 | 38.18 | 3254 | 2618 [10 +] 2746 [11 +] 2878 [12 +] | 10-40% = 뉴스, 10 %MeOH, 20-40% DMSO |
| NurA2 | 78.24 | 78.36 | 4890 | 4903 [16 +] 4614 [17 +] 4537 [18 +] 4666 [19 +] | 10-40 %MeOH, 20-40% DMSO |
| 헤 라1 | 56.33 | 56.32 | 4131 | 3647 [14 +] 3792 [15 +] 3950 [16 +] | 10-40 %ACN, 40% DMSO |
| 헤 라2 | 112.66 | 112.95 | 6475 | 5648 [20 +] 5747 [21 +] 5842 [22 +] 5996 [23 +] | 40% 마약, 10-40% = 뉴스 |
| 헤 라3 | 168.99 | 169.39 | 8607 | 7501 [25 +] 7616 [26 +] 7717 [27 +] 7867 [28 +] | 10-40 %MeOH, 할 수 10-40%, 40% DMSO |
| 헤 라3 + DNA | 183.99 | 184.976 | - | 7655 [26 +] 7990 [27 +] 8107 [28 +] | 10-30% ACN |
| 헤 라4 | 225.32 | 226.2 | 10477 | 9205 [30 +] 9287 [31] 9493 [32 +] 9961 [33 +] | 10-40 %MeOH, 10-40% = 뉴스 |
| 헤 라4 + DNA | 240.82 | 241.33 | - | 9637 [31 +] 9756 [32 +] 9830 [33 +] | 10-30% ACN |
| 헤 라5 | 281.65 | 282.75 | 11853 | 10847 [36 +] 10958 [37 +] 11161 [38 +] | 30-40% = 뉴스 |
| 헤 라6 | 337.98 | 339.3 | 12517 | 12335 [38 +] 12386 [39 +] 12498 [40 +] 12590 [41 +] 12676 [42 +] 13019 [43 +] | 10-40 %MeOH, 10-40% = 뉴스 |
| 헤 라6 + DNA | 353.48 | 354.626 | - | 12890 [40 +] 13081 [41 +] 13184 [42 +] 13273 [43 +] 13463 [44 +] 13576 [45 +] | 30% ACN |
| 헤 라7 | 394.3 | 395.85 | 13901 | 14154 [42 +] 14219 [43 +] 14261 [44 +] 14285 [45 +] 14335 [46 +] | 10-40 %MeOH, 10-40% = 뉴스 10-40% DMSO |
| 헤 라7 + DNA | 409.8 | 410.62 | - | 14414 [41 +] 14510 [42 +] 14558 [43 +] 14598 [44 +] 14630 [45 +] 14641 [46 +] | 10% ACN |
표 1. 실험 및 계산 대 중 및 헤 라 NurA 및 그 하위 단지의 CCS 값 생성 양식에서 솔루션 장애 연구.
토론
MS는 산출할, 상호 작용 및 소 단위 단백질 복합물의 건축을 특성화에 점점 중요 한 역할을 재생 됩니다. 메신저-MS 데이터 하위 단위 multicomponent 단지 내에서 위상 배열 정의를 사용할 수 있습니다. 다른 기존의 구조 생물학 방법에 비해, MS는 몇 가지 장점이 있습니다. 네이티브 MS는 신속 하 고 매우 중요 한 기술 이며 이종 단백질 견본을 사용할 수 있습니다. 솔루션 장애 실험 결합, 분리 단백질 어셈블리의 경로 모니터링할 수 있습니다. 크리스탈 구조 또는 상 동 모델, 구조 MS에서 제공 하는 정보는 단백질-리간드 상호작용을 조사 하기 위한 도구를 제공 하 고 근처 기본 모델 및 어셈블리 경로11제공 합니다.
여기, 우리는 통합 MS를 사용 하 여 산출할 및 단백질-리간드 상호작용 하나 이상의 ligands의 구성 분석에 필요한 실험 절차 설명. 이 MS 샘플 준비, 데이터 수집, 데이터 분석 및 계산 도구를 사용 하 여 MS 데이터의 통합이 포함 됩니다. 이렇게 하려면, 우리는 우리의 모델 시스템으로 (DNA, ATP, 그리고 ADP), 3 개의 ligands에 바인딩된 DNA 절제 헤 라-NurA hetero oligomeric 단백질 복잡 한를 사용 합니다. 프로토콜은 데이터 분석 및 프레 젠 테이 션을 돕기 위해 현재 사용할 수 있는 소프트웨어의 사용을 보여준다.
Ligand 바인딩 분석을 위해 중요 하다 고품질 스펙트럼을 취득, 따라서 주의 샘플 준비 단계는 중요 한 단백질 정화, 버퍼 교환, ligand 적정, 등. 한 제한 nESI 네이티브 MS ligand 바인딩 공부를 할 때 비 특정 바인딩입니다. 비 특정 바인딩 물방울 desolvation 분무 과정 전반에 걸쳐 발생합니다. 이 ligand 농도 증가 하 고 따라서 단백질/Ligand 비율29변경. 뉴클레오티드 바인딩 apo와 이온화 효율50,51를 변경 하지 않는 뉴클레오티드 바인딩 단백질 사이의 비교적 작은 질량 차이에 발생 합니다.
우리는 우리의 작업에 대 한 Synapt g 2 시 MS 시스템을 사용 하지만 프로토콜은 다른 상업적으로 사용 가능한 나노-분무 질량 분석기를 사용 하 여 다른 단백질-ligand 복합물의 다른 조사에 대 한 적용. 통합 구조 MS 점점 더 큰 복잡성의 생물학 문제 해결에 중요 한 역할을 재생입니다. 여기서 설명 하 고 워크플로 구조적 결과 이해 하 고 기존의 구조 기법을 사용 하 여 공부 하는 수 없는 복잡 한 단백질 및 단백질-리간드 형성의 메커니즘을 구축에 적합 .
공개
관심 없음 충돌 선언.
감사의 말
우리는 친절 하 게 제공 헤 라 헤 라 NurA 단백질 샘플에 대 한 그리고 그들의 실험 설계에 대 한 칼 피터 Hopfner와 로버트 토마스 번 감사 하 고 싶습니다. 우리는 또한 원고의 그의 검토에 대 한 박사 Eamonn 읽기를 감사합니다. 우리는 기꺼이 우리의 자금 시체 인정: Wellcome 신뢰 [109854/Z/15/Z]와 왕 사회 [되 게 RG150216].
자료
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-(3-thiotriphosphate) tetralithium salt | Merck Millipore | 119120-25MG | |
| Adenosine 5′-diphosphate | Sigma-Aldrich | 20398-34-9 | |
| Ammonium acetate solution | Sigma-Aldrich | A2706 | |
| Micro Bio-Spin Chromatography Columns | Bio-Rad | 7326204 | |
| Vivaspin concentrator | Sartorius | Z614041-25EA | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | 246964 | |
| Water TraceSelect | Sigma-Aldrich | 95305 | |
| Borosilicate Capillaries | Harvard Apparatus | 300060 |
참고문헌
- Wilm, M., Mann, M. Analytical Properties of the Nanoelectrospray Ion Source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Fenn, J. B., Mann, M., Meng, C. K., Wong, S. F., Whitehouse, C. M. Electrospray ionization for mass spectrometry of large biomolecule. Science. 246 (4926), 64-71 (1989).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nature Protocols. 2 (3), 715-726 (2007).
- Heck, A. J., Van Den Heuvel, R. H. Investigation of intact protein complexes by mass spectrometry. Mass Spectrom Review. 23 (5), 368-389 (2004).
- Boeri Erba, E., Petosa, C. The emerging role of native mass spectrometry in characterizing the structure and dynamics of macromolecular complexes. Protein Science. 24 (8), 1176-1192 (2015).
- Laganowsky, A., Reading, E., Hopper, J. T. S., Robinson, C. V. Mass spectrometry of intact membrane protein complexes. Nature. 8 (4), 639-651 (2013).
- Benesch, J. L. Collisional activation of protein complexes: picking up the pieces. Journal of the American Society for Mass Spectrometry. 20 (3), 341-348 (2009).
- Tian, Y., Han, L., Buckner, A. C., Ruotolo, B. T. Collision Induced Unfolding of Intact Antibodies: Rapid Characterization of Disulfide Bonding Patterns, Glycosylation, and Structures. Analytical Chemistry. 87 (22), 11509-11515 (2015).
- Eschweiler, J. D., Rabuck-Gibbons, J. N., Tian, Y., Ruotolo, B. T. CIUSuite: A Quantitative Analysis Package for Collision Induced Unfolding Measurements of Gas-Phase Protein Ions. Analytical Chemistry. 87 (22), 11516-11522 (2015).
- Hopper, J. T., Oldham, N. J. Collision induced unfolding of protein ions in the gas phase studied by ion mobility-mass spectrometry: the effect of ligand binding on conformational stability. Journal of the American Society for Mass Spectrometry. 20 (10), 1851-1858 (2009).
- Politis, A., et al. Topological models of heteromeric protein assemblies from mass spectrometry: application to the yeast eIF3:eIF5 complex. Chemical Biology. 22 (1), 117-128 (2015).
- Morgner, N., et al. Hsp70 forms antiparallel dimers stabilized by post-translational modifications to position clients for transfer to Hsp90. Cell Reports. 11 (5), 759-769 (2015).
- Lai, Y. T., et al. Structure of a designed protein cage that self-assembles into a highly porous cube. Nature Chemistry. 6 (12), 1065-1071 (2014).
- Levy, E. D., Boeri Erba, E., Robinson, C. V., Teichmann, S. A. Assembly reflects evolution of protein complexes. Nature. 453 (7199), 1262-1265 (2008).
- Sharon, M., et al. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Jurneczko, E., Barran, P. E. How useful is ion mobility mass spectrometry for structural biology? The relationship between protein crystal structures and their collision cross sections in the gas phase. Analyst. 136 (1), 20-28 (2011).
- Politis, A., Schmidt, C. Structural characterisation of medically relevant protein assemblies by integrating mass spectrometry with computational modelling. Journal of Proteomics. 175, 34-41 (2017).
- Zhou, M., et al. Mass spectrometry of intact V-type ATPases reveals bound lipids and the effects of nucleotide binding. Science. 334 (6054), 380-385 (2011).
- Barrera, N. P., Booth, P. J., Robinson, C. V. Micelles Protect Membrane Complexes from Solution to Vacuum. Science. 321 (5886), 243-246 (2008).
- Konijnenberg, A., et al. Global structural changes of an ion channel during its gating are followed by ion mobility mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 17170-17175 (2014).
- Schmidt, C., Beilsten-Edmands, V., Mohammed, S., Robinson, C. V. Acetylation and phosphorylation control both local and global stability of the chloroplast F1 ATP synthase. Scientific Reports. 7, 44068 (2017).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Research. 45 (20), 12025-12038 (2017).
- Pagel, K., Natan, E., Hall, Z., Fersht, A. R., Robinson, C. V. Intrinsically disordered p53 and its complexes populate compact conformations in the gas phase. Angewandte Chemie. 52 (1), 361-365 (2013).
- Afonso, J. P., et al. Insights into the structure and assembly of the Bacillus subtilis clamp-loader complex and its interaction with the replicative helicase. Nucleic Acids Research. 41 (9), 5115-5126 (2013).
- van Duijn, E. Current limitations in native mass spectrometry based structural biology. Journal of the American Society for Mass Spectrometry. 21 (6), 971-978 (2010).
- Susa, A. C., Xia, Z., Williams, E. R. Native Mass Spectrometry from Common Buffers with Salts That Mimic the Extracellular Environment. Angewandte Chemie. 56 (27), 7912-7915 (2017).
- Breukera, K., McLafferty, F. W. Stepwise evolution of protein native structure with electrospray into the gas phase, 10 to 10 s. Proceedings of the National Academy of Sciences of the United States of America. 105 (47), 18145-18152 (2008).
- Robinson, C. V., et al. Probing the Nature of Noncovalent Interactions by Mass Spectrometry. A Study of Protein-CoA Ligand Binding and Assembly. Journal of the American Chemical Society. 118 (36), 8646-8653 (1996).
- Shimon, L., Sharon, M., Horovitz, A. A method for removing effects of nonspecific binding on the distribution of binding stoichiometries: application to mass spectroscopy data. Biophysical Journal. 99 (5), 1645-1649 (2010).
- Dyachenko, A., Gruber, R., Shimon, L., Horovitz, A., Sharon, M. Allosteric mechanisms can be distinguished using structural mass spectrometry. Proceedings of the National Academy of Sciences of the United States of America. 110 (18), 7235-7239 (2013).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. Journal of Visualized Experiments. 19 (40), (2010).
- Marty, M. T., et al. Bayesian deconvolution of mass and ion mobility spectra: from binary interactions to polydisperse ensembles. Analytical Chemistry. 87 (8), 4370-4376 (2015).
- Allison, T. M., et al. Quantifying the stabilizing effects of protein-ligand interactions in the gas phase. Nature Communications. 6, 8551-8561 (2015).
- Sivalingam, G. N., Yan, J., Sahota, H., Thalassinos, K. Amphitrite: A program for processing travelling wave ion mobility mass spectrometry data. International Journal of Mass Spectrometry. 345-347, 54-62 (2013).
- Morgner, N., Robinson, C. V. Massign: an assignment strategy for maximizing information from the mass spectra of heterogeneous protein assemblies. Analytical Chemistry. 84 (6), 2939-2948 (2012).
- Bush, M. F., et al. Collision Cross Sections of Proteins and Their Complexes: A Calibration Framework and Database for Gas-Phase Structural Biology. Analytical Chemistry. 82, 9557-9565 (2010).
- Ruotolo, B. T., Benesch, J. L., Sandercock, A. M., Hyung, S. J., Robinson, C. V. Ion mobility-mass spectrometry analysis of large protein complexes. Nature Protocols. 3 (7), 1139-1152 (2008).
- Lanucara, F., Holman, S. W., Gray, C. J., Eyers, C. E. The power of ion mobility-mass spectrometry for structural characterization and the study of conformational dynamics. Nature Chemistry. 6 (4), 281-294 (2014).
- Wyttenbach, T., Bowers, M. T. Structural stability from solution to the gas phase: native solution structure of ubiquitin survives analysis in a solvent-free ion mobility-mass spectrometry environment. Journal of Physical Chemistry B. 115 (42), 12266-12275 (2011).
- Marcoux, J., Robinson, C. V. Twenty years of gas phase structural biology. Structure. 21 (9), 1541-1550 (2013).
- Michaelevski, I., Kirshenbaum, N., Sharon, M. T-wave ion mobility-mass spectrometry: basic experimental procedures for protein complex analysis. Journal of Visualized Experiments. (41), (2010).
- Mesleh, M. F., Hunter, J. M., Shvartsburg, A. A., Schatz, G. C., Jarrold, M. F. Structural Information from Ion Mobility Measurements: Effects of the Long-Range Potential. Journal of Physical Chemistry A. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chemical Physics Letters. 261, 86-91 (1996).
- Taverner, T., Hernández, H., Sharon, M., Ruotolo, B. T., Matak-Vinković, D., Devos, D., Russell, R. B., Robinson, C. V. Subunit Architecture of Intact Protein Complexes from Mass Spectrometry and Homology Modeling. Accounts of Chemical Research. 41 (5), 617-627 (2008).
- Wysocki, V. H., Joyce, K. E., Jones, C. M., Beardsley, R. L. Surface-induced dissociation of small molecules, peptides, and non-covalent protein complexes. Journal of the American Society for Mass Spectrometry. 19 (2), 190-208 (2008).
- Hall, Z., Politis, A., Bush, M. F., Smith, L. J., Robinson, C. V. Charge-state dependent compaction and dissociation of protein complexes: insights from ion mobility and molecular dynamics. Journal of the American Chemical Society. 134 (7), 3429-3438 (2012).
- Hyung, S. J., Robinsons, C. V., Ruotolo, B. T. Gas-Phase Unfolding and Disassembly Reveals Stability Differences in Ligand-Bound Multiprotein Complexes. Chemistry & Biology. 16, 382-390 (2009).
- Hall, Z., Politis, A., Robinson, C. V. Structural modeling of heteromeric protein complexes from disassembly pathways and ion mobility-mass spectrometry. Structure. 20 (9), 1596-1609 (2012).
- Woods, L. A., Radford, S. E., Ashcroft, A. E. Advances in ion mobility spectrometry-mass spectrometry reveal key insights into amyloid assembly. Biochimica et Biophysica Acta. 1834 (6), 1257-1268 (2013).
- Daubenfeld, T., Bouin, A. P., van der Rest, G. A deconvolution method for the separation of specific versus nonspecific interactions in noncovalent protein-ligand complexes analyzed by ESI-FT-ICR mass spectrometry. J Am Soc Mass Spectrom. 17 (9), 1239-1248 (2006).
- Loo, J. A. Studying noncovalent protein complexes by electrospray ionization mass spectrometry. Mass Spectrometry Reviews. 16, 1-23 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유