Method Article
بروتون تقديم العلاج وتطبيقه السريري في الأورام الصلبة تحديد الأورام الخبيثة
In This Article
Summary
يتم عرض أساسيات التخطيط الإشعاع وإيصالها للعلاج بروتون استخدام سرطان البروستاتا كنموذج. ويسلط الضوء على تطبيق هذه المبادئ على مواقع مختارة من الأمراض الأخرى كيف بروتون العلاج الإشعاعي قد تعزز النتائج السريرية لمرضى السرطان.
Abstract
العلاج الإشعاعي طريقة المستخدمة بشكل متكرر لعلاج السرطان. على الرغم من أن آليات قتل الخلية مماثلة لجميع أشكال الإشعاع، تختلف خصائص أشعة الفوتون وبروتون في فيفو المستغلة إلى حد كبير وربما لتحسين النتائج السريرية. على وجه الخصوص، تفقد جزيئات البروتون الطاقة بطريقة يمكن التنبؤ بها كما أنها تمر عبر الجسم. يتم استخدام هذه الخاصية سريرياً التحكم في عمق الذي ينهي شعاع بروتون، وإلى حد جرعة الإشعاع خارج المنطقة المستهدفة. يمكن أن تسمح هذه الاستراتيجية لتحقيق تخفيضات كبيرة في الجرعة الإشعاعية لانسجة طبيعية تقع خارج هدفا ورم فقط. بيد أن تدهور الطاقة بروتون في الجسم لا يزال شديد الحساسية لكثافة الأنسجة. نتيجة لذلك، أية تغييرات في كثافة الأنسجة أثناء فترة العلاج قد يغير كثيرا من الجرعات بروتون. مثل هذه التغييرات قد تحدث من خلال التعديلات في وزن الجسم، والتنفس، أو ملء الأمعاء/الغاز، وقد ينتج عن ترسب جرعة غير المواتية. في هذه المخطوطة، نحن نقدم طريقة مفصلة لتقديم العلاج بروتون استخدام مبعثر السلبي وشعاع قلم المسح تقنيات لسرطان البروستاتا. على الرغم من أن الإجراء المبين تتصل مباشرة بمرضى سرطان البروستاتا، الأسلوب يمكن تكييفها وتطبيقها لعلاج الأورام الصلبة كلها تقريبا. أن هدفنا تزويد القراء بفهم أفضل لتقديم العلاج بالبروتون والنتائج بغية تسهيل اندماج هذه الطريقة المناسبة أثناء علاج السرطان.
Introduction
ومن المقدر أن 1.7 مليون من الأفراد في الولايات المتحدة سوف يكون تشخيص السرطان في عام 2018، مع ما يزيد على 600,000 الخضوع ل المرض1. خيارات العلاج الحالية تنطوي على العلاج modality أحادية أو متعددة باستخدام الجراحة والعلاج بالإشعاع (RT) والعلاجات الجهازية. فيما يتعلق ب RT، ستتلقى ربع المرضى الذين شخصت حالاتهم حديثا فإنه كجزء من علاج السرطان الأولى بهم، وما يقرب من نصف سيتطلب في نهاية المطاف من خلال بهم المرض بالطبع2،3.
ظهور RT يعود تاريخها إلى عام 1895 عندما اكتشف "وليام كونراد رونتجن" الأشعة السينية أثناء العمل مع أنبوب الكاثود رأي – في مختبرة في جامعة Würzberg في ألمانيا4. بعد فترة ليست بالطويلة، يتلقى المرضى المصابين بأمراض واسعة النطاق مثل الذئبة والسرطان علاجات باستخدام أشعة الراديوم. المضاعفات المبكرة وتحققت بسرعة وناقشها حتى بيار كوري في محاضرة نوبل له5. أن الإشعاع يؤثر على أنسجة طبيعية والورم، يجب استخدام جرعات الإشعاع التي تسيطر عليها بعناية لزيادة نسبة العلاجية، تعرف بأنها احتمال مراقبة الورم مقابل احتمال سمية غير مقبول. مع التقدم التدريجي في التكنولوجيا، فضلا عن فهم أفضل للبيولوجيا الإشعاعية والفيزياء، وهذه النسبة العلاجية قد تحسنت كثيرا مع مرور الوقت. استخدام الرايت عزز إلى حد كبير نتائج بالنسبة للعديد من أنواع السرطان، كما يتبين من إدراجها في المبادئ التوجيهية الوطنية للسرطان العلاج6،7،،من89. في بعض الحالات، قد تستخدم RT كأسلوب وحيد للعلاج10، بينما في الأمراض الأخرى، ويمكن استخدامه كجزء من العلاج بطريقة متعددة لمكافحة الأمراض المحلية أو القضاء على الأمراض المجهرية11. على الرغم من أن كثيرا ما تستخدم بقصد العلاج، العديد من الرايت المرضى هم من المعالجة للتخفيف من الألم أو الأعراض الأخرى التي تضع من الضغط الناجم عن ورم أو غزو أو تدمير للأنسجة الطبيعية في الإعداد الإقليمية وكو أو على نطاق واسع، والمنتشر المرض.
المبادئ الأساسية الكامنة وراء RT واضحة. مع تطبيق الإشعاع، تودع الطاقة في الخلايا عن طريق تاين الذرات. هذه الطاقة، وعلى الرغم من أنه قد رفع درجة حرارة منطقة المشع بسوي بضع ميكروكيلفين، تنتج الجذور الحرة التي يمكن مباشرة الأضرار تتعرض الخلايا عن طريق الحمض النووي إصابة12،13. الكثير من فهمنا للجسيمات ذات الطاقة العالية الإشعاع وتفاعلها مع هذه المسألة يأتي من الدراسات النظرية والتجريبية للأشعة الكونية وتفاعلاتها في طبقات الجو العليا نفذت في وقت مبكر 20 القرنال 14. ومكشاف الجسيمات المشحونة (مليون إلكترون فولط إلى جيف) التفاعل مع هذه المسألة في المقام الأول عن طريق القوة الكهرومغناطيسية: هذه الجسيمات تمر عبر هذه المسألة أو الأنسجة، تصادم مرن مع الإلكترونات المدارية تؤدي إلى التأين والإثارة للموضوع المستهدف، و تصادم مرن مع أنوية ذرية يؤدي إلى مبعثر أو انحراف مسار الجسيمات. وباﻹضافة إلى ذلك، التصادم النووي والاصطدامات الثابت مع الإلكترونات يؤدي إلى تتالي الإشعاع الثانوي الذي يضيف إلى تأثير الإشعاع الجسيمات المؤينة. الجسيمات العالية الطاقة تعبر هذه المسألة وبالتالي ترك أعقاب الذرات المتأينة والجزيئات والإلكترونات الحرة التي هي رد الفعل كيميائيا ويمكن أن يحتمل أن تحفز التغيرات البيولوجية أو الضرر للكائنات الحية المعرضة لهذه الحقول المؤينة.
وقد هدف طويل الأجل رئيسية للعلاج بالأشعة لمعرفة أفضل السبل لتسخير هذه الإشعاعات المؤينة الحقول على نحو فعال سوف علاج الأمراض البشرية. سريرياً، النموذج المثالي للإشعاع (مثل فوتون أو بروتون أو إلكترون أو أيون الثقيلة) ينبغي الحث على التأين كافية في الهدف المرض لتقديم العلاجية المضادة للورم أثر، بينما في نفس الوقت قضية الحد الأدنى التأين في العادية المحيطة بها الأنسجة إلى أدنى حد من الآثار الضارة بالصحة. يتم تحديد أي نوع من الإشعاع ل RT يعتمد جزئيا على هذا المرض يعالجون. للأورام التي تقع أعمق داخل الجسم، وقد تكون أيضا غير قابلة للتشغيل جراحيا، تعتبر الفوتونات ميجافولت والبروتونات والايونات الثقيلة المثلى15،16. للسرطانات السطحية، مثل تلك التي تنطوي على الجلد، وقد يكون الإلكترون العلاج الأمثل والأفضل حتى لعملية جراحية ل cosmesis. من ناحية أخرى، واستفادة الفوتونات ميجافولت تكمن في قدرتها على اختراق عميق في الأنسجة مع الحد من الضرر الذي يلحق الجلد. وفي حالة الجسيمات المشحونة مثل الإلكترونات أو البروتونات أيونات ثقيلة، تكمن ميزتها الأساسية في خصائصها 'إيقاف'؛ هو الجسيمات المشحونة تفقد الطاقة بشكل مستمر عن طريق تصادم مرن المذكورة أعلاه، وهذه الخسارة في الطاقة العالية يمكن التنبؤ بها بمقياس ملليمتر. ولذلك، يمكن تسليم شعاع جسيمات المشحونة لمريض مع الطاقات الدقيقة إلى الأعماق المرجوة. علاوة على ذلك، تنتج الجسيمات المشحونة قليلاً إلى أي خروج الجرعة17. على النقيض من ذلك، يحمل جسيمات دون توجيه تهم لهم مثل الفوتونات هبوطاً أسي (التوهين) مع زيادة العمق، الذي غالباً ما يؤدي إلى جرعة كبيرة خروج التي قد تنال من الأنسجة السليمة البعيدة إلى الهدف. وأظهرت هذه المفاهيم في الشكل 1، والذي يظهر بالإشعاع الجرعة (التأين) الخصائص لأنواع مختلفة من الإشعاع المستخدمة سريرياً. دافع مركزي لاستخدام البروتونات أو أيونات الكربون بدلاً من الفوتونات لعمق الورم الأهداف هو أن هناك جرعة إدخال الحد الأدنى من الجرعة والجرعة صفر الخروج خارج الأنسجة المستهدفة بالقرب. ويلخص الجدول 1 بعض الخصائص ذات الصلة سريرياً من عوارض فوتون وبروتون.
التقدم في مجال العلاج الإشعاعي، بما في ذلك العلاج بالبروتون، وقعت على جبهتين الرئيسية: 1) بناء مسرعات الجسيمات الفعالة القادرة على إنتاج الطاقة العالية الإشعاع (مليون إلكترون فولط) مثل مسرعات السنكروتروني وسيكلوترون، و 2) تطوير الطرق الحسابية المتطورة التي تجمع بين بيانات التصوير المرض وحسابات النقل الإشعاع للسماح لمحاكاة الكمبيوتر "تخطيط العلاج." للتخطيط، وعلاج المرضى عادة الخضوع التصوير المقطعي (CT). الصور المقطعية تحتوي على المعلومات التشريحية ثلاثية الأبعاد حول المريض، فضلا عن دقة التحديد الكمي لكثافة الأنسجة. الصور المقطعية وخرائط الكثافة ثم المستخدمة في عمليات المحاكاة بالحاسوب لخطة العلاج الإشعاعي: كل من الطاقة وكثافة في مجال الإشعاع رياضيا هي الأمثل لكل مريض. كما يمكن إجراء فحص تصوير بالرنين المغناطيسي (التصوير بالرنين المغناطيسي) أو تفحص انبعاث بوزيترون طبقي (PET) لتكملة البيانات المقطعية.
فيما يلي، يصف لنا مخطط تفصيلي خطوة بخطوة لكيف يتم الانتقال المرضى خلال دورتهم العلاج الإشعاعي، متبوعة أمثلة على بعض أنواع الورم تعامل مع العلاج بروتون.
Protocol
البروتوكول تخطيط وتقديم العلاج الإشعاعي الدقيق يختلف حسب موقع المرض وقد تتطلب حتى الفردية لكل مريض. وعلاوة على ذلك، قد يتطلب الإجراء تعديلات لاستيعاب التفضيلات المؤسسية وتوافر المعدات. غرض هذه المناقشة، فإننا سوف مخطط الخطوات المستخدمة للتخطيط في حالة سرطان البروستاتا نموذجية لأن هذا هو السرطان الأكثر شيوعاً تعامل مع العلاج بروتون في الولايات المتحدة مراكز18بروتون. هذا البروتوكول يصف الإجراءات القياسية للرعاية السريرية، وذلك لا يتطلب موافقة لجنة أخلاقيات البحوث البشرية المؤسسية.
1-التصوير المقطعي محاكاة للعلاج الإشعاعي
- إدراج الطاولة الموسعة في الجدول المعاملة والتأكد من أنه مؤمن.
- ضع وسادة تجميد مبالغ فيها على أعلى الجدول وبار الفهرسة للعفن الساق على مستوى الركبة للمريض.
- مكان استراحة رأس صلبة في الجزء العلوي من الجدول. بدء تشغيل مع و حجم الرأس، الذي يستوعب معظم المرضى.
- التأكد من أن المريض قد أكملت عملية المثانة الكامل من الشرب 16-24 أوقية من السوائل 45 دقيقة قبل وقت الفحص المجدول. هذه الخطوة يجب أن تكتمل قبل 1.12 خطوة.
- سجل المريض في نظام تسجيل المريض CT.
- حدد بروتوكول المسح البروستاتا مع شريحة سمك 3 مم.
- وتؤكد أن موافقة العلاج، وموافقة على النقيض ومحاكاة النظام الانتهاء من الطبيب المعالج.
- أطلب من المريض إلى تغيير في ثوب وإزالة جميع الملابس من منطقة الخصر إلى الأسفل.
- تأكيد هوية المريض لفظياً التحقق من المريض في الاسم، وتاريخ الميلاد، والموقع الداخلي.
- التقاط صورة وجه للمريض.
- أطلب من المريض الجلوس على الطاولة وثم مساعدة المريض في موقف ضعيف، وأول رئيس.
- وضع الساقين للمريض في وسادة تجميد مبالغ فيها ووضع الأسلحة المريض على صدره بتشبيك أصابعهم، ومنحهم عصابة أزرق، أو تطبيق الأشرطة حول أسلحتهم.
- تأكد من محاذاة المريض مع نظام الليزر.
- قم بتوصيل مضخة فراغ مزدوج على فوهة وسادة التثبيت.
- وضع الساقين في وسادة التثبيت بحيث العفن سوف يطوق الجانب الساقين وأيضا إنشاء حاجز بين الساقين. ضمان تجميد وسادة أسفل الحوض ويمتد القدمين.
- إدراج وتضخيم بالون اندوريكتال ab إذا بينت سريرياً للطبيب الواحد.
- أداء الأمامي الخلفي (AP) والأفقي (LAT) الكشفية كيلوفولتاجي الأشعة السينية الصور (توبوجرامس) للتأكد من أن المريض المحاذاة هو الأمثل. يتضمن هذا التحقق من الاستقامة على الصورة AP والمحاذاة التناوب على الصورة الجانبية. استخدام كل الصور للتأكد من أن الغاز الأمعاء الحد الأدنى. تحديد المواقع ينبغي كل تصحيح وأكدت مع إعادة التصوير. إذا كان غاز الأمعاء الحاضرة والمفرط، عذر المريض إلى المرحاض وإعادة تشغيل العملية من "الخطوة 1، 15".
- بمجرد المريض في الموضع المطلوب، إزالة الهواء من وسادة التثبيت باستخدام مضخة فراغ مزدوج ف--فيكس لتشكيل العفن صلبة حول الساقين والقدمين.
- ضبط الجدول المعاملة يدوياً حيث تكون مرمى الليزر على مستوى الوركين المريض، وفي خط الوسط الوركين والبطن في مستوى الورك. تحديد مواقع التقاطع على المريض استخدام قلم تمييز. وضع علامات التعريب في مرمى لتعيين نقطة انطلاق لمحاكاة التحقق أثناء تسليم الإشعاع.
- مجموعة CT مسح معلمات تشمل منطقة الحوض من العمود الفقري L3 إلى منتصف عظم الفخذ.
- فحص المريض استخدام بروتوكول المسح البروستاتا.
- تأكيد أن التفحص مقبول لتخطيط العلاج. يجب أن تكون المثانة الكامل، والمستقيم ينبغي أن يكون الحد الأدنى من الهواء أو البراز.
- تصدير ملف المسح الرقمي لبرامج التخطيط العلاج وإخطار الجرعات الإشعاعية.
- تسمية وسادة تجميد المريض مع المريض معرف معاملة اسم الطبيب، وإعداد تعليمات قبل التخزين للاستخدام اللاحق أثناء العلاج.
- انتقل إلى "الخطوة 2، 1" إذا يمر المريض بقلم رصاص شعاع بروتون العلاج. تخطي إلى الخطوة 3.1 إذا سوف يتلقى المريض العلاج بروتون مبعثر السلبي.
2-إشعاع معالجة تخطيط استخدام العلاج شعاع قلم رصاص
- استيراد بيانات محاكاة CT في معالجة تخطيط البرامج (TPS).
- استخدام العلاج نظام التخطيط الكنتوري أدوات لتعريف جميع وحدات هندسية ذات الصلة استناداً إلى صور الأشعة المقطعية المكتسبة. وتشمل هذه الهياكل المثانة والمستقيم والأمعاء الغليظة، الأمعاء، رؤساء فخذي، سطح الجسم الخارجي، فيدوسيالس، مباعدة المستقيم أو بالون اندوريكتال.
- قم بإنشاء كفاف خارجية إضافية، الذي يشمل الجسم والجدول المعاملة وأي أجهزة التثبيت. ويتم احتساب فقط جرعة الإشعاع داخل هذا المحيط.
- كفاف وحدة التخزين الهدف السريرية الأولى (CTV1) أن تدرج في البروستاتا والحويصلات الليمفاوية المعنية. وسوف يشرع في CTV1 45.0 غراي (التاليتين). سوف يكون حجم CTV1 مظهر بنية على شكل U على الصور المحوري. الأنسجة الطبيعية الأمعاء والمستقيم والمثانة صغيرة تتواجد داخل وحدة التخزين الهدف على شكل U.
- كفاف وحدة التخزين الهدف السريرية الثانية (CTV2) لتشمل البروستات والحويصلات. وسوف يشرع في CTV2 جرعة إجمالي 34.2 غراي (التاليتين).
- حدد الدعامات الثلاث زوايا الهزال من 90، 180 و 270 درجة لمعالجة حجم CTV1. حدد فقط في 90 وزوايا شعاع 270 درجة للعلاج CTV2.
- تصميم هيكلين حظر هندسية (مجلدات الأبطال).
- إنشاء وحدة تخزين "منتصف كتلة" إبطال يشمل أنسجة طبيعية داخل المجلد CTV1 على شكل U.
- كتلة الجانب السفلي لشعاع الخلفي الأمامي (180 درجة) أدنى من مستوى الأعلى من البروستات باستخدام مصطلح "قطعة المستقيم".
- إنشاء توسيع 7 ملم الخواص CTV1 لتشكيل بروتون تخطيط وحدة التخزين الهدف، المسمى pPTV1. استخدام pPTV1 تحديد وحدة تخزين موضع تركيز مثل أن قمم البروتون براج (المشار إليها أيضا بروتون "البقع") متوضعة بمحسن التخطيط لتغطية CTV1.
- كما هو الحال في "الخطوة 2، 6"، قم بإنشاء عملية توسيع مماثل لحجم CTV2 شكل pPTV2، ولكن استخدام توسيع 8 ملم باتجاه اليسار واليمين والتوسعات 5 مم في كلا الاتجاهين الأمامي الخلفي وأدنى من الأعلى.
- لتمكين أمثلية قوية، إنشاء ميزة التي يمكن أن تمثل الإعداد عدم اليقين ونطاق عدم اليقين، وملء متغير غازات الأمعاء، الاصطناعية ("التجاوز") CT مجموعتين من البيانات: الأولى بأكملها الأمعاء الدقيقة، الأمعاء الغليظة، والمستقيم تجاوزها لكثافة الهواء، والثانية وحدات التخزين هذه الكتابة إلى كثافة العضلات.
- قبل التحسين، وإنشاء خطة جديدة لعلاج CTV1. تعيين الجهاز معاملة بروتون لاستخدامها للتخطيط وتعيين الجرعة المقررة وتجزئة 45 غراي (التاليتين) في 25 الكسور وتحديد الهدف الرئيسي لتكون CTV1. تعيين 100% الجرعة الموصوفة تغطي 98 في المائة على الأقل من حجم CTV1 استخدام جميع الحزم 3 (الجانبية اليمين واليسار الجانبي والخلفي الأمامي).
- إنشاء خطة علاجية أخرى CTV2 مع مجموعات شعاع 2. أولاً، تعيين 18 غراي (التاليتين) التي ستلقى في الكسور 10 إلى CTV2 استخدام شعاع الجانبي الأيسر فقط، وتعيين 16.2 غراي (التاليتين) التي ستلقى في الكسور 9 إلى CTV2 استخدام شعاع الحق الأفقي فقط. تعيين 100% الجرعة الموصوفة لتغطية 100% حجم CTV2.
- التحضير للاستفادة المثلى من هذه الخطة CTV1
- تعيين هيكل كتلة منتصف كهامش مجموعة لعوارض جانبية وتعيين هيكل كتلة المستقيم كهامش مجموعة لشعاع الخلفي الأمامي.
- تبدأ التحسين التلقائي (افتراضي) إعدادات الطاقة طبقة التباعد وتباعد بقعة الهامش المستهدفة.
- تحديد الحد أقصى لعدد تكرارات 40، عدد أقصى من قبل "تصفية موضعية" لتحسين الأداء من 10، ووزنها 1.5 وحدات رصد بقعة الحد أدنى. بقعة تصفية يزيل البقع بروتون مع وحدات مراقبة أقل من 1.5، كما يوجد حد أدنى تقنية على عدد البروتونات التي يمكن تسليمها بواسطة آلة العلاج.
- في الجولة الأولى من الأمثل CTV1، تعيين الهدف pPTV1 إنشاء شبكة المواقف بقعة بروتون. الأهداف المحددة هي 45.5 غراي (التاليتين) (الوزن = 100) إلى pPTV1 وهبوطاً جرعة من 45 إلى 0 غراي (التاليتين) على مسافة 1 سم (الوزن = 2).
- تبدأ جولة ثانية من الأمثل ل CTV1، بحذف pPTV1 الأهداف المذكورة أعلاه. ثم تستأنف الأمثل مع أهداف جديدة وموضوعية الأوزان. تحديد هذه المعلمات كما يلي لوضع خطة كثافة التضمين، يعرف أيضا باسم الحقل متعدد الأمثل (القوة المتعددة الجنسيات).
- لوحدة التخزين الخارجية، تعيين هبوطاً جرعة من 45 إلى 0 غراي (التاليتين) على مسافة 1 سم ووزنها 2.
- بالنسبة لحجم CTV1، تعيين جرعة الحد أدنى من 45 غراي (التاليتين) بوزن 100.
- بالنسبة لحجم CTV1، تعيين جرعة موحدة 45.5 غراي (التاليتين) ووزنها 100. تعيين هذا الهدف كقوى.
- لهذا المجلد pPTV1، تعيين الجرعة القصوى في 46 غراي (التاليتين) بوزن 100 وتعيين هذا الهدف كقوى.
- بالنسبة لحجم المستقيم، تعيين أقصى جرعة 45.8 غراي (التاليتين) بوزن 50. تعيين هذا الهدف كقوى.
- بالنسبة لحجم المثانة، تعيين أقصى جرعة 45.8 غراي (التاليتين) بوزن 50. تعيين هذا الهدف كقوى.
- بالنسبة للامعاء، تعيين أقصى جرعة 45.8 غراي (التاليتين) بوزن 50. تعيين هذا الهدف كقوى.
- بالنسبة للامعاء الغليظة، تعيين أقصى جرعة 45.8 غراي (التاليتين) بوزن 50. تعيين هذا الهدف كقوى.
- بالإضافة إلى أهداف محددة، تعيين إعدادات متانة للتخفيف من نوبات الموضعية 5 مم، 3.5% نطاق عدم اليقين، وإدراج البيانات المقطعية ("التجاوز") الاصطناعية المشار إليها أعلاه إلى عنوان الأمعاء الغاز تقلب. تطبيق هذه الإعدادات متانة فقط على تلك الأهداف المحددة أعلاه ك "قوية".
- استكمال التحسين لخطة CTV1 واستعراض الخطة الأمثل الناتجة التأكد من أن الوصفة الأهداف قد تحققت.
- إعداد لتعظيم الاستفادة من هذه الخطة CTV2
- استكمال التحسين الأولى لخطة CTV2 باستخدام pPTV2 تحقيق شبكة التوظيف بقعة كخطة CTV1.
- حذف الأهداف pPTV2 واستئناف الأمثل مع أهداف جديدة (بالنسب المئوية فيما يتعلق بالتقادم CTV2). بالنسبة للخطة CTV2، تحسين هذه الأهداف للشعاع الأيسر والأيمن على حدة. ويعرف هذا كحقل واحد الأمثل (SFO) والأهداف لكل شعاع كما يلي.
- لوحدة التخزين الخارجية، وتعيين هبوطاً جرعة 34.2 غراي (التاليتين) إلى 0 غراي (التاليتين) ضمن مسافة 5 ملم ووزنها 2.
- بالنسبة لحجم CTV2، تعيين جرعة الحد أدنى من غراي 34.37 (التاليتين) بوزن 120.
- بالنسبة لحجم CTV2، تعيين جرعة موحدة من غراي 34.54 (التاليتين) بوزن 100. تعيين هذا الهدف كقوى.
- بالنسبة لحجم pPTV2، تعيين أقصى جرعة من غراي 34.88 (التاليتين) بوزن 100. تعيين هذا الهدف كقوى.
- استخدام نفس إعدادات متانة للتحسين.
- استكمال التحسين بشكل منفصل لليسار وعوارض جانبية الحق لإنشاء خطة 2 شعاع مجموعات. هذا سيتم السماح بتوصيل الإشعاع إلى CTV2 باستخدام أما العوارض الجانبية اليمين أو اليسار. هذا على النقيض من إيصال جرعة CTV1، الذي يتطلب كافة الحزم 3 (RL، ليرة لبنانية، والسلطة الفلسطينية) لاستخدامها لكل معاملة.
- استعراض خطط العلاج CTV1 و CTV2 بشكل مستقل، وفي الجمع التأكد من أنها تفي بالقيود جرعة التشعيع سرطان البروستاتا أنشأها 0126 رتوج المحاكمة19.
- لحجم المثانة، التأكد من أن النسبة المئوية للأنسجة تلقي 80 غراي أقل من 15%، والنسبة المئوية تلقي غراي 75 أقل من 25 في المائة، والنسبة المئوية تلقي غراي 70 تحت 35%، والنسبة المئوية تلقي 65 غراي هو أقل من 50%.
- لوحدة التخزين المستقيم، والتأكد من أن النسبة المئوية للأنسجة تلقي غراي 75 أقل من 15 في المائة، والنسبة المئوية تلقي غراي 70 تحت 25%، النسبة المئوية تلقي 65 غراي هو أقل من 35%، والنسبة المئوية تلقي 60 غراي أقل من 50%.
- لحجم القضيب لمبة، تأكد أن الجرعة يعني تحت 52.5 غراي.
- للتخزين الهدف CTV1 و CTV2، كفالة حصول 95 في المائة على الأقل من كلا المجلدين الجرعة المقررة.
- إذا خطط وتوزيعات الجرعة تستوفي المبادئ التوجيهية قيد الجرعة المقبولة ومتانة، الحصول على موافقة الطبيب وتصدير هذه الخطط بنظام التسليم بالعلاج.
- قياس للتأكد من دقة الجرعة المخطط استخدام صفائف غرفة تاين، نوع من الكشف عن الإشعاع.
- التحقق من دقة حساب جرعة استخدام برمجيات حساب جرعة الثانوية ومستقلة.
- استعراض نتائج قياس وحساب النتائج، والخصائص التقنية للخطة مع عالم الفيزياء طبية لضمان مراقبة الجودة.
- إنشاء وثائق تخطيط العلاج والموافقة عليها دوسيميتريست التخطيط والفيزيائي، والإشراف على الطبيب.
- تصدير جميع أنواع العلاج تخطيط البيانات لنظام تقديم العلاج لعلاج المريض وتخطي إلى "الخطوة 4، 1" لتقديم العلاج بروتون.
3-الإشعاع العلاج التخطيط مبعثر السلبي أو زي المسح بروتون العلاج:
- استيراد بيانات محاكاة CT إلى العلاج الإشعاعي نظام التخطيط.
- كفاف استناداً إلى جميع وحدات هندسية ذات الصلة المكتسبة الصور المقطعية. وتشمل هذه الهياكل المثانة والمستقيم والأمعاء الغليظة، الأمعاء، رؤساء فخذي، سطح الجسم الخارجي، فيدوسيالس، مباعدة المستقيم أو بالون اندوريكتال.
- قم بإنشاء كفاف خارجية إضافية. استخدام أداة "عملية منطقية" لتشمل الجسم والجدول المعاملة وأي أجهزة التثبيت. ويتم احتساب فقط جرعة الإشعاع داخل هذا المحيط.
- كفاف CTV1 أن تدرج في البروستاتا والحويصلات الليمفاوية المعنية. وسوف يشرع في CTV1 45.0 غراي (التاليتين).
- CTV2 كفاف لتشمل البروستات والحويصلات. وسوف يشرع في CTV2 جرعة إجمالي 34.2 غراي (التاليتين).
- قم بتوسيع CTV1 من 7 ملم لإنشاء pPTV1 وإنشاء pPTV2 بتوسيع CTV2 من 7 ملم في جميع الاتجاهات ما عدا 5 ملم في الخلف.
- إنشاء الحزم في معالجة تخطيط النظام لاستهداف pPTV1 و pPTV2. وستوجه pPTV1 استخدام شعاع واحد 180° السلطة الفلسطينية بينما سيتم استهداف pPTV2 استخدام عوارض جانبية 90 و 270 درجة.
- إضافة كتل لكل شعاع مع هامش موحدة من 0.5 سم إلى وحدات تخزين pPTV1 و pPTV2.
- استخدام تحديد حجم كتلة الفتحة شعاع أصغر حجم ممكن استناداً إلى حجم وحدة التخزين بطف كل. الفتحة شعاع هو الفصل المخصص النحاس الذي سيلحق بانف الهزال إلى حواف الشكل الأفقي لكل شعاع بروتون.
- نموذج المعوض الشمع المناسبة اللازمة لتشكيل الهوامش البعيدة والقريبة من كل شعاع بروتون بتحديد المعلمات شعاع المناسبة كما يلي.
- إدخال قيمة عدم يقين تتراوح من 3.5 في المائة بالإضافة إلى إضافي 1-2 مم.
- إدخال المسافة الجوية المناسبة الفجوة بين الفتحة والمريض.
- على نحو سلس وتشويه الشكل المعوض للتدرج الجرعة المطلوبة.
- تعيين إيسوسينتيرس pPTV1 و pPTV2 على نفس الموقع بهدف التقليل من المريض التحولات اللازمة لإيصال شعاع بروتون.
- حساب الجرعات استخدام المعلمات التي تم إدخالها في الخطوات 3.10.1-3.10.4 للخطط المستهدفة pPTV1 و pPTV2 على السواء.
- استعراض خطط العلاج pPTV1 و pPTV2 بشكل مستقل، وفي الجمع التأكد من أنها تفي بالقيود جرعة التشعيع سرطان البروستاتا أنشأها 0126 رتوج المحاكمة19 وهو موضح في الخطوات 2.17.1-2.17.4.
- إذا رغبت في عدم تحقيق أهداف أور والمستهدفة للتغطية بالجرعة، ثم ضبط معلمات الكتلة والمعوض في النقاط التجارية كما هو موضح في الخطوات 3.8-3.10 حتى تتحقق الأهداف. بمجرد تحقيق الأهداف، الحصول على موافقة الطبيب والمضي قدما إلى الخطوة 3.14.
- التحقق من دقة حساب الجرعة في الخطة المعتمدة باستخدام حزمة برامج حساب جرعة الثانوية ومستقلة.
- استعراض نتائج قياس وحساب النتائج، والخصائص التقنية للخطة مع عالم الفيزياء طبية لضمان مراقبة الجودة.
- ترتيب الكتل والموازن، من البائع المناسب.
- سؤال وجواب كتل والموازن، حصلت عليها من المورد.
- إنشاء وثائق تخطيط العلاج والموافقة عليها عبر التواقيع الرقمية دوسيميتريست التخطيط والفيزيائي، والإشراف على الطبيب.
- تصدير جميع أنواع العلاج تخطيط البيانات لنظام تقديم العلاج لمعالجة المرضى، والمضي قدما إلى "الخطوة 4، 1".
4-الإشعاع علاج التسليم
- في اليوم الأول من العلاج، تحقق للتأكد من أن الخطة الإشعاع يطابق المعلمات الخطة في نظام المعالجة.
- ترتيب الغرفة معاملة استخراج الإعداد المريض المستخدمة أثناء محاكاة CT. تأكد من أن يطابق التسمية وسادة تجميد المريض معرف ومكان ثم على طاولة العلاج مع الفهرسة الصحيحة. ضع مسند الرأس تستخدم في محاكاة على رأس الجدول.
- تأكيد مع المريض التي أكملت عملية المثانة الكامل وغيرت في ثوب علاج.
- مرافقة المريض إلى غرفة العلاج، ووضعه في موقف ضعيف على طاولة العلاج بيديه شبك عبر الصدر والساقين في وسادة التثبيت.
- إدراج وتضخيم بالون اندوريكتال إذا استخدمت خلال المحاكاة.
- نقل الجدول المعاملة إلكترونيا من الحمولة نحو إيسوسينتير محاذاة المريض للعلامات التي يتم وضعها من خلال المحاكاة. ضبط الجدول لتصحيح أي أخطاء جسيمة في المريض لتحديد المواقع مثل الملعب، والتناوب، والسيد ياو.
- حالما يتم محاذاة المريض بشكل صحيح على علامات المحاكاة، إكمال التحول من موضع البداية لأولئك المصممين خلال العلاج الجرعات عملية التخطيط لمحاذاة المريض إلى إيسوسينتير العلاج المطلوب.
- أداء كيلوفولت متعامد التصوير لضمان التوافق المريض الداخلي السليم لعظام الحوض وعلامات الاعتماد على وضعه مسبقاً بالمسالك البولية داخل البروستاتا.
- تحديد إذا كانت هناك حاجة إلى تعديلات الموضعية استناداً إلى تراكب الصور كيلوفولت المكتسبة على الصور الشعاعية رقمياً أعيد بناؤها من محاكاة المقطعية التخطيط. تطبيق التحولات اللازمة لضمان التوافق.
- إذا تبين الصور كيلوفولت غازات الأمعاء المفرطة، أطلب من المريض طرد الهواء بينما الكذب على طاولة العلاج إذا كان ذلك ممكناً، ثم إعادة ترتيب وإعادة الصورة.
- إذا كان المريض غير قادر على إطلاق سراح على طاولة العلاج، إحباط المعاملة ويكون المريض الذهاب إلى المراحيض. بعد عودة المريض من المراحيض، قم بإعادة تشغيل عملية التسليم بروتون من "الخطوة 4، 3".
- حالما يتم الحصول عليها الصور كيلوفولت مقبولة وأكد، اكتمال شعاع مخروط مسح CT (كبكت) لتقييم المثانة/المستقيم ملء. تطبيق التعديلات تحديد الموضع المريض إضافية استناداً إلى المسح الضوئي كبكت. مع تصحيحات تحديد المواقع المستندة إلى تصوير كيلوفولت، التغييرات التي تم إجراؤها باستخدام بيانات CBCT سيتم إرسال مباشرة من وحدة التصوير للجدول المعاملة للتطبيق الآلي.
- تحقق من كافة التصحيحات الموضعية مع الطبيب قبل البدء في العلاج اليوم الأول من العلاج بالبروتون.
- الشروع في تقديم العلاج مع التحقق مسموعة بين اثنين من المعالجين من زاوية الهزال، وحدات رصد عدد البقع المسح والطبقات، والموقف الآنف لكل زاوية في المعاملة. يتم عرض هذه المعلمات في وحدة العلاج وفي وثائق التخطيط التي وقعت بقياس الجرعات الإشعاعية، والفيزياء، والطبيب المعالج.
- بعد العلاج، ومارك إيسوسينتير العلاج لمحاذاة اليومية وإزالة العلامات.
- كرر الخطوات من 4.2 4.9 لجميع الكسور المعالجة اللاحقة.
النتائج
البيانات المتاحة تشير إلى فائدة كبيرة مع بروتون العلاج لبعض أنواع السرطان20،21. وقد يفضل حزب العمال لحدد طب الأورام أو سرطانات المتكررة في مناطق سبق المشع أو غيرها من أنواع السرطان حيث خطر إصابة أنسجة طبيعية عالية مع العلاج فوتون. فيما يلي، نناقش تطبيق والاستفادة من العلاج بروتون للبروستاتا، وسرطان الثدي وميدولوبلاستوما. أن هدفنا تزويد القراء بفهم أفضل لتطبيق العلاج بالبروتون للأورام شيوعاً في الرجال والنساء والأطفال.
في الولايات المتحدة، سرطان البروستاتا الأكثر شيوعاً تشخيص الورم الخبيث في الرجال والسبب الثاني الأكثر شيوعاً للوفيات المتصلة بالسرطان بين الرجال. سوف يمكن تشخيص حدوث حالات جديدة 164,690 المقدرة في عام 2018، وسوف يموت الرجال 29,000 أكثر من هذا المرض. مرضى سرطان البروستاتا المنتشر-عدم تكون مؤهلة للحصول على خيارات العلاج، بما في ذلك المراقبة النشطة والبروستاتا جذرية والسينيه والإشعاع شعاع خارجي مع الفوتونات أو البروتونات22. العلاج الدقيق القرارات تبعاً للتشريح المرضى، comorbidities، مرحلة الورم، وتفضيل الحكم والمريض الطبيب.
توصيل الإشعاع لسرطان البروستاتا المرحلة الأولى يقتصر على غدة البروستات. وفي حالة سرطان البروستاتا المخاطر المتوسطة، والحويصلات الدانية تستهدف كذلك. على الرغم من أن يجري استكشاف العلاجات البروستاتا الجزئي، يظل العلاج الغدة كلها مستوى الرعاية. سدادي، العقد حرقفي عجزي مسبقاً، والداخلية حرقفي، والخارجية غالباً للمرضى الذين يعانون من الأمراض المتوسطة والشديدة الخطورة غير المواتية.
قبل العلاج الإشعاعي يمكن وضع علامات التخطيط والاعتماد للسماح بالعلاج الموجهة بصورة باستخدام التصوير كيلوفولتاجي قبل العلاج (أي.، الأشعة السينية القياسية)23. وبالإضافة إلى ذلك، يمكن أيضا إدراج فاصل المائية قبل محاكاة الأشعة المقطعية لخلق فجوة بين المستقيم والبروستاتا لزيادة جرعة الحد إلى أنسجة المستقيم24،25. أثناء معالجة التخطيط، وينبغي محاكاة المرضى في موقف ضعيف مع الحوض معطلة باستخدام جهاز وسادة مخصصة. ويمكن وضع بالون المستقيم في محاكاة الأشعة المقطعية للحد من الحركة البروستاتا وعدم اليقين فيما يتعلق ب حجم وكثافة المستقيم26. ينصح مثانة كامل بشكل مريح للحد من الجرعات للامعاء والجزء الأمامي من المثانة27. وينصح أيضا محاكاة التصوير بالرنين المغناطيسي للسماح بتحديد حجم الهدف أكثر دقة26.
العلاج ينبغي أن تصمم لتقديم جرعات من 75.6-79.2 غراي في البروستاتا، مع الجرعات غراي 45-50.4 أوصت للتغطية الاختيارية من العقدي أو حويصلة المناطق المعرضة لخطر الإصابة بأمراض مجهرية تنتشر9. يتم تسليم كافة الكسور مرة واحدة يوميا في 1.8 إلى 2 غراي كل جزء. لتلقي دفعة السينية المرضى المتوسطة والشديدة الخطورة، ينبغي أن تكون الجرعة الإشعاعية الخارجية شعاع محدودة إلى ما يقارب 45 غراي. وينبغي استخدام جرعات الأشعة غراي 110 مع معدل الجرعة المنخفضة I-125 يزرع الدائمة. مع تسليمها عن طريق القسطرة السينية معدل جرعة عالية، تشمل أنظمة شائعة دفعة الكسر غراي x 1 13 إلى 15، 8 إلى 11.5 غراي x 2 الكسور والكسور غراي x 3 5.5 إلى 6.5 و 4.0 إلى 6.0 غراي x 4 الكسور9.
تخطيط قياس الجرعات الإشعاعية في المعاملة هو الأمثل للحد من الجرعات بالمثانة والمستقيم والأمعاء. قياس الجرعات مقارنات بين فوتون-مقابل بروتون-أساس العلاج (أي.، IMRT مقابل تقنيات IMPT) أثبتت تجنيب محسنة لجرعات لانسجة طبيعية مع هذا النهج الأخير28.
وفيات سرطان البروستاتا محددة أقل من 2 في المائة في 10 سنوات للرجال مع المرض المرحلة المبكرة22 بغض النظر عن المعاملة المحددة. مع تكثيف جرعة RT، إظهار المرضى عالية المخاطر أيضا من وفيات سرطان البروستات منخفضة محددة من 5% في 9 سنوات29. الوفيات لا تزال منخفضة إلى حد كبير نظراً لتوافر العلاجات الجهازية التي تظل فعالة في الإعداد المنتشر. تبقى النتائج مع العلاج إيمرت وبروتون ممتازة30،31. دراسة بارتيقول (NCT01617161) دراسة معشاة ذات شواهد، الجارية بين بروتون شعاع العلاج (PBT) وإيمرت لسرطان البروستاتا المخاطر المنخفضة والمتوسطة التي نأمل أن تحدد إذا كان أسلوب واحد متفوقة على الآخر.
أن سرطان الثدي الأكثر شيوعاً تشخيص الورم الخبيث في المرأة والسبب الثاني الأكثر شيوعاً للوفيات المتصلة بالسرطان بين النساء في الولايات المتحدة. سوف يمكن تشخيص حدوث حالات جديدة 268,670 المقدرة في عام 2018، والنساء 41,400 سوف يموت من المرض1. خلافا لتلقي مريضات سرطان الثدي في سرطان البروستاتا حيث يتلقى معظم المرضى الإشعاع الأحادي، الإشعاع بعد التقليل من خطر السرطان تكرار11. تبعاً لمدى الجراحة المطلوبة، قد تكون مستهدفة الإشعاعي للثدي المتبقية بعد lumpectomy ورم أو جدار الصدر بعد استئصال الثدي11،32. قد تكون مستهدفة الإقليمية الغدد الليمفاوية في الإبط، سوبراكلافيكولار والمناطق الداخلية الثديية إذا فهي تعتبر في خطر لانتشار الورم.
جداول العلاج لمرضى الثدي عادة ما ينطوي العلاج مرة واحدة يوميا، خمسة أيام في الأسبوع. أوائل المرحلة المرضى يعالجون عموما مع تقليديا مجزأ (1.8 2.0 غراي/الكسر؛ 50 غراي المجموع) أو أنظمة هيبوفراكتيوناتيد (2.67 غراي/الكسر؛ مجموع غراي 40.05-42.56) إلى11،الثدي كله33. المرضى الذين يعانون من المرض أكثر تقدما، ولكن المترجمة تعامل مع تجزئة التقليدية إلى 50 غراي (1.8 2.0 غراي/الكسر) لكامل جدار الثدي أو الصدر والغدد الليمفاوية الإقليمية. هذه الجرعات تكون فعالة للأمراض السريرية التي قد تكون موجودة في أعقاب عملية جراحية.
عادة ما يتم إكمال محاكاة الأشعة المقطعية للعلاج سرطان الثدي بالأشعة في موقف ضعيف. وعلى النقيض من سرطان البروستاتا، يتم اختطافهم كلا ذراعيه النفقات العامة للسماح بالتعرض لانسجة الثدي أو جدار الصدر. وبالإضافة إلى ذلك، كثيرا ما تستخدم الجهاز تعانق مخصصة، والثدي-المجلس شل الصدر في موقف يثير حتى لا يكون موازيا للجدول المعاملة قبضة. وهذا ما يضمن أن لا تدخل أنسجة الثدي ﻷسلحته إلى منطقة الرقبة.
ويرتبط التعرض للإشعاع للقلب خلال سرطان الثدي مع زيادة خطر الإصابة بالأمراض الدماغية المستقبل34. نتيجة لذلك تقنيات لتقليل جرعات القلب من الأهمية بمكان. يتمثل أحد النهج لتوظيف عقد التنفس العميق الشهيقيه (ديبة) لزيادة الحيز الوعائي والمسافة بين القلب والصدر الأمامي الجدار/الثدي. كما يدل على ذلك الأسلوب، سوف تعلق دورة الجهاز التنفسي المرضى الذين يعالجون ديبة وتلقى العلاج في نقطة الحد الأقصى للإلهام. ليس جميع المرضى غير قادرة على تحمل يحمل التنفس لمدة تكفي للسماح بهذا الأسلوب. في بعض المرضى، قد يكون من المفيد موقفا معرضة ويأذن بأنسجة الثدي لشنق بعيداً عن الأنسجة العادية الحاسمة، بما في ذلك قلب35. عيب هذا النهج هو القيد فإنه يضع على القدرة على المناطق المستهدفة اللمفاوي. يمكن تحقيق العلاج بروتون تدخر الجرعة القلب كبيرة دون الحاجة إلى ديبة وتقنيات عرضه36،37.
العلاج بروتون يعمل لمرضى سرطان الثدي وقد ثبت أن تكون متفوقة على التقنيات المستندة إلى الفوتون فيما يتعلق بآثار الجرعة تجنيب على الهياكل الحيوية مثل الرئتين والقلب38. يمكن استخدام شعاع قلم رصاص حقل مفرد المسح الضوئي (PBS) الخطة مع شيفتر نطاق إدارة بروتون الإشعاع إلى جدار الصدر والعقد الإقليمية. كما يمكن استخدام النهج السلبي المبعثر. إذا كانت حقول متعددة مطلوبة من أجل معالجة جدار الصدر كامل والعقد الإقليمية بسبب قيود الحقل، ثم يجب استخدام حقل مطابقة التقنيات. استراتيجية واحدة استخدام مطابقة سوبراكلافيكولار والصدر الجدار الحقول المتطابقة مع فجوة في جلد 2-4 مم أسفل الرأس العضدي39. يتم نقل حدود الحقل على مسافة 1 سم في نقاط زمنية مختلفة أثناء الإشعاع للتقليل من البقع الساخنة والباردة.
وتبين النتائج السريرية مع الإشعاع سرطان الثدي البقاء على قيد حياة عموما من 50% لبداية مرحلة المرض11 و 37 في المائة للمرضى محلياً متقدمة في المتابعة 20 سنة32. ونظرا للفترة الطويلة مغفرة، المتصلة التقليل إلى أدنى حد علاج سمية مصدر قلق كبير. على الرغم من أن العلاج بالبروتون المتوقع أن يحتمل أن تخفض المخاطر السمية القلبية، يجري بحث هذه المسألة في "المحاكمة كونسورتيوم رادكومب" الجارية (NCT02603341)، الذي هو التعشئه النساء المصابات بسرطان الثدي للعلاج الإشعاعي فوتون أو بروتون.
السرطان ما زال هو السبب الثاني الأكثر شيوعاً للوفاة في الأطفال الذين تتراوح أعمارهم بين 1-14 في الولايات المتحدة، وهو تجاوز فقط بالحوادث. في عام 2018، سوف يتم تشخيص سرطان الأطفال 10,590، وسوف يموت 1,180 بهم خبيثة1. ضمن هذه المجموعة، سوف يكون تشخيص المرضى 250-500 ميدولوبلاستوما. متوسط العمر عند تشخيص ميدولوبلاستوما من 4-6 سنوات. نظراً للمخاطر العالية لمشاركة النخاعي ونشرها (30-40 ٪)، تشعيع كرانيوسبينال (منظمة التضامن المسيحي الدولية) معيار العناية بهؤلاء المرضى، مع ما يقرب من 80% من الباقين على قيد الحياة مع العلاج المناسب.
هي طبقات ميدولوبلاستوما المرضى إلى مجموعات مستوى الخطر وشديدة الخطورة استناداً إلى أعمارهم، ووجود أنابلاسيا أو الانبثاث، وكمية الورم المتبقية بعد الاستئصال الجراحي. في كلتا الحالتين، يشمل العلاج الإشعاعي بعد العملية الجراحية. RT ميدولوبلاستوما ينطوي على منظمة التضامن المسيحي الدولية الأولى لجرعة قدرها 23.4-36 غراي. ثم تعطي جرعة إضافية للسرير الورم لتحقيق جرعة من 50.4 55.8 غراي إلى موقع الورم الرئيسي40. اعتبارات التخطيط العلاج تشمل الحد الجرعات القصوى إلى جذع الدماغ والنخاع الشوكي إلى 54 غراي و 45 غراي، على التوالي. يمكن تسليم منظمة التضامن المسيحي الدولية استخدام العلاج فوتون أو بروتون. محاكاة الأشعة المقطعية والعلاج غالباً ما تتطلب التخدير لضمان أن المرضى لا تتحرك أثناء العلاج41.
بسبب المناطق الكبيرة المستهدفة مع الإشعاع، المستندة إلى الفوتون RT تقنيات نتيجة التعرض إشعاع كبير للهياكل والصدر والبطن عرفت الحبل الشوكي، بما في ذلك الرئتين والقلب والأمعاء الكلي والثدي. قد تكون هذه المناطق بمنأى عن الإشعاع الزائدة مع بروتون العلاج (الشكل 3)42. حزب العمال على أساس منظمة التضامن المسيحي الدولية يتطلب حقلين الأفقي المائل قليلاً تشعيع الدماغ والعمود الفقري العنقي العلوي، فضلا عن واحد أو أكثر من عوارض الخلفي الأمامي نحو المناطق العمود الفقري عنق الرحم والصدر وأسفل الظهر والمقدسة أقل. حقول متعددة مطلوبة منذ الهدف CTV لمنظمة التضامن المسيحي الدولية يتضمن مساحة كاملة من السائل الدماغي النخاعي (CSF) تمتد من ذروة الدماغ للقناة الشوكية من خلال ذيل الفرس كودا على مستوى تقاطع العمود الفقري S2/S3 (الشكل 3). طول العمود الفقري يحدد العدد الإجمالي للعمود الفقري الحقول المطلوبة للعلاج. يتم مطابقة الحدود العليا لحقل العمود الفقري العلوي إلى حد أدنى من حقول الجمجمة. إذا كان لا يمكن أن تغطي الحقل العمود الفقري العمود الفقري كامل، يتم مطابقة حقل العمود الفقري ثاني إلى حد أدنى من حقل العمود الفقري العلوي. وقد تكون هذه العملية المتكررة إذا كان حقل ثالث مطلوب المرضى طولاً. للمرضى الذين تقل أعمارهم عن 15 سنة، والحدود الأمامي من حقول العمود الفقري يمتد ليشمل كامل الهيئات العمود الفقري لضمان جرعة متجانسة للعظام المطلوبة لمنع تشوهات النمو المستقبلي في الهيكل العظمى النامي. لمن تزيد أعمارهم عن 15، تمتد الحدود حقل العمود الفقري الأمامي 2-3 مم خارج القناة الشوكية في العمود الفقري.
وقد استخدمت مبعثر السلبي وتقنيات برنامج تلفزيوني لمنظمة التضامن المسيحي الدولية42،43. وتشمل الأهداف المحددة للعلاج بمنظمة التضامن المسيحي الدولية جرعة الإشعاع متجانسة للسائل الدماغي النخاعي (CSF) إلى الطرف الأدنى من كيس thecal (S2 أو S3)، كامل الجرعة للجمجمة الأمامي كريبريفورم وقاعدة اللوحة، التقليل إلى أدنى حد جرعات لهياكل الألياف البصرية، والحد من الغدة الدرقية لا يزيد عن 5% من الجرعة الوصفات الطبية، والتقليل إلى أدنى حد من الجرعات ل المريء43.
تخطيط مبعثر السلبي العلاج عادة ما يبدأ بإنشاء حقول الجمجمة. الموازن، النطاق مع التحرير اليدوي غالباً ما مطلوبة لإنشاء توزيع جرعة متجانسة في الدماغ بينما يحد من الجرعة للعيون والقوقعة. لحقول العمود الفقري، والموازن، هي سميكة على مستوى الغدة الدرقية للتقليل من الجرعة. ثم يولي اهتمام خاص إلى ميدان تقاطعات بين الحقول الجمجمة والعمود الفقري وبين عدة حقول العمود الفقري عند الاقتضاء. منطقة مفرق يعرف طول 1.25-1.5 سم حيث الحقول المتجاورة. ملتقى تحول في اتجاه الجمجمة أو والذيلية أسبوعيا لمنع تنمية المناطق الساخنة أو الباردة الجرعة. ومن الناحية المثالية، يتم الاحتفاظ الجرعة الفرق بين 95-108 في المائة من الجرعة وصفه طبية. الترجيح الميدانية وعمليات التحرير الفتحة تحريرات المعوض جميعا يعملون لتحقيق هذا الهدف43.
الباحثون في مركز أم دي أندرسون للسرطان قد وضعت استراتيجية تدريجي للتخطيط42منظمة التضامن المسيحي الدولية. ويشمل هذا النهج وضع خطة القوة المتعددة الجنسيات لعلاج العمود الفقري الجمجمة وأقل الحقول متبوعاً بإنشاء خطة SFO للعمود الفقري والصدر. وتستخدم جرعة التدرجات في مناطق تقاطع. ثم يتم نسخ الخطة SFO إلى القوة المتعددة الجنسيات الخطة الأولية لوضع خطة القوة المتعددة الجنسيات النهائية، والمركب. يتم إزاحة العمود الفقري تقاطعات مرة واحدة بواسطة سم 2 خلال دورة مدتها 4 أسابيع من العلاج. بالمقارنة مع السلبي مبعثر منظمة التضامن المسيحي الدولية، يقوم برنامج تلفزيوني منظمة التضامن المسيحي الدولية عروض تخفيضات كبيرة في جرعة الإشعاع بالعدسات والقوقعة والغدد النكفية ولكن على حساب الغدة الدرقية زيادة الجرعة42.
ميدولوبلاستوما المرضى يمكن أن نتوقع معدلات البقاء على قيد الحياة الحرة الحدث من 60-80% حسب فئات المخاطر44. ونظرا لمساحة كبيرة من الأنسجة المشع مع منظمة التضامن المسيحي الدولية، والطبيعة الحساسة للأطفال المرضى، المخاطر الجانبية الطويلة الأجل كبيرة وتشمل ضعف عصبي، الأورام الخبيثة الثانوية، الخلل في الغدة النخامية، وفقدان السمع، وأمراض القلب ، العقم والغدة الدرقية، vasculopathy، جفاف العيون، تشكيل إعتام عدسة العين، وفقدان الرؤية والإشعاع نخر/سنجابية. ولذلك، منظمة التضامن المسيحي الدولية المستندة إلى بروتون قد تقدم فائدة كبيرة للعديد من المرضى.
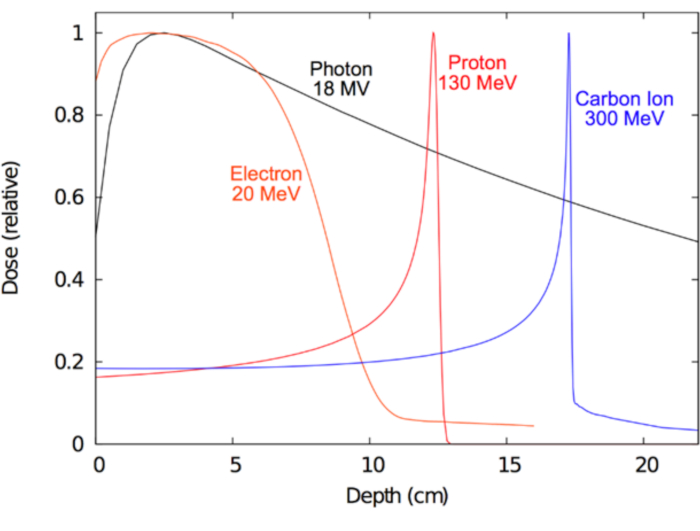
رقم 1: عمق منحنيات جرعة للعلاج بالأشعة- توزيعات الجرعة كدالة للعمق في المياه عرضه لشتى الإشعاع السريرية الحزم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
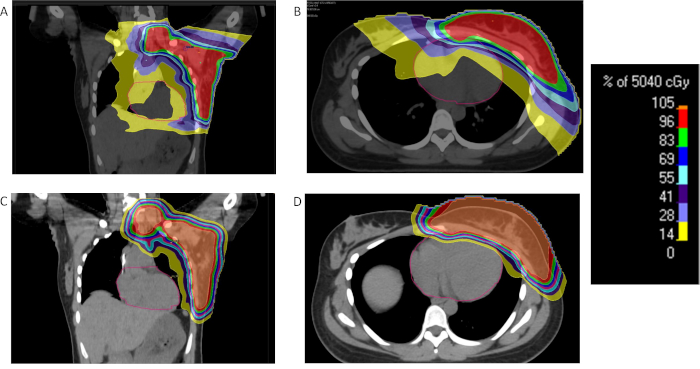
رقم 2: مقارنة بين البروتون وفوتون الإشعاع الثدي. % جرعة التوزيع لمريض بسرطان الثدي المتقدم محلياً يتلقون العلاج بالإشعاع بالبروتونات (ج، د) أو إيمرت (، ب) ومما يدل على تخفيض جرعة الإشعاع كبيرة إلى القلب و الرئتين مع البروتونات. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
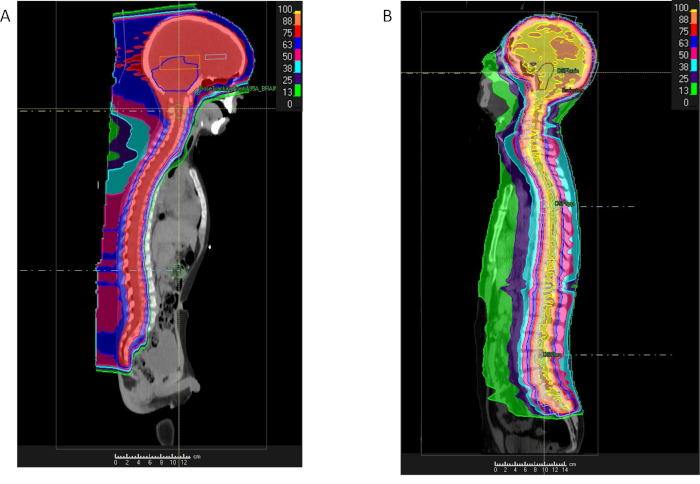
رقم 3: مقارنة بين البروتون وفوتون الإشعاع كرانيوسبينال. % جرعة التوزيع لمريض مع ميدولوبلاستوما تلقي تشعيع كرانيوسبينال باستخدام أما البروتونات (A) أو إيمرت (ب) والإشعاع كبيرة تبين جرعة الحد إلى مناطق داخل الصدر والبطن داخل مع البروتونات. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| فوتون | بروتون | |
| نوع الجسيمات | بوزون | فرميون مركب |
| شحن [ج] | 0 | +1.602 × 10-19 |
| كتلة [كغ] | 0 | 1.672 × 10-27 |
| زيادة ونقصان | 1 | 1/2 |
| Energy† [مليون إلكترون فولط] | 0.1--25 | 10-250 |
| المصادر الشائعة | معجل خطي، 60 شركة النظائر المشعة، الأشعة السينية أنبوب | سيكلوترون أو السنكروتروني مسرع |
| طرق التسليم | وتحديدالمنطقه الصلبة الحزم، كوليماتورس مولتيليف، كثافة التحوير، أقواس | نثر السلبي، والمسح المغناطيسي |
| † مجموعة الطاقة المستخدمة عادة لعلاج السرطانات البشرية | ||
الجدول 1: مقارنة بين البروتون وفوتون الإشعاع.
Discussion
تخطيط العلاج الإشعاعي وإيصالها للسرطان عملية عالية حسب الطلب شخصي لكل مريض على حدة وصفحته/صفحتها السرطان خاصة. العلاج الإشعاعي الحديث يسترشد صورة الحصول على صور الأشعة المقطعية المستندة إلى التدخل أثناء إشعاع مخصصة تخطيط المحاكاة. التصوير بالأشعة المقطعية إلزامي نظراً لأنه يحتوي على 3 الأبعاد (3D) المعلومات التشريحية حول المريض، فضلا عن دقة التحديد الكمي لكثافة الأنسجة في مواقع مختلفة داخل الجسم المطلوبة لحساب الجرعة. أثناء التصوير بالأشعة المقطعية، يتم وضع المريض على طاولة مزودة بمحركات. ويعمل العديد من الأجهزة الميكانيكية التثبيت عادة لتقييد حركة المريض أثناء التصوير وأثناء الولادة RT اللاحقة. رهنا بالدقة المطلوبة، وتتراوح هذه الأجهزة من الوسائد بسيطة من نوع العفن وتنسجم البلاستيكية، التي تتوافق مع السطح المريض وتتصلب ثم لتقييد الحركة، إلى مزيد من أجهزة الغازية مثل جمجمة جامدة أن يتم حفر في المكان. في كثير من الأحيان، تمليه الدقة المطلوبة للتثبيت الجهاز بقرب أنسجة الورم للهياكل الحيوية القريبة. على سبيل مثال، الجهاز تجميد معظم الغازية، هالة رأس حفرت في مكان، ويستخدم أحياناً عند الحاجة إلى الدقة ملليمتر واحد لعلاج ورم العينين أو الأعصاب البصرية لتقليل الفرصة للعمى التي قد تحدث من المريض تتحرك بالقرب في وضع غير صحيحة أثناء فترة العلاج.
CT تصوير المعلومات يستخدم أيضا لتحسين تشريح أنسجة طبيعية الداخلية. على سبيل المثال، انتفاخ المثانة غالباً ما تستخدم للتقليل من المثانة والأمعاء جرعة التعرض من تشعيع البروستاتا كما ورد في البروتوكول أعلاه. وبالمثل، إذا كان هو منتفخة المعدة لا سيما مع الأغذية خلال محاكاة تشعيع البطن العلوي (على سبيل المثال، المعدة، الكبد، المريء القاصي)، ثم المريض إعادة محاكاة بعد السماح للطعام بالمرور عبر المعدة والأمعاء . هذا سوف تتقلص المعدة وتقليل فرص التعرض للإشعاع أثناء العلاج الإشعاعي لاورام البطن العلوي. في الحالات حيث المعدة أو المثانة هم أنفسهم أهدافا الإشعاع، وقد منتفخة أو إفراغ لتحسين توزيع الجرعة عمدا.
في بعض الحالات، هو ليس كافياً أو موثوق بها تصور في الأشعة المقطعية وجود ورم لكن يمكن تحديد أكثر دقة بالتصوير بالرنين المغناطيسي أو الحيوانات الأليفة مسح. في مثل هذه الحالات، يتم استخدام فحص الحيوانات الأليفة أو التصوير بالرنين المغناطيسي لتكملة البيانات المقطعية نظراً لهذا الأخير لا يزال مطلوباً لحساب الجرعة. ويتحقق ذلك من خلال تسجيل الصور التصوير بالرنين المغناطيسي، والحيوانات الأليفة إلى صور الأشعة المقطعية لتخطيط العلاج. التصوير بالرنين المغناطيسي بالأشعة غالباً ما توفر الكثير من التباين المرئي أكبر ودقة أعلى من الأشعة المقطعية، التي قد تكون مفيدة لتحديد حدود رقيقة، والأنسجة اللينة من ورم مثل تلك الموجودة في الدماغ أو الكبد. الحيوانات الأليفة يوفر طريقة عرض وظيفي لتوزيع الجزيئات المشعة المسمى الراسم حقن المريض.
وتنشأ بعض الأورام في مناطق الصدر أو البطن حيث قد تتحرك إلى حد كبير مع التنفس. لحساب هذه الحركة لضمان دقة الإشعاع، يمكن استخدام ط م 4-الأبعاد، نوع من "وضع الفيلم" CT تصوير، التقاط التشريح المرضى 3D كما تتغير بمرور الوقت أثناء التنفس. لبعض الأهداف والصدر والبطن، قد تستخدم أحزمة الضغط أو وسائل أخرى للتخفيف من الحركة أثناء العلاج لتقييد الحركة، والحد من عدم اليقين فيما يتعلق ب مكان الورم45.
حالما يتم محاكاة المريض للعلاج، يتم وضع خطة علاج شخصية مع النظر في علم الأنسجة: السرطان، ومكان الورم، والميزات التشريحية، والتي تؤثر على التكوين الأمثل الحزم الإشعاع، أنواع الجسيمات، والطاقات، والجرعة مستويات لكل مريض على حدة. لكل مريض، تعتبر في البداية على عدد من الأسئلة الأساسية فريق السريرية وضع خطة علاج أمثل. وكنقطة انطلاق، يجب تحديد أنسب شكل للإشعاع. وتشمل خيارات الفوتونات أو الإلكترونات أو البروتونات. هذا عادة ما يعقب اختيار شعاع angle(s) لتوصيل الإشعاع. وتشمل معظم RT آلات مريض روبوتية موضع الجدول ومن الهزال الدورية التي تسمح لعوارض RT ستوجه إلى المريض من أي زاوية تقريبا. القرار ينطوي على العثور على المسار الأكثر فعالية الضربات المستهدفة مع RT ويتجنب أفضل غير الأهداف التي قد تكون في مسار الحزمة المحددة. وفي بعض الحالات، تتحدد زوايا الشعاع بنظام التخطيط نفسها بعد إدخال الأهداف الإشعاع للأورام والأنسجة العادية. هذه العملية يسمى "التخطيط العكسي" وغالباً ما يتم في حالة IMRT، الذي ينطوي على تحوير كثافة متعددة، عوارض الإشعاعات الواردة بطريقة تعتمد على الوقت التي توفر جرعة موحدة هدف ولكن قد يؤدي إلى جرعة عالية غير موحدة خارج الهدف. على الرغم من أن العلاج فوتون أو بروتون قد تكون كثافة التضمين، وعكس تخطيط يستخدم إلى حد كبير في بناء فوتون IMRT فقط. إذا كانت الحزمة الإشعاعية الصلبة لاستخدامها، قد لفقت كوليماتورس معدنية مخصصة لتطابق شكل شعاع الإشعاع بشكل الورم.
إذا تم تحديد العلاج بروتون، ثم قرار لاحق يحتاج إلى بذل فيما يتعلق باستخدام تقنيات برنامج تلفزيوني أو مبعثر السلبي. وفي حالة برنامج تلفزيوني، مطلوب على قرار إضافي بشأن استخدام القوة المتعددة الجنسيات أو الاستراتيجيات الأمثل/حقل واحد حقل واحد موحد الجرعة (SFO/سفود). في العلاج على القوة المتعددة الجنسيات، عوارض متعددة مطلوبة لعلاج ورم خلال كل جزء حيث يستهدف كل شعاع فقط جزء من الهدف. وفي المقابل، لخطط SFO، يغطي كل شعاع الهدف الكامل. القوة المتعددة الجنسيات هو غالباً ما يفضل للأورام القريبة من بنية حرجة (مثلاً.، ورم الدماغ قرب العصب البصري) التي قد يكون من المفيد لنحت جرعة الإشعاع فيها مجموعة متنوعة من زوايا الشعاع. استراتيجيات القوة المتعددة الجنسيات أيضا ضمان أن جميع الإشعاع الحزم/البقع لا "في نهاية النطاق" في المنطقة نفسها حيث يمكن أن تكون الجرعة عالية بشكل غير متوقع بسبب أثر قمة براج. من ناحية أخرى، وهو يفضل SFO لأهداف بالقرب من المناطق التشريحية عدم اليقين، مثل البروستات التي يمكن أن تتحرك بسبب شغل المستقيم والمثانة التفاضلية. SFO يوفر تعزيز متانة ضد التغييرات الجرعة بسبب الفروق التشريحية.
حالما يتم البت في استراتيجية التخطيط الأساسية، تشمل المرحلة التالية من تخطيط العلاج عادة الرياضي الأمثل لمجالات الإشعاع. الطاقة والكثافة، والتوزيع المكاني (مكانياً متفاوتة التمويه) الإشعاع الواردة معلمات عادة مجاناً في التحسين. جنبا إلى جنب مع تمثيل مصفوفة ثلاثية الأبعاد الكبيرة لجسم المريض بالأشعة المقطعية، يؤدي إلى حجم المشكلة كبير جداً والتحسين الكبير المقابلة على هذه المتغيرات الحرة المصفوفات (مثلاً، آلاف قيم المقطعية والآلاف من شعاع ممكن يجب أن كثافة يمكن اعتبار). هذه المصفوفات مؤطرة في "دالة الهدف"، وصيغة رياضية "الهدف المتمثل في تخطيط العلاج". كما ذكر أعلاه، يتم تحديد أولويات أهداف العلاج أولاً تحقيق جرعة محددة الهدف، وثانيا لتحقيق منخفضة جرعة كمن الممكن للأنسجة الطبيعية. لتقليل هذه "دالة الهدف"، هو المطلوب شرائية عالية الحوسبة بسرعة إجراء حسابات النقل RT أن تعبئة المصفوفات، وتستخدم أساليب التحسين العددية، مثل خوارزميات البحث التدرج، للبحث بسرعة عن الحدود الدنيا المحلية في الدالة. تتوافق هذه الحدود الدنيا لخطط العلاج الأمثل لكل مريض فريدة من نوعها. لا يمكن المبالغة في دور أجهزة الكمبيوتر في التخطيط للعلاج. العلاج الإشعاعي الحديثة والأشعة التشخيصية لن ممكن دون التقدم الكمبيوتر خلال العقود الثلاثة الماضية.
وتستعرض خطة العلاج الأمثل كمرحلة نهائية، الفريق الطبي (الطبيب، دوسيميتريست، والفيزيائي). في كثير من الحالات، قد تكيف مع زيادة الخطة أو إعادة الأمثل مع أهداف مختلفة لتحسين الجودة الشاملة. حالما يتم العثور على هذه الخطة الأمثل، هي المعايير الفنية للخطة استعرضها فيزيائي ونقلها إلى الجهاز تقديم العلاج.
في كثير من الحالات، يعود المريض للكسور المعالجة المتعددة (الدورات)، غالباً كل يوم من أيام الأسبوع لعدة أسابيع. وجود عدة أيام يمكن تكثيف حدة الآثار الجانبية الناجمة عن الإشعاع ولكن قد يقلل من إمكانيات الراحل، أشد من الآثار الجانبية ل RT مقارنة مع معاملة واحدة-جزء12. النهج المتعدد الكسر الأمثل للأورام التي تكون سرعة تقسيم أو غير قادر على إصلاح الأضرار المقاسة من الرايت ولكن هذا يعتمد على موقع العلاج الدقيق وحساسية الأنسجة الطبيعية المجاورة. نظراً للهدف المتمثل في تقديم العلاج الإشعاعي بإدارة نفس المعاملة خلال كل جزء، حتى بضعة ملليمترات من الحركة أو عدم اليقين في موقف المريض قد يؤدي إلى تدهور خطة العلاج العلاج بالجسيمات. لهذا السبب، يتم توجيه الصورة على متن النظم ذات أهمية قصوى أثناء التصوير بالأشعة السينية الرايت مولتيفراكشن أو مخروط الشعاع CT الأشعة الضوئية والمسح الضوئي الليزر التصوير السطحي كلها متاحة لهذا الغرض. تسمح هذه الأجهزة الموجهة بصورة الأشعة (إيجرت) من خلال تصوير المعالم التشريحية، أهداف الورم، أو علامات الاعتماد كامد إذاعة بديلة. الصور IGRT مقارنة بمسح المحاكاة الأصلية وتعديلها إذا لزم الأمر قبل كل جزء من الإشعاع.
على الرغم من ميزة مجموعة محدودة من العلاج بالبروتون، مما يحد من الجرعة الخروج، دقة التنبؤ بالمدى عادة ما ينظر إليها في التخطيط للعلاج بناء على أمر من بضعة ملليمترات. فقدان الطاقة الدقيقة في أنسجة المريض مختلفة غير مؤكد، أولاً، نظراً للمكونات الجزيئية الدقيقة للأنسجة تتسم بالغموض، وثانيا، نظراً لجسم المريض تتغير بمرور الوقت، سواء عبر قصيرة النطاقات الزمنية (علىسبيل المثال، التنفس) و فترات زمنية أطول (مثلفقدان الوزن، وانكماش الورم، والتشريح الطبيعي تغييرات). لمواجهة عدم اليقين هذا، تتم إضافة "هامش الأعلى" لوحدة التخزين الهدف وجود هامش إضافي من أنسجة طبيعية فقط وراء ورم أقصى العمق. ويضمن هذا هامش أن عمق الورم كامل حتى مع أوجه عدم اليقين في التنبؤ بالنطاق، سوف يعامل بثقة عالية. ولسوء الحظ، الهامش أنسجة طبيعية نتيجة لذلك يمكن أن يتعرض لجرعة RT الكامل، الذي يمكن أن يؤدي إلى آثار جانبية RT هامة في تلك الأنسجة. على النقيض من ذلك، كما الفوتونات لا تتوقف لكن بدلاً من ذلك إنهاء الهدف، لا هامش القاصي هذه مطلوب للتعويض عن نطاق عدم اليقين. هامش هندسية يزال يستخدم في العلاج فوتون لمعالجة الشكوك الموضعية للهدف، ولكن الفوتونات حساسية أقل بكثير من البروتونات إلى الوضع الدقيق لانسجة المريض المنبع للهدف. ولذلك، في بعض الأحيان يمكن أصغر للفوتونات من البروتونات الهامش المطلوب. وهذا يمكن أن يفهم بالنظر إلى أن البروتونات الخضوع لفقدان الطاقة المستمر في الأنسجة التي تؤثر بشكل كبير موقف مداها، بينما الفوتونات بدون توجيه تهمة إليه والسفر بحرية في المساحة الفارغة بين الذرات وهذه المدارات، باستثناء نادر اصطدام مع الإلكترونات أو نوى. الاختلافات كثافة كبيرة في الأنسجة، على سبيل المثال-، أجسام معدنية أو تجاويف الهواء، ومع ذلك، لا تزال تؤثر على جرعة فوتون فضلا عن بروتون بالجرعة، ولكن بحجم أقل.
عدم يقين النهائي وهامة تتعلق بفعالية البيولوجيا (التاليتين) أشكال مختلفة من الإشعاع. التاليتين هو نسبة الجرعات، من نوع إشعاع مرجع ونوع إشعاع اختبار، بشرط أن كل أنواع الإشعاع تنتج نفس التأثير البيولوجي. التاليتين أعلى، كلما تضر بالإشعاع في كل وحدة من الطاقة الترسيب في الأنسجة. يتم تعريف نسبة التاليتين في إشارة إلى فوتون الإشعاع. وعلى الرغم من هذا الوصف مباشرة، هناك عدم يقين كبيرة فعلا فيما يتعلق بالقيم التاليتين للجسيمات المشحونة بدلاً من الفوتونات. الاختلافات في التوزيعات المكانية بالجرعات بين الفوتونات وجسيمات مشحونة بمقياس ميكرومتر ونانومتر تؤدي إلى اختلافات في تأثير بيولوجي، حتى عندما كانت الجرعات العيانية متطابقة. ويمكن فهم هذا بدراسة الأنماط المكانية لتلف الحمض النووي بعد التعرض للجسيمات المشحونة في جرعات مختلفة والطاقات الحركية المختلفة. الطاقات الحركية المختلفة ورسوم مختلفة للبروتونات (+ 1) وأيونات الكربون (+ 6) تؤدي إلى الاختلافات في نقل الطاقة في أعماق مختلفة في المريض، بينما للفوتونات، نقل الطاقة أقل نسبيا وأيضا أكثر تجانساً في جميع أنحاء المريض. بينما يفهم من الناحية النظرية، هناك نقاش كبير في المجتمع الأورام الإشعاع فيما يتعلق بالقدرة على التنبؤ بدقة بهذه الآثار البيولوجية. للعلاج بأيونات الكربون، هناك انعدام توافق الآراء بشأن أفضل السبل لنموذج هذه الآثار البيولوجية، على الرغم من أن هناك اتفاق على أن هذه الآثار يجب أن تكون على غرار توفير العلاج. للبروتونات، المراكز السريرية الأكثر حاليا خطة العلاج دون نمذجة صريحة من آثار التاليتين، باستثناء استخدام عامل تصحيح مستمر من 1.1، لكن هذا من المرجح أن تتغير في المستقبل القريب كما بدأت نظم التخطيط معاملة تجارية جديدة البيولوجية وتشمل أدوات البرمجيات نموذج التاليتين للعلاج بالبروتون النمذجة.
مع الانتهاء من التجارب المعشاه ذات الشواهد، بما في ذلك رادكومب، بارتيقول ورتوج 1308، ينبغي أن لدينا إجابات أكثر تحديداً بشأن أشكال الإشعاع قد تكون متفوقة للثدي والبروستاتا، وسرطان الرئة، على التوالي. ومن المقرر إجراء دراسات مماثلة مواقع الأمراض الأخرى التي قد تساعد على تحديد أفضل طريقة معاملة أفضل لتلك الأنواع الورم. ومع ذلك، هناك بالفعل بيانات كافية لتشير إلى تفوق البروتونات في إعدادات معينة، لا سيما في أوساط السكان طب الأطفال، حيث تدخر أنسجة طبيعية كبيرة يمكن أن يقلل كثيرا من الاعتلال من السمية، بما في ذلك الثانوية الأورام الخبيثة.
Disclosures
وقد ه الأتعاب من استرا زينيكا، باير، وشركة نوفارتيس. وتشاورت مع استرا زينيكا، بريستول مايرز سكويب، وباير ه وكان أحد المتكلمين "مؤسسة فرنسا".
Acknowledgements
ر. س تقر منح التمويل من "برنامج سداد القروض المعاهد الوطنية للصحة". هجري تلقت تمويلاً من باير، كلوفيس، كوكبة، أجينسيس، سوتيو، أزرق، وكاليثيرا.
Materials
| Name | Company | Catalog Number | Comments |
| Proton beam cyclotron and gantry delivery system | Varian | N/A | Allows for generation and delivery of protons for radiotherapy |
| kVUE One Proton Couch Top | Qfix | RT-4551KV-03 | Permits patient placement for radiotherapy |
| CT simulator with 4D scanning capability | GE | N/A | Permits CT simulation for radiation planning |
| 100" x 70" Qfix VacQfix Cushion | Qfix | RT-4517-10070F30 | Immobilizes patient for more precise radiation delivery |
| Timo Foam Head Support | Qfix | RT-4490-F | Ensures minimization of head motion during radiotherapy |
| 3 CT Localizers Localization Markers | Beekley Medical | REF 211 | Ensures concordance of external markers and internal patient anatomy from CT simulation |
| VacQfix Indexer | Qfix | RT-4517-IND01 | Ensures VacQfix cushion placement is reproducible for every radiatiion treatment |
| Radiation treatment planning software | Raystation | N/A | Allows for personalized radiation planning for every tumor with robust optimization and multi-criteria optimization |
| Proton Range Compensator | .Decimal | RC-AC 1018 | Adjusts the range of the proton beam to achieve distal dose conformality |
| Proton Beam Aperture | .Decimal | AP-BR 1800 | Shapes the proton beam treatment area |
| Proton Range Shifter | .Decimal | RS-AC 1018 | Adjusts proton beam tissue depth penetration |
| Endorectal Balloon | Radiadyne | ILG-90F | Ensures uniform rectal filling and prostate positioning |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Barton, M. B., et al. Estimating the demand for radiotherapy from the evidence: a review of changes from 2003 to 2012. Radiotherapy and Oncology. 112 (1), 140-144 (2014).
- Pan, H. Y., et al. Supply and Demand for Radiation Oncology in the United States: Updated Projections for 2015 to 2025. International Journal of Radiation Oncology Biology and Physics. 96 (3), 493-500 (2016).
- Reed, A. B. The history of radiation use in medicine. Journal of Vascular Surgery. 53 (1 Suppl), (2011).
- T Landsberg, P. . Nobel Lectures in Physics, 1901-1921. 18, (1967).
- . Non-small cell lung cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (2018)
- . Pancreatic Adenocarcinoma Available from: https://www.nccn.org/professionals/physician_gls/pdf/pancreatic.pdf (2017)
- . Breast cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (2017)
- . Prostate Cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (2017)
- Chang, J. Y., et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncology. 16 (6), 630-637 (2015).
- Fisher, B., et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. The New England Journal of Medicine. 347 (16), 1233-1241 (2002).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. , (2012).
- Lomax, A. J. Charged particle therapy: the physics of interaction. The Cancer Journal. 15 (4), 285-291 (2009).
- Rossi, B., Greisen, K. Cosmic-Ray Theory. Reviews of Modern Physics. 13 (4), 240-309 (1941).
- Blakely, E. A., Chang, P. Y. Biology of charged particles. The Cancer Journal. 15 (4), 271-284 (2009).
- Schardt, D., Elsässer, T., Schulz-Ertner, D. Heavy-ion tumor therapy: Physical and radiobiological benefits. Reviews of Modern Physics. 82 (1), 383-425 (2010).
- Chun, S. G., et al. The Potential of Heavy-Ion Therapy to Improve Outcomes for Locally Advanced Non-Small Cell Lung Cancer. Frontiers in Oncology. 7 (201), 1-3 (2017).
- Pan, H. Y., Jiang, J., Shih, Y. T., Smith, B. D. Adoption of Radiation Technology Among Privately Insured Nonelderly Patients With Cancer in the United States, 2008 to 2014: A Claims-Based Analysis. Journal of the American College of Radiology. 14 (8), (2017).
- Michalski, J. M., et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncology. , (2018).
- Glimelius, B., et al. Number of patients potentially eligible for proton therapy. Acta Oncologica. 44 (8), 836-849 (2005).
- Doyen, J., Falk, A. T., Floquet, V., Herault, J., Hannoun-Levi, J. M. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treatment Reviews. , 104-112 (2016).
- Hamdy, F. C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine. 375 (15), 1415-1424 (2016).
- Ng, M., et al. Fiducial markers and spacers in prostate radiotherapy: current applications. British Journal of Urology International. 113, 13-20 (2014).
- Hedrick, S. G., et al. A comparison between hydrogel spacer and endorectal balloon: An analysis of intrafraction prostate motion during proton therapy. Journal of Applied Clinical Medical Physics. 18 (2), 106-112 (2017).
- Hamstra, D. A., et al. Continued Benefit to Rectal Separation for Prostate Radiation Therapy: Final Results of a Phase III Trial. International Journal of Radiation Oncology Biology Physics. 97 (5), 976-985 (2017).
- Wortel, R. C., et al. Local Protocol Variations for Image Guided Radiation Therapy in the Multicenter Dutch Hypofractionation (HYPRO) Trial: Impact of Rectal Balloon and MRI Delineation on Anorectal Dose and Gastrointestinal Toxicity Levels. International Journal of Radiation Oncology Biology Physics. 99 (5), 1243-1252 (2017).
- Chen, Z., Yang, Z., Wang, J., Hu, W. Dosimetric impact of different bladder and rectum filling during prostate cancer radiotherapy. Radiation Oncology. 11, 103 (2016).
- Rana, S., et al. Dosimetric and radiobiological impact of intensity modulated proton therapy and RapidArc planning for high-risk prostate cancer with seminal vesicles. Journal of Medical Radiation Sciences. 64 (1), 18-24 (2017).
- Rodda, S., et al. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer. International Journal of Radiation Oncology Biology Physics. 98 (2), 286-295 (2017).
- Zietman, A. L., et al. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09. Journal of Clinical Oncology. 28 (7), 1106-1111 (2010).
- Al-Mamgani, A., Heemsbergen, W. D., Peeters, S. T., Lebesque, J. V. Role of intensity-modulated radiotherapy in reducing toxicity in dose escalation for localized prostate cancer. International Journal of Radiation Oncology Biology Physics. 73 (3), 685-691 (2009).
- Ragaz, J., et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. Journal of the National Cancer Institute. 97 (2), 116-126 (2005).
- Whelan, T. J., et al. Long-term results of hypofractionated radiation therapy for breast cancer. New England Journal of Medicine. 362 (6), 513-520 (2010).
- Darby, S. C., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. New England Journal of Medicine. 368 (11), 987-998 (2013).
- Wroe, A. J., Bush, D. A., Schulte, R. W., Slater, J. D. Clinical immobilization techniques for proton therapy. Technology in Cancer Research and Treatment. 14 (1), 71-79 (2015).
- Shah, C., et al. Cardiac dose sparing and avoidance techniques in breast cancer radiotherapy. Radiotherapy and Oncology. 112 (1), 9-16 (2014).
- Patel, S. A., et al. Postmastectomy radiation therapy technique and cardiopulmonary sparing: A dosimetric comparative analysis between photons and protons with free breathing versus deep inspiration breath hold. Practical Radiation Oncology. 7 (6), e377-e384 (2017).
- Depauw, N., et al. A novel approach to postmastectomy radiation therapy using scanned proton beams. International Journal of Radiation Oncology Biology Physics. 91 (2), 427-434 (2015).
- MacDonald, S. M., et al. Proton therapy for breast cancer after mastectomy: early outcomes of a prospective clinical trial. International Journal of Radiation Oncology Biology Physics. 86 (3), 484-490 (2013).
- Merchant, T. E., et al. Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. International Journal of Radiation Oncology Biology Physics. 70 (3), 782-787 (2008).
- McMullen, K. P., Hanson, T., Bratton, J., Johnstone, P. A. Parameters of anesthesia/sedation in children receiving radiotherapy. Radiation Oncology. 10, 65 (2015).
- Stoker, J. B., et al. Intensity modulated proton therapy for craniospinal irradiation: organ-at-risk exposure and a low-gradient junctioning technique. International Journal of Radiation Oncology Biology Physics. 90 (3), 637-644 (2014).
- Giebeler, A., et al. Standardized treatment planning methodology for passively scattered proton craniospinal irradiation. Radiation Oncology. 8, 32 (2013).
- Gajjar, A., et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncology. 7 (10), 813-820 (2006).
- Lin, L., et al. Evaluation of motion mitigation using abdominal compression in the clinical implementation of pencil beam scanning proton therapy of liver tumors. Medical Physics. 44 (2), 703-712 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved