Method Article
Livraison de thérapie de proton et son Application clinique dans certains tumeurs solides malignes
Dans cet article
Résumé
Les auteurs présentent les principes fondamentaux de rayonnement planification et la prestation de protonthérapie en cancer de la prostate comme modèle. L’application de ces principes à d’autres sites sélectionnés de la maladie met en évidence comment radiothérapie proton peut améliorer les résultats cliniques pour les patients atteints de cancer.
Résumé
La radiothérapie est une modalité fréquemment utilisée pour le traitement des cancers solides. Bien que les mécanismes de mort cellulaire sont semblables pour toutes les formes de rayonnement, les propriétés in vivo des faisceaux de photons et de protons diffèrent considérablement et peut-être exploitée afin d’optimiser les résultats cliniques. En particulier, les particules de protons perdent de l’énergie d’une manière prévisible lorsqu’ils traversent le corps. Cette propriété est utilisée cliniquement pour contrôler la profondeur à laquelle le faisceau de protons se termine et limite la dose de rayonnement au-delà de la région cible. Cette stratégie peut permettre à des réductions substantielles à la dose de rayonnement aux tissus normaux situé juste au-delà de la cible de la tumeur. Cependant, la dégradation de l’énergie du proton dans le corps reste très sensible à la densité des tissus. En conséquence, toute modification de la densité des tissus au cours du traitement peut modifier considérablement dosimétrie de proton. Ces changements peuvent se produire par le biais de modifications du poids corporel, la respiration ou remplissage/gaz intestinaux et peuvent entraîner des dépôts de doses défavorable. Dans ce manuscrit, nous fournissons une méthode détaillée pour la livraison de protonthérapie utilisant dispersion passive et faisceau de crayon analyse techniques pour cancer de la prostate. Bien que la procédure décrite se rapporte directement aux patients de cancer de la prostate, la méthode peut être adaptée et appliquée pour le traitement de presque toutes les tumeurs solides. Notre objectif est d’équiper les lecteurs avec une meilleure compréhension de la proton thérapie prestation et les résultats afin de faciliter l’intégration appropriée de cette modalité au cours de la thérapie du cancer.
Introduction
On estime que 1,7 millions de personnes aux États-Unis seront diagnostiqués avec le cancer en 2018, plus 600 000 succomber à la maladie1. Les options thérapeutiques actuelles impliquent mono - ou multi - modality therapy à l’aide de la chirurgie, la radiothérapie (RT) et les traitements systémiques. En ce qui concerne les RT, un quart des patients nouvellement diagnostiqués il recevra comme partie de leur traitement du cancer initial et près de la moitié il exigera en fin de compte au cours de leur maladie cours2,3.
L’avènement de la remonte de la RT en 1895 quand William Conrad Roentgen découverte rayons x alors qu’il travaillait avec un tube à rayons cathodiques dans son laboratoire à l’Université de Würzberg en Allemagne4. Pas longtemps après, patients atteints de maladies de grande envergure telles que le lupus et recevaient des traitements utilisant des rayons du radium. Complications précoces ont été réalisées rapidement et étaient même discutées par Pierre Curie dans son prix Nobel conférence5. Puisque le rayonnement affecte les tissus normaux et de tumeur, soigneusement contrôlées des doses de radiations doivent être utilisés afin de maximiser le rapport thérapeutique, défini comme la probabilité de contrôle de la tumeur par rapport à la probabilité de toxicité inacceptable. Avec progressive avancements en technologie, mais aussi de mieux comprendre de radiobiologie et de physique, ce ratio thérapeutique a grandement amélioré avec le temps. L’utilisation de RT a considérablement renforcée résultats pour plusieurs types de cancers, comme en témoigne son inclusion dans les lignes directrices nationales pour le cancer thérapie6,7,8,9. Dans certains cas, RT peut servir la seule modalité pour thérapie10, alors que dans d’autres maladies, il peut être utilisé dans le cadre de la thérapie multimodale pour la lutte contre les maladies locales ou l’éradication de la maladie microscopique11. Bien que souvent utilisé avec une intention curative, de nombreux patients de RT sont traitées pour la palliation de la douleur ou autres symptômes qui se développent à partir de compression induite par la tumeur, d’invasion ou de destruction des tissus normaux dans le cadre de la loco-régionale ou généralisée, métastatique maladie.
Les principes de base derrière RT sont simples. Avec la demande de radiation, énergie se dépose dans les cellules par l’intermédiaire de l’ionisation des atomes. Cette énergie, même si elle peut élever la température d’une région irradiée par seulement quelques microkelvin, produit des radicaux libres qui peuvent directement les cellules de dommages exposés au moyen de l’ADN des blessures12,13. Une grande partie de notre compréhension du rayonnement de particules à haute énergie et de son interaction avec la matière provient d’études théoriques et expérimentales des rayons cosmiques et leurs interactions dans la haute atmosphère réalisée dans le début 20ème siècle14. Particules de haute énergies (MeV à GeV) interagissent avec la matière principalement par l’intermédiaire de la force électromagnétique : comme ces particules passent à travers la matière ou d’un tissu, les collisions avec les électrons orbitaux d’inélastiques conduire à ionisation et l’excitation de la matière de la cible, et collisions élastiques avec noyaux atomiques conduire à nuages de points ou de déviation de la trajectoire de la particule. En outre, collisions nucléaires et dures collisions avec des électrons conduisent à une cascade de rayonnement secondaire qui ajoute à l’effet ionisant des rayonnements corpusculaires. Des particules qui traversent les matières ainsi laissent derrière un sillage d’atomes ionisés, des molécules et des électrons libres qui sont chimiquement réactifs et il peuvent induire des changements biologiques potentiellement ou endommager les organismes exposés à ces champs de rayonnements ionisants.
Des principaux objectifs à long terme de la radiothérapie a été d’apprendre la meilleure façon d’exploiter ces ionisant des champs d’une manière qui permettra de traiter efficacement la maladie humaine. Cliniquement, la forme idéale de rayonnement (comme le photon, protons, électrons ou ions lourds) devrait amener suffisamment d’ionisation dans la cible de la maladie pour fournir un effet thérapeutique anti-tumorale, tandis que dans le même temps cause minime d’ionisation dans la normale environnante tissus pour réduire au minimum les effets délétères. Quel type de rayonnement est sélectionné pour RT dépend en partie de la maladie traitée. Pour les tumeurs qui sont situés plus profondément dans le corps et peuvent également être chirurgicalement inopérable, photons megavolt, protons et ions lourds sont considérées comme optimales15,16. Pour les cancers superficiels, telles que celles impliquant la peau, thérapie de l’électron peut être optimale et même préférable à la chirurgie esthétique. En revanche, l’avantage des photons Mégavolt réside dans leur capacité à pénétrer profondément dans le tissu tout en limitant les dommages à la peau. Dans le cas de particules chargées, comme les électrons, protons ou des ions lourds, leur principal avantage réside dans ses caractéristiques « arrêt » ; Autrement dit, particules chargées perdent de l’énergie en continu via les collisions inélastiques décrit ci-dessus, et cette perte d’énergie est hautement prévisible sur l’échelle millimétrique. Par conséquent, un faisceau de particules chargées peut être livré à un patient avec des énergies précises à la profondeur désirée. De plus, les particules chargées produisent peu ou pas de dose en sortie17. En revanche, les particules non chargées comme photons présentent une variation exponentielle décroissante (atténuation) avec la profondeur, ce qui conduit souvent à une dose importante de sortie qui peut-être compromettre les tissus sains distal par rapport à la cible. Ces concepts sont illustrés dans la Figure 1, qui montre la radiation dose (ionisation) propriétés des différents types de rayonnement utilisé en clinique. Une motivation centrale pour l’utilisation des protons ou ions carbone au lieu de photons pour les cibles tumorales plus profondes est qu’il est la dose minimale entrée dose et dose zéro sortie au-delà des tissus cibles à proximité. Le tableau 1 résume certaines des caractéristiques cliniquement pertinentes des faisceaux de photons et de protons.
Avancées dans le domaine de la radiothérapie, y compris la protonthérapie, ont eu lieu sur deux fronts principaux : 1) la construction d’accélérateurs de particules efficace capables de produire des radiations de haute énergie (MeV) tel que des accélérateurs synchrotrons et cyclotron et 2) développement des méthodes de calcul sophistiquées qui combinent les données d’imagerie de la maladie et les calculs de transport de radiations pour permettre la simulation informatique « planification du traitement. » Pour la planification du traitement, les patients subissent généralement d’imagerie de la tomodensitométrie (TDM). Les images de CT contiennent des informations anatomiques 3 dimensions sur la quantification précise mais aussi patiente des densités tissulaires. Les images de CT et les cartes de densité sont ensuite utilisés dans les simulations par ordinateur pour planifier le traitement par radiations : l’énergie et l’intensité du champ de rayonnement sont mathématiquement optimisés pour chaque patient. Une analyse de l’imagerie par résonance magnétique (IRM) ou un balayage de tomographie par émission de positons (TEP) peut également servir à compléter les données de CT.
Ci-dessous, nous décrivons un plan étape par étape de la façon dont les patients sont navigués dans leur cure de rayonnement, suivie par les exemples de certains types de tumeur traités par protonthérapie.
Protocole
Le protocole de planification et de livraison de thérapie rayonnement exacte variera selon le site de la maladie et peut-être même exiger d’individualisation pour chaque patient. En outre, la procédure peut également exiger des modifications pour tenir compte des préférences institutionnelles et la disponibilité de l’équipement. Dans le but de cette discussion, nous énoncerons les étapes utilisées pour proton planification dans un cas de cancer de la prostate typique puisque c’est le cancer le plus fréquent traité par protonthérapie à US centres18. Ce protocole décrit la norme de soins orthophoniques et donc ne nécessite pas d’approbation institutionnelle par le Comité d’éthique de la recherche humaine.
1. la tomographie par ordinateur de Simulation pour des traitements de radiothérapie
- Insérer la table étendue dans la table de traitement et s’assurer qu’il est verrouillé.
- Placez un coussin d’immobilisation gonflé sur le dessus de table et le bar d’indexation pour le moule de la jambe au niveau du genou du patient.
- Placer un support solide de la tête au dessus de la table. Commencer par la taille de la tête F, qui accueille la plupart des patients.
- Confirmer que le patient a terminé le processus de la vessie pleine en buvant des 16-24 onces de liquide 45 min avant l’heure de l’analyse planifiée. Cette étape doit être complétée avant l’étape 1.12.
- S’inscrire au patient dans le système d’enregistrement Patient CT.
- Sélectionnez protocole analyse la prostate avec l’épaisseur de la tranche de 3 mm.
- Confirmer que le consentement de traitement, le consentement de contraste et la simulation commander se sont achevées par le médecin traitant.
- Demander au patient de changer dans une robe et retirer tous les vêtements de la taille vers le bas.
- Confirmer l’identité du receveur par vérifier verbalement que du patient, nom, date de naissance et de l’emplacement de la procédure.
- Prenez une photo du visage du patient.
- Demander au patient de s’asseoir sur la table et alors aider le patient en position couchée, la tête la première.
- Placer les jambes du patient dans le coussin gonflé d’immobilisation et les bras du patient sur la poitrine de l’entrelacement de leurs doigts, en leur donnant un anneau bleu ou d’appliquer les bandes autour de leurs bras.
- Confirmer l’alignement patient avec le système de laser.
- Branchez la pompe à vide double à la buse du coussin immobilisation.
- Placez les pieds dans le coussin d’immobilisation afin que le moule sera enveloppent le côté des jambes et aussi créer une barrière entre les jambes. Assurez-vous que le coussin d’immobilisation est en dessous du bassin et s’étend au-delà des pieds.
- Insérer et gonfler le ballonnet d’endorectal ab si indiqué sur le plan clinique par le médecin traitant.
- Effectuer antéro-postérieur (AP) et latéral (LAT) scout kilovoltage images par rayons x (topograms) pour confirmer que le patient alignement est optimisée. Cela inclut la vérification de la rectitude sur l’image de l’AP et alignement de rotation sur l’image latérale. Utiliser les deux images pour s’assurer que les gaz intestinaux est minime. Positionnement doit tous être corrigé et confirmé avec re-imaging. Si les gaz intestinaux est présent et excessive, excusez le patient aux toilettes et relancer le processus de 1.15 de l’étape.
- Une fois que le patient est dans la position souhaitée, retirer l’air le coussin d’immobilisation à l’aide de la pompe à vide double Q-fix pour former un moule solid autour de leurs jambes et les pieds.
- Régler manuellement la table de traitement afin que le collimateur laser est au niveau de la hanche du patient et à la ligne médiane de la hanches et le ventre au niveau de l’articulation de la hanche. Spécifier les emplacements en forme de croix sur le patient en utilisant un marqueur. Placer les marqueurs de localisation à la ligne de mire pour désigner un point de départ pour la simulation de vérification lors de la livraison de rayonnement.
- Paramètres pour inclure la région pelvienne de la colonne vertébrale L3 sur le mid-fémur Tomodensitométrie à ensemble.
- Analyser le patient en utilisant le protocole d’analyse la prostate.
- Confirmer que le scan est acceptable pour la planification du traitement. La vessie doit être pleine, et le rectum devrait avoir air minimal ou selles.
- Exporter le fichier de scan numérique vers le logiciel de planification de traitement et de prévenir la dosimétrie.
- Étiqueter le coussin d’immobilisation patient avec le patient ID, traitant nom médecin et installation instructions avant stockage pour une utilisation ultérieure au cours de la thérapie.
- Passez à l’étape 2.1 si le patient subit crayon faisceau protonthérapie. Passez à l’étape 3.1 si le patient recevra protonthérapie dispersion passive.
2. radiothérapie planification à l’aide de crayon de la radiothérapie
- Importer les données de simulation CT dans le logiciel (TPS) de planification de traitement.
- Utiliser le traitement système de planification contournage outils pour définir tous les volumes géométriques pertinents basé sur des images acquises de CT. Ces structures comprennent la vessie, rectum, gros intestin, intestin grêle, têtes fémorales, surface extérieure, fiducials, entretoise rectale ou endorectales ballon.
- Créer un contour externe supplémentaire, qui inclut le corps, la table de traitement et tout dispositif d’immobilisation. Dose de rayonnement sera uniquement calculée dans ce périmètre.
- Contour du premier volume cible clinique (CTV1) d’inclure la prostate, vésicules séminales et des ganglions concernées. Le CTV1 se prescriront 45,0 Gy (EBR). Le volume de CTV1 aura l’apparence d’une structure en forme de U sur des images axiales. Petits tissus normaux de l’intestin, du rectum et la vessie résidera dans le volume cible en forme de U.
- Contour du deuxième volume cible clinique (CTV2) d’inscrire la prostate et les vésicules séminales. Le CTV2 sera prescrit une dose totale de 34,2 Gy (EBR).
- Sélectionnez les trois faisceaux à des angles de portique de 90, 180 et 270 degrés pour le traitement du volume CTV1. Sélectionnez seulement les 90 et angles de faisceau de 270 degrés pour traitement CTV2.
- Création de deux structures géométriques de blocage (volumes d’évitement).
- Créer un volume de « Mid-bloc » évitement englobant les tissus normaux dans le volume en forme de U CTV1.
- Bloquer l’aspect inférieur du faisceau postéro-antérieure (180 degrés) au-dessous du niveau de la partie supérieure de la prostate à l’aide d’un bloc « rectum ».
- Créer une expansion isotrope de 7 mm de la CTV1 pour former un proton planification volume cible, nommé pPTV1. Le pPTV1 permet de définir un volume de placement spot telle que le proton Bragg pics (aussi dénommé « taches » de proton) sont positionnés à l’optimiseur de planification de la couverture de la CTV1.
- Comme dans l’étape 2.6, créer une expansion similaire du volume CTV2 former pPTV2, mais utiliser l’expansion de 8 mm dans le sens gauche-droite et l’expansion de 5 mm dans les deux directions antéro-postérieur et supérieur-inférieure.
- Pour activer l’optimisation robuste, une caractéristique qui peut rendre compte de la configuration incertitudes, incertitudes de la gamme et le remplissage de gaz variable de l’intestin, créez deux artificielle jeux de données du CT (« substitué ») : le premier a l’entier intestin grêle, gros intestin, et rectum écrasé à la densité de l’air et la seconde a ces volumes écrasées à la densité du muscle.
- Avant optimisation, créer un plan de traitement pour le CTV1. Désigner la machine de traitement de proton pour être utilisé pour la planification, affecter la dose prescrite et fractionnement de 45 Gy (RBE) en 25 fractions et définir la cible primaire pour être le CTV1. Attribuer 100 % de la dose prescrite pour couvrir au moins 98 % du volume CTV1 en utilisant tous les 3 faisceaux (latérale droite, gauche latérale et postéro-antérieure).
- Créer un autre plan de traitement pour le CTV2 avec 2 jeux de faisceau. Tout d’abord, attribuer 18 Gy (RBE) devant être livrés en 10 fractions à la CTV2 en utilisant seulement le faisceau latéral gauche et attribuer 16,2 Gy (RBE) à livrer dans les 9 fractions à la CTV2 en utilisant seulement le faisceau latéral droit. Attribuer 100 % de la dose prescrite pour couvrir 100 % du volume CTV2.
- Se préparer pour l’optimisation du plan CTV1
- Affecter la structure du milieu bloc comme une marge de gamme pour les poutres latérales et affecter la structure du rectum-bloc comme une marge de gamme pour le faisceau postéro-antérieure.
- Démarrez l’optimisation avec réglages automatique (par défaut) pour espacement couche énergétique, espacement spot et marge de cible.
- Spécifier un nombre maximal d’itérations de 40, un nombre maximal d’optimisations avant « filtrage spot » de 10 et un poids minimum de tache de 1,5 unité de moniteur. Spot filtrage élimine taches de proton avec moins de 1,5 unité de moniteur, tel qu’il existe une limite technique minimale sur le nombre de protons qui peuvent être offerts par la machine de traitement.
- Au premier tour de l’optimisation pour les CTV1, désigner la cible comme le pPTV1 d’établir la grille de positions spot de proton. Les objectifs spécifiés sont 45,5 Gy (EBR) (poids = 100) à la pPTV1 et une atténuation de la dose de 45 à 0 Gy (RBE) à une distance de 1 cm (poids = 2).
- Commencer un second tour de l’optimisation pour CTV1, en supprimant les objectifs pPTV1 ci-dessus. Puis reprendre l’optimisation avec les nouveaux objectifs et poids objectifs. Spécifiez ces paramètres comme suit, afin d’élaborer un plan d’intensité modulée, également connu sous le nom de multi-champ optimisation (FMO).
- Pour le volume externe, définir une atténuation de la dose de 45 à 0 Gy (RBE) à une distance de 1 cm et un poids de 2.
- Pour le volume CTV1, définir une dose minimale de 45 Gy (RBE) avec un poids de 100.
- Pour le volume CTV1, définir une dose uniforme de 45,5 Gy (RBE) et un poids de 100. Définir cet objectif comme robuste.
- Pour le volume de pPTV1, la valeur de la dose maximale à 46 Gy (RBE) avec un poids de 100 et cet objectif comme robuste.
- Pour le volume du rectum, définir une dose maximale de 45,8 Gy (RBE) avec un poids de 50. Définir cet objectif comme robuste.
- Pour le volume de la vessie, définir une dose maximale de 45,8 Gy (RBE) avec un poids de 50. Définir cet objectif comme robuste.
- Pour l’intestin grêle, définir une dose maximale de 45,8 Gy (RBE) avec un poids de 50. Définir cet objectif comme robuste.
- Pour le gros intestin, définir une dose maximale de 45,8 Gy (RBE) avec un poids de 50. Définir cet objectif comme robuste.
- Outre les objectifs spécifiques, affecter des paramètres de robustesse pour atténuer les quarts positionnels de 5 mm, incertitude de 3,5 % de gamme et incorporer les données de CT (« substituées ») artificielles mentionnées ci-dessus à la variabilité du gaz intestinaux adresse. Appliquer ces paramètres de robustesse qu’à ces objectifs précisés ci-dessus comme « robuste ».
- Terminer l’optimisation pour le plan CTV1 et examiner le plan optimisé pour s’assurer que la prescription d’objectifs ont été atteints.
- Se préparer pour l’optimisation du plan CTV2
- Compléter la première optimisation pour le plan de CTV2 à l’aide de la pPTV2 pour réaliser une grille de placement spot comme le plan CTV1.
- Supprimer les objectifs pPTV2 et reprendre l’optimisation avec nouveaux objectifs (les pourcentages sont établis à l’égard de la prescription pour les CTV2). Pour le plan CTV2, optimiser individuellement ces objectifs pour le faisceau de gauche et de droit. Ceci est connu comme le seul champ optimisation (AFS) et les objectifs pour chaque faisceau sont comme suit.
- Pour le volume externe, affectez une atténuation de la dose de 34,2 Gy (RBE) 0 Gy (RBE) à une distance de 5 mm et un poids de 2.
- Pour le volume CTV2, définir une dose minimale de 34,37 Gy (RBE) avec un poids de 120.
- Pour le volume CTV2, définir une dose uniforme de 34.54 Gy (RBE) avec un poids de 100. Définir cet objectif comme robuste.
- Pour le pPTV2 volume, a fixé une dose maximale de 34.88 Gy (RBE) avec un poids de 100. Définir cet objectif comme robuste.
- Utiliser les mêmes paramètres de robustesse pour l’optimisation.
- Terminer l’optimisation séparément pour les poutres latérales droite et gauche créer 2 jeux de faisceau de plan. Cela permettra la livraison de rayonnement à CTV2 en utilisant soit les poutres latérales droite ou gauche. Cette méthode diffère la livraison dose CTV1, qui exige que tous les 3 faisceaux (RL, LL et PA) à utiliser pour chaque traitement.
- Examiner les plans de traitement CTV1 et CTV2 indépendamment et en résumé pour s’assurer qu’ils respectent les contraintes de dose pour l’irradiation de la prostate établi par les essais RTOG 012619.
- Pour le volume de la vessie, faire en sorte que le pourcentage de tissu recevant 80 Gy est moins de 15 %, le pourcentage recevant 75 Gy est inférieure à 25 %, le pourcentage recevant 70 Gy est inférieur à 35 % et le pourcentage de réception de 65 Gy est inférieure à 50 %.
- Pour le volume rectal, faire en sorte que le pourcentage de tissu recevant 75 Gy est inférieure à 15 %, le pourcentage de recevoir 70 Gy est inférieur à 25 %, le pourcentage de réception de 65 Gy est inférieure à 35 % et le pourcentage recevant 60 Gy est inférieure à 50 %.
- Pour le volume du bulbe du pénis, assurez-vous que la dose moyenne est moins 52,5 Gy.
- Pour les volumes cibles CTV1 et CTV2, assurez-vous qu’au moins 95 % de ces deux volumes reçoivent la dose prescrite.
- Si les plans et les distributions de dose satisfont aux directives de contrainte de dose acceptée et robustesse, obtenir l’approbation du médecin et les plans d’exportation vers le système de livraison de traitement.
- Mesure pour confirmer l’exactitude de la dose prévue à l’aide de tableaux de la chambre d’ionisation, un type de détecteur de radiations.
- Vérifier l’exactitude de la calcul de la dose à l’aide d’un logiciel de calcul de dose secondaire et indépendante.
- Examiner les résultats des mesures et résultats du calcul des propriétés techniques du plan avec un physicien médical pour s’assurer le contrôle de la qualité.
- Générer les documents de planification de traitement et de les approuver par la planification de dosimétrie, physicien et médecin superviseur.
- Exporter des données vers le système de livraison de traitement pour le traitement des patients de planification de traitement tous les et passez à l’étape 4.1 pour la livraison de thérapie de proton.
3. rayonnement planification du traitement pour dispersion Passive ou uniforme protonthérapie d’analyse :
- Importer des données de simulation CT dans le système de planification des traitements de radiothérapie.
- Le contour de tous les volumes géométriques pertinentes basées sur les images de CT acquises. Ces structures comprennent la vessie, rectum, gros intestin, intestin grêle, têtes fémorales, surface extérieure, fiducials, entretoise rectale ou endorectales ballon.
- Créer un contour externe supplémentaire. Utiliser l’outil opération booléenne pour inclure le corps, la table de traitement et tout dispositif d’immobilisation. Dose de rayonnement sera uniquement calculée dans ce périmètre.
- CTV1 contour d’inclure la prostate, vésicules séminales et des ganglions concernées. Le CTV1 se prescriront 45,0 Gy (EBR).
- CTV2 contour d’inclure la prostate et les vésicules séminales. Le CTV2 sera prescrit une dose totale de 34,2 Gy (EBR).
- Développez CTV1 de 7 mm pour créer pPTV1 et créer pPTV2 en élargissant CTV2 de 7 mm dans toutes les directions sauf 5 mm vers l’arrière.
- Créer des poutres sur le système pour cibler les pPTV1 et pPTV2 de planification de traitement. pPTV1 s’adressera à l’aide d’un faisceau unique 180° PA tandis que pPTV2 s’adressera à l’aide de poutres latérales de 90° et 270°.
- Ajouter des blocs pour chaque faisceau avec une marge uniforme de 0,5 cm à des volumes pPTV1 et pPTV2.
- En utilisant le bloc taille sélectionnez le plus petit possible ouverture de taille de faisceau selon la taille de chaque volume pPTV. L’ouverture de faisceau est la découpe personnalisée en laiton qui sera joint au museau portique aux bords latéraux de forme de chaque faisceau de protons.
- Modèle de compensateur de cire appropriées nécessaire pour façonner la marge distale et proximale de chaque faisceau de protons en sélectionnant les paramètres appropriés de faisceau comme suit.
- Entrez une valeur d’incertitude gamme de 3,5 %, plus un supplémentaire 1 à 2 mm.
- La distance d’écart air approprié entre le patient et l’ouverture de l’entrée.
- Lisse et la forme de compensateur au gradient de dose souhaitée de diffamation.
- La valeur du isocenters pour pPTV1 et pPTV2 au même endroit dans le but de réduire au minimum les déplacements de patients requis pour la livraison de faisceau de protons.
- Calculer la dose à l’aide des paramètres entrés dans étapes 3.10.1-3.10.4 pour le pPTV1 et le pPTV2 des plans de cible.
- Examiner les plans de traitement pPTV1 et pPTV2 indépendamment et en résumé pour s’assurer qu’ils respectent les contraintes de dose pour le cancer de la prostate irradiation créée par les essais RTOG 012619 et décrit dans les étapes 2.17.1-2.17.4.
- Si vous le souhaitez OAR et cible objectifs pour la couverture de dose ne sont pas atteints, puis ajuster des paramètres de bloc et compensateur dans le TPS comme indiqué aux étapes 3.8-3.10 jusqu'à ce que les objectifs soient atteints. Une fois que les objectifs sont atteints, obtenir l’approbation du médecin et passez à l’étape 3.14.
- Vérifier l’exactitude de la calcul de la dose dans le plan approuvé en utilisant un ensemble de logiciels de calcul de dose secondaire et indépendante.
- Examiner les résultats des mesures et résultats du calcul des propriétés techniques du plan avec un physicien médical pour s’assurer le contrôle de la qualité.
- Commander les blocs et les compensateurs de fournisseur approprié.
- QA les blocs et les compensateurs reçues du fournisseur.
- Générer des documents de planification de traitement et de les approuver par l’intermédiaire de signatures numériques par la planification de dosimétrie, physicien et médecin superviseur.
- Exporter des données vers le système de livraison de traitement pour le traitement des patients de planification de traitement tous les et passez à l’étape 4.1.
4. rayonnement traitement livraison
- Le premier jour du traitement, vérifier que le plan de rayonnement correspond aux paramètres de plan dans le système de traitement.
- Organiser la salle de traitement afin de reproduire la configuration patiente utilisée au cours de la simulation de la CT. Assurez-vous que l’étiquette de coussin d’immobilisation correspond le patient ID et puis placer sur la table de traitement avec une indexation correcte. Placez l’appui-tête utilisé dans la simulation à la tête de la table.
- Confirmer avec le patient qu’ils ont achevé le processus de vessie pleine et transformé en une robe de traitement.
- L’escorter dans la salle de traitement et lui mettre en décubitus dorsal sur la table de traitement avec les mains jointes sur la poitrine et les jambes dans le coussin de l’immobilisation.
- Insérer et gonfler le ballonnet d’endorectal si utilisé pendant la simulation.
- Par voie électronique, déplacer la table de traitement de la position de chargement vers l’isocenter pour aligner le patient pour les marques qui sont placés pendant la simulation. Ajuster la table pour corriger des erreurs grossières en positionnement comme le tangage, rotation du patient et de lacet.
- Une fois que le patient est correctement aligné sur les marques de simulation, toutes les déplacements de la position de départ à celles déterminées au cours du processus de planification de traitement dosimétrique pour aligner le patient à l’isocenter de traitement souhaité.
- Effectuer KV orthogonale d’imagerie afin d’assurer le bon alignement de patient interne à la ceinture pelvienne et des marqueurs fiducial précédemment placés par urologie au sein de la prostate.
- Déterminer si les ajustages sont requises basé sur les images acquises de KV qui vient se superposer sur des radiographies reconstruites numériquement lors de la planification CT simulation. Appliquer les changements nécessaires pour assurer un alignement.
- Si KV images montrent des gaz intestinaux excessive, demandez au patient d’expulser l’air en position couchée sur la table de traitement si possible, puis réaligner et recréer l’image.
- Si le patient est incapable de sortir sur la table de traitement, interrompre le traitement et avoir le patient aller aux toilettes. Après que le patient revient de la salle de bain, relancer le processus de livraison de proton de 4,3 étape.
- Une fois acceptable KV images sont acquises et confirmés, un faisceau conique de balayage de CT (CBCT) est réalisé afin d’évaluer le remplissage de la vessie/rectal. Appliquer des ajustements de positionnement patients supplémentaires, issus de la numérisation CBCT. Comme avec KV axée sur l’imagerie positionnement corrections, les modifications apportées à l’aide de données CBCT seront envoyées directement à partir de la console d’imagerie à la table de traitement pour application automatisée.
- Vérifiez toutes les corrections de positions avec le médecin traitant avant d’entreprendre le traitement le premier jour de protonthérapie.
- Initier l’administration du traitement avec vérification sonore entre deux thérapeutes d’angle de portique, moniteur unités, nombre de taches de balayage et de couches et la position de museau pour chaque angle de traitement. Ces paramètres sont affichés sur la console de traitement et dans les documents de planification signés par dosimétrie, la physique et le médecin traitant.
- Après le traitement, marquer l’isocenter de traitement pour un alignement quotidiens et enlever les marques.
- Répétez les étapes 4.2 à 4.9 pour toutes les fractions de traitement ultérieur.
Résultats
Les données disponibles indiquent un bénéfice substantiel avec la protonthérapie pour certains cancers20,21. PT peut être favorisée pour certains tumeurs pédiatriques, les cancers récurrents dans des régions précédemment irradiées ou autres cancers où le risque de lésion tissulaire normale est élevé avec traitement de photon. Nous discutons ci-dessous, la demande et au profit de protonthérapie pour la prostate, du sein et un médulloblastome. Notre objectif est de fournir aux lecteurs une meilleure compréhension de la demande de protonthérapie pour les tumeurs fréquents chez les hommes, femmes et enfants.
Aux États-Unis, le cancer de la prostate est le plus couramment diagnostiqué une tumeur maligne chez les hommes et la seconde cause de décès liés au cancer chez les hommes. Environ 164 690 nouveaux cas seront diagnostiqués en 2018, et plus 29 000 hommes mourront de la maladie. Cancer de la prostate non métastatique est admissibles à des options de traitement, y compris une surveillance active, la prostatectomie radicale, la curiethérapie et radiothérapie externe avec des photons ou des protons du22. Traitement exact décisions sont prises selon l’anatomie patient, comorbidités, stade de la tumeur, jugement et patient préférence du chirurgien.
Livraison de rayonnement pour le cancer de la prostate de stade précoce est limitée à la prostate. Dans le cas de cancer de la prostate de risque intermédiaire, les vésicules séminales proximales s’adressent aussi bien. Bien que les traitements de la prostate partielles sont explorées, glande tout traitement demeure la norme de diligence. Obturateur, pré sacrales, internes iliaques et externes des ganglions iliaques sont souvent incluses des patients présentant la maladie intermédiaire et à haut risque défavorable.
Avant la radiothérapie planification, fiducial marqueurs peuvent être placés afin de permettre le traitement guidé par l’image en utilisant l’imagerie de prétraitement kilovoltage (i.e., radiographies standards)23. En outre, une entretoise d’hydrogel peut également être insérée avant simulation CT pour créer un espace entre le rectum et la prostate à autre dose limite aux tissus rectaux24,25. Au cours de la planification du traitement, les patients devraient être simulés en décubitus au bassin immobilisés à l’aide d’un dispositif de coussin sur mesure. Un ballon rectal peut être placé à la simulation de la CT de limiter tant la prostate motion et incertitude concernant rectale volume et densité26. Une vessie pleine confortablement est recommandée de limiter la dose à l’intestin grêle et la portion antérieure de la vessie27. Simulation de MRI est aussi conseillée pour permettre la meilleure cible volume délimitation26.
Les traitements devraient être conçues pour délivrer des doses de 75,6-79,2 que GY à la prostate, avec des doses de 45-50,4 Gy recommandé pour une couverture facultative de nodal ou vésicule séminale des régions à risque de maladie microscopique propagent9. Toutes les fractions sont envoyées une fois par jour à 1,8 à 2 Gy par fraction. Pour intermédiaires et à haut risque les patients recevant un coup de pouce de curiethérapie, la dose de rayonnement du faisceau externe devrait être limitée à environ 45 Gy. Doses de curiethérapie de 110 Gy doivent être utilisés avec implants permanents de taux I-125 à faible dose. Avec une dose élevée de brachythérapie envoyée par l’intermédiaire de cathéters, schémas de poussée couramment utilisés comprennent 13 à 15 Gy x 1 fraction, 8 à 11.5 Gy x 2 fractions, fractions de 5,5 à 6,5 Gy x 3 et 4,0 à 6,0 Gy x 4 fractions9.
Dosimétrie de planification de traitement est optimisé pour limiter la dose à la vessie, le rectum et le côlon. Dosimétriques comparaisons entre photon-versus proton - basent de thérapie (i.e., IMRT par rapport aux techniques de l’IMPT) ont démontré l’épargnant améliorée de doses pour les tissus normaux avec la dernière approche28.
La mortalité spécifique de cancer de la prostate est moins de 2 % à 10 ans pour les hommes avec la maladie de stade précoce22 quel que soit le traitement choisi. Avec la dose-intensifié RT, patients à risque élevé montrent également un taux de mortalité spécifiques de cancer de la prostate faible de 5 % à 9 ans29. La mortalité reste faible en grande partie en raison de la disponibilité des thérapies systémiques qui restent efficaces dans le cadre métastatique. Résultats avec IMRT et proton thérapie restent excellentes30,31. L’étude de PARTIQoL (NCT01617161) est une étude randomisée, en cours, entre protonthérapie faisceau (PBT) et IMRT pour cancer de la prostate de risque faible et intermédiaire qui permettra de déterminer si tout va bien si une modalité est supérieure sur l’autre.
Le cancer du sein est le plus souvent diagnostiquée une tumeur maligne chez les femmes et la seconde cause de décès liés au cancer chez les femmes américaines. Environ 268 670 nouveaux cas seront diagnostiqués en 2018, et 41 400 femmes mourront de la maladie1. Contrairement au cancer de la prostate où la plupart des patients reçoivent un rayonnement en monothérapie, patientes atteintes du cancer reçoivent un rayonnement après l’opération afin de réduire le risque de récidive de cancer11. En fonction de l’étendue de la chirurgie nécessaire, rayonnements peuvent être ciblés pour le restant de la poitrine après une tumorectomie tumeur ou à la paroi thoracique après mastectomie11,32. Les ganglions lymphatiques régionaux en région axillaire, sus-claviculaires et zones mammaires internes peuvent être ciblées si elles sont jugées à risque de tumeur se propager.
Horaires de traitement pour les patientes atteintes d’un entraînent généralement un traitement une fois par jour, cinq jours par semaine. Précoce est généralement traitées par conventionnellement fractionnés (1,8 à 2,0 Gy/fraction ; 50 Gy total) ou hypofractionated (2,67 Gy/fraction ; 40.05-42,56 Gy total) des régimes à la poitrine entière11,33. Patients atteints de maladie plus avancée, mais localisée sont traités avec fractionnement conventionnel à 50 Gy (1,8 à 2,0 Gy/fraction) le tout le mur du sein ou de la poitrine et les ganglions lymphatiques régionaux. Ces doses sont efficaces pour subclinique qui peut-être être présent après une intervention chirurgicale.
Simulation de CT pour la radiothérapie du cancer du sein est généralement terminée en décubitus dorsal. Contrairement au cancer de la prostate, les deux bras sont enlevés aériennes afin de permettre l’exposition des tissus mural ou la poitrine poitrine. En outre, un dispositif berçant personnalisée et la poitrine-Conseil sont souvent utilisés pour immobiliser le thorax en position surélevée afin que le manubrium est parallèle à la table de traitement. Cela garantit que les tissus du sein ne tombent pas supérieurement à la région du cou.
Exposition aux rayonnements à cœur pendant le cancer du sein est associée à un risque accru de futures maladies ischémiques34. Ainsi, des techniques pour réduire les doses de cœur sont d’une importance primordiale. Une approche consiste à employer cale souffle profond-inspiratoire (DIBH) pour augmenter l’espace intrathoracique et la distance entre le coeur et la poitrine mur/poitrine. Comme l’indique la méthode, les patients traités par DIBH vont suspendre leur cycle respiratoire et reçoivent un traitement au point maximal d’inspiration. Cependant, non tous les patients sont en mesure de tolérer les cales de souffle d’une durée suffisante pour permettre cette technique. Chez certains patients, une position couchée peut être avantageuse et peut permettre le tissu mammaire pour accrocher loin des tissus normaux critiques, y compris le coeur35. L’inconvénient de cette approche est la limitation qu’il accorde à la capacité de régions de vaisseaux lymphatiques de cibles. Protonthérapie peut atteindre dose cardiaque substantielle d’épargne sans avoir besoin de DIBH et de sujets techniques36,37.
Protonthérapie est employé pour les patientes atteintes de cancer et s’est révélé pour être supérieur aux techniques photoniques en ce qui concerne les effets parcimonieux des doses sur des structures critiques tels que les poumons et le coeur38. Un faisceau de crayon seul champ plan (PBS) avec un levier de vitesses gamme de balayage peut être utilisé pour administrer le rayonnement de protons à la paroi thoracique et les ganglions régionaux. Approches de dispersion passive peuvent également être employées. Si plusieurs champs sont nécessaires afin de traiter de la paroi thoracique ensemble et ganglions régionaux en raison des limites de champ, puis champ correspondants techniques doit être employé. La stratégie consiste à employer correspondant sus-claviculaires et des champs de paroi thoracique, jumelées à une lacune de la peau de 2 à 4 mm sous le chef claviculaire39. Les bordures de champ sont déplacés sur une distance de 1 cm à différents moments au cours de l’irradiation pour réduire au minimum les endroits chauds et froids.
Résultats cliniques avec radiothérapie mammaire démontrent une survie globale de 50 % pour la maladie au début du stade11 et 37 % pour les patients localement avancés à 20 ans de suivi32. Compte tenu de la période de rémission longue, minimisation du traitement liés à la toxicité est très préoccupante. Bien que la protonthérapie devrait potentiellement diminuer les risques de toxicité cardiaque, cette question est examinée dans le procès en cours RADCOMP Consortium (NCT02603341), qui est randomisant femmes atteintes du cancer à la radiothérapie de photons ou des protons.
Le cancer reste la seconde cause de décès chez les enfants âgés de 1 à 14 aux États-Unis et est seulement dépassé par les accidents. En 2018, 10 590 enfants seront diagnostiqués avec le cancer, et 1 180 mourront de leur malignité1. Parmi ce groupe, 250-500 patients seront diagnostiqués chez un médulloblastome. L’âge médian au diagnostic d’un médulloblastome est 4-6 ans. Compte tenu du risque élevé de liquide céphalo-rachidien participation et de diffusion (30-40 %), l’irradiation craniospinale (CSI) est standard de soins chez ces patients, avec environ 80 % de survie avec un traitement approprié.
Les patients médulloblastome sont stratifiés en groupes de risque normal et à haut risque selon leur âge, présence d’anaplasie ou métastases et quantité de tumeur résiduelle après résection chirurgicale. Dans les deux cas, le traitement comprend des radiations post-opératoires. RT pour un médulloblastome implique CSI initial à une dose de 23,4-36 Gy. Dose supplémentaire est alors donnée pour le lit de la tumeur pour atteindre une dose de 50,4-55,8 Gy à la tumeur primaire site40. Questions de planification de traitement incluent la limitation des doses maximales pour le tronc cérébral et la moelle épinière vers 54 Gy et 45 Gy, respectivement. CSI peut être livrée à l’aide de la thérapie de photons ou des protons. Simulation de CT et le traitement souvent nécessitent une anesthésie pour s’assurer que les patients ne bougent pas pendant le traitement,41.
En raison des grands domaines ciblés avec rayonnements photoniques RT techniques entraînent l’exposition irradiation considérables aux structures thoraciques et abdominales, antérieur à la moelle épinière, y compris le poumons, coeur, intestin reins et la poitrine. Ces régions peuvent être épargnées par excès rayonnement avec proton thérapie (Figure 3)42. PT base CSI nécessite deux champs latéraux légèrement obliques pour irradier le rachis cervical supérieur et le cerveau, ainsi qu’une ou plusieurs poutres postéro-antérieure visés la région inférieure de la colonne vertébrale cervicale, thoracique, lombaire et sacrée. Plusieurs champs sont requis, puisque la cible CTV pour CSI inclut l’espace de tout le liquide céphalorachidien (LCR), s’étendant depuis le sommet du cerveau pour le canal rachidien par l’intermédiaire de l’equina de cauda au niveau de la jonction vertèbre S2/S3 (Figure 3). La longueur de la colonne vertébrale détermine le nombre total de la colonne vertébrale champs obligatoires pour le traitement. La frontière supérieure du champ de la colonne vertébrale supérieure correspond à la bordure inférieure des champs crâniennes. Si le champ de la colonne vertébrale ne peut pas couvrir la colonne vertébrale entière, puis un deuxième champ de la colonne vertébrale est adapté à la frontière inférieure du champ spinal supérieur. Ce processus peut être répété si un champ tiers est nécessaire pour les patients plus grands. Pour les patients sous l’âge de 15 ans, le bord antérieur des champs colonne vertébrale est étendu pour inclure les corps vertébraux ensemble pour s’assurer une dose homogène à l’OS nécessaire afin d’éviter des anomalies de croissance future dans le squelette en développement. Pour les plus de 15 ans, la frontière de champ de colonne vertébrale antérieure se prolonge 2-3 mm au-delà du canal rachidien dans la colonne vertébrale.
Tant dispersion passive et les PBS techniques ont été utilisées pour CSI42,43. Des objectifs spécifiques de la thérapie CSI comprennent la dose de rayonnement homogène pour le liquide céphalo-rachidien (LCR) à l’extrémité inférieure de la thèque CCS (S2 ou S3), une dose complète à la plaque de base et cribriforme antérieure du crâne, réduction de la dose à des structures optiques, limitation de la thyroïde à pas plus de 5 % de la dose de prescription et à la minimisation de la dose à l' oesophage43.
Planification des traitements de dispersion passive commence généralement par la création de champs crâniennes. Compensateurs de la gamme avec l’édition manuelle sont souvent obligés de créer une distribution homogène de dose dans le cerveau, tout en limitant la dose pour les yeux et de la cochlée. Pour les champs de la colonne vertébrale, les compensateurs sont épaissis au niveau de la thyroïde pour minimiser la dose. Une attention particulière est alors accordée aux jonctions de champ entre les champs crâniens et spinaux et entre plusieurs champs de la colonne vertébrale lorsque requis. La zone de jonction est définie comme la longueur de 1,25 à 1,5 cm, où voisinent les champs. La jonction est décalée dans le sens crânien ou caudal par semaine pour prévenir le développement des zones chaudes ou froides dose. Idéalement, la variance de dose est conservée entre 95 à 108 % de la dose de prescription. Pondération de champ, ouverture modifications et les modifications compensateur sont tous employées pour atteindre cet objectif43.
Chercheurs au M.D. Anderson Cancer Center ont élaboré une stratégie par étapes pour CSI planification42. Cette approche implique l’élaboration d’un plan MFO pour traiter les champs de colonne vertébrale crânien et bas suivies par la création d’un plan SFO pour le rachis thoracique. Gradients de dose sont utilisés dans les zones de jonction. Le plan de la SFO est ensuite copié dans le plan initial de la FMO à élaborer un plan MFO final, composite. Jonctions de la colonne vertébrale sont déplacées une fois par 2 cm sur un parcours de 4 semaines de traitement. Par rapport à la dispersion passive CSI, PBS selon CSI offre des réductions substantielles des doses de rayonnement aux lentilles, cochlée et glandes parotides mais au prix de thyroïde une augmentation dose42.
Médulloblastome patients peuvent s’attendre à des taux de survie sans événement de 60 à 80 % selon les strates de risque44. Compte tenu de la grande surface de tissus irradiés avec CSI et de la nature sensible des patients pédiatriques, risques d’effets secondaires à long terme sont considérables et comprennent les tumeurs malignes secondaires, dysfonctionnement hypophysaire, surdité, troubles neurocognitifs, cardiopathie , infertilité, hypothyroïdie, vasculopathie, sécheresse des yeux, la formation de cataractes, une perte de vision et rayonnement nécrose/myélite. Par conséquent, axée sur les protons CSI peut offrir un avantage considérable pour de nombreux patients.
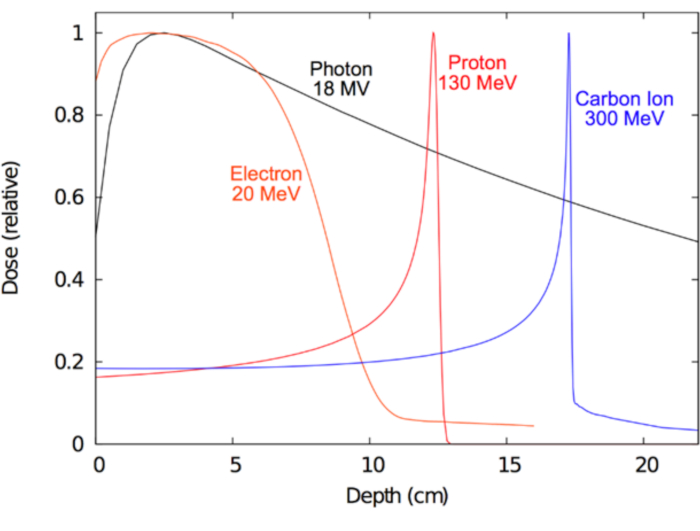
Figure 1 : courbes de dose de profondeur pour la radiothérapie. Répartition de la dose en fonction de la profondeur de l’eau pour divers faisceaux de rayonnement clinique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
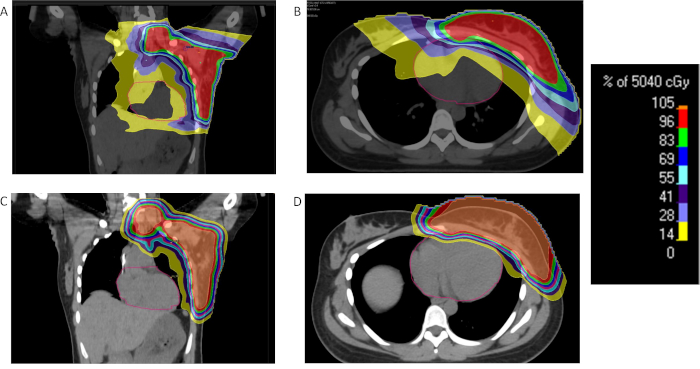
Figure 2 : comparaison du rayonnement du sein proton et photon. Pour cent de dose distribution pour un patient d’un cancer du sein localement avancé recevant une radiothérapie avec IMRT (A, B) ou Protons (C, D) et de réduction de dose de rayonnement considérable à coeur de démontrer et poumons avec des protons. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
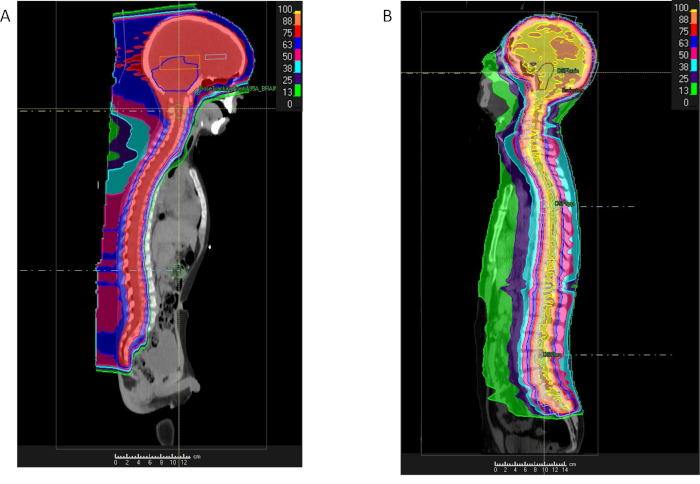
Figure 3 : comparaison des protons et photon irradiation craniospinale. Pour cent de dose distribution pour un patient avec un médulloblastome recevant l’irradiation craniospinale en utilisant soit Protons (A) ou RMI (B) et rayonnement considérable mettant en évidence la dose réduction aux régions intra-thoracique et intra-abdominale avec des protons. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Photon | Proton | |
| Type de particule | Boson | Fermion composite |
| Charge [C] | 0 | +1.602 x 10-19 |
| Masse [kg] | 0 | 1,672 x 10-27 |
| Essorage | 1 | 1/2 |
| Energy† [MeV] | 0,1 - 25 | 10 - 250 |
| Sources courantes | Accélérateur linéaire, Co-60 radio-isotopes, Tube à rayons x | Cyclotron ou accélérateur Synchrotron |
| Méthodes de livraison | Collimaté de poutres massives, les collimateurs multilames, intensité Modulation, Arcs | Diffusion passive, balayage magnétique |
| † Gamme d’énergie généralement utilisé pour traiter les cancers humains | ||
Tableau 1 : Comparaison des rayonnement de protons et le photon.
Discussion
Planification des traitements de radiation et de livraison pour le cancer est un processus hautement personnalisé personnalisé à chaque patient et l’accès à son notamment le cancer. Des traitements de radiothérapie moderne sont une guidée par l’image axée sur l’intervention CT images obtenues au cours d’un rayonnement sur mesure, simulation de planification. L’imagerie CT est obligatoire car il contient 3 dimensions (3D) anatomique d’informations sur la patiente mais aussi précise quantification des densités des tissus à différents endroits dans le corps qui sont requises pour le calcul de la dose. Au cours de l’imagerie tomographique, le patient est placé sur une table motorisée. Plusieurs dispositifs d’immobilisation mécanique sont généralement utilisés pour restreindre le mouvement patient en imagerie et au cours de la livraison subséquente de RT. Selon la précision voulue, ces appareils varie des coussins de moule-type simple et mailles en plastique, qui sont conformes à la surface du patiente et ensuite durcissent pour restreindre le mouvement, de plus les dispositifs invasifs tels que les dispositifs de crâne rigide qui sont percés en place. Souvent, la précision requise de l’appareil d’immobilisation est dictée par la proximité du tissu tumoral de structures critiques à proximité. À titre d’exemple, le dispositif d’immobilisation plus envahissant, un halo de tête percé dans place, est parfois utilisée lorsque la précision millimétrique unique est nécessaire pour traiter une tumeur près des yeux ou des nerfs optiques pour minimiser le risque de cécité qui peut-être survenir chez le patient se déplaçant dans une mauvaise position pendant le traitement.
CT d’imagerie d’informations est également utilisé pour optimiser l’anatomie interne de tissu normal. Par exemple, la distension de la vessie est souvent utilisée pour réduire au minimum la vessie et l’intestin grêle dose exposition par irradiation de la prostate comme indiqué dans le protocole ci-dessus. De même, si l’estomac est notamment distendu avec de la nourriture pendant la simulation d’irradiation abdominale supérieure (par exemple, estomac, foie, oesophage distal), puis le patient est ré-simulé après avoir laissé la nourriture de traverser l’estomac et du tractus intestinal . Cela va rétrécir l’estomac et réduire les risques d’exposition aux radiations au cours de la radiothérapie des tumeurs abdominales supérieures. Dans les cas où l’estomac ou la vessie sont eux-mêmes des objectifs de radiation, elles peuvent être intentionnellement distendus ou vidés pour optimiser la distribution de la dose.
Dans certains cas, une tumeur n’est pas adéquatement ou fiable visualisée sur CT mais peut-être être identifiée plus précisément par une IRM ou un PET scan. Dans de tels cas, les scans de PET ou IRM sont utilisés pour compléter les données CT puisque ce dernier est toujours requis pour le calcul de la dose. Ceci est réalisé en enregistrant les images IRM et TEP pour les images de CT pour la planification de traitement. IRM offrent souvent beaucoup plus grand contraste visuel et une résolution supérieure à CT, ce qui peut être bénéfique pour identifier les limites minces, tissus mous d’une tumeur comme celles dans le cerveau ou le foie. PET fournit une vue fonctionnelle de la distribution des molécules de traceur radioactif marqué injectée au patient.
Certaines tumeurs surviennent dans les zones du thorax ou l’abdomen où ils peuvent se déplacer beaucoup avec la respiration. Afin de tenir compte de ce mouvement assurer l’exactitude de rayonnement, un CT 4 dimensions, un type d’imagerie en « mode film » CT, peut servir à capturer l’anatomie 3D patient comme elle change au fil du temps au cours de la respiration. Pour certaines cibles thoraciques et abdominales, courroies de compression ou d’autres moyens d’atténuation de la motion peut servir pendant la thérapie à la motion de restreindre et limiter l’incertitude au sujet de la tumeur emplacement45.
Une fois que le patient est simulé pour le traitement, il élabore un plan de traitement personnalisé en tenant compte de l’histologie du cancer, tumeur emplacement et caractéristiques anatomiques, qui influencent la configuration optimale des faisceaux de rayonnement, les types de particules, les énergies, et les niveaux de dose pour chaque patient. Pour chaque patient, un certain nombre de questions fondamentales est initialement envisagé par l’équipe de la clinique d’élaborer un plan de traitement optimal. Comme point de départ, la forme la plus appropriée de rayonnement doit être sélectionnée. Options incluent des photons, les électrons et les protons. Il est généralement suivi par la sélection du faisceau angle(s) pour la livraison de rayonnement. La plupart des machines de RT comprennent un patient robotique, positionnement de la table et un portique rotatif permettant aux poutres de RT qui sera réalisé dans le patient par pratiquement n’importe quel angle. La décision consiste à trouver le chemin d’accès qui frappe plus efficacement la cible avec la RT et meilleur évite non-cibles qui peuvent être dans le chemin des poutres sélectionnées. Dans certains cas, les angles de faisceau sont déterminées par le système de planification lui-même après saisie dans des objectifs de radiation pour les tumeurs et les tissus normaux. Ce processus s’appelle « planification inverse » et se fait souvent dans le cas de l’IMRT, qui consiste à moduler l’intensité de multiples, des faisceaux de rayonnement entrant d’une manière dépendante du temps qui apporte une dose cible uniforme, mais peut conduire à dose très hétérogène en dehors de la cible. Même si les deux photons ou proton thérapie peut-être intensité modulée, inverse planification sert en grande partie en photon basé IMRT seulement. Si les faisceaux de rayonnement solides doivent être utilisés, des collimateurs métalliques personnalisés peuvent être fabriquées pour correspondre à la forme de rayonnement du faisceau avec la forme de la tumeur.
Si protonthérapie est sélectionné, puis un arrêt subséquent a besoin au sujet de l’utilisation de dispersion passive ou techniques de PBS. Dans le cas de PBS, une décision supplémentaire est nécessaire concernant l’utilisation de MFO ou stratégies monochamp optimisation/monochamp dose uniforme (AFS/SFUD). Dans les traitements de la FMO, faisceaux multiples sont nécessaires pour traiter une tumeur au cours de chaque fraction étant donné que chaque faisceau cible uniquement une partie de la cible. En revanche, pour les plans de l’OFS, chaque faisceau couvre l’ensemble de la cible. MFO est souvent préférée pour les tumeurs près une infrastructure critique (e.g., tumeur au cerveau près du nerf optique) où une variété d’angles de faisceau peut être avantageuse pour sculpter la dose de rayonnement. Stratégies MFO également veiller à ce que tous les rayonnements poutres/spots ne « finissent pas gamme » dans la même zone où la dose pourrait être exceptionnellement élevée due à l’effet de pic de Bragg. En revanche, SFO est favorisée pour les cibles près des zones d’incertitude anatomique, tels que la prostate qui peut se déplacer en raison de la vessie différentielle et remplissage rectal. SFO offre une robustesse accrue contre les changements de dose en raison des variations anatomiques.
Une fois que la stratégie de planification base est décidée, la prochaine étape de planification du traitement implique généralement optimisation mathématique, les champs de rayonnement. L’énergie, l’intensité et la répartition spatiale (spatialement variant de flux) du rayonnement incident sont des paramètres généralement libres dans l’optimisation. Ainsi que la représentation de la grande matrice 3D de l’anatomie de patients par le CT, ces variables libres conduisent à une taille très grand problème et une optimisation importante correspondante matrices (p. ex., des milliers de valeurs de CT et des milliers de faisceau possible intensités doit être considérés). Ces matrices sont encadrées d’une fonction objectif, qui est une formulation mathématique de la « finalité de planification du traitement ». Comme mentionné ci-dessus, les objectifs du traitement sont priorisés pour atteindre tout d’abord la dose prescrite à la cible, et ensuite pour atteindre le plus bas d’une dose est possible pour les tissus normaux. Pour minimiser cette fonction objectif, puissance de calcul élevée est souhaitée pour effectuer rapidement des calculs de transport de RT qui peuplent les matrices, et des méthodes d’optimisation numérique, tels que les algorithmes de gradient-recherche, sont utilisés pour rechercher rapidement des minima locaux dans la fonction. Ces minima correspondre à des plans de traitement optimal pour chaque patient unique. Le rôle des ordinateurs dans la planification du traitement ne peut être surestimé. Radiodiagnostic et radiothérapie moderne ne serait pas possibles sans les progrès de l’informatique des trois dernières décennies.
Comme une étape finale, le plan de traitement optimisé est examiné par l’équipe médicale (médecin, physicien et dosimétrie). Dans de nombreux cas, le plan peut être adapté plus ou ré-optimisé avec des objectifs différents pour améliorer la qualité globale. Une fois que le plan s’avère optimale, les paramètres techniques du plan sont étudiés par un physicien et transférés à la machine de livraison de traitement.
Dans de nombreux cas, le patient retourne plusieurs fractions de traitement (sessions), souvent tous les jours ouvrables pendant plusieurs semaines. Fractionnement de plusieurs jour peut intensifier les effets secondaires aigus induits par la radiation mais peut réduire le potentiel fin, plus graves effets secondaires de la RT par rapport à la fraction simple traitement12. Fraction de multiples approches sont optimales pour les tumeurs qui sont divisent rapidement ou incapable de réparer des lésions sublétales de RT Toutefois, cela dépend du site de traitement exact et la sensibilité des tissus normaux à proximité. Étant donné que l’objectif de l’administration du traitement rayonnement est d’administrer le même traitement au cours de chacune des fractions, même à quelques millimètres de mouvement ou d’incertitude dans la position du patient peuvent conduire à la dégradation d’un plan de traitement de thérapie de particules. Pour cette raison, le guidage par l’image embarqué systèmes sont d’une importance primordiale au cours de la multifraction imageurs RT. radiographie, cone beam CT scans ou imageurs surfaces optiques, laser à balayage sont tous disponibles à cet effet. Ces dispositifs permettent de radiothérapie guidée par l’image (IGRT) par le biais de l’imagerie des repères anatomiques, des cibles tumorales ou marqueurs repères radio-opaques de substitution. Les images de RTGI sont comparés pour les scans de simulation original et réglés comme il est nécessaire avant chaque fraction du rayonnement.
Malgré l’avantage de la portée finie de protonthérapie, qui limite la dose de sortie, la précision de la prédiction de gamme généralement vue dans la planification du traitement est l’ordre de quelques millimètres. La perte d’énergie exacte dans différents tissus du patient est incertaine, tout d’abord, puisque les composants moléculaires exactes du tissu sont ambiguës et, deuxièmement, étant donné que l’anatomie du patient change au fil du temps, les deux plus courtes échelles de temps (p. ex., respiration) et plus longues échelles de temps (p. ex., perte de poids, rétrécissement de la tumeur, modifications de l’anatomie normale). Pour répondre à cette incertitude, une « marge distale » est ajoutée au volume cible qui est une marge additionnelle de tissu normal juste au-delà de la profondeur maximale de tumeur. Une telle marge assure que même avec les incertitudes dans la prédiction de la gamme, la profondeur de la tumeur tout est traitée avec le degré de confiance élevé. Malheureusement, la marge de tissu normal peut ainsi être exposée à la dose complète de la RT, qui peut conduire à des effets secondaires importants RT dans ce tissu. En revanche, comme les photons ne pas arrêter mais plutôt sortir de la cible, aucune telle marge distale n’est nécessaire pour compenser l’incertitude de la gamme. Une marge géométrique est encore utilisée dans la thérapie de photon pour tenir compte des incertitudes positionnel de la cible, mais les photons sont beaucoup moins sensibles que les protons le statut précis des tissus du patient en amont de la cible. Par conséquent, la marge nécessaire peut être parfois inférieure pour les photons à protons. Cela peut se comprendre en prenant en considération que les protons subissent une perte d’énergie continue dans les tissus qui affectent considérablement la position de leur aire de répartition, alors que les photons sont déchargées et voyagent librement dans l’espace vide entre les atomes et leurs orbitales, à l’exception de rares collisions avec des électrons ou des noyaux. Différences de densité importante dans les tissus, par exemple., des objets métalliques ou des cavités d’air, cependant, encore influencent dose de photons ainsi que de la dose de protons, mais à un niveau inférieur.
Une finale et importante d’incertitude porte sur l’efficacité radiobiologique (EBR) de différentes formes de rayonnements. L’EBR est le rapport entre les doses, d’un type de rayonnement de référence et un type de rayonnement de test, à condition que les deux types de rayonnement produisent le même effet biologique. Plus le RBE, plus endommager le rayonnement par unité de dépôt d’énergie dans les tissus. Le ratio RBE est défini en ce qui concerne les rayonnements de photons. Malgré cette simple description, il n’y a en fait grande incertitude concernant les valeurs de l’EBR de particules chargées par opposition aux photons. Différences dans les distributions spatiales dose entre les photons et les particules chargées à l’échelle micrométrique et nanométrique mènent aux différences d’effet biologique, même lorsque les doses macroscopiques sont identiques. Cela peut se comprendre en examinant la répartition spatiale des dommages à l’ADN après exposition à des particules chargées à des doses différentes et de différentes énergies cinétiques. Différentes énergies cinétiques et différentes charges des protons (+ 1) et des ions carbone (+ 6) conduisent à des différences de transfert d’énergie à différentes profondeurs dans le patient, alors que pour les photons, le transfert d’énergie est comparativement plus faible et aussi plus homogène tout au long de le patient. Bien que théoriquement, il y a débat significatif dans la communauté d’oncologie de rayonnement concernant la capacité de prédire ces effets biologiques. Pour la thérapie d’ions carbone, il y a un manque de consensus sur la meilleure façon de modéliser ces effets biologiques, même si l'on reconnaît que ces effets doivent être modelées pour fournir une thérapie. Pour les protons, centres cliniques plus plan actuellement la thérapie sans modélisation explicite des effets RBE, sauf en utilisant un facteur de correction constante de 1.1, mais cela est susceptible de changer dans un proche avenir comme nouveau systèmes de planification de traitement commerciaux commencent à inclure biologique logiciels outils pour modéliser l’EBR de protonthérapie de modélisation.
Avec l’achèvement des essais randomisés, dont RADCOMP, PARTIQoL et RTOG 1308, nous devrions avoir des réponses plus concrètes quant aux formes de rayonnement peuvent être supérieurs pour le cancer du sein, la prostate et le cancer du poumon, respectivement. Des études similaires sont prévues pour d’autres sites de maladies qui peuvent aider à mieux identifier la meilleure modalité de traitement pour ces types de tumeurs. Cependant, il y a déjà suffisamment de données pour suggérer la supériorité des protons dans certains milieux, en particulier dans la population pédiatrique, où épargnant les tissus normaux substantielle peut considérablement réduire la morbidité des effets toxiques, y compris secondaire tumeurs malignes.
Déclarations de divulgation
A.H. a honoraires d’Astrazeneca, Bayer et Novartis. A.H. a consulté avec Astrazeneca, Bristol-Myers Squibb et Bayer et a été conférencier pour la fondation de France.
Remerciements
S.R. reconnaît les subventions du programme de remboursement de prêt NIH. A.H. a reçu un financement de Bayer, Clovis, Constellation, Agensys, Sotio, Cerulean et Calithera.
matériels
| Name | Company | Catalog Number | Comments |
| Proton beam cyclotron and gantry delivery system | Varian | N/A | Allows for generation and delivery of protons for radiotherapy |
| kVUE One Proton Couch Top | Qfix | RT-4551KV-03 | Permits patient placement for radiotherapy |
| CT simulator with 4D scanning capability | GE | N/A | Permits CT simulation for radiation planning |
| 100" x 70" Qfix VacQfix Cushion | Qfix | RT-4517-10070F30 | Immobilizes patient for more precise radiation delivery |
| Timo Foam Head Support | Qfix | RT-4490-F | Ensures minimization of head motion during radiotherapy |
| 3 CT Localizers Localization Markers | Beekley Medical | REF 211 | Ensures concordance of external markers and internal patient anatomy from CT simulation |
| VacQfix Indexer | Qfix | RT-4517-IND01 | Ensures VacQfix cushion placement is reproducible for every radiatiion treatment |
| Radiation treatment planning software | Raystation | N/A | Allows for personalized radiation planning for every tumor with robust optimization and multi-criteria optimization |
| Proton Range Compensator | .Decimal | RC-AC 1018 | Adjusts the range of the proton beam to achieve distal dose conformality |
| Proton Beam Aperture | .Decimal | AP-BR 1800 | Shapes the proton beam treatment area |
| Proton Range Shifter | .Decimal | RS-AC 1018 | Adjusts proton beam tissue depth penetration |
| Endorectal Balloon | Radiadyne | ILG-90F | Ensures uniform rectal filling and prostate positioning |
Références
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Barton, M. B., et al. Estimating the demand for radiotherapy from the evidence: a review of changes from 2003 to 2012. Radiotherapy and Oncology. 112 (1), 140-144 (2014).
- Pan, H. Y., et al. Supply and Demand for Radiation Oncology in the United States: Updated Projections for 2015 to 2025. International Journal of Radiation Oncology Biology and Physics. 96 (3), 493-500 (2016).
- Reed, A. B. The history of radiation use in medicine. Journal of Vascular Surgery. 53 (1 Suppl), (2011).
- T Landsberg, P. . Nobel Lectures in Physics, 1901-1921. 18, (1967).
- . Non-small cell lung cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (2018)
- . Pancreatic Adenocarcinoma Available from: https://www.nccn.org/professionals/physician_gls/pdf/pancreatic.pdf (2017)
- . Breast cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (2017)
- . Prostate Cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (2017)
- Chang, J. Y., et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncology. 16 (6), 630-637 (2015).
- Fisher, B., et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. The New England Journal of Medicine. 347 (16), 1233-1241 (2002).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. , (2012).
- Lomax, A. J. Charged particle therapy: the physics of interaction. The Cancer Journal. 15 (4), 285-291 (2009).
- Rossi, B., Greisen, K. Cosmic-Ray Theory. Reviews of Modern Physics. 13 (4), 240-309 (1941).
- Blakely, E. A., Chang, P. Y. Biology of charged particles. The Cancer Journal. 15 (4), 271-284 (2009).
- Schardt, D., Elsässer, T., Schulz-Ertner, D. Heavy-ion tumor therapy: Physical and radiobiological benefits. Reviews of Modern Physics. 82 (1), 383-425 (2010).
- Chun, S. G., et al. The Potential of Heavy-Ion Therapy to Improve Outcomes for Locally Advanced Non-Small Cell Lung Cancer. Frontiers in Oncology. 7 (201), 1-3 (2017).
- Pan, H. Y., Jiang, J., Shih, Y. T., Smith, B. D. Adoption of Radiation Technology Among Privately Insured Nonelderly Patients With Cancer in the United States, 2008 to 2014: A Claims-Based Analysis. Journal of the American College of Radiology. 14 (8), (2017).
- Michalski, J. M., et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncology. , (2018).
- Glimelius, B., et al. Number of patients potentially eligible for proton therapy. Acta Oncologica. 44 (8), 836-849 (2005).
- Doyen, J., Falk, A. T., Floquet, V., Herault, J., Hannoun-Levi, J. M. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treatment Reviews. , 104-112 (2016).
- Hamdy, F. C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine. 375 (15), 1415-1424 (2016).
- Ng, M., et al. Fiducial markers and spacers in prostate radiotherapy: current applications. British Journal of Urology International. 113, 13-20 (2014).
- Hedrick, S. G., et al. A comparison between hydrogel spacer and endorectal balloon: An analysis of intrafraction prostate motion during proton therapy. Journal of Applied Clinical Medical Physics. 18 (2), 106-112 (2017).
- Hamstra, D. A., et al. Continued Benefit to Rectal Separation for Prostate Radiation Therapy: Final Results of a Phase III Trial. International Journal of Radiation Oncology Biology Physics. 97 (5), 976-985 (2017).
- Wortel, R. C., et al. Local Protocol Variations for Image Guided Radiation Therapy in the Multicenter Dutch Hypofractionation (HYPRO) Trial: Impact of Rectal Balloon and MRI Delineation on Anorectal Dose and Gastrointestinal Toxicity Levels. International Journal of Radiation Oncology Biology Physics. 99 (5), 1243-1252 (2017).
- Chen, Z., Yang, Z., Wang, J., Hu, W. Dosimetric impact of different bladder and rectum filling during prostate cancer radiotherapy. Radiation Oncology. 11, 103 (2016).
- Rana, S., et al. Dosimetric and radiobiological impact of intensity modulated proton therapy and RapidArc planning for high-risk prostate cancer with seminal vesicles. Journal of Medical Radiation Sciences. 64 (1), 18-24 (2017).
- Rodda, S., et al. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer. International Journal of Radiation Oncology Biology Physics. 98 (2), 286-295 (2017).
- Zietman, A. L., et al. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09. Journal of Clinical Oncology. 28 (7), 1106-1111 (2010).
- Al-Mamgani, A., Heemsbergen, W. D., Peeters, S. T., Lebesque, J. V. Role of intensity-modulated radiotherapy in reducing toxicity in dose escalation for localized prostate cancer. International Journal of Radiation Oncology Biology Physics. 73 (3), 685-691 (2009).
- Ragaz, J., et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. Journal of the National Cancer Institute. 97 (2), 116-126 (2005).
- Whelan, T. J., et al. Long-term results of hypofractionated radiation therapy for breast cancer. New England Journal of Medicine. 362 (6), 513-520 (2010).
- Darby, S. C., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. New England Journal of Medicine. 368 (11), 987-998 (2013).
- Wroe, A. J., Bush, D. A., Schulte, R. W., Slater, J. D. Clinical immobilization techniques for proton therapy. Technology in Cancer Research and Treatment. 14 (1), 71-79 (2015).
- Shah, C., et al. Cardiac dose sparing and avoidance techniques in breast cancer radiotherapy. Radiotherapy and Oncology. 112 (1), 9-16 (2014).
- Patel, S. A., et al. Postmastectomy radiation therapy technique and cardiopulmonary sparing: A dosimetric comparative analysis between photons and protons with free breathing versus deep inspiration breath hold. Practical Radiation Oncology. 7 (6), e377-e384 (2017).
- Depauw, N., et al. A novel approach to postmastectomy radiation therapy using scanned proton beams. International Journal of Radiation Oncology Biology Physics. 91 (2), 427-434 (2015).
- MacDonald, S. M., et al. Proton therapy for breast cancer after mastectomy: early outcomes of a prospective clinical trial. International Journal of Radiation Oncology Biology Physics. 86 (3), 484-490 (2013).
- Merchant, T. E., et al. Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. International Journal of Radiation Oncology Biology Physics. 70 (3), 782-787 (2008).
- McMullen, K. P., Hanson, T., Bratton, J., Johnstone, P. A. Parameters of anesthesia/sedation in children receiving radiotherapy. Radiation Oncology. 10, 65 (2015).
- Stoker, J. B., et al. Intensity modulated proton therapy for craniospinal irradiation: organ-at-risk exposure and a low-gradient junctioning technique. International Journal of Radiation Oncology Biology Physics. 90 (3), 637-644 (2014).
- Giebeler, A., et al. Standardized treatment planning methodology for passively scattered proton craniospinal irradiation. Radiation Oncology. 8, 32 (2013).
- Gajjar, A., et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncology. 7 (10), 813-820 (2006).
- Lin, L., et al. Evaluation of motion mitigation using abdominal compression in the clinical implementation of pencil beam scanning proton therapy of liver tumors. Medical Physics. 44 (2), 703-712 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon