Method Article
Entrega de terapia de protones y su aplicación clínica en tumores malignos Tumor sólido seleccione
En este artículo
Resumen
Se presentan los fundamentos de la planificación y entrega para la terapia de protones con el cáncer de próstata como modelo. La aplicación de estos principios a otros sitios de enfermedad seleccionada destaca cómo radioterapia de protones puede mejorar los resultados clínicos para los pacientes de cáncer.
Resumen
La radioterapia es una modalidad utilizada para el tratamiento de cánceres sólidos. Aunque los mecanismos de muerte celular son similares para todas las formas de radiación, las propiedades en vivo de haces de fotones y protones difieren considerablemente y tal vez explotados para optimizar los resultados clínicos. En particular, las partículas de protones pierden energía de manera predecible a medida que pasan a través del cuerpo. Esta propiedad se utiliza clínicamente para el control de la profundidad en que se termina el haz de protones y límite la dosis de radiación más allá de la región de destino. Esta estrategia puede permitir reducciones sustanciales de dosis de radiación a los tejidos normales situado más allá de un objetivo de tumor. Sin embargo, la degradación de la energía de protones en el cuerpo es muy sensible a la densidad del tejido. Como consecuencia, cualquier cambio en la densidad del tejido durante el curso del tratamiento puede alterar significativamente la dosimetría de protones. Tales cambios pueden ocurrir por alteraciones en el peso corporal, respiración o relleno de gas intestinal y pueden resultar en la deposición de dosis desfavorable. En este manuscrito, nos proporcionan un método detallado para la entrega de terapia de protones utiliza dispersión pasiva y haz de lápiz exploración técnicas para cáncer de próstata. Aunque el procedimiento descrito se refiere directamente a los pacientes de cáncer de próstata, el método puede adaptado y aplicado para el tratamiento de prácticamente todos los tumores sólidos. Nuestro objetivo es dotar a los lectores con una mejor comprensión de los resultados y la entrega de terapia de protones para facilitar la integración apropiada de esta modalidad durante la terapia del cáncer.
Introducción
Se estima que 1,7 millones de personas en los Estados Unidos se diagnosticarán con cáncer en 2018, con más de 600.000 sucumbir a la enfermedad1. Opciones actuales de tratamiento incluyen terapia de mono o multi modality mediante cirugía, radioterapia (RT) y tratamientos sistémicos. Con respecto a la RT, un cuarto de los pacientes recién diagnosticados lo recibirá como parte de su terapia del cáncer inicial y casi la mitad en última instancia requiere durante su curso de la enfermedad2,3.
El advenimiento de RT remonta a 1895 cuando Roentgen de Guillermo Conrado descubrió rayos x mientras trabajaba con un tubo de rayos catódicos en su laboratorio en la Universidad de Wurzburgo en Alemania4. No mucho después, pacientes con distintas enfermedades tales como lupus y cáncer estaban recibiendo tratamientos con rayos de radio. Complicaciones tempranas fueron rápidamente se dio cuenta y se discutieron incluso por Pierre Curie en su premio Nobel Conferencia5. Puesto que la radiación afecta a los tejidos normal y tumoral, deben ser utilizadas cuidadosamente controladas dosis de radiación para maximizar la relación terapéutica, definida como la probabilidad de control tumoral versus la probabilidad de toxicidad inaceptable. Los graduales avances en tecnología, así como comprensión de la física y Radiobiología, relación terapéutica ha mejorado con el tiempo. El uso de RT ha mejorado significativamente los resultados para varios tipos de cáncer, como se refleja por su inclusión en las guías nacionales para cáncer terapia6,7,8,9. En algunos casos, RT puede utilizarse como la única modalidad de tratamiento10, mientras que en otras enfermedades, puede ser usada como parte de la terapia de modalidad múltiple para el control local de la enfermedad o la erradicación de la enfermedad microscópica11. Aunque a menudo se utiliza con una intención curativa, muchos pacientes de RT son tratados para el alivio del dolor u otros síntomas que se desarrollan de compresión inducida por el tumor, invasión o destrucción de los tejidos normales en el ajuste de loco-regional o generalizada, metastásico de la enfermedad.
Los principios básicos detrás de RT son sencillos. Con la aplicación de la radiación, energía se deposita en las células a través de la ionización de los átomos. Esta energía, aunque puede elevar la temperatura de una región irradiada por sólo unos cuantos microkelvins, produce radicales libres que pueden directamente las células de daños expuestos por medio de ADN lesiones12,13. Mucha de nuestra comprensión de la radiación de la partícula de alta energía y su interacción con la materia proviene de estudios teóricos y experimentales de los rayos cósmicos y sus interacciones en la atmósfera superior llevado a cabo en los primeros 20th siglo14. Las partículas cargadas de alta energía (MeV a GeV) interactúan con la materia principalmente por medio de la fuerza electromagnética: como estas partículas pasan a través de materia o tejido, inelástica colisiones con electrones orbitales conducen a ionización y excitación de la materia del destino, y colisiones elásticas con núcleos atómicos conducen a la dispersión o desviación de la trayectoria de la partícula. Además, colisiones nucleares y duras colisiones con electrones conducen a una cascada de radiación secundaria que añade el efecto ionizante de la radiación de la partícula. Partículas de alta energía atraviesa la materia así dejan una estela de átomos ionizados, moléculas y electrones libres que son químicamente reactivas y potencialmente pueden inducir cambios biológicos o dañar a los organismos expuestos a estos campos ionizantes.
Un importante objetivo a largo plazo de la radioterapia ha sido aprender cómo mejor aprovechar estos campos de manera que se tratan efectivamente la enfermedad humana de ionización. Clínicamente, la forma ideal de radiación (por ejemplo, fotones, protones, electrones o iones pesados) debe inducir ionización suficiente en el objetivo de la enfermedad para proporcionar efecto terapéutico antitumoral, mientras que en el mismo tiempo causa mínimo de ionización en la normal circundante tejidos para reducir al mínimo efectos nocivos. Selecciona que tipo de radiación para RT depende en parte de la enfermedad que padece. Para los tumores que se encuentran más profundas dentro del cuerpo y también pueden ser quirúrgicamente inoperable, megavolt fotones, protones e iones pesados se consideran óptimo15,16. Para los cánceres superficiales, tales como aquellos que involucran la piel, terapia del electrón puede ser óptima e incluso preferible a la cirugía estética. Por otro lado, la ventaja de fotones megavolt radica en su capacidad de penetrar profundamente en el tejido mientras limita el daño a la piel. En el caso de partículas cargadas, como electrones, protones o iones pesados, su principal ventaja reside en sus características de 'parar'; es decir, partículas cargadas pierden energía continuamente a través de la colisión inelástica descrito anteriormente, y esta pérdida de energía es altamente predecible en la escala de milímetros. Por lo tanto, un haz de partículas cargadas se puede entregar a un paciente con las energías precisas a la profundidad deseada. Además, las partículas cargadas producen poca o ninguna salida dosis17. Por el contrario, sin cargar partículas como fotones exhiben una disminución exponencial (atenuación) con el aumento de profundidad, que a menudo conduce a una dosis de salida importante que puede comprometer tejidos sanos distales a la meta. Estos conceptos se demuestran en la figura 1se muestra la radiación dosis (ionización) propiedades de los distintos tipos de radiación utilizados clínicamente. Una motivación central para utilizar protones o iones de carbono en vez de fotones para objetivos de tumor más profundo es que hay dosis mínima dosis de entrada y cerca de cero dosis de salida más allá de los tejidos diana. La tabla 1 resume algunas de las características clínicamente relevantes de haces de fotones y protones.
Avances en el campo de la radioterapia, incluyendo la terapia de protones, se han producido en dos frentes principales: 1) la construcción eficiente de aceleradores de partículas capaces de producir energía (MeV) la radiación tales como aceleradores de sincrotrón y ciclotrón y 2) desarrollo de métodos computacionales sofisticados que combinan datos de imágenes de la enfermedad y cálculos de transporte de radiación para permitir simulado por ordenador "planificación del tratamiento." Para la planificación del tratamiento, los pacientes típicamente experimentan proyección de imagen de tomografía computada (CT). Las imágenes del CT contienen 3 dimensiones información anatómica sobre la paciente, así como precisa cuantificación de las densidades de tejido. Las imágenes de CT y mapas de densidad entonces se utilizan en simulaciones de computadora para planificar el tratamiento de radiación: la energía y la intensidad del campo de radiación están optimizadas matemáticamente para cada paciente. Una exploración de la proyección de imagen de resonancia magnética (MRI) o una tomografía emisión de positrones (PET) también puede utilizarse para complementar los datos de CT.
A continuación, se describe un esquema paso a paso de cómo los pacientes se navegaron a través de su curso de tratamiento de radiación, seguido por los ejemplos de ciertos tipos de tumores tratados con la terapia de protones.
Protocolo
El protocolo de planificación y entrega de terapia de radiación exacta variará según el sitio de la enfermedad y puede incluso requerir individualización para cada paciente. Además, el procedimiento también puede requerir modificaciones para acomodar las preferencias institucionales y la disponibilidad de equipos. Con el propósito de esta discusión, describiremos los pasos utilizados para la planificación en un caso típico de cáncer de próstata es el cáncer más común tratado con terapia de protones en los Estados Unidos centros18protones. Este protocolo describe procedimientos clínicos estándar de atención y por lo tanto no requiere aprobación institucional Comité de ética de la investigación en humanos.
1. tomografía de simulación de radioterapia
- Inserte el tablero de la mesa ampliada de la mesa de tratamiento y asegurarse de que está bloqueado.
- Coloque un colchón inflado inmovilización sobre la mesa y barra de indexación para el molde de la pierna a la altura de la rodilla.
- Coloque un soporte sólido de cabeza en la parte superior de la tabla. Empezar con la cabeza de tamaño F, que acomoda la mayoría de los pacientes.
- Confirmar que el paciente ha completado el proceso completo de la vejiga por beber 16-24 onzas de líquido 45 min antes de la hora del análisis programado. Este paso debe completarse antes de paso 1.12.
- Registro del paciente en el sistema de registro de paciente de CT.
- Seleccione protocolo de exploración de próstata con el grosor de corte de 3 mm.
- Confirmar que el consentimiento de tratamiento, consentimiento de contraste y simulación orden han completado por el médico tratante.
- Pida al paciente que cambie en un vestido y quite toda la ropa de la cintura hacia abajo.
- Verificación verbal de la paciente, nombre, fecha de nacimiento y sitio del procedimiento para confirmar la identificación del paciente.
- Tomar una foto de la cara del paciente.
- Pida al paciente a sentarse en la mesa y luego ayudar al paciente en posición supina, la cabeza primero.
- Coloque las piernas del paciente en el cojín inflado inmovilización y posición de los brazos del paciente en el pecho por entrelazar sus dedos, dándoles un anillo azul, o la aplicación de las correas alrededor de sus brazos.
- Confirme la alineación del paciente con el sistema láser.
- Conecte la bomba de vacío dual a la boquilla de la almohadilla de inmovilización.
- Coloque las piernas en el colchón de inmovilización para que el molde se envuelve el lado de las piernas y también crea una barrera entre las piernas. Asegúrese de que el cojín de inmovilización está por debajo de la pelvis y se extiende más allá de los pies.
- Inserte e infle el balón del endorectal ab si clínicamente indicado por el médico tratante.
- Realizar antero-posterior (AP) y lateral (LAT) scout kilovoltage imágenes de rayos x (topograms) para confirmar que la alineación del paciente está optimizada. Esto incluye la verificación de la rectitud en la imagen de AP y la alineación rotacional en la imagen lateral. Utilice ambas imágenes para asegurar que el gas intestinal es mínimo. Posicionamiento debe todos ser corregido y confirmado con volver a la proyección de imagen. Si el gas intestinal está presente y excesiva, disculpa al paciente al baño y reiniciar el proceso desde el paso 1.15.
- Una vez que el paciente está en la posición deseada, quite el aire del amortiguador de inmovilización con la bomba de vacío dual fix Q para formar un molde sólido alrededor de las piernas y los pies.
- Ajustar manualmente la tabla de tratamiento para que el punto de mira de láser está a la altura de las caderas del paciente y en la línea media de las caderas y el abdomen a nivel de la articulación de la cadera. Especifique las ubicaciones de punto de mira sobre el paciente utilizando una pluma de marca. Coloque los marcadores de la localización en el punto de mira para designar un punto de partida para la simulación de verificación durante la administración de radiación.
- Parámetros para incluir la región pélvica de la columna vertebral de L3 a fémur medio de exploración del CT de conjunto.
- La exploración del paciente mediante el protocolo de análisis de próstata.
- Confirmar que la exploración es aceptable para la planificación del tratamiento. La vejiga debe estar llena, y el recto debe tener mínimo aire o heces.
- Exportar el archivo digital con el software de planificación de tratamiento y notificar a la dosimetría.
- El cojín de la inmovilización del paciente con el paciente ID, tratamiento médico nombre y configuración de la etiqueta las instrucciones antes de almacenar para su posterior utilización durante la terapia.
- Continúe en el paso 2.1 si el paciente es sometido a terapia de protones de haz de lápiz. Vaya al paso 3.1 si el paciente recibirá terapia de protones de dispersión pasiva.
2. radioterapia planeamiento usando terapia de haz de lápiz
- Importar los datos de simulación de CT en el tratamiento (TPS) de software de planificación.
- Utilizar el tratamiento del sistema de planificación de herramientas para definir los volúmenes geométricos pertinentes de contorno basado en imágenes de CT adquiridas. Estas estructuras incluyen la vejiga, recto, intestino grueso, intestino delgado, cabezas femorales, superficie externa del cuerpo, fiduciales, separador rectal o globo endorectal.
- Crear un contorno externo adicional, que incluye el cuerpo, la mesa de tratamiento y dispositivos de inmovilización. Sólo se calculará la dosis de radiación dentro de este contorno.
- El primer volumen blanco clínico (CTV1) que incluye próstata, vesículas seminales y los ganglios linfáticos involucrados del contorno. Se prescriben el CTV1 45.0 Gy (RBE). El volumen de CTV1 tendrá el aspecto de una estructura en forma de U en imágenes axiales. Los tejidos normales del intestino, el recto y la vejiga pequeña residirá dentro del volumen de destino en forma de U.
- El segundo volumen blanco clínico (CTV2) para incluir la próstata y las vesículas seminales del contorno. El CTV2 se prescriben una dosis total de 34,2 Gy (RBE).
- Seleccione tres vigas en los ángulos de gantry de 90, 180 y 270 grados para el tratamiento del volumen CTV1. Seleccione sólo los 90 y 270 grados Haz ángulos CTV2 tratamiento.
- Diseño de dos estructuras geométricas de bloqueo (volúmenes de evitación).
- Crear un volumen de evitación "media cuadra" que abarca los tejidos normales dentro del volumen CTV1 en forma de U.
- Bloque el aspecto inferior de la viga posterior-anterior (180 grados) por debajo del nivel de la parte superior de la próstata usando un "bloque de recto".
- Crear una extensión de 7 mm isotrópica de la CTV1 para formar un protón planificación volumen de destino, denominado pPTV1. Utilice el pPTV1 para definir un volumen de colocación punto tal que el protón Bragg picos (también conocido como "manchas" de protones) se colocan por el optimizador de planificación para cubrir la CTV1.
- Como en el paso 2.6, crear una extensión similar del volumen CTV2 a forma pPTV2, pero uso de expansión de 8 mm en la dirección de izquierda a derecha y expansiones de 5 mm en ambas direcciones antero-posterior y superior-inferior.
- Para habilitar la optimización robusta, una característica que puede explicar configuración incertidumbres, incertidumbres de gama y el relleno de gas variable del intestino, crear dos artificiales conjuntos de datos de CT ("cambiados"): la primera tiene todo intestino delgado, intestino grueso, y recto sobrescribe a la densidad del aire y la segunda tiene esos volúmenes sobrescritos a la densidad del músculo.
- Antes de la optimización, crear un nuevo plan de tratamiento para el CTV1. Designar a la máquina del tratamiento del protón se utiliza para la planificación, asignar la dosis prescrita y fraccionamiento de (RBE) de 45 Gy en 25 fracciones y definir el objetivo principal que el CTV1. Asignar el 100% de la dosis prescrita para cubrir al menos el 98% del volumen CTV1 utilizando 3 vigas todos (lateral derecha, lateral y posterior-anterior a la izquierda).
- Crear otro plan de tratamiento para el CTV2 con 2 sistemas de viga. En primer lugar, asignar 18 Gy (RBE) para ser entregados en 10 fracciones a la CTV2 usando sólo la barra lateral izquierda y asignar 16.2 Gy (RBE) para ser entregados en 9 fracciones a la CTV2 usando sólo la barra lateral derecha. Asignar el 100% de la dosis prescrita para cubrir el 100% del volumen CTV2.
- Preparar para la optimización del plan CTV1
- Asignar la estructura de bloque medio como margen de rango para las vigas laterales y asignar la estructura de bloque recto como un margen de gama de la viga posterior anterior.
- Comenzar la optimización con configuración automática (por defecto) para el espaciamiento de la capa de energía, el espaciado de punto y margen blanco.
- Especificar un número máximo de iteraciones de 40, un número máximo de las optimizaciones antes de "filtrado de punto" de 10 y un peso mínimo punto de 1,5 unidades de monitor. Punto filtrante elimina manchas de protones con menos de 1,5 unidades de monitor, ya que hay un límite mínimo técnico en el número de protones que puede ser entregado por la máquina de tratamiento.
- En la primera ronda de optimización para el CTV1, designar el blanco como el pPTV1 establecer la cuadrícula de posiciones spot de protones. Los objetivos especificados son 45.5 Gy (RBE) (peso = 100) a la pPTV1 y una disminución de la dosis de 45 a 0 Gy (RBE) a una distancia de 1 cm (peso = 2).
- Comenzar una segunda ronda de optimización para CTV1, eliminando los objetivos de la pPTV1 anteriores. A continuación, continúe optimización con los nuevos objetivos y objetivos pesos. Especificar estos parámetros como se indica a continuación para elaborar un plan modulada de intensidad, también conocido como optimización de múltiples campo (MFO).
- Para el volumen exterior, establece una reducción de dosis de 45 a 0 Gy (RBE) a una distancia de 1 cm y con un peso de 2.
- Para el volumen CTV1, establecer una mínima dosis de 45 Gy (RBE) con un peso de 100.
- Para el volumen CTV1, establecer una dosis uniforme de 45.5 Gy (RBE) y un peso de 100. Establecer ese objetivo como robusto.
- Para el volumen pPTV1, ajuste de la dosis máxima en 46 Gy (RBE) con un peso de 100 y este objetivo como robusto.
- Para el volumen recto, establece una dosis máxima de 45,8 Gy (RBE) con un peso de 50. Establecer ese objetivo como robusto.
- El volumen de la vejiga, establecer una dosis máxima de 45,8 Gy (RBE) con un peso de 50. Establecer ese objetivo como robusto.
- Para el intestino delgado, se establece una dosis máxima de 45,8 Gy (RBE) con un peso de 50. Establecer ese objetivo como robusto.
- Para el intestino, establece una dosis máxima de 45,8 Gy (RBE) con un peso de 50. Establecer ese objetivo como robusto.
- Además de los objetivos específicos, asignar valores de robustez para mitigar cambios posicionales de 5 mm, incertidumbre de la gama de 3,5% e incorporar los datos de CT ("cambiados") artificiales mencionados a la variabilidad de gas dirección del intestino. Aplicar esta configuración de robustez sólo a los objetivos mencionados como "robusta".
- Completar la optimización del plan CTV1 y el resultante plan optimizado para garantizar que la prescripción se han logrado los objetivos.
- Preparar para la optimización del plan CTV2
- Completa la primera optimización del plan CTV2 utilizando el pPTV2 para lograr una cuadrícula de punto de colocación del plan CTV1.
- Eliminar los objetivos pPTV2 y reanudar la optimización con nuevos objetivos (los porcentajes son con respecto a la prescripción para el CTV2). Para el plan CTV2, optimizar individualmente estos objetivos para la viga de la izquierda y derecha. Esto se conoce como optimización de campo solo (SFO) y los objetivos para cada viga son las siguientes.
- Para el volumen exterior, establece una reducción de dosis de 34.2 Gy (RBE) a 0 Gy (RBE) dentro de una distancia de 5 mm y un peso de 2.
- Para el volumen CTV2, establecer una dosis mínima de 34,37 Gy (RBE) con un peso de 120.
- Para el volumen CTV2, establecer una dosis uniforme de 34.54 Gy (RBE) con un peso de 100. Establecer ese objetivo como robusto.
- Para el volumen pPTV2, establece una dosis máxima de 34.88 Gy (RBE) con un peso de 100. Establecer ese objetivo como robusto.
- Utilizar la misma configuración de robustez para la optimización.
- Completar la optimización por separado para las vigas laterales derecho e izquierdas crear 2 plan Haz juegos. Esto permitirá la entrega de la radiación a CTV2 mediante las vigas de laterales derecho o izquierdas. Esto está en contraste con la entrega de dosis CTV1, que requiere todo 3 vigas (RL, LL y PA) para cada tratamiento.
- Revisar los planes de tratamiento CTV1 y CTV2 independientemente y en adición para asegurar que cumplen con las restricciones de dosis para la irradiación del cáncer de próstata por el ensayo RTOG 012619.
- Para el volumen de la vejiga, asegúrese de que el porcentaje de tejido recibe 80 Gy es inferior al 15%, el porcentaje de recepción de 75 Gy es inferior al 25%, el porcentaje de recepción de 70 Gy es de menos de 35% y el porcentaje reciben 65 Gy es menos del 50%.
- Para el volumen rectal, asegúrese de que el porcentaje de tejido recibe 75 Gy es inferior al 15%, el porcentaje recibe 70 Gy es de menos de 25%, el porcentaje de recepción de 65 Gy es inferior al 35% y el porcentaje de recepción de 60 Gy es inferior al 50%.
- Para el volumen del bulbo del pene, asegúrese de que la dosis media es menos 52,5 Gy.
- Para los volúmenes de destino CTV1 y CTV2, asegurar que al menos el 95% de ambos volúmenes reciban la dosis prescrita.
- Si los planes y las distribuciones de dosis cumple con las pautas de restricción de dosis aceptadas y robustez, obtener la aprobación del médico y los planes de exportación para el sistema de tratamiento.
- Medida para confirmar la exactitud de la dosis planeada usando arreglos de compartimiento de ionización, un tipo de detector de la radiación.
- Verifique la precisión del cálculo de dosis usando un software de cálculo de dosis secundaria, independiente.
- Revisar los resultados de medición resultados de cálculo y características técnicas del plan por un físico médico para control de calidad.
- Generar los documentos de planificación de tratamiento y aprobar la planificación dosimetrista, físico y médico.
- Exportar todo tratamiento planificación de datos en el sistema de entrega de tratamiento para el tratamiento del paciente y vaya directamente al paso 4.1 para la entrega de terapia de protones.
3. la planificación de tratamiento para dispersión pasiva o uniforme de la terapia de protones de exploración:
- Importar datos de simulación de CT en el sistema de planificación de radioterapia.
- Contorno de los volúmenes geométricos pertinentes basados en imágenes de CT adquiridas. Estas estructuras incluyen la vejiga, recto, intestino grueso, intestino delgado, cabezas femorales, superficie externa del cuerpo, fiduciales, separador rectal o globo endorectal.
- Crear un contorno externo adicional. Utilice la herramienta de operación booleana para incluir el cuerpo, la mesa de tratamiento y dispositivos de inmovilización. Sólo se calculará la dosis de radiación dentro de este contorno.
- CTV1 contorno que incluye próstata, vesículas seminales y los ganglios linfáticos involucrados. Se prescriben el CTV1 45.0 Gy (RBE).
- CTV2 contorno a la próstata y las vesículas seminales. El CTV2 se prescriben una dosis total de 34,2 Gy (RBE).
- Ampliar CTV1 7 mm a crear pPTV1 y pPTV2, ampliando posteriormente CTV2 por 7 milímetros en todas las direcciones excepto 5 mm.
- Crear vigas en el sistema para llegar a pPTV1 y pPTV2 de planificación de tratamiento. estará dirigido a pPTV1 con un rayo de solo 180° PA mientras pPTV2 estará dirigido con vigas laterales de 90° y 270°.
- Agregar bloques para cada viga con un margen uniforme de 0.5 cm a los volúmenes de pPTV1 y pPTV2.
- Utilizando el bloque tamaño Seleccione el más pequeño posible de tamaño de abertura viga en función del tamaño de cada volumen de pPTV. La abertura de la viga es el recorte personalizado de latón que se unirá al hocico de pórtico a la forma de los bordes laterales de cada haz de protones.
- Modelo compensador de cera apropiada necesaria para forma los márgenes distales y proximal de cada haz de protones mediante la selección de los parámetros del rayo apropiado como sigue.
- De entrada un valor de incertidumbre de rango de 3,5% más un adicional de 1-2 mm.
- Entrada de la distancia de separación apropiada entre el diafragma y el paciente.
- Liso y manchan la forma compensador a la gradiente de dosis deseada.
- Establecer los isocenters para pPTV1 y pPTV2 en la misma ubicación con el objetivo de reducir al mínimo cambios paciente necesarios para la entrega de haz de protones.
- Calcular la dosis utilizando los parámetros consignados en pasos 3.10.1-3.10.4 para el pPTV1 y el pPTV2 planes de destino.
- Revisar los planes de tratamiento pPTV1 y pPTV2 de forma independiente y en adición para asegurar que cumplen con las restricciones de dosis para cáncer de próstata irradiación establecida por el ensayo RTOG 012619 y se describe en pasos 2.17.1-2.17.4.
- Si no se logran metas de remo y blanco para cobertura de dosis, ajuste compensador y el bloque de parámetros en el TPS como se muestra en pasos 3.8-3.10 hasta que se logran los objetivos. Una vez que se alcanzan los objetivos, obtener la aprobación del médico y proceder a paso 3.14.
- Verificar la exactitud del cálculo de dosis en el plan aprobado utilizando un paquete de software de cálculo de dosis secundaria, independiente.
- Revisar los resultados de medición resultados de cálculo y características técnicas del plan por un físico médico para control de calidad.
- Ordenar los bloques y los compensadores del proveedor correspondiente.
- QA los bloques y los compensadores de recibieron del vendedor.
- Generar documentos de planificación de tratamiento y aprobación mediante firmas digitales planificación dosimetrista, físico y médico.
- Exportar todo el tratamiento planificación de datos en el sistema de entrega de tratamiento para el tratamiento del paciente y proceder a paso 4.1.
4. radiación tratamiento entrega
- En el primer día de tratamiento, asegurarse de que el plan de radiación coincide con los parámetros del plan en el sistema de tratamiento.
- Organizar la sala de tratamiento para reproducir la configuración paciente utilizada durante la simulación de CT. Asegurarse que la etiqueta del colchón de inmovilización con el paciente ID y luego lugar en la mesa de tratamiento con indexación correcta. Coloque el cabezal utilizado en la simulación a la cabeza de la tabla.
- Confirmar con el paciente que han completado el proceso de vejiga llena y cambiado en un vestido de tratamiento.
- Acompañar al paciente en la sala de tratamiento y colocarlo en posición supina en la mesa de tratamiento con las manos cruzadas en el pecho y las piernas en el colchón de inmovilización.
- Insertar e inflar globo endorectal si se utiliza durante la simulación.
- Electrónicamente, mover la tabla de tratamiento de la posición de la carga hacia el isocentro para alinear al paciente para las marcas que se colocan durante la simulación. Ajustar la tabla para corregir los errores graves en paciente posicionamiento como pitch, rotación y desvío.
- Una vez que el paciente esté correctamente alineado a las marcas de la simulación, realizar los cambios de la posición de inicio a los determinados durante el proceso de planificación el tratamiento dosimétrico para alinear al paciente en el isocentro del tratamiento deseado.
- Realizar KV ortogonal proyección de imagen para asegurar la alineación apropiada de paciente interna para huesos de la pelvis y marcadores de referencia colocados previamente por Urología dentro de la próstata.
- Determinar si se requieren ajustes postural basado en la superposición de las imágenes adquiridas de KV en las radiografías digitalmente reconstruidas de la planificación TAC de simulación. Aplicar los cambios necesarios para asegurar la alineación.
- Si KV imágenes demuestran gas intestinal excesivo, pida al paciente que expulse el aire mientras se está acostado en la mesa de tratamiento si es posible, realinear y volver a la imagen.
- Si el paciente es incapaz de liberar en la mesa de tratamiento, el tratamiento de la interrupción y que el paciente vaya al baño. Después de que el paciente regresa del baño, reiniciar el proceso de entrega de protones de paso 4.3.
- Una vez aceptables imágenes KV son adquiridos y confirmados, un haz de cono exploración de CT (CBCT) completa para evaluar vejiga rectal de relleno. Aplicar los ajustes de posicionamiento paciente adicionales basados en el análisis de la TC Cone Beam. Como con correcciones de posicionamiento basado en la proyección de imagen de KV, cambios de datos de la TC Cone Beam se enviará directamente desde la consola de imagen a la mesa de tratamiento para aplicación automatizada.
- Verificar todas las correciones posicionales con el médico antes de iniciar el tratamiento el primer día de terapia de protones.
- Iniciar la entrega de tratamiento con verificación audible entre dos terapeutas de ángulo de gantry, monitor unidades, número de zonas escaneo y capas y la posición de Morro para cada ángulo de tratamiento. Estos parámetros se muestran en la consola de tratamiento y en los documentos de planificación firmados por el médico tratante, dosimetría y física.
- Después del tratamiento, marque el isocentro del tratamiento para la alineación diaria y quitar las marcas.
- Repita los pasos 4.2-4.9 para todas aquellas fracciones de tratamiento subsecuente.
Resultados
Los datos disponibles indican un beneficio sustancial con la terapia de protones para ciertos cánceres20,21. PT puede ser favorecido para seleccionarlos tumores pediátricos, cánceres recurrentes en regiones previamente irradiados u otros tipos de cáncer donde el riesgo de lesión del tejido normal es alto con tratamiento del fotón. A continuación, discutimos la aplicación y el beneficio de la terapia de protones para la próstata, mama y meduloblastoma. Nuestro objetivo es ofrecer a los lectores una mejor comprensión de la aplicación de la terapia de protones para los tumores comunes en los hombres, mujeres y niños.
En los Estados Unidos, el cáncer de próstata es el más comúnmente diagnosticado neoplasia en hombres y la segunda causa más común de muerte relacionada con cáncer entre los hombres. Un 164.690 estimado de nuevos casos se diagnosticarán en el 2018, y más de 29.000 hombres morirán de la enfermedad. Pacientes de cáncer de próstata no metastásico son elegibles para las opciones de tratamiento, incluyendo la vigilancia activa, prostatectomía radical, braquiterapia y radioterapia externa con fotones o protones22. Se toman las decisiones de tratamiento exacto dependiendo de la anatomía del paciente, comorbilidades, estadio tumoral, preferencia del juicio y paciente médico.
La administración de radiación para cáncer de próstata de estadio temprano se limita a la glándula prostática. En el caso de cáncer de próstata de riesgo intermedio, las vesículas seminales proximal se dirigen así. Aunque se están estudiando terapias próstata parciales, glándula toda terapia sigue siendo el estándar de atención. Obturador, pre sacros internos ilíacos y externos ilíacos nodos son a menudo para pacientes con enfermedad intermedio y alto riesgo desfavorable.
Antes del tratamiento de radiación se pueden colocar marcadores fiduciales, planificación para permitir el tratamiento guiado por imágenes usando proyección de imagen de pre-tratamiento kilovoltage (es decir., rayos x estándar)23. Además, también puede insertarse un espaciador de hidrogel antes de simulación CT para crear un espacio entre el recto y la próstata a los tejidos rectales24,25más dosis límite. Durante la planificación del tratamiento, pacientes deben simular la posición de decúbito supina con la pelvis inmovilizada mediante un dispositivo de cojín personalizado. En simulación de CT para limitar el movimiento de próstata y la incertidumbre en cuanto a volumen y densidad rectal26se puede colocar un globo rectal. Una vejiga llena cómodamente se recomienda limitar la dosis en el intestino delgado y la porción anterior de la vejiga27. Simulación de MRI también se recomienda para permitir más preciso objetivo volumen delineación26.
Tratamientos deben ser diseñados para ofrecer dosis de 75.6-79,2 que GY a la próstata, con dosis de 45-50.4 Gy recomendado para cobertura electiva de nodal o vesícula seminal regiones corren el riesgo de enfermedad microscópica de difusión9. Todas aquellas fracciones se entregan una vez al día en 1.8 a 2 Gy por fracción. Para los pacientes intermedios y alto riesgo reciben un boost de braquiterapia, la dosis de radiación de haz externo debe limitarse a aproximadamente 45 Gy. Deben usarse dosis de braquiterapia de Gy 110 con implantes permanentes de la tasa de dosis baja I-125. Con la braquiterapia de dosis alta tasa través de catéteres, regímenes de refuerzo comúnmente usadas incluyen 13 a 15 Gy x 1 fracción, fracciones de Gy x 2 de 8 a 11.5, 5.5 a 6.5 Gy x 3 fracciones y de fracciones de Gy x 4 de 4.0 a 6.09.
Dosimetría de planificación del tratamiento se ha optimizado para limitar la dosis a la vejiga, el recto y el intestino. Dosimétricos comparaciones entre fotón-versus protón - basan terapia (es decir., IMRT versus técnicas IMPT) han demostrado ahorrar mejor de dosis a los tejidos normales con el de este último enfoque28.
Mortalidad específica del cáncer de próstata está debajo del 2% en 10 años para los hombres con principios de enfermedad de etapa22 independientemente del tratamiento seleccionado. Con RT intensificado de dosis, pacientes de alto riesgo también muestran una mortalidad específica de cáncer de próstata bajo del 5% en 9 años29. La mortalidad sigue siendo baja en gran parte debido a la disponibilidad de terapias sistémicas que siendo eficaces en el entorno metastásico. Resultados con el tratamiento IMRT y protones siguen siendo excelente30,31. El estudio de PARTIQoL (NCT01617161) es un estudio permanente, con asignación al azar entre la terapia de haz de protones (PBT) y IMRT para cáncer de próstata de riesgo bajo e intermedio que esperemos que va a determinar si una modalidad es superior sobre el otro.
Cáncer de mama es el más comúnmente diagnosticado tumor maligno en las mujeres y la segunda causa más común de muerte relacionada con el cáncer entre las mujeres de Estados Unidos. Un estimado de 268.670 nuevos casos se diagnosticarán en el 2018, y 41.400 mujeres morirán de la enfermedad1. A diferencia de en el cáncer de próstata en la mayoría de los pacientes recibe radiación como monoterapia, pacientes con cáncer de mama reciben radiación después de la operación para reducir el riesgo de recurrencia de cáncer11. Dependiendo de la magnitud de la cirugía necesaria, la radiación puede orientarse a la mama restante después de tumorectomía de tumor o a la pared torácica después de mastectomía11,32. Los ganglios linfáticos regionales en la axila, supraclavicular y las áreas mamarias internas puede orientarse si se considera en el riesgo del tumor.
Esquemas de tratamiento para pacientes de mama por lo general implican tratamiento una vez al día, cinco días por semana. Pacientes en estadio temprano se tratan generalmente con convencionalmente fraccionada (1.8-2.0 Gy/fracción; 50 Gy total) o regímenes hipofraccionada (2.67 Gy/fracción; 40,05-42.56 Gy total) a la mama11,33. Pacientes con enfermedad más avanzada, pero localizada se tratan con fraccionamiento convencional a 50 Gy (Gy/fracción de 1.8-2.0) a la pared entera de la mama o el pecho y los ganglios linfáticos regionales. Estas dosis son eficaces para la enfermedad subclínica que puede presentarse después de la cirugía.
Simulación de CT para radioterapia de cáncer de mama normalmente se completa en la posición supina. En contraste con el cáncer de próstata, ambos brazos están abducidos arriba para permitir la exposición de los tejidos de pared o mama del pecho. Además, un dispositivo acunando modificado para requisitos particulares y Consejo de mama a menudo se utilizan para inmovilizar el tórax en una posición elevada para que el manubrio sea paralelo a la mesa de tratamiento. Esto asegura que el tejido mamario caiga superiormente a la zona del cuello.
Exposición a la radiación del corazón durante el cáncer de mama se asocia con un mayor riesgo de enfermedad isquémica futuro34. Como resultado, técnicas para reducir al mínimo la dosis de corazón son de suma importancia. Un método consiste en emplear apnea inspiratoria profunda (DIBH) para aumentar el espacio intratorácico y la distancia entre el corazón y la pared anterior del pecho, mama. Como lo indica el método, pacientes tratados con DIBH suspender su ciclo respiratorio y recibir tratamiento en el punto máximo de inspiración. Sin embargo, no todos los pacientes son capaces de tolerar tiene respiración de duración suficiente para permitir esta técnica. En algunos pacientes, una posición prona puede ser ventajosa y puede permitir que el tejido mamario a la caída de los tejidos normales críticos, incluyendo el corazón35. Un inconveniente de este enfoque es la limitación que impone a la capacidad de regiones de destino lymphatics. La terapia de protones puede alcanzar dosis cardiaca importante ahorrar sin la necesidad de DIBH y técnicas propensas a36,37.
La terapia de protones se emplea para pacientes con cáncer de mama y ha demostrado ser superior a las técnicas basadas en fotones con respecto a efectos escasamente dosis de estructuras críticas tales como los pulmones y el corazón38. Un haz de lápiz solo campo exploración plan (PBS) con una palanca de cambios de la gama puede utilizarse para administrar radiación de protones a la pared torácica y ganglios regionales. También pueden emplearse métodos de dispersión pasiva. Si varios campos son necesarios para tratar la pared de pecho entero y ganglios regionales debido a las limitaciones de campo, campo que técnicas debe ser empleado. Una estrategia es emplear supraclavicular que empareja y campos de la pared de pecho con un gap de piel de 2-4 mm por debajo de la cabeza clavicular39. Las fronteras del campo se mueven sobre una distancia de 1 cm en diferentes momentos durante el curso de radiación para reducir al mínimo los puntos fríos y calientes.
Resultados clínicos con radiación del cáncer de mama muestran una supervivencia global del 50% para el de enfermedad de etapa temprana11 y 37% para los pacientes localmente avanzados en el seguimiento de 20 años32. Dado el período largo de remisión, minimización del tratamiento relacionados con la toxicidad es de gran preocupación. Aunque se espera que la terapia de protones para reducir potencialmente los riesgos de toxicidad cardiaca, esta cuestión se examina en la RADCOMP consorcio ensayo en curso (NCT02603341), que se asignaron al azar a mujeres con cáncer de mama a la radioterapia de fotones o protón.
El cáncer sigue siendo la segunda causa más común de muerte en niños de 1-14 en los Estados Unidos y sólo es superado por los accidentes. En 2018, 10.590 niños serán diagnosticados con cáncer y 1.180 morirá de su malignidad1. Entre este grupo, se diagnosticarán 250-500 pacientes con meduloblastoma. La edad mediana al diagnóstico de meduloblastoma es 4-6 años. Dado el alto riesgo de implicación del líquido cerebroespinal y difusión (30-40%), la irradiación craneoespinal (CSI) es estándar del cuidado en estos pacientes, con aproximadamente 80% de supervivencia con el tratamiento apropiado.
Pacientes de meduloblastoma son estratificados en grupos de riesgo estándar y de alto riesgo basados en su edad, presencia de anaplasia o metástasis y la cantidad de tumor residual después de la resección quirúrgica. En cualquier caso, el tratamiento incluye radiación postoperatoria. RT para Meduloblastoma implica CSI inicial a una dosis de 36 23.4 Gy. Luego se administra dosis adicional a la cama del tumor para conseguir una dosis de 50,4 55,8 Gy al tumor primario sitio40. Consideraciones de planificación de tratamiento incluyen la limitación de las dosis máxima a la médula oblonga y la médula espinal a 54 Gy y 45 Gy, respectivamente. CSI puede ser entregada utilizando la terapia de fotón o protón. Simulación de CT y el tratamiento a menudo requieren anestesia para asegurar que los pacientes no se muevan durante el tratamiento41.
Debido a las grandes áreas con radiación, basada en fotones resultado de técnicas de RT en exposición de irradiación considerable para las estructuras torácicas y abdominales anterior a la médula espinal, incluyendo los pulmones, corazón, intestino riñones y mamas. Estas regiones pueden salvarse de exceso radiación con protones terapia (figura 3)42. PT en base CSI requiere dos campos laterales ligeramente oblicuos para irradiar el cerebro y la espina dorsal cervical superior, así como una o más vigas posterior anterior dirigidas a las regiones más bajas de la espina dorsal cervical, torácica, lumbar y sacra. Múltiples campos son obligatorios ya que el objetivo de CTV para CSI incluye el espacio entero del líquido cerebroespinal (CSF) que se extiende desde el vértice del cerebro hacia el canal espinal a través del equina del tallo a nivel de la Unión vertebral S2/S3 (figura 3). La longitud de la columna vertebral determina el número total de espinales campos requeridos para el tratamiento. La frontera superior del campo espinal superior se corresponde al límite inferior de los campos craneales. Si el campo de la columna vertebral no puede cubrir la columna entera, un segundo campo de columna se ajustan a la frontera inferior del campo espinal superior. Este proceso puede ser repetido si un tercer campo se requiere para los pacientes más altos. Para los pacientes menores de 15, el borde anterior de los campos de la espina dorsal se extiende para incluir a los cuerpos vertebrales todos para asegurar una dosis homogénea al hueso para evitar anomalías de crecimiento futuro en el esqueleto en desarrollo. Para ésos sobre la edad de 15 años, la frontera del campo anterior de la espina dorsal se extiende 2-3 mm más allá del canal espinal en la columna vertebral.
Técnicas de PBS y dispersión pasiva se han utilizado para CSI42,43. Objetivos específicos de la terapia CSI incluyen dosis homogénea en el líquido cerebroespinal (CFS) para el extremo inferior del saco tecal (S2 o S3), dosis completa a la anterior del cráneo base y agujereada placa, minimización de dosis a las estructuras de la ópticas, limitación de la tiroides a no más del 5% de la dosis de prescripción y la minimización de dosis para el esófago43.
Dispersión pasiva planificación del tratamiento por lo general comienza con la creación de campos craneales. Compensadores de gama con edición manual se requieren a menudo para crear una distribución homogénea de la dosis en el cerebro al mismo tiempo limitar la dosis a los ojos y la cóclea. Para los campos espinales, compensadores se espesan a nivel de la tiroides para minimizar la dosis. Entonces se presta especial atención a las ensambladuras de campo entre los campos craneales y espinales y entre varios campos espinales cuando sea necesario. La zona de cruce se define como la longitud de 1.25-1.5 centímetros donde adjunto los campos. El cruce se desplaza en la dirección craneal o caudal semanalmente para prevenir el desarrollo de las zonas de caliente o frío de la dosis. Idealmente, variación de dosis se mantiene entre 95-108% de la dosis de prescripción. Ponderación de campo, abertura ediciones y ediciones compensador se emplean para alcanzar esta meta43.
Investigadores del M.D. Anderson Cancer Center han desarrollado una estrategia paso a paso para CSI planificación42. Este enfoque implica el desarrollo de un plan de fuerza para el tratamiento de los campos de columna vertebral craneal e inferior seguidos por la creación de un plan de la OFS de la espina dorsal torácica. Se utilizan gradientes de dosis en las áreas de cruce. El plan SFO se copiará en el plan inicial de MFO para desarrollar un plan final, compuesto de MFO. Uniones de la espina dorsal se cambia de puesto una vez 2 cm sobre un curso de 4 semanas de tratamiento. En comparación con la dispersión pasiva CSI, PBS basado en CSI ofrece reducciones sustanciales de dosis de radiación a las lentes, cóclea y glándulas parótidas pero a costa de tiroides aumento dosis42.
Pacientes de meduloblastoma pueden esperar tasas de supervivencia libre de evento de 60-80% dependiendo de los estratos de riesgo44. Dada la gran superficie de tejido irradiado con CSI y la naturaleza sensible de los pacientes pediátricos, riesgos de efectos secundarios a largo plazo son considerables e incluyen deterioro neurocognitivo, malignidades secundarias, disfunción pituitaria, pérdida de la audición, enfermedades del corazón , infertilidad, hipotiroidismo, vasculopathy, ojos secos, la formación de cataratas, pérdida de la visión y necrosis de la radiación/mielitis. Por lo tanto, CSI basado en protón puede ofrecer un beneficio substancial para muchos pacientes.
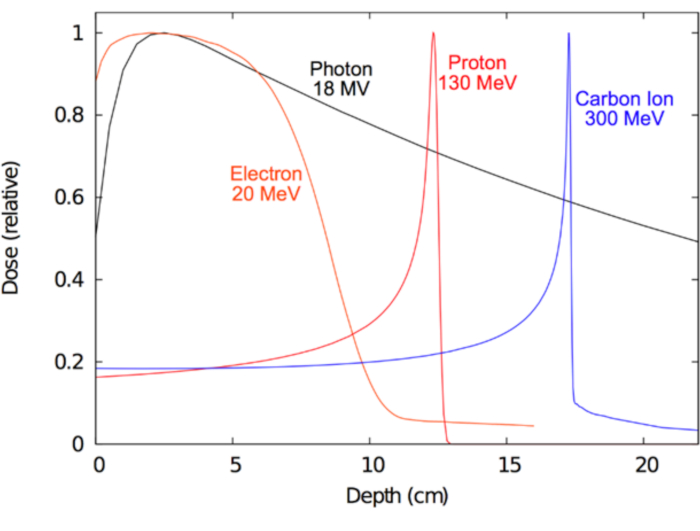
Figura 1: curvas de dosis de profundidad para la radioterapia. Distribuciones de dosis en función de la profundidad en agua por varios haces de radiación clínica. Haga clic aquí para ver una versión más grande de esta figura.
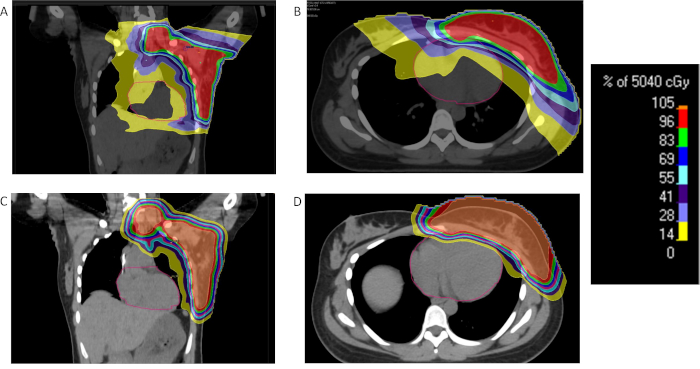
Figura 2: comparación de la radiación de mama protones y fotones. % Dosis de distribución para un paciente con cáncer de mama localmente avanzado recibiendo radioterapia con IMRT (A, B) o protones (C, D) y demostrar la reducción de la dosis de radiación importante al corazón y pulmones con protones. Haga clic aquí para ver una versión más grande de esta figura.
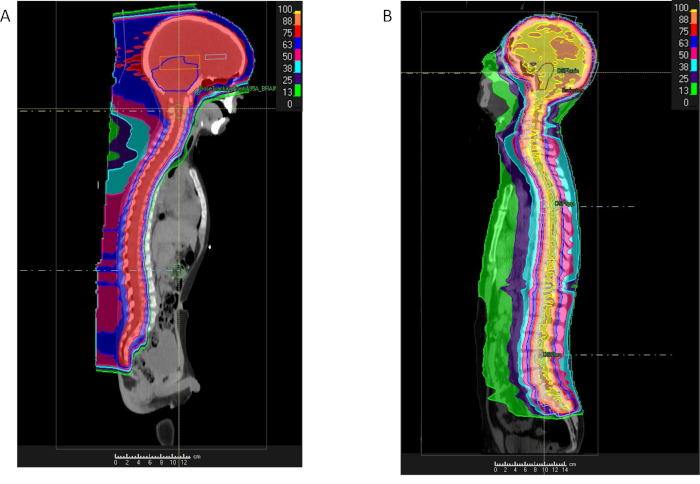
Figura 3: comparación de protones y fotones de la radiación del craniospinal. % Dosis de distribución para un paciente con meduloblastoma recibir irradiación craneoespinal con radiación substancial demostrando o IMRT (B) y protones (A) reducción a regiones intra torácicas y abdominales de la dosis con los protones. Haga clic aquí para ver una versión más grande de esta figura.
| Photon | Protón | |
| Tipo de partícula | Bosón | Fermión compuesto |
| Carga [C] | 0 | +1.602 x 10-19 |
| Masa [kg] | 0 | 1.672 x 10-27 |
| De la vuelta | 1 | 1/2 |
| Energy† [MeV] | 0.1 - 25 | 10 - 250 |
| Fuentes comunes | Tubo de acelerador lineal, Co-60 de radioisótopos, rayos x | Ciclotrón o sincrotrón acelerador |
| Métodos de entrega | Colimado sólidas vigas, colimadores Multileaf, modulación de intensidad, arcos | Dispersión pasiva, exploración magnética |
| † Gama de la energía típicamente utilizado para el tratamiento de cánceres humanos | ||
Tabla 1: Comparación de la radiación de protones y fotones.
Discusión
Planificación del tratamiento de radiación y entrega para el cáncer es un proceso altamente modificado para requisitos particulares personalizado a cada paciente y su cáncer en particular. Radioterapia moderna está guiada por una imagen basada en la intervención CT imágenes obtenidas durante una radiación medida planificación simulación. Proyección de imagen de CT es obligatorio ya que contiene información anatómica de 3 dimensiones (3D) sobre el paciente, así como precisa cuantificación de las densidades de tejidos en diferentes lugares dentro del cuerpo que se requieren para el cálculo de la dosis. Durante la proyección de imagen de CT, el paciente es colocado en una mesa motorizada. Normalmente se emplean varios dispositivos de inmovilización mecánicos para restringir el movimiento del paciente durante la proyección de imagen y posterior entrega de RT. Dependiendo de la precisión requerida, estos gama de los dispositivos de tipo simple del molde cojines y mallas de plástico, que se ajustan a la superficie del paciente y luego se endurecen para restringir el movimiento, más dispositivos invasivos tales como dispositivos de cráneo rígido están perforados en su lugar. A menudo, la precisión requerida del dispositivo de inmovilización se basa en la proximidad del tejido del tumor a estructuras críticas cercanas. Por ejemplo, el dispositivo de inmovilización más invasivo, un halo central perforado en lugar, se utiliza a veces cuando se necesita precisión milimétrica solo para tratar un tumor cerca de los ojos o los nervios ópticos para reducir al mínimo la posibilidad de ceguera que se puede presentar por el paciente en movimiento en una posición incorrecta durante el tratamiento.
Información de la proyección de imagen de CT también se utiliza para optimizar la anatomía interna de tejido normal. Por ejemplo, distensión de la vejiga se utiliza a menudo para reducir al mínimo la vejiga e intestino exposición de dosis de la irradiación de la próstata como se señala en el protocolo anterior. Del mismo modo, si el estómago se dilata en particular con los alimentos durante la simulación para la irradiación abdominal superior (por ejemplo, gástrico, hígado, esófago distal), entonces el paciente es re-simulado después de permitir que el alimento pase por el estómago y tracto intestinal . Esto reducir el estómago y reducir la posibilidad de exposición a la radiación durante la radioterapia de tumores abdominales superiores. En los casos donde el estómago o la vejiga están blancos de la radiación, pueden ser intencionalmente, distendidas o vaciados para optimizar la distribución de dosis.
En algunos casos, un tumor no es adecuada o fiable visualizado en la TC, pero puede identificarse con mayor precisión mediante una resonancia magnética o una exploración PET. En tales casos, las exploraciones PET o MRI se utilizan para complementar los datos de la TC ya que este último sigue siendo necesario para el cálculo de la dosis. Esto se consigue registrando las imágenes de resonancia magnética y PET a las imágenes de CT para la planificación de la terapia. Las exploraciones de MRI a menudo proporcionan mucho mayor contraste visual y mayor resolución que la TC, que puede ser beneficioso para identificar límites finos, tejidos blandos de un tumor como el cerebro o el hígado. PET proporciona una vista funcional de la distribución de moléculas etiquetado radiactivo como trazador inyectado en el paciente.
Algunos tumores se presentan en zonas del tórax o del abdomen donde puede moverse significativamente con la respiración. Para explicar esta propuesta garantizar la exactitud de la radiación, un CT 4-dimensional, un tipo de proyección de imagen de CT "modo película", puede usarse para capturar la anatomía paciente 3D como cambia con el tiempo durante la respiración. Para algunos objetivos torácicas y abdominales, correas de compresión u otros medios de reducción de movimiento pueden utilizarse durante la terapia para restringir el movimiento y limitar la incertidumbre con respecto a la localización de tumor45.
Una vez que el paciente es simulado para el tratamiento, se desarrolla un plan de tratamiento personalizado con la consideración de la histología de cáncer, localización del tumor y características anatómicas, que influyen en la configuración óptima de haces de radiación, tipos de partícula, energías, y los niveles de dosis para cada paciente. Para cada paciente, una serie de preguntas básicas se considera inicialmente por el equipo clínico para desarrollar un plan de tratamiento óptimo. Como punto de partida, se debe seleccionar la forma más apropiada de radiación. Las opciones incluyen fotones, electrones o protones. Esto es normalmente seguido por la selección de angle(s) de la viga para la administración de radiación. Mayoría de las máquinas RT incluye a un paciente robótico de posicionamiento mesa un pórtico giratorio que haces RT para dirigirse al paciente por prácticamente cualquier ángulo. La decisión implica encontrar el camino que más eficazmente el objetivo con el RT y mejor evita no objetivos que pueden estar en el camino de las vigas seleccionadas. En algunos casos, ángulos de haz se determinan por el sistema de planificación sí mismo después de introducir objetivos de radiación para tumores y tejidos normales. Este proceso se denomina "planificación inversa" y se realiza en el caso de IMRT, que consiste en modular la intensidad de múltiples, haces de radiación entrante de una manera dependiente del tiempo que proporciona una dosis uniforme blanco, pero puede conducir a dosis altamente no uniforme fuera de la meta. Aunque la terapia del fotón o protón puede ser intensidad modulada, inversa la planificación se utiliza en gran parte en fotón base IMRT solamente. Si haces de radiación sólidos van a utilizarse, colimadores de metal personalizados pueden ser fabricados para que coincida con la forma del haz de radiación con la forma del tumor.
Si se selecciona la terapia de protones, una decisión posterior debe hacerse con respecto a la utilización de técnicas de PBS o dispersión pasiva. En el caso de PBS, una decisión adicional se requiere el uso de fuerza o campo único campo optimización/único dosis uniforme (SFO/SFUD) estrategias. En los tratamientos de la MFO, vigas múltiples se requieren para tratar un tumor durante cada fracción puesto que cada haz sólo apunta a una parte de la meta. En cambio, para los planes de SFO, cada viga cubre el objetivo entero. MFO es a menudo favorecida para los tumores cerca de una estructura crítica (por ej., tumor cerebral cerca del nervio óptico) donde una variedad de ángulos de haz puede ser ventajosa para esculpir la dosis de radiación. Estrategias MFO también aseguran de que toda los radiación vigas/puntos "termina gama" en la misma zona donde la dosis podrían ser inesperadamente alta debido al efecto del pico de Bragg. Por otro lado, SFO es favorecido para objetivos cerca de las áreas de incertidumbre anatómica, como la próstata que se puede mover debido a la vejiga diferencial y llenado rectal. OFS ofrece mayor robustez frente a cambios de dosis debido a las variaciones anatómicas.
Una vez que se decide la estrategia de planificación básica, la siguiente fase de planificación del tratamiento implica típicamente la optimización matemática de los campos de radiación. La energía, intensidad y distribución espacial (espacial variable flujo) de la radiación entrante son parámetros normalmente libres en optimización. Junto con la representación de la gran matriz 3D de la anatomía del paciente por el CT, estas variables libres conducen a un problema muy grande tamaño y correspondiente optimización grandes matrices (por ejemplo, miles de valores de CT y miles de viga posibles intensidades debe ser considerada). Estas matrices se enmarcan en una función objetivo, que es una formulación matemática de la "meta de la planificación del tratamiento". Como se mencionó anteriormente, objetivos del tratamiento son priorizados para lograr primero la dosis prescrita en el destino, y en segundo lugar alcanzar tan bajos de una dosis como es posible a los tejidos normales. Para minimizar esta función objetivo, alta potencia de cálculo desea realizar rápidamente cálculos de transporte de RT que pueblan las matrices, y se utilizan métodos de optimización numérica, tales como algoritmos de búsqueda de gradiente, para rápidamente buscar mínimos locales en la función. Estos mínimos corresponden a los planes de tratamiento óptimo para cada paciente único. No puede subestimarse el papel de las computadoras en la planificación del tratamiento. Modernos de radioterapia y radiología de diagnóstico no sería posibles sin los avances de la informática de las últimas tres décadas.
Como una etapa final, el plan de tratamiento optimizado es revisado por el equipo médico (médico, dosimetrista y físico). En muchos casos, el plan puede ser adaptado más o volver a optimizado con diferentes objetivos para mejorar la calidad en general. Una vez que el plan resulta para ser óptimo, los parámetros técnicos del plan son revisados por un físico y transferidos a la máquina de entrega de tratamiento.
En muchos casos, el paciente vuelve para las fracciones múltiples de tratamiento (sesiones), a menudo cada día de la semana durante varias semanas. Fraccionamiento de varios día puede intensificar los efectos secundarios inducidos por radiación agudos pero puede reducir el potencial tardíos, más graves los efectos secundarios de RT en comparación con el tratamiento solo fracción12. Fracción de múltiples enfoques son óptimos para los tumores que se están dividiendo rápidamente o incapaces de reparar daños subletales de RT Sin embargo, esto depende del sitio exacto del tratamiento y la sensibilidad de los tejidos normales cercanos. Puesto que el objetivo de la administración de tratamiento de radiación es administrar el mismo tratamiento durante cada fracción, incluso unos milímetros de movimiento o de incertidumbre en la posición del paciente pueden conducir a la degradación del plan de tratamiento de terapia de partículas. Por esta razón, la dirección de la imagen a bordo los sistemas son de suma importancia durante multifracción toner RT. radiografía, cone beam CT exploraciones o toner de la superficie ópticos, escaneo láser están disponibles para este propósito. Estos dispositivos permiten la radioterapia guiada por imágenes (IGRT) a través de la proyección de imagen de puntos anatómicos, tumor objetivos o sustituto radio-opaco marcadores fiduciales. Las imágenes IGRT en comparación con los análisis de simulación original y ajustar como sea necesario antes de cada fracción de la radiación.
A pesar de la ventaja de la gama finita de la terapia de protones, que limita la dosis de salida, la precisión de la predicción de la gama normalmente visto en la planificación del tratamiento es del orden de unos pocos milímetros. La pérdida de energía exacta en diferentes tejidos del paciente es incierta, en primer lugar, ya que los componentes moleculares exactos del tejido son ambiguos y, en segundo lugar, puesto que la anatomía del paciente cambia con el tiempo, tanto en cortos plazos (por ejemplo, la respiración) y escalas de tiempo más largo (p. ej., pérdida de peso, reducción del tumor, cambios de la anatomía normal). Para hacer frente a esta incertidumbre, un "margen distal" es añadido al volumen de destino que es un margen adicional de tejido normal más allá de la profundidad máxima del tumor. Tal margen garantiza que aún con la incertidumbre en la predicción de la gama, se tratará la profundidad de todo tumor con alta confianza. Lamentablemente, el margen de tejido normal como resultado de ello puede estar expuesto a la dosis completa de RT, que potencialmente puede conducir a efectos secundarios de RT significativos en ese tejido. En cambio, como fotones no dejar salir algo blanco, no hay tal margen distal es necesario para compensar la incertidumbre de la gama. Un margen geométrico todavía se utiliza en la terapia del fotón incertidumbre posicional dirección del destino, pero fotones son mucho menos sensibles que los protones a la situación precisa de los tejidos del paciente antes del blanco. Por lo tanto, el margen necesario a veces puede ser menor para fotones protones. Esto puede entenderse Considerando que protones experimentan pérdida continua de energía en los tejidos que afectan grandemente la posición de su serie, mientras que los fotones son descargados y viajan libremente en el espacio vacío entre los átomos y sus orbitas, salvo raras colisiones con electrones o núcleos. Diferencias de gran densidad en el tejido, por ejemplo., objetos metálicos o cavidades de aire, sin embargo, todavía influyen en la dosis de fotones, así como dosis de protones, pero a una menor magnitud.
Una incertidumbre final e importante se refiere a la eficacia radiobiológica (RBE) de diferentes formas de radiación. La RBE es la proporción de dosis, de un tipo de radiación de referencia y un tipo de radiación de prueba, bajo la condición de que ambos tipos de radiación producen el mismo efecto biológico. Cuanto mayor sea la RBE, el más perjudicial de la radiación por unidad de deposición de energía en el tejido. La relación de la RBE se define en referencia a la radiación del fotón. A pesar de esta sencilla descripción, hay realmente mucha incertidumbre con respecto a los valores de RBE para las partículas cargadas en lugar de fotones. Diferencias en las distribuciones de dosis espacial entre fotones y partículas cargadas en la escala del micrómetro y del nanómetro conducen a diferencias en el efecto biológico, incluso cuando las dosis macroscópicas son idénticas. Esto puede ser comprendido examinando la distribución espacial del daño de la DNA después de la exposición a las partículas cargadas en diferentes dosis y diferentes energías cinéticas. Diferentes energías cinéticas y diferentes cargas de los protones (+ 1) e iones de carbono (+ 6) conducen a las diferencias en la transferencia de energía a diferentes profundidades en el paciente, mientras que para fotones, la transferencia de energía es comparable más bajo y también más homogéneas a lo largo de el paciente. Mientras que teóricamente se entiende, hay debate importante en la comunidad de Oncología de radiación con respecto a la capacidad de predecir exactamente tales efectos biológicos. Para la terapia de iones de carbono, hay una falta de consenso sobre la mejor manera de modelar estos efectos biológicos, aunque existe un acuerdo que tales efectos deben ser modelados para proporcionar terapia. Para los protones, más clínicos centros actualmente plan de terapia sin modelado explícito de los efectos del RBE, excepto usando un factor de corrección constante de 1.1, pero esto es probable que cambie en un futuro cercano como nuevos sistemas de planificación de tratamiento comerciales están comenzando a incluyen biológico modelado herramientas de software para modelar la RBE de la terapia de protones.
Con la realización de estudios clínicos aleatorizados, incluyendo RADCOMP, PARTIQoL y RTOG 1308, deberíamos tener respuestas más concretas en cuanto a que las formas de radiación pueden ser superiores para mama, de próstata y cáncer de pulmón, respectivamente. Se planean estudios similares para otros sitios de enfermedad que pueden ayudar a identificar mejor la mejor modalidad de tratamiento para este tipo de tumor. Sin embargo, ya hay suficientes datos para sugerir la superioridad de los protones en ciertos ajustes, particularmente en la población pediátrica, donde escasamente importante tejido normal puede reducir morbilidad de toxicidad, incluyendo secundaria tumores malignos.
Divulgaciones
A.H. tiene honorarios de Astrazeneca, Bayer y Novartis. A.H. ha consultado con Astrazeneca, Bristol-Myers Squibb y Bayer y fue un orador para la Fundación de Francia.
Agradecimientos
S.R. acepta donaciones de fondos del programa de reembolso de préstamo de NIH. A.H. ha recibido financiación del Bayer, Clovis, constelación, Agensys, Sotio, cerúleo y Calithera.
Materiales
| Name | Company | Catalog Number | Comments |
| Proton beam cyclotron and gantry delivery system | Varian | N/A | Allows for generation and delivery of protons for radiotherapy |
| kVUE One Proton Couch Top | Qfix | RT-4551KV-03 | Permits patient placement for radiotherapy |
| CT simulator with 4D scanning capability | GE | N/A | Permits CT simulation for radiation planning |
| 100" x 70" Qfix VacQfix Cushion | Qfix | RT-4517-10070F30 | Immobilizes patient for more precise radiation delivery |
| Timo Foam Head Support | Qfix | RT-4490-F | Ensures minimization of head motion during radiotherapy |
| 3 CT Localizers Localization Markers | Beekley Medical | REF 211 | Ensures concordance of external markers and internal patient anatomy from CT simulation |
| VacQfix Indexer | Qfix | RT-4517-IND01 | Ensures VacQfix cushion placement is reproducible for every radiatiion treatment |
| Radiation treatment planning software | Raystation | N/A | Allows for personalized radiation planning for every tumor with robust optimization and multi-criteria optimization |
| Proton Range Compensator | .Decimal | RC-AC 1018 | Adjusts the range of the proton beam to achieve distal dose conformality |
| Proton Beam Aperture | .Decimal | AP-BR 1800 | Shapes the proton beam treatment area |
| Proton Range Shifter | .Decimal | RS-AC 1018 | Adjusts proton beam tissue depth penetration |
| Endorectal Balloon | Radiadyne | ILG-90F | Ensures uniform rectal filling and prostate positioning |
Referencias
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Barton, M. B., et al. Estimating the demand for radiotherapy from the evidence: a review of changes from 2003 to 2012. Radiotherapy and Oncology. 112 (1), 140-144 (2014).
- Pan, H. Y., et al. Supply and Demand for Radiation Oncology in the United States: Updated Projections for 2015 to 2025. International Journal of Radiation Oncology Biology and Physics. 96 (3), 493-500 (2016).
- Reed, A. B. The history of radiation use in medicine. Journal of Vascular Surgery. 53 (1 Suppl), (2011).
- T Landsberg, P. . Nobel Lectures in Physics, 1901-1921. 18, (1967).
- . Non-small cell lung cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (2018)
- . Pancreatic Adenocarcinoma Available from: https://www.nccn.org/professionals/physician_gls/pdf/pancreatic.pdf (2017)
- . Breast cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (2017)
- . Prostate Cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (2017)
- Chang, J. Y., et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncology. 16 (6), 630-637 (2015).
- Fisher, B., et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. The New England Journal of Medicine. 347 (16), 1233-1241 (2002).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. , (2012).
- Lomax, A. J. Charged particle therapy: the physics of interaction. The Cancer Journal. 15 (4), 285-291 (2009).
- Rossi, B., Greisen, K. Cosmic-Ray Theory. Reviews of Modern Physics. 13 (4), 240-309 (1941).
- Blakely, E. A., Chang, P. Y. Biology of charged particles. The Cancer Journal. 15 (4), 271-284 (2009).
- Schardt, D., Elsässer, T., Schulz-Ertner, D. Heavy-ion tumor therapy: Physical and radiobiological benefits. Reviews of Modern Physics. 82 (1), 383-425 (2010).
- Chun, S. G., et al. The Potential of Heavy-Ion Therapy to Improve Outcomes for Locally Advanced Non-Small Cell Lung Cancer. Frontiers in Oncology. 7 (201), 1-3 (2017).
- Pan, H. Y., Jiang, J., Shih, Y. T., Smith, B. D. Adoption of Radiation Technology Among Privately Insured Nonelderly Patients With Cancer in the United States, 2008 to 2014: A Claims-Based Analysis. Journal of the American College of Radiology. 14 (8), (2017).
- Michalski, J. M., et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncology. , (2018).
- Glimelius, B., et al. Number of patients potentially eligible for proton therapy. Acta Oncologica. 44 (8), 836-849 (2005).
- Doyen, J., Falk, A. T., Floquet, V., Herault, J., Hannoun-Levi, J. M. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treatment Reviews. , 104-112 (2016).
- Hamdy, F. C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine. 375 (15), 1415-1424 (2016).
- Ng, M., et al. Fiducial markers and spacers in prostate radiotherapy: current applications. British Journal of Urology International. 113, 13-20 (2014).
- Hedrick, S. G., et al. A comparison between hydrogel spacer and endorectal balloon: An analysis of intrafraction prostate motion during proton therapy. Journal of Applied Clinical Medical Physics. 18 (2), 106-112 (2017).
- Hamstra, D. A., et al. Continued Benefit to Rectal Separation for Prostate Radiation Therapy: Final Results of a Phase III Trial. International Journal of Radiation Oncology Biology Physics. 97 (5), 976-985 (2017).
- Wortel, R. C., et al. Local Protocol Variations for Image Guided Radiation Therapy in the Multicenter Dutch Hypofractionation (HYPRO) Trial: Impact of Rectal Balloon and MRI Delineation on Anorectal Dose and Gastrointestinal Toxicity Levels. International Journal of Radiation Oncology Biology Physics. 99 (5), 1243-1252 (2017).
- Chen, Z., Yang, Z., Wang, J., Hu, W. Dosimetric impact of different bladder and rectum filling during prostate cancer radiotherapy. Radiation Oncology. 11, 103 (2016).
- Rana, S., et al. Dosimetric and radiobiological impact of intensity modulated proton therapy and RapidArc planning for high-risk prostate cancer with seminal vesicles. Journal of Medical Radiation Sciences. 64 (1), 18-24 (2017).
- Rodda, S., et al. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer. International Journal of Radiation Oncology Biology Physics. 98 (2), 286-295 (2017).
- Zietman, A. L., et al. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09. Journal of Clinical Oncology. 28 (7), 1106-1111 (2010).
- Al-Mamgani, A., Heemsbergen, W. D., Peeters, S. T., Lebesque, J. V. Role of intensity-modulated radiotherapy in reducing toxicity in dose escalation for localized prostate cancer. International Journal of Radiation Oncology Biology Physics. 73 (3), 685-691 (2009).
- Ragaz, J., et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. Journal of the National Cancer Institute. 97 (2), 116-126 (2005).
- Whelan, T. J., et al. Long-term results of hypofractionated radiation therapy for breast cancer. New England Journal of Medicine. 362 (6), 513-520 (2010).
- Darby, S. C., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. New England Journal of Medicine. 368 (11), 987-998 (2013).
- Wroe, A. J., Bush, D. A., Schulte, R. W., Slater, J. D. Clinical immobilization techniques for proton therapy. Technology in Cancer Research and Treatment. 14 (1), 71-79 (2015).
- Shah, C., et al. Cardiac dose sparing and avoidance techniques in breast cancer radiotherapy. Radiotherapy and Oncology. 112 (1), 9-16 (2014).
- Patel, S. A., et al. Postmastectomy radiation therapy technique and cardiopulmonary sparing: A dosimetric comparative analysis between photons and protons with free breathing versus deep inspiration breath hold. Practical Radiation Oncology. 7 (6), e377-e384 (2017).
- Depauw, N., et al. A novel approach to postmastectomy radiation therapy using scanned proton beams. International Journal of Radiation Oncology Biology Physics. 91 (2), 427-434 (2015).
- MacDonald, S. M., et al. Proton therapy for breast cancer after mastectomy: early outcomes of a prospective clinical trial. International Journal of Radiation Oncology Biology Physics. 86 (3), 484-490 (2013).
- Merchant, T. E., et al. Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. International Journal of Radiation Oncology Biology Physics. 70 (3), 782-787 (2008).
- McMullen, K. P., Hanson, T., Bratton, J., Johnstone, P. A. Parameters of anesthesia/sedation in children receiving radiotherapy. Radiation Oncology. 10, 65 (2015).
- Stoker, J. B., et al. Intensity modulated proton therapy for craniospinal irradiation: organ-at-risk exposure and a low-gradient junctioning technique. International Journal of Radiation Oncology Biology Physics. 90 (3), 637-644 (2014).
- Giebeler, A., et al. Standardized treatment planning methodology for passively scattered proton craniospinal irradiation. Radiation Oncology. 8, 32 (2013).
- Gajjar, A., et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncology. 7 (10), 813-820 (2006).
- Lin, L., et al. Evaluation of motion mitigation using abdominal compression in the clinical implementation of pencil beam scanning proton therapy of liver tumors. Medical Physics. 44 (2), 703-712 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados