Method Article
Протонная терапия доставки и его клинического применения в выберите твердых опухолей злокачественные новообразования
В этой статье
Резюме
Представлены основы радиационной планирования и доставки для протонной терапии, используя в качестве модели рака простаты. Применение этих принципов на другие сайты, выбранные болезни подчеркивает, как Протон лучевой терапии могут улучшить клинические исходы для больных раком.
Аннотация
Лучевая терапия является механизм часто используется для лечения солидных раковых заболеваний. Хотя механизмы убить клетки похожи для всех видов излучения, в естественных условиях свойства фотонов и протонных пучков отличаются и, возможно, сильно эксплуатируемых оптимизировать клинические исходы. В частности частицы протона терять энергию на предсказуемой основе, как они проходят через тело. Это свойство используется клинически для контроля глубины, на которой наведение протонного луча прекращается и предел дозы излучения за пределами целевого региона. Эта стратегия может позволить для значительного сокращения дозы излучения для нормальных тканей, расположен сразу за опухоль целевой. Однако деградация Протон энергии в организме остается крайне чувствителен к плотности ткани. Как следствие любые изменения в плотности ткани в ходе лечения могут существенно изменить Протон дозиметрии. Такие изменения могут происходить через изменения веса тела, дыхания или кишечника наполнения/газ и может привести к неблагоприятным дозы осаждения. В этой рукописи мы предоставляем подробный метод для доставки протонной терапии с использованием пассивной разброс и карандаш луч сканирование техники для рака простаты. Хотя описанная процедура непосредственно относится к пациентам рака простаты, метод может адаптировать и применяется для лечения практически всех твердых опухолей. Наша цель – вооружить читателей лучшего понимания протонной терапии доставки и результаты для того чтобы содействовать надлежащей интеграции этого механизма во время терапии рака.
Введение
Предполагается, что 1,7 миллиона человек в Соединенных Штатах будут диагностированы с раком в 2018 году, с более чем 600,000, поддаваясь болезни1. Текущие параметры лечения включают mono или multi modality терапии, хирургии, лучевой терапии (RT) и системной терапии. Что касается RT одной четверти вновь диагностированных пациентов получит его, как часть их начального рака терапии и почти половина в конечном итоге потребует его во время их болезни курс2,3.
Появления RT восходит к 1895, когда Вильгельм Конрад Рентген открыл рентгеновское во время работы с электронно-лучевой трубки – в его лаборатории в университете Вюрцбурга в Германии4. Не долго после этого пациентов с широким кругом заболеваний, таких как волчанка и рак получали лечения с помощью лучей радия. Ранние осложнения были быстро понял и даже обсуждались Пьер Кюри в своей Нобелевской лекции5. Так как излучение влияет на нормальных и опухолевых тканей, тщательно контролируемых доз излучения должны использоваться максимально терапевтическое отношение, определяется как вероятность возникновения опухоли управления против вероятность возникновения неприемлемых токсичности. С постепенным достижениями в технологии, а также лучшего понимания радиобиологии и физики это терапевтический соотношение значительно улучшилась с течением времени. Использование RT значительно повысила результаты для нескольких видов рака, как отражение ее включение в национальные руководящие принципы для рака терапии6,,78,9. В некоторых случаях RT может использоваться как единственного механизма для терапии10, тогда как в других заболеваний, она может использоваться как часть терапии мульти-модальности для контроля местных заболеваний или ликвидация микроскопических заболевания11. Хотя часто используется с лечебной целью, многие пациенты RT обработанной для паллиативной боли или другие симптомы, которые развиваются из опухоли индуцированной сжатие, вторжения или разрушения нормальных тканей в параметре Локо-региональных или широко распространенной, метастатические болезни.
Основные принципы RT прямолинейны. С применением излучения энергия хранится в клетки путем ионизации атомов. Эта энергия, хотя он может поднять температуру облученного региона, только несколько microkelvin, производит свободные радикалы, которые могут непосредственно подвергаются повреждения клеток посредством ДНК травмы12,13. Большая часть нашего понимания частиц высоких энергий излучения и его взаимодействие с веществом происходит от теоретических и экспериментальных исследований космических лучей и их взаимодействия в верхних слоях атмосферы, проведенные в начале 20 века14тыс . Заряженных частиц высоких энергий (МЭВ до ГэВ) взаимодействуют с веществом преимущественно через электромагнитные силы: как эти частицы проходят через вопрос или ткани, Неупругое столкновение с орбиты электронов приводят к ионизации и возбуждения целевых материи, и упругие столкновения с атомными ядрами приводят к точечной или отклонения траектории частиц. Кроме того ядерных столкновений и жесткие столкновения с электронами привести к Каскад вторичного излучения, который добавляет воздействию ионизирующего излучения частиц. Частиц высоких энергий, обход вопрос таким образом оставить позади wake ионизированных атомов, молекул и свободных электронов, которые химически активные и потенциально может вызвать биологические изменения или повреждения организмов, воздействию ионизирующего поля.
Как лучше всего научиться использовать эти ионизирующего поля таким образом, чтобы эффективно лечить болезни человека был основной долгосрочной целью лучевой терапии. Клинически идеальная форма излучения (например, фотон, протонов, электронов или тяжелых ионов) следует побудить достаточно ионизации в болезнь цель предоставлять терапевтические противоопухолевый эффект, в то же время причиной минимальной ионизации в окружающие нормальные ткани для сведения к минимуму пагубных последствий. Какой тип излучения выбирается для RT зависит отчасти от болезни лечат. Для опухолей, которые расположены глубже в теле и может также быть хирургически неоперабельных Мегавольт фотонов, протонов и тяжелых ионов считаются оптимальной15,16. Для поверхностных рака, таких как те, которые касаются кожи электрон терапия может быть оптимальным и даже предпочтительнее хирургии для Батарейная. С другой стороны преимущество Мегавольт фотонов заключается в их способности проникать глубоко в ткани, ограничивая повреждения кожи. В случае заряженных частиц, электронов, протонов или тяжелых ионов их главное преимущество заключается в их «остановить» характеристики; то есть заряженные частицы потеряют энергию непрерывно через неупругими столкновениями, описанных выше, и эта потеря энергии весьма предсказуемым на шкале миллиметр. Таким образом пучка заряженных частиц может быть доставлен больной с точным энергиями до желаемой глубины. Кроме того заряженные частицы производят практически нет выхода доза17. Контрастом не заряженные частицы как фотоны демонстрируют экспоненциальный спад (ослабление) с увеличением глубины, что часто приводит к значительный выход дозы, которые могут скомпрометировать здоровые ткани дистальной к целевому объекту. Эти концепции демонстрируются в Рисунок 1, который показывает радиационной дозы (ионизацией) свойства различных видов излучения используется клинически. Центральный мотивация для вместо протонов и ионов углерода фотонов глубже опухоли целей — это минимальная доза доза вход и вблизи нулевой дозы выхода за пределы тканях-мишенях. В таблице 1 приведены некоторые из клинически значимых характеристик фотонов и протонных пучков.
Достижения в области лучевой терапии, включая протонной терапии, имели место на двух основных направлениях: 1) здания эффективных ускорителях, способных производить высоких энергий излучения (МэВ) например синхротронного и циклотрон ускорителей и 2 Разработка сложных вычислительных методов, которые сочетают болезни визуализации данных и излучения транспорта расчеты позволяют моделировать компьютер «планирование лечения.» Для планирования лечения, пациенты обычно проходят томография компьютерная томография (КТ). КТ изображения содержат 3-мерной анатомические информацию о пациента, а также точного количественного определения плотности ткани. КТ изображения и карты плотности затем используются в компьютерных симуляций планирования облучения: энергии и интенсивность излучения поля математически оптимизированы для каждого пациента. Магнитно-резонансная томография (МРТ) или томография (ПЭТ) сканирование позитронно излучение может также использоваться для дополнения данных КТ.
Ниже мы опишем пошаговое изложение как больных переходите через их курс лечения излучения, следуют примеры некоторых типов опухолей, относились с протонной терапии.
протокол
Точный лучевой терапии планирования и доставки протокол будет варьироваться в зависимости от заболевания сайт и могут даже потребовать индивидуализации для каждого пациента. Кроме того процедура может также потребовать изменения для размещения институциональных предпочтения и доступность оборудования. Для целей этой дискуссии мы очертим шаги, используемые для планирования в случае типичный рака простаты, так как это наиболее распространенный тип рака лечение с протонной терапии в США центров18Протон. Этот протокол описывает стандарт обслуживания клинических процедур и поэтому не требуют институциональных одобрения Комитета по этике исследований человеческого.
1. Компьютерная томография моделирования для лучевой терапии
- Вставьте таблицу лечения расширенных столешницы и убедитесь, что он заблокирован.
- Место завышенные иммобилизации подушке над верхней таблице и индексации бар для ног плесень на уровне колена пациента.
- Поместите сплошной подголовник в верхней части таблицы. Начните с F размер головы, который вмещает большинство пациентов.
- Убедитесь, что пациент завершил процесс полного мочевого пузыря, выпив 16-24 унций жидкости 45 мин до того времени, проверки по расписанию. Этот шаг должен быть завершен до 1.12 шаг.
- Зарегистрируйте пациента в системе регистрации КТ пациента.
- Выберите простаты сканирования протокол с кусочек толщиной 3 мм.
- Убедитесь, что порядка завершены лечащим врачом лечения согласия, контраст согласия и моделирования.
- Попросите пациента, чтобы изменения в платье и удалить всю одежду от талии вниз.
- Подтвердите пациента идентификации, устно проверки, имя, Дата рождения пациента и процедура сайта.
- Возьмите фотографию лица пациента.
- Попросите пациента, чтобы сидеть на стол и затем помочь пациента в положении лежа, головой.
- Поместите ноги пациента в подушке завышенные иммобилизации и положение пациента в руки на груди путем переплетения их пальцами, давая им синее кольцо или ремни вокруг их оружия.
- Подтвердите пациент согласования с лазерной системой.
- Подключите двойного вакуумного насоса в сопло иммобилизации подушки.
- Поместите ноги в иммобилизации подушку так, что плесень будет окружить стороне ноги и также создать барьер между ног. Убедитесь, что иммобилизация подушки ниже таза и расширяет мимо ног.
- Вставка и надуть шар трансректальное АВ если клинически указал на лечащего врача.
- Выполняйте передний задний (AP) и боковой (LAT) разведчик kilovoltage рентгеновских снимков (topograms) для подтверждения, что пациент согласования оптимизирован. Это включает в себя проверку прямолинейности на изображении AP и вращения выравнивание боковая образе. Используйте оба изображения для обеспечения что кишечника газа является минимальным. Позиционирование должны все быть исправлены и подтвердил с повторно изображений. Если кишечника газа присутствующих и чрезмерное, извините пациента в туалете и перезапустить процесс с шага 1.15.
- После того, как пациент находится в нужном положении, удалите воздух из подушки иммобилизации, с помощью двойного вакуумного насоса Q-исправить сформировать твердые формы вокруг их ноги и ноги.
- Вручную настройте таблицу лечения так что перекрестье лазерных находятся на уровне больного бедра и на средней линии живота на уровне тазобедренного сустава и бедра. Укажите расположение перекрестие на пациента с помощью пера маркировки. Место локализации маркеры на перекрестье назначить отправной точкой для проверки моделирования во время доставки излучения.
- КТ набор параметров включить области таза от позвоночника L3 до середины бедра.
- Сканирование с использованием протокола простаты сканирования пациента.
- Убедитесь, что проверка является приемлемым для планирования лечения. Мочевой пузырь должен быть полным, и прямой кишки должны иметь минимальный воздуха или стула.
- Экспортируйте файл цифрового сканирования программного обеспечения планирования лечения и уведомлять дозиметрии.
- Ярлык пациента иммобилизации подушки с пациента ID, лечащий врач и именем установки инструкции до хранения для последующего использования во время терапии.
- Если пациент проходит карандаш протонной лучевой терапии, перейдите к шагу 2.1. Если пациент будет получать пассивный разброс протонной терапии, перейдите к шаг 3.1.
2. облучение планирования с помощью карандаша лучевой терапии
- Импорт данных моделирования CT в планирования программного обеспечения (TPS) лечения.
- Используйте лечение, контурной инструменты определить все соответствующие геометрические тома системы планирования на основе полученных изображений КТ. Эти структуры включают мочевого пузыря, прямой кишки, толстой кишки, тонкого кишечника, бедренной головки, космическое тело поверхности, реперам, ректальные прокладку или трансректальное шар.
- Создание дополнительного внешнего контура, который включает в себя тело, в таблице обращения и любых устройств иммобилизации. Доза радиации будет рассчитываться только внутри этого контура.
- Контур первого тома клинических целевого (CTV1), чтобы включить предстательной железы, семенных пузырьков и вовлеченных лимфатических узлов. CTV1 будет назначаться 45.0 Gy (РРБ). Объем CTV1 будет иметь вид U-образной структуры на осевых изображениях. Малые кишечника, прямой кишки и мочевого пузыря нормальных тканей будет находиться внутри U-образный целевого тома.
- Контур второго тома клинических целевого (CTV2), чтобы включить предстательной железы и семенных пузырьков. CTV2 будет назначаться общей дозы 34.2 Gy (РРБ).
- Выберите три луча на козловой углах 90, 180 и 270 градусов для лечения CTV1 тома. Выберите только 90 и 270 градусов луч углов для лечения CTV2.
- Дизайн две геометрические структуры блокировки (недопущение томов).
- Создание тома «середине блока» недопущение, охватывающей нормальных тканей внутри тома, U-образные CTV1.
- Блок уступает аспект пучка кзади передний (180 градусов) ниже уровня верхней части простаты с помощью «прямой кишки блока».
- Создайте изотропной расширение 7-мм CTV1 сформировать протона планирование целевой том, названный pPTV1. Используйте pPTV1 чтобы определить место размещения тома, который такие, которые Протон Брэгг пики (также упоминаемый как Протон «пятна») расположены оптимизатором планирования для покрытия CTV1.
- Как шаг 2.6 Создайте аналогичные расширения объема CTV2 в форме pPTV2, но использовать расширение 8-мм в направлении слева направо и 5-мм разложения в передней задней и Улучшенный уступает направлениях.
- Чтобы включить надежные оптимизации, функция, которая может учитывать для установки неопределенности, диапазон неопределенности и заполнение переменной газа кишечника, создайте два искусственных («переопределенные») CT наборов данных: первый имеет весь тонкой кишки, толстой кишки, и прямой кишки, перезаписаны плотность воздуха, а второй имеет эти тома, перезаписаны плотности мышц.
- До оптимизации создайте новый план лечения для CTV1. Обозначить Протон лечения машины, чтобы быть использованы для планирования, назначить предписанную дозу и фракционирование 45 гр (РРБ) в 25 фракций и определить основной мишенью для CTV1. Назначьте 100% предписанные дозы для покрытия по меньшей мере 98% от объема CTV1, с использованием всех 3 балки (правый сбоку, слева боковой и задней и передней).
- Создайте еще один план лечения для CTV2 с 2 пучка наборами. Во-первых назначить 18 гр (РРБ) будут поставлены в 10 фракций для CTV2 с использованием только левой боковой пучок и назначить 16.2 Gy (РРБ) будут поставлены в 9 фракций для CTV2 с использованием только правой боковой брус. Назначьте 100% предписанные дозы для покрытия 100% от объема CTV2.
- Подготовить для оптимизации плана CTV1
- Назначить структура среднего блока как диапазон разницы для боковых балок и назначить прямой кишки блочную структуру как диапазон разницы для заднего и переднего пучка.
- Запустите оптимизации с параметрами автоматического (по умолчанию) для интервалов слоя энергии, пятно интервал и целевого поля.
- Укажите максимальное количество итераций 40, максимальное количество оптимизаций перед «пятно фильтрация» из 10 и минимальный вес пятно 1,5 монитор единиц. Место фильтрация удаляет пятна Протон с менее чем 1,5 монитор единиц, как существует технический минимальный лимит на количество протонов, которые могут быть поставлены на машине лечения.
- В первом туре оптимизации для CTV1 назначить целевой pPTV1 установить сетку Протон спот-позиции. Указанной цели являются 45.5 Gy (РРБ) (вес = 100) pPTV1 и дозы рассеивания 45 до 0 гр (РРБ) на расстоянии 1 см (вес = 2).
- Начинается второй раунд процесса оптимизации для CTV1, удалив выше цели pPTV1. Затем возобновите оптимизации с новыми целями и объективных весов. Укажите эти параметры следующим разработать план модуляцией интенсивности, также известный как многопрофильный оптимизации (МСН).
- Для внешнего тома установите на расстоянии 1 см и весом 2 дозы рассеивания 45 до 0 гр (РРБ).
- Для тома CTV1 задайте минимальную дозу 45 гр (РРБ) с весом 100.
- Для тома CTV1 установите единый дозы 45.5 Gy (РРБ) и вес 100. Установите эту цель как надежные.
- Для тома pPTV1 установить максимальная доза в 46 Gy (РРБ) с весом 100 и установить эту цель как надежные.
- Для тома прямой кишки задайте максимальная доза 45.8 Gy (РРБ) с весом 50. Установите эту цель как надежные.
- Объем мочевого пузыря задайте максимальная доза 45.8 Gy (РРБ) с весом 50. Установите эту цель как надежные.
- Для тонкого кишечника задайте максимальную дозу 45.8 Gy (РРБ) с весом 50. Установите эту цель как надежные.
- Для толстой кишки задайте максимальную дозу 45.8 Gy (РРБ) с весом 50. Установите эту цель как надежные.
- Помимо конкретных целей назначьте параметры надежности для смягчения позиционные смены 5-мм, 3,5% диапазон неопределенности и включать искусственные («переопределенные») КТ данных, упомянутых выше адрес кишечника газа изменчивости. Эти параметры надежности применять только для этих целей, указанных выше как «надежный».
- Полная оптимизация для плана CTV1 и просмотрите полученный оптимизированного плана для обеспечения того, чтобы рецепт, что цели были достигнуты.
- Подготовить для оптимизации плана CTV2
- Завершите первый оптимизации для CTV2 плана, используя pPTV2 для достижения место размещения сетки, как план CTV1.
- Удалить pPTV2 цели и возобновить оптимизации с новыми целями (процентные показатели являются относительно рецепт для CTV2). Для CTV2 плана оптимизируйте эти цели для левого и правого пучка индивидуально. Это известно как одно поле оптимизации (SFO) и преследует следующие цели для каждого луча.
- Для внешнего тома равным 0 Gy (РРБ) в пределах на расстоянии 5 мм и весом 2 дозы рассеивания 34.2 гр (РРБ).
- Для тома CTV2 задайте минимальную дозу 34.37 Gy (РРБ) с весом 120.
- Для тома CTV2 установите единый дозы 34.54 Gy (РРБ) с весом 100. Установите эту цель как надежные.
- Для pPTV2, громкость, максимальная доза-34,88 Gy (РРБ) с весом 100. Установите эту цель как надежные.
- Используйте те же параметры надежности для оптимизации.
- Полная оптимизация отдельно для левой и правой боковых балок для создания 2 план луч наборов. Это позволит доставки излучения для CTV2 с помощью левой или правой боковой балки. Это отличается от CTV1 доза доставки, которая требует все 3 балки (RL, LL и ПА) использоваться для каждого лечения.
- Обзор планов лечения CTV1 и CTV2, самостоятельно и в суммирование, чтобы убедиться, что они соответствуют доз облучения рака простаты, установленных RTOG 0126 суда19.
- Объем мочевого пузыря убедитесь, что доля ткани получают 80 гр, под 15%, доля получающих 75 гр ниже 25%, доля получающих 70 гр составляет до 35%, и доля получающих 65 гр составляет менее 50%.
- Для ректального тома убедитесь, что процент ткани, получающих 75 гр ниже 15%, доля получающих 70 гр составляет менее 25%, доля получающих 65 гр составляет менее 35%, и процент получения 60 гр ниже 50%.
- Объем полового члена лампы убедитесь, что средняя доза до 52,5 Gy.
- Для CTV1 и CTV2 целевых томов обеспечить по меньшей мере 95% обоих томов предписанную дозу.
- Если планы и распределения дозы соответствуют принятой дозы ограничение руководящие принципы и надежность, получить одобрение врача и экспортировать планы в системе предоставления лечения.
- Мера для подтверждения точности запланированной дозы, используя массивы ионизационная камера, типа детектора излучения.
- Проверьте точность расчета дозы, используя программное обеспечение для расчета среднего, независимые дозы.
- Обзор результатов измерений, результаты расчетов и технические свойства плана с Медицинский физик для обеспечения контроля качества.
- Создание документов планирования лечения и утвердить их планирования дозиметрист, физик и контроль врача.
- Экспортировать все лечение планирования данных в системе доставки лечения для лечения пациентов и перейдите к шаг 4.1 для доставки протонной терапии.
3. излучение планирование лечения для пассивного точечной или Uniform, сканирование протонной терапии:
- Импорт данных моделирования CT в лучевой терапии, системы планирования.
- Контур все соответствующие геометрические тома, основанные на полученных изображений КТ. Эти структуры включают мочевого пузыря, прямой кишки, толстой кишки, тонкого кишечника, бедренной головки, космическое тело поверхности, реперам, ректальные прокладку или трансректальное шар.
- Создание дополнительного внешнего контура. Используйте средство логической операции включить тело, таблице обращения и любых устройств иммобилизации. Доза радиации будет рассчитываться только внутри этого контура.
- Контур CTV1 включить предстательной железы, семенных пузырьков и вовлеченных лимфатических узлов. CTV1 будет назначаться 45.0 Gy (РРБ).
- Контур CTV2 включить предстательной железы и семенных пузырьков. CTV2 будет назначаться общей дозы 34.2 Gy (РРБ).
- Разверните CTV1, 7 мм для создания pPTV1 и создания pPTV2 путем расширения CTV2, 7 мм во всех направлениях, за исключением 5 мм кзади.
- Создайте балки на планирования системы для pPTV1 и pPTV2 лечения. pPTV1 будут направлены с использованием единого 180° ПА луч пока pPTV2 будут направлены с использованием 90° и 270° поперечной балки.
- Добавьте блоки для каждого луча с однородное поле размером 0,5 см в pPTV1 и pPTV2 тома.
- Используя минимальный размер апертуры луч основанный на размер каждого тома pPTV выберите размер блока. Апертурой луча является латуни пользовательских вырез, который будет прикреплен к козловой морду форму боковых краев каждого наведение протонного луча.
- Модели соответствующие воск компенсатор обязаны формировать проксимальном и дистальном поля каждого пучка протонов, выбрав соответствующий луча параметры следующим образом.
- Входной диапазон неопределенности значение 3,5% плюс дополнительно 1-2 мм.
- Вход воздуха зазор расстояние между диафрагмы и пациента.
- Гладкие и смазать форму компенсатор для требуемой дозы градиента.
- Установка isocenters для pPTV1 и pPTV2 в том же месте с целью сведения к минимуму пациента изменений, необходимых для доставки пучка протонов.
- Расчет дозы, с использованием параметров, введенные в 3.10.1-3.10.4 шаги для pPTV1 и pPTV2 целевых планов.
- Обзор планов лечения pPTV1 и pPTV2, самостоятельно и в суммирование, чтобы убедиться, что они соответствуют доз облучения рака простаты установленных RTOG 0126 суда19 и описаны в 2.17.1-2.17.4 шаги.
- При желании что ВЕСЛА и целевой цели покрытие дозы не достигаются, затем настройте параметры блока и компенсатор в TPS, как показано в шагах 3.8-3.10, пока не будут достигнуты цели. После того, как будут достигнуты цели, получить одобрение врача и перейти к шагу 3.14.
- Проверьте точность расчета дозы в утвержденный план, используя пакет программного обеспечения расчета среднего, независимые дозы.
- Обзор результатов измерений, результаты расчетов и технические свойства плана с Медицинский физик для обеспечения контроля качества.
- Заказывайте блоков и компенсаторы от соответствующего поставщика.
- QA блоков и компенсаторы получил от поставщика.
- Создание документов планирования лечения и утвердить их через цифровые подписи, планирования дозиметрист, физик и контроль врача.
- Экспортировать все лечение планирования данных в системе доставки лечения для лечения пациентов и перейти к шагу 4.1.
4. излучения лечения Доставка
- В первый день лечения убедитесь, что план излучения соответствует параметрам плана в системе лечения.
- Организовать комнату лечения воспроизвести пациента установки, используемые во время КТ моделирования. Убедитесь, что метка подушки иммобилизации соответствует пациента ID и затем место на таблице лечения с правильной индексации. Место подголовник, используемых на моделирование во главе стола.
- Подтвердите с пациентом, что они завершили процесс полного мочевого пузыря и превратилась в платье лечения.
- Сопровождение пациента в комнату лечение и поместить его в лежачем положении на столе лечения с руками, сложенными на груди и ногах в иммобилизации подушку.
- Вставка и надуть шар трансректальное, если используется во время симуляции.
- Электронном виде переместить таблицу лечения от нагрузки позиции к изоцентр для выравнивания пациента на знаки, которые помещаются во время симуляции. Настройте таблицу исправить грубые ошибки в пациента, позиционирование как шаг, вращение и рыскания.
- После того, как пациент правильно выровнен на моделирование знаки, завершите переход от начальной позиции на тех, которые определены в ходе дозиметрического планирования процесса лечения для выравнивания пациента изоцентр желаемого лечения.
- Выполняйте ортогональных кв изображений для обеспечения надлежащего внутреннего пациента выравнивание костей таза и фидуциальный маркеры, ранее размещенные по урологии в пределах простаты.
- Определите если требуются позиционные корректировки, основанные на наложение кв изображений на цифровой реконструированный рентгенограммах от планирования КТ моделирования. Примените необходимые сдвиги для обеспечения выравнивания.
- Если кв изображения демонстрируют чрезмерное кишечника газа, просят пациента, чтобы изгнать воздух лежа на столе лечения, если это возможно, а затем перестроить и заново образ.
- Если пациент не в состоянии выпустить на таблице лечения, прервать лечение и пациента идти в туалет. После того, как пациент возвращается из туалета, перезапустите процесс доставки протона от шаг 4.3.
- После того, как приемлемые изображения кв приобретаются и подтвердил, луч конуса CT (CBCT) сканирования завершения для оценки пузыря/ректального наполнения. Применить дополнительные пациента позиционирования корректировки, основанные на CBCT сканирования. Как с кв на основе изображений позиционирования исправления, изменения, внесенные с помощью CBCT данных будет направляться непосредственно из консоли изображений в таблице лечения для автоматизированного приложения.
- Проверьте все позиционные исправления с лечащим врачом перед началом лечения в первый день протонной терапии.
- Начать лечение доставки с звуковой проверки между двумя терапевтами козловой угла, монитор единицы, количество сканирования пятен и слои и морда позиции для каждого угла лечения. Эти параметры отображаются на консоли лечения и в документах планирования, подписанный дозиметрии, физики и лечащего врача.
- После лечения Марк изоцентр лечения для ежедневных выравнивания и удалить знаки.
- Повторите шаги с 4.2-4.9 для всех последующих лечение фракций.
Результаты
Имеющиеся данные предполагает существенную выгоду с протонной терапии для определенных видов рака20,21. PT может отдавать предпочтение для выбора детской опухоли, рецидивирующий рак в ранее облученного регионах или другие виды рака, где высок риск повреждения нормальных тканей с Фотон лечения. Ниже мы обсуждаем, применения и выгоды протонной терапии для простаты, молочной железы и Медуллобластомы. Наша цель-обеспечить читателей с лучшего понимания применение протонной терапии опухолей встречается у мужчин, женщин и детей.
В Соединенных Штатах рак предстательной железы является наиболее часто диагноз злокачественные опухоли у мужчин и второй наиболее распространенной причиной связанных с раком смерти среди мужчин. Около 164,690 новых случаев будет поставлен в 2018 году, и свыше 29 000 мужчин умирают от этой болезни. Non метастатический рак предстательной железы пациенты имеют право на варианты лечения, включая активное наблюдение, радикальная простатэктомия, брахитерапия и внешний пучка излучения фотонов или протоны22. Точное лечение решения принимаются в зависимости от пациента анатомии, сопутствующих заболеваний, стадии опухоли, врач суждение и пациент предпочтения.
Доставки излучения для ранней стадии рака предстательной железы ограничивается предстательной железы. В случае промежуточного риска рака простаты также ориентированы проксимальной семенных пузырьков. Хотя частичная простаты терапии в настоящее время изучаются, всей железы терапии остается стандарт медицинской помощи. Обтюратор, предварительно сакрального, внутренней подвздошной кости и внешние подвздошные узлы часто включаются для пациентов с неблагоприятной среднего и повышенного риска заболевания.
До лучевого лечения планирования, фидуциальный маркеры могут быть размещены на разрешение изображения-лечение с помощью kilovoltage Предварительная обработка изображений (т.е., Стандартный рентген)23. Кроме того гидрогеля заполнитель может также включить до КТ моделирования для создания разрыв между прямой кишки и предстательной железы для дальнейшего предел дозы в ректальных тканей24,25. Во время планирования лечения пациенты должны моделируется в лежачем положении с таза, прикол с помощью заказной подушки устройства. Ректальные шар может находиться в CT моделирования ограничить простаты движения и неопределенность в отношении ректальной объема и плотности26. Комфортно полный мочевой пузырь рекомендуется ограничить дозы для тонкого кишечника и передняя часть мочевого пузыря27. Моделирование МРТ рекомендуется также для более точной целевой объем разграничения26.
Лечение должно быть призвано доставить доз 75,6-79,2 порекомендованное Gy для простаты, при дозах 45-50,4 гр для выборных освещение узловых или семенных пузырьков регионов риску микроскопические болезнь распространилась9. Все фракции доставляются один раз в день в 1,8-2 гр за дроби. Для среднего и высокого риска пациентов, получающих подталкивание брахитерапия внешний пучка излучения доза должна быть ограничена примерно 45 гр. Брахитерапия доз 110 гр должны использоваться с I-125 низкой дозы скорость постоянных имплантантов. С высокой дозы скорость брахитерапии через катетеры часто используемые импульс схемы включают 13-15 гр x 1 фракция, 8 до 11,5 гр x 2 фракций, 5,5 до 6,5 гр x 3 дроби и 4,0 до 6,0 гр x 4 фракций9.
Дозиметрического планирования лечения оптимизирован для ограничения дозы пузыря, прямой кишки и кишечника. Дозиметрические сравнений между Фотон-против Протон - на основе терапии (т.е., IMRT против IMPT техники) продемонстрировали более щадящие доз в нормальных тканях с последний подход28.
Конкретные смертность рака простаты является под 2% на 10 лет для мужчин с ранней стадии болезни22 независимо от выбранного режима. С активизации доза RT пациентов высокого риска также показывают низкий рака простаты конкретных смертности 5% на 9 лет29. Смертность остается на низком уровне во многом из-за наличия системной терапии, которые остаются в силе в параметре метастатическим. Результаты с IMRT и протонной терапии остаются отличным30,31. Исследование PARTIQoL (NCT01617161) является постоянной, рандомизированное исследование между протонной лучевой терапии (ПБТ) и IMRT для низкого и среднего риска рака простаты, который мы надеемся будет определить, является ли один механизм Улучшенный над другим.
Рак молочной железы является наиболее часто диагноз злокачественных женщинами и второй наиболее распространенной причиной связанных с раком смерти среди женщин США. Около 268,670 новых случаев будет поставлен в 2018 году, и 41400 женщин умрут от болезни1. В отличие от рака простаты, где большинство пациентов получают излучения как монотерапия, больных раком молочной железы получают радиации после операции, чтобы уменьшить риск рецидива рака11. В зависимости от степени хирургии требуется, излучения могут быть направлены на оставшиеся грудь после лампектомии опухоли или к стене груди после мастэктомии11,32. Регионарных лимфатических узлов в подмышечной впадине, надключичных и внутренних районах молочных желез могут быть направлены, если они считаются риску распространения опухоли.
Графиков лечения для больных груди, как правило, предусматривают лечения один раз в день, пять дней в неделю. Ранние стадии обычно лечат больных с условно фракционированный (1.8-2.0 гр/фракция; 50 Gy всего) или hypofractionated (2.67 Gy/фракция; всего 40.05-42,56 Gy) схемы грудку11,33. С более продвинутых, но локализованные болезни пациентов с обычными фракционирование до 50 гр (1.8-2.0 гр/фракция) всей груди или грудной стенки и регионарных лимфатических узлов. Эти дозы являются эффективными для субклинический заболевание, которое может присутствовать после операции.
CT моделирования для лучевой терапии рака молочной железы обычно завершается в лежачем положении. В отличие от рака простаты обе руки похищают накладные разрешить экспозиции в груди стены или груди ткани. Кроме того индивидуальные прижимая устройство и груди Совет часто используются для иммобилизации грудной клетки в поднятом положении так, чтобы рукоятка параллельно к таблице лечения. Это гарантирует, что ткани груди не главно попадают в область шеи.
Радиационного облучения в сердце во время рак молочной железы связан с повышенным риском будущих ишемической болезни34. В результате методы минимизации доз сердца имеют первостепенное значение. Один подход — использовать удерживайте глубокого вдоха дыхание (DIBH) для увеличения пространства в внутригрудного и расстояние между сердцем и передней грудной стенки/груди. Как метод подразумевает, пациентов с DIBH приостановить их дыхательного цикла и получить лечение в максимальной точке вдохновения. Однако не все пациенты в состоянии терпеть дыхание держит достаточной продолжительности разрешить эту технику. В некоторых пациентов подверженных позиции может быть выгодно и может разрешить ткани груди повесить от критических нормальных тканей, включая сердце35. Недостатком этого подхода является ограничение, которую он возлагает на способность целевых регионов лимфатических. Протонотерапия можно добиться существенной сердца дозы щадящие без необходимости DIBH и подверженных методы36,37.
Протонная терапия используется для больных раком молочной железы и продемонстрировал свое превосходство для ФОТОН-методов в отношении дозы щадящее воздействие на критически важные структуры таких легких и сердца38. Луч карандаш одного поля сканирования (PBS) план с Диапазон сдвига может использоваться для администрирования излучения протона к грудной стенки и региональных узлов. Может также использоваться пассивный точечных подходов. Если несколько полей требуются для того, чтобы рассматривать весь грудной стенки и региональных узлов из-за ограничения поля, поля соответствия методы должны быть использованы. Одна стратегия — использовать сопоставления надключичных и грудной стенки поля соответствует разрыв кожи 2-4 мм ниже ключицы Глава39. Границы поля перемещаются на расстоянии 1 см в разное время точках в ходе излучения для сведения к минимуму горячих и холодных пятен.
Клинические результаты с груди Рак излучения показывают общее выживание 50% на ранней стадии болезни11 и 37% больных местнораспространенным на последующие 20 лет32. Учитывая период длительного ремиссии, минимизация лечения связанных токсичность вызывает большую озабоченность. Хотя ожидается, что протонной терапии потенциально снизить риски сердечного токсичность, этот вопрос рассматривается в текущих суд консорциум RADCOMP (NCT02603341), который случайной женщин с раком молочной железы для фотона или протонной лучевой терапии.
Рак остается второй наиболее распространенной причиной смерти детей в возрасте 1-14 в Соединенных Штатах и превзойден только аварий. В 2018 году 10,590 дети будут диагностированы с раком, и 1180 умрут от их злокачественности1. Среди этой группы 250-500 пациентов будет диагнозом медуллобластомы. Средний возраст диагностирования медуллобластома составляет 4-6 лет. Учитывая высокий риск для спинномозговой жидкости участие и распространение (30-40%), craniospinal облучения (CSI) стандарт медицинской помощи в этих больных, с приблизительно 80% выживших с соответствующего лечения.
Медуллобластома больных разбиты на стандарт риска и риска группы на основании их возраста, наличие anaplasia или метастазы и количество остаточной опухоли после хирургической резекции. В любом случае лечение включает послеоперационной излучения. RT для Медуллобластомы включает первоначальный CSI дозы 23,4-36 гр. Дополнительная доза затем предоставляется кровать опухоли для достижения дозы 50,4-55,8 Gy в первичной опухоли сайта40. Вопросы планирования лечения включают в себя ограничение максимальной дозы в ствол головного мозга и спинного 54 гр и 45 гр, соответственно. CSI может быть доставлен с помощью фотона или протонной терапии. CT моделирования и лечение часто требуют анестезии для обеспечения, что пациенты не двигаться во время лечения41.
Из-за больших районов, поражавшихся с излучением, на основе фотонных RT методы результат воздействия значительное облучение грудной и брюшной структурам впереди спинного мозга, в том числе легких, сердца, кишечника, почек и груди. Эти регионы могут быть избавлены от избыточного излучения с протонной терапии (рис. 3)42. PT основе CSI требует два слегка косо боковые поля чтобы облучить верхнего шейного отдела позвоночника и мозга, а также один или несколько кзади передней балки, ориентированные на нижней шейного, грудного, поясничного и крестцового позвоночника регионов. Несколько полей требуются, поскольку цель CTV для CSI включает весь спинномозговой жидкости (CSF) пространство, простирающееся от вершины мозга в спинномозговой канал через конского хвоста на уровне S2/S3 позвоночной соединения (рис. 3). Длина позвоночника определяет общее количество позвоночника полей, необходимых для лечения. Улучшенный границы верхней спинной поля соответствует нижней границе краниально поля. Если поле позвоночника не может охватить весь позвоночник, второй спинной поле соответствует нижней границе верхней области позвоночника. Этот процесс может быть повторяться, если третье поле является обязательным для выше пациентов. Для пациентов, в возрасте 15 передней границы полей позвоночника расширена, чтобы включить весь тел позвонков обеспечить однородная доза кости для предотвращения будущего роста аномалий в развивающихся скелета. Для тех, кто старше 15 лет границы поля передней позвоночника расширяется 2-3 мм за пределы позвоночного канала в позвоночнике.
Пассивный разброс и PBS методы были использованы для CSI42,43. Конкретные цели CSI терапии включают однородного излучения дозы в спинномозговой жидкости (СМЖ) на нижнем конце гнойный мешок (S2 или S3), полной дозы к передней череп базы и решетчатой пластине, минимизация дозы оптические структуры, ограничения объема щитовидной железы не более 5% дозы по рецепту, и минимизация дозы пищевода43.
Планирование лечения пассивный разброс обычно начинается с создания краниально поля. Диапазон компенсаторы с ручного редактирования часто требуется для создания однородной дозы распределения в головном мозге при ограничении дозы для глаз и улитки. Для спинномозговой областях компенсаторы утолщенные на уровне щитовидной железы для сведения к минимуму дозу. Особое внимание уделяется затем поля соединения между полями черепа и позвоночника, а также между несколькими полями позвоночника при необходимости. Площадь соединения определяется как 1,25-1,5 см длины, где примыкают поля. Перекрестка смещается в краниально и каудально направлении еженедельно для предотвращения развития районов, горячей или холодной дозы. В идеале доза дисперсия хранится между 95-108% принятой дозы рецепта. Для достижения этой цели43используются поля взвешивания, изменения диафрагмы и компенсатор изменений.
Исследователи в доктор медицинских наук Центр рака Андерсона разработали стратегию поэтапного для планирования42CSI. Этот подход предусматривает разработку плана МФО для лечения головы и нижней позвоночника поля следуют создание плана SFO для грудного отдела позвоночника. Доза градиенты используются на стыке областей. SFO план затем копируется в первоначальный план МФО разработать план окончательного, композитный МФО. Позвоночника развязок смещены один раз за 4-недельный курс лечения на 2 см. По сравнению с пассивной разброс CSI PBS на основе CSI предлагает существенные сокращения дозы излучения для линз, улитки и околоушной железы, но за счет увеличения щитовидной железы доза42.
Медуллобластома пациентов можно ожидать событие бесплатно выживаемости 60-80% в зависимости от риска слоев44. Учитывая большой площади облученных тканей с CSI и деликатный характер педиатрических больных, долгосрочные риски побочных эффектов являются значительными и включают нейрокогнитивный обесценения, вторичных злокачественных опухолей, дисфункции гипофиза, потеря слуха, болезни сердца , бесплодие, гипотиреоз, заболеванием, сухость глаз, катаракты, потеря зрения и излучения некроз/миелит. Таким образом на базе Протон CSI может предложить существенную выгоду для многих пациентов.
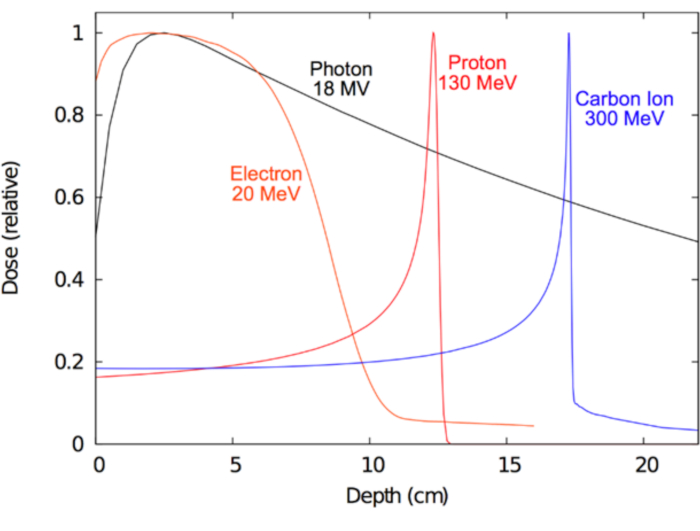
Рисунок 1: глубина доза кривые для радиотерапии. Доза дистрибутивы как функция глубины в воде, для различных клинических радиационных лучей. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
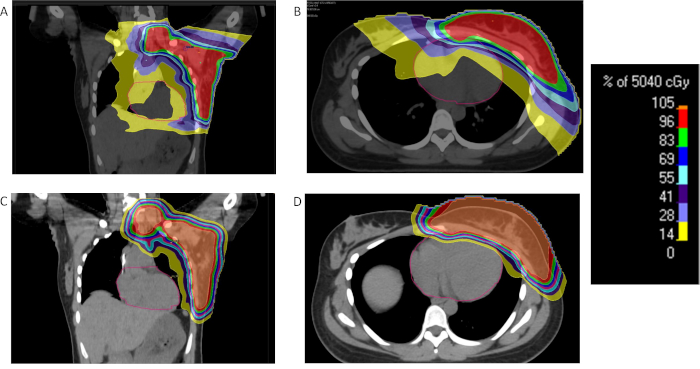
Рисунок 2: сравнение Протон и фотонного излучения груди. % Дозы распределения для пациента с местнораспространенного РМЖ получения лучевой терапии с IMRT (A, B) или протонов (C, D) и демонстрации излучения значительное уменьшение дозы в сердце и легкие с протонами. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
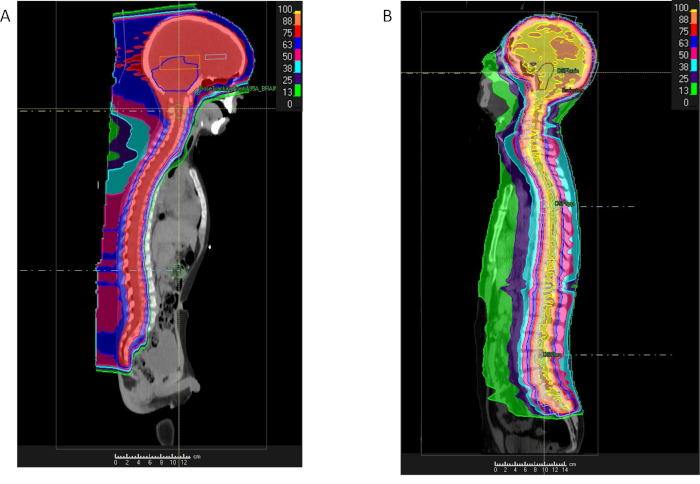
Рисунок 3: сравнение Протон и фотонного излучения craniospinal. % Дозы распределения для пациента с медуллобластомой, получающих craniospinal облучения, с использованием либо протонов (A) или IMRT (B) и демонстрируя существенное излучения дозу уменьшают в регионах внутри грудной и брюшной стенки с протонами. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Фотон | Протон | |
| Тип частиц | Бозон | Композитный фермион |
| Заряд [C] | 0 | +1.602 x 10-19 |
| Масса [кг] | 0 | 1.672 x 10-27 |
| Спина | 1 | 1/2 |
| Energy† [МЭВ] | 0,1 - 25 | 10 - 250 |
| Общие источники | Линейный ускоритель, Co-60 радиоизотопов, рентгеновская трубка | Циклотрон или синхротронного ускорителя |
| Методы доставки | Коллимированного сплошной балки, Multileaf коллиматоры, модуляции интенсивности, дуги | Пассивные рассеяния, магнитные сканирование |
| † Энергетический диапазон, обычно используется для лечения раковых заболеваний человека | ||
Таблица 1: Сравнение Протон и фотонного излучения.
Обсуждение
Планирование лечения излучения и доставки для рака процесс индивидуального персонализированные для каждого отдельного пациента и его конкретного рака. Современная лучевая терапия является изображение гидом на основе вмешательства CT изображения, полученные в ходе заказной излучения, планированию моделирования. КТ является обязательным, поскольку он содержит 3-мерной (3D) анатомические данные о пациента, а также точного количественного определения плотности ткани в различных местах в организме, которые необходимы для расчета дозы. Во время КТ, пациент располагается на моторизованных таблицы. Несколько устройств механических иммобилизации обычно применяются для ограничения движения пациента во время визуализации и последующей доставки RT. В зависимости от требуемых точностью, эти устройства варьируются от простой формы тип подушки и пластиковых сеток, которые соответствуют пациента поверхность и затем затвердевают ограничить движения, чтобы более инвазивных устройств, таких как грузовик череп, сверлят в месте. Зачастую требуется точность иммобилизации устройства диктуется близость опухолевой ткани рядом критически важные структуры. Например наиболее инвазивных устройств иммобилизации, головы ореола детализация место, иногда используется, когда один миллиметр точность необходима для лечения опухоли около глаз или зрительных нервов, чтобы свести к минимуму вероятность слепоты, которая может возникнуть от перемещения пациента в неправильной позиции во время лечения.
КТ визуализации информации также используется для оптимизации анатомии внутренних нормальной ткани. К примеру вздутия мочевого пузыря часто используется для сведения к минимуму мочевого пузыря и тонкого кишечника дозу облучения от облучения предстательной железы, как отмечено в протоколе выше. Аналогично Если желудок особенно растянутый с пищей во время симуляции для верхней брюшной излучения (например, желудка, печени, дистальной части пищевода), то пациент повторно имитируемых после позволяя пищи через желудочно-кишечного тракта . Это будет уменьшить желудок и уменьшить вероятность облучения во время лучевой терапии опухолей верхней брюшной полости. В тех случаях, когда желудок или пузыря сами подвергаются радиации, они могут быть намеренно растянутый или опорожняется оптимизировать распределение дозы.
В некоторых случаях опухоль не адекватно или надежно визуализируется на CT, но могут быть определены более точно МРТ или ПЭТ-сканирование. В таких случаях PET или МРТ сканирования используются для дополнения данных КТ, поскольку это все еще требуется для расчета дозы. Это достигается путем регистрации изображения МРТ и ПЭТ КТ изображений для планирования терапии. МРТ часто обеспечивают гораздо больший Визуальный контраст и высокое разрешение, чем CT, которая может быть полезной для идентификации границ тонкой, мягкой ткани опухоли как в мозг и печень. PET предоставляет представление функционального распределения молекул радиоактивных меченых трассирующими, вводят в пациента.
Некоторые опухоли возникают в области грудной клетки или живота, где они могут двигаться значительно с дыханием. Для учета этого движения для обеспечения точности излучения, 4-мерной CT, типа «кино режим» КТ, может использоваться для захвата 3D анатомии пациента, как она изменяется с течением времени во время дыхания. Для некоторых целей грудной и брюшной ремни сжатия или другие средства смягчения движения может использоваться во время терапии для ограничения движения и ограничения неопределенность в отношении местоположения опухоли45.
После того, как пациент моделируется для лечения, индивидуальный подход план разрабатывается с учетом рака гистологии, расположения опухоли и анатомические особенности, которые влияют на оптимальной конфигурации пучков излучения, типов частиц, энергии, и дозе уровни для каждого отдельного пациента. Для каждого пациента ряд основных вопросов, первоначально рассматриваются группой клинических разработать план оптимального лечения. Как отправной точки наиболее подходящей формой излучения должен быть выбран. Варианты включают фотонов, электронов и протонов. Обычно это сопровождается отбор луч angle(s) для доставки излучения. Большинство машин RT включают роботов пациента позиционирования таблицы и вращающегося козловые, которые позволяют RT лучи направляются в пациента, практически под любым углом. Решение включает в себя поиск по пути, который наиболее эффективно поражает цель с RT и лучший избегает не цели, которые могут находиться в пути выбранного балок. В некоторых случаях углы луча определяется сама система планирования после ввода в излучения целей для опухолевых и нормальных тканей. Этот процесс называется «обратное планирование» и часто делается в случае IMRT, который включает в себя модуляции интенсивности нескольких, входящего излучения балки образом зависящих от времени, что обеспечивает единый целевой дозы, но может привести к весьма неоднородной дозы за пределами целевой. Хотя фотона или протонной терапии может быть интенсивности модуляции, обратное планирование используется в основном в Фотон только основе IMRT. Если балки твердых излучения должны использоваться, пользовательские металлических коллиматоры может сфабриковано, чтобы соответствовать форме пучка излучения с формой опухоли.
Если выбран протонной терапии, последующее решение необходимо быть сделаны относительно использования пассивного точечной или PBS методов. В случае PBS требуется дополнительное решение относительно использования МСН или стратегии одного поля оптимизации/одного поля единой дозы (SFO/SFUD). В МФО лечения несколько пучков необходимы для лечения опухоли во время каждой фракции, поскольку каждый луч только цели часть целевого объекта. В отличие от планов SFO, каждый луч охватывает весь целевой объект. МФО часто выступает за опухолями вблизи критические структуры (например., опухоли головного мозга вблизи зрительного нерва) где разнообразные луч углов может быть выгодно лепить дозы излучения. Стратегии МФО также убедиться, что все лучи излучения/пятна не «конец диапазона» в том же районе, где доза может быть неожиданно высоким благодаря эффекту Брэгг пик. С другой стороны SFO благоприятствования для целей вблизи области анатомической неопределенности, например предстательной железы, который может двигаться из-за дифференциального мочевого пузыря и прямой кишки наполнения. SFO обеспечивает повышение надежности против изменения дозы из-за анатомических отклонений.
После того как основной стратегии планирования решается, следующий этап планирования лечения, как правило, включает математической оптимизации полей излучения. Энергии, интенсивности и пространственного распределения (пространственно переменного потока) входящего излучения являются обычно свободные параметры оптимизации. Наряду с большой 3D матричное представление анатомии пациента, CT эти свободные переменные приведет к очень большой проблемой размер и соответствующих крупных оптимизации матрицы (например, тысячи CT ценностей и тысячи возможных луч света должны рассматривать). Эти матрицы обрамлены в цель функции, который является математической формулировки «цели планирования лечения». Как упоминалось выше, цели лечения являются приоритеты, чтобы сначала достичь предписанной дозе в целевой, а во-вторых, для достижения как низкие дозы как возможен для нормальных тканей. Чтобы свести к минимуму эта функция цели, высокой вычислительной мощности желательно быстро выполнять расчеты транспорта РТ, заполняющих матрицы, и численной оптимизации методов, таких как градиент поисковых алгоритмов, используются для быстрого поиска локальных минимумов в функция. Эти минимумы соответствуют оптимального лечения планы для каждой уникальной пациента. Нельзя переоценить роль компьютеров в планирование лечения. Не будет возможным без компьютерных достижений последних трех десятилетий современной лучевой терапии и радиологии.
Как заключительный этап план оптимизации лечения просматривается медицинской группой (дозиметрист, врач и физик). Во многих случаях этот план может быть адаптированы далее или повторно оптимизирован для работы с различными целями для повышения общего качества. Как только план считается оптимальным, технические параметры плана рассматриваются физик и переданы лечения доставки машины.
Во многих случаях пациент возвращается для нескольких лечения фракций (сессии), часто каждый будний день в течение нескольких недель. Многодневные фракционирование может активизировать острых радиационно индуцированных побочные эффекты, но может уменьшить потенциал поздно, более серьезные побочные эффекты РТ по сравнению с одной фракция лечение12. Мульти фракция подходы являются оптимальными для опухолей, которые быстро делящиеся или не в состоянии ремонта сублетальных ущерб от RT. Однако это зависит на сайте точного лечения и чувствительность близлежащих нормальных тканей. Поскольку цель доставки излучения лечения заключается в том, чтобы управлять же лечение во время каждой фракции, даже на несколько миллиметров движения или неопределенности в положении пациента может привести к деградации плана лечения терапия частиц. По этой причине руководство встроенного изображения системы имеют первостепенное значение в ходе мультифракционном RT. X-ray тепловизоры, конус луча КТ сканирование или оптический, лазерное сканирование поверхности тепловизоры доступны для этой цели. Эти устройства позволяют изображение руководствуясь радиотерапии (IGRT) через изображений анатомических ориентиров, целей опухоли или суррогатных рентгеноконтрастное фидуциальный маркеров. IGRT изображения по сравнению с оригинальной моделирование сканирует и корректировать при необходимости перед каждой фракции излучения.
Несмотря на преимущество конечного диапазона протонной терапии, который ограничивает выход дозы, точность прогноза диапазона, обычно видели в планировании лечения составляет порядка нескольких миллиметров. Потеря энергии точный в разных тканях пациента является неопределенным, во-первых, поскольку точные молекулярные компоненты тканей являются неоднозначными, и, во-вторых, поскольку пациент анатомии изменяется с течением времени, оба над коротких периодов времени (например, дыхание) и больше периодов времени (например, потеря веса, опухоли усадка, нормальная анатомия изменения). Для решения этой неопределенности, «дистальной маржа» добавляется к целевой том является дополнительной маржи нормальной ткани только за глубину максимальной опухоли. Такой разницы гарантирует, что даже с неопределенности прогноза диапазона, глубины всей опухоли будет рассматриваться с высокой степенью уверенности. К сожалению в результате нормальной ткани маржа могут подвергаться полной дозы RT, который потенциально может привести к значительным RT побочных эффектов в этой ткани. Напротив как фотоны не остановить, но скорее выйти из цели, не таким дистальной разницы необходимо компенсировать диапазон неопределенности. Геометрическая маржа по-прежнему используется в терапии Фотон позиционные неопределенности адрес целевого объекта, но фотоны являются гораздо менее чувствительны, чем протонов точного статуса пациента тканей вверх по течению целевого объекта. Таким образом иногда может быть меньше для фотонов протонов необходимой маржи. Это можно понять, учитывая, что протоны проходят непрерывное энергетических потерь в тканях, которые существенно затрагивают положение их диапазона, тогда как фотоны без предъявления обвинений и свободно передвигаться в пустом пространстве между атомов и их орбиталей, за исключением редких столкновения с электронами и ядрами. Большая плотность различия в ткани, например., металлические предметы или воздушных полостей, однако, по-прежнему влияют на Фотон дозы и дозы протонов, но ниже величины.
Окончательный и важные неопределенности относится к радиобиологических эффективности различных видов излучения (РРБ). РРБ является соотношение доз, от ссылочного типа излучения и излучения тип теста, при условии, что оба вида излучения производят же биологический эффект. Чем выше РРБ, тем более, повредив излучения на единицу энергии осаждения в ткани. РРБ коэффициент определяется со ссылкой на фотонного излучения. Несмотря на это простое описание есть на самом деле большой неопределенности относительно РРБ значения для заряженных частиц в отличие от фотонов. Различия в дозу пространственный распределения фотонов и заряженных частиц в микрометр и нанометровом масштабе привести к различия в биологический эффект, даже когда макроскопических дозы идентичны. Это может пониматься путем изучения пространственных структур ДНК повреждения после воздействия заряженных частиц в разных дозах и различные кинетические энергии. Различные кинетические энергии и различных сборов, протонов (+ 1) и ионов углерода (+ 6) привести к различия в передаче энергии на разных глубинах в пациента, тогда как для фотонов, передача энергии сравнительно ниже и также более однородным по всему пациент. Хотя теоретически понимает, существует значительные дебаты в радиационной онкологии сообщество относительно способности прогнозировать такие биологические эффекты. Для углерода Ион терапии является отсутствие консенсуса в отношении наилучших путей модели эти биологические эффекты, хотя существует согласие, что такие последствия должны быть смоделированы предоставлять терапии. Для протонов большинство клинических центров в настоящее время план терапии без явного моделирования РРБ эффектов, за исключением с помощью постоянной коррекции коэффициента 1.1, но это может измениться в ближайшем будущем, как системы планирования новых коммерческих лечения начинают включать биологического моделирования программного обеспечения для моделирования РРБ протонной терапии.
С завершением рандомизированных испытаний, в том числе RADCOMP, PARTIQoL и RTOG 1308 мы должны иметь более конкретные ответы о том, какие формы излучения может быть лучше для груди, простаты и рак легких, соответственно. Подобные исследования планируется для других сайтов болезни, которые могут помочь лучше определить лучший методом лечения для этих типов опухолей. Однако есть уже достаточно данных для предложить превосходство протонов в определенных условиях, особенно в педиатрической популяции, где значительные нормальной ткани щадящие может значительно снизить заболеваемость от токсичности, включая вторичные злокачественных опухолей.
Раскрытие информации
A.H. имеет гонораров от АстраЗенека, Байер и Новартис. A.H. проконсультировался с Astrazeneca, Bristol-Myers Squibb и Bayer и был оратором фонда Франции.
Благодарности
С.р. признает грантовое финансирование из программы погашения кредита NIH. A.H. получил финансирование от Байер, Кловис, созвездие, Agensys, Sotio, Лазурный и Calithera.
Материалы
| Name | Company | Catalog Number | Comments |
| Proton beam cyclotron and gantry delivery system | Varian | N/A | Allows for generation and delivery of protons for radiotherapy |
| kVUE One Proton Couch Top | Qfix | RT-4551KV-03 | Permits patient placement for radiotherapy |
| CT simulator with 4D scanning capability | GE | N/A | Permits CT simulation for radiation planning |
| 100" x 70" Qfix VacQfix Cushion | Qfix | RT-4517-10070F30 | Immobilizes patient for more precise radiation delivery |
| Timo Foam Head Support | Qfix | RT-4490-F | Ensures minimization of head motion during radiotherapy |
| 3 CT Localizers Localization Markers | Beekley Medical | REF 211 | Ensures concordance of external markers and internal patient anatomy from CT simulation |
| VacQfix Indexer | Qfix | RT-4517-IND01 | Ensures VacQfix cushion placement is reproducible for every radiatiion treatment |
| Radiation treatment planning software | Raystation | N/A | Allows for personalized radiation planning for every tumor with robust optimization and multi-criteria optimization |
| Proton Range Compensator | .Decimal | RC-AC 1018 | Adjusts the range of the proton beam to achieve distal dose conformality |
| Proton Beam Aperture | .Decimal | AP-BR 1800 | Shapes the proton beam treatment area |
| Proton Range Shifter | .Decimal | RS-AC 1018 | Adjusts proton beam tissue depth penetration |
| Endorectal Balloon | Radiadyne | ILG-90F | Ensures uniform rectal filling and prostate positioning |
Ссылки
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Barton, M. B., et al. Estimating the demand for radiotherapy from the evidence: a review of changes from 2003 to 2012. Radiotherapy and Oncology. 112 (1), 140-144 (2014).
- Pan, H. Y., et al. Supply and Demand for Radiation Oncology in the United States: Updated Projections for 2015 to 2025. International Journal of Radiation Oncology Biology and Physics. 96 (3), 493-500 (2016).
- Reed, A. B. The history of radiation use in medicine. Journal of Vascular Surgery. 53 (1 Suppl), (2011).
- T Landsberg, P. . Nobel Lectures in Physics, 1901-1921. 18, (1967).
- . Non-small cell lung cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (2018)
- . Pancreatic Adenocarcinoma Available from: https://www.nccn.org/professionals/physician_gls/pdf/pancreatic.pdf (2017)
- . Breast cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (2017)
- . Prostate Cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (2017)
- Chang, J. Y., et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncology. 16 (6), 630-637 (2015).
- Fisher, B., et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. The New England Journal of Medicine. 347 (16), 1233-1241 (2002).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. , (2012).
- Lomax, A. J. Charged particle therapy: the physics of interaction. The Cancer Journal. 15 (4), 285-291 (2009).
- Rossi, B., Greisen, K. Cosmic-Ray Theory. Reviews of Modern Physics. 13 (4), 240-309 (1941).
- Blakely, E. A., Chang, P. Y. Biology of charged particles. The Cancer Journal. 15 (4), 271-284 (2009).
- Schardt, D., Elsässer, T., Schulz-Ertner, D. Heavy-ion tumor therapy: Physical and radiobiological benefits. Reviews of Modern Physics. 82 (1), 383-425 (2010).
- Chun, S. G., et al. The Potential of Heavy-Ion Therapy to Improve Outcomes for Locally Advanced Non-Small Cell Lung Cancer. Frontiers in Oncology. 7 (201), 1-3 (2017).
- Pan, H. Y., Jiang, J., Shih, Y. T., Smith, B. D. Adoption of Radiation Technology Among Privately Insured Nonelderly Patients With Cancer in the United States, 2008 to 2014: A Claims-Based Analysis. Journal of the American College of Radiology. 14 (8), (2017).
- Michalski, J. M., et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncology. , (2018).
- Glimelius, B., et al. Number of patients potentially eligible for proton therapy. Acta Oncologica. 44 (8), 836-849 (2005).
- Doyen, J., Falk, A. T., Floquet, V., Herault, J., Hannoun-Levi, J. M. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treatment Reviews. , 104-112 (2016).
- Hamdy, F. C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine. 375 (15), 1415-1424 (2016).
- Ng, M., et al. Fiducial markers and spacers in prostate radiotherapy: current applications. British Journal of Urology International. 113, 13-20 (2014).
- Hedrick, S. G., et al. A comparison between hydrogel spacer and endorectal balloon: An analysis of intrafraction prostate motion during proton therapy. Journal of Applied Clinical Medical Physics. 18 (2), 106-112 (2017).
- Hamstra, D. A., et al. Continued Benefit to Rectal Separation for Prostate Radiation Therapy: Final Results of a Phase III Trial. International Journal of Radiation Oncology Biology Physics. 97 (5), 976-985 (2017).
- Wortel, R. C., et al. Local Protocol Variations for Image Guided Radiation Therapy in the Multicenter Dutch Hypofractionation (HYPRO) Trial: Impact of Rectal Balloon and MRI Delineation on Anorectal Dose and Gastrointestinal Toxicity Levels. International Journal of Radiation Oncology Biology Physics. 99 (5), 1243-1252 (2017).
- Chen, Z., Yang, Z., Wang, J., Hu, W. Dosimetric impact of different bladder and rectum filling during prostate cancer radiotherapy. Radiation Oncology. 11, 103 (2016).
- Rana, S., et al. Dosimetric and radiobiological impact of intensity modulated proton therapy and RapidArc planning for high-risk prostate cancer with seminal vesicles. Journal of Medical Radiation Sciences. 64 (1), 18-24 (2017).
- Rodda, S., et al. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer. International Journal of Radiation Oncology Biology Physics. 98 (2), 286-295 (2017).
- Zietman, A. L., et al. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09. Journal of Clinical Oncology. 28 (7), 1106-1111 (2010).
- Al-Mamgani, A., Heemsbergen, W. D., Peeters, S. T., Lebesque, J. V. Role of intensity-modulated radiotherapy in reducing toxicity in dose escalation for localized prostate cancer. International Journal of Radiation Oncology Biology Physics. 73 (3), 685-691 (2009).
- Ragaz, J., et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. Journal of the National Cancer Institute. 97 (2), 116-126 (2005).
- Whelan, T. J., et al. Long-term results of hypofractionated radiation therapy for breast cancer. New England Journal of Medicine. 362 (6), 513-520 (2010).
- Darby, S. C., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. New England Journal of Medicine. 368 (11), 987-998 (2013).
- Wroe, A. J., Bush, D. A., Schulte, R. W., Slater, J. D. Clinical immobilization techniques for proton therapy. Technology in Cancer Research and Treatment. 14 (1), 71-79 (2015).
- Shah, C., et al. Cardiac dose sparing and avoidance techniques in breast cancer radiotherapy. Radiotherapy and Oncology. 112 (1), 9-16 (2014).
- Patel, S. A., et al. Postmastectomy radiation therapy technique and cardiopulmonary sparing: A dosimetric comparative analysis between photons and protons with free breathing versus deep inspiration breath hold. Practical Radiation Oncology. 7 (6), e377-e384 (2017).
- Depauw, N., et al. A novel approach to postmastectomy radiation therapy using scanned proton beams. International Journal of Radiation Oncology Biology Physics. 91 (2), 427-434 (2015).
- MacDonald, S. M., et al. Proton therapy for breast cancer after mastectomy: early outcomes of a prospective clinical trial. International Journal of Radiation Oncology Biology Physics. 86 (3), 484-490 (2013).
- Merchant, T. E., et al. Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. International Journal of Radiation Oncology Biology Physics. 70 (3), 782-787 (2008).
- McMullen, K. P., Hanson, T., Bratton, J., Johnstone, P. A. Parameters of anesthesia/sedation in children receiving radiotherapy. Radiation Oncology. 10, 65 (2015).
- Stoker, J. B., et al. Intensity modulated proton therapy for craniospinal irradiation: organ-at-risk exposure and a low-gradient junctioning technique. International Journal of Radiation Oncology Biology Physics. 90 (3), 637-644 (2014).
- Giebeler, A., et al. Standardized treatment planning methodology for passively scattered proton craniospinal irradiation. Radiation Oncology. 8, 32 (2013).
- Gajjar, A., et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncology. 7 (10), 813-820 (2006).
- Lin, L., et al. Evaluation of motion mitigation using abdominal compression in the clinical implementation of pencil beam scanning proton therapy of liver tumors. Medical Physics. 44 (2), 703-712 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены