Method Article
פרוטון טיפול משלוח ויישומו קלינית של מחלות ממאירות גידולים מוצקים בחר
In This Article
Summary
היסודות של קרינה תכנון ואספקה עבור פרוטון טיפול באמצעות סרטן הערמונית כמודל מוצגים. היישום של עקרונות אלה לאתרים אחרים למחלה שנבחרה מדגיש כמה הקרנות פרוטון עשוי לשפר את התוצאות הקליניות לחולי סרטן.
Abstract
טיפול בקרינה הוא מודאליות נפוצות לטיפול סרטן מוצק. למרות המנגנונים של להרוג תאים דומים עבור כל הטפסים של קרינה, המאפיינים ויוו של קרני פוטון, פרוטון שונים במידה רבה ואולי מנוצלת כדי למטב את התוצאות הקליניות. בפרט, פרוטון חלקיקים לאבד אנרגיה באופן צפוי, כשהם עוברים דרך הגוף. מאפיין זה משמש קלינית כדי לשלוט העומק-אשר הסתיים קרן הפרוטונים, וכדי מגבלת קרינה במינון מעבר לאזור המטרה. אסטרטגיה זו יכולה לאפשר הפחתות הקרינה לרקמות נורמלי ממוקם ממש מעבר המטרה גידול משמעותי. ההשפלה של פרוטון האנרגיה בגוף, אולם נותרה רגישה מאוד צפיפות רקמה. כתוצאה מכך, שינויים בצפיפות רקמת במהלך הטיפול עשוי לשנות משמעותית קרינה פרוטון. שינויים כאלה עלול להתרחש באמצעות שינויים במשקל הגוף, נשימה או המעי מילוי/גז, עלול לגרום בעדות במינון שלילי. כתב יד זה, אנו מספקים שיטה מפורטת למסירה של פרוטון טיפול באמצעות פיזור פסיבי והן עיפרון קרן סריקה טכניקות עבור סרטן הערמונית. אף-על-פי ההליך המתואר מתייחס ישירות על חולי סרטן הערמונית, ייתכן השיטה הותאם ויש להחיל לטיפול של כמעט כל גידולים מוצקים. המטרה שלנו היא כדי לצייד את הקוראים עם הבנה טובה יותר של פרוטון טיפול משלוח ותוצאות כדי להקל על השילוב המתאים של מודאליות הזה במהלך טיפול בסרטן.
Introduction
ההערכה היא כי 1.7 מיליון אנשים בארצות הברית יאובחנו עם סרטן ב-2018, עם מעל 600,000 להיכנע המחלה1. אפשרויות הטיפול הנוכחי לערב modality מונו או ריבוי טיפול באמצעות ניתוח, טיפול בקרינה (RT) וטיפולים מערכתית. ביחס RT, רבע חולים שאובחנו רק לאחרונה יקבלו זה כמו החלק של הטיפול בסרטן הראשוני שלהם ואת כמעט מחצית בסופו של דבר ידרוש אותו במהלך שלהם קורס2,של המחלה3.
כניסתו של RT שתחילתה 1895 כאשר וויליאם קונרד רנטגן גילה רנטגן תוך כדי עבודה עם קתודית במעבדתו באוניברסיטת Würzberg גרמניה4. זמן לא רב לאחר מכן, חולים עם מחלות המגוון הרחב כגון זאבת סרטן קיבלו טיפולים באמצעות קרני הרדיום. סיבוכים בתחילת התממשו מהר, אפילו נדונו על ידי פייר קירי הרצאה שלו פרס נובל5. מאז קרינה משפיע על רקמות רגילה והן הגידול, מינונים מבוקרים בקפידה של קרינה חייב להיות מנוצל כדי להגדיל את היחס הטיפולי, הגדיר את ההסתברות של הגידול שליטה לעומת ההסתברות של רעילות לא מקובל. עם התקדמות הדרגתית טכנולוגיה, כמו גם הבנה טובה יותר של רדיוביולוגיה ופיזיקה, יחס טיפולי זה שחל שיפור ניכר עם הזמן. השימוש של RT יש משמעותי משופר תוצאות עבור מספר סוגי סרטן, כפי שהיא משתקפת ההכללה שלו בהנחיות נבחרת עבור סרטן טיפול6,7,8,9. במקרים מסוימים, RT עשוי לשמש את המודאליות בלעדית עבור טיפול10, ואילו מחלות אחרות, ניתן להשתמש במסגרת טיפול רב מודאליות עבור מחלות מקומיות או מיגור של מחלה מיקרוסקופית11. למרות משמש לעתים קרובות עם יעד המרפא, חולים רבים RT הם גרורתי או נרחבת, מטופל עבור palliation של כאב או תסמינים אחרים להתפתח גידול-induced דחיסה, הפלישה או הרס של רקמות רגילה בסביבה של לוקו-אזורי המחלה.
העקרונות הבסיסיים מאחורי RT הם פשוטה. עם היישום של קרינה, אנרגיה מועבר לתאים דרך יינון של אטומים. אנרגיה זו, אם כי הוא עשוי להעלות את הטמפרטורה של אזור לקרינה על-ידי רק כמה microkelvin, מייצר רדיקלים חופשיים יכולים ישירות נזק נחשפו תאים בדרך של ה-DNA פציעה12,13. הרבה ההבנה שלנו של חלקיקים באנרגיה גבוהה והאינטראקציה שלו עם החומר מקורו מחקרים תיאורטיים וניסויים של קרניים קוסמיות ואת האינטראקציות שלהם באטמוספירה העליונה ביצעו את המוקדמות 20th המאה ה14. אנרגיה גבוהה חלקיקים טעונים (תהליך על גב) אינטראקציה עם החומר בעיקר באמצעות הכוח האלקטרומגנטי: החלקיקים עוברים דרך חומר או רקמות, פלסטית התנגשויות עם אלקטרונים מסלולית להוביל יינון ו עירור של חומר היעד, ו אלסטית התנגשויות עם האטום להוביל פיזור או הסטה של הנתיב של חלקיקים. בנוסף, הגרעין ההתנגשויות והתנגשויות קשה עם אלקטרונים להוביל לגל קרינה משנית המוסיפה על אפקט ionizing של קרינה של חלקיקים. חלקיקים באנרגיה גבוהה וחוצה את החומר ובכך להשאיר שובל של מיונן אטומים, מולקולות, אלקטרונים חופשיים תגובתי מבחינה כימית, יכול העלול לגרום שינויים ביולוגיים או נזק לאורגניזמים נחשפים שדות ionizing אלה.
מטרה ארוכת טווח גדול של הקרנות היה לומדים כיצד לרתום את אלה מייננת שדות באופן יעיל יתייחס מחלות אנושיות. קלינית, הצורה האידיאלית של קרינה (כגון פוטון, פרוטונים, אלקטרונים או יון כבד) אמורות לגרום יינון מספיק בתוך המטרה המחלה כדי לספק אפקט אנטי הגידול טיפולית, בזמן באותו זמן כי יינון מינימלי רגיל שמסביב רקמות כדי למזער השפעות מזיקות. איזה סוג של קרינה נבחרה עבור RT תלויה בחלקה המחלה מטופלת. עבור גידולים נמצאים עמוק בתוך הגוף, אולי גם בניתוח שמיש, נחשבים אופטימלית15,16megavolt פוטונים, פרוטונים ו יונים כבד. עבור סרטן שטחי, כגון אלה הכוללים את העור, טיפול אלקטרון עשוי להיות מיטבי, אפילו עדיף על ניתוח cosmesis. מצד שני, היתרון של פוטונים megavolt טמון ביכולתם לחדור עמוק בתוך רקמת תוך הגבלת נזק לעור. במקרה של חלקיקים טעונים, כמו אלקטרונים, פרוטונים או יונים כבד, היתרון העיקרי שלהם טמון המאפיינים שלהם 'עוצר'; כלומר, חלקיקים טעונים לאבד אנרגיה באופן רציף דרך ההתנגשויות פלסטית שתוארו לעיל, אובדן אנרגיה זה צפוי מאוד בסולם מילימטר. לכן, אלומת חלקיקים טעונים יכול להיות מועברת לחולה עם אנרגיות מדויק לעומק הרצוי. יתרה מזאת, חלקיקים טעונים לייצר קטן ללא יציאה במינון17. לעומת זאת, חלקיקים לא טעונים כמו פוטונים התערוכה של ההפחתה מעריכית (הנחתה) עם הגדלת עומק, אשר מובילה לעיתים קרובות מנה יציאה משמעותית עלולה לסכן רקמות בריאה דיסטלי אל המטרה. מושגים אלה הם הפגינו איור 1, אשר מציג הקרינה מינון (יינון) המאפיינים של סוגים שונים של קרינה בשימוש קליני. מניע מרכזי לשימוש פרוטונים או פחמן יונים במקום פוטונים עבור מטרות גידול עמוק הוא שיש מינון מינימלי ערך במינון ולאחר ליד אפס יציאה מינון מעבר ברקמות היעד. טבלה 1 מסכמת כמה מהמאפיינים הרלוונטית קלינית של קרני פוטון, פרוטון.
ההתקדמות בתחום של הקרנות, כולל טיפול פרוטון, התרחשו בשני תחומים עיקריים: 1) בניית מאיצי חלקיקים יעיל מסוגל לייצר אנרגיה גבוהה (תהליך) קרינה כגון סינכרוטרון, ציקלוטרון מאיצים, ו- 2) פיתוח שיטות מתוחכמות המשלבות המחלה הדמיה הנתונים והחישובים תחבורה קרינה כדי לאפשר מדומה-המחשב "תכנון טיפול." לתכנון טיפול, מטופלים בדרך כלל עוברים הדמיה טומוגרפיה (CT). הדימויים CT מכילים מידע אנטומי תלת-ממדי על כימות המטופל, כמו גם מדויק הצפיפויות רקמות. מפות צפיפות ותמונות CT משמשים לאחר מכן בהדמיות מחשב כדי לתכנן את הטיפול קרינה: אנרגיה והן עוצמת השדה קרינה מתמטית אופטימיזציה עבור כל מטופל. סריקת תהודה מגנטית (MRI) או סריקה טומוגרפיית פליטת פוזיטרונים (PET) עשוי לשמש גם כדי להשלים את הנתונים CT.
בהמשך נתאר קו מתאר צעד אחר צעד של מה חולים הם מנווט דרך שלהם קורס טיפול קרינה, ואחריו הדוגמאות של סוגי גידול מסוימים שטופלו עם טיפול פרוטון.
Protocol
קרינה המדויק טיפול לפרוטוקול תכנון ואספקה ישתנו לפי אתר מחלת, אולי אפילו דורשת האינדיבידואליזציה עבור כל מטופל. יתר על כן, ההליך עשויים גם לדרוש שינויים כדי להכיל את העדפות מוסדיים וזמינות הציוד. לצורך הדיון הזה, אנחנו מתאר את השלבים המשמש עבור פרוטון תכנון במקרה סרטן הערמונית טיפוסי, מאז זה הסרטן השכיח ביותר שטופלו עם טיפול פרוטון מרכזים בארה ב18. פרוטוקול זה מתאר הליכים קליני סטנדרטי של טיפול, אז שלא דורש אישור מוסדיים על ידי ועדת האתיקה האנושית מחקר.
1. טומוגרפיה סימולציה לטיפול קרינה
- הכנס את פלטת שולחן המורחבת לתוך הטבלה טיפול ולהבטיח כי הוא נעול.
- מקם כרית הנייח המנופח על השולחן ועל בר יצירת האינדקסים עבור כייר הרגל ברמה של הברך של המטופל.
- מקום מנוחה הראש מוצק בחלק העליון של הטבלה. להתחיל עם F גודל הראש, אשר יכול להכיל רוב המטופלים.
- לוודא כי המטופל השלים את תהליך שלפוחית מלאה על ידי שתיית 16 אונקיות עשרים וארבע של נוזל 45 דקות לפני הזמן סריקה מתוזמנת. שלב זה צריך להסתיים לפני שלב 1.12.
- רישום החולה למערכת רישום החולה CT.
- בחר פרוטוקול סריקה הערמונית עם פרוסה בעובי של 3 מ מ.
- לאשר הסכמתו לטיפול, ניגודיות הסכמה וסימולציות להזמין הושלמו על ידי הרופא המטפל.
- בקש מהמטופל כדי לשנות לתוך שמלה ולהסיר בגדים כל מהמותניים למטה.
- לאשר את הזיהוי החולה על ידי מילולית אימות שהחולה שם, תאריך לידה, ואתר הליך.
- לצלם תמונה הפנים של המטופל.
- בקש מהמטופל לשבת על השולחן ולסייע ואז החולה לתנוחה פרקדן, ראשה.
- למקם את הרגליים של המטופל הכרית הנייח המנופח והצב זרועות המטופל על החזה השזירה האצבעות שלהם, לתת להם טבעת כחולה או החלת רצועות לידיים שלהם.
- לאשר את היישור החולה באמצעות מערכת לייזר.
- לחבר את משאבת ואקום כפול הצינור של כרית הנייח.
- המקום על הרגליים בתוך כרית הנייח כך העובש לעטוף את הצד של הרגליים, גם ליצור חיץ בין הרגליים. ודא הנייח כרית מתחת לאגן פרושים על פני כפות הרגליים.
- הכנס והפעל לנפח בלון endorectal אלב אם קלינית הצביע לאדם המטפל.
- לבצע הקדמי-אחוריים (AP) ותמונות לרוחב (LAT) הצופים kilovoltage רנטגן (topograms) כדי לוודא כי המטופל יישור ממוטבת. זה כולל את האימות של יושר על התמונה AP ויישור המסתובבת על התמונה לרוחב. השתמש גם תמונות כדי להבטיח כי המעי הגז הוא מינימלי. מיצוב צריך כל להיות מתוקן, אישר עם תמונה חדשה. אם המעי הגז הוא ההווה מופרז, סלח המטופל לשירותים והפעל מחדש את התהליך של שלב 1.15.
- לאחר המטופל במיקום הרצוי, הסר את האוויר כרית הנייח באמצעות משאבת ואקום כפול של Q-fix לטופס תבנית מוצק סביב שלהם וכפות רגליים.
- כוונן באופן ידני את הטבלה הטיפול כך הכוונת לייזר הן ברמה של הירכיים החולה בקו האמצע של הירכיים, הבטן ברמה של מפרק הירך. ציין את מיקומי צלב דק על המטופל באמצעות עט סימון. למקם את סמני לוקליזציה הכוונת כדי לייעד נקודת התחלה עבור אימות סימולציה במהלך הלידה קרינה.
- CT ערכה סריקה פרמטרים כדי לכלול את אזור האגן מעמוד השדרה L3 עד אמצע הירך.
- סרוק את החולה באמצעות פרוטוקול סריקה הערמונית.
- לאשר הסריקה הוא מקובל לתכנון הטיפול. שלפוחית השתן צריכה להיות מלאה, פי הטבעת צריך אוויר מינימלית או שרפרף.
- לייצא את הקובץ סריקה דיגיטלית לתוכנת תכנון הטיפול והודע קרינה.
- תווית כרית הנייח החולה עם החולה מזהה, בטיפול שם הרופא, הגדרת ההוראות לפני אחסון עבור הבאים במהלך הטיפול.
- המשך שלב 2.1 אם המטופל עובר עיפרון קרן הפרוטונים טיפול. לדלג על שלב 3.1 אם המטופל יקבל טיפול פרוטון פיזור פסיבי.
2. הקרנות תכנון באמצעות עיפרון קרן טיפול
- לייבא את הנתונים הדמיית CT הטיפול תכנון תוכנה (TPS).
- השתמש טיפול מערכת תכנון עיצוב כלים להגדרת כל אמצעי האחסון גיאומטריות רלוונטיים בהתבסס על תמונות CT הנרכש. מבנים אלה כוללים את שלפוחית השתן, פי הטבעת, המעי הגס, המעי הגס קטן, ראש הירך, משטח הגוף החיצוני, fiducials, מרווח רקטלי, ו/או בלון endorectal.
- ליצור מתאר חיצוניים נוספים, אשר כוללת את הגוף, השולחן טיפול התקנים הנייח. מינון הקרינה יחושבו רק בתוך זה מתאר.
- Contour הכרך הראשון היעד קליניים (CTV1) כדי לכלול את הערמונית vesicles הזרע, מעורבים בלוטות הלימפה. CTV1 שייקבע 45.0 Gy (RBE). אמצעי האחסון CTV1 תהיה ההופעה של מבנה בצורת U על תמונות ההדמיה. רקמות רגילה קטן המעי, פי הטבעת, שלפוחית השתן ישכון בתוך האחסון בצורת U היעד.
- Contour הכרך השני היעד קליניים (CTV2) כדי לכלול את הערמונית ושלפוחיות הזרע. CTV2 שייקבע מנה הכוללת של Gy 34.2 (RBE).
- בחר שלוש קורות גנטרי בזוויות של 90, 180 ו 270 מעלות לטיפול של אמצעי האחסון CTV1. בחר רק 90, 270 מעלות קרן זוויות לטיפול CTV2.
- עיצוב שני מבנים חסימה גיאומטריים (הימנעות כרכים).
- ליצור אמצעי אחסון "אמצע הבלוק" הימנעות המקיף את רקמות רגילה בתוך האחסון בצורת U CTV1.
- לחסום את ההיבט נחות של קרן אחוריים-הקדמי (180 מעלות) מתחת למפלס העליון של הערמונית באמצעות "חלחולת-בלוק".
- ליצור הרחבה 7-מ מ איזוטרופיות של CTV1 כדי ליצור פרוטון תכנון אחסון של יעד, בשם pPTV1. השתמש את pPTV1 כדי להגדיר אמצעי אחסון מיקום נקודה כזו פרוטונים בראג פסגות (המכונה גם פרוטון "כתמים") ממוקמות על ידי ייעול התכנון כדי לכסות CTV1.
- כמו שלב 2.6, ליצור הרחבה דומה של אמצעי האחסון CTV2 בצורת pPTV2, אבל להשתמש הרחבה 8 מ מ בכיוון משמאל לימין והרחבות במרינות 5 מ מ בשני הכיוונים הקדמי-אחוריים, סופריור-נחות.
- כדי לאפשר אופטימיזציה חזקה, תכונה שיכולה להסביר הוודאות הגדרת טווח אי ודאות, מילוי גז משתנה של המעי, ליצור שני מלאכותיים ("שנדרסו") CT ערכות נתונים: הראשונה יש את כל המעי הדק, המעי הגס, הטבעת נדרסות כדי הצפיפות של אוויר, ואילו השני יש אחסון אלה מוחלפים לצפיפות של השריר.
- לפני אופטימיזציה, צור תוכנית טיפול חדשה CTV1. לייעד את המכונה טיפול פרוטון לשמש לתכנון, להקצות את המינון הקבוע ואת fractionation של Gy 45 (RBE) 25 שברים של הגדרת המטרה העיקרית להיות CTV1. להקצות 100% המינון הקבוע לכסות לפחות 98% נפח CTV1 באמצעות קורות כל 3 (נכון לרוחב, עזב לרוחב ו אחוריים-הקדמי).
- צור תוכנית טיפול נוסף עבור CTV2 2 סטים קרן. ראשית, להקצות Gy 18 (RBE) יועברו בחלקים 10 כדי CTV2 שימוש רק האלומה הלטראלי השמאלי והקצה Gy נמצא 16.2 (RBE) יועברו בחלקים 9 כדי CTV2 השימוש רק את הקרן הימנית. להקצות 100% המינון הקבוע לכסות 100% של אמצעי האחסון CTV2.
- להתכונן אופטימיזציה של התוכנית CTV1
- להקצות את המבנה אמצע הבלוק כמו שוליים טווח עבור הקורות לרוחב ולהקצות את מבנה הטבעת-בלוק כמו שוליים טווח עבור קרן אחוריים-קדמי.
- נתחיל אופטימיזציה אוטומטית (ברירת מחדל) הגדרות ריווח שכבת אנרגיה, ריווח ספוט של היעד שוליים.
- ציין את המספר המרבי של איטראציות של 40, מספר מרבי של אופטימיזציות לפני "הסינון ספוט" של 10, ומשקל מינימלי ספוט של יחידות צג 1.5. ספוט מסיר סינון פרוטון כתמים עם פחות מ- 1.5 צג יחידות, כמו שיש גבול מינימלי טכני על מספר הפרוטונים זה יכול להיות מועברת ע י המכונה טיפול.
- בסיבוב הראשון של מיטוב עבור CTV1, תייעד את המטרה pPTV1 להקים את הרשת של עמדות ספוט פרוטון. המטרות שצוינו הם 45.5 Gy (RBE) (משקל = 100) של pPTV1, עם הפחתת המינון של Gy 45 ל 0 (RBE) במרחק של 1 ס מ (משקל = 2).
- מתחילים סיבוב שני של אופטימיזציה עבור CTV1, על-ידי מחיקת המטרות pPTV1 לעיל. ואז לחדש אופטימיזציה עם יעדים חדשים, האובייקטיבי משקולות. ציין פרמטרים אלה כדלקמן לפתח תוכנית מאופנן בעוצמה, הידוע גם בשם שדה מרובה אופטימיזציה (MFO).
- עבור אמצעי האחסון החיצוני, להגדיר הפחתת מינון של Gy 45 ל 0 (RBE) במרחק של 1 ס מ, עם משקל של 2.
- עבור אמצעי האחסון CTV1, לקבוע מינון מינימלי של Gy 45 (RBE) עם משקל של 100.
- עבור אמצעי האחסון CTV1, להגדיר מנה אחידה של 45.5 Gy (RBE) ומשקל של 100. להגדיר מטרה זו חזקה.
- עבור אמצעי האחסון pPTV1, לקבוע את המינון המקסימלי Gy 46 (RBE) עם משקל של 100 ו להגדיר מטרה זו חזקה.
- עבור אמצעי האחסון הרקטום, להגדיר מנה מקסימלית של Gy 45.8 (RBE) עם משקל של 50. להגדיר מטרה זו חזקה.
- עבור אמצעי האחסון שלפוחית השתן, להגדיר מנה מקסימלית של Gy 45.8 (RBE) עם משקל של 50. להגדיר מטרה זו חזקה.
- המעי הדק, להגדיר מנה מקסימלית של Gy 45.8 (RBE) עם משקל של 50. להגדיר מטרה זו חזקה.
- המעי גדול, להגדיר מנה מקסימלית של Gy 45.8 (RBE) עם משקל של 50. להגדיר מטרה זו חזקה.
- בנוסף מטרות ספציפיות, להקצות חוסן הגדרות כדי להמתיק משמרות מיקום 5 מ מ, 3.5% טווח אי-וודאות, ולשלב את הנתונים מלאכותי CT ("שנדרסו") הנ אל הכתובת המעי הגז השתנות. להחיל את הגדרות חוסן אלה רק על המטרות שצוינו לעיל כמו "חזקים".
- להשלים אופטימיזציה עבור התוכנית CTV1 וסקור את תוכנית אופטימיזציה וכתוצאה מכך כדי להבטיח את המרשם המטרות הושגו.
- להתכונן אופטימיזציה של התוכנית CTV2
- השלם הראשון אופטימיזציה עבור התוכנית CTV2 באמצעות pPTV2 כדי להשיג רשת השמה ספוט כמו התכנית CTV1.
- למחוק את יעדי pPTV2 וחדש אופטימיזציה עם יעדים חדשים (אחוזים הם ביחס מרשם CTV2). עבור התוכנית CTV2, למטב את המטרות הללו עבור קרן ימינה ושמאלה בנפרד. דבר זה ידוע בתור אופטימיזציה שדה יחיד (SFO), יעדי בכל הקורה הם כדלקמן.
- עבור אמצעי האחסון החיצוני, הגדר של הפחתת מינון של Gy 34.2 (RBE) Gy 0 (RBE) בתוך מרחק של 5 מ מ ומשקל של 2.
- עבור אמצעי האחסון CTV2, לקבוע מינון מינימלי של Gy 34.37 (RBE) עם משקל של 120.
- עבור אמצעי האחסון CTV2, להגדיר מנה אחידה של Gy 34.54 (RBE) עם משקל של 100. להגדיר מטרה זו חזקה.
- עבור אמצעי האחסון pPTV2, להגדיר מנה מקסימלית של Gy 34.88 (RBE) עם משקל של 100. להגדיר מטרה זו חזקה.
- להשתמש באותן הגדרות חוסן עבור אופטימיזציה.
- להשלים אופטימיזציה עבור הקורות וגם הימנית ליצור 2 סטים של קרן תוכנית בנפרד. זה יאפשר המסירה של קרינה CTV2 באמצעות הקורות השמאלית או הימנית. זאת בניגוד CTV1 במינון משלוח, המחייב כל קורות 3 (RL LL, הרשות הפלסטינית) שישמש עבור כל טיפול.
- סקור את תוכניות טיפול CTV1 ו- CTV2 באופן עצמאי כדי להבטיח שיענו על האילוצים מנה עבור סרטן הערמונית הקרנה שהוקם על ידי ניסוי RTOG 012619. לסיכום.
- עבור אמצעי האחסון שלפוחית השתן, ודא כי אחוז רקמת קבלת 80 Gy הוא מתחת לגיל 15% אחוז קבלת 75 Gy הוא מתחת ל- 25%, אחוז קבלת 70 Gy הוא מתחת לגיל 35%, אחוז קבלת 65 Gy הוא פחות מ- 50%.
- עבור אמצעי האחסון רקטלי, ודא כי אחוז רקמת קבלת 75 Gy הוא מתחת ל-15% אחוז קבלת 70 Gy הוא מתחת לגיל 25%, אחוז קבלת 65 Gy הוא פחות מ- 35%, אחוז קבלת 60 Gy הוא מתחת ל 50%.
- עבור אמצעי האחסון הנורה הפין, ודא כי המינון הממוצע Gy מתחת 52.5.
- עבור אמצעי האחסון היעד CTV1 ו- CTV2, ודא כי לפחות 95% של שני הכרכים לקבל את המינון הקבוע.
- אם התוכניות ואת המינון הפצות לפגוש במינון המקובל אילוץ הנחיות ועמידות, לקבל אישור רופא ולייצא את התכניות למערכת טיפול משלוח.
- למדוד כדי לאשר את הדיוק של המינון המתוכנן שימוש במערכים יינון קאמרית, סוג של גלאי קרינה.
- ודא את הדיוק של חישוב מינון באמצעות תוכנת חישוב מינון המשני, עצמאית.
- סקור את תוצאות המדידה, תוצאות חישוב ומאפיינים טכניים של התוכנית עם פיזיקאי רפואי כדי להבטיח בקרת איכות.
- הפקת מסמכי התכנון טיפול ולאשר אותם על ידי dosimetrist התכנון, פיזיקאי, פיקוח רופא.
- טיפול כל תכנון נתונים למערכת משלוח טיפול עבור טיפול בחולים ולייצא לדלג על שלב 4.1 למסירה טיפול פרוטון.
3. קרינה תכנון טיפול עבור פיזור פסיבי או המדים סריקה פרוטון טיפול:
- לייבא נתונים הדמיה CT הטיפול קרינה תכנון המערכת.
- מתאר כל אמצעי האחסון גיאומטריות רלוונטיים בהתבסס על רכשה CT תמונות. מבנים אלה כוללים את שלפוחית השתן, פי הטבעת, המעי הגס, המעי הגס קטן, ראש הירך, משטח הגוף החיצוני, fiducials, מרווח רקטלי, ו/או בלון endorectal.
- ליצור מתאר חיצוניים נוספים. השתמש בכלי בוליאנית כדי לכלול בגוף השולחן טיפול, התקנים הנייח. מינון הקרינה יחושבו רק בתוך זה מתאר.
- CTV1 מתאר כדי לכלול את הערמונית vesicles הזרע, מעורבים בלוטות הלימפה. CTV1 שייקבע 45.0 Gy (RBE).
- CTV2 מתאר כדי לכלול את הערמונית ושלפוחיות הזרע. CTV2 שייקבע מנה הכוללת של Gy 34.2 (RBE).
- הרחב את CTV1 על ידי 7 מ מ כדי ליצור pPTV1 וליצור pPTV2 על ידי הרחבת CTV2 על ידי 7 מ מ לכל הכיוונים למעט 5 מ מ posteriorly.
- ליצור קורות הטיפול תכנון מערכת היעד pPTV1 ו- pPTV2. pPTV1 יהיה ממוקד באמצעות קרן יחידה 180° הרשות הפלסטינית בזמן pPTV2 יהיה ממוקד באמצעות קורות לרוחב 90° ו- 270 מעלות.
- הוסף אבני עבור כל הקורה עם שוליים המדים של 0.5 ס מ pPTV1 ומסוג pPTV2.
- באמצעות בחירת גודל בלוק ביותר האפשרי הקטן ביותר של גודל הצמצם קרן בהתבסס על הגודל של כל אמצעי אחסון pPTV. הצמצם קרן הוא גזיר פליז מותאם אישית אשר יצורף את החוטם גנטרי צורה הקצוות לרוחב של כל קרן הפרוטונים.
- מודל ורכיב שעווה המתאים הנדרש לעצב את דיסטלי והשמאליים הפרוקסימלית של כל קרן הפרוטונים על-ידי בחירת הפרמטרים המתאימים קרן כדלקמן.
- קלט ערך אי הוודאות בטווח של 3.5% בתוספת של נוסף 1-2 מ מ.
- קלט המרחק הפער האוויר המתאים בין הצמצם לבין החולה.
- חלקה, ימרחו את הצורה של מפצה על מעבר הצבע המינון הרצוי.
- הגדר את isocenters pPTV1, pPTV2 באותו המיקום עם המטרה של צמצום משמרות המטופל נדרש עבור משלוח קרן הפרוטונים.
- לחשב את המינון שימוש בפרמטרים נכנס צעדים 3.10.1-3.10.4 לתכניות היעד הן pPTV1 והן pPTV2.
- סקירה של תוכניות טיפול pPTV1 ו- pPTV2 באופן עצמאי, לסיכום כדי להבטיח שיענו את המינון אילוצים עבור סרטן הערמונית הקרנה שהוקם על ידי ניסוי RTOG 012619 שמתואר צעדים 2.17.1-2.17.4.
- במידת הצורך לא יושגו המטרות שהוצבו משוט והיעד לכיסוי במינון, ואז להתאים בפרמטרים block, ורכיב המיתאר כמוצג בשלבים 3.8-3.10 עד המטרות מושגות. פעם אחת הם השיגו את המטרות, לקבל אישור רופא והמשך שלב 3.14.
- לוודא דיוק החישוב במינון בתכנית המאושרת באמצעות חבילת תוכנה לחישוב מינון המשני, עצמאית.
- סקור את תוצאות המדידה, תוצאות חישוב ומאפיינים טכניים של התוכנית עם פיזיקאי רפואי כדי להבטיח בקרת איכות.
- סדר את רחובות ואת תברוג מן הספק המתאים.
- QA בלוקים תברוג קיבלו מהספק.
- הפקת מסמכי התכנון טיפול ולאשר אותם באמצעות חתימות דיגיטליות על ידי תכנון dosimetrist, פיזיקאי, פיקוח רופא.
- ייצוא כל טיפול תכנון נתונים למערכת משלוח טיפול לטיפול המטופל והמשך שלב 4.1.
4. קרינה טיפול משלוח
- ביום הראשון של הטיפול, בדוק כדי לוודא כי התוכנית קרינה תואם את הפרמטרים תוכנית במערכת טיפול.
- לארגן את חדר הטיפול לשחזר את הגדרת החולה במהלך CT הדמיה. להבטיח כי התווית כרית הנייח תואם את החולה מזהה ולאחר מכן מקם על השולחן טיפול עם יצירת האינדקס הנכון. המקום למשענת מנוצל ב סימולציה בראש הטבלה.
- לאשר עם המטופל הם יש להשלים את תהליך שלפוחית מלאה שונה לתוך שמלה טיפול.
- ללוות את החולה לחדר הטיפולים ולמקם אותו במצב פרקדן על השולחן טיפול עם הידיים חיבקה לרוחב החזה והרגליים בתוך כרית הנייח.
- הכנס והפעל לנפח בלון endorectal אם נעשה שימוש במהלך סימולציה.
- אלקטרונית הניעו את הטבלה טיפול טען כלפי isocenter כדי ליישר את החולה לסימנים הממוקמות במהלך סימולציה. להתאים את השולחן כדי לתקן שגיאות דוחה אצל המטופל מיקום כגון גובה, סיבוב, שהסב.
- ברגע החולה מיושר כראוי סימני סימולציה, להשלים את המשמרות מהמיקום start לאלה נקבע במהלך הטיפול דוזומטריות תהליך התכנון כדי ליישר למטופל הטיפול הרצוי isocenter.
- לבצע KV אורתוגונלית הדמיה כדי להבטיח יישור החולה פנימי תקין עצמות האגן, סמנים fiducial שבוצעה קודם לכן על-ידי אורולוגיה בתוך הערמונית.
- לקבוע אם נדרשות התאמות לפי מיקום מבוסס על שכיסה את התמונות KV הנרכש על צילומי רנטגן דיגיטלית המשוחזרת מהסריקה CT הדמיה התכנון. החל משמרות הדרושים כדי להבטיח יישור.
- אם KV תמונות מדגימות המעי מופרז גז, לשאול את המטופלת לגרש את האוויר בשכיבה על השולחן הטיפול במידת האפשר, ולאחר מכן ליישר מחדש, להתקין מחדש.
- אם החולה אינו מסוגל לשחרר על השולחן טיפול, בטל את הטיפול ויש לחולה ללכת לשירותים. לאחר המטופל חוזר מהשירותים, הפעל מחדש את תהליך המשלוח פרוטון מ 4.3 שלב.
- ברגע תמונות KV מקובל רכשה ואישר, קרן חרוט סריקת CT (CBCT) הושלמה כדי להעריך את שלפוחית השתן/פי הטבעת מילוי. להחיל כוונונים נוספים החולה מיקום מבוסס על הסריקה CBCT. כמו עם KV דימות מבוסס מיקום תיקונים, שינויים שנעשו באמצעות CBCT נתונים יישלחו ישירות מהמסוף הדמיה לטבלה טיפול עבור יישום אוטומטית.
- ודא כל התיקונים לפי מיקום עם הרופא המטפל לפני ביצוע הטיפול ביום הראשון של טיפול פרוטון.
- ליזום טיפול אספקה עם אימות נשמעים בין שני מטפלים גנטרי זווית, צג יחידות, מספר כתמים סריקה ושכבות, חוטם המיקום עבור כל זווית טיפול. פרמטרים אלה יוצגו במסוף טיפול, מסמכי התכנון חתום על ידי קרינה, פיזיקה, הרופא המטפל.
- לאחר הטיפול, לסמן את isocenter טיפול ליישור יומי ולהסיר את הסימנים.
- חזור על הצעדים 4.2-4.9 כל הטיפול הבאים שברים.
תוצאות
נתונים זמינים מצביע על יתרון משמעותי עם פרוטון טיפול עבור סרטן מסוימים,20,21. PT ייתכן המועדף עבור בחירה גידולים ילדים, סרטן חוזרים ונשנים באיזורים לקרינה בעבר או סוגי סרטן אחרים איפה הסיכון לפגיעה הרקמות גבוהה עם פוטון טיפול. בהמשך נדון על יישום ותועלת של פרוטון טיפול הערמונית, השד של medulloblastoma. המטרה שלנו היא לספק לקוראים הבנה טובה יותר של היישום של פרוטון טיפול עבור גידולים נפוץ אצל גברים, נשים וילדים.
בארצות הברית, סרטן הערמונית הוא ביותר מאובחנים כלל ממאיר גברים, הגורם השני בשכיחותו למוות מסרטן בקרב גברים. מקרים חדשים משוער 164,690 יאובחנו ב-2018, גברים מעל 29,000 תמות של המחלה. חולי סרטן הערמונית גרורתי-שאינם זכאים אפשרויות טיפול, כולל מעקב פעיל, ערמונית רדיקלית, ברכיתרפיה, קרינה חיצוני קרן פוטונים או פרוטונים22. הטיפול המדויק ההחלטות מתקבלות בהתאם אנטומיה החולה, מחלות רקע, שלב הגידול, שיקול דעת הרופא העדפות החולה.
קרינה משלוח עבור סרטן הערמונית בשלב מוקדם מוגבלת בלוטת הערמונית. במקרה של סרטן הערמונית בסיכון בינוני, מיועדים גם צינתור שלפוחית הזרע. למרות טיפולים הערמונית חלקית נידונות להיות, טיפול בלוטת כולו נשאר סטנדרטי של טיפול. האטם, מראש סאקרל, פנימי iliac וחיצוני iliac צמתים כלולים לעיתים קרובות עבור חולים עם מחלת ביניים, בסיכון גבוה שלילי.
לפני טיפול קרינה סמני התכנון, fiducial אפשר למקם להתיר תמונה מונחה טיפול באמצעות טיפול קדם kilovoltage הדמיה (כלומר., צילומי רנטגן רגיל)23. בנוסף, כרווח הידרוג עשוי גם להיות מוכנס לפני הדמיית CT כדי ליצור פער בין הרקטום הערמונית לקחת מנה נוספת מגבלת24,רקמות רקטלי25. במהלך הטיפול בתכנון, חולים צריכים ניתן לדמות במצב פרקדן עם האגן מתאושש שימוש בהתקן כרית אישית. בלון רקטלית אפשר למקם ב CT הדמיה להגבלת תנועה הערמונית וגם חוסר ודאות לגבי צפיפות ונפח רקטלי26. שלפוחית שתן מלאה בנוחות מומלץ להגביל את המינון ל המעי הדק ואת החלק הקדמי של שלפוחית השתן27. הדמיית MRI מומלץ גם להתיר מדויקת יותר המטרה אמצעי תיחום26.
טיפולים צריך להיות מתוכנן לספק מינונים של 75.6-79.2 ש-gy על הערמונית, במינונים של 45-50.4 Gy מומלצת בחירה סיקור קטרי או שלפוחית הזרע אזורים בסיכון למחלות מיקרוסקופי התפשטו9. שברים כל מועברים מדי יום ב- Gy 1.8-2 לכל שבר. ביניים, בסיכון גבוה בחולים שקיבלו דחיפה ברכיתרפיה, מינון הקרינה חיצוני קרן צריך להיות מוגבל Gy כ 45. ברכיתרפיה מינונים של 110 Gy אמור לשמש עם שתלים קבועים של קצב I-125 במינון נמוך. עם מינון גבוה שיעור ברכיתרפיה מועברת באמצעות קטטר, משטרי דחיפה נפוצים כוללים 13-15 Gy x 1 שבר, שברים Gy x 2 8 ל 11.5, שברים Gy x 3 5.5-6.5 ו- 4.0 to 6.0 Gy x 4 שברים9.
טיפול תכנון קרינה ממוטבת כדי להגביל את המינון ל שלפוחית השתן, פי הטבעת ואת המעי. דוזומטריות השוואות בין פוטון-לעומת פרוטון - הטיפול מבוסס (כלומר., IMRT לעומת טכניקות IMPT) הדגימו ממעט משופרת של מינונים רקמות רגילה עם הצגנו28.
התמותה ספציפי סרטן הערמונית נמצא מתחת לגיל 2% 10 שנים לגברים עם תחילת המחלה שלב22 ללא קשר לטיפול שנבחרו. עם מינון-התעצמה RT, בחולים בסיכון גבוה גם מראים תמותה מסוים של סרטן הערמונית נמוך של 5% בגיל 9 שנים29. התמותה נותר נמוך בעיקר בשל הזמינות של טיפולים מערכתית שנותרו יעיל בהגדרת גרורתי. תוצאות עם טיפול IMRT והן פרוטון נשארים מצוינים30,31. המחקר PARTIQoL (NCT01617161) הוא המחקר המתמשך, אקראי בין טיפול קרן הפרוטונים (PBT) ו IMRT לסרטן הערמונית סיכון נמוך, בינוני אשר בתקווה יקבע אם מודאליות אחת עדיפה על השני.
סרטן השד הוא ביותר מאובחנים כלל ממאיר נשים, הגורם השני בשכיחותו למוות מסרטן בקרב נשים בארה ב. מקרים חדשים משוער 268,670 יאובחנו ב-2018, נשים 41,400 ימותו של המחלה1. בניגוד סרטן הערמונית שבו רוב המטופלים מקבלים קרינה כטיפול, חולי סרטן השד לקבל הקרנות במשככי כדי להפחית את הסיכון של הישנות סרטן11. בהתאם של היקף הניתוח הנדרש, עשויות להיות ממוקדות קרינה השד שנותרה לאחר lumpectomy הגידול או על קיר החזה לאחר כריתה11,32. עשויות להיות ממוקדות הלימפה האזוריות בית השחי, supraclavicular ואזורי החלב פנימי אם הם נחשבים בסיכון הגידול התפשט.
לוחות זמנים לטיפול עבור חולים השד כרוכה בדרך כלל טיפול יומי פעם, חמישה ימים בשבוע. בתחילת שלב חולים מטופלים בדרך כלל עם מקובל fractionated (1.8-2.0 Gy/שבר; סה כ 50 Gy) או hypofractionated (Gy 2.67/שבר; סה כ Gy 40.05-42.56) משטרי11,33השד כולו. בחולים עם מחלה מתקדמת יותר, אך מקומי מטופלים עם fractionation המקובלת עד 50 Gy (1.8-2.0 Gy/שבר) לקיר כל השד או בחזה, הלימפה האזוריות. אלה מינונים יעילים למחלה תת-קליני אשר עשוי להיות נוכח בעקבות הניתוח.
CT הדמיה עבור הקרנות סרטן השד הושלמה בדרך כלל במצב פרקדן. בניגוד סרטן הערמונית, שתי הזרועות נחטפים תקורה להתיר חשיפת הרקמה קיר או חזה בחזה. בנוסף, התקן מותאם אישית מערסלת בעלת השד פנסיון מנוצלים לעיתים קרובות כדי לשתק את בית החזה באורבייטו כך מדויקים הוא מקביל הטבלה טיפול. פעולה זו מבטיחה כי רקמת השד לא נופל עליונית לאזור הצוואר.
חשיפה לקרינה ללב במהלך סרטן השד קשורה לסיכון מוגבר של מחלות עתידיות איסכמי34. כתוצאה מכך, טכניקות הפחתת מינונים הלב הם בחשיבות עליונה. גישה אחת היא להעסיק להחזיק לנשום עמוק-inspiratory (DIBH) כדי להגדיל את שטח intrathoracic, המרחק בין הלב לבין קיר החזה הקדמי/חזה. כפי שרומז השיטה, חולים שטופלו DIBH להשעות את המחזור הנשימה שלהם ולקבל טיפול בנקודת המקסימום של השראה. עם זאת, לא כל המטופלים מסוגלים לסבול חסימות נשימה של משך מספיק כדי לאפשר בטכניקה זו. אצל חלק מהחולים, שכיבה עשוי להיות יתרון, עלול לאפשר רקמת השד לתלות הרחק קריטי רקמות רגילה, כולל את הלב35. החיסרון של גישה זו היא המגבלה שומציבה ביכולת לאזורי היעד lymphatics. פרוטון טיפול ניתן להשיג במינון לב משמעותית ממעט ללא צורך DIBH ו36,נוטה טכניקות37.
טיפול פרוטון הוא מועסק לחולים בסרטן השד, הוכח להיות מעולה כדי טכניקות מבוססות פוטון ביחס מנה שמוטב השפעות על מבנים קריטיים כגון בריאות, לב38. קרן עיפרון בשדה יחיד סריקה התוכנית (PBS) עם טווח משנה-צורה היכולה לשמש לניהול הקרנות פרוטון החזה לקיר, צמתי אזוריים. גם יכול להיות מועסק גישות פיזור פסיבי. אם מספר שדות נדרשים לטיפול שהחזה לקיר, האזוריות צמתים בשל מגבלות שדה, אז השדה התאמת טכניקות חייב להיות מועסק. אסטרטגיה אחת היא להעסיק supraclavicular תואמות ושדות קיר החזה מתאימים עם פער העור של 2-4 מ מ מתחת הראש בריחי39. גבולות שדה מועברים במרחק 1 ס מ בנקודות זמן שונות במהלך הקורס קרינה כדי למזער את נקודות חמות וקרות.
תוצאות קליניות בקרינה בסרטן השד להפגין על ההישרדות של 50% עבור שלב מוקדם במחלה11 ו 37% עבור חולים מקומי מתקדם-20 שנה מעקב32. לאור תקופת הפוגה ארוכה, וצמצום של הטיפול הקשורות toxicity הוא דאגה גדולה. למרות טיפול פרוטון צפוי העלול להפחית סיכונים רעילות לבבית, שאלה זו נבדקת במשפט המתמשך RADCOMP Consortium (NCT02603341), אשר הוא סידור אקראי של נשים עם סרטן שד ל הקרנות פוטון או פרוטון.
סרטן נשאר הגורם השני בשכיחותו למוות אצל ילדים בגילאי 1-14 ב ארצות הברית ו הוא רק שעלתה על ידי תאונות. ב-2018, 10,590 ילדים יאובחנו עם סרטן, 1,180 ימותו שלהם ממאירות1. בקרב קבוצה זו, 250-500 חולים יאובחנו עם medulloblastoma. הגיל החציוני בהאבחנה של medulloblastoma הוא 4-6 שנים. לאור הסיכון גבוה עבור מעורבות השדרתי והפצה (30-40 אחוזים), craniospinal הקרנה (CSI) הוא סטנדרט של טיפול בחולים אלה, עם-80% לשרוד עם טיפול מתאים.
Medulloblastoma חולים הם מרובדת לקבוצות סיכון רגיל ולא בסיכון גבוה בהתבסס על גילם, הנוכחות של anaplasia או גרורות, כמות הגידול שיורית לאחר כריתה כירורגית. בכל מקרה, הטיפול כולל הקרנות לאחר הניתוח. RT עבור medulloblastoma כרוך הראשונית זירות פשע. בשביל מנה של Gy 23.4-36. מינון נוספים נתון אז אל המיטה הגידול להשגת מנה של 50.4-55.8 Gy כדי לאתר הגידול העיקרי40. שיקולים תכנוניים טיפול כוללים את המגבלה של המנות המרבי גזע המוח, חוט השדרה ועד 54 Gy 45 Gy, בהתאמה. CSI יכולה להיות מועברת באמצעות טיפול פוטון או פרוטון. הדמיית CT וטיפול לעיתים קרובות לדרוש הרדמה כדי להבטיח כי החולים לא לזוז במהלך הטיפול41.
עקב שטחים גדולים ממוקד עם קרינה, המבוסס על פוטון RT טכניקות תוצאה הקרנה משמעותית בחשיפה למבנים בית החזה והבטן והשתרשה עמוק בלבה חוט השדרה, כולל את הריאות, הלב, הכליות המעי, השד. אזורים אלה ייתכן יחוסו על מהקרינה עודף עם פרוטון טיפול (איור 3)42 PT מבוססת CSI דורש שני שדות לרוחב מעט אלכסונית כדי להאיר. השדרה הצווארי העליון של המוח, כמו גם קורות אחוריים-קדמית אחת או יותר ממוקד לאזורים צוואר הרחם, בית החזה, המותניים, סאקרל עמוד השדרה התחתון. מספר שדות נדרשים מאז המטרה CTV על CSI כולל את החלל כולו נוזל מוחי שדרתי (CSF) הנמתח מהקודקוד המוח אל תעלת השדרה דרך זנב הסוס ברמה של הצומת בחוליות S2/S3 (איור 3). אורך עמוד השדרה קובעת את המספר הכולל של שדות עמוד השדרה הנדרש לצורך טיפול. לגבול עליון של השדה בעמוד השדרה מעייניו נמצא תואם לגבול נחות של השדות הגולגולת. אם השדה עמוד השדרה לא יכול לכסות את עמוד השדרה כולו, שדה עמוד השדרה השנייה נמצא תואם לגבול נחות של השדה בעמוד השדרה העליון. תהליך זה עשוי להיות חזר אם השלישית שדה נדרש עבור חולים גבוה. עבור חולים מתחת לגיל 15, הגבול הקדמי של שדות עמוד השדרה יורחב לכלול את הגופות בחוליות כולו כדי להבטיח מנה הומוגנית העצם הנדרשות כדי למנוע צמיחה עתידית ליקויים בשלד המתפתח. עבור אלה מעל גיל 15, הגבול שדה עמוד השדרה הקדמי מורחב 2-3 מ מ מעבר תעלת השדרה לתוך עמוד השדרה.
פיזור פסיבי והטכניקות PBS כבר נעזרו CSI42,43. מטרותיה של CSI טיפול כוללים קרינה הומוגנית המינון ל נוזל מוחי שדרתי (CSF) לקצה התחתון של שק thecal (S2 או S3), המינון המלא לבסיס הגולגולת הקדמי הבסיסי, cribriform, וצמצום מינון למבנים אופטיים, הגבלה של בלוטת התריס לא יותר מ 5% של מרשם במינון, ומינימיזציה של המינון ל הוושט43.
פיזור פסיבי תכנון הטיפול מתחיל בדרך כלל עם הקמתה של שדות הגולגולת. תברוג טווח עם עריכה ידנית לעתים קרובות נדרש ליצור התפלגות במינון הומוגנית במוח תוך הגבלת מינון עיניים, שבלול. עבור שדות עמוד השדרה, תברוג הם מעובה ברמת בלוטת התריס כדי למזער את המינון. תשומת לב מיוחדת מוקדשת אז צמתי שדה בין השדות הגולגולת, עמוד השדרה, בין שדות מרובים בעמוד השדרה כאשר הדבר יידרש. אזור צומת מוגדר 1.25-1.5 ס"מ אורך שבו השדות להימצא. הצומת הוא זז בכיוון גולגולתי או סימטרית מדי שבוע כדי למנוע התפתחות של אזורים במינון חם או קר. באופן אידיאלי, סטיה מנה נשמרת בין 95-108% של המינון מרשם. שקלול שדה, צמצם עריכות, ורכיב עריכות מועסקים כדי להשיג את המטרה43.
חוקרים ב MD Anderson Cancer Center פיתחו אסטרטגיה הדרגתיים על CSI תכנון42. גישה זו כרוכה ההתפתחות של תוכנית כוח המשקיפים הרב-לאומי לטיפול בשדות עמוד השדרה הגולגולת והתחתון ולאחריו היצירה של תוכנית SFO לעמוד השדרה החזי. מעברי צבע במינון מנוצלים-צומת אזורים. התוכנית SFO תועתק ואז התוכנית הראשונית MFO לפתח תוכנית כוח המשקיפים הרב-לאומי הסופי ללא הפרדות צבע. עמוד השדרה צמתי יוזזו פעם אחת על ידי 2 ס מ מעל קורס 4 שבועות של טיפול. לעומת פיזור פסיבי CSI, PBS מבוסס CSI ניכר הצעות הפחתות מינון הקרינה עדשות, שבלול, בלוטות parotid אך במחיר של מינון מוגבר בבלוטת התריס42.
Medulloblastoma חולים יכול לצפות אירוע שיעורי ההישרדות ללא תשלום של 60-80% בהתאם רבדים הסיכון44. בהינתן אזור גדול של רקמות לקרינה עם החוקרת, ואת אופי רגיש של ילדים חולים, סיכונים תופעת לוואי לטווח ארוך הם ניכרים וכוללים ליקויי נוירוקוגניטיבי, ממאירות משנית, תפקוד לקוי של יותרת המוח, אובדן שמיעה, מחלות לב , בעיות פוריות, בלוטת התריס, vasculopathy, יובש בעיניים, היווצרות קטרקט, אובדן ראייה ו קרינה נמק/דלקת חוט השדרה. לכן, CSI מבוסס-פרוטון עשוי להציע יתרון משמעותי עבור חולים רבים.
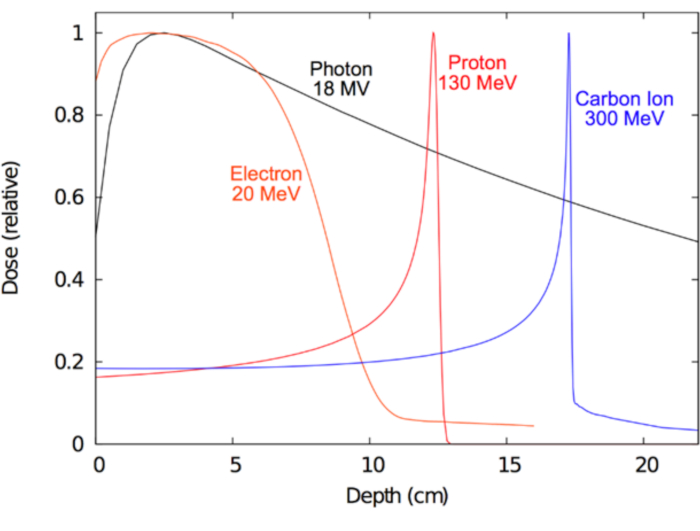
איור 1: עומק עקומות מנה עבור הקרנות. מינון הפצות כפונקציה של עומק המים המוצג עבור קורות קרינה קליניים שונים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
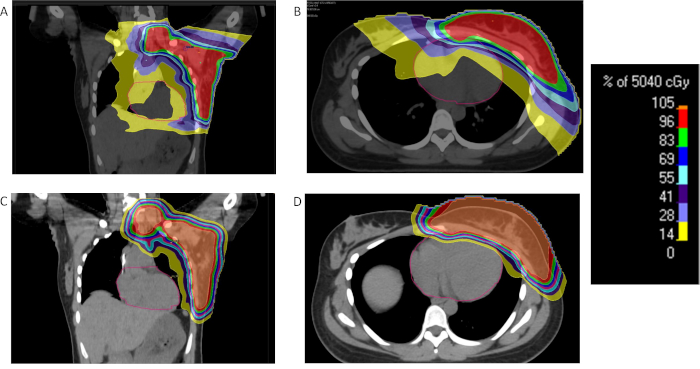
איור 2: השוואה של קרינה השד פרוטון, פוטון. אחוז מנה הפצה עבור חולה עם סרטן שד מתקדם מקומית הוכחת הפחתת מינון קרינה משמעותית ללב וקבלת טיפול בקרינה IMRT (, B) או פרוטונים (C, D), הריאות עם פרוטונים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
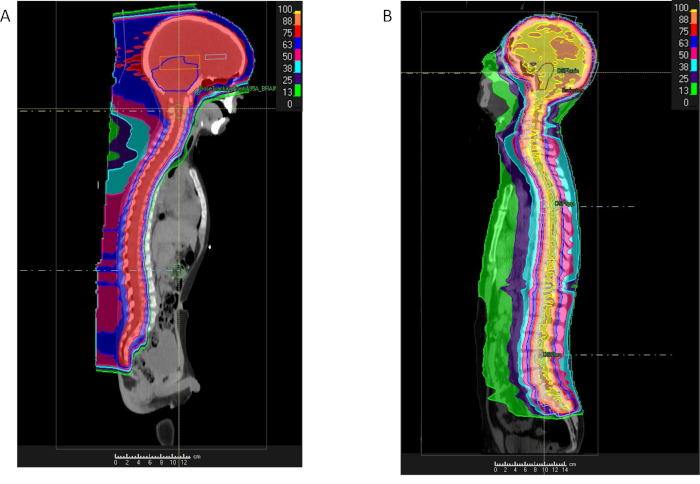
איור 3: השוואה של פרוטון, פוטון קרינה craniospinal. אחוז מנה הפצה עבור חולה עם medulloblastoma שקיבלו הקרנה craniospinal באמצעות פרוטונים (A) או IMRT (B) והקרנות ניכר המפגינים מנה הפחתת אינטרה-בית החזה והבטן אינטרה-אזורים עם פרוטונים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| פוטון | פרוטון | |
| סוג החלקיקים | בוזון | פרמיון ללא הפרדות צבע |
| תשלום [C] | 0 | +1.602 x 10-19 |
| המוני [kg] | 0 | 1.672 x 10-27 |
| ספין | 1 | 1/2 |
| Energy† [תהליך] | 0.1 - 25 | 10 - 250 |
| מקורות נפוצים | שפופרת רנטגן מאיץ, רדיואיזוטופים Co-60, | ציקלוטרון או מאיץ סינכרוטרון |
| שיטות משלוח | ממוקדת קורות מוצק, Multileaf Collimators, עוצמת אפנון, קשתות | פיזור פסיבי, סריקה מגנטית |
| † טווח אנרגיה משמש בדרך כלל לטיפול סרטן אנושיים | ||
טבלה 1: השוואה של הקרנות פרוטון, פוטון.
Discussion
תכנון טיפול קרינה ואספקה לסרטן הוא תהליך מאוד אישית אישית לכל מטופל בודדים וסרטן מסוים שלו. טיפול קרינה מודרני הוא תמונה מונחה תמונות CT המבוססות על התערבות שהתקבל במהלך קרינה. אישית תכנון הסימולציה. CT הדמיה הוא חובה כיוון שהוא מכיל תלת-ממדי (3D) מידע אנטומי על כימות המטופל, כמו גם מדויק הצפיפויות רקמות במקומות שונים בתוך הגוף, הדרושים לחישוב מינון. במהלך CT הדמיה, החולה ממוקם על שולחן ממונע. מספר התקנים מכניים הנייח מועסקים בדרך כלל כדי להגביל את התנועה המטופל במהלך דימות, במהלך הלידה RT עוקבות. בהתאם נדרש דיוק, אלה מכשירים נע בין כריות עובש-סוג פשוט ולרשתות פלסטיק, אשר מתאימות השטח המטופל, ואז להקשיח להגבלת תנועה, למכשירים פולשניים יותר כגון התקנים הגולגולת נוקשה זה הם קדחו במקום. לעיתים קרובות, הדיוק הנדרשת של המכשיר הנייח מוכתב על ידי הקרבה של רקמת הגידול למבנים הסמוכים קריטי. לדוגמה, המכשיר הנייח הכי פולשני, הילה ראש הנקדח במקום, משמש לעתים כאשר דיוק מילימטר אחד יש צורך לטפל בגידול ליד העיניים או העצבים האופטים כדי למזער את הסיכוי של עיוורון שעלולות להתרחש מן המטופל עובר לעמדה שגוי במהלך הטיפול.
CT הדמיה מידע משמש גם כדי לייעל את הרקמות הפנימיות אנטומיה. לדוגמה, distention שלפוחית השתן לעיתים קרובות מנוצל כדי למזער את שלפוחית השתן, המעי הגס קטן מינון החשיפה של הקרנה של הערמונית, כאמור בפרוטוקול לעיל. באופן דומה, אם הבטן בעיקר נפוחה עם אוכל במהלך סימולציה על הקרנה בבטן העליונה (למשל, קיבה, כבד, הוושט הדיסטלי), אז המטופל הוא מדומה מחדש לאחר המאפשר את האוכל לעבור הבטן ואת מערכת העיכול . זה לכווץ את הבטן, להקטין את הסיכוי של חשיפה לקרינה במהלך הקרנות של גידולים בבטן העליונה. במקרים שבהם בקיבה או שלפוחית השתן עצמם הם מטרות קרינה, הם עשויים להיות בכוונה נפוחה או ריקון כדי למטב את המינון הפצה.
במקרים מסוימים, הגידול הוא לא מספקת או בצורה אמינה מדמיין ב- CT אך עשוי לזהות בצורה מדויקת יותר באמצעות MRI או סריקה טומוגרפית. במקרים כאלה, סריקות PET או MRI משמשים להשלמת נתונים CT כיוון שהאחרון הוא עדיין הנדרשים לחישוב מינון. זו מושגת על-ידי רישום הדימויים MRI ו- PET CT תמונות לתכנון הטיפול. סריקות MRI מספקים לעתים קרובות הרבה ניגוד חזותי רב יותר, ברזולוציה גבוהה יותר מאשר CT, אשר עשוי להיות מועיל לזהות גבולות דק, ברקמות הרכות של הגידול כגון אלה במוח או הכבד. מחמד מספקת תצוגה פונקציונלי של ההתפלגות של מולקולות מעקב עם התווית רדיואקטיבי מוזרק לתוך החולה.
עולות כמה גידולים באזורים של בית החזה או הבטן שבו הם יכולים לנוע באופן משמעותי עם נשימה. כהתאמה תנועה זו להבטיח דיוק קרינה, סריקת סי 4-מימדי, סוג של "סרט-מצב" CT הדמיה, עשוי לשמש כדי ללכוד את האנטומיה החולה 3D כמו זה משתנה עם הזמן במהלך הנשימה. עבור כמה מטרות בית החזה והבטן, חגורות דחיסה או אמצעים אחרים של התנועה להפחתת הסיכון עשוי לשמש במהלך הטיפול כדי להגביל את התנועה ולהגביל ודאות לגבי מיקום הגידול45.
ברגע שהחולה מדומה לטיפול, תוכנית טיפול אישית מפותחת עם התחשבות של סרטן היסטולוגיה, מיקום הגידול, תכונות אנטומיים, אשר משפיעים על תצורת אופטימלית של קרינה קורות, סוגי חלקיקים, אנרגיות, מנה רמות עבור כל מטופל בודדים. עבור כל מטופל, תצורתן של מספר שאלות בסיסיות נחשבים בתחילה על ידי צוות רפואי לפתח תוכנית הטיפול האופטימלי. כנקודת התחלה, לבחור את הטופס המתאים ביותר של קרינה. אפשרויות כוללות פוטונים, אלקטרונים או פרוטונים. זה בדרך כלל מלווה את הבחירה של קרן angle(s) למסירה קרינה. רוב מכשירי RT כוללים מטופל רובוטית מיקום הטבלה, gantry מסתובב לאפשר RT קורות להיות מופנית אל החולה על ידי כמעט מכל זווית. ההחלטה כרוך במציאת הנתיב הפוגעת באופן היעיל ביותר את המטרה עם RT ומונעת הכי טוב ללא-מטרות שעשויים להיות בדרך של הקורות שנבחרו. במקרים מסוימים, זוויות קרן נקבעים על-ידי מערכת התכנון עצמו לאחר הזנת בקרינה מטרות עבור גידולים, רקמות רגילה. תהליך זה הנקרא "תכנון הופכי", לעיתים קרובות נעשה במקרה של IMRT, אשר כרוך הכוח ויסות עוצמת מרובות, נכנסות קרינה קורות באופן תלוי-זמן מספק מנה היעד אחיד אך עלול להוביל במינון מאוד לא אחידה מחוץ למטרה. למרות שני הפוטונים או פרוטון טיפול עשוי להיות בעוצמה מאופנן, ההופכי תכנון מנוצל במידה רבה על פוטון מבוסס IMRT בלבד. אם מוצק קרינה קורות כדי לשמש, collimators מתכת מותאם אישית יכול להיות מפוברק כדי להתאים את הצורה של קרן קרינה עם הצורה של הגידול.
אם נבחר טיפול פרוטון, ואז החלטה עוקבות צריך להיעשות לגבי השימוש פיזור פסיבי או טכניקות PBS. במקרה של PBS, נדרשת החלטה נוספת בנוגע לשימוש MFO או אסטרטגיות שדה יחיד אופטימיזציה/יחיד-שדה אחיד מינון (SFO/SFUD). בטיפולי כוח המשקיפים הרב-לאומי, קורות מרובות נדרשים לטפל בגידול במהלך כל שבר מאז כל קרן מטרות רק חלק של המטרה. לעומת זאת, בשביל SFO תוכניות, בכל הקורה מכסה את היעד. כוח המשקיפים הרב-לאומי פייבוריט לעיתים קרובות גידולים ליד מבנה קריטי (למשל., גידול במוח ליד עצב הראייה) שבו מגוון רחב של זוויות קרן עשוי להיות יתרון לפסל במינון הקרינה. כוח המשקיפים הרב-לאומי אסטרטגיות גם להבטיח כי כל קרינה הקורות/הנקודות "מסתיימת טווח" לתוך באותו אזור שבו המינון יכול להיות עקב האפקט בראג שיא גבוה באופן בלתי צפוי. מצד שני, SFO פייבוריט מטרות ליד אזורים של אי וודאות אנטומיים, כגון בלוטת הערמונית אשר ניתן להעביר בשל שלפוחית השתן דיפרנציאלית, מילוי רקטלי. SFO מספק חסינות משופרת במינון שינויים עקב סטיות אנטומיים.
ברגע התכנונית בסיסי הוחלט לשלב הבא של תכנון טיפול כוללת בדרך כלל אופטימיזציה של שדות קרינה. האנרגיה, עוצמת התפוצה המרחבית (משתנה במרחב השטף) של קרינה נכנסות הן בחינם בדרך כלל הפרמטרים אופטימיזציה. יחד עם ייצוג גדול מטריקס תלת-ממד של האנטומיה החולה על ידי CT, משתנים חינם אלה להוביל בעיה מאוד גדולה גודל ואופטימיזציה גדולים המתאימים מטריצות (למשל, אלפי ערכים CT ואלפי קרן אפשרי עוצמות עליך לקחת בחשבון). מטריצות אלה ממוסגרים בתוך פונקצית המטרה, וזה ניסוח מתמטי של המטרה של תכנון הטיפול. כפי שהוזכר לעיל, מטרות הטיפול הן עדיפות להשיג קודם את המינון הקבוע אל המטרה, ושנית כדי להשיג נמוך של מנה כמו אפשרי רקמות רגילה. כדי למזער פונקציה זו המטרה, כוח מיחשוב גבוהה רצוי לבצע במהירות חישובים תחבורה RT that לאכלס מטריצות, שיטות אופטימיזציה מספריים, כגון אלגוריתמים הדרגתי-חיפוש, משמשים כדי לחפש במהירות קיצון מקומי ב הפונקציה. קיצון אלה תואמות לתוכניות הטיפול האופטימלי עבור כל מטופל ייחודיים. לא ניתן להפריז את התפקיד של מחשבים בתכנון הטיפול. טיפול קרינה מודרני ו רדיולוגיה אבחון לא הייתה מתאפשרת ללא התקדמות המחשב של שלושת העשורים האחרונים.
כשלב הסופי, תוכנית טיפול מיטבי נבדק על ידי צוות רפואי (רופא, dosimetrist ו פיזיקאי). במקרים רבים, התוכנית עשויה להיות הותאם נוסף או ממוטב מחדש עם מטרות שונות כדי לשפר את האיכות הכוללת. לאחר התוכנית נמצא מיטביות, הפרמטרים הטכניים של התכנית נבדקו על ידי פיזיקאי והעבירו אל המכונה טיפול משלוח.
במקרים רבים, המטופל חוזר לשברים טיפול מרובים (פגישות), לעיתים קרובות בכל יום בשבוע במשך מספר שבועות. Fractionation הנמשך ניתן להעצים תופעות לוואי הנוצרות על-ידי קרינה חריפה, אך עשוי להפחית את הפוטנציאל מאוחר, חמורות יותר תופעות לוואי של RT לעומת טיפול יחיד, שבר12. שבר ריבוי הגישות הן האופטימלי עבור גידולים במהירות מחלקים או אין אפשרות לתקן את הנזק לא קטלני RT. עם זאת, הדבר תלוי באתר הטיפול המדויק ואת הרגישות של רקמות רגילה הסמוך. מאז המטרה של משלוח טיפול קרינה היא לנהל את אותו הטיפול במהלך כל שבר, אפילו בעוד כמה מילימטרים של תנועה או אי-וודאות במיקום החולה עלול להוביל ההשפלה של תוכנית טיפול טיפול חלקיקים. מסיבה זו, התמונה ב- board הדרכה מערכות הם בחשיבות עליונה במהלך multifraction imagers RT. רנטגן, סריקות CT קרן חרוט או imagers משטח אופטי, סריקה בלייזר הינם כולם זמינים למטרה זו. התקנים אלה היתר הקרנות תמונה מונחה (IGRT) באמצעות ההדמיה של ציוני דרך אנטומיים, הגידול מטרות או מחליף אטום סמנים fiducial. הדימויים IGRT לעומת הסריקות סימולציה המקורי, מותאם לפי הצורך לפני כל שבר של קרינה.
למרות היתרון מגוון מוגבל של פרוטון טיפול, אשר מגביל את המינון יציאה, הדיוק של טווח חיזוי ראיתי בדרך כלל בתכנון הטיפול הוא גודל כמה מילימטרים. אובדן האנרגיה המדויק ברקמות שונות החולה אינו ברור, קודם כל, מאז הרכיבים מולקולרית המדויק של הרקמה אינם חד משמעיים, וקצר, שנית, מאז האנטומיה החולה משתנה לאורך זמן, שניהם על צירי זמן (למשל, נשימה), צירי זמן ארוך יותר (למשל, ירידה במשקל, הצטמקות הגידול, אנטומיה נורמלי שינויים). כדי לטפל אי ודאות זו, "שוליים דיסטלי" נוסף לאמצעי האחסון של יעד זה שוליים נוספים של רקמה נורמלית מעבר העומק המרבי הגידול. שוליים כזו מבטיחה כי אפילו עם אי הוודאויות של טווח חיזוי, יטופלו העומק כל הגידול עם ביטחון עצמי גבוה. למרבה הצער, השוליים הרקמות יכול כתוצאה מכך ייחשפו את המינון המלא RT, אשר יכול להוביל שעשויות להיות תופעות לוואי משמעותיות של RT בתוך הרקמה הזו. לעומת זאת, כמו פוטונים לא להפסיק אך מעדיף לצאת את המטרה, אין שוליים דיסטלי כזה יש צורך לפצות את טווח אי-וודאות. שוליים גיאומטריות משמש עדיין בטיפול פוטון על אי-הודאות לפי מיקום הכתובת של היעד, אך פוטונים רגישים הרבה פחות מאשר פרוטונים המצב המדויק של המטופל רקמות במעלה הזרם של היעד. לכן, השוליים הדרושים יכול לפעמים להיות קטנה עבור פוטונים פרוטונים. זה יכול להיות מובן על ידי בהתחשב פרוטונים עוברים אובדן אנרגיה מתמשכת ברקמות מאוד להשפיע על המיקום של הטווח שלהם, ואילו פוטונים לא טעונים, לנוע בחופשיות בחלל הריק בין אטומים אורביטלי שלהם, מלבד נדירים התנגשויות עם אלקטרונים או גרעינים. צפיפות גדולה ההבדלים בתוך הרקמה, למשל., חפצים מתכתיים או אוויר חללים, עם זאת, פוטון במינון כמו גם מנה פרוטון, אך בעוצמה נמוכה יותר של השפעה.
אי-וודאות הסופית וחשוב מתייחס היעילות radiobiological (RBE) של צורות שונות של קרינה. RBE הוא היחס של מינונים, סוג קרינה הפניה, סוג קרינה בדיקה, בתנאי כי שני סוגי הקרינה לייצר את אותה ההשפעה הביולוגית. גבוה יותר RBE את, יותר נזק הקרינה לכל יחידת אנרגיה התצהיר ברקמות. היחס RBE מוגדרת ביחס קרינת פוטונים. למרות תיאור פשוטה, יש למעשה ודאות לגבי הערכים RBE עבור חלקיקים טעונים בניגוד פוטונים. הבדלים בין ההפצות במינון מרחבית בין פוטונים חלקיקים טעונים את המשקל מיקרומטר ו ננומטר להוביל הבדלים ביולוגיים אפקט, אפילו כאשר במינונים מאקרוסקופית זהים. זה יכול להיות מובן על ידי בחינת דפוסי המרחבי נזק לדנ א לאחר חשיפה חלקיקים טעונים מינונים שונים, אנרגיות שונות. אנרגיות שונים וחיובים שונים של פרוטונים (+1), פחמן יונים (+6) להוביל ההבדלים העברת האנרגיה בעומקים שונים אצל המטופל, ואילו על פוטונים, העברת האנרגיה היא וזהובה התחתון גם הומוגנית ברחבי המטופל. אמנם תיאורטית מובן, יש דיון משמעותי בקהילה קרינה לאונקולוגיה לגבי היכולת לחזות במדויק תופעות כאלה וחיסונים. לטיפול יון פחמן, יש חוסר הסכמה על הדרך הטובה ביותר ליצור מודל אפקטים ביולוגיים אלה, אך קיימת הסכמה כי תופעות כאלה חייבים להיות המודל לספק טיפול. עבור פרוטונים, מרכזי ביותר קליני כרגע תוכנית טיפול ללא מידול מפורשת של תופעות RBE, למעט שימוש מקדם תיקון קבוע של 1.1, אך זו עשויה להשתנות בעתיד הקרוב כמו מערכות תכנון הטיפול מסחרי חדש מתחילים כוללים ביולוגית מידול כלי תוכנה לדגמן את RBE של טיפול פרוטון.
עם השלמת בניית מחקרים אקראיים, כולל RADCOMP, PARTIQoL ו- RTOG 1308, אנחנו אמורים. לקבל תשובות יותר מוחשי לאיזה סוגי קרינה עשוי להיות מעולה של השד, הערמונית סרטן ריאות, בהתאמה. מחקרים דומים מתוכננים עבור אתרים אחרים המחלה שעשויים לסייע לזיהוי טוב יותר את המודאליות הטיפול הטוב ביותר עבור סוגי סרטן אלה. עם זאת, יש כבר מספיק נתונים כדי להציע העליונות של פרוטונים שהגדרות מסוימות, במיוחד באוכלוסיית ילדים, איפה הרקמות ניכר ממעט יכול לצמצם במידה ניכרת תחלואה של רעילות, כולל משני ממאירות.
Disclosures
A.H. יש honoraria של חברת Astrazeneca, באייר נוברטיס. A.H. יש להתייעץ עם חברת Astrazeneca, בריסטול מאיירס סקוויב ו באייר, היה נואם עבור קרן צרפת.
Acknowledgements
ס. ר מאשר מענק למימון התוכנית NIH פירעון ההלוואה. A.H. קיבלה מימון באייר, קלוביס, הכוכבים, Agensys, Sotio, Cerulean ו Calithera.
Materials
| Name | Company | Catalog Number | Comments |
| Proton beam cyclotron and gantry delivery system | Varian | N/A | Allows for generation and delivery of protons for radiotherapy |
| kVUE One Proton Couch Top | Qfix | RT-4551KV-03 | Permits patient placement for radiotherapy |
| CT simulator with 4D scanning capability | GE | N/A | Permits CT simulation for radiation planning |
| 100" x 70" Qfix VacQfix Cushion | Qfix | RT-4517-10070F30 | Immobilizes patient for more precise radiation delivery |
| Timo Foam Head Support | Qfix | RT-4490-F | Ensures minimization of head motion during radiotherapy |
| 3 CT Localizers Localization Markers | Beekley Medical | REF 211 | Ensures concordance of external markers and internal patient anatomy from CT simulation |
| VacQfix Indexer | Qfix | RT-4517-IND01 | Ensures VacQfix cushion placement is reproducible for every radiatiion treatment |
| Radiation treatment planning software | Raystation | N/A | Allows for personalized radiation planning for every tumor with robust optimization and multi-criteria optimization |
| Proton Range Compensator | .Decimal | RC-AC 1018 | Adjusts the range of the proton beam to achieve distal dose conformality |
| Proton Beam Aperture | .Decimal | AP-BR 1800 | Shapes the proton beam treatment area |
| Proton Range Shifter | .Decimal | RS-AC 1018 | Adjusts proton beam tissue depth penetration |
| Endorectal Balloon | Radiadyne | ILG-90F | Ensures uniform rectal filling and prostate positioning |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Barton, M. B., et al. Estimating the demand for radiotherapy from the evidence: a review of changes from 2003 to 2012. Radiotherapy and Oncology. 112 (1), 140-144 (2014).
- Pan, H. Y., et al. Supply and Demand for Radiation Oncology in the United States: Updated Projections for 2015 to 2025. International Journal of Radiation Oncology Biology and Physics. 96 (3), 493-500 (2016).
- Reed, A. B. The history of radiation use in medicine. Journal of Vascular Surgery. 53 (1 Suppl), (2011).
- T Landsberg, P. . Nobel Lectures in Physics, 1901-1921. 18, (1967).
- . Non-small cell lung cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (2018)
- . Pancreatic Adenocarcinoma Available from: https://www.nccn.org/professionals/physician_gls/pdf/pancreatic.pdf (2017)
- . Breast cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf (2017)
- . Prostate Cancer Available from: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf (2017)
- Chang, J. Y., et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncology. 16 (6), 630-637 (2015).
- Fisher, B., et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. The New England Journal of Medicine. 347 (16), 1233-1241 (2002).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. , (2012).
- Lomax, A. J. Charged particle therapy: the physics of interaction. The Cancer Journal. 15 (4), 285-291 (2009).
- Rossi, B., Greisen, K. Cosmic-Ray Theory. Reviews of Modern Physics. 13 (4), 240-309 (1941).
- Blakely, E. A., Chang, P. Y. Biology of charged particles. The Cancer Journal. 15 (4), 271-284 (2009).
- Schardt, D., Elsässer, T., Schulz-Ertner, D. Heavy-ion tumor therapy: Physical and radiobiological benefits. Reviews of Modern Physics. 82 (1), 383-425 (2010).
- Chun, S. G., et al. The Potential of Heavy-Ion Therapy to Improve Outcomes for Locally Advanced Non-Small Cell Lung Cancer. Frontiers in Oncology. 7 (201), 1-3 (2017).
- Pan, H. Y., Jiang, J., Shih, Y. T., Smith, B. D. Adoption of Radiation Technology Among Privately Insured Nonelderly Patients With Cancer in the United States, 2008 to 2014: A Claims-Based Analysis. Journal of the American College of Radiology. 14 (8), (2017).
- Michalski, J. M., et al. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncology. , (2018).
- Glimelius, B., et al. Number of patients potentially eligible for proton therapy. Acta Oncologica. 44 (8), 836-849 (2005).
- Doyen, J., Falk, A. T., Floquet, V., Herault, J., Hannoun-Levi, J. M. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treatment Reviews. , 104-112 (2016).
- Hamdy, F. C., et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. New England Journal of Medicine. 375 (15), 1415-1424 (2016).
- Ng, M., et al. Fiducial markers and spacers in prostate radiotherapy: current applications. British Journal of Urology International. 113, 13-20 (2014).
- Hedrick, S. G., et al. A comparison between hydrogel spacer and endorectal balloon: An analysis of intrafraction prostate motion during proton therapy. Journal of Applied Clinical Medical Physics. 18 (2), 106-112 (2017).
- Hamstra, D. A., et al. Continued Benefit to Rectal Separation for Prostate Radiation Therapy: Final Results of a Phase III Trial. International Journal of Radiation Oncology Biology Physics. 97 (5), 976-985 (2017).
- Wortel, R. C., et al. Local Protocol Variations for Image Guided Radiation Therapy in the Multicenter Dutch Hypofractionation (HYPRO) Trial: Impact of Rectal Balloon and MRI Delineation on Anorectal Dose and Gastrointestinal Toxicity Levels. International Journal of Radiation Oncology Biology Physics. 99 (5), 1243-1252 (2017).
- Chen, Z., Yang, Z., Wang, J., Hu, W. Dosimetric impact of different bladder and rectum filling during prostate cancer radiotherapy. Radiation Oncology. 11, 103 (2016).
- Rana, S., et al. Dosimetric and radiobiological impact of intensity modulated proton therapy and RapidArc planning for high-risk prostate cancer with seminal vesicles. Journal of Medical Radiation Sciences. 64 (1), 18-24 (2017).
- Rodda, S., et al. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer. International Journal of Radiation Oncology Biology Physics. 98 (2), 286-295 (2017).
- Zietman, A. L., et al. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09. Journal of Clinical Oncology. 28 (7), 1106-1111 (2010).
- Al-Mamgani, A., Heemsbergen, W. D., Peeters, S. T., Lebesque, J. V. Role of intensity-modulated radiotherapy in reducing toxicity in dose escalation for localized prostate cancer. International Journal of Radiation Oncology Biology Physics. 73 (3), 685-691 (2009).
- Ragaz, J., et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial. Journal of the National Cancer Institute. 97 (2), 116-126 (2005).
- Whelan, T. J., et al. Long-term results of hypofractionated radiation therapy for breast cancer. New England Journal of Medicine. 362 (6), 513-520 (2010).
- Darby, S. C., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. New England Journal of Medicine. 368 (11), 987-998 (2013).
- Wroe, A. J., Bush, D. A., Schulte, R. W., Slater, J. D. Clinical immobilization techniques for proton therapy. Technology in Cancer Research and Treatment. 14 (1), 71-79 (2015).
- Shah, C., et al. Cardiac dose sparing and avoidance techniques in breast cancer radiotherapy. Radiotherapy and Oncology. 112 (1), 9-16 (2014).
- Patel, S. A., et al. Postmastectomy radiation therapy technique and cardiopulmonary sparing: A dosimetric comparative analysis between photons and protons with free breathing versus deep inspiration breath hold. Practical Radiation Oncology. 7 (6), e377-e384 (2017).
- Depauw, N., et al. A novel approach to postmastectomy radiation therapy using scanned proton beams. International Journal of Radiation Oncology Biology Physics. 91 (2), 427-434 (2015).
- MacDonald, S. M., et al. Proton therapy for breast cancer after mastectomy: early outcomes of a prospective clinical trial. International Journal of Radiation Oncology Biology Physics. 86 (3), 484-490 (2013).
- Merchant, T. E., et al. Multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma. International Journal of Radiation Oncology Biology Physics. 70 (3), 782-787 (2008).
- McMullen, K. P., Hanson, T., Bratton, J., Johnstone, P. A. Parameters of anesthesia/sedation in children receiving radiotherapy. Radiation Oncology. 10, 65 (2015).
- Stoker, J. B., et al. Intensity modulated proton therapy for craniospinal irradiation: organ-at-risk exposure and a low-gradient junctioning technique. International Journal of Radiation Oncology Biology Physics. 90 (3), 637-644 (2014).
- Giebeler, A., et al. Standardized treatment planning methodology for passively scattered proton craniospinal irradiation. Radiation Oncology. 8, 32 (2013).
- Gajjar, A., et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncology. 7 (10), 813-820 (2006).
- Lin, L., et al. Evaluation of motion mitigation using abdominal compression in the clinical implementation of pencil beam scanning proton therapy of liver tumors. Medical Physics. 44 (2), 703-712 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved