Method Article
استخدام رقائق موائع جزيئية البلاستيك قبل تجميع لتجزئة الخلايا العصبية مورين الأولية
In This Article
Summary
ويصف هذا البروتوكول استخدام رقائق البلاستيك للثقافة، وتقسيم الخلايا العصبية مورين الأولية. هذه الرقائق ستنشئ وسهلة الاستخدام ومتوافق مع عالية الاستبانة، ويعيش، وتصوير الأسفار. هذا البروتوكول وصف كيفية لوحة الفئران الخلايا العصبية هيبوكامبال داخل هذه الرقائق وأداء عزل فلويديك وأكسوتومي وإيمونوستينينج.
Abstract
أساليب ميكروفابريكاتيد لتقسيم الخلايا العصبية أصبحت أدوات أساسية للعديد من علماء الأعصاب. ويصف هذا البروتوكول استخدام شريحة بلاستيكية قبل تجميع متوفرة تجارياً لتجزئة الفئران الابتدائي مثقف هيبوكامبال الخلايا العصبية. هذه الرقائق البلاستيكية، الواردة ضمن البصمة من شريحة مجهر القياسية، تتوافق مع عالية الاستبانة، ويعيش، وتصوير الأسفار. هذا البروتوكول يوضح كيفية إلى الوراء تسمية الخلايا العصبية عبر محاور عصبية معزولة باستخدام فيروس السعار تعديل ترميز بروتين فلوري وإنشاء ميكرونفيرونمينتس معزولة داخل حجرة واحدة، وأداء أكسوتومي وإيمونوسيتوتشيميستري على شريحة. يتم استزراع الخلايا العصبية > 3 أسابيع داخل رقائق البلاستيك، مما يوضح مدى توافق هذه الرقائق للثقافات العصبية طويلة الأمد.
Introduction
ثقافة العصبية التقليدية باتباع نهج يؤدي ثمرة عشوائية من محاور عصبية و dendrites، التي تحول دون دراسة الخلايا العصبية في مورفولوجيا الاستقطاب بهم فريدة من نوعها. أجهزة مولتيكومبارتمينت ميكروفابريكاتيد قد أصبحت أدوات بحثية راسخة واستخداما جيدا لعلماء الأعصاب في السنوات 10-15 الماضية (منشورات رفيعة مختارة هي المشار إليها1،،من23 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17). هذه الأجهزة تقسيم الخلايا العصبية وتوفر أسلوباً جسديا وكيميائيا التلاعب بالمناطق سوبسيلولار من الخلايا العصبية، بما في ذلك سوماتى، dendrites، ومحاور عصبية، ونهايات18،19. كما أنها توفر النماذج التجريبية المتعددة التي لا يمكن استخدام عشوائي الثقافات، بما في ذلك دراسات النقل محواري محواري البروتين، إكسون الإصابة/التجديد، وإشارات إكسون-إلى-سوما. 2-حجرة التكوين الأساسي يتكون من قناتين موائع جزيئية متوازية مفصولة بواسطة سلسلة من أصغر ميكروجروفيس عمودي. يتم مطلي الخلايا العصبية الأولية أو المستمدة من الخلايا الجذعية في إحدى القنوات موائع جزيئية وتسوية ونعلق على السطح السفلي للجهاز، وتمديد نيوريتيس على مدى الأيام. العديد من النمو الأقماع تجد طريقها إلى ميكروجروفيس، وصغيرة بما يكفي أنها تمنع الهيئات الخلية من الدخول. نظراً للنمو والأقماع وتقتصر ماديا وغير قادر على تشغيل جميع أنحاء داخل ميكروجروفيس، أنها تنمو مباشرة إلى حجرة مجاورة (حجرة محواري) حيث أنهم معزولون.
تاريخيا، هذه الأجهزة قد تم مصبوب باستخدام poly(dimethylsiloxane) (PDMS) من العفن رئيسي فوتوليثوجرافيكالي منقوشة وأدلى داخلية في مختبرات المحققين أو شراؤها تجارياً. أحد العوائق الرئيسية لاستخدام PDMS هو ما هيدروفوبيسيتي20. PDMS يمكن إجراء ماء مؤقتاً، ولكن ثم سرعان ما تصبح مسعور في غضون ساعات في بيئة غير مائية20. وبسبب هذا، يجب أن تكون الأجهزة متصلة ساترة من زجاج أو غيرها الركازة مناسبة في وقت الاستخدام. قبل تجميع رقائق البلاستيك مولتيكومبارتمينت الآن متوفرة تجارياً (مثلاً، إكسوناتشيبس) بحقن مصبوب البلاستيك. وتصنع هذه الرقائق ماء بشكل دائم، تبسيط ترطيب الجهاز والسماح للجمعية قبل رقاقة مع طبقة رقيقة من دوري اوليفينيه كوبوليمر (COC) أرفق القنوات موائع جزيئية في الجزء السفلي. هذه الرقائق مصطنعة في بلاستيك شفاف بصريا مناسبة لتصوير الفلورية ذات الدقة العالية.
والغرض من هذا البروتوكول للتدليل على استخدام رقائق موائع جزيئية البلاستيك قبل تجميع لنماذج تجريبية متعددة إجراء باستخدام الخلايا العصبية هيبوكامبال أو القشرية مورين. هذا البروتوكول، توضح هذه المقالة كيفية الوراء تسمية الخلايا العصبية باستخدام فيروس السعار معدلة داخل الرقاقة. كما يتم وصف أكسوتومي للدراسات الإصابة إكسون والتجدد. وأخيراً، هذا البروتوكول يوضح كيفية تنفيذ immunostaining الأسفار مع الجهاز.
Protocol
ملاحظة: يبين الشكل 1A، بتخطيطي للرقاقة مولتيكومبارتمينت البلاستيك. الرقاقة هو حجم شريحة مجهر القياسية (75 مم × 25 مم). ميزات الرقاقة، بما في ذلك القنوات الرئيسية أو حجرات وآبار ميكروجروفيس المسماة وترد للرجوع إليها في المستقبل. الشكل 1 صورة فوتوغرافية للرقائق مما يدل على عزل فلويديك من المقصورات.
1-إعداد وطلاء من رقائق مولتيكومبارتمينت
- في خزانة سلامة الأحيائية، وضع الرقائق في طبق بتري أو حاوية معقمة مناسبة أخرى.
- إضافة 100 ميليلتر من قبل طلاء الحل للعلوية اليسرى من الرقاقة جيدا والسماح تتدفق من خلال القناة الرئيسية المجاورة أيضا.
ملاحظة: يتم استخدام الحل قبل طلاء قبل معطف القنوات موائع جزيئية للقضاء على إمكانية تعويض اللون فقاعات الهواء داخل الرقاقة. - تعبئة اليسار السفلي جيدا مع 100 ميليلتر من قبل طلاء الحل. انتظر 5 دقائق للسماح للحل لتدفق من خلال ميكروجروفيس.
- إضافة 100 ميليلتر من قبل طلاء الحل إلى الأعلى على حق والسماح تتدفق من خلال القناة الرئيسية المجاورة أيضا. سد البئر الأيمن السفلي مع 100 ميليلتر من قبل طلاء الحل.
- نضح في الحل من كل بئر. نضح بعيداً عن القنوات الرئيسية لتجنب إزالة السائل من القنوات الرئيسية (الشكل 2A). فور إضافة 150 ميليلتر من الفوسفات مخزنة المالحة (PBS) إلى أعلى اليسار جيدا. انتظر دقيقة 1.5.
تنبيه: لا نضح السائل كل من القنوات الرئيسية المغلقة. - إضافة 150 ميليلتر PBS إلى الزاوية اليسرى السفلي جيدا. انتظر 5 دقائق للسماح للسوائل لتدفق من خلال ميكروجروفيس. إضافة 150 ميليلتر PBS إلى الأعلى على حق. إضافة 150 ميليلتر PBS إلى أدنى على حق. انتظر 10 دقائق.
- كرر الخطوات من 1.5-1.6 ليغسل PBS ثاني.
- تحقق في شرائح تحت مجهر زراعة الأنسجة للفقاعات في القنوات الرئيسية. في حالة وجود فقاعات، تنفيذ الإجراءات أدناه. في حالة وجود لا فقاعات، تخطي إلى الخطوة 1، 9.
- نضح برنامج تلفزيوني من آبار الصيد نصيحة بيبيت بعيداً عن القناة فتح (الشكل 2A).
- الاستغناء عن 100 ميليلتر من قبل طلاء الحل في البئر العلوي، الصيد غيض بيبيت قرب القناة فتح (الشكل 2). يجب نقل الفقاعات من خلال القناة في أسفل البئر. انتظر دقيقة 1.5.
- كرر الخطوات من 1.3-1.8.
- نضح برنامج تلفزيوني من آبار الصيد نصيحة بيبيت بعيداً عن القناة فتح (الشكل 2A).
- إضافة 100 ميليلتر من 0.5 ملغ/مل بولي د-يسين (PDL) أعلى اليسار من الرقاقة جيدا. انتظر دقيقة 1.5 ملء اليسار السفلي جيدا مع 100 ميليلتر من PDL.
- إضافة 100 ميليلتر من PDL إلى البئر الحق الأعلى للرقاقة. انتظر دقيقة 1.5 إضافة 100 ميليلتر للبئر الأيمن السفلي.
- أغلق طبق بتري والرقائق في حاضنة في 37 درجة مئوية ح 1.
- كرر الخطوات من المياه والصرف الصحي برنامج تلفزيوني 1.5-1.6 مرتين لإزالة الزائدة PDL.
- نضح برنامج تلفزيوني من الجهاز.
- فورا إضافة 100 ميليلتر من خلية ثقافة وسائل الإعلام إلى العلوية اليسرى من الرقاقة جيدا. انتظر دقيقة 1.5 وسائل الإعلام إضافة إلى الزاوية اليسرى السفلي جيدا. إضافة الوسائط إلى الأعلى على حق. انتظر دقيقة 1.5 إضافة 100 ميليلتر المتوسطة إلى البئر حق أقل من الرقائق.
- ضع الرقاقة في الحاضنة 37 درجة مئوية حتى جاهزة لخلايا لوحة.
2-زرع الخلايا العصبية في رقائق مولتيكومبارتمينت
- إعداد تعليق خلية من الخلايا العصبية هيبوكامبال الفئران ينتابها وفقا للبروتوكولات المعمول بها21،22 تسفر عن كثافة ~ 12 × 106 خلايا/مل.
ملاحظة: من الممكن استخدام كثافات تعليق خلية بين 3 و 12 × 106 خلايا/مل. إذا تم استخدام أقل كثافة، يمكن زيادة حجم تعليق الخلية المراد إضافتها إلى شرائح (انظر أدناه). ينطبق الإجراء الموضح أدناه للخلايا العصبية القشرية أو هيبوكامبال منفصلان مورين. قد تختلف كثافة الخلية المثلى لأنواع الخلايا العصبية الأخرى. - إزالة معظم وسائل الإعلام في كل بئر من الرقائق، ترك حوالي 5 ميليلتر في كل بئر. نضح بعيداً عن القنوات الرئيسية لتجنب إزالة السائل من القنوات الرئيسية (الشكل 2A).
تنبيه: لا نضح السائل من القنوات الرئيسية المغلقة. فقاعات الهواء قد أصبحوا محاصرين في الرقاقة إذا يستنشق السائل من القنوات الرئيسية. - تحميل 5 ميليلتر من تعليق خلية في الجزء العلوي على حق وآخر ميليلتر 5 من تعليق خلية في البئر الأيمن السفلي (مجموع الخلايا ~ 120,000). تحميل الخلايا بالاستغناء عن ما يقرب من القناة الرئيسية (الشكل 2). فحص تحت مجهر للتأكد من الخلايا العصبية في القناة الرئيسية. انتظر لمدة 5 دقائق للسماح للخلايا إرفاق.
ملاحظة: يمكن تحميل الخلايا العصبية في أي حجرة. ولأغراض التوضيح، المقصورة الجسدية القناة الرئيسية على الجانب الأيمن، ولكن يمكن أن تستخدم أما حجرة حجرة جسدية. من الممكن استخدام أقل كثافة الخلية وصولاً إلى خلايا 60,000 كل شريحة. ما يصل إلى 10 ميليلتر من الخلية ويمكن إضافة تعليق لكل جيد من المقصورة الجسدية في تركيبة مع تعليق خلية مع خلايا أقل مما هو موضح أعلاه. - إضافة ما يقرب من 150 ميليلتر من وسائل الإعلام ثقافة العصبية لكل من الطبقتين العليا والسفلي الحق الآبار، ثم قم بإضافة 150 ميليلتر لوسائل الإعلام لكل من الطبقتين العليا والسفلي ترك الآبار. ضع الرقاقة في علبة هوميديفيد في 5% CO2 37 درجة مئوية حاضنة.
- بعد 24 ساعة، إجراء تغيير الإعلام عن طريق إزالة الوسائط من الآبار. تأكد من أن يظل القناة الرئيسية شغلها. إضافة 150 ميليلتر لوسائل الإعلام لكل بئر أعلى، وقم بملء الآبار السفلي.
- ضع الرقاقة مرة أخرى في الحاضنة للعدد المطلوب من أيام.
ملاحظة: رصد وسائل الإعلام كل بضعة أيام للتأكد من أنها ما زالت خفيفة الوردي. إذا كانت الوسائط مصفر، تحل محل 50% من ذلك مع وسائط جديدة. إذا كان مستوى السائل منخفضا، تأكد من هناك الرطوبة الكافية والمناسبة الاحتواء الثانوي من رقائق لمنع التبخر. التغييرات وسائل الإعلام التقليل إلى أدنى حد، أو حتى القضاء، من الممكن استخدام الاحتواء الثانوي و/أو تغطي الطبق الذي يحتوي على شرائح مع تترافلوروايثيلين (PTFE)-الفيلم FEP.
3-رجعي تسمية الخلايا العصبية داخل رقاقة
ملاحظة: الوسم إلى الوراء يمكن إجراء باستخدام تقنيات متعددة، بما في ذلك استخدام فيروس الكوليرا تعديل السمية وداء الكلب. فيما يلي التعليمات الخاصة بوضع العلامات العصبية تستخدم فيروس داء الكلب-مشري أو-اجفب ز-حذف. التعامل مع المواد المعدية المحتملة وفقا للمبادئ التوجيهية للمنظمة المحلية. تدريب إضافية قد تكون مطلوبة.
- وسائط ثقافة العصبية الحارة الطازجة إلى 37 درجة مئوية. تقدير ~ 400 ميليلتر لوسائل الإعلام كل شريحة.
- تمييع 100000 وحدة فيروسية من فيروس داء الكلب تم التعديل في ما مجموعة 50 ميليلتر باستخدام وسائل الإعلام من أما جيدا من حجرة محواري.
ملاحظة: التخلص من نصائح وأنابيب على اتصال بالفيروس وفقا للبروتوكول وافقت عليها المنظمة. - بلطف بيبيت الوسائط المتبقية من آبار حجرة محواري ومخزن في جهاز الطرد مركزي أنبوب عند 37 درجة مئوية.
- إضافة 150 ميليلتر من وسائل الإعلام الحارة الطازجة و 50 ميليلتر من الفيروس المخفف لحجرة محواري. احتضانها ح 2 في حاضنة 37 درجة مئوية.
- قم بإزالة الوسائط التي تحتوي على الفيروسات والتخلص منها بشكل صحيح.
ملاحظة: قد أصبحوا محاصرين فقاعات الهواء في الرقاقة إذا يستنشق السائل من القنوات الرئيسية. - بلطف إضافة ميليلتر 75 وسائط جديدة إلى إكسون واحد جيد والسماح لها بالتدفق إلى إكسون الأخرى أيضا.
- إزالة من خلال تدفق من إكسون الثاني جيدا والتصرف بشكل صحيح.
- كرر الخطوات من 3.6 و 3.7 مرة.
- إضافة إلى حجرة محواري الوسائط التي تم تخزينها. إضافة حوالي 50 ميليلتر جديدة وسائل الإعلام، إذا لزم الأمر، الحفاظ على حجم مناسب والعودة الخلايا للحاضنة.
ملاحظة: تعبير البروتينات الفلورية مرئية قبل 48 ساعة واستمرت لمدة 8 أيام. يمكن تصويرها الخلايا العصبية لتصل إلى 30 دقيقة في درجة حرارة الغرفة في وسائل الإعلام ثقافة العصبية. يمكن أيضا استبدال ثقافة وسائل الإعلام مع المعالجون CO2-السبات مستقل ه مع B27 وتصويرها لفترة أطول. كما يمكن تصويرها الخلايا العصبية داخل دائرة بيئية جيدا هوميديفيد في أول أكسيد الكربون 37 درجة مئوية و 5%2. في هذه الحالة، الترطيب ضروري للتقليل من الخسائر البخر داخل الرقائق، التي تتفاقم من جراء التدفئة، ويمكن أن يعرض للخطر صحة الخلايا العصبية.
4-فلويديك عزل المقصورة محواري داخل رقاقة
- إزالة 20 ميليلتر من الدنيا ترك جيدا لحجرة محواري ومكانه في البئر الأيمن العلوي من المقصورة الجسدية. انتظر 2 دقيقة لتدفق داخل كل قناة لحجته.
- إزالة 50 ميليلتر من وسائل الإعلام من حجرة محواري. إضافة ميليلتر 0.3 مم 1 488 فلور أليكسا المالئيك إلى هذه الوسائط ومزيج عبر بيبيت والعودة مرة أخرى إلى حجرة محواري. الرقاقة جاهز للتصوير.
ملاحظة: يمكن إضافة مركبات أخرى للفائدة. يوصي بإضافة صبغة فلورسنت مع وزن الجزيئي مماثلة كمجمع للفائدة من أجل رصد العزلة فلويديك مع مرور الوقت.
5-أداء أكسوتومي داخل رقاقة
- قم بإزالة الوسائط من حجرة محواري حفظ نصيحة بيبيت بعيداً عن مدخل القناة الرئيسية (الشكل 2A) وتخزينها في أنبوب الطرد مركزي.
- نضح حجرة محواري تماما، وضع بيبيت تطلع قرب مدخل أما للقناة الرئيسية لحجرة محواري (الشكل 2). مواصلة التطلع للتأكد من أن الحل هو إزالتها بالكامل من المقصورة 1-2 دقيقة.
ملاحظة: يجب الضغط فراغ لتطلع على الأقل 18 بوصة-Hg للإجراء أكسوتومي للعمل بشكل صحيح. - استبدال حجرة محواري مع الوسائط المخزنة وتأكيد أن كانت قد قطعت في محاور عصبية بالنظر شرائح تحت مجهر.
ملاحظة: إذا كان تكوين فقاعات في حجرة محواري عند استبدال وسائط الإعلام، كرر الخطوات 5، 1-5، 2. - العودة الرقاقة للحاضنة.
6-إيمونوستينينج الأسفار داخل رقاقة
- إعداد 4% فورمالدهايد تثبيت الحل في برنامج تلفزيوني (4% فورمالدهايد، 1 ميكرومتر مجكل2، 0.1 ميكرومتر كاكل2، السكروز 120 ملم)
- إزالة معظم وسائل الإعلام في الآبار للرقاقة (لم تجف المقصورات الداخلية).
- فورا إضافة 100 ميليلتر لتثبيت الحل إلى الآبار أعلى من المقصورات محواري وجسدية.
- بعد 1 دقيقة، إضافة 100 ميليلتر لتثبيت الحل إلى الآبار السفلي. الإصلاح لمدة 30 دقيقة في درجة حرارة الغرفة.
- إزالة أكثر من الحل من الآبار للرقاقة (لم تجف المقصورات الداخلية). إضافة 150 ميليلتر من برنامج تلفزيوني فورا إلى كل من الآبار أعلى من المقصورات محواري وجسدية. انتظر 2 دقيقة لبرنامج تلفزيوني في التدفق إلى الآبار السفلي.
- كرر الخطوة 6، 5 مرتين.
- إزالة أكثر من برنامج تلفزيوني من الآبار للرقاقة. فور إضافة 150 ميليلتر من برنامج تلفزيوني مع 0.25% تريتونكس-100 لكل من الآبار أعلى من المقصورات محواري وجسدية. الانتظار لمدة 15 دقيقة.
- إزالة معظم السائل من آبار شرائح وإضافة 150 ميليلتر من عرقلة الحل (10% مصل الماعز العادي في برنامج تلفزيوني) فورا لكل من الآبار أعلى من المقصورات محواري وجسدية. الانتظار لمدة 15 دقيقة.
ملاحظة: ينبغي أن تكون محددة للأجسام المضادة الثانوية، مثلاً، لجسم حمار ثانوي الأغنام المضادة الحلول الفعالة التجميد، واستخدام المصل حمار في عرقلة الحل. - إزالة معظم السائل من الآبار للرقاقة وفورا إضافة 100 ميليلتر من جسم الأولية (أو الأجسام المضادة) في مصل الماعز العادي 1% في برنامج تلفزيوني لكل من الآبار أعلى من المقصورات محواري وجسدية. تغطية للتقليل من التبخر وانتظر ح 1 في درجة حرارة الغرفة أو 4 درجات مئوية بين عشية وضحاها.
- إزالة أكثر من الحل من الآبار للرقاقة (لم تجف المقصورات الداخلية). إضافة 150 ميليلتر من برنامج تلفزيوني فورا إلى كل من الآبار أعلى من المقصورات محواري وجسدية. انتظر 5 دقائق لبرنامج تلفزيوني في التدفق إلى الآبار السفلي.
- كرر الخطوة 6.10 مرتين.
- إزالة معظم السائل من آبار شرائح وإضافة 100 ميليلتر من جسم الثانوي (أو الأجسام المضادة) فورا في برنامج تلفزيوني إلى كل من الآبار أعلى من المقصورات محواري وجسدية. تغطية للتقليل من التبخر وانتظر ح 1 في درجة حرارة الغرفة.
ملاحظة: الرجوع إلى إرشادات الشركة المصنعة للتخفيف الموصى بها من الأجسام المضادة الثانوية. - كرر الخطوات 6، 6، 10-11.
- إذا كان التصوير في غضون يوم واحد من إيمونوستينينج، تبقى الرقاقة مليئة ببرنامج تلفزيوني. إذا كان سيتم تخزين شرائح أطول من يوم واحد قبل التصوير، التفاف الطبق يحتوي على الرقاقة في الفيلم البرافين لمنع التبخر وتخزينها في 4 درجات مئوية حتى جاهزة للصورة.
- للتخزين على المدى الطويل من العينات، يمكن استخدام وسائل الإعلام المتزايدة (مثلاً، فلوروماونت-ز).
- إزالة معظم السائل من الآبار للرقاقة. استخدام 1 مل بيبيت بلاستيك القابل لإضافة 2 قطرات من تركيب وسائط لكل من الآبار أعلى من المقصورات محواري وجسدية.
- إمالة رقاقة لتشجيع تدفق وسائل الإعلام المتزايدة عن طريق القنوات. بعد 5 دقائق أضف 2 قطرات إلى الآبار السفلي. انتظر ح 1 قبل التصوير.
ملاحظة: بعد استخدام تركيب وسائل الإعلام أنه لن الممكنة لإعادة التحقيق لأهداف أخرى.
النتائج
بعد حوالي 5-7 أيام لنمو الخلايا العصبية داخل الرقاقة، يتجلى النمو محواري. الرقائق المتوافقة مع تصوير المرحلة-على النقيض كما يتبين في الشكل 3، مما يدل على نمو الخلايا العصبية في 24 يوما. رقائق البطاطس أيضا متوافقة مع الأسفار التصوير (الشكل 4و الشكل 5، الرقم 6و الرقم 7). ثلاثة أيام بعد العدوى بفيروس داء الكلب عن طريق حجرة محواري، تم تصويرها مشري-إيجابية الخلايا العصبية مع محاور عصبية تمتد في حجرة محواري في الرقاقة (الشكل 4). لإثبات قدرته على عزل فلويديكالي المقصورات، تمت إضافة صبغة فلورسنت وزن الجزيئي منخفض (488 فلور أليكسا المالئيك) إلى حجرة محواري. هذه النتائج قابلة للمقارنة على أساس PDMS الدائرة17 وتثبت مدى ملاءمة لرقائق البلاستيك لمرحلة التباين وتصوير الأسفار.
لتوضيح نمو الخلايا العصبية برقائق البلاستيك وأجهزة PDMS، نحن استزراع الخلايا العصبية في كل المنابر ورصد نمو الخلايا العصبية على مر الزمن. ويبين الشكل 5 نمو الخلايا العصبية من 3 إلى 22 يوما في الثقافة؛ هذه النتائج تمثل 3 تجارب مستقلة. نمو الخلايا العصبية قابل للمقارنة داخل البلدين منصات تصل إلى 15 يوما في الثقافة، ولكن في الثقافة أطول الإعمار (> 21 يوما) محاور عصبية معزولة داخل رقاقة البلاستيك يبدو أكثر صحة مع الديكور أقل (الشكل 5A). كذلك تصور محاور عصبية داخل المقصورات محواري، نحن إيمونوستينيد β-tubulin الثالث مما يدل على نمو محواري صحية داخل البلاستيك للرقائق في 22 يوما في الثقافة (الشكل 5 (ب)).
دراسات الإصابة والتجدد إكسون شائعة من استخدام أجهزة موائع جزيئية مجزأة. لإظهار مدى ملاءمة هذه الدراسات استخدام الرقائق، رجعية المسماة الخلايا العصبية تم تصويرها قبل و 24 ساعة بعد أكسوتومي (الشكل 6). لمبة سحب وتجديد إكسون كلا أكسوتومي التالية واضحة. هذه النتائج مكافئة للبيانات المنشورة باستخدام الأجهزة المستندة إلى PDMS14،17.
إيمونوسيتوتشيميستري تقنية شائعة داخل حجرة متعددة من الأجهزة لتصور التعريب البروتين. بعد 24 يوما في الثقافة، الخلايا العصبية داخل الرقائق كانت ثابتة والملون لكل علامات متشابك ضادات والمثبطة و vGlut1 وفجات، على التوالي (الشكل 7). وكانت الخلايا العصبية إلى الوراء مشري المسمى أيضا المصورة (الشكل 7). تم إجراء التصوير باستخدام القرص الغزل [كنفوكل] مع هدف غمر زيت سيليكون 60 ×، مما يدل على القدرة على القيام بتصوير عالي الدقة. الأهم من ذلك، كانت الأشواك الجذعية واضحة داخل منطقة مكبرة، مما يدل على أن الخلايا العصبية المزروعة داخل الرقائق تم تشكيل نهايات ناضجة.
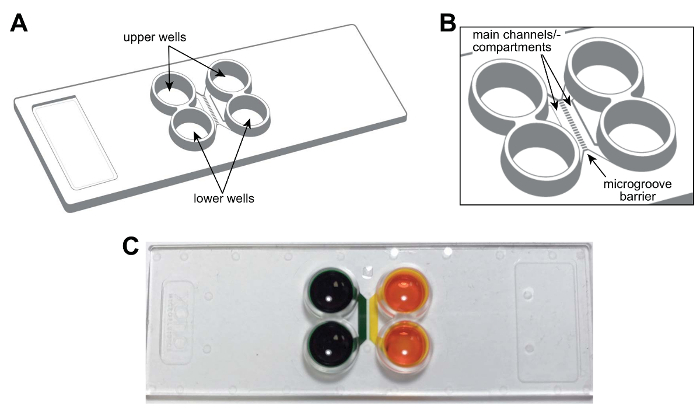
الشكل 1 : رقاقة موائع جزيئية المقصورة اثنين قبل تجميع، والبلاستيك لتجزئة الخلايا العصبية. (أ) التمثيل التخطيطي للرقاقة مولتيكومبارتمينت تبين مواقع الآبار العلوي والسفلي. (ب) تخطيطي موسع من شرائح عرض القنوات الرئيسية (أو الأقسام) وميكروجروفيس التي تربط المقصورات. القنوات الرئيسية حوالي 1.5 مم × 7 × 0.060 مم (م × × ل ح). العرض والارتفاع ميكروجروفيس حوالي 0.01 مم × 0.005 مم، على التوالي. طول ميكروجروفيس يختلف اعتماداً على التكوين، 0.15 ملم إلى 0.9 مم. (ج) بصورة فوتوغرافية لشريحة مولتيكومبارتمينت التمثيلية التي تحتوي على الأغذية تلوين صبغ في كل قناة رئيسية أو حجرة إثبات القدرة على فلويديكالي عزل كل قناة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
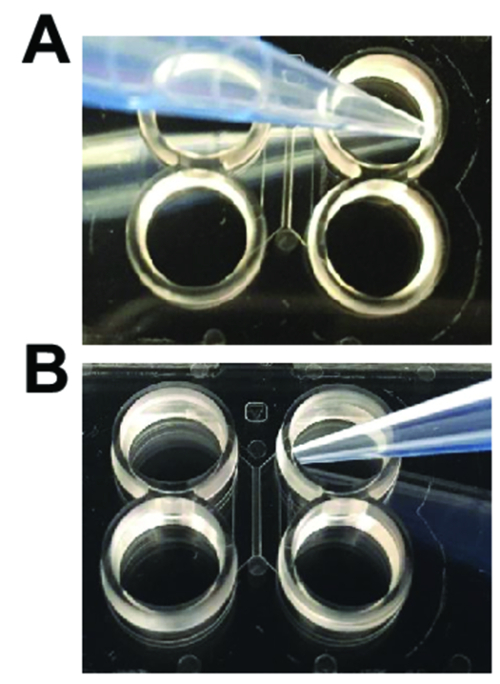
الشكل 2 : بيبيتينج التقنيات اللازمة عند استخدام رقائق البلاستيك مولتيكومبارتمينت. (أ) عند إضافة يسفط وسائل الإعلام ليغسل، ينبغي أن الزاوية نصيحة بيبيت بعيداً عن مدخل القناة الرئيسية كما هو موضح. (ب) عند تحميل الخلايا العصبية أو أداء أكسوتومي، تلميح بيبيت ينبغي أن تكون الزاوية نحو مدخل القناة الرئيسية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
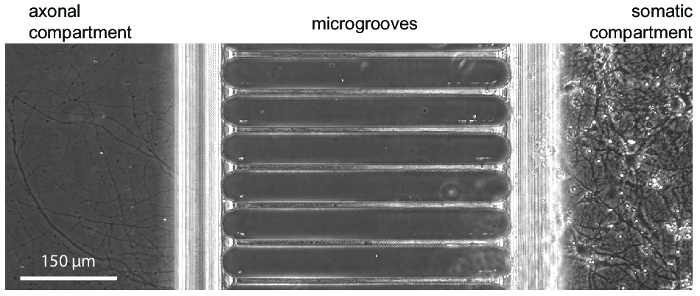
الشكل 3 : صورة مجهرية تباين مرحلة عرض نموذجي نمو الخلايا العصبية داخل الرقاقة في 24 يوما في الثقافة- كان المصنف الخلايا العصبية هيبوكامبال الجنينية في حجرة حق جسدية. النمو إكسون مرئياً في البداية حجرة محواري في 5-7 أيام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
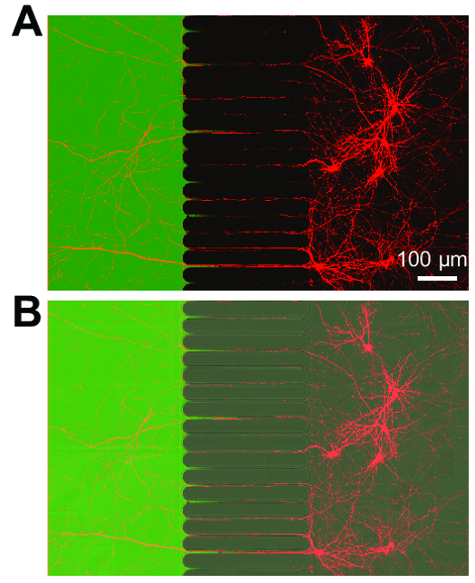
الشكل 4 : إلى الوراء من الخلايا العصبية المسماة التعبير عن البروتين الفلورسنت مشري وتمتد محاور عصبية في حجرة محواري فلويديكالي معزولة. (أ) صورة مجهرية فلورية مدمجة إظهار الخلايا العصبية المسماة إلى الوراء يعيش بالعدوى عن طريق فيروس السعار مشري تعديل تطبيقها بإيجاز إلى حجرة محواري. وكانت الخلايا العصبية المصورة 3 أيام ما بعد الإصابة في 21 يوما في الثقافة. إنشاء المكروية معزولة داخل المقصورة محواري يتجلى تطبيق صبغة منخفضة الوزن الجزيئي، المالئيك 488 فلور أليكسا. (ب) صورة مدمجة من (أ) بما في ذلك صورة تباين (DIC) تدخل تفاضلية لتصور منطقة ميكروجروفيس للرقاقة. الصور التي تم الحصول عليها مع ليزر المسح مجهر [كنفوكل] استخدام زيت سيليكون × 30/1.05 N.A. (ني = 1.406) عدسة الهدف. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
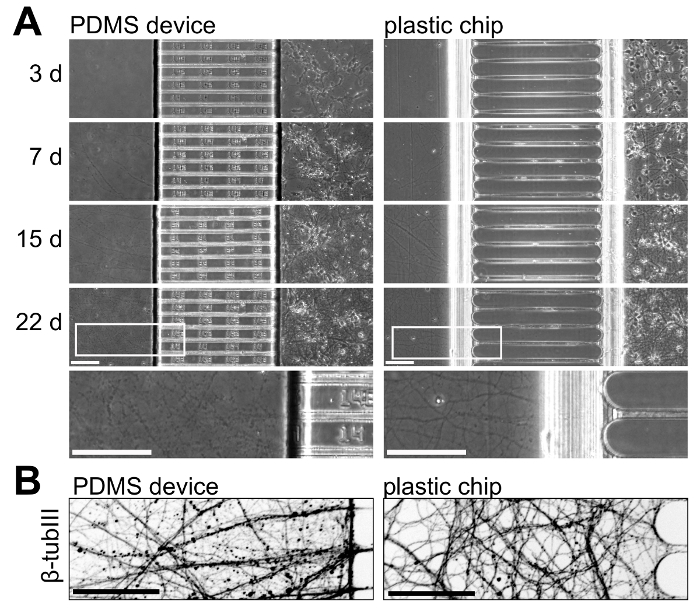
الشكل 5 : مقارنة جنبا بجنب لنمو الخلايا العصبية داخل الأجهزة PDMS مولتيكومبارتمينت ورقائق البلاستيك. (أ) المرحلة ميكروجرافس على النقيض من كل المنابر التي اتخذت في 3 و 7، 15 و 22 يوما في الثقافة. في الجزء السفلي، منطقة تكبير أعلى مأخوذة من الصور في 22 يوما يتم تضمين لتوضيح محواري النمو في هذا العمر داخل كل المنابر. محاور عصبية داخل الرقاقة أكثر استمرارية وتظهر أكثر صحة من الجهاز PDMS في هذا العصر. (ب) الملون صورة مجهرية الفلورة عكس الثالث β-tubulin محاور عصبية داخل المقصورة محواري لكل جهاز PDMS ورقائق البلاستيك في 22 يوما في الثقافة. الصور التي تم الحصول عليها بنظام غزل تصوير [كنفوكل] قرص باستخدام 20 س/0.45 N.A. الهدف العدسة. هي كافة أشرطة مقياس 100 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
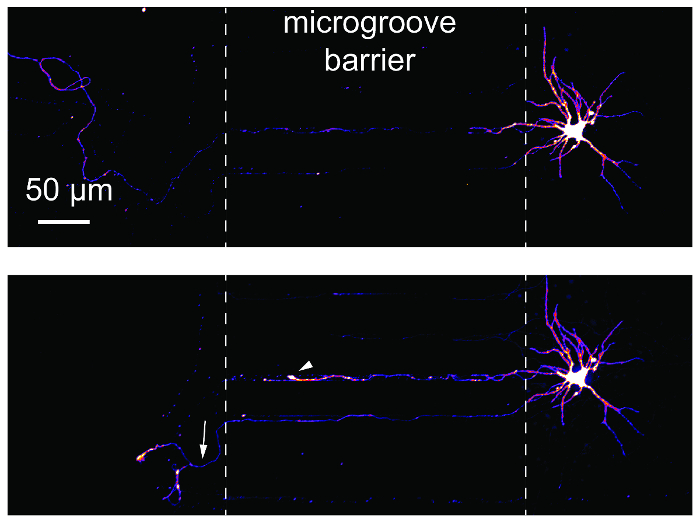
الرقم 6 : أكسوتومي والتجديد للخلايا العصبية هيبوكامبال داخل رقاقة مولتيكومبارتمينت البلاستيك. (أعلى) وكانت الخلايا العصبية إلى الوراء المسمى باستخدام فيروس السعار مشري معدلة وثم تصويرها قبل أكسوتومي في 24 يوما في الثقافة. وكانت الصور بسيودوكولوريد باستخدام جدول البحث عن الألوان 'النار'. (أسفل) وكان العصبية نفس تصويرها في أعلى اللوحة المصورة ح 24 وظيفة-أكسوتومي. خطوط متقطعة بيضاء تظهر حواف الحاجز ميكروجروفي. أكسوتومي وقع في موقع الخط المتقطع الأيسر. يظهر رأس السهم الأبيض لمبة تراجع. السهم الأبيض يدل تجديد إكسون. الصور تم الحصول عليها مع غزل قرص [كنفوكل] نظام تصوير باستخدام عدسة هدف N.A. ×/0.45 20. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
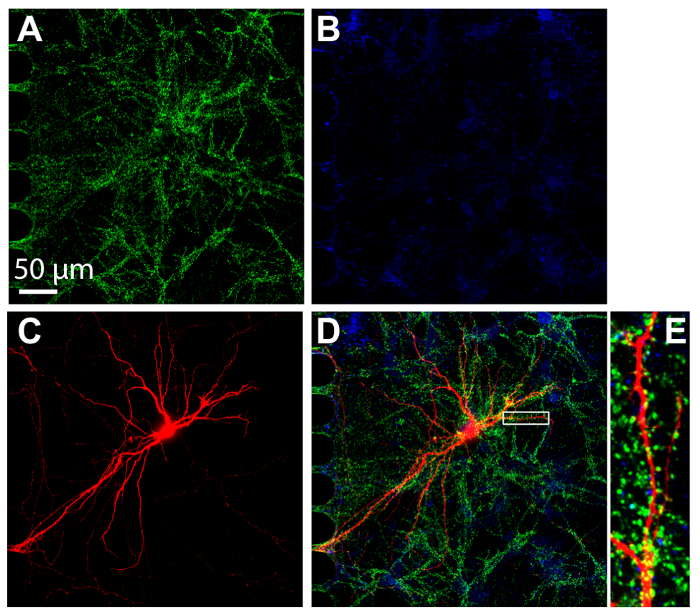
الشكل 7 : سينابسيس النموذج بين الخلايا العصبية هيبوكامبال مثقف داخل رقائق البلاستيك مولتيكومبارتمينت. إيمونوستينينج كان يؤديها في 24 يوما في الثقافة وتصويرها داخل المقصورة الجسدية باستخدام عدسة غمر زيت سيليكون 60 ×. الخلايا العصبية إكسبريس (A) علامة المشبك ضادات، vGlut1 (الأخضر) و (ب) علامة المشبك المثبطة، فجأت (أزرق). (ج) المسمى Retrograde مشري الخلايا العصبية (أحمر) أصيبوا عن طريق فيروس السعار المعدل المطبق لحجرة محواري. (د) فلورية مدمجة صورة مجهرية vGlut1، فجأت ومشري. (ه) المنطقة المكبرة في (د) أشارت إلى مع مربع أبيض يظهر العمود الفقري الجذعية، المواقع التي تتلقى مدخلات متشابك من الخلايا العصبية الأخرى. الصور التي تم الحصول عليها بنظام غزل تصوير [كنفوكل] قرص باستخدام زيت سيليكون × 60/1.3 N.A. (ني = 1.406) عدسة الهدف. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| رقائق البلاستيك مولتيكومبارتمينت | أجهزة PDMS مولتيكومبارتمينت |
| عزل محاور عصبية | عزل محاور عصبية |
| إنشاء ميكرونفيرونمينتس | إنشاء ميكرونفيرونمينتس |
| أكسوتوميزي الخلايا العصبية | أكسوتوميزي الخلايا العصبية |
| شفافة بصريا | شفافة بصريا |
| متوافق مع التصوير عالية الدقة | متوافق مع التصوير عالية الدقة |
| متوافق مع الفحص المجهري الأسفار | متوافق مع الفحص المجهري الأسفار |
| تجميع كامل | الجمعية إلى الركيزة اللازمة |
| محاور عصبية صحية > 21 يوما | محاور عصبية صحية > 14 يوما |
| ماء السطح تثقيف | مسعور |
| الغاز كتيمة | الغاز نفاذية |
| ميكروجروفيس مستدير والقنوات | ميكروجروفيس مستقيم |
| خطوات إعداد أقل | أعلى قابل للإزالة لتلطيخ داخل ميكروجروفيس |
| غير متوافق مع التذرية الليزر | امتصاص الجزيئات الصغيرة والمذيبات العضوية |
| غير متوافق مع زيوت الغمر المستندة إلى الزيوت المعدنية (زيوت السيليكون المستندة على ما يرام) |
الجدول 1: مقارنة بين البلاستيك ومنصات PDMS مولتيكومبارتمينت لاستزراع الخلايا العصبية.
Discussion
رقائق مولتيكومبارتمينت البلاستيك توفر خياراً سهل الاستخدام لتجزئة الخلايا العصبية، تقديم الثقافات العصبية طويلة الأمد (> 3 أسابيع). هذا البروتوكول تفاصيل كيفية الثقافة القشرية وهيبوكامبال مورين من الخلايا العصبية داخل هذه الرقائق. ونوقشت أيضا إنشاء ميكرونفيرونمينتس قابلة للذوبان وكيف للوراء تسمية الخلايا العصبية والقيام أكسوتومي، وأداء إيمونوسيتوتشيميستري. الأهم من ذلك، تكون هذه الرقائق متوافقة مع عالية الدقة، الأسفار، وتصوير حية.
توفر العديد من نفس وظائف الأجهزة المستندة إلى PDMS مجزأة رقائق البلاستيك مولتيكومبارتمينت، ولكن لها مزايا وعيوب، وبعض السمات المميزة. ويقدم الجدول 1 مقارنة ميزة للرقائق البلاستيكية والأجهزة المستندة إلى PDMS. أولاً وقبل كل شيء، الرقائق قبل تجميعها وتدلي ماء بشكل دائم، مما يسهل التبول، جعلها أسهل في الاستخدام. البلاستيك ليس الغاز نفاذية، على عكس PDMS، حتى لو بشكل غير متوقع تشكل فقاعات داخل القنوات، أنهم لن يهربوا سهولة ويجب إزالته. حل قبل طلاء تتضمن أساسا الإيثانول وبعض العوامل الأخرى الملكية يلغي تشكيل فقاعة.
يعيش تصوير إسقاطات التالية توصيل البروتينات الفلورية أنجز داخل الرقائق (الشكل 4) وهناك أوتوفلوريسسينسي لا يمكن كشفها من البلاستيك. تحذير أن غمر الزيوت المستخدمة مع الرقاقة لأهداف الفتحة العددية عالية يجب أن زيت السيليكون على أساس، ولا الزيوت المعدنية على أساس. الزيوت المعدنية يمكن أن يسبب حدوث رد فعل سلبي مع كوبوليمر اوليفينيه دوري. للتصوير برايتفيلد، ومن المهم أن نلاحظ أن يتم تقريب ميكروجروفيس في الرقاقة في النهايات وهناك مستدق تدريجيا من z-اتجاه القنوات الرئيسية نحو الحاجز ميكروجروفي تسبب بعض إنكسار الضوء على حد سواء ميكروجروفيس أثناء برايتفيلد التصوير (الشكل 3). لأن قبل تجميع الرقائق، اختراق جسم ميكروجروفيس ميكرون الحجم قد يكون متفاوتاً (كما هو الحال مع الأجهزة المستندة إلى PDMS المرتهن بشكل دائم)؛ وبالتالي، ينبغي إجراء تحليل كمي عقب إيمونوستينينج في القنوات/المقصورات. يمكن تحسين Immunostaining الإسقاطات الخلايا العصبية داخل ميكروجروفيس بإنشاء فرق حجم بين المقصورات لمساعدة تدفق الأجسام المضادة و fluorophores إلى ميكروجروفيس.
Disclosures
A.M.T. مخترع موائع جزيئية الدائرة/الرقاقة (B2 7419822 لنا) وهو عضو في إكسونا ميكروفلويديكس، شركة ذات مسؤولية محدودة. ف موظف شونا ميكروفلويديكس، شركة ذات مسؤولية محدودة. J.H. عضو شونا ميكروفلويديكس، شركة ذات مسؤولية محدودة. T.N. تعلن لا تضارب المصالح المالية. وترعى ميكروفلويديكس شونا الوصول المفتوح المنشور من هذه المقالة.
Acknowledgements
الكتاب تقر مساعدة فنية أو تحريرية من الذبول تايلور (شونا)، سميتا بارانجب (UNC-تشابل هيل)، جويس سيتشانووسكي (شونا) وبراد تايلور (شونا). الكتاب الاعتراف بدعم من ميكروفلويديكس شونا، شركة ذات مسؤولية محدودة والمعهد الوطني للصحة العقلية (R42 MH097377). تصوير أيده جزئيا كونفوكال ومولتيفوتون التصوير الأساسية مرفق من نيندس مركز منحة P30 NS045892 ومنحة مركز NICHD (U54 HD079124). المحتوى هي المسؤولة الوحيدة عن المؤلفين ولا تمثل بالضرورة وجهات النظر الرسمية "المعاهد الوطنية للصحة".
Materials
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
References
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes? Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. Culturing Nerve Cells. , Second edition, MIT Press. (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved