Method Article
Uso de Chips microfluídicos plástico pré-montados para compartimentar os neurônios primários de murino
Neste Artigo
Resumo
Este protocolo descreve o uso de chips de plástico para cultura e compartimentar os neurônios primários de murino. Esses chips são preassembled, fácil de usar e compatível com alta resolução, ao vivo e a imagem latente de fluorescência. Este protocolo descreve como neurônios hippocampal do rato dentro estes chips da placa e executar imunocoloração, axotomy e isolamento fluídico.
Resumo
Microfabricated métodos para compartimentar os neurônios tornaram-se ferramentas essenciais para muitos neurocientistas. Este protocolo descreve o uso de um chip de plástico pré-montados comercialmente disponível para compartimentar neurônios hippocampal culta rato primário. Esses chips de plástico, contido a pegada de um padrão de microscópio, são compatíveI com alta resolução, ao vivo e a imagem latente de fluorescência. Este protocolo demonstra como retrograde neurônios rótulo através de axônios isolados usando um vírus modificado da raiva codificação de uma proteína fluorescente, criar o microambiente isolado dentro de um compartimento e executar axotomy e imunocitoquímica em-microplaqueta. Os neurônios são cultivados por > 3 semanas dentro o chips de plástico, ilustrando a compatibilidade destes chips para culturas neuronais a longo prazo.
Introdução
Cultura tradicional neurônio abordagens resultam em consequência aleatória de axônios e dendritos, que impedem o estudo de neurônios em sua morfologia original e polarizada. Microfabricated multicompartment dispositivos se tornaram ferramentas de pesquisa bem estabelecido e bem utilizada para neurocientistas nos últimos 10-15 anos (publicações de alto perfil selecionadas são referenciados1,2,3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17). estes dispositivos compartimentar os neurônios e fornecem um método para fisicamente e quimicamente manipular regiões subcellular de neurônios, incluindo somata, dendritos, axônios e sinapses18,19. Eles também fornecem vários paradigmas experimentais que não são possíveis usando culturas aleatórias, incluindo estudos de transporte axonal, síntese de proteínas axonal, lesão do axônio/regeneração e axônio-para-soma de sinalização. A configuração básica do compartimento 2 consiste de dois canais microfluídicos paralelo, separados por uma série de pequenos microgrooves perpendicular. Primários ou células-tronco derivadas de neurônios são banhados em um dos canais microfluídicos, resolver e anexar à superfície inferior do dispositivo e estender neuritos ao longo dos dias. Muitos cones de crescimento encontram seu caminho para o microgrooves, que são pequenos o suficiente para que eles impedem corpos celulares entrando. Cones de crescimento são fisicamente restrito e incapaz de girar ao redor dentro do microgrooves, crescem direto no compartimento adjacente (compartimento axonal) onde estão isolados.
Historicamente, estes dispositivos têm sido moldados usando poly(dimethylsiloxane) (PDMS) de um molde mestre photolithographically padronizado e são feitos internamente em laboratórios dos inspectores ou adquiridos comercialmente. Uma das principais desvantagens do uso de PDMS é sua hidrofobicidade20. PDMS pode ser feitas hidrofílicos temporariamente, mas rapidamente torna-se então hidrofóbicos dentro de horas em um ambiente não-aquosa20. Por causa disso, os dispositivos devem ser anexados a uma lamela de vidro ou outros substratos adequados no momento da utilização. Chips de multicompartment plástico pré-montados estão agora comercialmente disponíveis (por exemplo, XonaChips) em plástico moldado por injeção. Esses chips são feitos permanentemente hidrofílicos, simplificando a umectação do dispositivo e permitindo a pré-montagem do chip com uma película fina de copolímero de olefina cíclica (COC) encerram os canais microfluídicos na parte inferior. Esses chips são fabricados em um plástico opticamente transparente apropriado para a imagem latente de fluorescência de alta resolução.
O propósito do presente protocolo é demonstrar o uso dos chips microfluídicos plástico pré-montados para múltiplos paradigmas experimentais realizadas usando murino neurônios hippocampal ou corticais. Este protocolo descreve como retrograde neurônios rótulo usando um vírus de raiva modificados dentro do chip. Axotomy de estudos de lesão do axônio e regeneração também são descritos. Por último, este protocolo mostra como executar imunocoloração de fluorescência com o dispositivo.
Protocolo
Nota: Um esquema do chip multicompartment plástico é mostrado na figura 1A, B. O chip é do tamanho de uma lâmina de microscópio padrão (75 mm × 25 mm). As características do chip, incluindo os principais canais ou compartimentos, poços e microgrooves são rotuladas e são fornecidas para referência futura. Figura 1 é uma fotografia do chip demonstrando o isolamento fluídico dos compartimentos.
1. preparação e revestimento dos Chips electrolyzer
- Um armário de bio-segurança, coloque o chip em uma placa de Petri ou outro recipiente estéril adequado.
- Adicione 100 µ l de pre-revestimento solução para a superior esquerda bem do chip e deixe-a fluir através do canal principal para o adjacente bem.
Nota: A solução de pre-revestimento é usada para pre-revestir os canais microfluídicos para eliminar o potencial de aprisionando bolhas de ar dentro do chip. - Preencher a parte inferior esquerdo bem com 100 µ l de pre-revestimento solução. Espere 5 minutos para permitir que a solução para fluir através do microgrooves.
- Adicione 100 µ l de pre-revestimento solução para o canto superior direito bem e deixe-a fluir através do canal principal para o adjacente bem. Encha o poço inferior direito com 100 µ l de pre-revestimento solução.
- Aspire a solução de cada poço. Aspire longe os principais canais para evitar a remoção de líquido dos canais principais (Figura 2A). Imediatamente adicione 150 µ l de tampão fosfato salino (PBS) para o canto superior esquerdo bem. Espera 1,5 min.
Cuidado: Não aspire o líquido dos principais canais fechados. - Adicione 150 µ l PBS para o canto inferior esquerdo bem. Espere 5 minutos para permitir que os líquidos a fluir através do microgrooves. Adicione 150 µ l PBS para o canto superior direito bem. Adicione 150 µ l PBS para abaixar-se muito bem. Espere 10 min.
- Repita as etapas 1.5-1.6 para uma segunda lavagem PBS.
- Verifique se o chip sob um microscópio de cultura de tecido para bolhas nos principais canais. Se as bolhas estiverem presentes, execute os procedimentos abaixo. Se não há bolhas estão presentes, pule para a etapa 1.9.
- Aspire PBS dos poços, dobrando a ponta da pipeta longe de abertura (Figura 2A) do canal.
- Dispense 100 µ l de pre-revestimento solução para o bem superior, dobrando a ponta da pipeta perto de abertura (Figura 2B) do canal. As bolhas devem mover-se através do canal dentro do poço inferior. Espera 1,5 min.
- Repita as etapas de 1,3-1,8.
- Aspire PBS dos poços, dobrando a ponta da pipeta longe de abertura (Figura 2A) do canal.
- Adicione 100 µ l de 0,5 mg/mL poli d-lisina (PDL) para o superior esquerda bem do chip. Espera 1,5 min. Encha a parte inferior esquerdo bem com 100 µ l de PDL.
- Adicione 100 µ l de PDL ao poço superior direito do chip. Espera 1,5 min. Adicione 100 µ l para o poço inferior direito.
- Feche a caixa de Petri e colocar o chip em uma incubadora a 37 ° C por 1h.
- Repita as etapas de lavagem PBS 1.5-1.6 duas vezes para remover o excesso PDL.
- Aspire a PBS do dispositivo.
- Imediatamente Adicione 100 µ l de meio de cultura celular para superior esquerda bem do chip. 1,5 min. Adicionar mídia para o canto inferior esquerdo Espere bem. Adicione mídia para o canto superior direito bem. Espera 1,5 min. médio Adicione 100 µ l do poço inferior direito do chip.
- Coloque o chip na incubadora a 37° C até que esteja pronto para as células da placa.
2. a propagação de neurônios em Chips electrolyzer
- Prepare a suspensão de células de neurônios hippocampal do rato dissociado de acordo com protocolos estabelecidos21,22 para produzir uma densidade de ~ 12 × 106 células/mL.
Nota: É possível a utilização de densidades de suspensão celular entre 3 e 12 × 106 células/mL. Se for utilizada uma densidade mais baixa, o volume da suspensão de células a ser adicionado à microplaqueta pode ser aumentado (veja abaixo). O procedimento descrito abaixo é aplicável para os neurônios corticais ou hippocampal dissociados murino. Densidades de célula ideal para outros tipos de neurônio podem variar. - Remova a maioria dos meios de comunicação em cada poço do chip, deixando aproximadamente 5 µ l em cada poço. Aspire longe os principais canais para evitar a remoção de líquido dos canais principais (Figura 2A).
Cuidado: Não aspire o líquido dos principais canais fechados. Bolhas de ar podem tornar-se preso no chip, se fluido é aspirado dos principais canais. - Carregar 5 µ l de suspensão de células na parte superior direita bem e outro 5 µ l de suspensão de células no poço bem inferior (total de células ~ 120.000). Carrega as células por dispensar perto do canal principal (Figura 2B). Verifique sob um microscópio para garantir que os neurônios estão no canal principal. Espere 5 minutos permitir que as células anexar.
Nota: Neurônios podem ser carregados em qualquer compartimento. Para fins de explicação, o compartimento somático é o canal principal do lado direito, mas de qualquer compartimento pode ser usado como o compartimento somático. É possível a utilização de menores densidades de célula até 60.000 células por chip. Até 10 µ l de célula suspensão pode ser adicionado a cada bem do compartimento somático em combinação com uma suspensão de células com menos células do que o descrito acima. - Adicionar aproximadamente 150 µ l de meios de cultura neuronal para cada uma das parte superior e inferior direito poços e adicione 150 µ l de mídia para cada uma das parte superior e inferior deixou de poços. Coloque o chip na bandeja umidificada numa incubadora de 37 ° C 5% CO2 .
- Após 24h, realizar uma alteração de mídia, removendo mídia dos poços. Certifique-se que o canal principal continua a ser preenchido. Adicionar 150 µ l de mídia para cada poço superior e em seguida, preencher os poços de fundo.
- Coloque o chip de volta na incubadora para o número desejado de dias.
Nota: Monitorar a mídia a cada dois dias para se certificar de que restos de luz rosa. Se a mídia estiver amarelada, substitua 50% com mídia fresca. Se o nível do líquido é baixo, verifique se há umidade adequada e adequada contenção secundária dos chips para evitar a evaporação. Alterações de mídia minimizando ou mesmo eliminando, é possível usar contenção secundária e/ou cobrindo o prato que contém o chip com politetrafluoretileno (PTFE)-filme do FEP.
3. retrograde rotulagem dos neurônios dentro do Chip
Nota: Rotulagem retrógrada pode ser executada usando várias técnicas, incluindo o uso de vírus toxina e raiva de cólera modificados. Abaixo estão instruções para rotular os neurônios usando vírus da raiva-mCherry ou - eGFP G-excluído. Lidar com materiais potencialmente infecciosos de acordo com as diretrizes da organização local. Treinamento adicional pode ser necessário.
- Morno fresco neuronal meios de cultura para 37 ° C. Estime ~ 400 µ l de mídia por chip.
- Diluir a 100.000 unidades virais do vírus da raiva modificados em um total de 50 µ l utilizando mídia retirada qualquer bem do compartimento axonal.
Nota: Dispose de tubos em contato com o vírus de acordo com o protocolo aprovado organização e dicas. - Delicadamente, pipetar os restantes meios de comunicação dos poços do compartimento axonal e loja em uma centrífuga tubo a 37 ° C.
- Adicione 150 µ l de mídia quente fresca e a 50 µ l de vírus diluído para o compartimento axonal. Incube durante 2 h a 37 ° C incubadora.
- Remova a mídia que contém o vírus e eliminá-la corretamente.
Nota: Bolhas de ar podem tornar-se preso no chip se o fluido é aspirado dos principais canais. - Acrescente 75 µ l de mídia fresca para um axônio bem e deixe-a fluir para o axônio de outro bem.
- Remover fluxo através do axônio segundo bem e descartar adequadamente.
- Repita os passos de 3.6 e 3.7 uma vez.
- Adicionar mídia armazenada de volta para o compartimento axonal. Adicione aproximadamente 50 µ l fresco mídia, se necessário, para manter o volume adequado e retornar as células para a incubadora.
Nota: A expressão da proteína fluorescente é visível por 48 h e persiste por até 8 dias. Os neurônios podem ser fotografados para até 30 min. à temperatura ambiente em meios de cultura neuronal. Meios de cultura também podem ser substituídos por aquecido CO2-independente de hibernação E com B27 e fotografada por mais tempo. Os neurônios também podem ser fotografados dentro de uma câmara ambiental bem umidificada a 37 ° C e 5% de CO2. Neste caso, humidificação é fundamental para minimizar as perdas por evaporação dentro os chips, que é exacerbada pelo aquecimento e podem comprometer a saúde do neurônio.
4. fluídico isolamento do compartimento Axonal dentro do Chip
- Remover de 20 µ l do menor deixou bem do compartimento axonal e lugar dentro do poço superior direito do compartimento somático. Espere 2 min para o fluxo dentro de cada canal para equilibrar.
- Remova o compartimento axonal 50 µ l de mídia. Adicionar 0,3 µ l de maleica 1mm Alexa Fluor 488 para essa mídia, misturar através de pipeta e retornar de volta para o compartimento axonal. O chip está pronto para a imagem latente.
Nota: Podem ser adicionados outros compostos de interesse. Adicionar um corante fluorescente com um peso molecular similar como o composto de interesse é recomendado para monitorar fluídico isolamento ao longo do tempo.
5. executar Axotomy dentro do Chip
- Remova a mídia do compartimento do axonal, mantendo a ponta da pipeta longe da entrada do canal principal (Figura 2A) e armazená-lo num tubo de centrífuga.
- Aspire o compartimento axonal completamente, colocando a pipeta de aspiração perto de qualquer entrada do canal principal do compartimento axonal (Figura 2B). Continue a aspiração para 1-2 min. Certifique-se que a solução é completamente removida do compartimento.
Nota: O pressão do vácuo para aspiração deve ser pelo menos 18 polegadas-Hg para o procedimento axotomy para funcionar corretamente. - Substitua o compartimento axonal com a mídia armazenada e confirmar que os axônios são cortados por olhar para o chip sob um microscópio.
Nota: Se bolhas se formam no compartimento axonal quando substituindo os meios de comunicação, repita os passos 5.1-5.2. - Devolver o chip para a incubadora.
6. fluorescência Immunostaining dentro do Chip
- Preparar a solução de fixação de formaldeído de 4% em PBS (4% de formaldeído, 1 µM MgCl2, 0,1 µm CaCl2, sacarose 120 mM)
- Remover a maioria dos meios de comunicação nos poços do chip (não seque compartimentos interiores).
- Imediatamente Adicione 100 µ l de solução de fixação aos poços superiores dos compartimentos de axonal e somáticos.
- Depois de 1 min, adicione 100 µ l de solução de fixação nos poços de fundo. Correção para 30 min à temperatura ambiente.
- Remover a maior parte da solução dos poços do chip (não seque compartimentos interiores). Imediatamente adicione 150 µ l de PBS a cada um dos poços superiores dos compartimentos de axonal e somáticos. Espere 2 min para a PBS a fluir para os poços de fundo.
- Repita a etapa 6.5 duas vezes.
- Remova a maior parte da PBS dos poços do chip. Imediatamente adicione 150 µ l de PBS com 0,25% TritonX-100 para cada um dos poços superiores dos compartimentos de axonal e somáticos. Espere por 15 min.
- Remover a maior parte do líquido dos poços do chip e imediatamente adicionar 150 µ l de solução de bloqueio (10% de soro de cabra normal em PBS) para cada um dos poços superiores dos compartimentos de axonal e somáticos. Espere por 15 min.
Nota: Soluções eficazes de bloqueio deve ser específico ao anticorpo secundário, por exemplo, para um anticorpo secundário de antiburro ovelhas, usar soro burro na solução de bloqueio. - Remover a maior parte do líquido dos poços do chip e imediatamente adicionar 100 µ l de anticorpo primário (ou anticorpos) no soro de cabra normal de 1% em PBS a cada um dos poços superiores dos compartimentos de axonal e somáticos. Cobrir para minimizar a evaporação e esperar por 1h à temperatura ambiente ou a 4 ° C durante a noite.
- Remover a maior parte da solução dos poços do chip (não seque compartimentos interiores). Imediatamente adicione 150 µ l de PBS a cada um dos poços superiores dos compartimentos de axonal e somáticos. Espere 5 min para a PBS a fluir para os poços de fundo.
- Repita a etapa 6.10 duas vezes.
- Remover a maior parte do líquido dos poços do chip e imediatamente adicionar 100 µ l de anticorpo secundário (ou anticorpos) em PBS a cada um dos poços superiores dos compartimentos de axonal e somáticos. Cobrir para minimizar a evaporação e esperar por 1h à temperatura ambiente.
Nota: Consulte as instruções do fabricante para a diluição recomendada de anticorpos secundários. - Repita as etapas de 6.10-6.11.
- Se a imagem latente dentro de 1 dia de imunocoloração, manter o chip cheio de PBS. Se chip será armazenado mais de 1 dia antes da imagem latente, embrulhe o prato que contém o chip no filme de parafina para evitar a evaporação e armazenar a 4 ° C até que esteja pronto a imagem.
- Para armazenamento de longo prazo de amostras, meios de montagem (por exemplo, Fluoromount-G) podem ser usados.
- Remova a maior parte do líquido dos poços do chip. Use uma pipeta plástica descartável de 1ml para adicionar 2 gotas de mídia para cada um dos poços superiores dos compartimentos de axonal e somáticos de montagem.
- Incline o chip para estimular o fluxo da mídia montagem através dos canais. Depois de 5 min adicione 2 gotas nos poços de fundo. Espere por 1h antes de imagem.
Nota: Depois de usar meios de montagem não será possível re-sonda para outros alvos.
Resultados
Depois de aproximadamente 5-7 dias de crescimento de neurônio dentro do chip, o crescimento axonal é evidente. Os chips são compatíveis com imagens de contraste de fase, como demonstrado na Figura 3, que mostra o crescimento neuronal em 24 dias. Os chips são também compatíveis com fluorescência de imagem (Figura 4, Figura 5, Figura 6e Figura 7). Três dias após a infecção pelo vírus da raiva através do compartimento axonal, mCherry-positivo neurônios com axônios, estendendo-se para o compartimento axonal foram fotografados no chip (Figura 4). Para demonstrar a capacidade de fluidically isolar os compartimentos, um corante fluorescente de baixo peso molecular (Alexa Fluor 488 maleica) foi adicionado ao compartimento axonal. Estes resultados são comparáveis a câmara baseada em PDMS17 e demonstram a adequação do chip de plástico para imagem de fluorescência e contraste de fase.
Para ilustrar o crescimento neuronal com os dispositivos PDMS e chips de plástico, nós cultivadas neurônios em ambas as plataformas e monitorados crescimento neuronal ao longo do tempo. A Figura 5 mostra o crescimento neuronal de 3 a 22 dias na cultura; Estes resultados são representativos de 3 experimentos independentes. Crescimento neuronal é comparável dentro as duas plataformas até 15 dias em cultura, mas a cultura mais idades (> 21 dias) axônios isolados dentro do chip de plástico aparecem mais saudáveis com menos perolização (Figura 5A). Para visualizar mais axônios dentro dos compartimentos axonal, nós immunostained para III β-tubulina, que mostra o crescimento axonal saudável dentro do plástico lascas no 22 dias em cultura (Figura 5B).
Estudos de lesão e regeneração do axônio são comuns usando dispositivos microfluídicos compartimentalizado. Para demonstrar a adequação destes estudos usando os chips, retrógrada, rotulados de neurônios foram fotografada antes e 24h após a axotomy (Figura 6). Uma lâmpada de retração e regeneração do axônio são ambos evidente axotomy seguir. Estes resultados são equivalentes aos dados publicados usando dispositivos baseados em PDMS14,17.
Imunocitoquímica é uma técnica comum executada dentro compartimento de vários dispositivos para visualizar a localização da proteína. Após 24 dias em cultura, neurônios dentro os chips foram fixo e manchados para marcadores sinápticos excitatórios e inibitórios, vGlut1 e vGat, respectivamente (Figura 7). Neurônios mCherry rotulado retrógrado também foram imagem (Figura 7). Imagem latente foi realizada usando disco giratório confocal com objectivo de imersão um 60 × do silicone óleo, demonstrando a capacidade de realizar imagens de alta resolução. Importante, espinhas dendríticas eram evidentes dentro de uma região ampliada, demonstrando que os neurônios cultivados dentro os chips foram formando sinapses maduras.
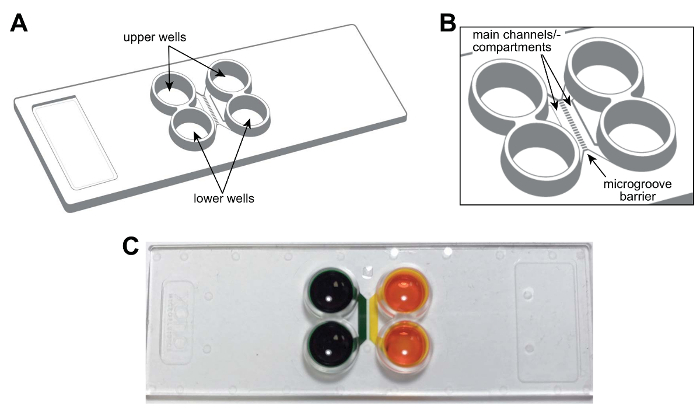
Figura 1 : Um chip pré-montados, plástico microfluidic dois-compartimento para compartimentar neurônios. (A) representação esquemática do chip multicompartment mostrando as localizações dos poços superiores e inferiores. (B) uma alargada do esquema do chip mostrando os canais principais (ou compartimentos) e microgrooves que conectam os compartimentos. Os principais canais são aproximadamente 1,5 mm × 7 × 0,060 mm (W × L × H). A largura e a altura do microgrooves são aproximadamente 0,01 mm × 0,005 mm, respectivamente. O comprimento da microgrooves varia dependendo da configuração, 0,15 mm a 0,9 mm. (C) A fotode um chip multicompartment representante, contendo alimentos de coloração tintura em cada canal principal ou compartimento, demonstrando a capacidade de fluidically Isole cada canal. Clique aqui para ver uma versão maior desta figura.
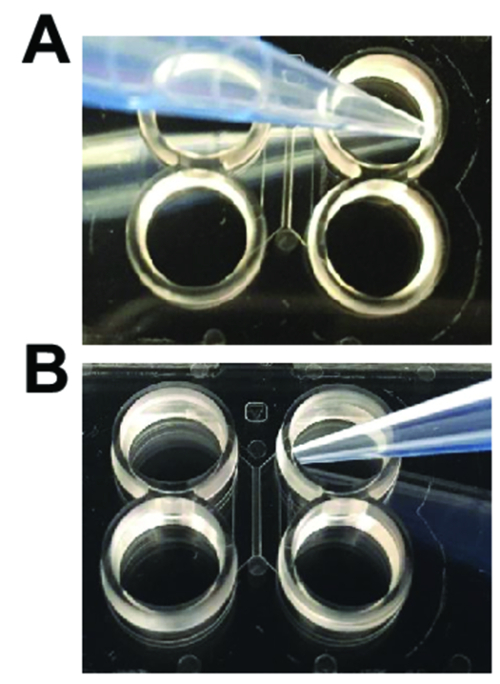
Figura 2 : Técnicas de pipetagem necessárias quando se utiliza chips de plástico multicompartment. (A) quando adicionando e mídia para lavagens de aspiração, a ponta da pipeta deve ser dobrada afastado da entrada do canal principal, conforme mostrado. (B) quando carregar neurônios ou realizando axotomy, a ponta da pipeta deve ser inclinado em direção à entrada do canal principal. Clique aqui para ver uma versão maior desta figura.
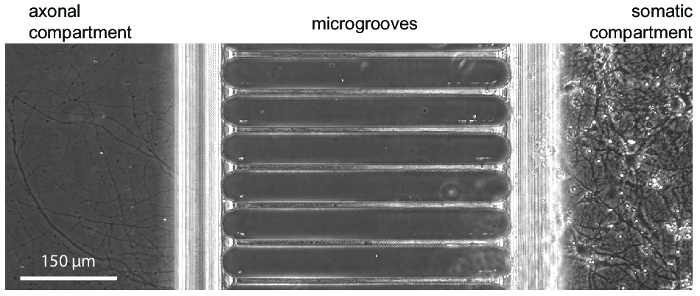
Figura 3 : Uma micrografia de contraste de fase mostrando típico crescimento neuronal dentro do chip em 24 dias em cultura. Os neurônios hippocampal embrionários foram semeados no compartimento da direita somático. Crescimento do axônio é visível no início do compartimento axonal em 5-7 dias. Clique aqui para ver uma versão maior desta figura.
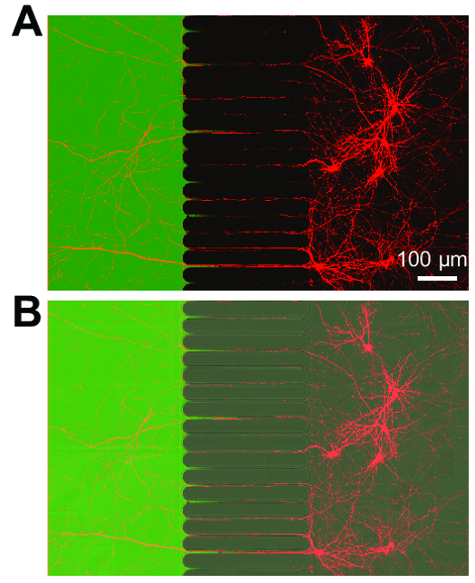
Figura 4 : Neurônios rotulados retrógrados express mCherry proteína fluorescente e axônios se estendem até um compartimento isolado fluidically axonal. (A) uma micrografia de fluorescência mesclado mostrando ao vivo neurônios rotulados retrógrados infectados por um vírus da raiva mCherry modificados brevemente aplicado ao compartimento axonal. Os neurônios foram imagem 3 dias pós infecção em 21 dias em cultura. Criar um microambiente isolada no interior do compartimento axonal é demonstrado pela aplicação de um corante de baixo peso molecular, Alexa Fluor 488 maleica. (B) uma imagem mesclada de (um), incluindo uma imagem de interferência diferencial (DIC) de contraste para visualizar a região microgrooves do chip. Imagens foram adquiridas com laser confocal microscópio usando um óleo de silicone de 30 × / 1,05 N.A. (ne = 1.406) da lente objetiva. Clique aqui para ver uma versão maior desta figura.
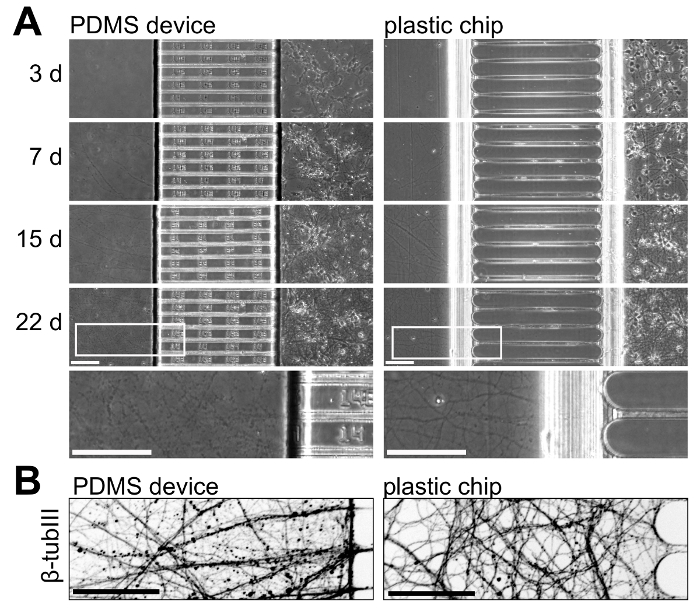
Figura 5 : Comparação lado-a-lado de crescimento neuronal dentro multicompartment dispositivos PDMS e chips de plástico. (A) fase micrografias de contraste de ambas as plataformas, tiradas em 3, 7, 15 e 22 dias em cultura. Na parte inferior, uma região de ampliação maior retirada as imagens em 22 dias é incluída para ilustrar o crescimento axonal nesta idade dentro de ambas as plataformas. Axônios dentro do chip são mais contínuos e aparecem mais saudáveis do que o dispositivo de PDMS nesta idade. (B) uma micrografia de imunofluorescência invertido de β-tubulina III manchado axônios no interior do compartimento axonal do dispositivo PDMS e chip de plástico em 22 dias em cultura. Imagens foram adquiridas com um fiação disco confocal sistema de imagem usando um 20 x / 0.45 N.A. da lente objetiva. Todas as barras de escala são 100 µm. clique aqui para ver uma versão maior desta figura.
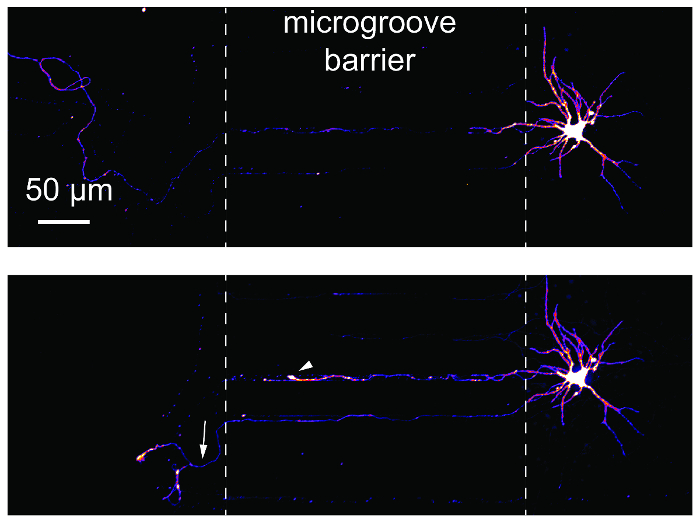
Figura 6 : Axotomy e regeneração de neurônios hippocampal dentro do chip multicompartment plástico. (Top) Os neurônios foram retrógrados rotulados usando um vírus de raiva mCherry modificados e então fotografada antes de axotomy em 24 dias em cultura. Imagens foram pseudocolored usando a tabela de consulta de cor 'Fogo'. (Parte inferior) O mesmo neurônio fotografado no painel superior foi imagem 24h post-axotomy. Linhas tracejadas brancas mostram as bordas da barreira de disco. Axotomy ocorreu na localidade de linha tracejada à esquerda. A seta branca mostra um bulbo de retração. A seta branca indica um axônio regeneradora. Imagens foram adquiridas com um fiação disco confocal sistema de imagem usando um 20 × / 0.45 N.A. objectiva. Clique aqui para ver uma versão maior desta figura.
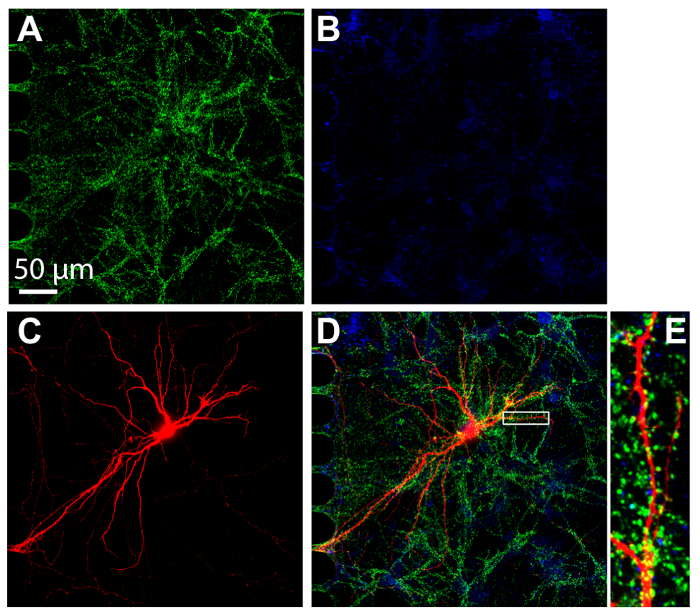
Figura 7 : Sinapses formam entre neurônios hippocampal cultivadas dentro de chips de plástico multicompartment. Immunostaining foi realizada em 24 dias em cultura e fotografada no interior do compartimento somático, usando uma lente de imersão de óleo de silicone 60 ×. Os neurônios expressam (A) o marcador de sinapse excitatória, vGlut1 (verde) e (B) o marcador de sinapse inibitória, vGAT (azul). (C) retrógrada rotulado mCherry neurônios (vermelhos) foram infectados através do vírus da raiva modificado aplicado ao compartimento axonal. (D) uma micrografia de fluorescência mesclado de vGlut1, vGat e mCherry. (E) a região ampliada em (D) indicado com uma caixa branca mostra espinhas dendríticas, os sites que recebem entrada sináptica de outros neurônios. Imagens foram adquiridas com um fiação disco confocal sistema de imagem usando um óleo de silicone 60 × / 1.3 N.A. (ne = 1.406) da lente objetiva. Clique aqui para ver uma versão maior desta figura.
| Chips de plástico multicompartment | Multicompartment dispositivos PDMS |
| isolar os axônios | isolar os axônios |
| estabelecer o microambiente | estabelecer o microambiente |
| neurônios axotomize | neurônios axotomize |
| opticamente transparente | opticamente transparente |
| compatível com imagens de alta resolução | compatível com imagens de alta resolução |
| compatível com microscopia de fluorescência | compatível com microscopia de fluorescência |
| totalmente montado | montagem de substrato necessária |
| axônios saudáveis > 21 dias | axônios saudáveis > 14 dias |
| superfície de cultivo hidrofílico | hidrofóbicos |
| gás impermeável | gás permeáveis |
| microgrooves arredondados e canais | microgrooves em linha reta |
| menos etapas de preparação | parte superior é removível para a coloração dentro microgrooves |
| Não é compatível com ablação a laser | absorção de pequenas moléculas & solventes orgânicos |
| Não é compatível com óleos de imersão à base de óleo mineral (óleos à base de silicone são bem) |
Tabela 1: Comparação de plástico e PDMS multicompartment plataformas para cultivo neurônios.
Discussão
Multicompartment de chips de plástico fornecem uma opção fácil de usar para compartimentar os neurônios, fornecendo culturas neuronal a longo prazo (> 3 semanas). Este protocolo detalha como cultura corticais e hippocampal murino neurônios dentro dessas fichas. A criação do microambiente solúvel e como retrograde neurônios de rótulo, realizar axotomy e executar imunocitoquímica também foram discutidos. Importante, esses chips são compatíveis com alta resolução, fluorescência e imagem ao vivo.
Multicompartment de chips de plástico fornecem muitas das mesmas funções que os dispositivos baseados em PDMS compartimentada, mas têm vantagens, desvantagens e algumas características distintivas. Tabela 1 fornece uma comparação de recursos do chip de plástico e dispositivos baseados em PDMS. Primeiro e acima de tudo, os chips são pré-montados e feitos permanentemente hidrofílicos, que facilita a molhadela, tornando-os mais fáceis de usar. O plástico não é gás permeável, ao contrário de PDMS, portanto se inesperadamente bolhas se formam dentro dos canais, eles não escapam facilmente e devem ser removidos. Uma solução de pre-revestimento contendo principalmente etanol e alguns outros agentes proprietários elimina a formação de bolhas.
Viver a imagem latente de projeções seguinte transdução da proteínas fluorescentes realizou-se dentro os chips (Figura 4) e não havia nenhum detectável autofluorescência do plástico. Uma ressalva é que óleos de imersão usados com o chip para objectivos de abertura numérica elevada devem ser à base de óleo de silicone e não base de óleo mineral. Óleo mineral pode causar uma reação adversa com o copolímero de olefina cíclica. Para a imagem latente brightfield, é importante notar que o microgrooves no chip são arredondados nas extremidades e há um afilamento gradual do z-direção dos principais canais para a barreira de disco causando alguma luz refração em das extremidades do microgrooves durante brightfield imaging (Figura 3). Porque o chip é pré-montado, penetração de anticorpo para as micro-empresas microgrooves pode ser irregular (como com dispositivos baseados em PDMS permanentemente ligados); assim, análise quantitativa immunostaining a seguir deve ser realizada nos canais/compartimentos. Immunostaining de projeções neuronais dentro do microgrooves pode ser melhorada através da criação de uma diferença de volume entre os compartimentos para auxiliar o fluxo de anticorpos e fluorophores no microgrooves.
Divulgações
A.M.T. é um inventor da câmara microfluidic/chip (nos 7419822 B2) e é um membro de Xona Microfluidics, LLC. V.P. é um empregado de Xona Microfluidics, LLC. J.H. é um membro de Xona Microfluidics, LLC. T.N. declara sem interesses financeiros concorrentes. Publicação de acesso aberto do presente artigo é patrocinada pela Xona Microfluidics.
Agradecimentos
Os autores reconhecem a assistência técnica ou editorial de Taylor Wilt (Xona), Smita Paranjape (UNC-Chapel Hill), Joyce Ciechanowski (Xona) e Brad Taylor (Xona). Os autores reconhecem o apoio de Xona Microfluidics, LLC e o Instituto Nacional de Saúde Mental (R42 MH097377). Imagem latente foi parcialmente suportado pelo Confocal e Multiphoton Imaging Core Facility de NINDS Center Grant P30 NS045892 e FORMULADORES Center Grant (U54 HD079124). O conteúdo é exclusivamente da responsabilidade dos autores e não representa necessariamente a opinião oficial do institutos nacionais da saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
Referências
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes? Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. Culturing Nerve Cells. , Second edition, MIT Press. (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados