Method Article
Использование предварительно собранные пластиковые Microfluidic чипов для допускаться первичной мышиных нейронов
В этой статье
Резюме
Этот протокол описывает использование пластиковых фишек, чтобы культура и устроены первичной мышиных нейронов. Эти чипы креплению, удобный и совместим с высоким разрешением, живут и флуоресценции изображений. Этот протокол описывает пластины гиппокампа крысы нейронов в пределах этих чипов и выполнять аэрогидродинамических изоляции, axotomy и иммуноокрашивания.
Аннотация
Microfabricated методы для compartmentalize нейроны стали важными инструментами для многие неврологи. Этот протокол описывает использование коммерчески доступных собранном пластиковых чип для допускаться Нейроны гиппокампа культивировали первичной крыса. Эти пластиковые фишки, содержащихся в след стандартной микроскопа совместимы с высоким разрешением, живут и флуоресценции изображений. Этот протокол демонстрирует ретроградной лейбл нейронов через изолированные аксонов, с использованием модифицированных бешенства вирус кодирования флуоресцентный белок, создавать изолированные микросреды в одном отсеке, и выполнять axotomy и immunocytochemistry на чипе. Нейроны культивировали для > 3 недели в пластиковые фишки, иллюстрирующие совместимость этих чипов для долгосрочного нейрональных культур.
Введение
Нейрон традиционной культуры подходов результат в случайных нарост аксонов и дендритов, препятствующие исследования нейронов в их уникальный поляризованные морфологии. Microfabricated многосредовой устройства стали устоявшихся и хорошо использовали исследовательских инструментов для неврологов в последние 10-15 лет (отдельных громких публикаций являются ссылки1,2,3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17). Эти устройства устроены нейронов и предоставляют метод для физически и химически манипулировать внутриклеточных регионов нейронов, включая somata, дендриты, аксоны и синапсы18,19. Они также предоставляют несколько экспериментальных парадигм, которые не возможно с использованием случайных культур, включая исследования аксональное транспорта, аксональное белкового синтеза, травмы/регенерации аксона и аксон Сома сигнализации. Базовая конфигурация 2-купе состоит из двух параллельных microfluidic каналов, разделенных серии небольших перпендикулярные microgrooves. Первичный или стволовых клеток, полученных нейронов покрыты в один из каналов microfluidic, урегулировать и прикрепить к нижней поверхности устройства и расширить невритов в течение дней. Многие конусы роста найти свой путь в microgrooves, которые достаточно малы, что они препятствуют клеток органов проникновения. Потому что конусы роста физически ограничены и не в состоянии повернуть вокруг внутри microgrooves, они растут прямо в отсеке рядом (аксональное отсека), где они изолированы.
Исторически эти устройства сформировали с помощью анонсированный (PDMS) с photolithographically рисунком мастер формы и сделал доме в лабораториях следователей или приобрели коммерчески. Один из главных недостатков с использованием PDMS является его гидрофобность20. PDMS могут быть сделаны гидрофильные временно, но затем быстро становится гидрофобные в течение часов в неводных среды20. Из-за этого устройства должны быть придает coverslip стекла или другой подходящий субстрат во время использования. Предварительно собранные пластиковые многосредовой фишки в настоящее время коммерчески доступных (например, XonaChips) литого пластика. Эти чипы изготавливаются постоянно гидрофильные, упрощения устройства увлажнения и позволяя Корпусообрабатывающее чип с тонкой пленкой циклических олефинов сополимер (COC) ограждающих microfluidic каналы на дне. Эти чипы изготавливаются в оптически прозрачный пластик, подходит для изображений с высоким разрешением флуоресценции.
Цель настоящего Протокола заключается в том, чтобы продемонстрировать использование предварительно собранные пластиковые microfluidic чипов для нескольких экспериментальных парадигм, с использованием мышиных гиппокампа или корковых нейронов. Этот протокол описывает ретроградной нейронов метки с помощью модифицированных бешенства вирус внутри чипа. Axotomy для исследования аксона травмы и регенерации также описаны. Наконец этот протокол показывает, как выполнить флуоресценции иммуноокрашивания с устройством.
протокол
Примечание: Схема пластиковые многосредовой чип показан на рисунке 1A, B. Чип представляет размер стандартного микроскопа (75 мм × 25 мм). Особенности чип, включая основные каналы или отсеков, колодцев и microgrooves помечены и предоставляются для использования в будущем. Рисунок 1 c является фотография чипа, демонстрируя аэрогидродинамических изоляции отсеков.
1. Подготовка и покрытие многосредовой чипов
- В кабинете био безопасности установите фишку в чашку Петри или других подходящих стерильный контейнер.
- 100 мкл предварительно покрытия решение верхней левой хорошо чипа и позволить ему поступать через основной канал в прилегающих хорошо.
Примечание: Решение предварительного покрытия используется для предварительно покрыть microfluidic каналы для устранения возможности захвата воздушных пузырьков внутри чипа. - Заливка, нижняя слева с 100 мкл предварительно покрытия решения. Подождите 5 минут, чтобы позволить решения потока через microgrooves.
- 100 мкл предварительно покрытия решение верхней правой хорошо и позволить ему поступать через основной канал в прилегающих хорошо. Заполните нижний правый колодец с 100 мкл предварительно покрытия решения.
- Аспирационная решение от каждой скважины. Аспирационная вдали от основных каналов, позволяющая избежать удаления жидкости из основных каналов (рис. 2A). Сразу же добавьте 150 мкл фосфат амортизированное saline (PBS) в левом верхнем хорошо. Ждать 1,5 мин.
Предупреждение: Не аспирационная все жидкости из закрытых магистральных каналов. - Хорошо добавьте 150 мкл PBS в левом нижнем. Подождите 5 минут, чтобы позволить жидкостей течь через microgrooves. Добавьте 150 мкл PBS в верхнем правом хорошо. Добавьте 150 мкл PBS снизить право хорошо. Подождите 10 минут.
- Повторите шаги 1.5-1.6 для второй мыть PBS.
- Проверка чип под микроскопом культуры ткани для пузырей в основные каналы. Если присутствуют пузырьки, выполните описанные ниже процедуры. Если присутствуют не пузыри, перейдите к шагу 1.9.
- Аспирационная PBS из скважин, рыбалка наконечник пипетки от канала, открытие (рисунок 2A).
- Отказаться от 100 мкл предварительно покрытия решения в верхней колодец, рыбалка кончиком пипетки рядом с каналом, открытие (рис. 2B). Пузырьки должны двигаться через канал в нижней колодец. Ждать 1,5 мин.
- Повторите шаги 1.3-1.8.
- Аспирационная PBS из скважин, рыбалка наконечник пипетки от канала, открытие (рисунок 2A).
- 100 мкл 0.5 мг/мл поли d Лизин (PDL), в верхней левой хорошо чипа. Ждать 1,5 мин заполнения нижней левой хорошо с 100 мкл PDL.
- Добавьте 100 мкл PDL в верхней правой хорошо чипа. Ждать 1,5 мин добавить 100 мкл в нижней правой хорошо.
- Закройте чашку Петри и поместите фишку в инкубаторе при 37 ° C за 1 ч.
- Повторите шаги с PBS мыть 1.5-1.6 дважды, чтобы удалить избыток PDL.
- Аспирационная PBS от устройства.
- Сразу же добавьте 100 мкл клетки культуры средств массовой информации к верхней левой хорошо чипа. Хорошо, подождите 1,5 мин добавить средства массовой информации в нижнем левом углу. Добавьте средства массовой информации к верхней право хорошо. Ждать 1,5 мин добавить 100 мкл средней и нижней правой чипа.
- Установите фишку в инкубаторе 37° C до готовности плита клетки.
2. Заполнение нейронов в многокомпонентных фишки
- Готовят суспензию клеток гиппокампа нейронов диссоциированных крыса согласно установленных протоколов21,22 приносить плотность ~ 12 × 106 клеток/мл.
Примечание: Использование клеток подвеска плотности между 3 и 12 × 106 клеток/мл возможен. Если используется более низкую плотность, объем суспензии клеток, чтобы быть добавлены к обломоку может быть увеличено (см. ниже). Описанные ниже процедура применима для мышиных диссоциированных нейронов коры головного мозга и гиппокампе. Оптимальное ячейки плотности для других типов нейрон может варьироваться. - Удалите часть средств массовой информации в каждой скважине чипа, оставив примерно 5 мкл в каждой скважине. Аспирационная вдали от основных каналов, позволяющая избежать удаления жидкости из основных каналов (рис. 2A).
Предупреждение: Не аспирационная жидкости из закрытых магистральных каналов. Пузырьки воздуха может стать в ловушке в чипе если жидкость придыханием из главных каналов. - Загрузить 5 мкл суспензии клеток в верхнем правом хорошо и еще 5 мкл суспензии клеток в нижней правой хорошо (~ 120 000 клеток всего). Загрузите клетки путем отказа недалеко от основного канала (рис. 2B). Проверить под микроскопом, чтобы убедиться, что нейроны находятся в основной канал. Подождите 5 минут позволить клетки для присоединения.
Примечание: Нейроны могут быть загружены либо отсек. Для разъяснения целей соматического отделения является основным каналом на правой стороне, но либо отсек может использоваться как соматического отделения. Использование нижней плотности клеток вплоть до 60 000 ячеек на чип возможен. До 10 мкл ячейки подвески могут быть добавлены к каждому и соматического отделения в сочетании с суспензию клеток с меньшим количеством ячеек, чем описано выше. - Добавить примерно 150 мкл нейрональных культуры средств массовой информации для каждого из верхней и нижней правой скважин, а затем добавить 150 мкл средств массовой информации каждому из верхней и нижней левой скважин. Установите фишку в увлажненные лоток в инкубатор 37 ° C 5% CO2 .
- После 24 часов выполните изменения СМИ, удалив СМИ из скважин. Убедитесь, что основной канал по-прежнему заполнены. 150 мкл СМИ для каждого верхнего колодца, а затем заполнить дно скважины.
- Место чипа обратно в инкубаторе для нужное количество дней.
Примечание: Мониторинг СМИ каждые несколько дней, чтобы убедиться, что он остается светло-розовый. Если средства массовой информации желтоватый, замените 50% его свежим СМИ. Если уровень жидкости низка, убедитесь, что нет надлежащего влажности и соответствующие вторичные сдерживания чипов для предотвращения испарения. Минимизация или даже ликвидации, средства массовой информации изменения можно с помощью вторичных сдерживания и/или пробега блюдо, содержащих чип с политетрафторэтилена (ПТФЭ)-фильм FEP.
3. ретроградной маркировки нейронов в чип
Примечание: Ретроградная маркировки может выполняться с использованием нескольких методов, включая использование модифицированных холеры токсин и бешенства вирус. Ниже инструкции для маркировки нейроны используют вирус бешенства mCherry или - eGFP, G-удалены. Обрабатывать потенциально инфекционные материалы согласно местной организации руководящих принципов. Может потребоваться дополнительная подготовка.
- Тепло свежих нейрональных культуры СМИ до 37 ° C. По оценкам ~ 400 мкл СМИ на чип.
- Разбавляют 100 000 единиц вирусный вируса бешенства модифицированных в общей сложности 50 мкл, с использованием средств массовой информации, взятые из либо хорошо из аксональное отсека.
Примечание: Утилизация советы и трубы при контакте с вирус согласно организации утвердил протокол. - Аккуратно накапайте оставшихся средств массовой информации из скважин аксональное салона и магазина в центрифуге трубки при 37 ° C.
- Добавьте 150 мкл свежий теплый СМИ и 50 мкл разбавленного вируса в отсеке аксональное. Проинкубируйте втечение 2 ч при 37 ° C инкубатора.
- Удалите носитель, содержащий вирус и распоряжаться его должным образом.
Примечание: Пузырьки воздуха может стать в ловушке чип если жидкость придыханием из главных каналов. - Аккуратно мкл 75 свежие средства массовой информации в один Аксон хорошо и позволить ей поток других аксон хорошо.
- Удаление потока через из второй аксон хорошо и утилизировать.
- Повторите шаги, 3,6 и 3,7 один раз.
- Добавить вернуться аксональное отсека носителей. Добавьте около 50 мкл свежие средства массовой информации, при необходимости, для поддержания адекватного объема и возвращение клетки в инкубаторе.
Примечание: Флуоресцентный белок выражение видимым на 48 ч и сохраняется на срок до 8 дней. Нейроны могут быть imaged для до 30 мин при комнатной температуре в нейрональных культуры средств массовой информации. Средства массовой информации культуры также может быть заменен с утепленным CO2-независимых спящий E с B27 и образы для больше. Нейроны могут также образы в хорошо увлажненные экологической палаты при 37 ° C и 5% CO2. В этом случае увлажнения имеет решающее значение для минимизации испарительного потери в пределах фишки, которая усугубляется Отопление и может поставить под угрозу здоровье нейрон.
4. аэрогидродинамических изоляции аксональное отсека внутри чипа
- Удаление 20 мкл из нижнего слева хорошо аксональное отсека и место в верхней правой колодец соматического отделения. Подождите 2 мин для потока в каждом канале, чтобы сбалансировать.
- Удаление 50 мкл СМИ из аксональное отсека. 0,3 мкл 1 мм Alexa Fluor 488 гидразида этот СМИ, перемешать через пипетки и вернуться обратно в отсеке аксональное. Чип готова к визуализации.
Примечание: Могут быть добавлены другие соединения интереса. Для того чтобы контролировать аэрогидродинамических изоляции с течением времени рекомендуется добавить Люминесцентную краску с молекулярной массой аналогичных как соединение интереса.
5. выполнение Axotomy в чип
- Извлеките из отсека аксональное, сохраняя наконечник пипетки от входа в главный канал (рисунок 2A) и хранить его в пластиковых пробирок.
- Аспирационная аксональное отсек полностью, поместив стремление накапайте либо входом главного русла аксональное отсека (рис. 2B). Продолжать аспирации для 1-2 мин убедитесь, что решение полностью удаляется из отсека.
Примечание: Вакуумного давления для аспирации должно быть по меньшей мере 18 дюйм Hg для axotomy процедуры для правильной работы. - Замените аксональное отсека носителей и подтвердите, что аксоны разорваны, глядя на чип под микроскопом.
Примечание: Если пузыри форме в отсеке аксональное при замене СМИ, повторите шаги 5.1-5.2. - Возвращение чип в инкубаторе.
6. флуоресценции иммуноокрашивания внутри чипа
- Подготовка 4% раствора формальдегида фиксации в PBS (4% формальдегида, 1 мкм MgCl2, 0,1 мкм CaCl2, сахароза 120 мм)
- Удалить большую часть средств массовой информации в скважинах чип (не сушите внутренних отсеков).
- Сразу же добавьте 100 мкл раствора фиксации Топ колодцы аксональное и соматического отделения.
- После 1 мин добавьте 100 мкл раствора фиксации нижней скважины. Исправление для 30 мин при комнатной температуре.
- Удалить большую часть решения из скважин чип (не сушите внутренних отсеков). Немедленно добавьте 150 мкл PBS в каждую из Топ колодцы аксональное и соматического отделения. Подождите 2 мин для PBS поступать в нижней скважины.
- Повторите шаг 6.5 дважды.
- Удалите большую часть PBS из скважин чипа. Сразу же добавить 150 мкл PBS с 0,25% TritonX-100 для каждого из Топ колодцы аксональное и соматического отделения. Подождите 15 минут.
- Удалить большую часть жидкости из скважин чипа и сразу же добавить 150 мкл раствора (10% нормальной козьего сыворотки в PBS) блокировки для каждого из Топ колодцы аксональное и соматического отделения. Подождите 15 минут.
Примечание: Эффективного блокирования решения должны быть специфическими для вторичного антитела, например, на вторичные антитела анти овец осла, используйте осла сыворотки в решении блокировки. - Удалить большую часть жидкости из скважин чипа и сразу же добавить 100 мкл основного антитела (или антител) в 1% нормальной козьего сыворотки в PBS каждому из Топ колодцы аксональное и соматического отделения. Обложка к минимуму испарение и ждать 1 ч при комнатной температуре или 4 ° C на ночь.
- Удалить большую часть решения из скважин чип (не сушите внутренних отсеков). Немедленно добавьте 150 мкл PBS в каждую из Топ колодцы аксональное и соматического отделения. Подождите 5 минут для PBS поступать в нижней скважины.
- Повторите шаг 6.10 дважды.
- Удалить большую часть жидкости из скважин чипа и сразу же добавить 100 мкл и вторичные антитела (антитела) в PBS каждому из Топ колодцы аксональное и соматического отделения. Обложка к минимуму испарение и ждать 1 ч при комнатной температуре.
Примечание: Обратитесь к инструкциям производителя для рекомендуется разбавление вторичных антител. - Повторите шаги 6.10-6.11.
- Если изображение в течение 1 дня иммуноокрашивания, держите чип, заполнены с PBS. Если чип будет храниться дольше, чем за 1 день до изображений, оберните блюдо, содержащих чип в фильме парафин для предотвращения испарения и хранить при 4 ° С до готовности к изображению.
- Для более длительного срока хранения образцов могут использоваться монтажные средства массовой информации (например, Fluoromount-G).
- Удалите большую часть жидкости из скважин чипа. Используйте одноразовые пластиковые пипетки 1 мл добавить 2 капли монтажные средства массовой информации каждому из Топ колодцы аксональное и соматического отделения.
- Наклоните чип, чтобы стимулировать приток монтажные средства массовой информации через каналы. После 5 минут добавьте 2 капли на дно скважины. Подождите 1 час перед изображений.
Примечание: После использования монтажа СМИ не удастся повторно зонда для других целей.
Результаты
После примерно 5-7 дней нейрон роста в пределах чип аксональное рост является очевидным. Фишки, совместимы с фазово контрастной визуализации, как продемонстрировано в рисунке 3, которая показывает рост нейронов на 24 дня. Фишки также совместимы с флуоресценцией изображений (Рисунок 4, Рисунок 5, Рисунок 6и рис. 7). Через три дня после заражения вирусом бешенства через аксональное отсека, mCherry позитивных нейронов с аксоны в отсеке аксональное были образы на чипе (рис. 4). Продемонстрировать способность fluidically изолировать отсеков, низкий молекулярный вес Люминесцентную краску (Alexa Fluor 488 гидразида) был добавлен в отсеке аксональное. Эти результаты сопоставимы с камеры на основе PDMS17 и продемонстрировать пригодность пластиковых чип для фазово контрастной и флуоресценции изображений.
Чтобы проиллюстрировать нейрональных роста с пластиковых фишек и PDMS устройств, мы культивировали нейронов в обеих платформах и мониторинг нейрональных рост с течением времени. Рисунок 5 показывает нейрональных рост от 3 до 22 дней в культуре; Эти результаты являются представитель 3 независимых экспериментов. Нейрональных рост сопоставимых в пределах двух платформ до 15 дней в культуре, но больше культуры возрастов (> 21 дня) Аксоны изолированы в пластиковых чип появляются здоровыми с менее бисером (Рисунок 5A). Чтобы визуализировать аксонов внутри аксональное отсеков, мы immunostained для β-тубулина III, который показывает здорового аксональное роста в пределах пластиковые фишки на 22 дня в культуре (Рисунок 5B).
Аксон травмы и регенерации исследования являются общими, используя microfluidic разобщенным устройств. Чтобы продемонстрировать пригодность этих исследований с использованием микросхемы, ретроградная помечены нейронов были образы до и 24 h после axotomy (рис. 6). Ретракция луковицу и регенерации аксона являются оба очевидны следующие axotomy. Эти результаты являются эквивалентными опубликованных данных, с помощью устройств на базе PDMS14,17.
Immunocytochemistry является распространенным приемом в многокамерных устройства для визуализации локализация протеина. После 24 дней в культуре, нейроны в пределах фишки были фиксированной и витражи для возбуждающих и тормозящий синаптических маркеров, vGlut1 и vGat, соответственно (рис. 7). Ретроградная помечены mCherry нейроны были также фотосъемка (рис. 7 c). Изображений проводилось с использованием вращающийся диск конфокальный с 60 × силиконовые масла погружения цели, демонстрируя способность выполнять с высоким разрешением изображения. Важно отметить, что дендритных шипиков были очевидны в увеличенном региона, демонстрируя, что нейроны, культивируемых в фишки формирования зрелой синапсы.
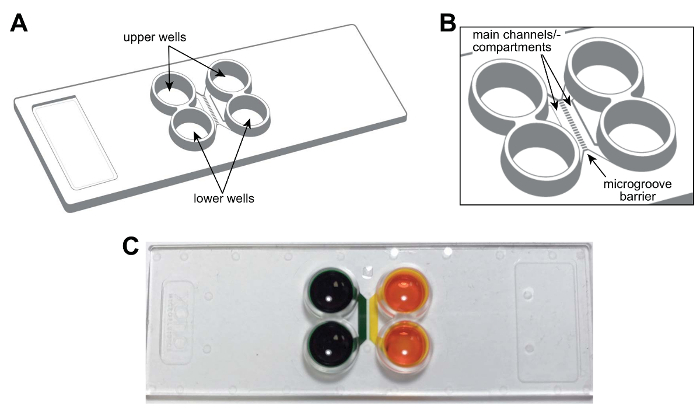
Рисунок 1 : Готовые, пластиковые двухкамерные microfluidic чип для допускаться нейронов. (A) схематическое представление многосредовой чип, показаны расположения верхнего и нижнего скважин. (B) расширенного схема микросхемы, показаны основные каналы (или отсеков) и microgrooves, которые соединяют отсеков. Основные каналы являются примерно 1,5 мм × 7 × 0,060 мм (Ш × L × H). Ширина и высота microgrooves являются приблизительно 0,01 мм × 0,005 мм, соответственно. Длина microgrooves варьируется в зависимости от конфигурации, 0,15 мм до 0.9 мм. (C) А фотографию представителя многосредовой чип, содержащий краситель красителя в каждой основной канал или отсека, демонстрируя способность fluidically Изолируйте каждого канала. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
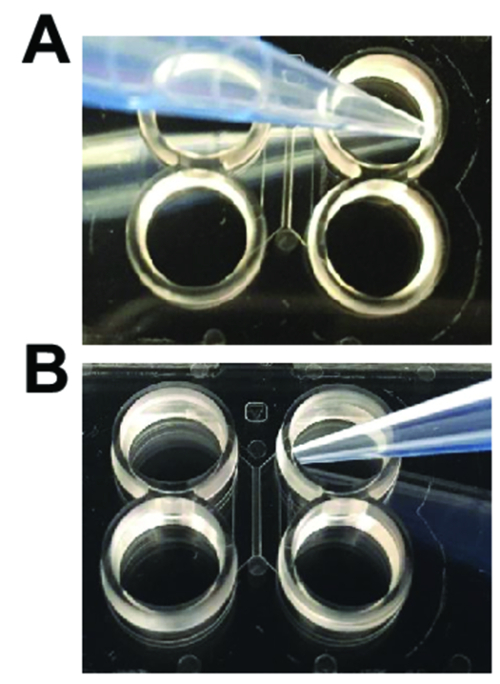
Рисунок 2 : Дозирования методы, необходимые при использовании пластиковых многосредовой фишек. (A) при добавлении и аспирационных СМИ для смывки, наконечник пипетки следует быть угловой от входа в главный канал, как показано. (B) когда загрузки нейронов или выполнения axotomy, наконечник пипетки должно быть под углом к входу главного канала. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
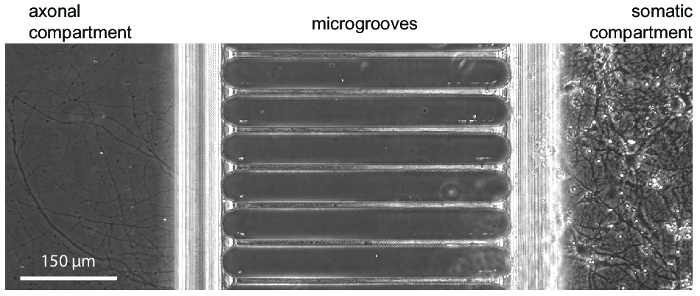
Рисунок 3 : Микрофотография контраст фазы, показаны типичные нейрональных роста в пределах чип на 24 дня в культуре. Эмбриональных Нейроны гиппокампа были посеяны в отсеке справа соматических. Аксон рост является видимым в начале аксональное отсека на 5-7 дней. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
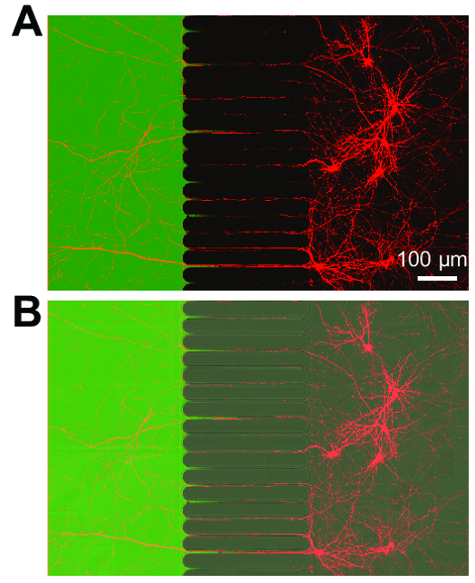
Рисунок 4 : Ретроградная помечены нейронов Экспресс mCherry флуоресцентный белок и продлить аксоны fluidically изолированные аксональное отсек. (A) Объединенные флуоресценции Микрофотография показаны живой Ретроградная помечены нейронов, инфицированных через изменение mCherry вирус бешенства, кратко применяется к аксональное отсека. Нейроны были образ 3 дня после инфекции на 21 день в культуре. Создание изолированных микроокружения в отсеке аксональное подтверждается применение низкомолекулярных красителя, Alexa Fluor 488 гидразида. (B) объединенного изображения (), включая образ контраст (DIC) дифференциальной помехи для визуализации регионе microgrooves чипа. Изображения были приобретены с лазерного сканирования конфокального микроскопа с помощью силиконового масла 30 × в 1.05 н.а. (ne = 1,406) объектива. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
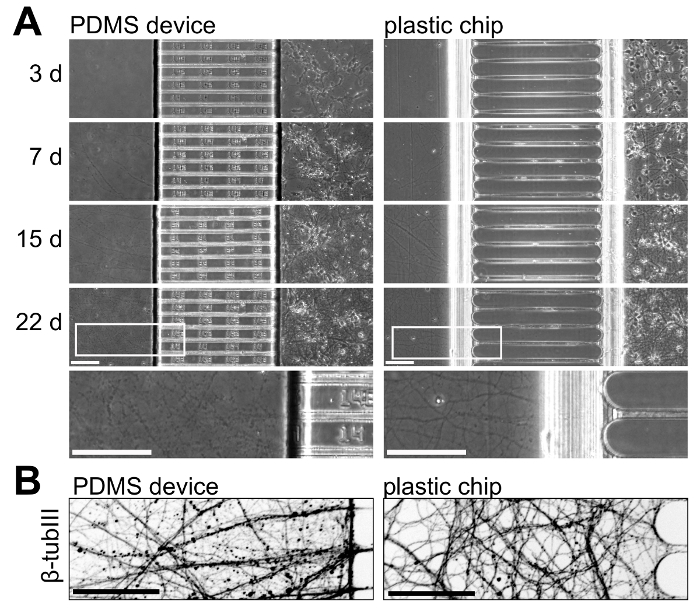
Рисунок 5 : Бок о бок сравнение нейрональных роста в многокомпонентных PDMS устройства и пластиковые фишки. (A) фаза контраст микроскопии обеих платформ, принятыми на 3, 7, 15 и 22 дней в культуре. В нижней части выше увеличение региона взяты из изображений на 22 дня входит проиллюстрировать аксональное роста в этом возрасте в обеих платформах. Аксоны в чип более непрерывный и появляются более здоровыми, чем в PDMS устройства в этом возрасте. (B) инвертировать иммунофлюоресценции Микрофотография β-тубулина III витражи аксоны в отсеке аксональное PDMS устройства и пластиковых чип на 22 дня в культуре. Изображения были приобретены с спиннинг диск конфокальный тепловизионные системы с использованием 20 x / 0.45 н.а. объектива. Все бары масштаба являются 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
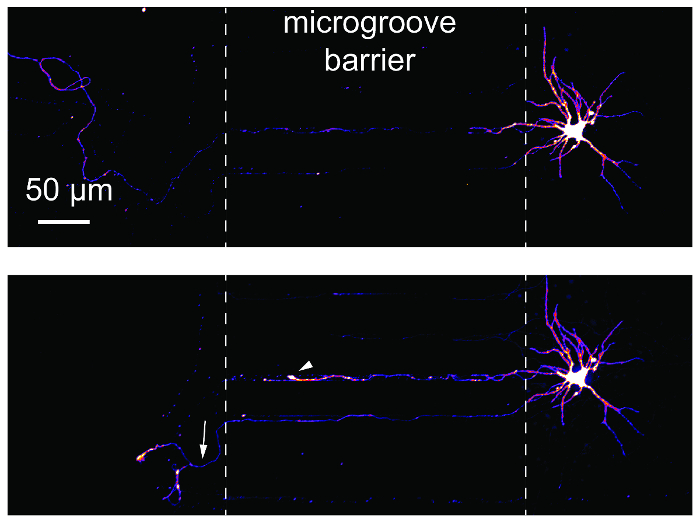
Рисунок 6 : Axotomy и регенерации гиппокампа нейронов в пластиковых многосредовой чип. (Вверху) Нейроны были ретроградным помечены с помощью модифицированных mCherry вирус бешенства и затем отображаемого перед axotomy на 24 дня в культуре. Изображения были pseudocolored с помощью просмотровой таблице «Огонь» цвет. (Внизу) Же нейрон, отображаемого в верхней панели был образ 24 h пост axotomy. Белый пунктирные линии показывают границы microgroove барьер. Axotomy произошло на месте левого пунктирной линии. Белая стрелка показывает Ретракция лампы. Белая стрелка указывает регенерации аксона. Изображения были приобретены с спиннинг диск конфокальный тепловизионные системы с использованием 20 × / 0,45 н.а. объектив. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
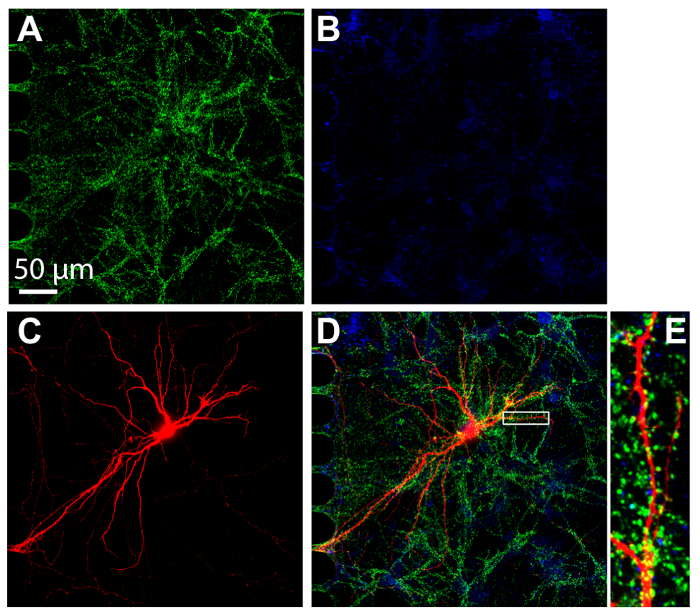
Рисунок 7 : Синапсов формы между гиппокампа нейронов, культивируемых в пластиковые фишки многосредовой. Иммуноокрашивания была исполнена на 24 дня в культуре и отражаться в отсеке соматических, используя объектив погружения 60 × силиконовые масла. Нейроны Экспресс (A) маркер возбуждающим синапса, vGlut1 (зеленый) и (B) маркер ингибирующее синапса, vGAT (синий). (C) Ретроградная помечены mCherry, которую нейронов (красный) были инфицированы через вирус бешенства модифицированных, применяется к аксональное отсека. (D) Объединенные флуоресценции Микрофотография vGlut1, vGat и mCherry. (E) увеличенное региона в (D) указано с белой коробке показывает дендритных шипиков, сайты, которые получают синаптических вход от других нейронов. Изображения были приобретены с закручивая диск конфокальный изображений системы с использованием силиконового масла 60 × / 1,3 Н.А (ne = 1,406) объектива. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Пластиковый многосредовой фишки | PDMS многосредовой устройства |
| изолировать аксонов | изолировать аксонов |
| Создание микросреды | Создание микросреды |
| axotomize нейроны | axotomize нейроны |
| оптически прозрачный | оптически прозрачный |
| совместимость с высоким разрешением изображений | совместимость с высоким разрешением изображений |
| совместим с микроскопии флуоресцирования | совместим с микроскопии флуоресцирования |
| полностью собран | Ассамблеи для субстрата необходимых |
| здоровые аксоны > 21 дней | здоровые аксоны > 14 дней |
| Гидрофильные культивирования поверхности | гидрофобная |
| непроницаемый газ | проницаемого газа |
| округлые microgrooves и каналы | прямой microgrooves |
| меньшее количество этапы подготовки | Top является съемным для пятнать в microgrooves |
| не совместим с лазерной абляции | поглощение малых молекул и органических растворителей |
| не совместимо с маслами погружения на основе минерального масла (на основе силиконового масла являются штраф) |
Таблица 1: Сравнение пластика и PDMS многосредовой платформ для культивирования нейронов.
Обсуждение
Пластиковые многосредовой микросхемы обеспечивают возможность easy-to-use допускаться нейронов, обеспечивая долгосрочное нейрональных культур (> 3 недели). Этот протокол описывает культура мышиных нейронов коры головного мозга и гиппокампе в пределах этих чипов. Были также обсуждены создание растворимых микросреды и как Ретроградная лейбл нейронов, axotomy, с выполнением иммуноцитохимии. Важно отметить, что эти чипы совместимы с высоким разрешением, флуоресценции и живой изображений.
Пластиковые многосредовой фишки обеспечивают многие из тех же функций как PDMS-устройств на базе разобщенным, но имеют свои преимущества, недостатки и некоторые отличительные черты. Таблица 1 содержит сравнение пластиковых чип и устройств на базе PDMS. Прежде всего чипы являются предварительно собранных и сделал постоянно гидрофильные, которая облегчает смачивания, что делает их легче использовать. Пластик не является газа проницаемыми, в отличие от PDMS, так что если пузыри форма неожиданно в каналы, они не легко бежать и должны быть удалены. Предварительное покрытие раствор, содержащий главным образом этанола и некоторые другие проприетарные агенты исключает формирования пузыря.
Живут изображений прогнозов, выполненных следующие трансдукции флуоресцентных белков внутри микросхемы (Рисунок 4) и там было не обнаружено аутофлюоресценция пластика. Предостережение, что погружение масла, используемые с чип для целей высокая числовая апертура должна быть силиконовое масло на основе, а не минерального масла на основе. Минеральное масло может вызвать негативную реакцию с сополимером циклических олефинов. Для brightfield изображений, важно отметить, что microgrooves в чипе закруглены на концах, и постепенно сужающийся z направлении магистральных каналов к microgroove барьер, вызывая некоторые преломление света на любом конце microgrooves во время brightfield изображений (рис. 3). Потому что чип собранном, антитела проникновения в microgrooves микронных размеров может быть неравномерным (как с постоянно кабального устройств на базе PDMS); Таким образом количественный анализ, после иммуноокрашивания должны выполняться в отсеках каналы. Иммуноокрашивания нейронов прогнозов в microgrooves может быть улучшено путем создания тома разница между отсеками для помощи потока антител и флуорофоров в microgrooves.
Раскрытие информации
A.M.T. — изобретатель microfluidic камеры/чипа (нас 7419822 B2) и является членом Xona микрофлюидика, LLC. В.п. является сотрудником микрофлюидика Xona, LLC. J.H. является членом Xona микрофлюидика, LLC. Т.н. объявляет без финансовых интересов. Открытого доступа публикации этой статьи авторами микрофлюидика Xona.
Благодарности
Авторы признают технические или редакционные помощи от увядания Тейлор (Xona), Paranjape Смита (КООН-Чапел-Хилл), Джойс Ciechanowski (Xona) и Брэд Тейлор (Xona). Авторы признают поддержке микрофлюидика Xona, LLC и Национальный институт психического здоровья (R42 MH097377). Визуализация поддержали частично Confocal и Multiphoton Imaging основного объекта из NINDS центра Грант P30 NS045892 и NICHD центр Грант (U54 HD079124). Содержание является исключительно ответственности авторов и не обязательно отражают официальную точку зрения национальных институтов здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
Ссылки
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes? Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. Culturing Nerve Cells. , Second edition, MIT Press. (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены