Method Article
שימוש של שבבי Microfluidic פלסטיק מראש ממדר נוירונים מאתר העיקרי
In This Article
Summary
פרוטוקול זה מתאר את השימוש שבבי פלסטיק תרבות, ממדר אותם נוירונים מאתר העיקרי. . הצ'יפס הזה preassembled, ידידותי למשתמש, תואם עם רזולוציה גבוהה, לחיות, קרינה פלואורסצנטית והדימות. פרוטוקול זה מתאר את אופן צלחת החולדה הנוירונים בהיפוקמפוס בתוך הצ'יפס הזה ולבצע בידוד fluidic, axotomy ו- immunostaining.
Abstract
Microfabricated שיטות להפריד נוירונים הפכו לכלי חיוני עבור מדעני מוח רבים. פרוטוקול זה מתאר את השימוש שבב זמינים מסחרית פלסטיק מראש עבור ממדר נוירונים בהיפוקמפוס החולדה הראשית בתרבית. פלסטיק, הנכלל עם טביעת רגל של שקופית מיקרוסקופ רגיל, הצ'יפס הזה תואם ברזולוציה גבוהה, לחיות, קרינה פלואורסצנטית והדימות. פרוטוקול זה מדגים כיצד ייסוג תווית הנוירונים באמצעות אקסונים מבודדים באמצעות וירוס הכלבת ששונה קידוד החלבון הניאון, ליצור microenvironments מבודדים בתוך תא אחד ולבצע axotomy ו- immunocytochemistry על שבב. נוירונים מתורבתים בשביל > 3 שבועות בתוך שבבי פלסטיק, הממחישות את התאימות של האסימונים עבור תרבויות עצביים לטווח ארוך.
Introduction
התרבות המסורתית נוירון ניגש תוצאה תוצר אקראי של אקסונים, דנדריטים, למנוע את המחקר של נוירונים במורפולוגיה מקוטב הייחודי שלהם. התקנים multicompartment Microfabricated הפכו כלי מחקר ומבוססת ומשמש היטב עבור מדעני מוח בשנים 10-15 (פרסומים בעלי פרופיל גבוה הם המופנה1,2,3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17)-התקנים אלה ממדר אותם נוירונים ומספקות שיטה פיזית, כימית לתפעל את האזורים subcellular של הנוירונים, כולל somata, דנדריטים, אקסונים של הסינפסות18,19. הם גם מספקים מרובים פרדיגמות ניסיוני זה אינן אפשריות באמצעות תרביות אקראי, כולל מחקרים של תחבורה עצב, סינתזה של חלבון עצב, האקסון פציעה/התחדשות, והאיתות האקסון-כדי-סומא. ההגדרות הבסיסיות של 2-תא מורכב בשני ערוצים במקביל microfluidic מופרדים על ידי סדרה של microgrooves בניצב קטנים יותר. ראשי או תאי גזע-derived הנוירונים הם מצופה לאחד הערוצים microfluidic, ליישב, לצרף מהמשטח התחתון של המכשיר, ומתחו neurites במרוצת הימים. קונוסים צמיחה רבים מוצאים את דרכם לתוך microgrooves, אשר הם קטנים מספיק שהם מונעים תא גופות מלהיכנס. בגלל הצמיחה קונוסים מוגבלת פיזית ולא יכולתי להסתובב בתוך microgrooves, הם גדלים ישר לתוך התא הסמוך (תא עצב) איפה הם מבודדים.
מבחינה היסטורית, התקנים אלה יצוק באמצעות poly(dimethylsiloxane) (PDMS) של תבנית הבסיס photolithographically בדוגמת הן עשה בתוך הבית במעבדות של חוקרים או לרכוש באופן מסחרי. אחד החסרונות העיקריים של שימוש PDMS הוא hydrophobicity שלה20. PDMS יכול להתבצע הידרופילית באופן זמני, אבל אז במהירות הופך הידרופובי בתוך שעות ב-מימית לסביבה20. מסיבה זו, המכשירים יש לצרף coverslip של זכוכית או מצע מתאים אחרים בזמן השימוש. מראש שבבי multicompartment פלסטיק נמצאים כעת זמינים מסחרית (למשל, XonaChips) בהזרקת פלסטיק. השבבים האלה נעשים הידרופילית לצמיתות, פישוט הרטבה מכשיר ומאפשר הרכבה טרום של השבב עם סרט דק של קופולימר אולפין מחזורית (קוק) תוחמת את ערוצי microfluidic על החלק התחתון. השבבים האלה מיוצרים בפלסטיק שקוף אופטית מתאימה דימות ברזולוציה גבוהה זריחה.
המטרה של פרוטוקול זה היא להדגים את השימוש האסימונים microfluidic פלסטיק מראש עבור מספר פרדיגמות ניסיוני המבוצעת באמצעות מאתר נוירונים בהיפוקמפוס או קליפתי. פרוטוקול זה מתאר כיצד ייסוג תווית הנוירונים באמצעות וירוס הכלבת ששונה בתוך השבב. גם מתוארים Axotomy ללימודים של האקסון פציעה והתחדשות. לבסוף, פרוטוקול זה מראה כיצד לבצע immunostaining זריחה עם המכשיר.
Protocol
הערה: תיאור סכמטי של השבב multicompartment פלסטיק מוצג איור 1A, B. השבב הוא הגודל של שקופית מיקרוסקופ רגיל (75 מ"מ × 25 מ"מ). התכונות של השבב, כולל ערוצים עיקריים או תאים, בארות microgrooves מסומנות, ניתנים לשימוש עתידי. איור 1C הוא תמונה של השבב הממחיש את הבידוד fluidic של התאים.
1. הכנה וציפוי של Multicompartment Chips
- בארון ביולוגית, מקם את השבב לתוך צלחת פטרי או מיכל סטרילי מתאים אחרים.
- להוסיף 100 µL של ציפוי מראש לפתרון העליון מצד שמאל טוב של השבב, לאפשר לו לזרום דרך ערוץ הראשי לתוך סמוכות טוב.
הערה: הפתרון ציפוי מראש נועד מראש מעיל הערוצים microfluidic לחסל את פוטנציאל השמנה בועות אוויר בתוך השבב. - מילוי התחתונה נשאר עם µL 100 של טרום ציפוי פתרון. המתן 5 דקות כדי לאפשר את הפתרון לזרום דרך microgrooves.
- להוסיף 100 µL של טרום ציפוי לפתרון העליון היטב ולאפשר לזרום דרך ערוץ הראשי לתוך טוב סמוכות. למלא הבאר נכון התחתון µL 100 של טרום ציפוי פתרון.
- האחות הפתרון מכל קידוח. מחוק לגמרי מן הערוצים הראשי כדי למנוע הסרת נוזל מן הערוצים העיקריים (איור 2 א). מיד להוסיף 150 µL של באגירה פוספט תמיסת מלח (PBS) השמאלית העליונה היטב. לחכות מינימום 1.5.
התראה: האחות לא כל הנוזל הערוצים הראשי סגור. - להוסיף 150 µL PBS השמאלי התחתון טוב. המתן 5 דקות כדי לאפשר נוזלים לזרום דרך microgrooves. להוסיף 150 µL PBS העליון היטב. להוסיף 150 PBS µL להורדת היטב. חכה 10 דקות.
- חזור על שלבים 1.5-1.6 לרחיצה PBS השני.
- בדוק את השבב תחת מיקרוסקופ תרביות רקמה של בועות אוויר בתוך הערוצים העיקריים. אם בועות קיימות, ביצוע ההליכים שלהלן. אם אין בועות קיימות, דלג לשלב 1.9.
- האחות PBS מן הבארות לדוג את הטיפ pipet מן הערוץ פתיחה (איור 2 א).
- לוותר על µL 100 של טרום ציפוי פתרון לתוך הבאר העליון, לדוג את קצה pipet סמוך לתעלה פתיחה (איור 2B). הבועות עליך להעביר דרך הערוץ לתוך הבאר נמוכה יותר. לחכות מינימום 1.5.
- חזור על שלבים 1.3-1.8.
- האחות PBS מן הבארות לדוג את הטיפ pipet מן הערוץ פתיחה (איור 2 א).
- להוסיף 100 µL של 0.5 מ"ג/מ"ל פוליפוני d-ליזין (PDL) העליון מצד שמאל טוב של השבב. המתן 1.5 מינימלית מילוי התחתונה נשאר עם µL 100 של PDL.
- להוסיף 100 µL של PDL הבאר נכון העליון של השבב. המתן מינימלית 1.5 µL להוסיף 100 לבאר נכון נמוכה יותר.
- לסגור את הפטרי ומניחים את השבב בתוך אינקובטור ב 37 ° C עבור 1 h.
- חזור על שלבים שטיפת PBS 1.5-1.6 פעמיים כדי להסיר עודפי PDL.
- האחות של PBS מההתקן.
- מיד להוסיף 100 µL של התקשורת התרבות התא העליון מצד שמאל טוב של השבב. המתן 1.5 מינימלית הוסף מדיה בפינה הימנית התחתונה טוב. הוסף מדיה העליון היטב. המתן 1.5 דק להוסיף 100 µL בינוני לבאר נכון התחתון של השבב.
- מקם את השבב בחממה 37° C עד מוכן לתאים צלחת.
2. זריעת את הנוירונים לתוך הצ'יפס Multicompartment
- הכן תא השעיית הפומבית החולדה הנוירונים בהיפוקמפוס לפי פרוטוקולים הוקמה21,22 להניב צפיפות של ~ 12 × 106 תאים/mL....
הערה: השימוש תא צפיפויות התלוי בין 3 12 × 106 תאים למ"ל אפשרי. אם צפיפות נמוכה יותר, הנפח של התא ההשעיה להוסיף השבב ניתן להאריכו (ראה להלן). ההליך המתואר להלן ישימה עבור מאתר נוירונים בקליפת המוח או בהיפוקמפוס חלופה מועדפת. צפיפויות תא אופטימלית עבור סוגים אחרים הנוירון עשוי להשתנות. - הסר הרוב המכריע של התקשורת כל טוב של השבב, משאיר כ 5 µL כל טוב. מחוק לגמרי מן הערוצים הראשי כדי למנוע הסרת נוזל מן הערוצים העיקריים (איור 2 א).
התראה: לא תשאף נוזל מן הערוצים הראשי סגור. ייתכן הופכים לכוד בועות אוויר בתוך השבב אם נוזל הוא aspirated מן הערוצים העיקריים. - לטעון µL 5 של השעיה התא העליון ממש טוב, עוד 5 µL תא השעיה בתוך הבאר נכון התחתון (סה כ ~ 120,000 תאים). לטעון את התאים על ידי dispensing קרוב המעבר העיקרי (איור 2B). בדוק תחת מיקרוסקופ כדי להבטיח הנוירונים בתעלה המרכזית. המתן 5 דקות כדי לאפשר את התאים לצרף.
הערה: נוירונים ניתן לטעון גם לתא. לצורך הסבר, תא סומאטית הערוץ הראשי בצד ימין, אבל גם התא יכול לשמש תא סומאטית. השימוש צפיפויות התא התחתון עד 60,000 תאים לכל שבב אפשרי. עד 10 µL של התא ההשעיה עשויים להתווסף לכל אחד טוב של תא סומאטית בשילוב עם השעיה תא עם תאים פחות ממה שתוארה לעיל. - להוסיף כ 150 µL של התקשורת העצבית תרבות לכל אחד העליון ואת התחתון נכון בארות, ולאחר מכן להוסיף 150 µL של המדיה לכל אחד העליון ואת התחתון עזב בארות. מקם את השבב לתוך מגש humidified ב חממה 37 ° C 5%2 CO.
- לאחר 24 שעות, לבצע שינוי מדיה על-ידי הסרת המדיה מן הבארות. ודא שהערוץ המרכזי נשאר מלא. להוסיף 150 µL של מדיה מכל קידוח העליון ולאחר מכן למלא הבארות התחתון.
- מקם את השבב בחזרה בחממה עבור מספר ימים הרצוי.
הערה: לפקח על התקשורת כל כמה ימים כדי לוודא שהם שרידים אור ורוד. אם התקשורת צהבהב, להחליף 50% מזה מדיה טריים. אם רמת נוזל נמוכה, כדי לוודא שאין לחות נאותה ובבלימה המשני המתאים של האסימונים כדי למנוע התאיידות. צמצום או ביטול אפילו, שינויים מדיה אפשרית באמצעות בלימה משני ו/או כיסוי המנה המכיל את השבב עם טפלון (PTFE)-הסרט FEP.
3. נסיגה תיוג של נוירונים בתוך השבב
הערה: תיוג רטרוגרדית יכול להתבצע באמצעות טכניקות מרובות, כולל שימוש הרעלן כולרה שונה וירוס הכלבת. להלן הנחיות תיוג נוירונים משתמש שנמחקו G כלבת-mCherry או - eGFP וירוס. לטפל בחומרים שעלולים זיהומיות לפי הקווים המנחים של הארגון המקומי. תרגול נוסף עשוי להידרש.
- חם טרי עצביים תרבות המדיה 37 מעלות צלזיוס. מעריכים µL ~ 400 של מדיה לכל שבב.
- לדלל 100000 יחידות ויראלי של נגיף הכלבת ששונה סך של 50 µL באמצעות מדיה שנלקחו גם טוב של תא עצב.
הערה: היפטרו טיפים וצינורות במגע עם הוירוס לפי הפרוטוקול שאושרו על-ידי הארגון. - בעדינות pipet צינור התקשורת שנותרו מן הבארות של תא עצב, חנות ומפרידה ב 37 º C.
- להוסיף 150 µL של התקשורת חמים טריים ולא את µL 50 של וירוס מדולל תא עצב. תקופת דגירה של 2 h ב- 37 מעלות צלזיוס חממה.
- להסיר את המדיה המכילה וירוס, להיפטר ממנו כראוי.
הערה: בועות אוויר עשוי להיות לכוד השבב אם נוזל הוא aspirated מן הערוצים העיקריים. - בעדינות להוסיף µL 75 של מדיה טריים אקסון אחד טוב ולאפשר זרימה הדנדריטי לאקסון אחר טוב.
- להסיר זרימה דרך הפעולה באקסון השני טוב ועושה כראוי.
- חזור על שלבים 3.6 ו- 3.7 פעם אחת.
- להוסיף בחזרה מדיה מאוחסנים תא עצב. להוסיף כ 50 µL טריים מדיה, במידת הצורך לשמור על נפח נאותה ולחזור התאים החממה.
הערה: חלבון פלואורסצנטי ביטוי גלוי מאת 48 h ולאחר נמשכת עד 8 ימים. נוירונים יכולים לדימות למשך עד 30 דקות בטמפרטורת החדר בתקשורת העצבית של תרבות. תרבות המדיה גם יכול להיות מוחלף עם CO ומחוממת2-עצמאית שינה E עם B27, עם תמונה של עוד. נוירונים יכולים לדימות גם בתוך תא סביבתיים היטב humidified ב CO 37 ° C ו-5%2. במקרה זה, לחות הוא קריטי עבור מזעור הפסדים אויר בתוך שבבי, אשר היא מתעצמת על ידי חימום יכול לסכן את בריאות נוירון.
4. fluidic בידוד של תא עצב בתוך השבב
- הסר 20 µL מ התחתונה נשאר טוב של תא עצב, המקום לתוך הבאר נכון העליונה של תא סומאטית. לחכות 2 דקות זרימה בתוך אחד מהערוצים equilibrate.
- הסר µL 50 של מדיה של תא עצב. להוסיף µL 0.3 של 1 מ מ 488 עבור חיל הים אלקסה hydrazide מדיה זו, לערבב ויה pipet, לחזור בחזרה תא עצב. השבב הוא מוכן עבור הדמיה.
הערה: תרכובות אחרות של עניין ניתן להוסיף. הוספת צבע פלורסנט עם משקל מולקולרי דומה בשם המתחם של עניין מומלץ כדי לעקוב אחר בידוד fluidic לאורך זמן.
5. ביצוע Axotomy בתוך השבב
- להסיר מדיה של תא עצב לשמור את הטיפ pipet מן הכניסה של הערוץ הראשי (איור 2 א) ולאחסן אותו בתוך שפופרת צנטרפוגה.
- האחות תא עצב לחלוטין, הצבת את השאיפה pipet בסמוך גם הכניסה של הערוץ העיקרי של תא עצב (איור 2B). להמשך השאיפה 1-2 דקות לוודא כי הפתרון מוסר לחלוטין מן התא.
הערה: לחץ ואקום עבור השאיפה להיות לפחות 18 אינטש-Hg שהפרוצדורה axotomy תקינה. - החלף תא עצב המדיה המאוחסנת ולאשר את האקסונים במחוז על ידי הסתכלות על השבב תחת מיקרוסקופ.
הערה: אם בועות יוצרות בתא עצב בעת החלפת המדיה, חזור על שלבים 5.1-5.2. - להחזיר את השבב החממה.
6. זריחה Immunostaining בתוך השבב
- להכין 4% פורמלדהיד קיבוע פתרון ב- PBS (4% פורמלדהיד מיקרומטר 1 MgCl2, 0.1 מיקרומטר CaCl2, 120 מ"מ סוכרוז)
- להסיר את מרבית כלי התקשורת בתוך הבארות של השבב (לא לייבש תאי פנים).
- מיד להוסיף 100 µL של קיבעון פתרון הבארות העליון של התאים עצב וגופניות.
- לאחר 1 דקות, להוסיף 100 µL של קיבעון פתרון הבארות התחתון. תיקון עבור 30 דקות בטמפרטורת החדר.
- להסיר את מרבית הפתרון מן הבארות של השבב (לא לייבש תאי פנים). מיד להוסיף µL 150 ל- PBS לכל אחד מן הבארות העליון של התאים עצב וגופניות. לחכות 2 דקות בשביל PBS לזרום לתוך הבארות התחתון.
- חזור על שלב 6.5 פעמיים.
- הסר את רוב PBS הבארות של השבב. מיד להוסיף µL 150 ל- PBS עם 0.25% TritonX-100 לכל אחד מן הבארות העליון של התאים עצב וגופניות. ממתינים 15 דקות.
- להסיר את מרבית הנוזל מן הבארות של השבב ולהוסיף מיד µL 150 בפתרון חסימה (10% סרום עז רגילה ב- PBS) לכל אחת מן הבארות העליון של התאים עצב וגופניות. ממתינים 15 דקות.
הערה: פתרונות חסימה יעילה אמור להיות ספציפי הנוגדן המשני, למשל, עבור נוגדנים משניים כבשים נגד חמור, להשתמש בסרום חמור בפתרון חסימה. - להסיר את מרבית הנוזל מן הבארות של השבב ולהוסיף מיד µL 100 של נוגדן ראשוני (או נוגדנים) בנסיוב עז רגיל 1% ב- PBS לכל אחד מן הבארות העליון של התאים עצב וגופניות. מכסים למזער אידוי. ולחכות h 1 בטמפרטורת החדר או 4 מעלות צלזיוס למשך הלילה.
- להסיר את מרבית הפתרון מן הבארות של השבב (לא לייבש תאי פנים). מיד להוסיף µL 150 ל- PBS לכל אחד מן הבארות העליון של התאים עצב וגופניות. המתן 5 דקות עבור מגניב לזרום לתוך הבארות התחתון.
- חזור על שלב 6.10 פעמיים.
- להסיר את מרבית הנוזל מן הבארות של השבב ולהוסיף מיד µL 100 של נוגדנים משניים (או נוגדנים) ב- PBS לכל אחד מן הבארות העליון של התאים עצב וגופניות. מכסים למזער אידוי ולחכות h 1 בטמפרטורת החדר.
הערה: עיין הוראות היצרן הדילול המומלץ של נוגדנים משניים. - חזור על שלבים 6.10-6.11.
- אם הדמיה בתוך 1 יום immunostaining, שמור את השבב מלא עם PBS. אם השבב יאוחסנו יותר יום אחד לפני הדמיה, לעטוף את המנה המכיל את השבב בסרט פרפין כדי למנוע אידוי, לאחסן ב 4 ° C עד מוכן לתמונה.
- עבור אחסון לטווח ארוך של דגימות, הרכבה מדיה (למשל, Fluoromount-G) יכול לשמש.
- הסר את רוב הנוזל הבארות של השבב. השתמש 1 מ"ל pipet פלסטיק חד פעמיות כדי להוסיף 2 טיפות של הרכבה מדיה לכל אחד מן הבארות העליון של התאים עצב וגופניות.
- להטות את השבב לעודד זרימת התקשורת הרכבה בערוצים. לאחר 5 דקות להוסיף 2 טיפות הבארות התחתון. המתן h 1 לפני הדמיה.
הערה: לאחר שימוש במדיית התקנה זה לא ניתן יהיה לחקור מחדש עבור מטרות אחרות.
תוצאות
לאחר כ 5-7 ימים של נוירון צמיחה בתוך השבב, עצב צמיחה ניכרת. האסימונים תואמים שלב-ניגודיות הדמיה כפי שהוכח איור 3, אשר מראה צמיחה עצביים-24 ימים. האסימונים תואמים גם קרינה פלואורסצנטית הדמיה (איור 4 איור 5, 6 איור, איור 7). שלושה ימים לאחר זיהום בנגיף הכלבת דרך תא עצב, הנוירונים mCherry-חיובית עם אקסונים הארכת לתוך תא עצב היו עם תמונה בשבב (איור 4). להפגין את היכולת לבודד את תאי fluidically, צבע פלורסנט נמוך משקל מולקולרי (hydrazide אלקסה עבור חיל הים 488) נוספה תא עצב. תוצאות אלו דומות קאמרית מבוסס-PDMS17 , להדגים את התאמתו של השבב פלסטיק עבור שלב-חדות, קרינה פלואורסצנטית הדמיה.
כדי להמחיש את הצמיחה עצביים עם שבבי פלסטיק והתקנים PDMS, אנו תרבותי נוירונים בשתי פלטפורמות, במעקב גדילה עצביים לאורך זמן. איור 5 מציגה צמיחה עצביים 3 22 ימים בתרבות; תוצאות אלה הן נציג של 3 ניסויים עצמאית. צמיחה עצביים משולה בתוך פלטפורמת עד 15 ימים תרבות, אך התרבות יותר גילאי (> 21 ימים) אקסונים מבודד בתוך השבב פלסטיק מופיעים בריא יותר עם פחות ואגלי (איור 5A). עוד יותר להמחיש אקסונים בתוך התאים עצב, אנו immunostained עבור β-טובולין השלישי אשר מציג גידול עצב בריא בתוך הפלסטיק שבבי ב-22 ימים בתרבות (איור 5B).
מחקרים פגיעה והתחדשות האקסון נפוצים באמצעות מכשירי microfluidic ממודר. כדי להדגים את התאמתו של מחקרים אלה באמצעות את שבבי, רטרוגרדית עם התווית נוירונים היו עם תמונה לפני, 24 שעות לאחר axotomy (איור 6). נורת הכחשה והתחדשות האקסון הם שני axotomy הבאים ניכרת. תוצאות אלו שוות נתונים שפורסמו באמצעות מכשירים מבוססי PDMS14,17.
Immunocytochemistry היא טכניקה נפוצה שבוצעו בתוך תא רב התקנים כדי להמחיש חלבון לוקליזציה. לאחר 24 ימים בתרבות, נוירונים בתוך הצ'יפס היו קבועים והמוכתמות סמני סינפטית סינאפסות, vGlut1, vGat, בהתאמה (איור 7). MCherry רטרוגרדית שכותרתו נוירונים היו גם הדמיה (איור 7C). הדמיה בוצעה באמצעות דיסק מסתובב קונאפוקלית המטרה טבילה שמן סיליקון 60 ×, הממחיש את היכולת לבצע דימות ברזולוציה. חשוב לציין, הדנדריטים ניכרו בתוך האזור המוגדל, הממחיש הנוירונים תרבותי בתוך הצ'יפס היו ויוצרים הסינפסות בוגרת.
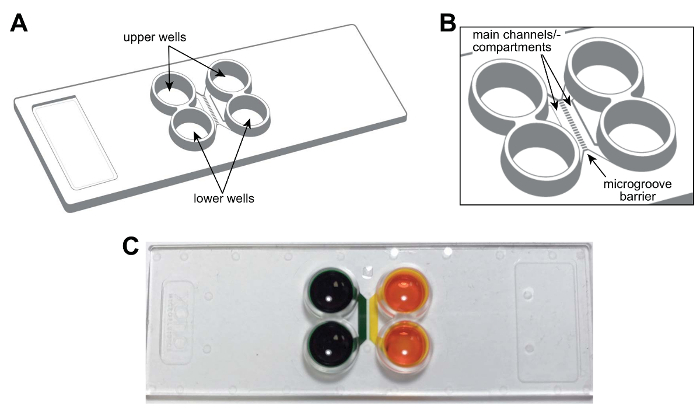
איור 1 : שבב מראש, פלסטיק 2-תא microfluidic עבור ממדר נוירונים. (א) ייצוג סכמטי של השבב multicompartment מציג את המיקומים של הבארות עליון ותחתון. (B) מוגדלת תיאור סכמטי של השבב הצגת ערוצי הראשי (או תאים) ו- microgrooves אשר מחברים התאים. הערוצים העיקריים הם כ 1.5 מ מ × 7 × 0.060 מ"מ (× × L W H). הרוחב והגובה של microgrooves הם בערך 0.01 מ מ × 0.005 mm, בהתאמה. האורך של microgrooves משתנה בהתאם לתצורת, 0.15 מ"מ עד 0.9 מ"מ. (ג) A צילום של שבב multicompartment נציג המכיל מאכל לצבוע בכל הערוץ העיקרי או תא להפגין את היכולת fluidically בודד אחד מהערוצים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
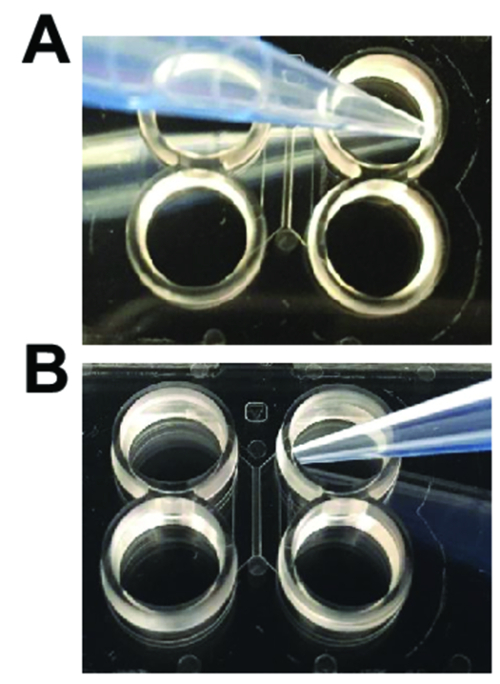
איור 2 : Pipetting טכניקות הדרושים בעת שימוש שבבי multicompartment פלסטיק. (א) בעת הוספת כ רפה בעברית מדיה עבור שוטף, הטיפ pipet צריך להיות בזווית מן הכניסה של הערוץ הראשי כפי שמוצג. (B) כאשר טעינת נוירונים או ביצוע axotomy, בקצה pipet צריך להיות בזווית לכיוון הכניסה של הערוץ המרכזי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
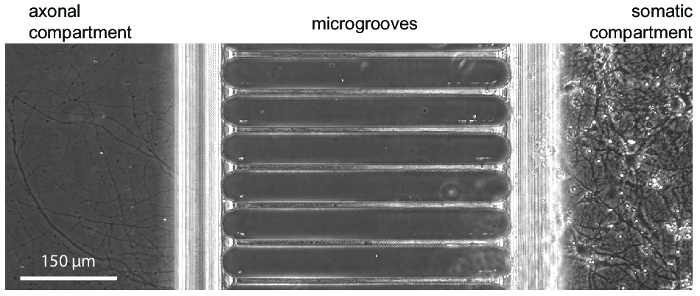
איור 3 : מיקרוסקופ לעומת זאת שלב מראה אופייני צמיחה עצביים בתוך השבב-24 ימים בתרבות. נוירונים בהיפוקמפוס עובריים היו נזרע לתוך תא נכון סומאטית. האקסון צמיחה מוצגת בתחילת תא עצב ב 5-7 ימים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
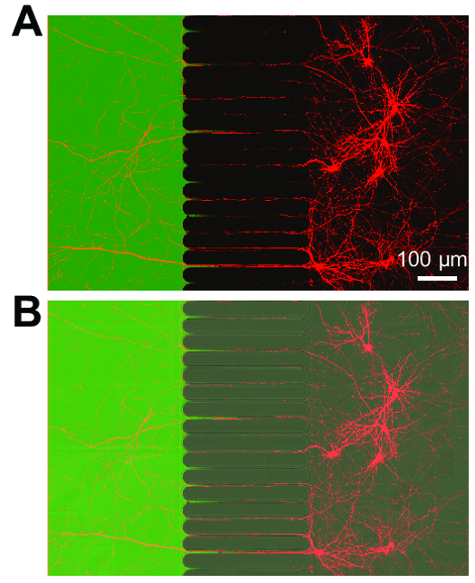
איור 4 : נוירונים שכותרתו רטרוגרדית אקספרס mCherry חלבון פלואורסצנטי ולהרחיב את האקסונים לתוך תא עצב fluidically מבודדים. (א) מיקרוסקופ פלורסצנטיות הממוזג מראה חי נוירונים שכותרתו רטרוגרדית נגוע באמצעות וירוס הכלבת mCherry ששונה בקצרה שהוחל תא עצב. נוירונים היו שבעורך 3 ימים לאחר הפגיעה-21 ימים בתרבות. יצירה של microenvironment מבודדים בתוך תא עצב מומחש היישום של צבע נמוך משקל מולקולרי, אלקסה עבור חיל הים 488 hydrazide. (B) תמונת הממוזג של (א) כולל תמונה חדות (DIC) התערבות דיפרנציאלית להמחיש את האזור microgrooves של השבב. תמונות נרכשו עם מיקרוסקופ קונפוקלי בעזרת שמן סיליקון × 30/1.05 נ. א של סורק לייזר (ne = 1.406) המטרה העדשה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
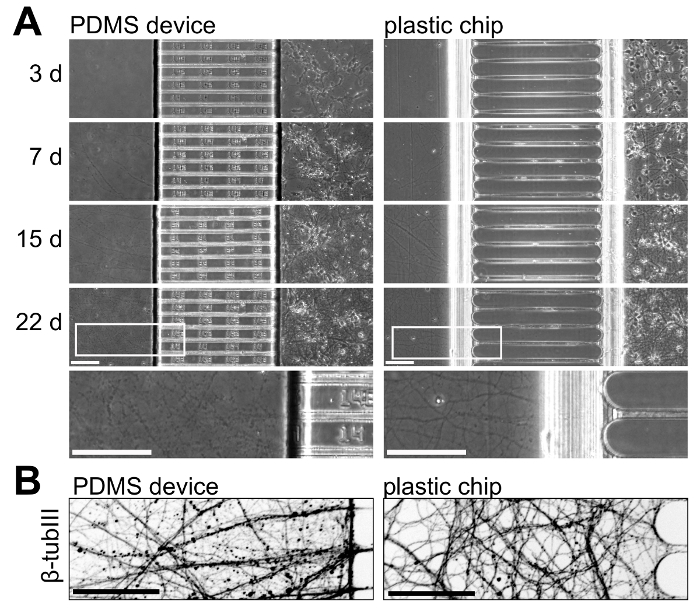
איור 5 : השוואה side-by-side של צמיחה עצביים בתוך מכשירים PDMS multicompartment ושבבי פלסטיק. (א) שלב החדות micrographs של שתי פלטפורמות שצולמו 3, 7, 15, 22 ימים בתרבות. בחלק התחתון, אזור הגדלה גבוהה יותר מן התמונות שצולמו 22 ימים נכלל להמחשת צמיחת עצב בגיל הזה בתוך שתי פלטפורמות. אקסונים בתוך השבב יותר רציפה, מופיעים בריא יותר במכשיר PDMS בגיל הזה. (B) micrograph immunofluorescence ' היפוך ' של β-טובולין השלישי מוכתם אקסונים בתוך תא עצב של המכשיר PDMS והן שבב פלסטיק-22 ימים בתרבות. תמונות נרכשו במערכת ספינינג דיסק קונאפוקלית הדמיה באמצעות 20 x / 0.45 נ. א המטרה העדשה. כל קווי מידה הם 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
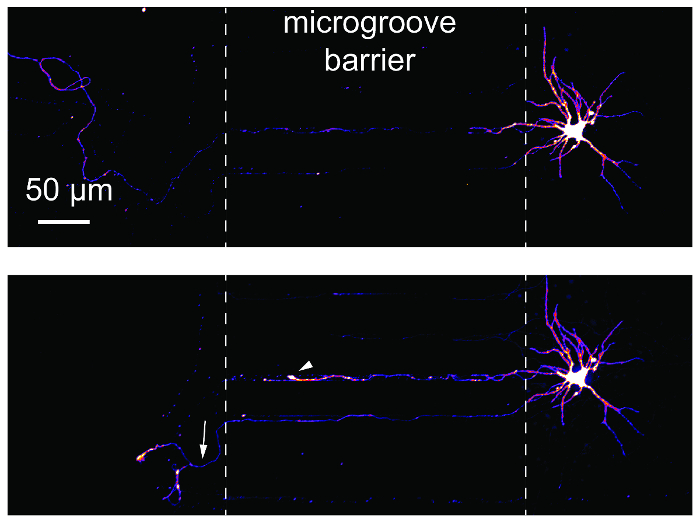
איור 6 : Axotomy והתחדשות של נוירונים בהיפוקמפוס בתוך השבב multicompartment פלסטיק. (למעלה) נוירונים היו רטרוגרדית שכותרתו באמצעות וירוס הכלבת mCherry שונה, ואז עם תמונה לפני axotomy ב- 24 ימים בתרבות. תמונות היו pseudocolored באמצעות טבלת בדיקת מידע של הצבע 'אש'. (למטה) נוירון אותו עם תמונה בחלונית העליונה היה שבעורך במשך 24 שעות ביממה פוסט-axotomy. קווים מקווקווים לבן הצג את הקצוות של המכשול microgroove. Axotomy אירעה במיקום של הקו המקווקו השמאלי. החץ הלבן מראה נורת התנצלות. החץ הלבן מציין של האקסון ההתחדשות. תמונות נרכשו ספינינג דיסק קונאפוקלית הדמיה מערכת משתמשים בעדשה המטרה 20 × / 0.45 נ. א. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
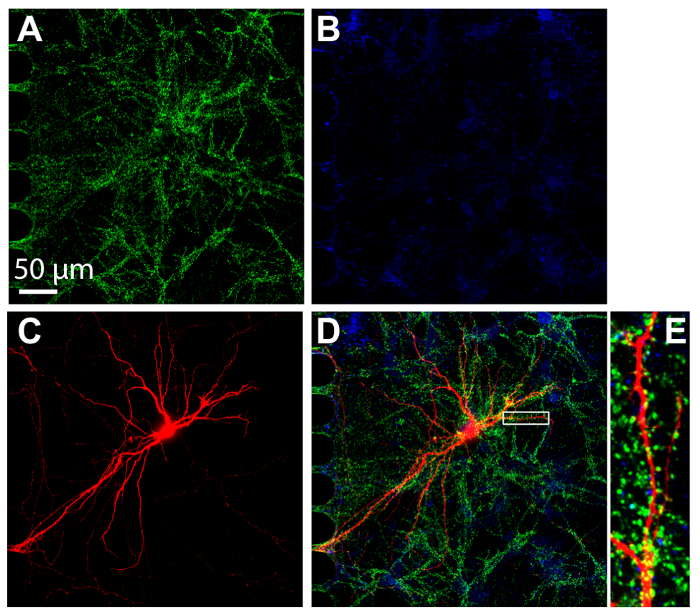
איור 7 : Synapses טופס בין נוירונים בהיפוקמפוס תרבותי בתוך פלסטיק שבבי multicompartment. Immunostaining בנטילת 24 ימים בתרבות, עם תמונה בתוך תא סומאטית משתמשים בעדשה טבילה 60 × שמן סיליקון. נוירונים אקספרס (א) דה מרקר סינפסה סינאפסות, vGlut1 (ירוק) ו- (B) דה מרקר סינפסה מעכבות, vGAT (כחול). (ג) Retrograde תוויות mCherry נוירונים (אדום) נדבקו באמצעות נגיף הכלבת ששונה שהוחל תא עצב. (ד) מיקרוסקופ פלורסצנטיות הממוזג של vGlut1, vGat ו- mCherry. (ה) האזור המוגדל (D) המצוין עם תיבה לבנה מראה הדנדריטים, האתרים המקבלים קלט סינפטית נוירונים אחרים. תמונות נרכשו במערכת ספינינג דיסק קונאפוקלית הדמיה באמצעות שמן סיליקון טובה × 60/נ. א 1.3 (ne = 1.406) המטרה העדשה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| שבבי multicompartment פלסטיק | התקנים multicompartment PDMS |
| לבודד אקסונים | לבודד אקסונים |
| הקמת microenvironments | הקמת microenvironments |
| axotomize נוירונים | axotomize נוירונים |
| שקוף אופטית | שקוף אופטית |
| תואם עם הדמיה ברזולוציה גבוהה | תואם עם הדמיה ברזולוציה גבוהה |
| תואם עם מיקרוסקופ קרינה פלואורסצנטית | תואם עם מיקרוסקופ קרינה פלואורסצנטית |
| הושלם | הרכבה סובסטרט נדרש |
| אקסונים בריא > 21 ימים | אקסונים בריא > 14 ימים |
| הידרופילי culturing | הידרופוביות |
| גז אטום | גז חדיר |
| microgrooves מעוגלות ותעלות | microgrooves ישר |
| שלבי הכנה פחות | החלק העליון הוא נשלף עבור צביעת בתוך microgrooves |
| לא תואם עם אבלציה לייזר | הקליטה של מולקולות קטנות & ממסים אורגניים |
| לא תואם עם שמנים על בסיס שמן מינרלי טבילה (שמני בסיס סיליקון הם בסדר) |
טבלה 1: השוואה של פלסטיק, פלטפורמות multicompartment PDMS culturing נוירונים.
Discussion
שבבי multicompartment פלסטיק מספקים אפשרות נוחה לשימוש עבור ממדר הנוירונים, מתן תרבויות עצביים לטווח ארוך (> 3 שבועות). פרוטוקול זה מפרט כיצד תרבות קורטיקליים ו בהיפוקמפוס מאתר נוירונים בתוך למעשיהם. היצירה של microenvironments מסיסים וכיצד ייסוג תווית נוירונים, לבצע axotomy, ולבצע immunocytochemistry נדונו גם. חשוב, הצ'יפס הזה תואם ברזולוציה גבוהה, קרינה פלואורסצנטית והדימות בשידור חי.
שבבי multicompartment פלסטיק מספקים רבים של אותן פונקציות של המכשירים ממודר מבוססי PDMS, אבל יש יתרונות, חסרונות, ועוד כמה תכונות הבחנה. טבלה 1 מספק השוואה תכונה של שבב פלסטיק וגם מכשירים מבוססי PDMS. בראש ובראשונה, האסימונים הם מראש התאספו ועשה לצמיתות הידרופיליות, אשר מקלה על הרטבה, שהופך אותם קל יותר לשימוש. הפלסטיק הוא לא חדיר, בניגוד PDMS, גז אז אם בועות יוצרות באופן בלתי צפוי בתוך הערוצים, הם לא בורחים בקלות ויש להסירו. פתרון ציפוי קדם המכיל בעיקר אתנול וביו -כמה סוכנים קנייניים אחרים מונע היווצרות בועה.
חיים הדמיה של הקרנות הבאה התמרה חושית של חלבונים פלורסנט בוצעה בתוך הצ'יפס (איור 4) ולא היה שום autofluorescence לזיהוי של הפלסטיק. אזהרה היא כי שמנים טבילה עם השבב שימשו מטרות מפתח נומרי גבוהה חייבת להיות על בסיס שמן סיליקון, שמן מינרלי לא מבוסס. שמן מינרלי יכול לגרום תגובה נגדית עם קופולימר אולפין מחזורית. עבור הדמיה brightfield, חשוב לציין כי microgrooves בשבב מעוגלים בקצוות יש מתחדדת הדרגתית של z-לכיוון של הערוצים הראשי לכיוון המחסום microgroove גורם קצת השתברות האור בשני צידי microgrooves במהלך brightfield הדמיה (איור 3). בגלל השבב הוא מראש, נוגדן לחדירה microgrooves בגודל מיקרון עשוי להיות לא אחידה (כמו עם מכשירים מבוססי PDMS לצמיתות בונדד); לפיכך, ניתוח כמותי בעקבות immunostaining צריכה להתבצע בתאים/הערוצים. ניתן לשפר Immunostaining של תחזיות עצביים בתוך microgrooves על-ידי יצירת שינוי נפח בין התאים כדי לסייע הזרימה של נוגדנים fluorophores לתוך microgrooves.
Disclosures
A.M.T. הוא ממציא של microfluidic הקאמרית/השבב (אותנו 7419822 B2), הוא חבר של Xona מיקרופלואידיקה, LLC. סמנכ ל הוא עובד של Xona מיקרופלואידיקה, LLC. ג'יי-אייץ הוא חבר של Xona מיקרופלואידיקה, LLC. T.N. מצהיר אין אינטרסים כלכליים מתחרים. גישה פתוחה פרסום של מאמר זה היא בחסות מיקרופלואידיקה Xona.
Acknowledgements
המחברים לאשר סיוע טכני או העריכה של טיילור ווילט (Xona), Paranjape רחלי אמבר (UNC-בצ'אפל היל), ג'ויס Ciechanowski (Xona), בראד טיילור (Xona). המחברים להכיר תמיכה מיקרופלואידיקה Xona, LLC, את נבחרת המכון לבריאות הנפש (R42 MH097377). הדמיה מומן בחלקו על ידי Confocal ו Multiphoton הדמיה הליבה מתקן של NINDS מרכז גרנט P30 NS045892 NICHD מרכז גרנט (U54 HD079124). התוכן הוא אך ורק באחריות המחברים, ואינם מייצגים בהכרח את הנופים הרשמי של מכוני הבריאות הלאומיים.
Materials
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
References
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes? Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. Culturing Nerve Cells. , Second edition, MIT Press. (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved