Method Article
プライマリ マウス神経細胞も見逃せません組み立て済みプラスチック製マイクロ流体チップの使用
要約
このプロトコルでは、文化し、一次マウス ニューロンを区分するプラスチック製のチップの使用について説明します。これらのチップは、組み立て済み、ユーザーフレンドリーで、高解像度と互換性がある、ライブ、および蛍光イメージング。このプロトコルでは、これらのチップ内でのラット海馬ニューロンのプレートおよび流体の分離、膠、免疫染色を実行する方法について説明します。
要約
ニューロンを区分する微細加工方法多くの神経科学者に不可欠なツールとなっています。このプロトコルでは、区画化培養初代ラット海馬ニューロンの市販の組み立て済みプラスチック チップの使用について説明します。高解像度と互換性のある標準的な顕微鏡スライドのフット プリント内に含まれるこれらのプラスチック製のチップ、ライブ、および蛍光イメージング。このプロトコルは、蛍光タンパク質をエンコード変更された狂犬病ウイルス分離神経軸索を介してラベル ニューロンを逆行、1 つのコンパートメント内で孤立した微小を作成し、膠の試みとを実行する方法を示します、オンチップ。神経細胞は培養 > 長期神経文化のこれらのチップの互換性を示すプラスチック製のチップ内で 3 週間。
概要
文化伝統的なニューロンの軸索と樹状突起は、そのユニークな偏光形態における神経細胞の研究を防ぐためのランダムな伸長の結果に近づきます。(選択した知名度の高い出版物が参照される1,2,3最後の 10-15 年に神経科学者によく確立され、よく使用される研究ツールとなっている 2重マルチコンパートメント,4,5,6,7,8,9,10,11,12,13,14,15,16,17). これらのデバイスは、ニューロンを区分し、物理的、化学的シナプス18,19軸索、樹状突起に含むニューロンの細胞内領域を操作するためのメソッドを提供します。また、軸索輸送、軸索のタンパク質合成、軸索損傷・再生、および軸索-相馬シグナルの研究を含むランダムなカルチャを使用して可能ではない複数の実験パラダイムを提供します。2 コンパートメントの基本的な構成は、一連の小さい垂直溝で区切られた 2 つの並列チャネルで構成されます。マイクロ チャンネルの一つにメッキパーツをプライマリまたは幹細胞由来神経細胞、解決しデバイスの底面に接続し、数日にわたって神経突起を拡張します。多くの成長円錐は、彼らが入力してから細胞体を防ぐため十分に小さいである溝にその方法を見つけます。成長円錐は物理的に制限と溝内を好転させることができないため、分離が隣接する区画 (軸索コンパートメント) まっすぐに育ちます。
歴史的には、これらのデバイス生ぜずパターン マスター型からポリジメチルシロキサン (PDMS) を使用して成形されているとが社内調査官の研究所で行われたまたは商業的に購入。PDMS を使用しての主な欠点の 1 つは、その疎水性20です。PDMS 親水性、一時的に行うことができますが、すぐに疎水性非水溶液環境20時間以内。このため、デバイスは使用時ガラス基板またはその他の適当な基板に接続する必要があります。組み立て済みのプラスチック製のマルチコンパートメント チップは射出成形のプラスチックに市販 (例えばXonaChips) されます。これらのチップは、完全に親水性、デバイスぬれし下部のマイクロ チャンネルを囲む環状オレフィン共重合体 (COC) の薄膜チップの前のアセンブリの簡素化で作られています。これらのチップは、高解像度蛍光イメージングに適した、光学的に透明なプラスチックで製造されています。
このプロトコルの目的は、マウスの海馬や大脳皮質のニューロンを用いて複数の実験的パラダイムの組み立て済みプラスチック製マイクロ流体チップの使用方法を示すことです。このプロトコルでは、チップ内の変更された狂犬病ウイルスを使用してラベルのニューロンを逆行する方法について説明します。軸索傷害および再生の研究のための膠についても述べる。最後に、このプロトコルは、デバイスと蛍光免疫染色を実行する方法を示します。
プロトコル
メモ: プラスチックのマルチコンパートメント チップの回路図は、図 1 a、 Bに示されています。チップは、標準的な顕微鏡のスライド (75 mm × 25 mm) のサイズです。チップは、メインのチャンネルまたはコンパートメント、井戸、溝などの機能は、ラベル付けされて、将来の参考のため提供されます。図 1は、コンパートメントの流体の分離を示すチップの写真です。
1. 準備とマルチコンパートメント チップのコーティング
- 生物学的安全キャビネットにシャーレまたは他の滅菌容器にチップを置きます。
- チップの井戸を左上の解決策を事前にコーティングを 100 μ l 添加し、よく隣にメイン チャンネルを通過します。
注: 事前コートにマイクロ流路チップ内の空気の泡をトラップの可能性を排除するために使用される塗装の前処理ソリューション。 - 左下の事前コート液を 100 μ l 添加で塗りつぶし。溝を通過するソリューションを許可する 5 分を待ちます。
- 事前も右上の解決策にコーティングの 100 μ L を追加し、よく隣にメイン チャンネルを通過すること。中古コート液を 100 μ l 添加の低右もを入力します。
- 各ウェルからソリューションを吸い出しなさい。メイン チャンネル (図 2 a) から液体を削除することを避けるためにメイン チャンネルから離れて吸い出しなさい。すぐに左上にもリン酸緩衝生理食塩水 (PBS) の 150 μ L を追加します。1.5 分を待ちます。
注意: は、同封のメイン チャンネルからすべての液体を吸い出してはいけない。 - 左下にも 150 μ L の PBS を追加します。溝を通過する液体を許可する 5 分を待ちます。右も上に 150 μ L の PBS を追加します。よく右下に 150 μ L の PBS を追加します。10 分を待ちます。
- 2 番目の PBS 洗浄手順 1.5 1.6 を繰り返します。
- メイン チャンネルに存在する気泡組織培養顕微鏡下でチップをチェックしてください。気泡が存在する場合は、以下の手順を実行します。気泡が存在しない場合は、1.9 のステップに進みます。
- (図 2 a) を開くチャネルから離れてピペット先端部を釣り井戸から PBS を吸い出しなさい。
- 事前 (図 2 b) を開くチャネル近くピペットの先端を釣りに上部だけでなく、ソリューションにコーティングの 100 μ L を分注します。低い井戸にチャネルを通じてバブルの動きする必要があります。1.5 分を待ちます。
- 1.3 1.8 の手順を繰り返します。
- (図 2 a) を開くチャネルから離れてピペット先端部を釣り井戸から PBS を吸い出しなさい。
- チップの井戸を左上に 0.5 mg/mL ポリ d リジン (PDL) の 100 μ L を追加します。1.5 分左下の PDL の 100 μ L と塗りつぶしを待ちます。
- チップの上部右もに PDL の 100 μ L を追加します。右下に 1.5 分追加 100 μ L を待ちます。
- ペトリ皿を閉じて 1 時間 37 ° c の定温器でチップを配置します。
- PBS 洗浄手順 1.5 から 1.6 倍余分な PDL を削除するを繰り返します。
- デバイスから PBS を吸い出しなさい。
- すぐにチップの井戸を左上への細胞培養媒体の 100 μ L を追加します。よく 1.5 分左下に追加メディアを待ちます。右も上にメディアを追加します。1.5 分追加 100 μ L チップの低い右も中長期を待ちます。
- プレート細胞する準備ができるまで、37 ° C の定温器でチップを配置します。
2. マルチコンパートメント チップにニューロンを播種
- 〜 12 × 106セル/ml の密度を生成するための確立したプロトコル21,22によると解離のラット海馬ニューロンの細胞懸濁液を準備します。
注: 3 と 12 × 106セル/mL の細胞懸濁液の密度の使用は可能です。低密度を使用する場合は、(下記参照) チップに追加する細胞を懸濁液の量を増やされるかもしれません。以下の手順は、マウスの解離大脳皮質や海馬の神経細胞の適用されます。他のニューロンの種類に最適な細胞密度が異なる場合があります。 - チップは、各ウェルに約 5 μ L を残してのメディアの大半を削除します。メイン チャンネル (図 2 a) から液体を削除することを避けるためにメイン チャンネルから離れて吸い出しなさい。
注意: は、同封のメイン チャンネルから液を吸い出してはいけない。メイン チャンネルから液を吸引する場合、気泡はチップの中に閉じ込めになる可能性があります。 - 右も上に細胞懸濁液 5 μ L を読み込むと下右も (~ 120,000 セルの合計) の細胞懸濁液 5 μ L 別。ロードセルをメイン チャンネル (図 2 b) 近くに調剤しています。ニューロンは、メインのチャンネルを確認するには顕微鏡下で確認してください。セルを接続するように 5 分待ちます。
注: いずれかのコンパートメントにニューロンをロードできます。説明のために、体細胞のコンパートメントは、右側のメイン チャンネルですがどちらかのコンパートメントは、体細胞のコンパートメントとして使用できます。チップ当たり 60,000 セルまでのセル密度が低いの使用可能です。セルの 10 μ L まで懸濁液は、それぞれに追加される可能性があります上で説明したよりも少なく細胞と細胞懸濁液との組み合わせで体細胞のコンパートメントの。 - 追加約 150 μ L の上部と下部の各神経細胞培養基井戸、右し、上部と下部の各メディアの 150 μ L を追加井戸を左します。5% CO2 37 ° C の定温器に加湿トレイにチップを置きます。
- 24 h 後、井戸からメディアを削除することによってメディアの変更を実行します。メイン チャンネルがいっぱい残っていることを確認します。トップも、メディアの 150 μ L を追加し、下の井戸を埋めます。
- 指定した日数のインキュベーターにチップを置きます。
注: は、メディアを監視しようとして幾日のあらゆるカップルままライトピンクします。メディアが黄色の場合は、新鮮なメディアでそれの 50% を置き換えます。流体のレベルが低い場合は、適切な湿度と蒸発を防ぐためにチップの適切な二次封じ込めがあるを確認します。最小化、または排除しても、メディアの変更がセカンダリ封じ込めを使用しておよび/またはポリテトラフルオロ エチレン (PTFE) とチップが入った料理をカバー可能な-FEP フィルム。
3 逆行性ニューロン チップ内の標識
注: 逆行性標識実行できます変更されたコレラ毒素と狂犬病ウイルスの使用を含む複数の技術を使用しています。以下ニューロンのラベル付けについては、狂犬病-mCherry、- eGFP で G 削除のウイルスを使用しています。ローカル組織のガイドラインに従って潜在的感染性物質を処理します。追加のトレーニングが必要です。
- 37 ° c. に暖かい新鮮な神経文化メディアメディア チップあたりの ~ 400 μ L を推定します。
- 50 の合計で変更された狂犬病ウイルス ウイルス口数を希釈 μ L のいずれかのメディアを使用して軸索のコンパートメントのも。
注: ヒントおよび組織承認プロトコルに従ってウイルスと接触してチューブの処分 - 37 ° C で、軸索のコンパートメントと遠心分離機でストアの井戸から残りのメディア チューブのピペットで移しなさい優しく
- 軸索のコンパートメントに新鮮な暖かいメディアの 150 μ L と希薄ウイルスの 50 μ L を追加します。37 ° C の定温器で 2 時間インキュベートします。
- ウイルスを含むメディアを削除し、それを適切に処分します。
注: メイン チャンネルから液を吸引する場合、気泡をチップに閉じ込めになる可能性があります。 - 優しくも 1 つの軸索に新鮮なメディアの 75 μ L を追加、他の軸索にも流れることができます。
- 2 番目の軸索からよく流れを削除し、適切に処分します。
- 3.6、3.7 の手順をもう一度繰り返します。
- 追加軸索のコンパートメントに格納されてメディアをバックアップします。必要に応じて、適切なボリュームを維持し、インキュベーターにセルを返すには、約 50 μ L 新鮮なメディアを追加します。
注: 蛍光蛋白質の表現は 48 h で表示され 8 日まで続きます。ニューロンは、神経細胞の培養液に室温で 30 分までのイメージすることができます。培地は、温めの CO2と置き換えることもできます-休止状態に依存しない B27 と E のイメージになったと。ニューロンは、37 ° C、5% CO2でよく加湿環境チャンバ内イメージを作成することができます。この場合、加湿は、チップ内の蒸発損失を最小限に抑えるための重要な加熱によって悪化し、ニューロンの健康を危険にさらすことができます。
4. 流体分離チップ内軸索の区画の
- 20 を削除下から μ を体細胞コンパートメントの上部右も軸索のコンパートメントと場所の左折します。平衡に各チャネル内流れの 2 分を待ちます。
- 軸索のコンパートメントからメディアの 50 μ L を削除します。このメディアに 1 mM Alexa Fluor 488 ヒドラジドの 0.3 μ L を追加、ピペットを介してミックスおよび軸索のコンパートメントに戻る。チップは画像の準備ができて。
注: 興味の他の化合物を追加できます。時間の経過とともに流体分離を監視するためには、関心の化合物として同じような分子量の蛍光染料を追加することをお勧めします。
5. チップ内の膠を実行します。
- メイン チャンネル (図 2 a) の入り口からピペット先端部を維持する軸索のコンパートメントからメディアを削除し、遠心管に格納します。
- 軸索のコンパートメント (図 2 b) のメイン チャンネルのいずれかの入り口の近くの吸引ピペットを配置する軸索のコンパートメントを完全に、吸い出しなさい。1-2 分コンパートメントからソリューションを完全に削除することを確認、吸引を続けます。
注: 穿刺用真空圧力は膠手順が正常に動作するために少なくとも 18 インチ Hg をある必要があります。 - 軸索のコンパートメントに置き換えて蓄積メディア、顕微鏡下でチップを見ることによって軸索が切断されたことを確認します。
メモ: メディアを交換するとき、泡は軸索のコンパートメントの形成する場合、5.1 5.2 の手順を繰り返します。 - チップをインキュベーターに戻ります。
6 チップ内蛍光免疫染色
- PBS (4% のホルムアルデヒド、1 μ M MgCl2、0.1 μ m CaCl2, 120 mM ショ糖) で 4% ホルムアルデヒド固定溶液を準備します。
- チップの井戸のほとんどのメディアを削除 (内部コンパートメントを乾燥しないでください)。
- すぐに軸索と体細胞コンパートメントの上の井戸に固定溶液 100 μ L を追加します。
- 1 分後に、下の井戸に固定溶液 100 μ L を追加します。室温で 30 分を修正しました。
- チップの井戸からソリューションのほとんどを削除 (内部コンパートメントを乾燥しないでください)。すぐに軸索と体細胞コンパートメント上の井戸の各 150 μ L の PBS を追加します。下の井戸に流入する PBS の 2 分を待ちます。
- 6.5 の手順を 2 回繰り返します。
- チップの井戸から PBS のほとんどを削除します。すぐに 0.25% と 150 μ L の PBS を追加各軸索と体細胞コンパートメント上の井戸の TritonX 100。15 分待ちます。
- チップの井戸から液体の大部分を除去し、すぐに各軸索と体細胞コンパートメントの上の井戸にブロッキング液 (PBS でヤギ血清を 10%) の 150 μ L を追加します。15 分待ちます。
注: ブロックの効果的なソリューションする必要があります例えばロバ反羊の二次抗体の抗体に対応する、ブロッキング液でロバ血清を使用します。 - チップの井戸から液体の大部分を除去し、すぐに軸索と体細胞コンパートメント上の井戸のそれぞれに PBS で 1% ヤギ血清で一次抗体 (または抗体) の 100 μ L を追加します。蒸発を最小限に抑え、1 時間室温でまたは 4 ° C に一晩待つまでカバーします。
- チップの井戸からソリューションのほとんどを削除 (内部コンパートメントを乾燥しないでください)。すぐに軸索と体細胞コンパートメント上の井戸の各 150 μ L の PBS を追加します。下の井戸に流入する PBS の 5 分を待ちます。
- 6.10 の手順を 2 回繰り返します。
- チップの井戸から液体の大部分を除去し、すぐに軸索と体細胞コンパートメント上の井戸のそれぞれに PBS で二次抗体 (または抗体) の 100 μ L を追加します。蒸発を最小限に抑え、室温で 1 時間待つまでカバーします。
注: は、二次抗体の推奨希釈は、製造元の指示を参照してください。 - 6.10 6.11 の手順を繰り返します。
- 免疫染色の 1 日以内イメージング、PBS でいっぱいチップを保ちます。イメージングの前に 1 日以上、チップが格納される場合は、蒸発防止のため、イメージする準備ができるまで 4 ° C で保存しパラフィン フィルムのチップが入った料理をラップします。
- サンプルの長期的な保存、(例えばFluoromount G) メディアをマウントを使用できます。
- チップの井戸から液体のほとんどを削除します。1 mL の使い捨てプラスチック ピペットを使用すると、軸索と体細胞コンパートメント上の井戸の各メディアのマウントの 2 滴を追加します。
- チャネルを介してマウント メディアの流れを奨励するチップを傾けます。5 分後に、下の井戸に 2 滴を追加します。イメージングの前に 1 時間待ちます。
メモ: メディアをマウントを使用した後それされません他のターゲットを再検出することが可能。
結果
チップ内のニューロンの成長の約 5-7 日後、軸索の成長は明らかです。チップは、図 3、24 日に神経の成長を示すに示すよう位相コントラスト イメージングと互換性があります。チップは、蛍光イメージング (図 4図 5図 6図 7)。軸索のコンパートメントを介して狂犬病ウイルス感染後 3 日 mCherry 陽性ニューロン軸索軸索のコンパートメントに拡張チップ (図 4) をイメージしました。Fluidically コンパートメントを分離する機能を示すためには、低分子蛍光染料 (Alexa Fluor 488 ヒドラジド) は軸索のコンパートメントに追加されました。これらの結果は PDMS による商工会議所17に匹敵して位相差顕微鏡および蛍光イメージングのためのプラスチック製のチップの適合性を示します。
PDMS 装置、プラスチック製のチップと神経細胞の成長を示すためには、両方のプラットフォームにおける神経細胞を培養し、時間の経過とともに神経の成長を監視します。図 5文化で 22 日に 3 から神経成長を示しています。これらの結果は、3 の独立実験の代表です。神経の成長は 2 つのプラットフォーム内で対等な文化では、15 日間は長い文化の年齢 (> 21 日) プラスチック製のチップ内で孤立した軸索が表示される以下のビーズ (図 5 a) と健康。さらに軸索のコンパートメント内にある軸索を視覚化する私たちプラスチック内健康の軸索の成長を表わす β-チューブリン III の immunostained チップで 22 日間の培養 (図 5 b)。
軸索の損傷と再生の研究区分マイクロ流体デバイスを使用して共通しています。これらの研究の適合性を実証するには、チップ、逆行性標識細胞を使用してをイメージしました前に、24 h 後膠 (図 6)。撤回電球と軸索の再生は、両方明らか次膠です。これらの結果は、PDMS ベースのデバイス14,17を使用してパブリッシュされたデータと同じです。
免疫細胞化学、蛋白質のローカリゼーションを視覚化するマルチコンパートメント デバイス内で実行される一般的な手法です。24 日間培養後チップ内のニューロン固定し、両方の興奮性および抑制性のシナプス マーカー、vGlut1、vgat ノックアウト、それぞれ染色 (図 7)。逆行性標識 mCherry ニューロンもイメージ (図 7) であった。高分解能イメージングを実行する能力を示す、60 × シリコーン油浸漬目的の回転のディスク共焦点を使用してイメージングを行った。重要なは、チップ内培養神経細胞が成熟したシナプスが形成されたことを示す拡大された領域内で樹状突起スパインが目立ちました。
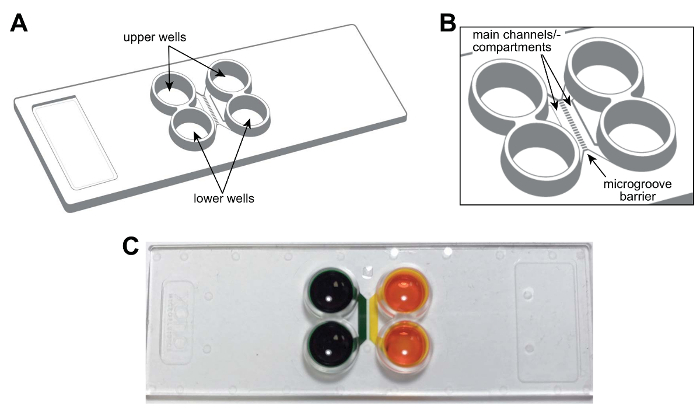
図 1: ニューロンを区画の完成、プラスチック 2 コンパートメントのマイクロ流体チップ。(A)上部および下の井戸の場所を示すマルチコンパートメント チップの模式図。(B)主要なチャネル (またはコンパートメント) を示すチップの拡大模式図とコンパートメントを接続する溝。メイン チャンネルが約 1.5 mm × 7 × 0.060 mm (W × L × H) です。幅と溝の高さが約 0.01 mm × 0.005 mm、それぞれです。溝の長さは 0.15 mm 0.9 mm。 (C)の写真は、メイン チャンネルまたは fluidically、能力を示すコンパートメントごとに色素を着色食品を含む代表的なマルチコンパートメント チップ構成によって異なります各チャンネルを分離します。この図の拡大版を表示するのにはここをクリックしてください。
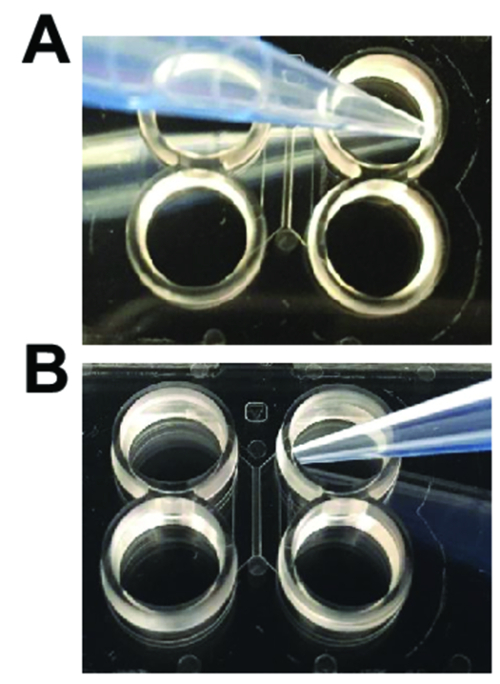
図 2: マルチコンパートメント プラスチック製のチップを使用する場合に必要なピペッティング テクニック。(A)ようにピペット先端部がメイン チャンネルの入り口から角度付き必要がありますを追加すると、洗浄のためのメディアを吸引します。(B)ニューロンの読み込みまたは膠を実行、ピペット チップする場合メイン チャンネルの入り口に向かって傾斜します。この図の拡大版を表示するのにはここをクリックしてください。
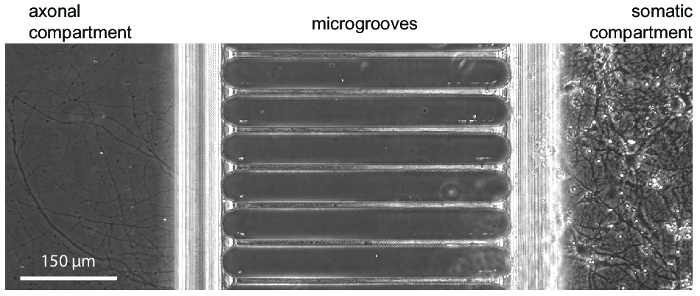
図 3: 文化の 24 日チップ内の典型的な神経の成長を示す位相コントラスト顕微鏡写真。萌芽期海馬ニューロンは右体細胞のコンパートメントに播種しました。軸索の伸長は 5-7 日で軸索のコンパートメントの先頭に表示されます。この図の拡大版を表示するのにはここをクリックしてください。
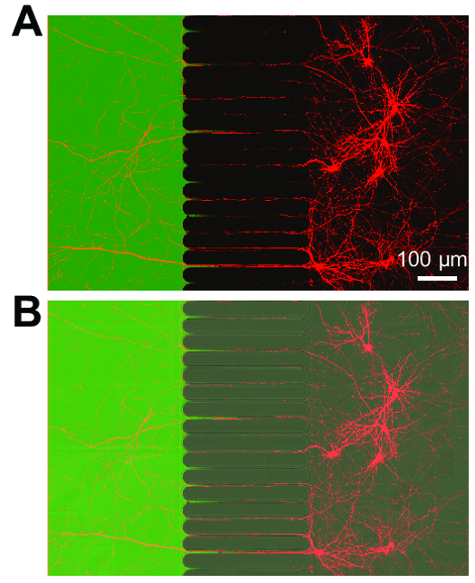
図 4: 逆行性標識細胞 mCherry 蛍光蛋白質を表現し、fluidically 分離軸索のコンパートメントに軸索を拡張します。(A)ライブ逆行性標識細胞軸索のコンパートメントに適用される簡潔に変更された mCherry 狂犬病ウイルスによる感染を示すマージされた蛍光顕微鏡像。ニューロンは 21 日間の培養で感染画像 3 日後だった低分子量染料、Alexa Fluor 488 ヒドラジドのアプリケーションによって示されて軸索のコンパートメント内の孤立した微小環境を作成します。(B) (A) チップの溝領域を視覚化する微分干渉の対照 (DIC) イメージを含むマージされたイメージ。レーザー走査型共焦点顕微鏡 30 ×/1.05 n. a. シリコーン オイルを使用して、画像を取得した (ne = 1.406) 対物レンズ。この図の拡大版を表示するのにはここをクリックしてください。
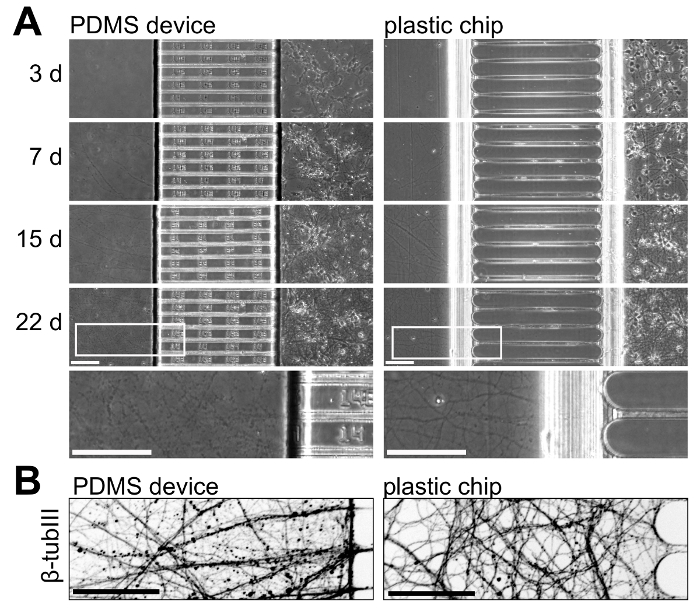
図 5: マルチコンパートメント PDMS デバイスとプラスチック製のチップ内にある神経の成長のサイド ・ バイ ・ サイド比較。(A)フェーズ 3、7、15、22 日間の培養で撮影した両方のプラットフォームのコントラスト顕微鏡写真。下部には、22 日撮影画像から高倍率地域は両方のプラットフォームでこの年齢で軸索の成長を説明するために含まれています。チップ内の軸索はより連続で、この年齢で PDMS デバイスでより健康的な表示されます。(B) β-チューブリン III の反転蛍光顕微鏡の写真は、22 日間の培養で PDMS デバイスとプラスチック製のチップの両方の軸索のコンパートメント内の軸索を染色しました。回転ディスク共焦点イメージング システムと x/0.45 20 を使用して画像を取得した対物レンズです。すべてのスケール バーは、100 μ mこの図の拡大版を表示するにはここをクリックしてください。 。
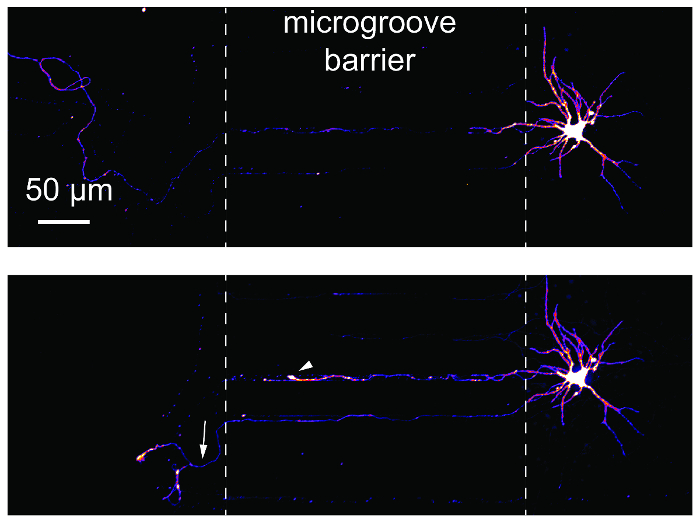
図 6: 膠とプラスチックのマルチコンパートメント チップ内海馬ニューロンの再生。(Top)ニューロンは、変更された mCherry 狂犬病ウイルスを使用してラベル付けし、膠文化で 24 日に前にイメージを作成し逆行.画像は、'火' カラー ルックアップ テーブルを使用して pseudocolored。(下)上部のパネルで画像化された同じニューロンだったイメージ 24 h ポスト膠です。白破線は microgroove バリアのエッジを表示します。膠は、左の点線の位置で発生しました。白い矢印は、撤回の電球を示しています。白い矢印は、再生軸索を示します。回転ディスク共焦点イメージング システムと 20 ×/0.45 n. a. 対物レンズを使用して画像に買収されました。この図の拡大版を表示するのにはここをクリックしてください。
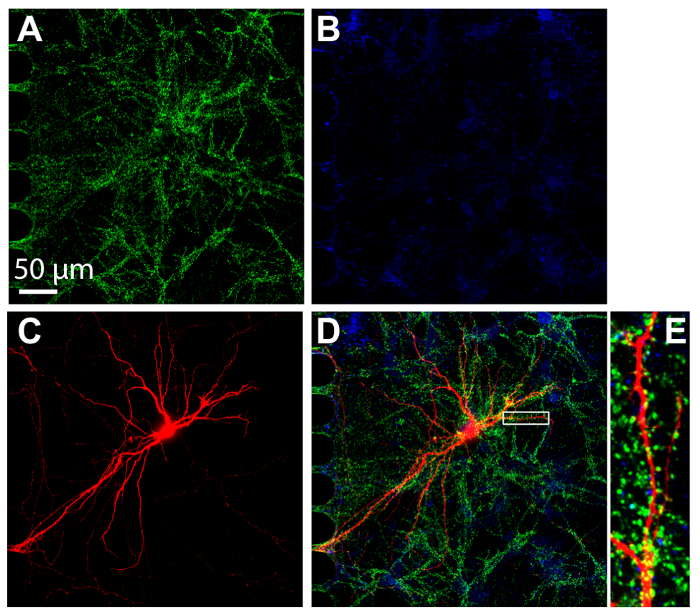
図 7: フォーム プラスチック マルチコンパートメント チップ内培養海馬神経細胞間のシナプスします。染色された文化で 24 日公演し、60 × シリコーン油浸漬レンズを用いた体細胞コンパートメント内のイメージを作成します。ニューロンは、抑制性シナプス マーカー、vgat ノックアウト (青) (A)興奮性シナプス マーカー、vGlut1 (緑) と(B)を表現します。(C)逆行性標識 (赤) ニューロンが軸索のコンパートメントに適用される変更された狂犬病ウイルスによって汚染された mCherry。(D) vGlut1、vgat ノックアウトと mCherry の結合された蛍光顕微鏡。(E) (D) 白いボックスで示されている拡大地域樹状突起スパイン、他のニューロンからのシナプス入力を受け取るサイトを示しています。回転ディスク共焦点イメージング システムと 60 ×/1.3 エヌ シリコーン オイルを使用して画像を取得した (ne = 1.406) 対物レンズ。この図の拡大版を表示するのにはここをクリックしてください。
| プラスチック製のマルチコンパートメント チップ | PDMS マルチコンパートメント デバイス |
| 軸索を分離します。 | 軸索を分離します。 |
| 微小を確立します。 | 微小を確立します。 |
| axotomize ニューロン | axotomize ニューロン |
| 光透過性 | 光透過性 |
| 高解像度画像に対応 | 高解像度画像に対応 |
| 蛍光顕微鏡との互換性 | 蛍光顕微鏡との互換性 |
| 完全に組み立てられて | 必要な基板アセンブリ |
| 健康的な軸索 > 21 日 | 健康的な軸索 > 14 日間 |
| 親水性培養表面 | 疎水性 |
| ガス不透過性 | ガス透過性 |
| 丸い溝およびチャネル | ストレート溝 |
| 準備手順が少ない | 上部は溝内の汚損のため取り外し可能 |
| レーザーアブレーションと互換性がないです。 | 小さな分子や有機溶媒の吸収 |
| 鉱物油ベースの液浸オイル (なシリコーン系オイル) と互換性がないです。 |
表 1:プラスチックと PDMS 培養神経細胞のマルチコンパートメント プラットフォームの比較。
ディスカッション
プラスチック製のマルチコンパートメント チップ提供長期神経文化を提供するニューロンを区画化の簡単に使用できるオプション (> 3 週間)。このプロトコルでは、これらのチップ内皮質と海馬マウスの神経細胞を培養する方法を説明します。水溶性の微小の作成およびラベル ニューロンを逆行、膠を実行し、免疫細胞化学を実行する方法を示した。重要なは、これらのチップと互換性のある高解像度、蛍光とライブ イメージング。
プラスチック マルチコンパートメント チップは、PDMS ベース区分デバイスと同じ機能の多くを提供するが、長所、短所、およびいくつかの特徴があります。表 1は、プラスチック製のチップと PDMS ベースのデバイスの両方の機能の比較を示します。まず、チップが組み立てたし、恒久親水化したを使用しやすく、濡れ性を容易にします。プラスチックはガス透過性、PDMS とは違ってではないので泡が予期せず、チャンネル内で構成されている場合彼らは容易にエスケープしないし、削除する必要があります。主にエタノールと他にいくつか独自のエージェントを含む塗装の前処理ソリューションは、バブル形成を排除します。
蛍光蛋白質の次の伝達を行ったチップ (図 4) 内の予測の画像をライブし、プラスチックの検出可能な蛍光はありませんでした。注意点は、チップと高開口数目標用浸漬オイルこと、シリコーン オイルとない鉱物油ベースです。鉱物油は、環状オレフィン共重合体と有害反応を引き起こす可能性が。明視野イメージング チップの溝が両端に丸みを帯びたの両端にいくつかの光の屈折を引き起こしているマイクログルーブ柵の方へのメイン チャンネルの z 方向の緩やかなテーパーがあることに注意することが重要です、明視野観察 (図 3) をイメージング中に溝。チップが完成、ので抗体ミクロン サイズ溝浸透がもでがあります (完全に接合した PDMS ベースのデバイスと同様)。したがって、チャンネル/コンパートメントで免疫染色の定量的解析を行わなければなりません。溝内神経投射の免疫染色は、溝に抗体の流れを支援するためにコンパートメントと fluorophores のボリュームの違いを作成することによって改善できます。
開示事項
A.M.T。 マイクロ流体チャンバー/チップ (米国 7419822 B2) の発明者は、ゾナ マイクロ、LLC のメンバーです。副社長は、ゾナ マイクロ、LLC の社員です。J. h. ゾナ マイクロ、LLC のメンバーであります。濃度は, 競合する金銭的な利益を宣言していません。この論文のオープン アクセス出版ゾナ マイクロ スポンサーです。
謝辞
著者は、Smita Paranjape (UNC チャペルの丘)、ジョイスの Ciechanowski (ゾナ)、ブラッド ・ テイラー (ゾナ) テイラー萎凋 (ゾナ) からの技術的あるいは校正上の支援を認めます。著者は、ゾナ マイクロ、LLC、国立精神衛生研究所 (R42 MH097377) からの支援を認めます。イメージングは、共焦点と多光子イメージング コア施設の組織プラスミノーゲンアクテベータ センター助成金 P30 NS045892 発育センター助成金 (U54 HD079124) によって部分的に支えられました。内容は著者の責任と国立衛生研究所の公式見解を必ずしも表さない。
資料
| Name | Company | Catalog Number | Comments |
| XonaChip | Xona Microfluidics, LLC | XC150 | 150 µm length microgroove barrier |
| Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier | |
| Xona Microfluidics, LLC | XC900 | 900 µm length microgroove barrier | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaPDL | Xona Microfluidics, LLC | XonaPDL | |
| E17/E18 timed pregnant Sprague Dawley rats | Charles River | 24100564 | |
| neuronal culture media: | |||
| - Neurobasal medium | ThermoFisher Scientific | 21103049 | |
| -B-27 Plus Supplement (50x) | ThermoFisher Scientific | A3582801 | |
| -GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| -Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Salk Institute for Biological Studies | G-deleted Rabies-mCherry | Material Transfer Agreement required | |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Pierce 16% formaldehyde | ThermoFisher Scientific | 28906 | |
| PBS (10x) | ThermoFisher Scientific | QVC0508 | |
| normal goat serum | ThermoFisher Scientific | 16210064 | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| Incubator, 5% CO2 37 °C | |||
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| Spinning disk confocal imaging system | Andor Technology | CSU-X1, iXon X3 EMCCD | 60x silicone oil & 20x objectives |
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
参考文献
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington's Disease. Cell Reports. 22 (1), 110-122 (2018).
- Batista, A. F. R., Martínez, J. C., Hengst, U. Intra-axonal Synthesis of SNAP25 Is Required for the Formation of Presynaptic Terminals. Cell Reports. 20 (13), 3085-3098 (2017).
- Yang, Y., et al. Presynaptic regulation of astroglial excitatory neurotransmitter transporter GLT1. Neuron. 61 (6), 880-894 (2009).
- Sutton, M. A., Taylor, A. M., Ito, H. T., Pham, A., Schuman, E. M. Postsynaptic decoding of neural activity: eEF2 as a biochemical sensor coupling miniature synaptic transmission to local protein synthesis. Neuron. 55 (4), 648-661 (2007).
- Hengst, U., Deglincerti, A., Kim, H. J., Jeon, N. L., Jaffrey, S. R. Axonal elongation triggered by stimulus-induced local translation of a polarity complex protein. Nature Cell Biology. 11 (8), 1024-1030 (2009).
- Sharma, N., et al. Long-distance control of synapse assembly by target-derived NGF. Neuron. 67 (3), 422-434 (2010).
- Harrington, A. W., et al. Recruitment of actin modifiers to TrkA endosomes governs retrograde NGF signaling and survival. Cell. 146 (3), 421-434 (2011).
- Zhang, Y., et al. Assembly and maintenance of nodes of ranvier rely on distinct sources of proteins and targeting mechanisms. Neuron. 73 (1), 92-107 (2012).
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Tran, H. T., et al. Alpha-synuclein immunotherapy blocks uptake and templated propagation of misfolded alpha-synuclein and neurodegeneration. Cell Reports. 7 (6), 2054-2065 (2014).
- Calafate, S., et al. Synaptic Contacts Enhance Cell-to-Cell Tau Pathology Propagation. Cell Reports. 11 (8), 1176-1183 (2015).
- Cosker, K. E., Fenstermacher, S. J., Pazyra-Murphy, M. F., Elliott, H. L., Segal, R. A. The RNA-binding protein SFPQ orchestrates an RNA regulon to promote axon viability. Nature Neuroscience. 19 (5), 690-696 (2016).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611 (2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625 (2017).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Mukhopadhyay, R. When PDMS isn't the best. What are its weaknesses, and which other polymers can researchers add to their toolboxes?. Analytical Chemistry. 79 (9), 3248-3253 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain research. 126 (3), 397-425 (1977).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved