Method Article
عزل الحويصلات خارج الخلية الأنسجة من الكبد
In This Article
Summary
هذا هو بروتوكول لعزل الحويصلات خارج الخلية الأنسجة (EVs) من الكبد. يصف البروتوكول عملية من خطوتين تنطوي على التسريب الكولاجيني تليها تفاضلية ultracentrifugation لعزل أنسجة الكبد EVs.
Abstract
يمكن إطلاق الحويصلات خارج الخلية (EVs) من العديد من أنواع الخلايا المختلفة واكتشافه في معظم سوائل الجسم، إن لم يكن كلها. يمكن للمركبات الكهربائية المشاركة في الاتصال من خلية إلى خلية عن طريق إغلاق الجزيئات النشطة بيولوجيا مثل الحمض النووي الريبي أو البروتين من خلية إلى أخرى. وقد أجريت معظم الدراسات من المركبات الكهربائية في نماذج ثقافة الخلايا أو في المركبات الكهربائية معزولة عن سوائل الجسم. وهناك اهتمام ناشئ بعزل المركبات الكهربائية عن الأنسجة لدراسة مساهمتها في العمليات الفسيولوجية وكيفية تغييرها في الأمراض. عزل المركبات الكهربائية مع غلة كافية من الأنسجة هو التحدي من الناحية الفنية بسبب الحاجة إلى تفكك الأنسجة دون ضرر الخلوية. يصف هذا الأسلوب إجراء لعزل المركبات الكهربائية من أنسجة كبد الماوس. وتنطوي هذه الطريقة على عملية من خطوتين تبدأ بهضم الكولاجين في الموقع متبوعة بعملية تفاضلية فائقة الطرد المركزي. التسريب الأنسجة باستخدام الكولاجين يوفر ميزة على القطع الميكانيكيأو تجانس أنسجة الكبد بسبب زيادة غلة المركبات الكهربائية التي تم الحصول عليها. استخدام هذه العملية من خطوتين لعزل المركبات الكهربائية من الكبد سوف تكون مفيدة لدراسة الأنسجة EVs.
Introduction
الحويصلات خارج الخلية (EVs) هي حويصلات مرتبطة بالغشاء يتم تحريرها من العديد من الأنواع المختلفة من الخلايا في الجسم. تحتوي المركبات الكهربائية على حمولة من الجزيئات التي تشمل الحمض النووي الريبي والحمض النووي والبروتين. يتم تفترض نقل هذه الشحنة من قبل المركبات الكهربائية من خلية إلى أخرى كآلية واحدة من خلالها الخلايا داخل الأنسجة التواصل مع بعضها البعض1. وقد استمدت غالبية المعلومات المتعلقة بالبضائع أو أدوار المركبات الكهربائية في الصحة العادية والأمراض من الدراسات على المركبات الكهربائية التي تم الحصول عليها من الخلايا في الثقافة أو التي تم جمعها من الدورة الدموية أو غيرها من سوائل الجسم2. من أجل فهم أدوارهم الفسيولوجية في الجسم الحي، طريقة قوية ضرورية لعزل الأنسجة EVs التي تلتقط جميع السكان من المركبات الكهربائية ويتجنب الضرر الخلوي أو التلوث3. الهدف العام للطريقة الموضحة هنا هو عزل الأنسجة EVs من كبد الماوس.
وقد ثبت أن معظم أنواع الخلايا في الكبد لإنتاج المركبات الكهربائية، ودراسة الإشارات القائمة على EV هو تعزيز المعرفة الأساسية وفهم الأمراض الكبدية. ومع ذلك، فإن التأثير المشترك للمركبات الكهربائية من أنواع الخلايا المختلفة داخل الأنسجة هو مفهوم جزئي فقط. عزل المركبات الكهربائية من أنسجة الكبد ضروري من أجل فهم المساهمات في الموقع من المركبات الكهربائية داخل بيئة الأنسجة. ويستند النهج الموضح هنا على التسريب خطوتين لتعزيز تفكك الأنسجة وتقليل تلف الخلايا. في وقت لاحق، يتم عزل المركبات الكهربائية من أنسجة الكبد المنفصلة. وقد استخدمت النهج التي تستخدم التسريب خطوتين لعزل خلايا الكبد منذ أوائل 1950s4. وقد تم تعديل هذه الأساليب لعزل خلايا الكبد وتحسينها باستمرار، وهي الآن النهج القياسية لعزل خلايا الكبد في الثقافات، في تعليق الخلايا، ومن الأنسجة5،6،7. في الخطوة الأولى، يخضع الكبد لتدفق غير تدوير مع العازلة خالية من الكالسيوم، حل الملح متوازن هانك (HBSS). في الخطوة الثانية، يتم غرس الكبد مع الكولاجين لإذابة المصفوفة خارج الخلية لمزيد من الفصل بين تقاطعات الخلايا إلى الخلايا. وقت العلاج الأمثل لحل الكولاجين هو 7 إلى 10 دقائق. ومدة أقصر من العلاج يسبب حل غير كامل والاحتفاظ باتصالات الخلية في الكبد, في حين أن مدة أطول قد يسبب تلف الكبد أو اضطراب الوريد المدخل. ثم يتم عزل المركبات الكهربائية باستخدام الطرد المركزي التفاضلي لإزالة الخلايا والحطام الخلوي. وهذا يؤدي إلى جمع EV في الغلة العالية التي يمكن استخدامها لمزيد من التحليلات النهائية أو الدراسات.
Protocol
أُجريت جميع الدراسات المتعلقة بالحيوانات وفقاً لبروتوكول وافقت عليه لجنة الرعاية والاستخدام المؤسسية للحيوانية في Mayo Clinic (مايو كلينك).
1. إعداد مقاعد البدلاء
- إعداد حمام مائي وتعيينها إلى 37 درجة مئوية. وترد المعدات الضرورية الأخرى والتجهيز في الشكل1.
- قياس 100 ملغ من الكولاجين النوع الرابع وإضافته إلى قارورة 125 مل تحتوي على 100 مل من HBSS في حمام مائي (40 درجة مئوية). تأكد من أن الكولاجين قد تم حلها عن طريق دوامة السائل في قارورة، وأيضا تأكد من أن يتم غمر قارورة تماما في حمام الماء. لمزيد من الكفاءة، اسمح للكولاجيناز أن يذوب لمدة 30 دقيقة على الأقل على الرغم من أنه قد يبدو أن يذوب على الفور.
- غمر قارورة 125 مل تحتوي على 50 مل من HBSS في حمام مائي عند 40 درجة مئوية. سيتم استخدام هذا للمسح الأولي.
- رش أسفل سطح جميع الأدوات مثل مقص وملقط مع الإيثانول 70٪. إعداد عدد قليل من مسحات القطن نظيفة.
- شطف الأنابيب من المضخة عن طريق تشغيل الإيثانول 70٪ من خلال المضخة وإزالة أي الإيثانول المتبقية عن طريق الشطف مرتين مع المياه الجارية.
- وضع وسادة مقاعد البدلاء ماصة على مقاعد البدلاء المختبر ووضع حاوية مربع الثابت على رأس. وسوف تكون هناك حاجة إلى هذا لاحتواء أي السوائل الزائدة أثناء التسريب الماوس. التفاف وسادة رغوة البوليسترين مع رقائق الألومنيوم ووضعها داخل الحاوية.
- ضع طبق ثقافة معقم 10 سم بالقرب من مقاعد البدلاء. وسوف تستخدم هذه لعقد الكبد المهضوم بعد الانتهاء من التسريب.
- صب 10 مل من الكولاجين المتوسطة (الخطوة 1.2) في طبق ثقافة معقمة مقدما.
- باستخدام مجموعة جمع الدم المجنحة، قم بتوصيل مقياس 23 إلى النهاية الحرة لأنابيب المضخة (قطع الأجنحة قبالة قنية الفراشة يمكن أن يؤدي إلى معالجة أفضل). تمر حتى يتم ملء غيض من قنية جمع الدم.
2. إعداد الحيوانات
- قبل البدء في التخدير باستخدام isoflurane، تأكد من أن كمية كافية من الغاز العرض متاح لمدة الإجراء. تشغيل الأكسجين (O2) العرض إلى غرفة الحث في 1-2 L، ثم تشغيل isoflurane بين 2-4٪ باستخدام مقياس التدفق.
- وضع الماوس في غرفة التعريفي وإغلاق الباب العلوي. مراقبة الماوس حتى يتم recumbent.
ملاحظة: الغازات في الغرفة سوف تبقي الفئران التخدير لعدة دقائق. - وضع الماوس على وسادة رغوة البوليسترين ملفوفة مع رقائق الألومنيوم. تحويل التدفق من غرفة الحث إلى أنفمخروط. تأكد من أن التخدير كافٍ. إذا كان الماوس قد بدأ الاستجابة، كبح بلطف في مخروط الأنف حتى يتم التخدير بالكامل.
- ضمان التخدير من خلال مراقبة التنفس والاستجابة للتحفيز أثناء الإجراء. ضبط معدل تدفق حسب الحاجة لضمان التخدير الكافي. يجب أن تكون الكفوف غير مستجيبة لاختبار قرصة تحت التخدير. ويمكن الحصول على تفاصيل إضافية من الدليل المختبري لرعاية الحيوانات.
- الشريط أو دبوس أسفل جميع الأطراف الأربعة من الماوس.
- تنظيف الجلد على البطن عن طريق الرش مع الإيثانول 70٪ ومحوه مع الشاش وسادة الكحول. هذه الخطوة حاسمة لتجنب التلوث من الفراء الماوس.
- جعل قطع مفتوحة على نطاق واسع من خلال الجلد من الأمامي إلى عظم الحوض باستخدام مجموعة من مقص معقم. يجب الحرص على عدم قطع أي أعضاء داخلية . إزاحة الأمعاء إلى الجانب الأيسر من الحيوان باستخدام قضيب القطن يميل إلى الكشف بلطف الوريد المدخل (PV) والوريد كافا السفلي (IVC).
3. التعليب والتسريب (0.5 ساعة)
- باستخدام ملقط منحني، وضع مؤشر ترابط تحت الوريد البوابة وربط عقدة فضفاضة لإعداد cinching بإحكام بعد التعليب.
- إدراج قنية (23G من مجموعة جمع الدم) في الوريد البوابة 5-10 ملم تحت الرباط. لا تقم بإدراج قنية الماضي فرع البوابة الأولى، وإلا يمكن أن يكون الفص الأمامي الأيمن مغروسة بشكل غير كاف. يمكن إصلاح قنية أو تثبيتها مع الموضوع باستخدام عقدة سدادة.
- بدء المضخة لضخ في HBSS بمعدل تدفق منخفض (1-2 مل / دقيقة). بمجرد التأكد من أن التعليب ناجح، سيبدأ الكبد في الغسل.
- قطع IVC لتخفيف الضغط والسماح للسوائل المفرطة داخل الكبد لاستنزاف. يتم تنفيذ هذا أفضل باستخدام عوامل التشغيل اليد الأخرى بحيث لا يتم نقل قنية.
- زيادة معدل التدفق ببطء إلى 8 مل / دقيقة وإكمال التسريب باستخدام حجم 50 مل كامل من HBSS من خلال الكبد، على مدى 5 دقيقة القادمة.
- تغيير الكولاجين التي تحتوي على المتوسطة (الخطوة 1.2) في الكأس قبل HBSS بدأت تنفد. تأكد من أن فقاعات الهواء غير موجودة ولا تتدفق إلى الكبد عند تغيير المتوسط.
- تطبيق ضغط عابر على IVC في فترات 5 ق عن طريق لقط مع ملقط. وهذا سوف يسبب تضخم الكبد والمساعدة في هضم الأنسجة والتفكك (7-8 دقائق). مع تقدم الهضم، سوف تنتفخ الكبد وتصبح بيضاء. الكبد يمكن أن تنتفخ بشكل موحد إلى ما يقرب من ضعف حجمها الأصلي.
- إيقاف المضخة وإزالة قنية بمجرد الانتهاء من الهضم. الانتهاء من هضم الكبد سوف تعتمد على حجم الماوس وحالة الكبد. يمكن ملاحظة وجود انفة في الكبد إذا تم استخدام قضيب ذو رؤوس قطنية لفحص الكبد بلطف.
- إزالة المرارة من الكبد، والحرص على عدم تمزيقه. باستخدام زوج مغسول من المقص اتّبع، قم باستخراج الكبد من الماوس إلى طبق ثقافة معقم بحجم 10 سم يحتوي على ملح مُسعّد بالفوسفات (PBS) لغسل السطح. نقل الكبد بعناية في طبق ثقافة معقمة 10 سم تحتوي على الكولاجين المتوسطة (من الخطوة 1.8). هذه خطوة حاسمة لتجنب التلوث من دم الماوس والصفراء.
- الاستيلاء على وتمزيق الكبد مع اثنين من ملقط نظيفة في حين يهز بلطف الخلايا من الكبد. كما يحدث هذا، سوف تصبح سحابة المتوسطة. يمكن أن تهتز جميع خلايا الكبد بعيدا، تاركة وراءها النسيج الضام والأنسجة الوعائية.
- Triturate حل الخلية عدة مرات باستخدام حقنة 3 مل حتى يتم اهتزت أجزاء غير مهضوم من الكبد قبالة. صب تشغيله في أنبوب مخروطي 50 مل مع 70 ميكرومتر نايلون مصفاة الخلايا لتصفية أي النسيج الضام غير مهضوم. اغسل الطبق مع HBSS لجمع الخلايا المتبقية وملء أنبوب مخروطي 50 مل.
- الطرد المركزي بهدوء أنبوب مخروطي 50 مل في الدوار دلو يتأرجح في 50 × ز لمدة 10 دقيقة في 4 درجة مئوية.
- نقل supernatant إلى أنبوب مخروطي 50 مل جديدة.
4. عزل المركبات الكهربائية (5 ح)
- الطرد المركزي supernatant في 300 × ز لمدة 10 دقيقة في 4 درجة مئوية. نقل supernatant في أنبوب مخروطي 50 مل جديدة.
- طرد مركزي في 2000 × ز لمدة 20 دقيقة في 4 درجة مئوية لإزالة حطام الخلية والمجاميع.
- نقل supernatant إلى أنبوب جولة القاع والطرد المركزي supernatant في 10،000 × ز لمدة 70 دقيقة في 4 درجة مئوية.
- جمع supernatant ووضعها في أنبوب البولي فائقة الطرد المركزي والطرد المركزي في 100،000 × ز لمدة 70 دقيقة في 4 درجة مئوية.
- جمع بيليه في أنبوب فائقة الطرد المركزي الذي يتم غسله بعد ذلك عن طريق إعادة تعليق في PBS. طرد مركزي ّ ال [سوبرنتنت] أبعد في 100,000 [إكس] [غ] ل 70 دقيقة في 4 [ك.].
- ويمكن استخدام بيليه النهائي الذي يتألف من الناوفيقات الخلوية مباشرة للتجارب أو إعادة تعليقها مع 1000 درجة مئوية من PBS وتخزينها عند -80 درجة مئوية.
5. تقييم نوعية وغلة العزلات
- تقييم حجم التوزيع والتركيز باستخدام تحليل تتبع الجسيمات النانوية أو استشعار النبض المقاوم القابل للضبط بعد بروتوكولات الشركة المصنعة للأداة.
- القيام بمزيد من العزلة وتنقية مجموعات محددة من الحويصلات من خلال نهج مختلفة مثل إضافة تدرج السكروز أو وسادة، وتقنيات المناعة، أو حجم استبعاد اللونية، استنادا إلى احتياجات تجريبية محددة.
النتائج
ويتألف الجهاز اللازم لهذه العزلات من معدات مختبرية قياسية، مما يجعل هذا النهج بسيطا نسبيا وفعالا من حيث التكلفة. وقد أجريت العزلات من 12-30 أسبوع الذكور والإناث بالب / ج أو FVB الفئران. واصطف صينية عقد الماوس مع رقائق الألومنيوم داخل حاوية ذات جدران صلبة التي تجمع السوائل الزائدة خلال التسريب. تُغمر القوارير التي تحتوي على HBSS أو المغفور لها بالكولاجين في حمام مائي (40 درجة مئوية) جاهزة للاستخدام. يتم استخدام طبقين ثقافة معقمة 10 سم. هناك حاجة إلى واحد لغسل السطح مع PBS، والآخر لفصل الكبد من مكونات الأنسجة الضامة.
في هذه الطريقة، يتم غرس الكبد بطريقة غير مستمرة عن طريق الوريد المدخل بدلا من التعليب من الوريد الأجوف السفلي. وهناك نهج التسريب البديل وشائع الاستخدام هو أداء التسريب الرجعي عن طريق قنية الوريد الأجوف السفلي وقطع الوريد للصرف. ومع ذلك، بوابة الوريد التعليب من السهل الوصول إليها وينطوي على مسافة قصيرة إلى الكبد، كما الوريد المدخل يغذي مباشرة في الكبد8. اختيار نقطة الإدراج لكانوبينيشن أمر بالغالأهمية للنجاح الأمثل (الشكل 2). يتم وضع قنية الماضي فروع المعدة والأوردة البنكرياس ولكن ليس وراء فرع البوابة الأولى (الأوردة المدخل الكبدي الأيمن والأيسر). بمجرد تحديد موقع الإدراج الأمثل في الوريد المدخل، يتم استخدام ملقط منحني لوضع مؤشر ترابط تحت الوريد المدخل وربط عقدة فضفاضة. يتم إصلاح إبرة قنية مع الموضوع باستخدام عقدة سدادة لوقف الإبرة من السقوط.
ويبين الشكل 3 مخطط المعالجة العام لالطرد المركزي التفاضلي لعزل المركبات الكهربائية لأنسجة الكبد. يزيل التموجات فوق المركزية الخلايا والحطام والشوائب الأخرى. تم تصميم الخطوات الأربع الأولى الطرد المركزي (50 × ز، 300 × ز، 2000 × ز، 10،000 × ز) لإزالة خلايا الكبد، والخلايا الأخرى سليمة، والخلايا الميتة، أو حطام الخلايا على التوالي. (الشكلان 4 ألف و4 باء). بعد هذه الخطوات، يتم تنفيذ ultracentrifugation مرة أخرى في 100،000 × ز لجمع بيليه (الشكل4C). يتم غسل بيليه عن طريق إعادة تعليق في PBS وتخضع لultracentrifugation النهائي في 100،000 × ز. بيليه بعد ultracentrifugation مرئية تماما وviscid في هذا الإجراء مقارنة مع المركبات الكهربائية من وسائل الإعلام الثقافة مكيفة. الأنابيب عدة مرات مطلوب حتى أي المجاميع البني هي بعيدا عن الأنظار وحلها تماما. يتم إعادة تعليق بيليه النهائي مع 1000 درجة مئوية من PBS (الشكل4D). يزيل التثئب الشوائب والملوثات الأخرى القابلة للذوبان من البلازما، والتي يمكن أن تؤثر على النتائج التجريبية الوظيفية. يتم تنفيذ الطرد المركزي عند درجة حرارة 4 درجة مئوية.
من كبد الماوس، ينتج عن هذه الطريقة تركيز EV للأنسجة يتراوح من 1.74 إلى 4.00 × 1012 مع متوسط 3.46 × 1012 جسيمات لكل مل كما يحددها تحليل تتبع الجسيمات النانوية (NTA) (الشكل 5). وكان متوسط حجم الأنسجة الكبد المعزولة EVs 157.7 نانومتر, مع حجم وضع 144.5 نانومتر وأحجام EV تتراوح بين 100-600 نانومتر من قبل NTA. سوف العائد من EV تعتمد على عوامل مثل وزن الكبد والخسائر داخل خطوات perfusate أو ultracentrifugation.
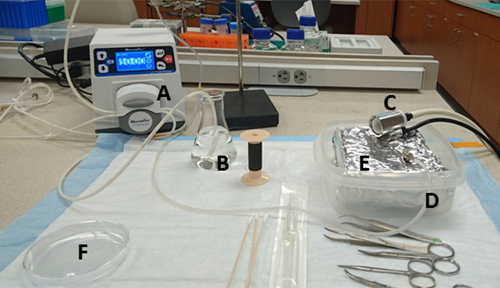
الشكل 1 إعداد مقاعد البدلاء. المواد ومواقعها هي: (أ) مضخة، (ب) تسخين قارورة 125 مل تحتوي على HBSS وميناء شفط المياه، (C) مخروط الأنف متصلة بمبخر Isoflurane، (D) ميناء العادم المياه من المضخة التي تربط مع إبرة، (E) صينية اصطف مع رقائق الألومنيوم داخل حاوية صلبة الجدران، و (F) 10 سم طبق الثقافة التي يتم سكب وسط الكولاجين مقدما. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
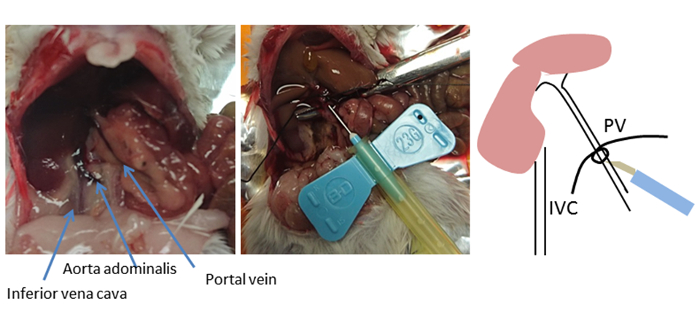
الشكل 2 موقع التعليب: يظهر تشريح بطن الماوس. باستخدام ملقط منحني، يتم وضع مؤشر ترابط تحت الوريد المدخل (PV) ويتم ربط عقدة فضفاضة. موقع الإدراج بالقرب من الكبد، 5-10 ملم تحت الرباط، ولكن ليس خارج فرع البوابة الأولى (الأوردة المدخل الكبدي الأيسر والأيمن). يتم إصلاح قنية أو تثبيتها باستخدام الموضوع مع عقدة سدادة. هذه العقدة بمثابة علامة على الموقع الكهروضوئية إذا تم خلع قنية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
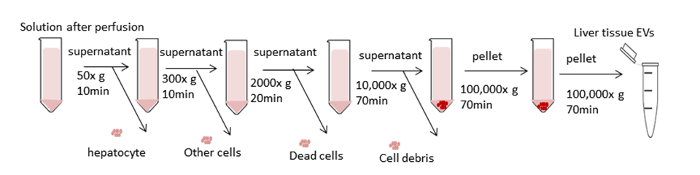
الشكل 3 مخطط خطوات الطرد المركزي. والهدف هو إزالة الخلايا غير المرغوب فيها وغيرها من المكونات وعزل المركبات الكهربائية. تم تصميم الخطوات الأربع الأولى الطرد المركزي لإزالة خلايا الكبد وغيرها من الخلايا، والخلايا الميتة، أو حطام الخلايا باستخدام الطرد المركزي التفاضلي. بعد هذه الخطوات، يتم تنفيذ ultracentrifugation في 100،000 × ز لجمع بيليه من المركبات الكهربائية. يتم غسل بيليه عن طريق إعادة تعليق في PBS وتخضع لultracentrifugation النهائي في 100،000 × ز. يتم تنفيذ جميع خطوات الطرد المركزي في 4 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
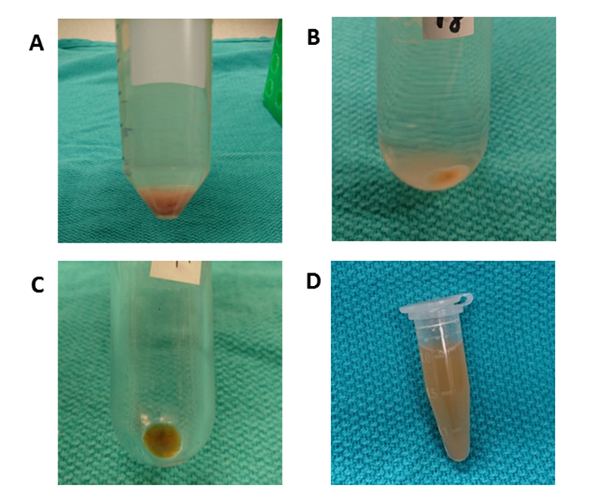
الشكل 4 الطرد المركزي التفاضلي. (أ) بعد الطرد المركزي عند 50 × غرام لمدة 10 دقائق، لوحظ بيليه يحتوي على خلايا الكبد. (ب) يُستخدم أنبوب مستدير القاع للطرد المركزي عند 000 10 x ز لمدة 70 دقيقة لإزالة حطام الخلايا. (C) يستخدم أنبوب البولي فائق الطرد المركزي للطرد المركزي في 100،000 × ز لمدة 70 دقيقة. يتم جمع بيليه في أنبوب واحد وغسلها عن طريق إعادة تعليق مع PBS. (د) يتم إعادة تعليق بيليه النهائي في 1000 ميكرولتر من PBS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
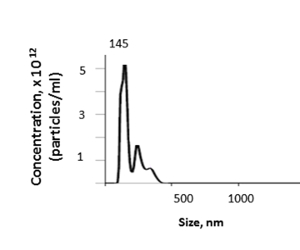
الشكل 5 نتيجة تمثيلية. يمكن تحديد حجم وتركيز الأنسجة الكبدية EVs عن طريق تحليل تتبع الجسيمات النانوية (NTA). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول طريقة أمثل واستنساخ لعزل الأنسجة الكبدية EV باستخدام عملية التسريب خطوتين عبر الوريد المدخل متبوعاً بتواق تفاضلي. وتشمل الخطوات الهامة للإجراء وضع قنية، تركيز الكولاجين ووقت الهضم، وسرعة تدفق المتوسطة، والتعامل مع الأنسجة بعد الهضم، وultracentrifugation التفاضلية الكلاسيكية.
يتم فصل الخلايا عن طريق الفصل من مكونات النسيج الضام بعد الهضم باستخدام الكولاجين النوع الرابع. تركيز الكولاجين المستخدمة لضخ يمكن أن تتراوح بين 0.1 إلى 5 ملغ / مل. يمكن أن يكون هناك تباين كبير من دفعة إلى دفعة في فعالية الكولاجين لهضم الأنسجة. تم اختبار تركيزات الكولاجين من 0.5 إلى 5 ملغ / مل، ولكن التركيز المستخدم لم يكن له تأثير كبير على العائد من المركبات الكهربائية التي تم الحصول عليها. استخدام تركيز أعلى من الكولاجين سيؤدي إلى تورم أسرع وتبييض الكبد. والهدف من ذلك هو الحصول على انفصال مرض عن الخلايا دون تلوث أو ضرر مفرط. التركيز الأمثل للكولاجيناز المستخدم في هذه العزلات هو 1-2 ملغ / مل perfused لمدة 7-8 دقائق بمعدل تدفق 8 مل / دقيقة. إجراء التسريب الذي هو طويل جدا زيادة خطر تدمير النسيج الضام رقيقة داخل الكبد، فضلا عن زيادة المخاطر التقنية مثل dislodgment إبرة من الوريد المدخل أو حبس الهواء مع الوريد.
والجانب الأكثر تحديا في هذا البروتوكول هو تعليب الوريد المدخل. هذا يمكن أن يكون تحديا لأداء, لا سيما في الفئران في نطاق حجم 18-25-ز. وقد وضعت تقنيات التسريب الكولاجينفي الأصل لاستخدامها في الفئران واعتمدت في وقت لاحق لاستخدامها في الفئران بعد العديد من التعديلات والتعديلات. التعليب باستخدام مجموعة جمع الدم 23G أسهل من وضع قسطرة في الأوعية الدموية ذات القطر الإنارة الصغيرة. ومن المستحسن إصلاح قنية باستخدام الموضوع مع عقدة سدادة لتجنب خلع وعقدة أيضا بمثابة علامة على موقع الوريد المدخل في حالة قنية يخرج من السفينة.
لتحليل المصب، من المهم للغاية أن يكون الحد الأدنى من التلوث من الخلايا. هناك العديد من الاعتبارات الهامة في التعامل مع الأنسجة بعد الهضم. أولا، يتم تغيير ملقط ومقص عندما يتم استخراج الكبد لتجنب تلوث الدم. ثانيا، من الأهمية بمكان أن تتم إزالة المرارة بعناية من الكبد لتجنب التمزق والتلوث غير المرغوب فيه من الصفراء. ثالثا، بمجرد إزالة الكبد من الماوس، يتم غسل الكبد بلطف شديد باستخدام PBS لإزالة أي دم. وينبغي إعطاء التقليل إلى أدنى حد من التلوث بالخلايا أولوية أعلى من تخفيض غلة المركبات الكهربائية التي يتم الحصول عليها.
Ultracentrifugation هو الأسلوب الأكثر استخداما لعزل وتنقيةالمركبات الكهربائية 8،9،10،11. هذا النهج سوف يزيل معظم الخلايا النكمعية مثل الخلايا الكبدية أو الخلايا الأقنية الصفراوية والخلايا غير parenchymal مثل خلايا Kupffer، والخلايا البطانية البطانية البطانية، والخلايا النجمية، بالإضافة إلى ذلك، فإن حطام الخلايا، وتجمعات الخلايا، والخلايا الميتة ستكون أيضا إزالة من قبل الطرد المركزي التفاضلية. ويمكن إجراء المزيد من تنقية وعزل مجموعات سكانية محددة عن طريق تحديد حجم الكروماتوغرافيا لاستبعاد هالاوغرافيا لإزالة أي مجاميع بروتين غير حويصلي أو بروتينات دهنية.
ويتمثل أحد قيود هذا البروتوكول في أنه قد لا يلتقط جميع حويصلات الأنسجة، بالنظر إلى إمكانية إزالة بعض الحويصلات في البيرفوسات. وإذا كانت هناك حاجة إلى تقييم عالمي، ينبغي النظر في جمع الحويصلات وعزلها داخل البيرفوسات. وهناك قيد آخر هو احتمال تلف الخلايا. لرصد التأثير المحتمل للموت المفرط للخلايا، يمكن رصد صلاحية الخلايا ودمجها ضمن معايير الجودة لعزل اتّهاب الأنسجة. في الختام، يصف هذا الإجراء سير عمل محسن باستخدام تقنية التسريب بخطوتين عبر الوريد المدخل متبوعاً بـ ultracentrifugation التفاضلي للحصول على مركبات EVs أنسجة الكبد من كبد الماوس بعائد مرتفع. هذه المركبات الكهربائية الأنسجة هي مناسبة للتحليلات المصب مثل توصيف التركيب الجزيئي الحيوي وغيرها من الدراسات التي تهدف إلى وصف أدوارها الفسيولوجية أو الفسيولوجية المرضية أو التطبيقات المحتملة كعلامات المرض.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذه الدراسة بتمويل من المعهد الوطني للسرطان منحة CA-217833.
Materials
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
References
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved