Method Article
Isolamento dei Tessuti Vescicoli Extracellulari dal Fegato
In questo articolo
Riepilogo
Questo è un protocollo per isolare le vesciche extracellulari del tessuto (EV) dal fegato. Il protocollo descrive un processo in due fasi che coinvolge la perfusione di collagenasi seguito da ultracentrifugazione differenziale per isolare gli EV del tessuto epatico.
Abstract
Le vesciche extracellulari (EV) possono essere rilasciate da molti tipi di cellule diverse e rilevate nella maggior parte, se non in tutti, i fluidi corporei. Gli EV possono partecipare alla comunicazione cellula-cellula chiudendo molecole bioattive come l'RNA o la proteina da una cellula all'altra. La maggior parte degli studi di EV sono stati eseguiti in modelli di coltura cellulare o in VEICOLi isolati dai fluidi corporei. C'è un interesse emergente per l'isolamento dei VE dai tessuti per studiare il loro contributo ai processi fisiologici e come vengono alterati nella malattia. L'isolamento degli EV con una resa sufficiente dai tessuti è tecnicamente impegnativo a causa della necessità di dissociazione dei tessuti senza danni cellulari. Questo metodo descrive una procedura per l'isolamento dei veicoli elettrici dal tessuto epatico del topo. Il metodo prevede un processo in due fasi che inizia con la digestione del collagenase in situ seguito da ultra-centrifugazione differenziale. La perfusione di tessuti con collagenasi offre un vantaggio rispetto al taglio meccanico o all'omogeneizzazione del tessuto epatico a causa della sua maggiore resa di EV ottenuti. L'uso di questo processo in due fasi per isolare i veicoli elettrici dal fegato sarà utile per lo studio dei veliti.
Introduzione
Le vesciche extracellulari (EV) sono vesciche legate alla membrana che vengono rilasciate da molti tipi diversi di cellule nel corpo. Gli EV contengono un carico di molecole che includono RNA, DNA e proteine. Il trasferimento di questo carico da veicoli elettrici da una cellula all'altra è postulato come un meccanismo mediante il quale le cellule all'interno dei tessuti comunicano tra loro1. La maggior parte delle informazioni riguardanti il carico o i ruoli dei veicoli elettrici in condizioni di salute e malattie normali è stata ricavata da studi sui veicoli elettrici ottenuti da cellule in coltura o raccolti dalla circolazione o da altri fluidi corporei2. Per comprendere i loro ruoli fisiologici invivo, è necessario un metodo robusto per l'isolamento dei veliti cellulari che cattura tutte le popolazioni di veicoli elettrici ed evita danni cellulari o contaminazioni3. L'obiettivo generale del metodo qui descritto è quello di isolare i veliti tissue dai fegati dei topi.
La maggior parte dei tipi di cellule nel fegato hanno dimostrato di produrre EV, e lo studio della segnalazione basata su EV sta portando avanti la conoscenza di base e la comprensione delle malattie epatiche. Tuttavia, l'impatto combinato dei VEICOLi elettrici di diversi tipi di cellule all'interno dei tessuti è solo parzialmente compreso. L'isolamento dei veicoli elettrici dai tessuti epatici è necessario per comprendere i contributi in situ dei veicoli elettrici all'interno dell'ambiente tissutale. L'approccio qui descritto si basa su una perfusione in due fasi per migliorare la dissociazione dei tessuti e ridurre al minimo i danni alle cellule. Successivamente, gli EV sono isolati dal tessuto epatico dissociato. Gli approcci che utilizzano la perfusione in due fasi per l'isolamento degli epaticiti sono stati utilizzati fin dai primi anni '504. Questi metodi per l'isolamento degli epatociti sono stati modificati e continuamente migliorati e sono ora approcci standard per l'isolamento degli epatociti nelle colture, nelle sospensioni cellulari e dai tessuti5,6,7. Nella prima fase, il fegato è sottoposto a una perfusione non ricircolante con buffer privo di calcio, soluzione di sale equilibrato di Hank (HBSS). Nella seconda fase, il fegato è perfuso con collagenasi per sciogliere la matrice extracellulare per un'ulteriore separazione delle giunzioni desmosomiche da cellula a cellula. Un tempo di trattamento ottimale per la dissoluzione del collagenaè è di 7-10 minuti. Una durata più breve del trattamento causerà una dissoluzione incompleta e manterrà i contatti delle cellule nel fegato, mentre una durata più lunga può causare danni al fegato o interruzione della vena del portale. I veicoli elettrici vengono quindi isolati utilizzando la centrifugazione differenziale per rimuovere cellule e detriti cellulari. Ciò si traduce nella raccolta di EV in rendimenti elevati che possono essere utilizzati per ulteriori analisi o studi a valle.
Protocollo
Tutti gli studi sugli animali sono stati effettuati in conformità con un protocollo approvato dal Comitato per la cura e l'uso degli animali della Mayo Clinic.
1. Preparazione della panca
- Preparare un bagno d'acqua e impostarlo a 37 gradi centigradi. Le altre attrezzature e i set-up necessari sono illustrati nella Figura 1.
- Misurare 100 mg di collagenasi di tipo IV e aggiungerlo a un flacone da 125 mL contenente 100 mL di HBSS in un bagno d'acqua (40 gradi centigradi). Assicurarsi che il collagenasi sia stato sciolto ruotando il liquido nella fiaschetta, e anche assicurarsi che il pallone sia immerso completamente nel bagno d'acqua. Per una maggiore efficienza, lasciare che il collagenasi si dissolva per almeno 30 minuti anche se può sembrare dissolversi istantaneamente.
- Immergere un flacone da 125 mL contenente 50 mL di HBSS in un bagno d'acqua a 40 gradi centigradi. Questo verrà utilizzato per lo scarico iniziale.
- Spruzzare la superficie di tutti gli strumenti come le forbici e le pinze con 70% di etanolo. Preparare alcuni tamponi di cotone pulito.
- Risciacquare il tubo della pompa eseguendo 70% etanolo attraverso la pompa e rimuovere qualsiasi etanolo residuo risciacquandolo due volte con acqua corrente.
- Posare un panca assorbente sul banco di laboratorio e posizionare un contenitore scatola dura sulla parte superiore. Questo sarà necessario per contenere eventuali liquidi in eccesso durante la perfusione del topo. Avvolgere un pad in schiuma di polistirolo con un foglio di alluminio e posizionarlo all'interno del contenitore.
- Posizionare un piatto di coltura sterile di 10 cm vicino alla panca. Questo verrà utilizzato per contenere il fegato digerito dopo che la perfusione è completata.
- Versare 10 mL di mezzo collagenae (passaggio 1.2) in un piatto di coltura sterile in anticipo.
- Utilizzando un set di raccolta del sangue alato, collegare il calibro 23 all'estremità libera del tubo pompa (tagliare le ali fuori la cannula farfalla può portare a una migliore manipolazione). Passare fino a riempire la punta della cannula della raccolta del sangue.
2. Preparazione degli animali
- Prima di iniziare l'anestesia utilizzando l'isoflurane, assicurarsi che sia disponibile una quantità adeguata di gas di alimentazione per tutta la durata della procedura. Accendere l'alimentazionedi ossigeno (O 2) alla camera di induzione a 1-2 L, quindi attivare l'isoflurane tra il 2 e il 4% utilizzando un misuratore di flusso.
- Mettere il mouse nella camera di induzione e chiudere la porta superiore. Monitorare il mouse fino a quando non è reclinata.
NOTA: I gas nella camera manterranno i topi anestesiper per diversi minuti. - Posizionare il mouse su un cuscinetto di schiuma di polistirolo avvolto con un foglio di alluminio. Passare il flusso dalla camera di induzione a un nosecone. Assicurarsi che l'anestesia sia adeguata. Se il mouse ha iniziato a rispondere, trattenerlo delicatamente in un cono naso fino a quando non è completamente anetizzato.
- Assicurare l'anestesia monitorando la respirazione e la risposta alla stimolazione durante la procedura. Regolare il misuratore di flusso della velocità in base alle esigenze per garantire un'adeguata anestesia. Le zampe devono non rispondere al test di pizzico in anestesia. Ulteriori dettagli possono essere ottenuti dalla guida di laboratorio per la cura degli animali.
- Nastro o pin giù tutti e quattro gli arti del mouse.
- Pulire la pelle sull'addome spruzzando con il 70% di etanolo e asciugandola con una garza e un tamponino. Questo passaggio è fondamentale per evitare la contaminazione dalla pelliccia del topo.
- Fare un taglio spalancato attraverso la pelle dalla parte anteriore all'osso pelvi utilizzando una serie di forbici sterili. Fare attenzione a non tagliare gli organi interni . Spostare l'intestino sul lato sinistro dell'animale utilizzando un applicatore con punta di cotone per esporre delicatamente la vena del portale (PV) e vena cava inferiore (IVC).
3. Canulazione e perfusione (0,5 h)
- Utilizzando pinze curve, posizionare un filo sotto la vena del portale e legare un nodo liberamente per preparare stringendo saldamente dopo la cannosatura.
- Inserire la cannula (23G dal set di raccolta del sangue) nella vena del portale 5-10 mm sotto la legatura. Non inserire la cannula oltre il primo ramo del portale, altrimenti il lobo anteriore destro può essere percepito in modo inadeguato. La cannula può essere fissata o fissata con filo utilizzando un nodo di tappo.
- Avviare la pompa per infondere in HBSS a bassa portata (1-2 mL/min). Una volta che la canonulazione è confermata per avere successo, il fegato inizierà a sbollentare.
- Tagliare l'IVC per alleviare la pressione e consentire eccessivo fluido all'interno del fegato per drenare. Questa operazione viene eseguita meglio utilizzando gli operatori altra mano in modo che la cannula non venga spostata.
- Aumentare lentamente la portata a 8 mL/min e completare la perfusione utilizzando l'intero volume di 50 mL di HBSS attraverso il fegato, nei prossimi 5 min.
- Cambiare il collagenasi contenente il mezzo (passaggio 1.2) nel becher appena prima che l'HBSS stia per esaurire. Assicurarsi che le bolle d'aria non siano presenti e non fluiscano nel fegato quando si cambia il mezzo.
- Applicare la pressione transitoria all'IVC a intervalli di 5 s bloccando con pinze. Questo causerà il fegato a gonfiarsi e aiutare con la digestione dei tessuti e la dissociazione (7-8 min). Come la digestione progredisce, il fegato si gonfia e diventa bianco. Il fegato può gonfiarsi uniformemente a circa il doppio delle sue dimensioni originali.
- Spegnere la pompa e rimuovere la cannula una volta completata la digestione. Il completamento della digestione del fegato dipenderà dalle dimensioni del topo e dalle condizioni del fegato. Un'ammaccatura nel fegato può essere osservata se un applicatore con punta di cotone viene utilizzato per sondare delicatamente il fegato.
- Rimuovere la cistifellea dal fegato, facendo attenzione a non strapparlo. Utilizzando un paio di forbici e pinze lavate, estrarre il fegato dal topo in un piatto di coltura sterile di 10 cm contenente salina (PBS) con buffer di fosfato per il lavaggio della superficie. Trasferire il fegato con attenzione nel sterile piatto di coltura di 10 cm contenente il mezzo di collagenana (dal punto 1.8). Questo è un passo fondamentale per evitare la contaminazione dal sangue del topo e dalla bile.
- Afferra e strappa il fegato con due pinze pulite mentre scuoti delicatamente le cellule dal fegato. In questo modo, il mezzo diventerà offuscato. Tutti gli epatociti possono essere scossi, lasciando dietro di sé il tessuto connettivo e il tessuto vascolare.
- Triturare la soluzione cellulare molte volte utilizzando una siringa da 3 mL fino a quando le parti non digerite del fegato sono scosse. Versare in un tubo conico da 50 mL con ceppi di cellule di nylon da 70 m per filtrare qualsiasi tessuto connettivo non digerito. Lavare il piatto con HBSS per raccogliere le cellule rimanenti e riempire il tubo conico da 50 mL.
- Centrifugare dolcemente il tubo conico da 50 mL in un rotore a benna oscillante a 50 x g per 10 min a 4 gradi centigradi.
- Trasferire il supernatante in un nuovo tubo conico da 50 mL.
4. Isolamento dei veicoli elettrici (5 h)
- Centrifugare il supernatante a 300 x g per 10 min a 4 gradi centigradi. Trasferire il supernatante in un nuovo tubo conico da 50 mL.
- Centrifugare il supernatante a 2000 x g per 20 min a 4 gradi centigradi per rimuovere i detriti cellulari e gli aggregati.
- Trasferire il supernatante in un tubo rotondo e centrifugare il supernatante a 10.000 x g per 70 min a 4 gradi centigradi.
- Raccogliere il supernatante e posizionarlo in un tubo di ultracentrifuga in policarbonato e centrifugare a 100.000 x g per 70 min a 4 gradi centigradi.
- Raccogliere il pellet in un tubo di ultracentrifuga che viene poi lavato re-sospensione in PBS. Centrifugare ulteriormente il supernatante a 100.000 x g per 70 min a 4 gradi centigradi.
- Il pellet finale composto da nanovesicoli cellulari può essere utilizzato direttamente per esperimenti o ri-sospeso con 1000 L di PBS e conservato a -80 gradi centigradi.
5. Valutazione della qualità e del rendimento degli isolati
- Valutare la distribuzione e la concentrazione delle dimensioni utilizzando l'analisi del tracciamento delle nanoparticelle o il rilevamento degli impulsi resistenti regolabili seguendo i protocolli del produttore dello strumento.
- Eseguire un ulteriore isolamento e purificazione di specifiche popolazioni vescicane con vari approcci come l'aggiunta di un gradiente di saccarosio o cuscino, tecniche di immunoaffinità o cromatografia di esclusione di dimensioni, sulla base di specifiche esigenze sperimentali.
Risultati
L'apparato necessario per questi isolati comprende attrezzature di laboratorio standard, il che rende questo un approccio relativamente semplice ed economico. Gli isolamenti sono stati eseguiti da 12 a trenta settimane maschi e femmine di topi Balb/c o FVB. Il vassoio che tiene il mouse è rivestito con un foglio di alluminio all'interno di un contenitore a parete dura che raccoglie i fluidi in eccesso durante la perfusione. I flaconi che contengono un mezzo HBSS o di collagenae sono sommersi in un bagno d'acqua (40 gradi centigradi) pronto per essere utilizzato. Vengono utilizzati due sterili piatti di coltura 10 cm. Uno è necessario per il lavaggio superficiale con PBS, e l'altro per la separazione degli epatociti dai componenti del tessuto connettivo.
In questo metodo, il fegato è perfuso in modo non continuo attraverso la vena del portale, in preferenza alla canona dalla vena cava inferiore. Un approccio alternativo e comunemente usato perfusione è quello di eseguire la perfusione retrograda cannulando la vena cava inferiore e tagliando la vena del portale per il drenaggio. Tuttavia, la canonatria della vena del portale è facile da accedere e comporta una breve distanza dal fegato, poiché la vena del portale si nutre direttamente nel fegato8. La selezione di un punto di inserimento per la funzione di calcolo è fondamentale per un successo ottimale (Figura 2). La cannula è posta oltre i rami dello stomaco e le vene pancreatiche ma non oltre il primo ramo portale (vene portali epatiche destra e sinistra). Una volta identificata la posizione di inserimento ottimale nella vena del portale, le pinze curve vengono utilizzate per posizionare un filo sotto la vena del portale e legare un nodo sciolto. L'ago di cannula è fissato con filo utilizzando un nodo tappo per fermare l'ago di cadere.
La figura 3 illustra lo schema di elaborazione complessivo per la centrifugazione differenziale per l'isolamento dei VEICOLi epatici. L'ultracentrifuga rimuove le cellule, i detriti e altre impurità. I primi quattro gradini di centrifugazione (50 x g, 300 x g, 2.000 x g, 10.000 x g) sono progettati per rimuovere gli epatociti, altre cellule intatte, cellule morte o detriti cellulari rispettivamente. (Cifre 4A e 4B). Dopo questi passaggi, l'ultracentrifugazione viene nuovamente eseguita a 100.000 x g per raccogliere il pellet (Figura 4C). Il pellet viene lavato nuovamente in PBS e sottoposto ad un'ultracentrifuga finale a 100.000 x g. Il pellet dopo l'ultracentrifugazione è assolutamente visibile e viscida in questa procedura rispetto agli EV dei mezzi di coltura condizionati. Il pipeggio molte volte è necessario fino a quando eventuali aggregati marroni sono fuori dalla vista e completamente disciolti. Il pellet finale viene ri-sospeso con 1000 gradi l di PBS (Figura4D). L'ultracentrifuga toglie impurità e altri contaminanti solubili dal plasma, che possono influenzare i risultati sperimentali funzionali. La centrifugazione è effettuata a 4 gradi centigradi.
Dal fegato di topo, questo metodo produce una concentrazione di EV di tessuto che varia da 1,74 a 4,00 x 1012 conuna media di 3,46 x 1012 particelle per mL come determinato dall'analisi del tracciamento delle nanoparticelle (NTA) (Figura 5). La dimensione media dei VE del tessuto epatico isolato era di 157,7 nm, con una dimensione in modalità di 144.5 nm e EV di dimensioni che vanno da 100-600 nm di NTA. La resa di EV dipenderà da fattori come il peso del fegato e le perdite all'interno dei passi perfuniti o ultracentrifugation.
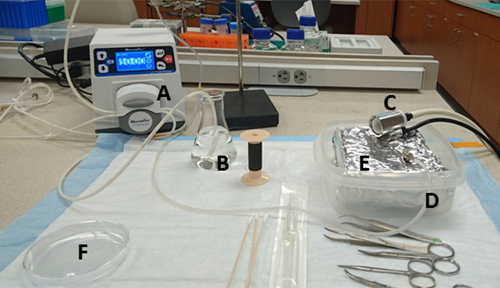
Figura 1 : preparazione della panca. I materiali e le loro posizioni sono: (A) pompa, (B) flacone riscaldato 125 mL contenente HBSS e porta di aspirazione dell'acqua, (C) cono naso collegato a un vaporizzatore Isoflurane, (D) porta di scarico dell'acqua della pompa che collega con ago, vassoio (E) rivestito con foglio di alluminio all'interno di un contenitore a parete dura, e (F) 10 cm piatto di coltura in cui il mezzo di collagenana viene versato in anticipo. Fare clic qui per visualizzare una versione più grande di questa figura.
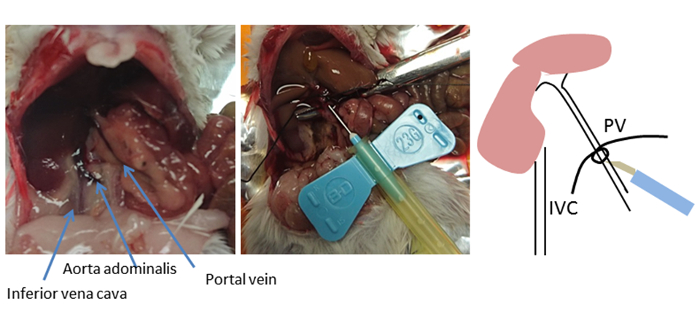
Figura 2 : sito di canonulation. Viene mostrata l'anatomia dell'addome del topo. Utilizzando pinze curve, un filo viene posizionato sotto la vena del portale (PV) e viene legato un nodo sciolto. La posizione di inserimento è vicino al fegato, 5-10 mm sotto la legatura, ma non oltre il primo ramo portale (veine portali epatici sinistra e destra). La cannula è fissata o fissata utilizzando filo con nodo tappo. Questo nodo serve come marcatore della posizione fotovoltaica se la cannula viene sloggiata. Fare clic qui per visualizzare una versione più grande di questa figura.
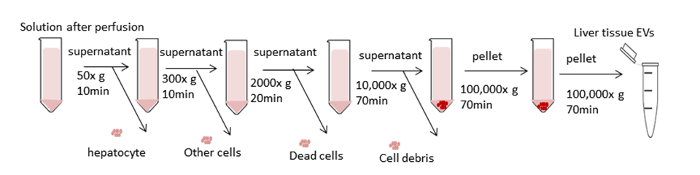
Figura 3 : Schematica delle fasi di centrifugazione. L'obiettivo è quello di rimuovere le cellule indesiderate e altri componenti e isolare i veicoli elettrici. I primi quattro passaggi di centrifugazione sono progettati per rimuovere epatociti e altre cellule, cellule morte o detriti cellulari utilizzando la centrifugazione differenziale. Dopo questi passaggi, l'ultracentrifuga viene eseguita a 100.000 x g per raccogliere il pellet di eV. Il pellet viene lavato nuovamente in PBS e sottoposto ad un'ultracentrifuga finale a 100.000 x g. Tutte le fasi di centrifugazione sono effettuate a 4 gradi centigradi. Fare clic qui per visualizzare una versione più grande di questa figura.
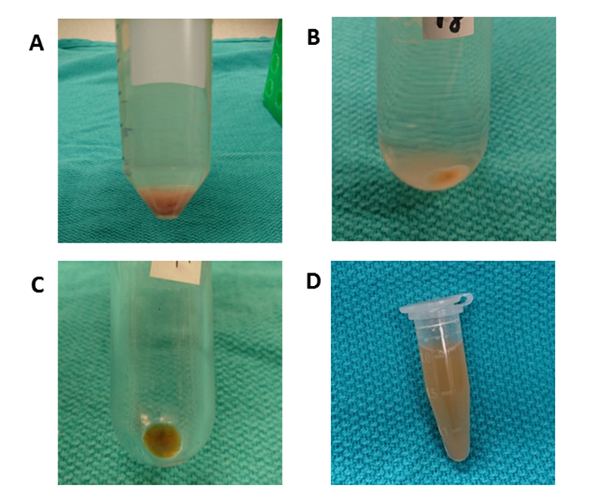
Figura 4 : centrifugazione differenziale. (A) Dopo la centrifugazione a 50 x g per 10 min, si osserva un pellet contenente epatociti. (B) Un tubo rotondo-inferiore viene utilizzato per la centrifugazione a 10.000 x g per 70 min per rimuovere i detriti cellulari. (C) Un tubo di ultracentrifuga in policarbonato viene utilizzato per la centrifugazione a 100.000 x g per 70 min. Il pellet viene raccolto in un tubo e lavato nuovamente con PBS. (D) Il pellet finale viene ri-sospeso in 1000 - L'luna di PBS. Fare clic qui per visualizzare una versione più grande di questa figura.
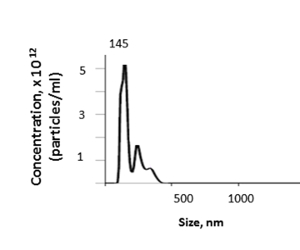
Figura 5 : Risultato rappresentativo. La dimensione e la concentrazione degli EV del tessuto epatico può essere determinata dall'analisi del tracciamento delle nanoparticelle (NTA). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo descrive un metodo ottimale e riproducibile per l'isolamento del tessuto epatico EV utilizzando un processo di perfusione in due fasi attraverso la vena del portale seguita da ultracentrifugazione differenziale. Fasi importanti della procedura includono il posizionamento delle cannula, la concentrazione di collagenasi e il tempo di digestione, la velocità di flusso del mezzo, la manipolazione del tessuto dopo la digestione e l'ultracentrifugazione differenziale classica.
La separazione cellulare si ottiene mediante la separazione dai componenti del tessuto connettivo dopo la digestione utilizzando il tipo di collagena si ottiene IV. La concentrazione di collagenasi utilizzata per la perfusione può variare da 0,1 a 5 mg/mL. Ci può essere una notevole variazione batch-a-batch nell'efficacia della collagenasi per la digestione dei tessuti. Sono state testate concentrazioni di collagenasi da 0,5 a 5 mg/mL, ma la concentrazione utilizzata non ha avuto un impatto significativo sulla resa dei veicoli elettrici ottenuti. Utilizzando una maggiore concentrazione di collagenasi si tradurrà in un gonfiore più rapido e sbiancamento del fegato. L'obiettivo è quello di ottenere una dissociazione cellulare soddisfacente senza eccessiva contaminazione o danno. Una concentrazione ottimale di collagenasi utilizzata in questi isolamenti è di 1-2 mg/mL perfuso per 7-8 min ad una portata di 8 mL/min. Una procedura di perfusione troppo lunga aumenterà il rischio di distruggere il sottile tessuto connettivo all'interno del fegato e aumenterà i rischi tecnici come il dislodgment dell'ago dalla vena del portale o l'intrappolamento dell'aria con la vena.
L'aspetto più impegnativo di questo protocollo è la cannulation della vena del portale. Questo può essere difficile da eseguire, in particolare nei topi nella gamma di dimensioni da 18 a 25-g. Le tecniche per la perfusione di collagenasi sono state originariamente sviluppate per l'uso nei ratti e successivamente adottate per l'uso nei topi dopo numerose modifiche e regolazioni. La cannulazione utilizzando un set di raccolta del sangue 23G è più facile del posizionamento di un catetere in vasi sanguigni di piccolo diametro luminale. Si consiglia di fissare la cannula con filo con un nodo di tappo per evitare lo spostamento e il nodo serve anche come marcatore della posizione della vena del portale nel caso in cui la cannula uscisse dalla nave.
Per l'analisi a valle, è estremamente importante avere una contaminazione minima dalle cellule. Ci sono diverse considerazioni importanti nella manipolazione del tessuto dopo la digestione. In primo luogo, le pinze e le forbici vengono modificate quando il fegato viene estratto per evitare la contaminazione del sangue. In secondo luogo, è fondamentale che la cistifellea sia accuratamente rimossa dal fegato per evitare strappi e contaminazioni indesiderate dalla bile. In terzo luogo, una volta che il fegato è stato rimosso dal mouse, il fegato viene lavato molto delicatamente utilizzando PBS per rimuovere qualsiasi sangue. La riduzione al minimo della contaminazione con le cellule dovrebbe avere una priorità maggiore rispetto alla riduzione della resa dei veicoli elettrici ottenuti.
L'ultracentrifugazione è il metodo più comunemente usato per l'isolamento e la purificazione degli EV8,9,10,11. Questo approccio rimuoverà la maggior parte delle cellule parenchychymal come epatociti o colgaliociti e cellule non parenchymal come le cellule di Kupffer, le cellule endoteliali sinusoidali e le cellule stellate, inoltre, i detriti cellulari, le aggregazioni cellulari e le cellule morte saranno dalla centricazione differenziale. Ulteriore purificazione e isolamento di popolazioni specifiche può essere eseguita mediante cromatografia di esclusione di dimensioni per rimuovere eventuali aggregati proteici non vescicolari o lipoproteine.
Una limitazione di questo protocollo è che non può catturare tutte le vesciche dei tessuti, data la possibilità che alcune vesciche possano essere rimosse nel perfusate. Se è necessaria una valutazione globale, si dovrebbe prendere in considerazione la raccolta di perfusate e l'isolamento delle vesciche all'interno del perfusate. Un'ulteriore limitazione è il potenziale di danni alle cellule. Per monitorare il potenziale impatto di un'eccessiva morte cellulare, la fattibilità cellulare può essere monitorata e incorporata all'interno di parametri di qualità per gli isolamenti di EV dei tessuti. In conclusione, questa procedura descrive un flusso di lavoro ottimizzato utilizzando una tecnica di perfusione in due fasi tramite la vena del portale seguita da ultracentrifugazione differenziale per ottenere EV del tessuto epatico dai fegati di topo ad alta resa. Questi Velti tissutali sono adatti per analisi a valle come la caratterizzazione della composizione biomolecolare e altri studi che mirano a caratterizzare i loro ruoli fisiologici o patologici o potenziali applicazioni come marcatori di malattia.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto da finanziamenti dal National Cancer Institute Grant CA-217833.
Materiali
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
Riferimenti
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon