Method Article
Изоляция тканей внеклеточных пузырьков от печени
В этой статье
Резюме
Это протокол для изоляции тканей внеклеточных пузырьков (EVs) из печени. Протокол описывает двухэтапный процесс с участием опфузии коллагеназа с последующим дифференциальной ультрацентрифугации для изоляции тканей печени EVs.
Аннотация
Внеклеточные пузырьки (EVs) могут быть освобождены от различных типов клеток и обнаружены в большинстве, если не все, жидкости организма. EVs может участвовать в связи от клетки к клетке путем shuttling биоактивные молекулы such as RNA или протеин от одной клетки к другой. Большинство исследований EVs были проведены в моделях клеточной культуры или в EVs изолированы от жидкостей организма. Появляется интерес к изоляции ЭВ от тканей для изучения их вклада в физиологические процессы и того, как они изменяются при заболеваниях. Изоляция EVs с достаточным выходом из тканей технически трудна из-за необходимости диссоциации тканей без повреждения клеток. Этот метод описывает процедуру изоляции EVs от ткани печени мыши. Метод включает в себя двухэтапный процесс, начиная с in situ коллагенеза пищеварения с последующим дифференциальной ультра-центрифугации. Ткань перфузии с помощью коллагеназы обеспечивает преимущество перед механической резки или гомогенизации ткани печени из-за его повышенной урожайности полученных ЭВ. Использование этого двухступенчатого процесса для изоляции ЭВ из печени будет полезно для изучения тканях EVs.
Введение
Внеклеточные пузырьки (EVs) являются мембранными пузырьками, которые высвобождаются из различных типов клеток в организме. EVs содержат груз молекул, которые включают РНК, ДНК и белок. Передача этого груза ЭВ из одной клетки в другую постулируется как один механизм, с помощью которого клетки в тканях общаются друг с другом1. Большая часть информации о грузе или роли EVs в нормальном здоровье и заболеваниях была получена из исследований на EVs, полученных из клеток культуры или собранных из циркуляции или других жидкостей организма2. Для того, чтобы понять их физиологические роли в vivo, надежный метод необходим для изоляции ткани EVs, который захватывает все популяции EVs и позволяет избежать повреждения клеток или загрязнения3. Общая цель описанного в настоящем году метода заключается в изоляции тканьвых ЭВ от печени мыши.
Большинство типов клеток в печени было показано, производить EVs, и изучение EV основе сигнализации продвигает базовые знания и понимание заболеваний печени. Тем не менее, комбинированное воздействие EVs из различных типов клеток в тканях только частично понимается. Изоляция EVs от тканей печени необходимо для того, чтобы понять in situ вклад Ов в среде ткани. Описанный в настоящем году подход основан на двухступенчатой перфузии для усиления диссоциации тканей и минимизации повреждения клеток. Впоследствии, EVs изолированы от диссоциированной ткани печени. Подходы с использованием двухступенчатой перфузии для изоляции гепатоцитов используются с начала 1950-хгодов 4. Эти методы изоляции гепатоцитов были изменены и постоянно совершенствуются и в настоящее время являются стандартными подходамидля изоляции гепатоцитов в культурах, в клеточных суспензиях и из тканей 5,6,7. На первом этапе печень подвергается нерециркуляционной перфузии с буфером без кальция, сбалансированным сосольным раствором Хэнка (HBSS). На втором этапе печень пронизана коллагенеза для растворения внеклеточной матрицы для дальнейшего разделения десмосомальных клеточных соединений. Оптимальное время лечения растворения коллагеназа составляет от 7 до 10 минут. Более короткая продолжительность лечения вызовет неполное растворение и сохранит контакты клеток в печени, в то время как более длительная продолжительность может привести к повреждению печени или нарушению портовой вены. ЭВ затем изолированы с помощью дифференциальной центрифугации для удаления клеток и клеточного мусора. Это приводит к сбору EV при высоких урожаях, которые могут быть использованы для дальнейшего анализа или исследования ниже по течению.
протокол
Все исследования с участием животных были проведены в соответствии с протоколом, который был одобрен клиникой Майо институционального ухода за животными и использования комитета.
1. Подготовка скамейки
- Приготовьте водяную баню и установите ее до 37 градусов по Цельсию. Другое необходимое оборудование и настройка показаны на рисунке 1.
- Измерьте 100 мг коллагеназа типа IV и добавьте его в колбу 125 мл, содержащую 100 мл HBSS в водяной бане (40 градусов по Цельсию). Убедитесь, что коллагеназа была растворена путем закрученного жидкости в колбе, а также убедитесь, что колба полностью погружена в водяную ванну. Для большей эффективности, позвольте коллагенезе раствориться, по крайней мере 30 мин, даже если он может показаться, растворяются мгновенно.
- Погрузите колбу 125 мл, содержащую 50 мл HBSS, в водяной бане при 40 градусах Цельсия. Это будет использоваться для первоначального промывки.
- Спрей вниз по поверхности всех инструментов, таких как ножницы и щипцы с 70% этанола. Подготовьте несколько чистых ватных тампонов.
- Промыть трубки насоса, запустив 70% этанола через насос и удалить любой остаточный этанол путем промывки его дважды с проточной водой.
- Положите абсорбирующим скамейке площадку на скамейке лаборатории и место жесткий контейнер коробки на вершине. Это будет необходимо, чтобы содержать любые избыточные жидкости во время перфузии мыши. Оберните полистирол пены площадку с алюминиевой фольгой и поместите его в контейнер.
- Поместите стерильное блюдо культуры 10 см рядом со скамейкой. Это будет использоваться для хранения переваренной печени после перфузии завершена.
- Налейте 10 мл коллагенеза среды (шаг 1.2) в стерильной культуры блюдо заранее.
- Используя крылатый набор сбора крови, подключите 23-калибровочный к свободному концу трубки насоса (отрезав крылья от канюли бабочки может привести к лучшей управляемости). Пройдите до тех пор, пока кончик канюли сбора крови не будет заполнен.
2. Подготовка животных
- Перед началом анестезии с использованием изофруран, убедитесь, что достаточное количество газа питания доступна в течение всего срока процедуры. Включите кислород (O2) поставки в индукционную камеру на 1-2 л, затем включите изофларан между 2-4% с помощью потока.
- Положите мышь в индукционную камеру и закройте верхнюю дверь. Мониторинг мыши, пока он не лежа.
ПРИМЕЧАНИЕ: Газы в камере будут держать мышей под анестетом в течение нескольких минут. - Поместите мышь на полистирол пены площадку, завернутые в алюминиевую фольгу. Переключите поток из индукционной камеры в носекон. Убедитесь, что анестезия является адекватной. Если мышь начала реагировать, осторожно сдержать его в конусе носа, пока он полностью анестезируется.
- Обеспечить анестезию путем мониторинга дыхания и реагирования на стимуляцию во время процедуры. Отрегулируйте скорость потока по мере необходимости, чтобы обеспечить адекватную анестезию. Лапы должны быть не реагируют на щепотку тест под наркозом. Дополнительную информацию можно получить из лабораторного руководства по уходу за животными.
- Лента или прикрепите все четыре конечности мыши.
- Очистите кожу над животом, распыляя 70% этанола и вытирая его марлей и спиртовой площадкой. Этот шаг имеет решающее значение, чтобы избежать загрязнения от мыши меха.
- Сделайте широко открытый прорези через кожу от передней до таза кости с помощью набора стерильных ножниц. Будьте осторожны, чтобы не сократить любые внутренние органы . Вытесните кишечник на левую сторону животного с помощью хлопка наконечником аппликатор мягко подвергать портал вены (PV) и нижней полы вены (IVC).
3. Каннулуляция и перфузия (0,5 ч)
- Используя изогнутые щипцвые, поместите нить под вену портала и связать узел свободно, чтобы подготовить cinching плотно после канистики.
- Вставьте канюлю (23G из набора для сбора крови) в вену портала на 5-10 мм ниже лигатуры. Не вставляйте канюль мимо первой ветви портала, иначе правая передняя доли может быть недостаточно проникнута. Канюля может быть исправлена или закреплена нитью с помощью пробки узел.
- Запустите насос для настояться в HBSS при низкой скорости потока (1-2 мл/мин). Как только канналяция будет подтверждена успешной, печень начнет бланшировать.
- Вырезать IVC, чтобы облегчить давление и позволить чрезмерной жидкости в печени, чтобы стечь. Это лучше всего выполнять с помощью операторов с другой стороны, чтобы канюля не перемещается.
- Медленно увеличивайте скорость потока до 8 мл/мин и завершите перфузию, используя весь объем HBSS мощностью 50 мл через печень, в течение следующих 5 мин.
- Измените коллагенеза, содержащая среднюю (шаг 1.2) в стакан непосредственно перед HBSS начинает иссякать. Убедитесь, что пузырьки воздуха не присутствуют и не текут в печень при изменении среды.
- Нанесите преходящее давление на IVC с интервалом 5 с путем зажима щипками. Это приведет к печени набухают и поможет с пищеварением тканей и диссоциации (7-8 мин). Как пищеварение прогрессирует, печень будет набухать и стать белым. Печень может набухать равномерно примерно в два раза его первоначальный размер.
- Выключите насос и удалите канюли, как только пищеварение будет завершено. Завершение пищеварения печени будет зависеть от размера мыши и состояния печени. Вмятина в печени можно наблюдать, если хлопчатобумажный аппликатор используется для мягко зондирования печени.
- Удалить желчный пузырь из печени, стараясь не рвать его. Используя вымытую ножницу и щипцы, извлеките печень из мыши в стерильное 10-сантиметровое культурное блюдо, содержащее фосфатно-буферный солей (PBS) для поверхностного мытья. Перенесите печень тщательно в стерильное 10 см культуры блюдо, содержащее коллагенеза среды (от шага 1.8). Это критический шаг для избежания загрязнения от крови мыши и желчи.
- Захватите и разорвать печень с двумя чистыми щипками в то время как осторожно встряхивая клетки из печени. По мере того как это случается, средство будет быть затуманено. Все гепатоциты можно встряхнуть, оставив за собой соединительную ткань и сосудистую ткань.
- Triturate клеточного раствора много раз с помощью 3 мл шприца до тех пор, пока непереваренные части печени стряхивают. Налейте его в 50 мл конической трубки с 70 мкм нейлоновых клеток ситечко для фильтрации любой непереваренной соединительной ткани. Вымойте блюдо с HBSS, чтобы собрать оставшиеся клетки и заполнить 50 мл конической трубки.
- Centrifuge мягко 50 мл конической трубки в размахивая ротор ведро на 50 х г в течение 10 минут при 4 c.
- Перенесите супернатант на новую коническую трубку 50 мл.
4. Изоляция ЭВ (5 ч)
- Центрифуга супернатант на 300 х г в течение 10 мин при 4 градусах Цельсия. Перенесите супернатант в новую коническую трубку мощностью 50 мл.
- Центрифуга супернатант на 2000 х г в течение 20 мин при 4 кв КС, чтобы удалить мусор и агрегаты клеток.
- Перенесите супернатант в трубку с круглым дном и центрифугия супернатант на 10000 х г в течение 70 минут при 4 "C.
- Соберите супернатант и поместите в поликарбонатную ультрацентрифугу и центрифугу при 100 000 х г в течение 70 мин при 4 градусах Цельсия.
- Соберите гранулы в ультрацентрифуге трубки, которая затем промывают повторноприостановления в PBS. Centrifuge супернатант далее на 100000 х г в течение 70 мин при 4 КС.
- Окончательные гранулы, состоящие из клеточных нановезиклов, могут быть непосредственно использованы для экспериментов или повторно приостановлены с 1000 Л Л ПБС и храниться при -80 градусах Цельсия.
5. Оценка качества и урожайности изоляций
- Оцените распределение и концентрацию размера с помощью анализа отслеживания наночастиц или настраиваемого резистивного зондирования импульса в соответствии с протоколами производителя приборов.
- Выполняйте дальнейшую изоляцию и очистку конкретных популяций везикул с помощью различных подходов, таких как добавление градиента сахарозы или подушки, методы иммуноаффинити или хроматография исключения размера, основанная на конкретных экспериментальных потребностях.
Результаты
Аппарат, необходимый для этих изоляций, состоит из стандартного лабораторного оборудования, что делает этот подход относительно простым и экономичным. Изоляция была выполнена от двенадцати до тридцати недель мужчин и женщин Balb /c или FVB мышей. Лоток, держащий мышь, облицован алюминиевой фольгой внутри контейнера с твердыми стенами, который собирает излишки жидкости во время перфузии. Фляги, содержащие HBSS или коллагеназесодержащую среду, погружаются в водяную ванну (40 градусов по Цельсию), готовую к использованию. Используются две стерильные блюда культуры по 10 см. Один из них необходим для поверхностного мытья с помощью PBS, а другой для разделения гепатоцитов от компонентов соединительной ткани.
В этом методе, печень perfused в непрерывном образе через вену портала в предпочтении к cannulation от более низкой cava вены. Альтернативный и широко используемый подход перфузии заключается в выполнении ретроградной перфузии путем консервации нижней полы вены и резки вены портала для дренажа. Тем не менее, портал вены каниляции легко получить доступ и включает в себя короткое расстояние до печени, как портал вены питается непосредственно в печень8. Выбор точки вставки для канистики имеет решающее значение для оптимального успеха(рисунок 2). Канюля помещается мимо ветвей желудка и поджелудочной железы, но не за пределами первой ветви портала (правая и левая печеночные вены портала). Как только оптимальное расположение вставки в вену портала определено, изогнутые щипцвые пущи используются для размещения нити под веной портала и завязывая рыхлый узел. Игла канюли фиксируется нитью с помощью пробки узел, чтобы остановить иглу от выпадения.
На рисунке 3 излагается общая схема обработки дифференциальной центрифугации для изоляции ЭВ-изоляции тканей печени. Ультрацентрифугация удаляет клетки, мусор и другие примеси. Первые четыре шага центрифугации (50 x, 300 x g, 2000 x g, 10,000 x g) предназначены для удаления гепатоцитов, нетронутых других клеток, мертвых клеток или клеточного мусора соответственно. (Цифры 4A и 4B). После этих шагов, ультрацентрифугация снова выполняется на 100000 х г, чтобы собрать гранулы(Рисунок 4C). Гранулы промывают путем повторного приостановки в PBS и подвергаются окончательной ультрацентрифугации на 100000 х г. Гранулы после ультрацентрифугации является абсолютно видимым и viscid в этой процедуре по сравнению с EVs из условных средств культуры. Пелеттинг много раз требуется до тех пор, пока любые коричневые агрегаты не будут вне поля зрения и полностью растворены. Окончательный гранулы повторно приостановлено с 1000 Зл Л PBS(Рисунок 4D). Ультрацентррифация удаляет из плазмы примеси и другие растворимые загрязняющие вещества, что может повлиять на функциональные экспериментальные исходы. Центрифугация осуществляется при 4 градусах Цельсия.
Из мышиной печени, этот метод дает концентрации ev ткани, которая колеблется от 1,74 до 4,00 х 1012 со средним 3,46 х 1012 частиц на мл, как это определено наночастиц отслеживания анализа (NTA) (Рисунок 5). Средний размер изолированных eVs ткани печени eVs был 157.7 nm, с размером режима 144.5 nm и размерами EV колебаясь от 100-600 nm NTA. Урожайность EV будет зависеть от таких факторов, как вес печени и потери в рамках перфузации или ультрацентрифугации шагов.
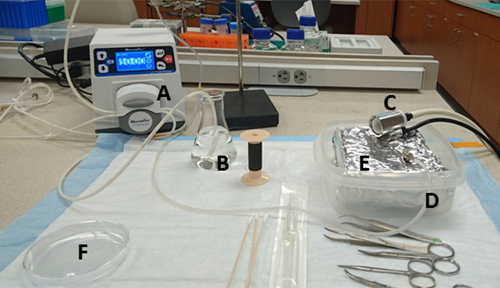
Рисунок 1 : Подготовка скамейки. Материалы и их расположение: (A) насос, (B) нагревается 125 мл колба, содержащая HBSS и всасывания порта воды, (C) носовой конус, подключенный к испарителю Isoflurane, (D) водяной выхлопной порт насоса, соединяющего с иглой, (E) лоток, выложенный алюминиевой фольгой внутри жесткий стеной контейнер, и (F) 10 см культуры блюдо, в котором коллагенеза среды наливают заранее. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
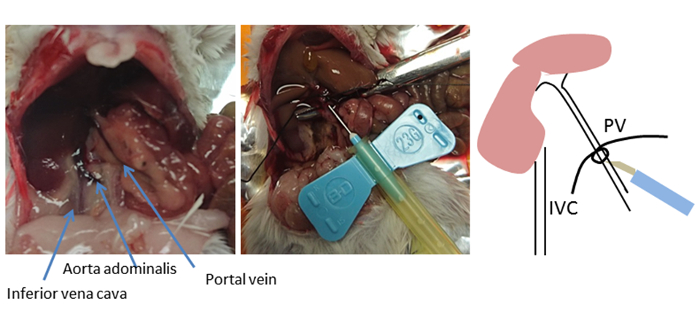
Рисунок 2 : Кануляционный сайт. Показана анатомия живота мыши. Используя изогнутые щипцмы, нить помещается под вену портала (PV) и рыхлый узел завязывается. Расположение вставки находится рядом с печенью, на 5-10 мм ниже лигатуры, но не за пределами первой ветки портала (левая и правая печеночные вены портала). Канюля фиксируется или крепится с помощью нити с пробкой узел. Этот узел служит маркером места PV, если канюля выбита. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
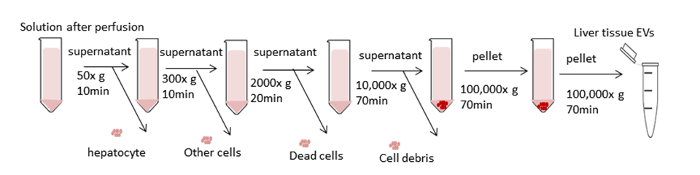
Рисунок 3 : Схема шагов центрифугации. Цель состоит в том, чтобы удалить нежелательные клетки и другие компоненты и изолировать EVs. Первые четыре шага центрифугации предназначены для удаления гепатоцитов и других клеток, мертвых клеток или клеточного мусора с помощью дифференциальной центрифугации. После этих шагов, ультрацентрифугация выполняется на 100000 х г для сбора гранул EVs. Гранулы промывают путем повторного приостановки в PBS и подвергаются окончательной ультрацентрифугации на 100000 х г. Все этапы центрифугации выполняются при 4 градусах Цельсия. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
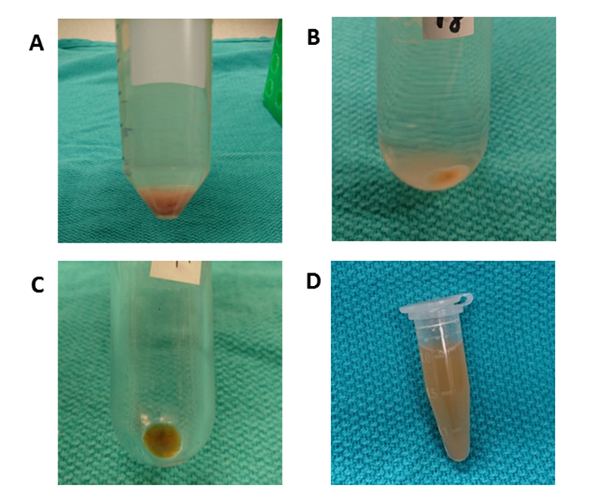
Рисунок 4 : Дифференциальная центрифугация. (A) После центрифугирования при 50 х г в течение 10 мин, гранулы, содержащие гепатоциты наблюдается. (B) Круглая нижняя трубка используется для центрифугирования при 10000 х г в течение 70 минут для удаления клеточного мусора. (C) Поликарбонатультрацентрифуговая трубка используется для центрифугирования при 100 000 х г в течение 70 мин. Гранулы собирают в одну трубку и промывают путем повторного приостановки с помощью PBS. (D) Окончательный гранулы повторно приостановлено в 1000 Л Л PBS. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
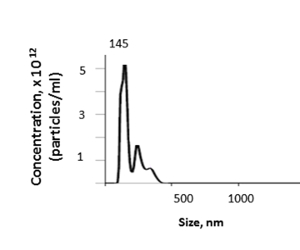
Рисунок 5 : Представительный результат. Размер и концентрация ЭВ тканей печени можно определить с помощью анализа отслеживания наночастиц (NTA). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Этот протокол описывает оптимальный и воспроизводимый метод изоляции печеночной ткани EV с помощью двухступенчатого процесса перфузии через портальную вену с последующим дифференциальной ультрацентррифизобилием. Важные шаги процедуры включают размещение канюли, концентрацию коллагенаны и время пищеварения, скорость потока среды, обработку ткани после пищеварения, и классический дифференциальный ультрацентрифугация.
Разделение клеток достигается путем отделения от компонентов соединительной ткани после пищеварения с помощью коллагеназе типа IV. Концентрация коллагеназа, используемая для перфузии, может варьироваться от 0,1 до 5 мг/мл. Там может быть значительное пакет-к-пакет изменения в эффективности коллагеназа для пищеварения тканей. Были протестированы концентрации коллагеназа от 0,5 до 5 мг/мл, однако используемая концентрация не оказала существенного влияния на урожайность полученных ЭВ. Использование более высокой концентрации коллагеназа приведет к более быстрому отеку и отбеливание печени. Цель состоит в том, чтобы получить удовлетворительное диссоциация клеток без чрезмерного загрязнения или повреждения. Оптимальная концентрация коллагеназа, используемая в этих изоляциях, составляет 1-2 мг/мл в течение 7-8 мин при скорости потока 8 мл/мин. Процедура перфузии, которая слишком долго увеличит риск разрушения тонкой соединительной ткани в печени, а также увеличить технические риски, такие как дизлоги из вены портала или захвата воздуха с веной.
Наиболее сложным аспектом этого протокола является кануляция вены портала. Это может быть сложной задачей для выполнения, особенно у мышей в диапазоне от 18 до 25 г размера. Методы для перфузии коллагеназы были первоначально разработаны для использования у крыс и впоследствии приняты для использования у мышей после многочисленных изменений и корректировок. Каннулирование с использованием набора 23G крови легче, чем размещение катетера в кровеносных сосудах малого светящегося диаметра. Фиксация канюли с помощью нити с пробкой узел рекомендуется, чтобы избежать вытеснения и узел также служит маркером расположения вены портала в случае, если канюля сходит с судна.
Для анализа ниже по течению крайне важно иметь минимальное загрязнение от клеток. Есть несколько важных соображений в обработке тканей после пищеварения. Во-первых, щипцы и ножницы меняются, когда печень извлекается, чтобы избежать заражения крови. Во-вторых, очень важно, чтобы желчный пузырь был тщательно удален из печени, чтобы избежать разрыва и нежелательного загрязнения от желчи. В-третьих, как только печень была удалена из мыши, печень промывается очень осторожно с помощью PBS для удаления любой крови. Минимизации загрязнения клетками следует уделять более высокий приоритет, чем снижению урожайности полученных ЭВ.
Ультрацентрифугация является наиболее часто используемым методомдля изоляции и очистки EVs 8,9,10,11. Этот подход позволит удалить большинство паренхимальных клеток, таких как гепатоциты или холангиоциты и не-паренхимальные клетки, такие как клетки Купффера, синусоидальные эндотелиальные клетки, и stellate клетки, Кроме того, клеточный мусор, скопления клеток, и мертвые клетки также будет удалены дифференциальной центрифугией. Дальнейшая очистка и изоляция конкретных популяций может быть выполнена путем исключения размера хроматографии для удаления любых невезикулярных белковых агрегатов или липопротеинов.
Ограничение этого протокола заключается в том, что он не может захватить все пузырьки ткани, учитывая возможность того, что некоторые пузырьки могут быть удалены в перфузате. Если необходима глобальная оценка, следует рассмотреть вопрос о сборе перфузата и изоляции пузырьков в пределах перфузата. Еще одним ограничением является потенциальная возможность повреждения клеток. Для мониторинга потенциального воздействия чрезмерной гибели клеток, жизнеспособность клеток может контролироваться и включаться в параметры качества для изоляции тканя EV. В заключение, эта процедура описывает оптимизированный рабочий процесс с использованием двухступенчатой техники перфузии через вену портала с последующим дифференциальной ультрацентрифугации для получения печеночной ткани EVs из печени мыши при высокой урожайности. Эти тканивые ЭВ подходят для анализа ниже по течению, таких как характеристика биомолекулярного состава и другие исследования, которые направлены на характеристику их физиологических или патофизиологических ролей или потенциальных приложений в качестве маркеров болезни.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано финансированием из Национального института рака Грант CA-217833.
Материалы
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
Ссылки
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены