Method Article
Karaciğerden Doku Ekstrasellüler İzoles İzolasyon
Bu Makalede
Özet
Bu karaciğerden doku ekstrasellüler (EVs) izole etmek için bir protokoldür. Protokol, kollajenaz perfüzyonunu içeren iki aşamalı bir süreci ve ardından karaciğer dokusu EVs'lerini izole etmek için diferansiyel ultrasantrifüji tanımlıyor.
Özet
Ekstrasellüler veziküller (EVs) birçok farklı hücre tiplerinden serbest bırakılabilir ve çoğunda, hepsi olmasa da, vücut sıvılarında saptanabilir. EV'ler, RNA veya protein gibi biyoaktif molekülleri bir hücreden diğerine kapatarak hücreden hücreye iletişime katılabilirler. EVs çoğu çalışmalar hücre kültürü modelleri veya evs vücut sıvıları izole yapılmıştır. Ev'lerin dokulardan izole edilmesine ve fizyolojik süreçlere olan katkılarının ve hastalıkta nasıl değiştirildiklerinin incelenmesine ilgi artmaktadır. Dokulardan yeterli verim ile EVs izolasyon u hücresel hasar olmadan doku bölünmesi ihtiyacı nedeniyle teknik olarak zordur. Bu yöntem, fare karaciğer dokusundan EVs izolasyonu için bir prosedür açıklar. Yöntem, situ kollajenaz sindirim ile başlayan iki aşamalı bir süreç ve ardından diferansiyel ultra santrifüj içerir. Kollajenaz kullanılarak doku perfüzyonu, elde edilen EVs'lerin veriminin artması nedeniyle karaciğer dokusunun mekanik olarak kesilmesi veya homojenleştirilmesi ne kadar avantaj sağlar. KaraciğerDEN EVs izole etmek için bu iki aşamalı sürecin kullanımı doku EVs çalışma için yararlı olacaktır.
Giriş
Ekstrasellüler veziküller (EVs) vücutta hücrelerin birçok farklı türde serbest membran bağlı veziküller vardır. EVs RNA, DNA ve protein içeren moleküllerin bir kargo içerir. Bu kargonun bir hücreden diğerine evs tarafından aktarılması, dokular içindeki hücrelerin birbirleriyle iletişim kurduğu bir mekanizma olarak öne sürülecektir1. Normal sağlık ve hastalıklarda EVs kargo veya rolleri ile ilgili bilgilerin çoğunluğu kültür hücrelerinden elde edilen veya dolaşım veya diğer vücut sıvıları toplanan EVs çalışmaları elde edilmiştir2. Vivo onlarınfizyolojik rollerini anlamak için, sağlam bir yöntem EVs tüm popülasyonları yakalar ve hücresel hasar veyakontaminasyon3 önler doku EVs izolasyon için gereklidir. Burada açıklanan yöntemin genel amacı fare karaciğerlerinden doku EVs izole etmektir.
Karaciğerde çoğu hücre tipleri EVs üretmek için gösterilmiştir, ve EV tabanlı sinyal çalışma hepatik hastalıkların temel bilgi ve anlayış ilerliyor. Ancak, dokular içinde farklı hücre tiplerinden EVs kombine etkisi sadece kısmen anlaşılmaktadır. EVs'nin karaciğer dokularından izole edilmesi, EVs'in doku ortamındaki insitu katkılarını anlamak için gereklidir. Burada açıklanan yaklaşım doku bölünmesini artırmak ve hücre hasarını en aza indirmek için iki adımlı perfüzyon dayanmaktadır. Daha sonra, EVs ayrışmış karaciğer dokusundan izole edilir. Hepatositlerin izolasyonu için iki adımlı perfüzyon kullanan yaklaşımlar 1950'lerin başından beri kullanılmaktadır4. Hepatosit izolasyonu için bu yöntemler değiştirilmiş ve sürekli geliştirilmiş ve şimdi kültürlerde hepatosit izolasyoniçin standart yaklaşımlar, hücre süspansiyonlar, ve dokulardan5,6,7. İlk adımda, karaciğer kalsiyumiçermeyen tampon ile bir non-recirculating perfüzyon tabi tutulur, Hank dengeli tuz çözeltisi (HBSS). İkinci adımda, karaciğer desmosomal hücre-hücre kavşakları daha fazla ayrılması için ekstrasellüler matris çözmek için kollajenaz ile perfüzyon. Kollajenaz çözünme için en uygun tedavi süresi 7-10 dakikadır. Tedavinin daha kısa bir süre eksik çözünmeye neden olur ve karaciğerde hücre temasları korumak, daha uzun bir süre karaciğer hasarı veya portal ven bozulmasına neden olabilir ise. EVs sonra hücreleri ve hücresel enkaz kaldırmak için diferansiyel santrifüj kullanılarak izole edilir. Bu, daha fazla akış aşağı analizveya çalışma için kullanılabilecek yüksek verimlerde EV toplama ile sonuçlanır.
Protokol
Hayvanlarla ilgili tüm çalışmalar Mayo Clinic Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanan bir protokole uygun olarak yapılmıştır.
1. Tezgah Hazırlama
- Bir su banyosu hazırlayın ve 37 °C'ye ayarlayın. Diğer gerekli ekipman ve kurulum Şekil1'de gösterilmiştir.
- Ölçü 100 kollajenaz tip IV mg ve bir su banyosu (40 °C) HBSS 100 mL içeren 125 mL şişe ekleyin. Kollajenazşişedeki sıvıyı girerek çözünmüş olduğundan emin olun ve ayrıca şişenin tamamen su banyosuna batırıldığından emin olun. Daha fazla verimlilik için, kollajenaz anında çözülmek gibi görünse bile en az 30 dakika erimesine izin verin.
- 40 °C'deki bir su banyosunda 50 mL HBSS içeren 125 mL'lik bir şişeyi sulayın. Bu ilk yıkama için kullanılacaktır.
- % 70 etanol ile makas ve forceps gibi tüm araçların yüzeyini aşağı sprey. Birkaç temiz pamuklu bez hazırlayın.
- Pompa nın üzerinden %70 etanol çalıştırarak pompanın borularını durulayın ve akan suyla iki kez durulayarak artık etanolleri çıkarın.
- Laboratuvar bankına emici bir tezgah pedi yerleştirin ve üstüne sert bir kutu kabı yerleştirin. Bu fare perfüzyon sırasında herhangi bir aşırı sıvı lar içermek için gerekli olacaktır. Alüminyum folyo ile bir polistiren köpük ped sarın ve konteyner içine yerleştirin.
- Tezgahın yakınına 10 cm'lik steril bir kültür çanağı yerleştirin. Bu perfüzyon tamamlandıktan sonra sindirilmiş karaciğer tutmak için kullanılacaktır.
- Önceden steril bir kültür çanağı içine kollajenaz orta (adım 1.2) 10 mL dökün.
- Kanatlı kan toplama seti kullanarak, pompa boru serbest ucuna 23-gauge bağlayın (kelebek kanül kapalı kanatları kesme daha iyi işleme yol açabilir). Kan toplama kanülünün ucu dolana kadar geçirin.
2. Hayvan Hazırlığı
- Isoflurankullanarak anesteziye başlamadan önce, işlem süresince yeterli miktarda besleme gazı nın mevcut olduğundan emin olun. Oksijeni (O2)indüksiyon odasına 1-2 L'de açın, ardından akış ölçer kullanarak isofluran'ı %2-4 arasında açın.
- Fareyi indüksiyon odasına koyun ve üst kapıyı kapatın. Fareyi bükülene kadar izleyin.
NOT: Odadaki gazlar fareleri birkaç dakika boyunca anestezi altında tutar. - Fareyi alüminyum folyo ile sarılmış polistiren köpük pedüzerine yerleştirin. Akışı indüksiyon odasından nosecone'a çevirin. Anestezinin yeterli olduğundan emin olun. Fare yanıt vermeye başladıysa, tamamen anestezi yapılana kadar burun konisi içinde hafifçe dizginle.
- İşlem sırasında solunum uyup uyarıma yanıt vererek anesteziyi sağlayın. Yeterli anestezi sağlamak için hız akış ölçerini gerektiği gibi ayarlayın. Patiler anestezi altında çimdik testine yanıt vermemelidir. Hayvanların bakımı için laboratuvar rehberinden ek bilgi alınabilir.
- Farenin dört uzvunu da bantlayın veya sabitleyin.
- % 70 etanol ile püskürtme ve gazlı bez ve alkol pedi ile silerek karın üzerinde cilt temizleyin. Bu adım, fare kürkünden kirlenmeyi önlemek için çok önemlidir.
- Steril makas seti kullanarak ön den pelvis kemiğine kadar deri ile geniş bir açık kesim olun. İç organları kesmemeye dikkat edin. Portal ven (PV) ve inferior vena kava (IVC) nazikçe ortaya çıkarmak için hafifçe bir pamuk uçlu aplikatör kullanarak hayvanın sol tarafına bağırsak yerinden.
3. Kanülasyon ve Perfüzyon (0.5 saat)
- Kavisli forceps kullanarak, portal ven altında bir iplik yerleştirin ve kanülasyon sonra sıkıca cinching hazırlamak için gevşek bir düğüm kravat.
- Kanülleri (kan toplama setinden 23G) ligatür altında portal vene 5-10 mm takın. Kanülilk portal dalı geçmiş eklemeyin, aksi takdirde sağ ön lob yetersiz perfüzyon olabilir. Kanül bir stoper düğümü kullanılarak iş parçacığı ile sabitlenebilir veya sabitlenebilir.
- Düşük akış hızında (1-2 mL/dk) HBSS'ye aşılamak için pompayı çalıştırın. Kanülasyonun başarılı olduğu doğrulandıktan sonra karaciğer beyazletmeye başlayacaktır.
- Basıncı azaltmak ve karaciğer içinde aşırı sıvı drenaj izin IVC kesin. Bu, kanülün taşınmaması için diğer el işleçler kullanılarak en iyi şekilde gerçekleştirilir.
- Akış hızını yavaşça 8 mL/dk'ya yükseltin ve sonraki 5 dk boyunca karaciğer de HBSS'nin 50 mL'lik hacminin tamamını kullanarak perfüzyonu tamamlayın.
- HBSS tükenmeye başlamadan hemen önce orta içeren kollajenazı (adım 1.2) kabın içine değiştirin. Hava kabarcıklarının bulunmadığından ve ortamı değiştirirken karaciğere akmayan dan emin olun.
- Forceps ile kenetlenerek 5 s aralıklarla IVC'ye geçici basınç uygulayın. Bu karaciğer şişmesine neden olur ve doku sindirim ve dissociation (7-8 dk) ile yardımcı olur. Sindirim ilerledikçe, karaciğer şişecek ve beyaz olacak. Karaciğer, orijinal boyutunun yaklaşık iki katı kadar tek tip olarak şişebilir.
- Pompayı kapatın ve sindirim tamamlandıktan sonra kanülçıkarın. Karaciğer sindirim tamamlanması fare nin boyutu na ve karaciğer durumuna bağlıdır. Bir pamuk uçlu aplikatör yavaşça karaciğer probe için kullanılırsa karaciğerde bir ezik görülebilir.
- Karaciğerden safra kesesi çıkarın, onu yırtmak için dikkatli olmak. Yıkanmış bir makas ve forseps kullanarak, yüzey yıkama için fosfat tamponlu salin (PBS) içeren steril 10 cm kültür çanak içine fareden karaciğer ayıklayın. Karaciğeri kollajenaz orta içeren steril 10 cm kültür kabına dikkatlice aktarın (adım 1.8'den). Bu fare kan ve safra kontaminasyonu önlemek için kritik bir adımdır.
- Kapmak ve yavaşça karaciğer hücreleri sallayarak iki temiz forceps ile karaciğer parçalamak. Bu durumda, ortam bulanıklaşır. Tüm hepatositler sarsılabilir, bağ dokusu ve vasküler doku geride bırakarak.
- Karaciğerin sindirilmemiş parçaları sarsılın kadar 3 mL şırınga kullanarak birçok kez hücre çözeltisi triturate. Sindirilmemiş bağ dokusunu filtrelemek için 70 m naylon hücreli süzgeçlerle birlikte 50 mL konik bir tüpe dökün. Kalan hücreleri toplamak ve 50 mL konik tüp doldurmak için HBSS ile çanak yıkayın.
- Santrifüj 50 mL konik boruyu 4 °C'de 10 dk boyunca 50 x g'da sallanan bir kova rotorunda hafifçe yerleştirin.
- Supernatant'ı yeni bir 50 mL konik tüpe aktarın.
4. EV Izolasyonu (5 saat)
- 4 °C'de 10 dk için 300 x g'de süpernatantı santrifüj edin. Supernatant'ı yeni bir 50 mL konik tüpe aktarın.
- Hücre enkazını ve agregalarını temizlemek için 2000 x g'de 4 °C'de 20 dk'da süpernatantı santrifüj edin.
- Supernatant'ı yuvarlak bir alt tüpe aktarın ve supernatant'ı 4°C'de 70 dk için 10.000 x g'de santrifüj edin.
- Supernatant toplayın ve 4 °C'de 70 dakika için 100.000 x g bir polikarbonat ultracentrifuge tüp ve santrifüj içine yerleştirin.
- Daha sonra PBS yeniden askıya alınarak yıkanır bir ultracentrifuge tüp pelet toplamak. 4 °C'de 70 dk için 100.000 x g'de süpernatantı daha fazla santrifüj edin.
- Hücresel nanoveziküllerden oluşan son pelet deneyler için doğrudan kullanılabilir veya 1000 μL PBS ile yeniden askıya alınabilir ve -80 °C'de depolanabilir.
5. İzolasyonların Kalite ve Veriminin Değerlendirilmesi
- Nanopartikül izleme analizi veya cihaz üreticisinin protokollerini izleyerek dayanıklı darbe algılamasını kullanarak boyut dağılımını ve konsantrasyonu değerlendirin.
- Belirli deneysel ihtiyaçlara dayalı olarak sakaroz gradyan veya yastık, immünaffinite teknikleri veya boyut dışlama kromatografisi gibi çeşitli yaklaşımlarla spesifik vezikül popülasyonlarının daha fazla izolasyonve saflaştırılmasını gerçekleştirin.
Sonuçlar
Bu izolasyonlar için gerekli olan cihaz standart laboratuvar ekipmanından oluşur ve bu da bunu nispeten basit ve uygun maliyetli bir yaklaşım haline getirir. İzolasyonlar on iki ila otuz haftalık erkek ve dişi Balb/c veya FVB farelerden yapılmıştır. Fareyi tutan tepsi, perfüzyon sırasında fazla sıvı toplayan sert duvarlı bir kabın içinde alüminyum folyo ile kaplıdır. HBSS veya kollajenaz içeren ortam içeren şişeler kullanılmaya hazır bir su banyosuna (40 °C) batırılır. İki steril 10 cm kültür yemekleri kullanılır. Biri PBS ile yüzey yıkama için, diğeri ise bağ dokusu bileşenlerinden hepatosit ayrılması için gereklidir.
Bu yöntemde, karaciğer inferior vena kava dan kanülasyon tercih portal ven yoluyla sürekli olmayan bir şekilde perfüzyon. Alternatif ve yaygın olarak kullanılan perfüzyon yaklaşımı, inferior vena kavasını tutarak ve drenaj için portal damarı keserek retrograd perfüzyon gerçekleştirmektir. Ancak, portal ven kanülasyonu erişmek kolaydır ve karaciğere kısa bir mesafe içerir, portal ven doğrudan karaciğer içine beslenir gibi8. Kanülasyon için bir ekleme noktasının seçimi optimal başarıiçin çok önemlidir (Şekil 2). Kanül mide ve pankreas damarlarının dalları geçmiş ama ilk portal dalı (sağ ve sol hepatik portal venler) ötesinde yerleştirilir. Portal ven içinde optimal ekleme konumu tespit edildikten sonra, kavisli çifenekler portal ven altında bir iplik yerleştirmek ve gevşek bir düğüm bağlamak için kullanılır. Kanül iğnesi, iğnenin düşmesini önlemek için stoper düğümü kullanılarak iplikle sabitlenir.
Şekil 3 karaciğer dokusu EVs izolasyon uğruyor diferansiyel santrifüj için genel işleme şeması özetliyor. Ultracentrifugation hücreleri, enkaz ve diğer kirleri kaldırır. İlk dört santrifüj basamak (50 x g, 300 x g, 2.000 x g, 10.000 x g) hepatositleri, bozulmamış diğer hücreleri, ölü hücreleri veya hücre enkazlarını kaldırmak için tasarlanmıştır. (Şekil 4A ve 4B). Bu adımlardan sonra, ultrasantrifüj tekrar 100.000 x g pelet toplamak için yapılır (Şekil 4C). Pelet PBS'de yeniden askıya atılarak yıkanır ve 100.000 x g'de son bir ultrasantrifüje maruz kalır. Ultracentrifugation sonrası pelet şartlı kültür medyasından EVs ile karşılaştırıldığında bu prosedürde kesinlikle görünür ve viscid. Pipetleme birçok kez herhangi bir kahverengi agrega gözden uzak ve tamamen çözülmüş kadar gereklidir. Son pelet 1000 μL PBS (Şekil4D) ile yeniden askıya alınır. Ultracentrifugation plazmadan kirleri ve diğer çözünür kirleticimaddeleri temizler, bu da fonksiyonel deneysel sonuçları etkileyebilir. Santrifüj 4 °C'de yapılır.
Fare karaciğerinden, bu yöntem nanopartikül izleme analizi (NTA) tarafından belirlenen mL başına ortalama 3,46 x 1012 partikül ile 1,74 ila 4,00 x 1012 arasında değişen bir doku EV konsantrasyonu verir (Şekil5). İzole karaciğer dokusu EVs ortalama boyutu 157.7 nm, 144.5 nm ve EV boyutları 100-600 nm NTA tarafından değişen bir mod boyutu ile oldu. EV verimi karaciğer ağırlığı ve perfusate veya ultracentrifugation adımlar içinde kayıplar gibi faktörlere bağlıdır.
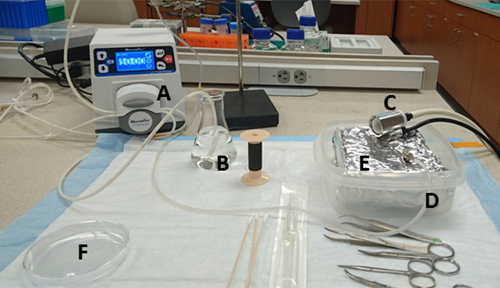
Şekil 1 : Tezgah hazırlığı. Malzemeler ve konumları şunlardır: (A) pompa, (B) HBSS ve su emme portu içeren 125 mL şişe ısıtılmış, (C) bir Isofluranbuharı bağlı burun konisi, (D) iğne ile bağlanan pompanın su egzoz portu, (E) tepsi içinde alüminyum folyo ile kaplı bir sert duvarlı konteyner ve (F) kollajenaz orta önceden dökülür 10 cm kültür çanak. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
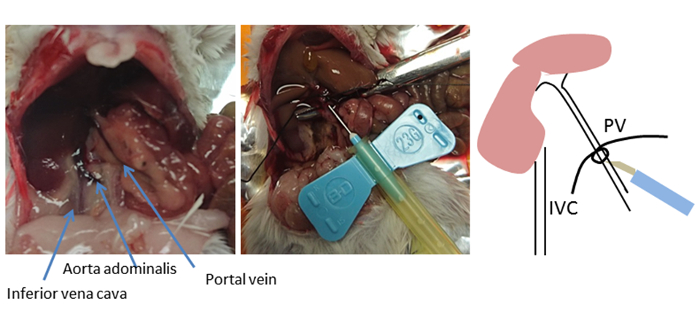
Şekil 2 : Kannülasyon sitesi. Fare karın anatomisi gösterilir. Kavisli forceps kullanılarak, portal ven (PV) altına bir iplik yerleştirilir ve gevşek bir düğüm bağlanır. Ekleme yeri karaciğer yakın, ligatür altında 5-10 mm, ancak ilk portal dalı ötesinde değil (sol ve sağ hepatik portal damarlar). Kanül sabit veya stoper düğüm ile iplik kullanılarak sabit. Kanül yerinden ise bu düğüm PV konumunun bir işareti olarak hizmet vermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
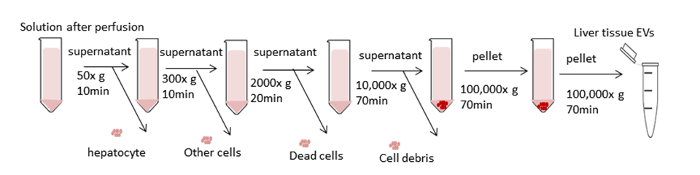
Şekil 3 : Santrifüj basamaklarının şeması. Amaç, istenmeyen hücreleri ve diğer bileşenleri kaldırmak ve EVs'leri yalıtmaktır. İlk dört santrifüj adımları hepatositler ve diğer hücreler, ölü hücreler veya hücre enkazdimidiredidial santrifüj kullanarak kaldırmak için tasarlanmıştır. Bu adımlardan sonra, ultracentrifugation 100.000 x g evs pelet toplamak için gerçekleştirilir. Pelet PBS'de yeniden askıya atılarak yıkanır ve 100.000 x g'de son bir ultrasantrifüje maruz kalır. Tüm santrifüj basamakları 4 °C'de gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
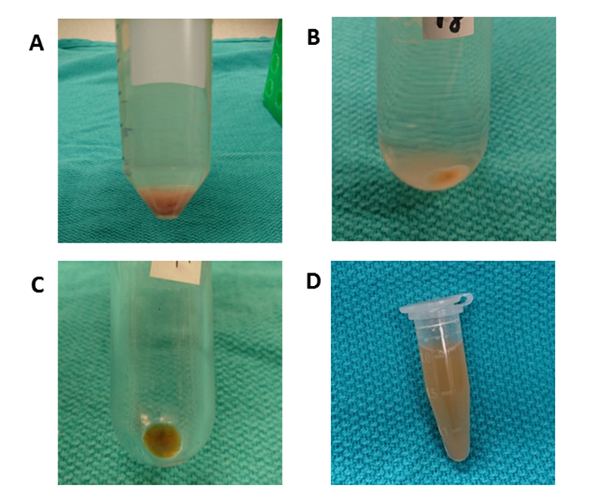
Şekil 4 : Diferansiyel santrifüj. (A) 10 dk için 50 x g santrifüjden sonra hepatosit içeren bir pelet görülür. (B) Hücre enkazLarını temizlemek için 10.000 x g'de 70 dk'lık bir yuvarlak alt tüp santrifüj için kullanılır. (C) 100.000 x g 70 dk için santrifüj için bir polikarbonat ultracentrifuge tüp kullanılır. Pelet bir tüp içinde toplanır ve PBS ile yeniden askıya alınarak yıkanır. (D) Son pelet 1000 μL PBS'de yeniden askıya alınır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
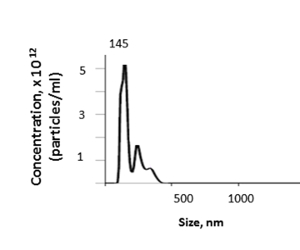
Şekil 5 : Temsili sonuç. Karaciğer dokusu EVs boyutu ve konsantrasyonu nanopartikül izleme analizi (NTA) ile belirlenebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, portal ven üzerinden iki adımlık perfüzyon işlemi ve ardından diferansiyel ultrasantrifüj kullanılarak hepatik doku EV izolasyonu için optimal ve tekrarlanabilir bir yöntem tanımlanmaktadır. Prosedürün önemli adımları kanül yerleştirme dahil, kollajenaz konsantrasyonu ve sindirim süresi, orta akış hızı, sindirim sonrası doku işleme, ve klasik diferansiyel ultrasantrifüj.
Hücre ayrıştırma kollajenaz tip IV kullanılarak sindirim sonra bağ dokusu bileşenlerinden ayrılması ile elde edilir. Perfüzyon için kullanılan kollajenaz konsantrasyonu 0.1 ila 5 mg/mL arasında olabilir. Doku sindirimi için kollajenaz etkinliğini önemli toplu-to-batch varyasyon olabilir. Kollajenaz konsantrasyonları 0.5 ila 5 mg/mL arasında test edildi, ancak kullanılan konsantrasyon elde edilen EVs verimi üzerinde önemli bir etkisi yoktu. Kollajenaz daha yüksek bir konsantrasyon kullanarak karaciğer daha hızlı şişme ve beyazlatma neden olacaktır. Amaç aşırı kontaminasyon veya hasar olmadan tatmin edici hücre bölünmesi elde etmektir. Bu izolasyonlarda kullanılan kollajenazOptimal konsantrasyonu 8 mL/dk akış hızında 7-8 dk perfüzyon1-2 mg/mL'dir. Çok uzun bir perfüzyon prosedürü karaciğer içinde ince bağ dokusu yok riskini artıracak yanı sıra portal ven veya ven ile hava bindirme iğne delodgment gibi teknik riskleri artıracaktır.
Bu protokolün en zorlu yönü portal ven kanülasyonudur. Bu, özellikle 18-25 g boyutuaralığındafarelerde gerçekleştirmek zor olabilir. Kollajenaz perfüzyon teknikleri başlangıçta sıçanlarda kullanılmak üzere geliştirilmiş ve daha sonra çok sayıda değişiklik ve ayarlamalar sonra farelerde kullanılmak üzere kabul edilmiştir. 23G kan toplama seti kullanılarak kanülasyon küçük luminal çapı kan damarlarında bir kateter yerleştirilmesi daha kolaydır. Bir stoper düğümü ile iplik kullanarak kanül sabitleme yerinden önlemek için tavsiye edilir ve düğüm de kanül damar dan geliyor durumda portal ven konumu bir belirteç olarak hizmet vermektedir.
Downstream analizi için, hücrelerden en az kontaminasyon olması son derece önemlidir. Sindirim sonrası doku kullanımında birkaç önemli husus vardır. İlk olarak, karaciğer kan kontaminasyonunu önlemek için çıkarıldığında forceps ve makas değiştirilir. İkinci olarak, safra kesesi dikkatle karaciğerden yırtılma ve safra istenmeyen kontaminasyon önlemek için kaldırılması önemlidir. Üçüncü olarak, bir kez karaciğer fare den kaldırıldı, karaciğer çok yavaşça herhangi bir kan kaldırmak için PBS kullanılarak yıkanır. Hücrelerle kontaminasyonun en aza indirilmesi, elde edilen EVs veriminde azalmadan daha yüksek bir öncelik verilmelidir.
Ultracentrifugation eVs8,9,10,11izolasyon ve arıtma için en yaygın olarak kullanılan yöntemdir. Bu yaklaşım hepatositler veya kolanjiyositler ve Kupffer hücreleri, sinüzoidal endotel hücreleri ve yıldız hücreleri gibi parenkimal olmayan hücreler gibi çoğu parenkimal hücreleri ortadan kaldıracak, Buna ek olarak, hücre enkaz, hücre toplama, ve ölü hücreler de olacak diferansiyel santrifüj ile kaldırılır. Veziküler olmayan protein agregalarını veya lipoproteinleri çıkarmak için boyut dışlama kromatografisi ile belirli popülasyonların daha fazla saflaştırılması ve izolasyonu yapılabilir.
Bu protokolün bir sınırlama bazı veziküller perfusat kaldırılabilir olasılığı göz önüne alındığında, tüm doku vezikülleri yakalamak olmayabilir. Küresel bir değerlendirme gerekiyorsa, perfusate içinde perfusate veziküllerin izolasyon ve toplama düşünülmelidir. Bir başka sınırlama hücre hasarı potansiyelidir. Aşırı hücre ölümünün potansiyel etkisini izlemek için, hücre canlılığı izlenebilir ve doku EV izolasyonları için kalite parametreleri içinde dahil edilebilir. Sonuç olarak, bu prosedür portal ven üzerinden iki adımperfüzyon tekniği kullanılarak optimize edilmiş bir iş akışını açıklar ve ardından fare karaciğerlerinden yüksek verimle karaciğer dokusu EVs elde etmek için diferansiyel ultracentrifugation. Bu doku EV'leri, biyomoleküler bileşimin karakterizasyonu ve fizyolojik veya patofizyolojik rollerini veya potansiyel uygulamalarını hastalık belirteçleri olarak tanımlamayı amaçlayan diğer çalışmalar gibi alt akım analizleri için uygundur.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Ulusal Kanser Enstitüsü Grant CA-217833 tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| 125 mL Erlenmeyer flask | Fisher scientific | FB500125 | |
| Curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| Masking tape | Home supply store | ||
| Aluminum foil | Home supply store | ||
| Styrofoam pad | Home supply store | ||
| Absorbent Bench Underpad | Scientific inc. | B1623 | |
| Masterflex L/S Digital Miniflex Pump | Cole-parmer | ZX-07525-20 | |
| Water bath | Thermo Electron Precision | 2837 | |
| Blood collection sets | Becton Dickinson | 367292 | |
| Petri dish, clear lid 100x15 | Fisher Scientific | FB0875712 | |
| Falcon 70mm Nylon Cell Strainers | Fisher scientific | 352350 | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| Cotton Tipped Applicators | Moore medical | 69622 | |
| 25mL Serological Pipet | Falcon | 357525 | |
| Ohmeda Isotec 4 Isoflurane Vaporiser | BioSurplus | 203-2751 | |
| O2 gas | |||
| Isoflurane | |||
| Levo Plus Motorized Pipette Filler | Scilogex | 74020002 | |
| Centrifuge 5804R | Sigma-aldrich | 22628048 | |
| Beckman Coulter Optima L-100 XP | Beckman | 969347 | |
| Beckman Coulter Avanti JXN-26 | Beckman | B34182 | |
| 70 Ti Fixed-Angle Rotor | Beckman | 337922 | |
| JA-25.50Fixed-Angle Rotor | Beckman | 363055 | |
| Nalgene Round-bottom tube | Thermo Scientific | 3118-0028 | |
| Polycarbonate ultracentrifuge tubes with cap assembly | Beckman | 355618 | |
| Reagents | |||
| HyClone Hank's Balanced Salt Solution (HBSS), Ca/Mg free | Fisher scientific | SH30588.01 | |
| Collagenase, Type IV, powder | Fisher scientific | 17104019 | |
| Phosphate Buffered Saline (PBS) | Fisher scientific | SH30256.01 |
Referanslar
- Kogure, T., Lin, W. L., Yan, I. K., Braconi, C., Patel, T. Intercellular nanovesicle-mediated microRNA transfer: a mechanism of environmental modulation of hepatocellular cancer cell growth. Hepatology. 54 (4), 1237-1248 (2011).
- Maji, S., Matsuda, A., Yan, I. K., Parasramka, M., Patel, T. Extracellular vesicles in liver diseases. American Journal of Physiology - Gastrointestinal and Liver Physiology. 312 (3), 194-200 (2017).
- Kogure, T., Patel, T. Isolation of extracellular nanovesicle microRNA from liver cancer cells in culture. Methods in Molecular Biology. 1024, 11-18 (2013).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. Journal of Experimental Medicine. 94 (5), 431-453 (1951).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cellular Biology. 13, 29-83 (1976).
- Klaunig, J. E., et al. Mouse liver cell culture. I. Hepatocyte isolation. In Vitro. 17 (10), 913-925 (1981).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Yin, Z., Ellis, E. C., Nowak, G. Isolation of mouse hepatocytes for transplantation: a comparison between antegrade and retrograde liver perfusion. Cell Transplantation. 16 (8), 859-865 (2007).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Currents Protocols in Cell Biology. , (2006).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır