Method Article
عزل الخلايا الكيراتينية البشرة الماوس وثقافتهم في المختبر Clonogenic
In This Article
Summary
الهدف من هذا البروتوكول هو عزل الخلايا القرنية البشرة من الجلد الظهري للفئران البالغة لمجموعة متنوعة من التطبيقات النهائية مثل البيولوجيا الجزيئية، والكيمياء الحيوية، وفرز الخلايا المنشطة الفلورية، والاستخدامات الأولية في المختبر (على سبيل المثال، clonogenic الخلايا الكيراتينية).
Abstract
البروتوكول الموصوف هنا هو طريقة موثوق بها لحصاد الخلايا الكيراتينية الأولية من الفئران الإناث البالغين (54 ± 2 أيام من العمر) مما أسفر عن ما يقرب من 30 × 106 خلايا قابلة للحياة لكل فأر. يتم حصاد الخلايا الكيراتينية الماوس الكبار الأولية من الجلد الظهري للفئران الإناث. يمكن استخدام الفئران الذكور (~ 6 أسابيع من العمر) لحصاد الخلايا الكيراتينية اعتمادا على متطلبات التجربة. يتم حلق الفئران القتل الرحيم وتعقيمها مع الشهي التسلسلي في اليود povidone وحلول الإيثانول (70٪ الكحول). بعد تطهير الفئران ، تتم إزالة الجلد الظهري ويتم إزالة الدهون والعضلات تحت الجلد مع مشرط وتجاهلها. يتم قطع الجلود إلى قطع صغيرة ومعالجتها مع الترببسينات خفيفة ومنخفضة درجة الحرارة لفصل الأدمة السفلى من البشرة. يتم تحريك البشرة كشط بسرعة منخفضة، وتصفيتها لإزالة الشعر، عد، وإعادة تعليق هافيت وسط الثقافة. توفر هذه الطريقة تعليق خلية واحدة ممتازة من الخلايا القابلة للزراعة للغاية للعديد من التطبيقات المصب.
Introduction
تغطي بشرة الثدييات الجسم بأكمله وتخدم العديد من الوظائف (على سبيل المثال، حاجز مادي أساسي، وتنظيم درجة الحرارة، والاحتفاظ بالرطوبة). على مدى العقود الخمسة الماضية، أسفرت البحوث الأساسية على جلد الماوس معلومات جديدة عن بنية ووظيفة الجلد. وقد ساعد نموذج جلد الماوس إلى حد كبير على فهم البيولوجيا الأساسية وراء الآليات الجزيئية المعقدة للتسرطن الكيميائي أو الأشعة فوق البنفسجية الناجمة عن الأشعة. قدمت هذه النماذج الجلد الماوس مساهمة كبيرة نحو فهم الأمراض الجلدية البشرية والتخفيف منها. لاستكشاف المزيد من تشريح الجزيئية من الخلايا الكيراتينية الأولية في البيولوجيا التنموية بصيلات الشعر، والبحوث الخلايا الجذعية، والسرطنة، والاستكشاف الوراثي للالبشرة، فمن المستحسن في كثير من الأحيان لعزل وثقافة الظهارية الأولية الخلايا الكيراتينية من جلد الفئران لاستخدامها بالتوازي مع تجارب في الجسم الحي. وكان العامل الدافع في تطوير هذه الطريقة هو الحاجة إلى إجراء تحليل في المختبر للخلايا الجذعية الجلدية وجريصال الشعر1،2. كما كانت هناك حاجة ملحة لتعليق خلية واحدة من الخلايا الجلدية مناسبة للفحص clonogenic3، الفلورة تنشيط فرز الخلايا ، وتدفق قياس الخلايا3،4. مزايا هذه الطريقة هي حصاد قوي زيادة حجم على طرق أخرى5،6، إدراج الجزء الظهاري من بصيلات الشعر ، والقابلية للزراعة العالية للخلايا التي تم حصادها. وفي الثمانينات، لم تكن هناك أساليب معروفة يمكن أن تفي بهذه المتطلبات. في السنوات اللاحقة، تم صقل هذه الطريقة لزيادة غلة الخلية. والقيد الرئيسي لهذه الطريقة هو إخفاء بعض الأجسام المضادة الحساسة التربسين التي من شأنها أن تضر بالتفاعل المناعي6.
تلقت الفئران تربية وفقا للمبادئ التوجيهية محددة خالية من مسببات الأمراض. تم الحصول على واحد إلى خمسإناث الفئران 54 ± 2 أيام من العمر. في الفئران القديمة ، سيتم تقليل صلاحية الخلايا الكيراتينية بسبب مرحلة أناجين (النمو) لدورة الشعر. أيضا، عملية التربسيني أكثر صعوبة بالمقارنة مع الفئران الشباب. وقد تم تحسين إجراء الحصاد بنجاح للبشرة أرق من الفئران الإناث بالمقارنة مع الذكور. لا تستخدم الفئران الذكور عموما لحصاد الخلايا الكيراتينية كما لديهم ميل للقتال مع بعضها البعض أثناء السكن، وبالتالي قد تترك الخدوش أو الجروح على الجلد.
Protocol
وقد وافقت لجنة الرعاية والاستخدام المؤسسية للحيوانية التابعة لجامعة مينيسوتا على جميع بروتوكولات استخدام الحيوانات الفقارية وفقاً للمبادئ التوجيهية الموصى بها للمعهد الوطني للصحة والمبادئ التوجيهية الحكومية.
1. تهيئة طبقة التغذية والزراعة الفرعية
- إذابة قارورة خلية واحدة تحتوي على الماوس السويسري المجمدة 3T3 من خزان النيتروجين السائل عن طريق وضع القارورة في حمام مائي 37 درجة مئوية لمدة 1-2 دقيقة. عدد الخلايا في القارورة هو تقريبا 1 × 106.
- إزالة قارورة الخلية 3T3 عندما ذاب الشظية النهائية من الجليد. مسح الأنبوب مع مسحة الكحول 70٪. ثم، نقل القارورة إلى خزانة السلامة البيولوجية.
- نقل الخلايا ببطء في قارورة T-150، وشطف قارورة 3T3 مع 1 مل من CGM المتوسطة. إضافة ببطء 30 مل من متوسط النمو الكامل 3T3 قبل تسخينها (CGM) إلى الخلايا. هز القارورة بلطف لنشر الخلايا الليفية 3T3 بالتساوي. قم بتسمية القارورة بتفاصيل خط الخلية والتاريخ ورقم المرور بشكل مناسب.
- حضانة الخلايا في 37 درجة مئوية مع 5٪ CO2 والرطوبة 95٪.
ملاحظة: وفقا لATCC, الوقت مضاعفة من الماوس السويسري 3T3 هو 18 ح; عندما confluent (الاتصال تثبيط)، والكثافة حوالي 40،000 خلية لكل سم2. نستخدم سطرًا معينًا من 3T3 ضمن 10-15 مقطعًا بعد التهيئة. يمكن أن يحدث نمو أسرع أو وجود خلايا على شكل المغزل في الممرات العليا وعادة ما يكون علامة على أن 3T3 لن تؤدي وكذلك خلايا التغذية للخلايا الكيراتينية الماوس الكبار. إذا حدث نمو سريع، فمن الأفضل لبدء خط جديد من خلايا الممر السفلي. - تغيير وسائل الإعلام بعد 24 ساعة لإزالة الخلايا الميتة وDMSO المتبقية (عامل الحفظ بالتبريد)، ومرتين أسبوعيا بعد ذلك. السماح للخلايا بالانتشار حول 80٪ التقاء واستخدام T-150 قوارير لبدء الثقافة. استخدم قوارير T-225 للثقافة الفرعية بعد التهيئة.
- للزراعة الفرعية 3T3 الخلايا الليفية، وإزالة قارورة من حاضنة ثقافة الخلية وغسل مرتين مع PBS معقمة الباردة (1X) مع جنتاميسين. Pipet 10 مل من التسخين المسبق (37 درجة مئوية حمام الماء) حل التربسين (0.25٪) في كل قارورة T-225.
- ضع القارورة على لوحة الاحترار لمدة 3-8 دقائق. قد يظهر حل التربسين غائمًا مع خلايا 3T3 منفصلة.
- Pipet الحل التربسين 3-4X لغسل سطح نمو الخلية من قارورة ونقل الخلية trypsinized إلى 30 مل من CGM في أنبوب مخروطي 50 مل. إعادة غسل القارورة 3-5x مع 10 مل من خليط الخلايا CGM-trypsin من الأنبوب المخروطي 50 مل.
ملاحظة: يمكن إضافة محتويات اثنين من محتويات قارورة إلى أنبوب 50 مل. إذا تم استخدام قارورة واحدة فقط، ثم وضع 10 مل من التربسين / الخلايا في 20 مل من CGM في أنبوب 50 مل. - الطرد المركزي أنبوب مخروطي 50 مل في 160 × ز لمدة 7 دقائق في 4 درجة مئوية.
- الآن يستنشق supernatant وإعادة تعليق بيليه الخلية مع 5 مل من CGM، pipetting بلطف ~ 10X لتعطيل تماما بيليه الخلية. إضافة 10 مل من CGM لجعل الحجم الإجمالي للأنبوب المخروطي 50 مل إلى 15 مل.
- مزيج مرة أخرى ~ ~ 10X ووضع 5 مل من تعليق الخلية في 3 قوارير T-150 منفصلة. نسبة الزراعة الفرعية هي 1:3 في قوارير T-225 أو 1:4 في قوارير T-150. أضف 30 مل من 3T3 CGM الدافئة مسبقاً إلى كل من القوارير.
- قم بتسمية القارورة باسم خط الخلية وتاريخ بذر الخلايا ورقم المقطع.
- لتجميد الخلايا 3T3 بعد الطرد المركزي في خطوة الثقافة الفرعية، وإزالة أنبوب 50 مل من الطرد المركزي ووضعها على دلو الجليد. يستنشق supernatant ويعلق بيليه الخلية مع 1 مل من 5٪ DMSO-DMEM خليط (انظر الجدول1) لكل قارورة حصادها.
- ضع 1 مل من خليط DMSO-DMEM مع تعليق الخلية في كل فيلة التبريد (واحد بالتبريد لكل قارورة 3T3 حصادها). قم بتسمية القارورة مع رقم المقطع واسم خط الخلية (3T3) وتاريخ تجميد الخلايا.
- ضع هذه القنينات الخلوية 3T3 في جرة الفريزر الخلوي (انظر جدولالمواد) ونقلها إلى -70 درجة مئوية الفريزر لـ > 5 ح. إزالة الدقيق ونقل القنينات من جرة الفريزر الخلوي ومكانها في خزان النيتروجين السائل للتخزين على المدى الطويل حتى الاستخدام التالي . أدخل معلومات حول اسم خط الخلية والموقع في الخزان والتاريخ في ورقة مخزون النيتروجين السائل المختبر.
2. إعداد طبقة التغذية 3T3 للأشعة السينية والبذر
- إعداد خلايا 3T3 قبل أسبوع واحد من التشعيع والسماح لهم بالنمو ~ 100٪ التقاء. الخلايا 3T3 عادة داخل الممرات من 120 إلى 130.
-
للحصول على الاختبارات الكلونية الناجحة للكريات القرنية الأولية، قبل زرع خلايا 3T3، معطف السطح أطباق بيتري 60 ملم مع الكولاجين.
- Pipet حوالي 2-3 مل من محلول طلاء الكولاجين في أطباق بيتري 60 مم لمعطف السطح السفلي وإزالة السائل طلاء الكولاجين الزائد (انظر الجدول1). نقل أطباق بيتري إلى حاضنة 37 درجة مئوية مع 5٪ CO2 لمدة لا تقل عن 1 ساعة. لا تدع الأطباق تجف في الحاضنة.
- خطوة الأشعة السينية التشعيعية: اتبع الخطوات 1.4-1.6. استخدام 50 مل من CGM الطازجة لإعادة تعليق بيليه الخلية، وإغلاق أنبوب مخروطي وختم مع فيلم ختم البارافين. لتجنب أي تلوث، استخدم أكياس بلاستيكية لمضاعفة كيس الخلية المختومة بالبارافين التي تحتوي على أنبوب ووضعها على الجليد. يمكن استخدام طبقة التغذية البديلة المستندة إلى ميتوميسين لثقافة الكيراتينية7.
-
الخلايا الليفية المشعة 3T3 في الأنبوب المخروطي 50 مل مع جرعة 5000 رادس (50 Cgy) مع جهاز الأشعة السينية البيولوجية. تشعيع هذه الخلايا جنبا إلى جنب مع وسائل الإعلام CGM.
- بعد الأشعة السينية التشعيع، خلايا الطرد المركزي في 160 × غرام لمدة 7 دقائق في 4 درجة مئوية. يستنشق وسائل الإعلام الفائقة وبلطف إعادة تعليق بيليه الخلية مع 5 مل من CGM triturating بلطف ~ 10X. الآن جلب المجلد النهائي إلى 30 مل مع إضافية 25 مل من المتوسطة وtriturate 10X. هذه الخطوات triturating حاسمة لطبقة الليفية 3T3 موحدة لـ clonogenicity.
- قابلة للحياة عد الخلايا: عد الخلايا الكيراتينية باستخدام مقياس الهيموكيتومتر الزجاج العادية. تأخذ ما يقرب من 0.5 مل من الخلايا ووضعها في أنبوب 1.5 مل. إزالة 200 درجة مئوية من خليط الخلية وإضافة حجم متساو من 0.4٪ تريبان الحل الأزرق والخليط 3-4X. نقل الخلايا مع مقياس الهيموكياتومتر وحساب جميع الخلايا النووية (الذهب الصغيرة والخلايا الوردية) كخلايا قابلة للحياة. حساب التركيز النهائي للخلايا الذهبية القابلة للحياة.
- ماصة 1 × 106 3T3 يمكن استخدام الخلايا (الحد الأدنى من 7 × 105) الخلايا) في 60 ملم الكولاجين المغلفة أطباق بيتري (الخطوة 2.2) وبلطف إضافة 4 مل من تعديل عالية الكالسيوم وليامز E وسائل الإعلام (انظر الجدول 1). السماح للخلايا 3T3 البذر الطازجة لنعلق لمدة 24 ساعة. في اليوم التالي، حصاد الخلايا الكيراتينية الأولية الطازجة والبذور لهم على رأس طبقة 3T3 الليفية المرفقة للبفحص clonogenic كما هو مبين أدناه.
3. حصاد الخلايا الكيراتينية الأولية والبذر
- قتل ما بين 4 إلى 5 فئران من الإناث البالغات عن طريقاستنشاق ثاني أكسيد الكربون وفقاً لمعايير المرفق الحيواني المعتمد/IACUC. ومع ذلك، يمكن استخدام هذا البروتوكول أيضًا للفئران الإناث/الذكور العازبين.
- مقطع ما يقرب من 9 سم2 من الفراء الظهري مع المقص الحيوان الكهربائية ووضع جميع الفئران مقطع في جرة 500 مل مع ما يكفي من محلول مطهر اليود povidone (وليس فرك) لتغطية لهم لمدة 1-2 دقيقة. حل على الفئران.
- صب قبالة الحل وشطف بالماء النظيف حتى السائل يعمل واضحة. كرر نفس الغسيل المطهر متبوعاً بشطف الماء. بعد غسل مطهر مع محلول اليود، نقع جميع الفئران في الإيثانول 70٪ لمدة 5-10 دقيقة.
ملاحظة: ستحتفظ الفئران ذات الفراء الخفيف (على سبيل المثال BALB/c) بلون مصفر طفيف من مهاد اليود المطهر، في حين أن الفئران الداكنة (مثل C57BL/6) لن تحتفظ بذلك. وتجدر الإشارة إلى أن بقاء الخلايا أو نمو الثقافة لا يتأثر بسبب اللون الأصفر.
- قم بإزالة الجلد الظهري المقصوّق بعناية باستخدام ملقط الإبهام والمقص في غطاء سير لامينار. ضع الجلد الظهري المكوس في أنبوب مخروطي مملوء بـ PBS/2x جنتاميسين. تجنب استخدام الجلد الجانبي البطني لمنع تلوث الخلايا الثديية في الثقافة.
- باستخدام ملقط الأوتوكلاف ومشرط، ضع جلد الظهر واحد في وقت شعر الجانب وصولا الى طبق بيتري رقيقة. بدء كشط جميع الأنسجة تحت الجلد بما في ذلك الدهون من الجانب البطني من أنسجة الجلد حتى تكون شبه شفافة. في محاولة لإزالة آثار أقصى من الأنسجة تحت الجلد دون تمزيق الجلد (جزء بصيلات الشعر). أيضا، لا كشط لفترة طويلة وتجنب تجفيف الجلد.
- الحفاظ على الجلد كشط في حل PBS حتى تتم معالجة جميع الجلود المتبقية الأخرى. باستخدام مشرط، قم بتقطيع الجلود إلى 0.5 سم × 1-1.5 سم من الشرائط ووضع الجانب المشعر على طبق بيتري معقم.
- ماصة بعناية 20 مل من PBS / 2X حل جنتاميسين مختلطة مع التربسين (0.25٪) في طبق بيتري البلاستيك 100 مم × 20 ملم. باستخدام ملقط معقمة، نقل الجلود وتعويم لهم الجانب شعر حتى على سطح محلول التربسين لمدة 2 ساعة في حاضنة 32 درجة مئوية.
ملاحظة: وقت الترسيبينووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووووو على الرغم من أن أساليب أخرى قد توفر غلة جيدة من الخلايا القابلة للحياة، كانت قابلية التشعب من الخلايا الكيراتينية أقل مرضية.- خلال هذا الوقت 2 ح الحضانة، وأطباق معطف مع طلاء الكولاجين ووضعها في 37 درجة مئوية لمدة 1 ساعة (انظر الخطوة 3.1.2). بالنسبة للتجارب الكلوجينية، تم بالفعل تغطية أطباق بيتري التي تبلغ مساحتها 60 مم بـ 24 ساعة قبل حصاد الخلايا الكيراتينية للسماح للطبقة المغذية 3T3 المشعة بإرفاقها بالقاع وتنتشر بالتساوي.
ملاحظة: طلاء أطباق الثقافة للثقافة clonogenic مهم جدا للارتباط السليم، وتشكيل مستعمرة، والنمو النهائي / انتشار الفئران الكيراتينية البشرة.
- خلال هذا الوقت 2 ح الحضانة، وأطباق معطف مع طلاء الكولاجين ووضعها في 37 درجة مئوية لمدة 1 ساعة (انظر الخطوة 3.1.2). بالنسبة للتجارب الكلوجينية، تم بالفعل تغطية أطباق بيتري التي تبلغ مساحتها 60 مم بـ 24 ساعة قبل حصاد الخلايا الكيراتينية للسماح للطبقة المغذية 3T3 المشعة بإرفاقها بالقاع وتنتشر بالتساوي.
- خطوة كشط البشرة: ترتيب طبق بيتري مربع بلاستيكي معقم وخلق سطح في 30 درجة يميل لكشط البشرة المناسبة مع 15 مل من الحصاد المتوسطة (انظر الجدول 1). قم بإزالة شريط البشرة العائم بعناية من محلول التربسين مع ملقط منحني. مع شفرة مشرط جديدة، كشط قبالة البشرة والشعر في الوسط.
- لا تستخدم القوة المفرطة، ولكن استخدام القوة الكافية لكشط البشرة، أو أنها سوف تؤثر على بقاء الخلية.
- أثناء كشط البشرة، حافظ على الشفرة متعامدة مع قطعة الجلد. إذا كان النصل زاوية نحو حركة النصل، وهناك المزيد من فرص تمزيق الجلد. إذا كان النصل زاوية بعيدا عن حركة شفرة، وهناك المزيد من فرص إزالة البشرة غير كافية.
- صب بعناية المتوسطة الحصاد التي تحتوي على خلايا البشرة كشط في جرة معقمة 60 مل (الأوتوكلاف وقابلة لإعادة الاستخدام) مع شريط التحريك المغناطيسي 1.5 بوصة. شطف طبق بيتري مع وسيلة حصاد إضافية لجمع الخلايا الجلدية المتبقية وجلب الحجم النهائي إلى 30 مل. استخدم النمام المغناطيسي وحرّك في 100 دورة في الدقيقة لمدة 20 دقيقة في درجة حرارة الغرفة. هذه العملية سوف إزالة خلايا البشرة المحاصرين من الشعر.
- ضع مصفاة خلية معقمة بـ 70 ميكرومتر على الجزء العلوي من أنبوب مخروطي بدرجة 50 مل. مصفاة الخلية يناسب على رأس أنبوب مخروطي 50 مل.
- خذ الجرة داخل غطاء الأمان الحيوي. إزالة شريط تحريك وصب المحتويات في مرشح مصفاة تعلق على أنبوب مخروطي 50 مل. قم بإجهاد الشعر غير المرغوب فيه وأوراق الطبقة القرنية.
- اضغط على الشعر جنبا إلى جنب مع مواد القرنية الطبقة داخل مصفاة والتلاعب بها للإفراج عن خلايا الشعر المحاصرين. استخدام 5 مل من الحصاد المتوسطة للسماح للخلايا المحاصرين المتبقية للإفراج عن هاوتدفق إلى الأنبوب. جلب حجم الإجمالي تصل إلى 50 مل في أنبوب مخروطي.
- قم بغطاء الأنبوب المخروطي بمقدار 50 مل مع فيلترات الخلية والطرد المركزي عند درجة حرارة 160 × غرام لمدة 7 دقائق عند درجة حرارة 4 درجات مئوية. المقبل يستنشق supernatant وإضافة 5 مل من وسط الحصاد. إعادة تعليق بيليه الخلية عن طريق triturating بلطف ~ 20X مع الأنابيب 5 مل.
- في هذه الخطوة، الاحتفاظ الخلايا في مربع الثلج لتجنب أي تجميع. إضافة 25 مل من الحصاد المتوسط وtriturate مرة أخرى (20-25x).
- لضمان عدد دقيق من الخلايا الكيراتينية في هذه الخطوة، واتخاذ 1 مل من تعليق الخلية وإضافة 19 مل وسط الحصاد. الآن تخفيف الخلية هو 1:20 في أنبوب مخروطي 50 مل. إذا تم حصاد الخلايا الكيراتينية من فأر واحد، ضبط حجم تعليق الخلية. بدلا من 30 مل، استخدم 15 مل وجعل تخفيف 1:10 لحساب الخلايا.
- Pipet 0.5 مل من الخلايا المخففة من أنبوب مخروطي 50 مل (1:20 تخفيف) ونقل إلى أنبوب الطرد المركزي الأوتوكلاف 1.5 مل. إزالة 0.2 مل (200 درجة مئوية) من مزيج الخلية إلى أنبوب آخر 1.5 مل الطاردة الدقيقة وإضافة حجم متساو (200 درجة مئوية) من 0.4٪ تريبان الحل الأزرق. خلط بلطف هذا الحل 3X ونقل الخلايا إلى مقياس الهيموكيتومتر لحساب الخلايا الكيراتينية النووية.
- يسجل جميع الخلايا الزرقاء الداكنة إيجابية لتريبان الأزرق والخلايا الميتة غير قابلة للحياة، ويسجل الذهب الصغيرة والخلايا الوردية كخلايا قابلة للحياة. يجب أن يكون العائد النهائي للكيراتينية لكل فأر حوالي 30 مليون خلية قابلة للحياة.
- طرد مركزي الأصلي 50 مل أنبوب مخروطي (من الخطوة 3.8) لمدة 7 دقائق في 160 × ز في 4 درجة مئوية. في هذه الخطوة، إعادة تعليق الخلايا في الوسط المطلوب وجعل التخفيف المطلوب للخلايا البذر.
- للثقافة الجماهيرية، البذور 2-4 مليون خلايا الذهب قابلة للحياة في كل طبق بيتري 35 ملم في خلية الثقافة المتوسطة (KGM-نوع المتوسطة + ملاحق للثقافات أحادية الطبقة) (انظر الجدول 1). لclonogenic (تشكيل مستعمرة) اختبار, البذور 1,000 الخلايا لكل 60 ملم طبق بيتري على الأشعة السينية الأشعة السينية الأشعة السينية السويسرية 203 طبقات المغذية مع طلاء الكولاجين وتعديل ها وليام المتوسطة مع المكملات الغذائية والمصل.
- استخدم ما مجموعه 2 إلى 4 مل وسطل لأطباق بيتري 35 مم و 60 مم، على التوالي. أيضا، صياغة DMEM ووليامز E المتوسطة التي تم شراؤها من ATCC معانخفاض مستويات بيكربونات الصوديوم للاستخدام في 5٪ CO 2.
- تنمو الخلايا الثقافية (كتلة أو clonogenic) في 32 درجة مئوية، والرطوبة 95٪ مع 5٪ CO2. تغيير وسائل الإعلام بعد يوم واحد من البذر الأولي للثقافة الجماهيرية، ثم 3X أسبوعيا بعد ذلك. ومع ذلك، بالنسبة للفاكسات clonal، فإن التغيير المتوسط الأول هو 2 أيام بعد بذر الخلايا و 3X أسبوعيا بعد ذلك.
- للثقافة clonal، زراعة الخلايا على فترات أسبوعين وأربعة أسابيع. بعد الانتهاء من الثقافات clonal (2 أو 4 أسابيع)، يستنشق المتوسطة. إصلاح المستعمرات في 10٪ المخزنة رسميا بين عشية وضحاها في درجة حرارة الغرفة ووصمة عار مع 0.5٪ رودامين B في الماء الأوتوكلاف لمدة 1 ساعة. ثم، قم بإزالة وصمة عار رودامين B مع ماصة من حافة الأطباق.
- شطف الأطباق في الماء الأوتوكلاف الباردة حتى الأطباق تشغيل واضحة. وضع الأطباق يميل على غطاء من الأطباق والسماح لهم الجافة لعد المستعمرة النهائية. وتجدر الإشارة إلى أنه عند إجراء اختبار الثقافة الكلونية، لا يتم أبداً ضخ المواب و1 مل من الخلايا. إذا كانت الخلايا مركزة، تمييع تركيز الخلية بشكل تسلسلي.
النتائج
عادة، يتم الحصول على غلة الخلايا الكيراتينية البشرة لكل ماوس تتراوح بين 20 × 106 إلى 30 × 106 التريبان الأزرق باستثناء الخلايا8،9. وتتراوح نسبة البقاء بين 80% و90%. تبلغ كفاءة البذر النموذجية حوالي 30% مرفقة في 24 ساعة. ،11. يتم توضيح النتائج النموذجية من الاختبارات تشكيل المستعمرة في الشكل 1. عدد الخلايا الجذعية بصيلات الشعر هو ما يقرب من 9٪ CD34+/CD49f+ الخلايا الجذعية للفئران C57BL/612. وترد النتائج النموذجية من قياس التدفق في الشكل 2.
ويبين الشكل 3خصائص النمو لأربع وسائط مختلفة. وتشمل وسائل الإعلام التي تم اختبارها KGM-الذهب، SFM، وليام E المتوسطة، وموريس-2 (وهو انخفاض وسط الكالسيوم وضعت في مختبر موريس على أساس وليامز E).
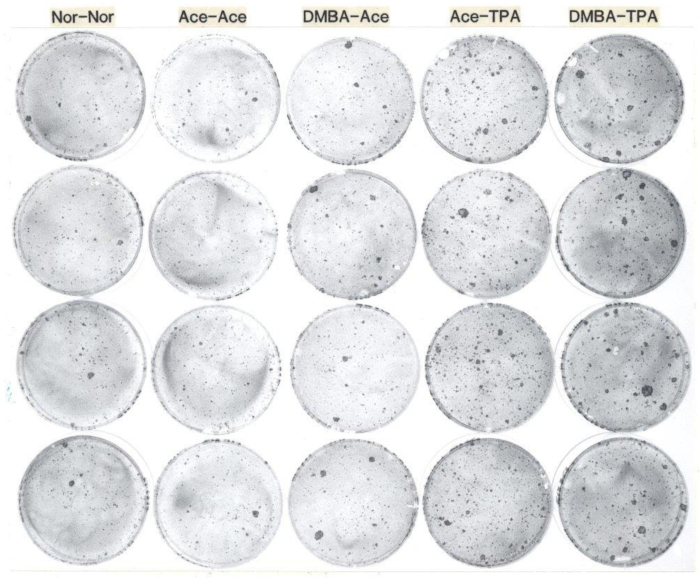
الشكل 1: أمثلة تمثيلية من اختبار لخلايا الكيراتين الكلونية من الفئران البالغة. توضح هذه الصورة تشكيل مستعمرة الكيراتينية من الفئران الإناث CD-1 54 يوما من العمر تعامل موضعيا مع 1) لا علاج، 2) الأسيتون تليها أسبوع واحد في وقت لاحق من قبل الأسيتون مرتين أسبوعيا لمدة أسبوعين، 3) DMBA تليها أسبوع واحد في وقت لاحق من قبل الأسيتون مرتين أسبوعيا لمدة أسبوعين، 4) الأسيتون تليها أسبوع واحد في وقت لاحق من قبل TPA مرتين أسبوعيا لمدة أسبوعين، و 5) DMBA تليها أسبوع واحد في وقت لاحق من قبل TPA مرتين في الأسبوع لمدة أسبوعين. بعد العلاجات في الجسم الحي، تم حصاد الخلايا الكيراتينية وبذرها في 1000 خلية لكل طبق على طبقات التغذية من 3T3 المشعة، ومثقفلمدة أسبوعين، وبعد ذلك تم إصلاح الأطباق مع الرسميين المخزنة وملطخة rhodamine B. يتم نسخ الأطباق في كل عمود من كل مجموعة معالجة الماوس. لاحظ أن عدد المستعمرات الكبيرة زادت عند العلاج مع DMBA، وزاد العدد الإجمالي للمستعمرات TPA العلاج من الفئران قبل حصاد الخلايا الكيراتينية. المختصرات: DMBA: 7,12-dimethylbenz[a]anthracene; TPA: 12-O-tetradecanoylphorbol-13-خلات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
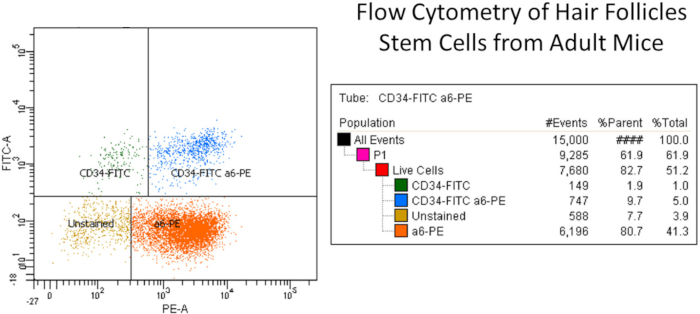
الشكل 2: مثال تمثيلي لتدفق الخلايا الجذعية بصيلات الشعر من الفئران البالغة. وباختصار، تم عزل الخلايا الكيراتينية الأولية المعزولة عن جلد الفئران الظهرية وتصفيتها للحطام الخلوي باستخدام فلتر الخلايا. تم تسمية تعليق الخلايا الكيراتينية المعزولة مع الأجسام المضادة CD49f أو α6 integrin (PE) و CD34 (FITC) جنبا إلى جنب مع صبغة ميتة حية وغيرها من الضوابط. واستخدمت الأجسام المضادة للتحكم في نوع الأونوع (Rat IgG2akappa) لأغراض التعويض (انظر جدولالمواد). تم اختيار الخلايا الجذعية عن طريق CD49f (قناة PE)، التي اعترفت بالمكون الخارجي للهيمي-desmosomes وجدت على البشرة القاعدية وخلايا بصيلات الشعر، وCD34 (قناة FITC)، التي اعترفت الخلايا الجذعية بصيلات الشعر (أي CD34-FITC+ وa6-PE+ (العمود الأيمن العلوي، المجموع 5٪). يظهر العمود الأيمن مجموعات الخلايا الكيراتينية المختلفة وهي CD34-FITC فقط، CD34-FITC وخلايا a6-PE (مجموعة الخلايا الجذعية الإيجابية المزدوجة)، a6-PE فقط، والخلايا غير الملطخة. لاحظ أن هناك اثنين CD34+ مجموعات الخلايا الجذعية كما تم الإبلاغ عن6،14. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مقارنة بين أربع وسائط مختلفة بشأن الثقافات الأولية للخلايا الجلدية من الفئران الإناث البالغات. تم عزل الخلايا الكيراتينية الأولية من جلد الفئران الظهرية وتحسب للبذر باستخدام أربعة وسائل إعلام مختلفة (KGM، SFM، ويلم-E وموريس-2). تم زرع أعداد متساوية من الخلايا الكيراتينية واتبعها لشكلها العام ونمط النمو. لاحظ أن الخلايا الكيراتينية المنتشرة لها مورفولوجيات مختلفة قليلاً. KGM، SFM، وموريس-2 كلها هي انخفاض وسائل الإعلام الكالسيوم لديها النمو أقوى بعد أربعة عشر يوما. في المقابل، لا تستمر الخلايا عندما يتم التزراع في ويليامز E المتوسطة التي لديها 1.4 مليون كالسيوم ونسبة عالية من البوتاسيوم إلى الصوديوم. من المستغرب, وليامز E المتوسطة مع المكملات الغذائية وعشرين في المئة المصل البقري الجنيني يدعم الثقافات clonal الكيراتينية أفضل بكثير من أي وسيلة أخرى اختبارها, ربما لأن المتوسط وليامز E المخصب يساعد الخلايا المغذية 3T3 على "تغذية" أفضل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الحلول والإعلام | تعليقات |
| حلول الحصاد | |
| 2.5٪ تريبسين (5 مل) | |
| [دولبكو] [ببس] (500 [مل]) | |
| جنتاميسين (2 مل) | |
| PBS مع 2X جنتاميسين (45 مل) | |
| ملحي مُسَّاب بالفوسفات (PBS) مع جنتاميسين 2x | |
| محلول التربسين | |
| حلول زراعة الخلايا | |
| بيوركول فيبرونيكتين طبق طلاء الحل: | |
| 1 م هيبس (1 مل) | |
| 116 مليون متر CaCl2 (1 مل) | |
| الزلال المصل البقري 1.0 ملغ/ مل (10 مل) | |
| خلية ثقافة متوسّطة (100 [مل]) | |
| فيبرونيكتين (1 ملغ) | |
| بيوركول كولاجين (1 مل) | |
| حل تجميد الخلايا | |
| DMSO (2 مل) | |
| DMEM مع 10٪ BCS والقلم العقدية | |
| حصاد متوسط | يجب أن يكون بدون كالسيوم |
| 2x جنتاميسين (1 مل) | |
| FBS (50 مل) | |
| الملايين والمتوسطة الحجم (500 مل) | |
| عالية الكالسيوم وليامز 'E وسائل الإعلام مع: | |
| EGF (5 ميكروغرام/مل) 1 مل | |
| الجلوتامين 14.5 مل | |
| هيدروكورتيزون (1 ملغ / مل) 0.5 مل | |
| الأنسولين 1 مل | |
| لينوسيد-BSA (0.1 ملغ / مل) 0.5 مل | |
| MEM Ess AminoAcids 4 مل | |
| MEM فيتامينات 5 مل | |
| البنسلين-ستربيتميوسين 5 مل | |
| ترانسفيرين (5 ملغ/ مل) 1 مل | |
| Vit A (1 مغ/1000 ميكرولتر) 57.5 ميكرولتر | |
| Vit E 1 ملغ / مل (4 درجة مئوية) 3.5 درجة مئوية | |
| Vit D2 (10 ملغ / مل) 50 درجة مئوية | |
| 3T3 الليفية النمو الكامل المتوسطة (CGM) | |
| BCS (100 مل) | |
| DMEM (900 مل) | |
| البنسلين-ستربيميتاسين (10 مل) | |
| KGM | المتوسط المستخدم للزراعة الجماهيرية هو انخفاض وسط الكالسيوم |
| موريس 2 المتوسطة مع نفس المكملات الغذائية كما وليامز 'E | انخفاض الكالسيوم البديل من وليامز E مع المكملات الغذائية |
الجدول 1: الحلول وصفات الوسائط.
Discussion
تم تطوير طريقة حصاد الخلايا الكيراتينية الموصوفة هنا لإنتاج غلة عالية من الخلايا الجلدية الأولية القابلة للزراعة للغاية من الجزء الخلفي من الفئران الإناث البالغات. هذه الخلايا الكيراتينية هي مناسبة لتدفق قياس الخلايا، وتطبيق البيولوجيا الجزيئية، وثقافة الخلية الأولية، بما في ذلك القول الكلوجيني ذكر هنا. هذه الطريقة حصاد الخلايا الكيراتينية كانت مفيدة أيضا لدراسة الجوانب الأخرى المصب من السرطنة الكيميائية الجلدية وتعزيز الورم1،13.
هناك عدة خطوات حاسمة في البروتوكول. أولا، لصرامة واستنساخ، واستخدمت الفئران الإناث من سن 54 ± 2 أيام. وقد مكننا ذلك من إجراء عمليات اختبار مستعمرة حساسة وكمية من سلالات متعددة من الفئران واستخدامها كنمط فينوتاي في تحليل الربط مما يؤدي إلى تحديد جين تنظيمي جديد واحد على الأقل من الخلايا الجذعية10و11 . ثانيا، فمن المفيد لقطع الجلود إلى قطع أصغر، كما التربسينيهو أكثر فعالية من محاولة للحفاظ على الجلد كله. ثالثا، الوقت ودرجة الحرارة من التعويم التربسين مهم جدا للculturability اللاحقة. وعلاوة على ذلك، يحتاج المرء إلى "كزة إلى حد كبير" في الشعر المتبقية على مرشح لطرد الخلايا المرفقة. هذه الخطوة مهمة للحصول على عوائد عالية من الخلايا. وعلاوة على ذلك، فإن درجة حرارة الحاضنة البالغة 32 درجة مئوية مهمة لزراعة الخلايا الكيراتينية على المدى الطويل من الفئران البالغة. وأخيرا، في هذا البروتوكول، تستند التلاوة المتوازية للتجارب في المختبر وفي الجسم الحي1 إلى الثقافات الأولية بدلا من الثقافات الفرعية أو خطوط الخلايا. وتجدر الإشارة إلى أنه إذا كان حصاد الخلايا الكيراتينية الأولية لأول مرة باستخدام هذا البروتوكول، والحفاظ على الأدمة المتبقية بعد كشط لتأكيد الإزالة الكاملة لبصيلات الشعر جنبا إلى جنب مع البشرة عن طريق الملاحظة الأنسجة المرضية.
القوة الرئيسية لهذا البروتوكول لحصاد الخلايا الكيراتينية الماوس الكبار هو أنه ينتج عوائد عالية من الخلايا القابلة للزراعة التي هي مناسبة للعديد من التطبيقات المصب. الحد الرئيسي هو أن بعض النعوت سطح الخلية قد تكون حساسة للتريبسينت بحيث قد تتعرض لتلطيخ المناعة للخطر. لذلك، عند اختبار جسم مضاد سطح خلية جديدة، قد يكون من الحكمة استخدام ديسباس6 أو ثيرموليسين5 طريقة قائمة للحصاد للمقارنة. أهمية هذا البروتوكول هو أنه قد تم اختباره بدقة، وكمي، وتطبيقها على هذهالتطبيقات المتنوعة كما اختبارات للخلايا الجذعية clonogenic 1،9،10،11،للثقافات الجماهيرية في الكيمياء الحيوية8، لفرز FACS في تحليل الخلايا الجذعية3،4، للبيولوجيا الجزيئية3،12، وللحمض النووي الريبي الجارية وتسلسل الحمض النووي الريبي.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وليس لدى أصحاب البلاغ أي اعتراف.
Materials
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue 1X in 0.9% saline | Life Technologies Gibco | 15250-061 | |
| 1 M HEPES Buffer | Sigma | H0887 | Sterile |
| 1.5-inch magnetic stir bar with pivot ring | Bel-Art, Wayne | 371101128 | in 2 oz Nalgene jar |
| 10 mL disposable pipettes | BD Falcon | 357551 | |
| 15 mL sterile conical tube | BD Falcon | 352097 | |
| 150 cm2 (T-150) culture flask | Corning | 430825 | |
| 2 mL Screw Cap Micro Tube Conical | Sarstedt | 72.608 | |
| 2 oz Nalgene jar | Thermo Fisher Scientific | 2118-0002 | 60 mL |
| 2.5% Trypsin solution 10X | Life Technologies Gibco | 15090-046 | |
| 225 cm2 (T-225) culture flask | Corning | 431082 | |
| 32 oz Nalgene Square Storage Bottles: PETG | Thermo Fisher Scientific | 2019-1000 | 1000 mL |
| 35-mm sterile culturing dish | Corning | 430165 | |
| 5 mL disposable pipets | BD Falcon | 357543 | |
| 50 mL sterile conicle tube | BD Falcon | 352098 | |
| 60-mm sterile culturing dish | Corning | 430166 | |
| 70% ethanol | |||
| 90-mm diameter Spectra Mesh filter, 74-µm pore size | Spectrum Laboratories | 145956 | |
| Antibiotics (penicillin-streptomycin) | Life Technologies Gibco | 15140-122 | |
| Bovine calf serum (BCS) | Thermo Fisher Scientific Hyclone | SH30073.03 | |
| Bovine serum albumin | BD Biosciences | 354331 | |
| CD34 Ram34 FITC conjugated antibody | BD Pharmingen | 553733 | |
| CD49f (alpha6-integrin, GOH3) PE conjugated antibody | BD Pharmingen | 555736 | |
| Cell Strainer, 70-µm sterile | BD Discovery Labware | 352350 | |
| Collagen, Bovine, Type I, 30mg | BD Biosciences | 354231 | |
| CoolCell Economical cell freezing container for 1 or 2 mL cryovials | Biocison | BCS-136PK | |
| Corning 2mL Polypropylene Cryogenic Vial, Self-Standing with Round Bottom | Corning | 430659 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D2650 | |
| Distilled Milli-Q water | made fresh; twice distilled reverse osmosis water | ||
| Dulbecco’s phosphate-buffered saline 1X, Ca2+ and Mg2+ free | Life Technologies Gibco | 14190-144 | Sterile |
| Dulbecco's Modified Eagle's Medium (DMEM) | ATCC | 30-2002 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Hyclone | SH 300070.03 | |
| Fibronectin | Sigma | F1141-5MG | |
| Fisherbrand 4 oz. Sterile Specimen Container | Fisher Scientific | 16-320-730 | |
| Gentamicin 50 mg/mL 10 | Life Technologies Gibco | 15750-060 | |
| KGM | Lonza | CC-3103 | |
| Nalgene “Mr. Frosty" cell freezer | Thermo Fisher Scientific | 5100-0001 | |
| Nalgene PC Straight-Side Wide-Mouth Jars, 16oz | Thermo Fisher Scientific | 2116-0500 | |
| No. 22 sterile stainless-steel blades | BD Bard-Parker | 371222 | |
| No. 4 scalpel handles | Biomedical Research Instruments | 26-1200 | In a cup with 70% ethanol |
| One pair of full-curve eye dressing forceps | Militex | 18-784 | In a cup with 70% ethanol |
| One pair of scissors | Biomedical Research Instruments | 25-1050 | In a cup with 70% ethanol |
| One pair of thumb dressing forceps | Militex | 6-4 | In a cup with 70% ethanol |
| Oster Pro-Cord/Cordless Trimmer no.40 blade | Jarden Consumer Solutions/Oster | 78997-010 | |
| Plastic Petri dish 100 mm X 20 mm sterile | Corning | 430167 | |
| Pyrex Brand Plain Stemless Glass Funnel | Corning | 6240-75 | |
| Rat IgG2akappa FITC isotype control antibody | BD Pharmingen | 553929 | |
| Rat IgG2akappa PE isotype control antibody | BD Pharmingen | 555844 | |
| SFM | Life Technologies Gibco | 10725-018 | |
| SMEM | Life Technologies Gibco | 11380-037 | |
| SMEM: Ca2+ and Mg2+ free minimal essential medium for suspension culture | Life Technologies Gibco | 11380-037 | |
| Square sterile plastic Petri dishes | BD Falcon | 351112 | |
| Swiss mouse 3T3 fibroblasts | ATCC | CCL-92 | used within 10 passages |
| Triadine; 10% Povidone-Iodine Prep Topical Solution, 16oz | Triad Group | 10-8216 | |
| VWR Plastic Petri dishes, sterile Space Saver 100 X 10 | VWR | 25384-324 | |
| Williams E Medium | Life Technologies Gibco | 12551-032 | |
| Ziploc bag |
References
- Morris, R. J., Tacker, K. C., Fischer, S. M., Slaga, T. J. Quantitation of primary in vitro clonogenic keratinocytes from normal adult murine epidermis, following initiation, and during promotion of epidermal tumors. Cancer Research. 48 (22), 6285-6290 (1988).
- Tani, H., Morris, R. J., Kaur, P. Enrichment for murine keratinocyte stem cells based on cell surface phenotype. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10960-10965 (2000).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nature Biotechnology. 22 (4), 411-417 (2004).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. Journal of Investigative Dermatology. 120 (4), 501-511 (2003).
- Redvers, R. P., Kaur, P. Serial cultivation of primary adult murine keratinocytes. Methods in Molecular Biology. 289, 15-22 (2005).
- Jensen, K. B., Driskell, R. R., Watt, F. M. Assaying proliferation and differentiation capacity of stem cells using disaggregated adult mouse epidermis. Nature Protocols. 5 (5), 898-911 (2010).
- Blacker, K. L., Williams, M. L., Goldyne, M. Mitomycin C-treated 3T3 fibroblasts used as feeder layers for human keratinocyte culture retain the capacity to generate eicosanoids. Journal of Investigative Dermatology. 89 (6), 536-539 (1987).
- Morris, R. J. . Procedure for harvesting epidermal cells from the dorsal epidermis of adult mice for primary cell culture in “high calcium” defined medium. , (1994).
- Wu, W. Y., Morris, R. J. Method for the harvest and assay of in vitro clonogenic keratinocytes stem cells from mice. Methods in Molecular Biology. 289, 79-86 (2005).
- Popova, N. V., Teti, K. A., Wu, K. Q., Morris, R. J. Identification of two keratinocyte stem cell regulatory loci implicated in skin carcinogenesis. Carcinogenesis. 24 (3), 417-425 (2003).
- Popova, N. V., Tryson, K. A., Wu, K. Q., Morris, R. J. Evidence that the keratinocyte colony number is genetically controlled. Experimental Dermatology. 11 (6), 503-508 (2002).
- Trempus, C. S., et al. Comprehensive microarray transcriptome profiling of CD34-enriched mouse keratinocyte stem cells. Journal of Investigative Dermatology. 127 (12), 2904-2907 (2007).
- Baer-Dubowska, W., Morris, R. J., Gill, R. D., DiGiovanni, J. Distribution of covalent DNA adducts in mouse epidermal subpopulations after topical application of benzo(a)pyrene and 7,12-dimethylbenz(a)anthracene. Cancer Research. 50 (10), 3048-3054 (1990).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118 (5), 635-648 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved