Method Article
Isolement des kératinocytes épidermiques de souris et de leur culture clonogène in vitro
Dans cet article
Résumé
L'objectif de ce protocole est d'isoler les kératinocytes épidermiques de la peau dorsale de souris adultes pour une variété d'applications en aval telles que la biologie moléculaire, la biochimie, le tri cellulaire activé par fluorescence et les utilisations in vitro primaires (p. ex., clonogènes kératinocytes).
Résumé
Le protocole décrit ici est une méthode fiable de récolte des kératinocytes primaires à partir de souris femelles adultes (54 à 2 jours) produisant environ 30 x 106 cellules viables par souris. Les kératinocytes adultes primaires de souris sont moissonnés de la peau dorsale des souris femelles. Les souris mâles (6 semaines) peuvent être utilisées pour la récolte des kératinocytes selon les exigences de l'expérience. Les souris euthanasiées sont rasées et stérilisées avec des lavages en série dans des solutions d'iode de povidone et d'éthanol (70% d'alcool). Après avoir désinfecté les souris, la peau dorsale est enlevée et la graisse et le muscle sous-cutanés sont enlevés avec un scalpel et jetés. Les peaux sont coupées en petits morceaux et traitées avec une légère, trypsinisation à basse température pour détacher le derme inférieur de l'épiderme. Les épidermises grattées sont agitées à basse vitesse, filtrées pour enlever les poils, comptées, et re-suspendues dans le milieu de culture. Cette méthode fournit une excellente suspension à cellule unique de cellules hautement culturables pour de nombreuses applications en aval.
Introduction
La peau des mammifères couvre tout le corps et remplit une multitude de fonctions (p. ex., une barrière physique primaire, une régulation de la température et la rétention d'humidité). Au cours des cinq dernières décennies, la recherche fondamentale sur la peau de souris a donné de nouvelles informations sur la structure et la fonction de la peau. Le modèle de peau de souris a grandement aidé à comprendre la biologie de base derrière les mécanismes moléculaires complexes de la carcinogenèse chimique ou ultraviolette induite par rayonnement. Ces modèles de peau de souris ont fourni une contribution significative à la compréhension des maladies de peau humaine et de leur atténuation. Pour explorer davantage la dissection moléculaire des kératinocytes primaires dans la biologie du développement du follicule pileux, la recherche sur les cellules souches, la carcinogenèse et l'exploration génétique de l'épiderme, il est souvent souhaitable d'isoler et de culture épithéliale primaire kératinocytes de souris peau à utiliser en parallèle avec des expériences in vivo. Le facteur motivant dans le développement de cette méthode a été la nécessité d'un analyse in vitro pour les cellules souches épidermiques et pileux follicules clonogéniques1,2. Il y avait également un besoin urgent de suspensions de cellulessimples des cellules épidermiques appropriées pour des essais clonogènes 3, fluorescence activée tri de cellules, et cytométrie de flux3,4. Les avantages de cette méthode sont une récolte robuste augmenter un ordre de grandeur sur d'autres méthodes5,6, l'inclusion de la partie épithéliale des follicules pileux, et la grande culturabilité des cellules récoltées. Dans les années 1980, il n'y avait pas de méthodes connues qui pouvaient répondre à ces exigences. Dans les années suivantes, cette méthode a été raffinée pour augmenter le rendement cellulaire. La principale limitation de cette méthode serait le masquage de certains anticorps sensibles à la trypsine qui compromettraient l'immunoréactivité6.
Les souris ont reçu l'élevage selon les directives spécifiques sans pathogène. Une à cinq souris femelles de 54 à 2 jours ont été obtenues. Chez les souris plus âgées, la viabilité des kératinocytes sera réduite en raison de la phase anagène (croissance) du cycle capillaire. En outre, le processus de trypsinisation est plus difficile par rapport aux jeunes souris. La procédure de récolte a été optimisée avec succès pour la peau plus mince des souris femelles par rapport aux mâles. Les souris mâles ne sont généralement pas utilisées pour les récoltes de kératinocytes car elles ont tendance à se battre les unes avec les autres pendant le logement et peuvent donc laisser des égratignures ou des blessures sur la peau.
Protocole
Tous les protocoles d'utilisation des animaux vertébrés ont été approuvés par le Comité institutionnel de soins et d'utilisation des animaux de l'Université du Minnesota, conformément aux lignes directrices recommandées par les NIH et le gouvernement.
1. Initialisation et subculturing de couche d'alimentation
- Décongeler un flacon de cellules contenant la souris suisse congelée 3T3 du réservoir d'azote liquide en plaçant le flacon dans un bain d'eau de 37 oC pendant 1-2 min. Le nombre de cellules dans le flacon est d'environ 1 x 106.
- Retirez le flacon de la cellule 3T3 lorsque le dernier morceau de glace a fondu. Essuyez le tube avec un écouvillon d'alcool de 70 %. Ensuite, transférez le flacon dans un cabinet de biosécurité.
- Transférer les cellules lentement dans un flacon T-150, et rincer le flacon 3T3 avec 1 ml de milieu CGM. Ajouter lentement 30 ml de 3T3 de croissance complète (CGM) préréchauffée aux cellules. Bercez doucement le flacon pour répartir uniformément les cellules de fibroblaste 3T3. Étiquetez le flacon avec les détails de la ligne cellulaire, la date et le numéro de passage de façon appropriée.
- Incuber les cellules à 37 oC avec 5 % de CO2 et 95 % d'humidité.
REMARQUE: Selon l'ATCC, le temps de doublement de la souris suisse 3T3 est de 18 h; lorsque confluent (contact inhibé), la densité est d'environ 40 000 cellules par cm2. Nous utilisons une ligne particulière de 3T3 dans 10-15 passages après l'initialisation. Une croissance plus rapide ou la présence de cellules en forme de fuseau peut se produire à des passages plus élevés et est généralement un signe que le 3T3 ne fonctionnera pas aussi bien que les cellules d'alimentation pour les kératinocytes souris adultes. Si la croissance rapide se produit, il est préférable d'initier une nouvelle ligne à partir de cellules de passage inférieure. - Changer de support après 24 h pour enlever les cellules mortes et le DMSO restant (agent de cryoconservation), et deux fois par semaine par la suite. Permettre aux cellules de proliférer autour de 80% de confluence et utiliser des flacons T-150 pour l'initiation à la culture. Utilisez des flacons T-225 pour la sous-culture après l'initialisation.
- Pour sous-culture 3T3 cellules fibroblaste, retirer le flacon de l'incubateur de culture cellulaire et laver deux fois avec le froid stérile PBS (1x) avec de la gentamycine. Pipet 10 ml de solution de trypsine préréchauffée (bain d'eau à 37 oC) (0,25 %) dans chaque flacon T-225.
- Placer le flacon sur une plaque chauffante pendant 3-8 min. Retirez le flacon et utilisez délicatement les paumes pour tapoter les parois du flacon pour détacher les cellules et confirmer le détachement cellulaire sous microscope inversé. La solution de trypsine peut sembler trouble avec les cellules 3T3 détachées.
- Pipet la solution de trypsine 3-4x pour laver la surface de croissance cellulaire du flacon et transférer la cellule trypsinisée à 30 ml de CGM dans un tube conique de 50 ml. Relaver le flacon 3 à 5x avec 10 ml du mélange CGM-trypsin-cellule du tube conique de 50 ml.
REMARQUE: Le contenu de deux flacons peut être ajouté à un tube de 50 ml; si un seul flacon est utilisé, puis placer 10 ml de trypsine / cellules dans 20 ml de CGM dans un tube de 50 ml. - Centrifuger le tube conique de 50 ml à 160 x g pendant 7 min à 4 oC.
- Maintenant aspirer le supernatant et resuspendre le granule de cellule avec 5 ml de CGM, pipetting doucement 10x pour perturber complètement le granule de cellules. Ajouter 10 ml de CGM pour porter le volume total du tube conique de 50 ml à 15 ml.
- Mélanger à nouveau 10x et placer 5 ml de la suspension cellulaire dans 3 flacons T-150 séparés. Le rapport de sous-culture est de 1:3 dans les flacons T-225 ou de 1:4 dans les flacons T-150. Ajouter 30 ml de 3T3 CGM préréchauffé à chacun des flacons.
- Étiquetez le flacon avec le nom de la lignée cellulaire, la date de l'ensemencement des cellules et le numéro de passage.
- Pour congeler les cellules 3T3 après centrifugation dans l'étape de la sous-culture, retirez le tube de 50 ml de la centrifugeuse et placez-le sur un seau à glace. Aspirer le supernatant et resuspendre le granule cellulaire avec 1 ml de mélange DMSO-DMEM de 5 % (voir le tableau 1) pour chaque flacon récolté.
- Placer 1 ml de mélange DMSO-DMEM avec une suspension cellulaire dans chaque cryovial (un flacon cryovial par 3T3 récolté). Étiquetez le flacon avec le numéro de passage, le nom de la lignée cellulaire (3T3) et la date à laquelle les cellules ont été congelées.
- Placez ces flacons de cellules 3T3 dans le bocal du congélateur cellulaire (voir Tableau des matériaux)et transférez-les au congélateur de -70 oC pendant 5 h. Retirez et transférez les flacons du pot de congélation cellulaire et placez-les dans un réservoir de stockage d'azote liquide pour le stockage à long terme jusqu'à l'utilisation suivante. . Entrez des informations sur le nom de la lignée cellulaire, l'emplacement dans le réservoir et la date dans la feuille d'inventaire d'azote liquide de laboratoire.
2. Préparation de la couche d'alimentation 3T3 pour l'irradiation et l'ensemencement des rayons X
- Préparer les cellules 3T3 une semaine avant leur irradiation et leur permettre de croître de 100% de confluence. Les cellules 3T3 sont généralement dans les passages de 120 à 130.
-
Pour des essais clonogènes réussis des kératinocytes primaires, avant l'ensemencement des cellules 3T3, la surface recouvre les plats de Petri de 60 mm avec un collagène.
- Pipet autour de 2-3 ml de la solution de collagène-enrobage dans les plats Petri 60 mm pour enrober la surface inférieure et enlever l'excès de collagène-enrobage liquide (voir tableau 1). Transférer les plats Petri dans un incubateur de 37 oC avec 5 % de CO2 pour un minimum de 1 h. Ne laissez pas sécher la vaisselle dans un incubateur.
- Étape d'irradiation de rayon X : Suivez les étapes 1.4-1.6. Utilisez 50 ml de CGM frais pour suspendre à nouveau le granule de cellules, fermer le tube conique et sceller avec du film d'étanchéité à la paraffine. Pour éviter toute contamination, utilisez des sacs en plastique pour doubler le sac de la cellule scellée parlinthe contenant le tube et placer sur la glace. Une couche d'alimentation alternative à base de mitomycine peut être utilisée pour la culture des kératinocytes7.
-
Irradier les cellules fibroblaste 3T3 dans le tube conique de 50 ml avec une dose de 5 000 rads (50 Cgy) avec une machine à rayons X biologique. Irradier ces cellules avec le support CGM.
- Après l'irradiation des rayons X, les cellules centrifugeuses à 160 x g pendant 7 min à 4 oC. Aspirer le support supernatant et resuspendre doucement le granule de cellules avec 5 ml de CGM triturating doucement 10x. Maintenant, porter le volume final à 30 ml avec 25 ml supplémentaires de milieu et triturate 10x. Ces étapes trituantes sont cruciales pour la couche uniforme de fibroblaste 3T3 pour l'essai de clonogenicity.
- Comptage cellulaire viable : Comptez les kératinocytes à l'aide d'un hémocytomètre en verre régulier. Prendre environ 0,5 ml des cellules et les placer dans un tube de 1,5 ml. Enlever 200 l de mélange cellulaire et ajouter un volume égal de 0,4% de solution trypan bleu et le mélange 3-4x. Transférer les cellules avec un hémocytomètre et compter toutes les cellules nucléées (petites cellules dorées et roses) comme cellules viables. Calculer la concentration finale de cellules aurifères viables.
- Pipette 1 x 106 cellules 3T3 (un minimum de 7 x 105) cellules peuvent être utilisées) dans des plats Petri enrobés de collagène de 60 mm (étape 2.2) et ajouter doucement 4 ml de williams E à haute teneur en calcium modifiée (voir tableau 1). Laisser les cellules 3T3 fraîchement ensecastes se fixer pendant 24 h. Le lendemain, récoltez le kératinocyte primaire frais et ensemencez-les au-dessus de la couche de fibroblaste 3T3 ci-jointe pour l'assay clonogénique comme indiqué ci-dessous.
3. Récolte et ensemencement primaire de kératinocytes
- Euthanasier quatre à cinq souris femelles adultes par inhalation de CO2 selon les normes approuvées d'installation animale/IACUC. Cependant, ce protocole peut également être utilisé pour les souris femelles/mâles simples.
- Clip environ 9 cm2 de la fourrure dorsal avec une tondeuse pour animaux électrique et placer toutes les souris coupées dans un bocal de 500 ml avec assez de solution antiseptique à l'iode de povidone (pas de gommage) pour les couvrir pendant 1 x 2 min. Secouez bien le pot pour bien enrober uniformément l'antiseptique solution sur les souris.
- Verser la solution et rincer à l'eau propre jusqu'à ce que le liquide soit clair. Répétez le même lavage antiseptique suivi d'un rinçant à l'eau. Après le lavage antiseptique avec la solution d'iode, tremper toutes les souris dans l'éthanol de 70% pendant 5-10 min.
REMARQUE: Les souris à fourrure légère (p. ex. BALB/c) conserveront une légère couleur jaunâtre des lavages à l'iode antiseptique, tandis que les souris plus foncées (p. ex. C57BL/6) ne le feront pas. Notamment, la viabilité cellulaire ou la croissance de la culture n'est pas affectée en raison de la couleur jaune.
- Retirez soigneusement la peau dorsale coupée à l'aide de forceps du pouce et de ciseaux dans une hotte à flux laminaire. Placez la peau dorsal excisée dans un tube conique rempli de PBS/2x gentamycine. Évitez d'utiliser la peau latérale ventrale pour prévenir la contamination des cellules mammaires dans la culture.
- À l'aide de forceps autoclaved et d'un scalpel, placez une peau dorsale à la fois côté poilu vers le bas sur un plat petri mince. Commencez à gratter tous les tissus sous-cutanés, y compris la graisse du côté ventral du tissu cutané jusqu'à ce qu'il soit semi-translucide. Essayez d'enlever les traces maximales de tissu sous-cutané sans déchirer la peau (partie follicule pileux). Aussi, ne pas gratter pendant une longue période et éviter le séchage de la peau.
- Gardez la peau grattée dans la solution PBS jusqu'à ce que toutes les autres peaux restantes soient traitées. À l'aide d'un scalpel, couper les peaux en lanières de 0,5 cm x 1,5 cm et placer le côté poilu vers le haut sur un plat stérile Petri.
- Pipette 20 mL de solution PBS/2x Gentamicin mélangée à la trypsine (0,25%) dans un plat Petri en plastique de 100 mm x 20 mm. À l'aide de forceps stériles, transférer les peaux et les faire flotter côté poilu vers le haut sur la surface de la solution de trypsine pendant 2 h dans un incubateur de 32 oC.
REMARQUE : Le temps et la température de trypsinisation sont cruciaux pour le bon rendement des kératinocytes primaires fortement culturables. Bien que d'autres méthodes puissent fournir de bons rendements de cellules viables, la culturabilité des kératinocytes a été moins satisfaisante.- Pendant ce temps d'incubation de 2 h, enrober les plats d'un enrobage de collagène et les placer à 37 oC pendant 1 h (voir l'étape 3.1.2). Pour les essais clonogènes, les plats Petri de 60 mm ont déjà été enduits de 24 h avant la récolte des kératinocytes pour permettre à la couche d'alimentation 3T3 irradiée de se fixer au fond et de se propager uniformément.
REMARQUE: Le revêtement des plats de culture pour la culture clonogenic est très important pour l'attachement approprié, la formation de colonie, et la croissance/prolifération finale des kératinocytes épidermiques de souris.
- Pendant ce temps d'incubation de 2 h, enrober les plats d'un enrobage de collagène et les placer à 37 oC pendant 1 h (voir l'étape 3.1.2). Pour les essais clonogènes, les plats Petri de 60 mm ont déjà été enduits de 24 h avant la récolte des kératinocytes pour permettre à la couche d'alimentation 3T3 irradiée de se fixer au fond et de se propager uniformément.
- Étape de raclage épidermique : Disposer d'un plat stérile en plastique carré Petri et créer une surface à une pente de 30 degrés pour un raclage épidermique approprié avec 15 ml de milieu de récolte (voir tableau 1). Retirez soigneusement une bande de peau flottante de la solution de trypsine avec des forceps incurvés. Avec une nouvelle lame de scalpel, gratter l'épiderme et les poils dans le milieu.
- N'utilisez pas une force excessive, mais utilisez une force suffisante pour gratter l'épiderme, ou cela affectera la viabilité de la cellule.
- Pendant le grattage de l'épiderme, garder la lame perpendiculaire à la pièce de peau. Si la lame est inclinée vers le mouvement de la lame, il y a plus de chances de déchirure de la peau. Si la lame est inclinée loin du mouvement de la lame, il y a plus de chances d'élimination insuffisante de l'épiderme.
- Versez délicatement le support de récolte contenant des cellules épidermiques grattées dans un bocal stérile de 60 ml (autoclavable et réutilisable) avec une barre magnétique de 1,5 pouce. Rincer le plat Petri avec un milieu de récolte supplémentaire pour recueillir les cellules épidermiques restantes et porter le volume final à 30 ml. À l'emploi, utilisez un agitateur magnétique et remuer à 100 tr/min pendant 20 min à température ambiante. Ce processus permettra d'enlever les cellules épidermiques piégées des poils.
- Placer une passoire stérile à cellules de 70 m sur le dessus d'un tube conique de 50 ml. La passoire cellulaire s'adapte au-dessus d'un tube conique de 50 ml.
- Prenez le bocal à l'intérieur d'une hotte de biosécurité. Retirez la barre d'agitation et versez le contenu dans un filtre de passoire fixé à un tube conique de 50 ml. Filtrer les cheveux indésirables et les feuilles de cornée de la strate.
- Appuyez sur les poils avec des matériaux de cornée de strate dans la passoire et manipulez-les pour libérer les cellules ciliées emprisonnées. Utilisez 5 ml de milieu de récolte pour permettre aux cellules piégées restantes de se libérer et de s'écouler dans le tube. Apportez le volume total jusqu'à 50 ml dans le tube conique.
- Garnir le tube conique de 50 ml de filtrate cellulaire et de centrifugeuse à 160 x g pendant 7 min à 4 oC. Ensuite aspirer le supernatant et ajouter 5 ml de milieu de récolte. Resuspendre la pastille cellulaire en tritutant doucement 20x avec une tuyauterie de 5 ml.
- À cette étape, gardez les cellules dans une glacière pour éviter toute agrégation. Ajouter 25 ml de milieu de récolte et triturate à nouveau (20 à 25x).
- Pour assurer un nombre précis de kératinocytes à cette étape, prendre 1 ml de suspension cellulaire et ajouter 19 ml de milieu de récolte. Maintenant, la dilution cellulaire est de 1:20 dans 50 ml tube conique. Si les kératinocytes sont récoltés à partir d'une seule souris, ajustez le volume de la suspension cellulaire. Au lieu de 30 ml, utiliser 15 ml et faire une dilution de 1:10 pour compter les cellules.
- Pipet 0,5 ml de cellules diluées du tube conique de 50 ml (1:20 dilution) et transférer dans un tube microcentrifuge autoclaved de 1,5 ml. Retirez 0,2 mL (200 l) de mélange cellulaire dans un autre tube microcentrifuge de 1,5 ml et ajoutez un volume égal (200 l) de la solution bleu Trypan de 0,4 %. Mélangez délicatement cette solution 3x et transférez les cellules à un hémocytomètre pour compter les kératinocytes nucléés.
- Marquez toutes les cellules bleues foncées positives pour le bleu de Trypan en tant que cellules mortes non viables, et marquez de petites cellules d'or et de pinkish comme cellules viables. Le rendement final de kératinocyte par souris devrait être environ 30 millions de cellules viables.
- Centrifuger le tube conique d'origine de 50 ml (à partir de l'étape 3,8) pendant 7 min à 160 x g à 4 oC. À cette étape, resuspendre les cellules dans le milieu désiré et faire la dilution requise pour les cellules d'ensemencement.
- Pour la culture de masse, les semences de 2 à 4 millions de cellules aurifères viables dans chaque plat Petri de 35 mm dans le milieu de la culture cellulaire (médium de type KGM et suppléments pour les cultures monocouches) (voir tableau 1). Pour un exemple clonogénique (formation de colonie), les graines 1 000 cellules par plat Petri de 60 mm sur des couches d'alimentation 3T3 de souris suisses irradiées à rayons X avec enrobage de collagène et modification du milieu E de William avec suppléments et sérum.
- Utilisez un milieu total de 2 à 4 ml pour les plats Petri de 35 mm et 60 mm, respectivement. En outre, formuler DMEM et Williams E moyen obtenu auprès de l'ATCC avec des niveaux réduits de bicarbonate de sodium pour une utilisation à 5% CO2.
- Cultivez les cellules de culture (masse ou clonogène) à 32oC, 95 % d'humidité avec 5 % de CO 2. Changer les médias un jour après l'ensemencement initial pour la culture de masse, puis 3x hebdomadaire par la suite. Cependant, pour les essais clonaux, le premier changement moyen est de 2 jours après l'ensemencement cellulaire et de 3 fois par semaine par la suite.
- Pour la culture clonale, cultiver des cellules à intervalles de deux et quatre semaines. Après l'achèvement des cultures clonales (2 ou 4 semaines), aspirer le milieu. Fixer les colonies dans 10% de formaline tamponnée pendant la nuit à température ambiante et tacher avec 0,5% de rhodamine B dans l'eau autoclave pendant 1 h. Ensuite, retirer la tache de rhodamine B avec une pipette du bord de la vaisselle.
- Rincer les plats à l'eau froide et auto-claved jusqu'à ce que la vaisselle soit claire. Mettez les plats inclinés sur le couvercle de la vaisselle et laissez-les sécher pour le comptage final de la colonie. Notamment, lors de l'exécution de l'épistogène de la culture clonogenic, jamais pipet 'lt;1 mL de cellules. Si les cellules sont concentrées, diluer en série la concentration cellulaire.
Résultats
Typiquement, les rendements des kératinocytes épidermiques par souris allant de 20 x 106 à 30 x 106 Trypan bleu excluant les cellules sont obtenus8,9. La viabilité varie de 80% à 90%. L'efficacité typique de l'ensemencement est d'environ 30 % d'attachement à 24 h. La formation de colonies sur les couches d'alimentation 3T3 irradiées est d'environ 60 colonies pour 1 000 cellules viables ensemencées pour les souris C57BL/6, et d'environ 30 colonies pour 1 000 cellules pour les souris de type suisse10 ,11. Les résultats typiques des essais de formation des colonies sont illustrés à la figure 1. Le nombre de cellules souches follicules pileux est d'environ 9 % CD34et49f de cellules souches pour les souris C57BL/612. Les résultats typiques de la cytométrie du débit sont donnés à la figure 2.
Les caractéristiques de croissance de quatre médias différents sont illustrées à la figure 3. Les médias testés comprennent KGM-or, SFM, William's E medium et Morris-2 (un milieu calcique réduit développé dans le laboratoire Morris basé sur Williams E).
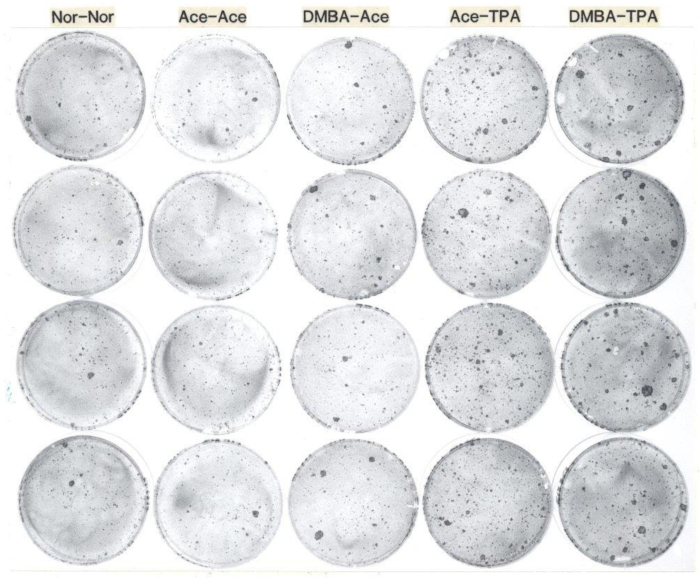
Figure 1 : Exemples représentatifs d'un exemple pour les kératinocytes clonogéniques de souris adultes. Cette photographie démontre la formation de colonie de kératinocytes des souris femelles CD-1 54 jours traités topiquement avec 1) aucun traitement, 2) acétone suivi une semaine plus tard par l'acétone deux fois par semaine pendant deux semaines, 3) DMBA suivi une semaine plus tard par l'acétone deux fois par semaine pendant deux semaines, 4) acétone suivi une semaine plus tard par TPA deux fois par semaine pendant deux semaines, et 5) DMBA suivi une semaine plus tard par TPA deux fois par semaine pendant deux semaines. Après leurs traitements in vivo, les kératinocytes ont été récoltés et enseisés à 1 000 cellules par plat sur des couches d'alimentation de 3T3 irradié, et cultivés pendant deux semaines, après quoi les plats ont été fixés avec de la formaline tamponnée et tachés de rhodamine B. Les plats de chaque colonne sont des répliques de chaque groupe de traitement de souris. Notez que le nombre de grandes colonies a augmenté lors du traitement avec DMBA, et le nombre total de colonies a augmenté le traitement de TPA des souris avant la récolte de kératinocyte. Abréviations: DMBA: 7,12-dimethylbenz[a]anthracene; TPA: 12-O-tetradecanoylphorbol-13-acetate. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
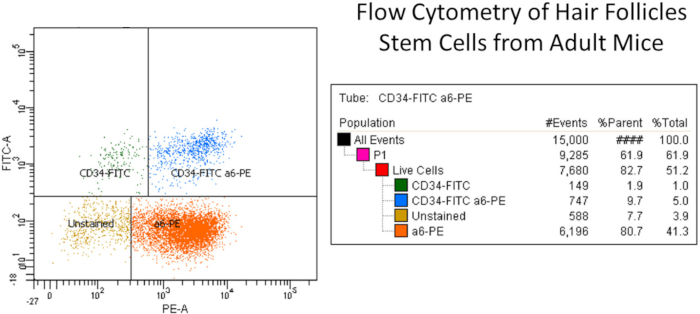
Figure 2 : Exemple représentatif de cytométrie du flux des cellules souches du follicule pileux provenant de souris adultes. En bref, les kératinocytes primaires isolés ont été isolés de la peau de souris dorsales et filtrés pour les débris cellulaires à l'aide du filtre cellulaire. La suspension isolée de kératinocyte a été étiquetée avec cD49f ou 6-integrin (PE) et CD34 (FITC) anticorps avec le colorant mort vivant et d'autres contrôles. Les anticorps anti-isotypes FITC et PE (Rat IgG2akappa) ont été utilisés à des fins de compensation (voir tableau des matériaux). Les cellules souches ont été sélectionnées au moyen de CD49f (canal PE), qui reconnaissait la composante externe des hémi-desmosomes trouvés sur les cellules épidermiques et pileuses basiques, et cD34 (canal FITC), qui reconnaissait les cellules souches du follicule pileux (c.-à-d. CD34-FITC. et a6-PE(colonne supérieure droite, total 5%).). La colonne latérale droite montre les différentes populations de kératinocytes, à savoir CD34-FITC seulement, CD34-FITC et a6-PE cellules (double population positive de cellules souches), a6-PE seulement, et les cellules non tachées. Notez qu'il y a deux populations de cellules souches CD34, comme cela a été signalé6,14. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Comparaison de quatre médias différents sur les cultures primaires des cellules épidermiques de souris femelles adultes. Les kératinocytes primaires ont été isolés de la peau des souris dorsales et comptés pour l'ensemencement à l'aide de quatre médias différents (KGM, SFM, Willem's-E et Morris-2). Des nombres égaux de kératinocytes ont été ensepépins et suivis pour leur morphologie générale et leur modèle de croissance. Notez que les kératinocytes proliférants ont des morphologies légèrement différentes. KGM, SFM, et Morris-2 qui sont tous les médias réduits de calcium ont la croissance la plus robuste après quatorze jours. En revanche, les cellules ne persistent pas lorsqu'elles sont cultivées dans le milieu Williams E qui a 1,4 mM de calcium et un rapport élevé de potassium au sodium. Étonnamment, Williams E milieu avec des suppléments et vingt pour cent de sérum bovin fœtal soutient les cultures clonales kératinocyte beaucoup mieux que tout autre milieu testé, probablement parce que le milieu enrichi Williams E aide les cellules d'alimentation 3T3 à «nourrir» mieux. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Solutions et médias | Commentaires |
| Solutions de récolte | |
| 2,5% trypsine (5 ml) | |
| PBS de Dulbecco (500 ml) | |
| Gentamycine (2 mL) | |
| PBS avec 2x gentamycine (45 ml) | |
| Saline tamponnée de phosphate (PBS) avec 2x gentamycine | |
| Solution Trypsin | |
| Solutions de culture cellulaire | |
| Solution de revêtement de vaisselle Purecol-fibronectin : | |
| 1 M HEPES (1 ml) | |
| 116 mM CaCl2 (1 ml) | |
| Albumine de sérum bovin 1,0 mg/mL (10 ml) | |
| Milieu de culture cellulaire (100 ml) | |
| Fibronectine (1 mg) | |
| Collagène Purcol (1 ml) | |
| Solution de congélation cellulaire | |
| DMSO (2 mL) | |
| DMEM avec 10% BCS et pen-strep | |
| Récolte moyenne | Doit être sans calcium |
| 2x gentamycine (1 ml) | |
| FBS (50 ml) | |
| SMEM (500 ml) | |
| High-Calcium Williams' E Media avec: | |
| EGF (5 g/mL) 1 mL | |
| Glutamine 14,5 ml | |
| Hydrocortisone (1 mg/ml) 0,5 ml | |
| Insuline 1 ml | |
| LinoAcid-BSA (0,1 mg/ml) 0,5 ml | |
| MEM Ess AminoAcides 4 mL | |
| Vitamines MEM 5 ml | |
| Pénicilline-Streptomycine 5 mL | |
| Transfert (5mg/mL) 1 mL | |
| Vit A (1 mg/1 000 l) 57,5 l | |
| Vit E 1 mg/mL (4 oC) 3,5 l | |
| Vit D2 (10 mg/mL) 50 l | |
| 3T3 fibroblaste milieu de croissance complet (CGM) | |
| BCS (100 ml) | |
| DMEM (900 ml) | |
| Pénicilline-streptomycine (10 ml) | |
| Kgm | Le milieu utilisé pour la culture de masse est un milieu de calcium réduit |
| Morris 2 milieu avec les mêmes suppléments que Williams' E | Une variante réduite de calcium de Williams E avec des suppléments |
Tableau 1 : Recettes de solution et de médias.
Discussion
La méthode de récolte de kératinocyte décrite ici a été développée pour produire des rendements élevés des kératinocytes épidermiques primaires fortement culturables du dos des souris femelles adultes. Ces kératinocytes sont appropriés pour la cytométrie de flux, l'application moléculaire de biologie, et la culture primaire de cellules, y compris l'essai clonogenic rapporté ici. Cette méthode de récolte de kératinocyte a également été utile pour étudier d'autres aspects en aval de la carcinogenèse chimique cutanée et de la promotion de tumeur1,13.
Il y a plusieurs étapes critiques dans le protocole. Tout d'abord, pour la rigueur et la reproductibilité, des souris femelles de l'âge 54 - 2 jours ont été employées. Cela nous a permis d'effectuer des analyses de colonies sensibles et quantitatives à partir de souches multiples de souris et de les utiliser comme phénotype dans l'analyse de liaison menant à l'identification d'au moins un nouveau gène de régulation des cellules souches10,11. Deuxièmement, il est utile de couper les peaux en petits morceaux, comme la trypsinisation est plus efficace que d'essayer de garder la peau entière. Troisièmement, le temps et la température de la flottaison trypsine est très important pour la culturabilité ultérieure. En outre, il faut "poke considérablement" sur les poils restant sur le filtre pour déloger les cellules attachées. Cette étape est importante pour obtenir des rendements élevés de cellules. De plus, la température de l'incubateur de 32 oC est importante pour la culture à long terme des kératinocytes à partir de souris adultes. Enfin, dans ce protocole, les résultats parallèles des expériences in vitro et in vivo1 sont basés sur des cultures primaires plutôt que sur des sous-cultures ou des lignées cellulaires. Notamment, si la récolte des kératinocytes primaires pour la première fois en utilisant ce protocole, garder le derme restant après le grattage pour confirmer l'enlèvement complet des follicules pileux avec l'épiderme par observation histopathologique.
La principale force de ce protocole pour la récolte des kératinocytes de souris adultes est qu'il produit des rendements élevés de cellules culturables qui conviennent à de nombreuses applications en aval. La principale limitation est que certaines épitopes de surface cellulaire peuvent être sensibles à la trypsinisation de telle sorte que l'immunostaining peut être compromise. Par conséquent, lors de l'essai d'un nouvel anticorps de surface cellulaire, il peut être prudent d'utiliser une méthode basée sur la dispase6 ou la thermolyse5 pour la récolte à des fins de comparaison. L'importance de ce protocole est qu'il a été rigoureusement testé, quantifié, et appliqué à des applications aussi diverses que les essais pour les cellules souches clonogéniques1,9,10,11, pour les cultures de masse en biochimie8, pour le tri FACS dans l'analyse des cellules souches3,4, pour la biologie moléculaire3,12, et pour le séquençage continu de l'ARN et de l'ADN.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs n'ont pas de reconnaissance.
matériels
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue 1X in 0.9% saline | Life Technologies Gibco | 15250-061 | |
| 1 M HEPES Buffer | Sigma | H0887 | Sterile |
| 1.5-inch magnetic stir bar with pivot ring | Bel-Art, Wayne | 371101128 | in 2 oz Nalgene jar |
| 10 mL disposable pipettes | BD Falcon | 357551 | |
| 15 mL sterile conical tube | BD Falcon | 352097 | |
| 150 cm2 (T-150) culture flask | Corning | 430825 | |
| 2 mL Screw Cap Micro Tube Conical | Sarstedt | 72.608 | |
| 2 oz Nalgene jar | Thermo Fisher Scientific | 2118-0002 | 60 mL |
| 2.5% Trypsin solution 10X | Life Technologies Gibco | 15090-046 | |
| 225 cm2 (T-225) culture flask | Corning | 431082 | |
| 32 oz Nalgene Square Storage Bottles: PETG | Thermo Fisher Scientific | 2019-1000 | 1000 mL |
| 35-mm sterile culturing dish | Corning | 430165 | |
| 5 mL disposable pipets | BD Falcon | 357543 | |
| 50 mL sterile conicle tube | BD Falcon | 352098 | |
| 60-mm sterile culturing dish | Corning | 430166 | |
| 70% ethanol | |||
| 90-mm diameter Spectra Mesh filter, 74-µm pore size | Spectrum Laboratories | 145956 | |
| Antibiotics (penicillin-streptomycin) | Life Technologies Gibco | 15140-122 | |
| Bovine calf serum (BCS) | Thermo Fisher Scientific Hyclone | SH30073.03 | |
| Bovine serum albumin | BD Biosciences | 354331 | |
| CD34 Ram34 FITC conjugated antibody | BD Pharmingen | 553733 | |
| CD49f (alpha6-integrin, GOH3) PE conjugated antibody | BD Pharmingen | 555736 | |
| Cell Strainer, 70-µm sterile | BD Discovery Labware | 352350 | |
| Collagen, Bovine, Type I, 30mg | BD Biosciences | 354231 | |
| CoolCell Economical cell freezing container for 1 or 2 mL cryovials | Biocison | BCS-136PK | |
| Corning 2mL Polypropylene Cryogenic Vial, Self-Standing with Round Bottom | Corning | 430659 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D2650 | |
| Distilled Milli-Q water | made fresh; twice distilled reverse osmosis water | ||
| Dulbecco’s phosphate-buffered saline 1X, Ca2+ and Mg2+ free | Life Technologies Gibco | 14190-144 | Sterile |
| Dulbecco's Modified Eagle's Medium (DMEM) | ATCC | 30-2002 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Hyclone | SH 300070.03 | |
| Fibronectin | Sigma | F1141-5MG | |
| Fisherbrand 4 oz. Sterile Specimen Container | Fisher Scientific | 16-320-730 | |
| Gentamicin 50 mg/mL 10 | Life Technologies Gibco | 15750-060 | |
| KGM | Lonza | CC-3103 | |
| Nalgene “Mr. Frosty" cell freezer | Thermo Fisher Scientific | 5100-0001 | |
| Nalgene PC Straight-Side Wide-Mouth Jars, 16oz | Thermo Fisher Scientific | 2116-0500 | |
| No. 22 sterile stainless-steel blades | BD Bard-Parker | 371222 | |
| No. 4 scalpel handles | Biomedical Research Instruments | 26-1200 | In a cup with 70% ethanol |
| One pair of full-curve eye dressing forceps | Militex | 18-784 | In a cup with 70% ethanol |
| One pair of scissors | Biomedical Research Instruments | 25-1050 | In a cup with 70% ethanol |
| One pair of thumb dressing forceps | Militex | 6-4 | In a cup with 70% ethanol |
| Oster Pro-Cord/Cordless Trimmer no.40 blade | Jarden Consumer Solutions/Oster | 78997-010 | |
| Plastic Petri dish 100 mm X 20 mm sterile | Corning | 430167 | |
| Pyrex Brand Plain Stemless Glass Funnel | Corning | 6240-75 | |
| Rat IgG2akappa FITC isotype control antibody | BD Pharmingen | 553929 | |
| Rat IgG2akappa PE isotype control antibody | BD Pharmingen | 555844 | |
| SFM | Life Technologies Gibco | 10725-018 | |
| SMEM | Life Technologies Gibco | 11380-037 | |
| SMEM: Ca2+ and Mg2+ free minimal essential medium for suspension culture | Life Technologies Gibco | 11380-037 | |
| Square sterile plastic Petri dishes | BD Falcon | 351112 | |
| Swiss mouse 3T3 fibroblasts | ATCC | CCL-92 | used within 10 passages |
| Triadine; 10% Povidone-Iodine Prep Topical Solution, 16oz | Triad Group | 10-8216 | |
| VWR Plastic Petri dishes, sterile Space Saver 100 X 10 | VWR | 25384-324 | |
| Williams E Medium | Life Technologies Gibco | 12551-032 | |
| Ziploc bag |
Références
- Morris, R. J., Tacker, K. C., Fischer, S. M., Slaga, T. J. Quantitation of primary in vitro clonogenic keratinocytes from normal adult murine epidermis, following initiation, and during promotion of epidermal tumors. Cancer Research. 48 (22), 6285-6290 (1988).
- Tani, H., Morris, R. J., Kaur, P. Enrichment for murine keratinocyte stem cells based on cell surface phenotype. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10960-10965 (2000).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nature Biotechnology. 22 (4), 411-417 (2004).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. Journal of Investigative Dermatology. 120 (4), 501-511 (2003).
- Redvers, R. P., Kaur, P. Serial cultivation of primary adult murine keratinocytes. Methods in Molecular Biology. 289, 15-22 (2005).
- Jensen, K. B., Driskell, R. R., Watt, F. M. Assaying proliferation and differentiation capacity of stem cells using disaggregated adult mouse epidermis. Nature Protocols. 5 (5), 898-911 (2010).
- Blacker, K. L., Williams, M. L., Goldyne, M. Mitomycin C-treated 3T3 fibroblasts used as feeder layers for human keratinocyte culture retain the capacity to generate eicosanoids. Journal of Investigative Dermatology. 89 (6), 536-539 (1987).
- Morris, R. J. . Procedure for harvesting epidermal cells from the dorsal epidermis of adult mice for primary cell culture in “high calcium” defined medium. , (1994).
- Wu, W. Y., Morris, R. J. Method for the harvest and assay of in vitro clonogenic keratinocytes stem cells from mice. Methods in Molecular Biology. 289, 79-86 (2005).
- Popova, N. V., Teti, K. A., Wu, K. Q., Morris, R. J. Identification of two keratinocyte stem cell regulatory loci implicated in skin carcinogenesis. Carcinogenesis. 24 (3), 417-425 (2003).
- Popova, N. V., Tryson, K. A., Wu, K. Q., Morris, R. J. Evidence that the keratinocyte colony number is genetically controlled. Experimental Dermatology. 11 (6), 503-508 (2002).
- Trempus, C. S., et al. Comprehensive microarray transcriptome profiling of CD34-enriched mouse keratinocyte stem cells. Journal of Investigative Dermatology. 127 (12), 2904-2907 (2007).
- Baer-Dubowska, W., Morris, R. J., Gill, R. D., DiGiovanni, J. Distribution of covalent DNA adducts in mouse epidermal subpopulations after topical application of benzo(a)pyrene and 7,12-dimethylbenz(a)anthracene. Cancer Research. 50 (10), 3048-3054 (1990).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118 (5), 635-648 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon