Method Article
Isolierung von Maus epidermalen Keratinozyten und ihrer In-Vitro-Clonogenen Kultur
In diesem Artikel
Zusammenfassung
Ziel dieses Protokolls ist es, epidermale Keratinozyten aus der dorsalen Haut erwachsener Mäuse für eine Vielzahl nachgelagerter Anwendungen wie Molekularbiologie, Biochemie, Fluoreszenzaktivierte Zellsortierung und primäre In-vitro-Anwendungen (z. B. clonogene Keratinozyten).
Zusammenfassung
Das hier beschriebene Protokoll ist eine zuverlässige Methode zur Ernte primärer Keratinozyten von erwachsenen weiblichen Mäusen (54 x 2 Tage alt), die etwa 30 x 106 lebensfähige Zellen pro Maus ergeben. Primäre erwachsene Maus Keratinozyten werden aus der rückenden Haut von weiblichen Mäusen geerntet. Männliche Mäuse (ca. 6 Wochen alt) können je nach den Anforderungen des Experiments zur Keratinozytenernte verwendet werden. Euthanisierte Mäuse werden mit seriellen Washes in Povidon-Jod- und Ethanollösungen (70% Alkohol) rasiert und sterilisiert. Nach der Desinfektion der Mäuse wird die Rückenhaut entfernt und das unterkutane Fett und der Muskel mit einem Skalpell entfernt und entsorgt. Die Häute werden in kleine Stücke geschnitten und mit einer leichten, niedertemperaturigen Trypsinisierung behandelt, um die untere Dermis von der Epidermis zu lösen. Die abgekratzten Epidermisen werden mit niedriger Geschwindigkeit gerührt, gefiltert, um die Haare zu entfernen, gezählt und im Kulturmedium wieder aufgehängt. Diese Methode bietet eine ausgezeichnete Einzelzellsuspension hochkultiierbarer Zellen für viele nachgeschaltete Anwendungen.
Einleitung
Säugetierhaut bedeckt den gesamten Körper und erfüllt eine Vielzahl von Funktionen (z. B. eine primäre physikalische Barriere, Temperaturregulierung und Feuchtigkeitsretention). In den letzten fünf Jahrzehnten hat die Grundlagenforschung zur Maushaut neue Informationen über die Struktur und Funktion der Haut gebracht. Das Maushautmodell hat sehr dazu beigetragen, die grundlegende Biologie hinter den komplexen molekularen Mechanismen der chemischen oder ultravioletten Strahlung-induzierten Karzinogenese zu verstehen. Diese Maushautmodelle leisteten einen wesentlichen Beitrag zum Verständnis menschlicher Hautkrankheiten und ihrer Abschwächung. Um die weitere molekulare Zerlegung der primären Keratinozyten in der Haarfollikelentwicklungsbiologie, Der Stammzellforschung, der Karzinogenese und der genetischen Erforschung der Epidermis zu untersuchen, ist es häufig wünschenswert, primäre Epithel zu isolieren und zu kulturieren. Keratinozyten aus der Mäusehaut parallel zu In-vivo-Experimenten zu verwenden. Der motivierende Faktor bei der Entwicklung dieser Methode war die Notwendigkeit eines In-vitro-Assays für clonogene epidermale und Haarfollikel-Stammzellen1,2. Es bestand auch ein dringender Bedarf an einzelzelligen Suspensionen von epidermalen Zellen, die für clonogene Assays3, fluoreszenzaktivierte Zellsortierung und Durchflusszytometrie3,4geeignet sind. Die Vorteile dieser Methode sind eine robuste Ernteerhöhung um eine Größenordnung gegenüber anderen Methoden5,6, Einbeziehung des Epithelanteils der Haarfollikel und die hohe Kultiumbarkeit der geernteten Zellen. In den 1980er Jahren gab es keine bekannten Methoden, die diese Anforderungen erfüllen konnten. In den folgenden Jahren wurde diese Methode verfeinert, um die Zellausbeute zu erhöhen. Die Hauptbeschränkung dieser Methode wäre die Maskierung einiger Trypsin-empfindlicher Antikörper, die die Immunreaktivität beeinträchtigen würden6.
Die Mäuse wurden nach den spezifischen pathogenfreien Richtlinien gemanak. Ein bis fünf weibliche Mäuse im Alter von 54 bis 2 Tagen wurden gewonnen. Bei älteren Mäusen wird die Lebensfähigkeit von Keratinozyten aufgrund der Anagenphase (Wachstum) des Haarzyklus reduziert. Auch der Prozess der Trypsinisierung ist schwieriger im Vergleich zu jungen Mäusen. Das Ernteverfahren wurde erfolgreich für die dünnere Haut weiblicher Mäuse im Vergleich zu männlichen Mäusen optimiert. Männliche Mäuse werden in der Regel nicht für Keratinozytenernten verwendet, da sie eine Tendenz haben, während des Gehäuses miteinander zu kämpfen und daher Kratzer oder Wunden auf der Haut hinterlassen können.
Protokoll
Alle Protokolle zur Verwendung von Wirbeltieren wurden vom Institutional Animal Care and Use Committee der University of Minnesota in Übereinstimmung mit den empfohlenen NIH- und Regierungsrichtlinien genehmigt.
1. Feeder-Layer-Initialisierung und Subkultivierung
- Eine Zelldurchstechflasche mit gefrorener Schweizer Maus 3T3 aus dem flüssigen Stickstofftank auftauen, indem Sie die Durchstechflasche 1-2 min in ein 37 °C-Wasserbad legen. Die Anzahl der Zellen in der Durchstechflasche beträgt ca. 1 x 106.
- Entfernen Sie die 3T3-Zell-Durchstechflasche, wenn der letzte Eissplitter geschmolzen ist. Wischen Sie die Röhre mit einem 70% Alkoholabstrich ab. Dann übertragen Sie die Durchstechflasche in einen Biosicherheitsschrank.
- Übertragen Sie die Zellen langsam in einen T-150-Kolben und spülen Sie die 3T3-Durchstechflasche mit 1 ml CGM-Medium ab. Fügen Sie den Zellen langsam 30 ml vorgewärmtes 3T3 Complete Growth Medium (CGM) hinzu. Den Kolben sanft schaukeln, um die 3T3-Fibroblastenzellen gleichmäßig zu verteilen. Beschriften Sie den Kolben mit Zellenliniendetails, Datum und Durchgängenentsprechend.
- Inkubieren Sie die Zellen bei 37 °C mit 5% CO2 und 95% Luftfeuchtigkeit.
HINWEIS: Laut ATCC beträgt die Verdoppelungszeit der Schweizer Maus 3T3 18 h; wenn konfluent (Kontakt gehemmt), beträgt die Dichte etwa 40.000 Zellen pro cm2. Wir verwenden eine bestimmte Linie von 3T3 innerhalb von 10-15 Passagen nach der Initialisierung. Schnelleres Wachstum oder das Vorhandensein von spindelförmigen Zellen kann an höheren Passagen auftreten und ist in der Regel ein Zeichen dafür, dass der 3T3 nicht so gut funktioniert wie Feederzellen für erwachsene Mauskeratinozyten. Wenn es zu einem schnellen Wachstum kommt, ist es besser, eine neue Linie aus unteren Durchgangszellen zu initiieren. - Medien nach 24 h wechseln, um abgestorbene Zellen und verbleibende DMSO (Kryokonservierungsmittel) zu entfernen, und zweimal wöchentlich danach. Lassen Sie Zellen etwa 80% Konfluzon vermehren und T-150-Flaschen für die Kulturinitiierung verwenden. Verwenden Sie T-225-Flaschen für Subkultur nach der Initialisierung.
- Um 3T3-Fibroblastenzellen zu subkulturieren, entfernen Sie den Kolben aus dem Zellkultur-Inkubator und waschen Sie zweimal mit kaltem sterilem PBS (1x) mit Gentamycin. Pipette 10 ml vorgewärmte (37 °C Wasserbad) Trypsinlösung (0,25%) in jeden T-225-Kolben.
- Legen Sie den Kolben für 3-8 min auf eine wärmende Platte. Entfernen Sie den Kolben und verwenden Sie sanft Handflächen, um die Wände des Kolbens zu erschließen, um Zellen zu lösen und die Zellablösung unter dem invertierten Mikroskop zu bestätigen. Die Trypsin-Lösung kann mit abgetrennten 3T3-Zellen trüb erscheinen.
- Pipetdieren Sie die Trypsin-Lösung 3–4x, um die Zellwachstumsfläche des Kolbens zu waschen und die Trypsinisierte Zelle in einem 50 ml konischen Rohr auf 30 ml CGM zu übertragen. Den Kolben 3–5x mit 10 ml der CGM-Trypsin-Zell-Mischung aus dem 50 ml konischen Rohr erneut waschen.
HINWEIS: Der Inhalt von zwei Kolbeninhalt kann zu einem 50 ml Rohr hinzugefügt werden; Wenn nur ein Kolben verwendet wird, dann 10 ml Trypsin/Zellen in 20 ml CGM in einem 50 ml Rohr platzieren. - Zentrifugieren Sie das 50 ml konische Rohr bei 160 x g für 7 min bei 4 °C.
- Nun den Überstand ansaugen und das Zellpellet mit 5 ml CGM wieder aufhängen, sanft um 10x pipetieren, um das Zellpellet vollständig zu stören. Fügen Sie 10 ml CGM hinzu, um das Gesamtvolumen des 50 ml konischen Rohres auf 15 ml zu erhöhen.
- Mischen Sie erneut 10x und legen Sie 5 ml der Zellsuspension in 3 separate T-150-Flaschen. Das Subkulturverhältnis beträgt 1:3 in T-225-Flaschen oder 1:4 in T-150-Flaschen. Fügen Sie 30 ml vorgewärmten 3T3 CGM zu jedem der Kolben hinzu.
- Beschriften Sie den Kolben mit dem Zellliniennamen, dem Datum der Zellaussaat und der Durchlaufnummer.
- Um 3T3-Zellen nach der Zentrifugierung im Subkulturschritt einzufrieren, entfernen Sie das 50 ml-Rohr aus der Zentrifuge und legen Sie es auf einen Eiskübel. Den Überstand ansaugen und das Zellpellet mit 1 ml 5% DMSO-DMEM-Mischung (siehe Tabelle 1) für jeden geernteten Kolben wieder aufsetzen.
- 1 ml DMSO-DMEM-Mischung mit Zellsuspension in jedes Kryovial geben (ein Kryovial pro geerntetem 3T3-Kolben). Beschriften Sie die Durchstechflasche mit der Durchlaufnummer, dem Zellliniennamen (3T3) und dem Datum, an dem die Zellen eingefroren wurden.
- Legen Sie diese 3T3-Zell-Fläschchen in das Zellgefrierglas (siehe Materialtabelle) und übertragen Sie sie für >5 h in einen Gefrierschrank von -70 °C. Entfernen und übertragen Sie die Durchstechflaschen vorsichtig aus dem Zellgefrierglas und legen Sie sie in einen Flüssigstickstoffspeicher für die Langzeitlagerung bis zum nächsten Gebrauch. . Geben Sie Informationen über den Namen der Zellenlinie, den Standort im Tank und das Datum im Labor-Inventarfürden für flüssigen Stickstoff ein.
2. Herstellung der 3T3 Feeder-Schicht für Röntgenbestrahlung und Seeding
- Bereiten Sie 3T3-Zellen eine Woche vor ihrer Bestrahlung vor und lassen Sie sie 100% Zusammenfluss wachsen. Die 3T3-Zellen befinden sich in der Regel innerhalb der Passagen von 120 bis 130.
-
Für erfolgreiche klonogene Assays von primären Keratinozyten, bevor 3T3-Zellen gesät werden, beschichten Sie die 60 mm Petrischalen mit einem Kollagen.
- Pipetten Sie ca. 2-3 ml der Kollagen-Beschichtungslösung in 60 mm Petrischalen, um die untere Oberfläche zu beschichten und die überschüssige Kollagenbeschichtungsflüssigkeit zu entfernen (siehe Tabelle 1). Die Petri-Gerichte auf einen 37 °C-Inkubator mit 5%CO2 für mindestens 1 h übertragen. Lassen Sie die Gerichte im Brutkasten nicht trocknen.
- Röntgenbestrahlungsschritt: Führen Sie die Schritte 1.4–1.6 aus. Verwenden Sie 50 ml frisches CGM, um das Zellpellet wieder aufzuhängen, das konische Rohr zu schließen und mit Paraffin-Dichtungsfolie abzudichten. Um verunreinigungen zu vermeiden, verwenden Sie Plastiktüten, um die paraffinversiegelte Zelle, die ein Rohr enthält, zu verdoppeln und auf Eis zu legen. Eine Mitomycin-basierte alternative Feederschicht kann für keratinozytenkultur7verwendet werden.
-
Bestrahlen Sie Fibroblast3-Zellen in der 50 ml konischen Röhre mit einer Dosis von 5.000 rads (50 Cgy) mit einem biologischen Röntgengerät. Bestrahlen Sie diese Zellen zusammen mit den CGM-Medien.
- Zentrifugenzellen nach Röntgenbestrahlung bei 160 x g 7 min bei 4 °C. Aspirieren Sie die überstandenen Medien und heben Sie das Zellpellet vorsichtig mit 5 ml CGM-Trituieren sanft um das 10-fache ab. Bringen Sie nun das Endvolumen auf 30 ml mit zusätzlichen 25 ml Medium und Triturat 10x. Diese Trituierungsschritte sind entscheidend für eine gleichmäßige 3T3-Fibroblastenschicht für clonogenen Test.
- Lebensfähige Zellzählung: Zählen Sie die Keratinozyten mit einem normalen Glashämozytometer. Nehmen Sie ca. 0,5 ml der Zellen und legen Sie sie in ein 1,5 ml Rohr. Entfernen Sie 200 l Zellmischung und fügen Sie ein gleiches Volumen von 0,4% Trypan blaue Lösung und Mischung 3–4x. Übertragen Sie Zellen mit einem Hämozytometer und zählen Sie alle nukleierten Zellen (kleine Gold- und rosa Zellen) als lebensfähige Zellen. Berechnen Sie die endgültige Konzentration lebensfähiger Goldzellen.
- Pipette 1 x 106 3T3 Zellen (mindestens 7 x 105) Zellen können verwendet werden) in 60 mm kollagenbeschichtete Petrischalen (Schritt 2.2) und sanft 4 ml modifizierte hochkalziumreiche Williams E-Medien hinzufügen (siehe Tabelle 1). Frisch gesäte 3T3-Zellen für 24 h anbringen lassen. Am nächsten Tag die frische primäre Keratinozyte ernten und auf der befestigten 3T3-Fibroblastenschicht für clonogene Assay saatieren, wie unten angegeben.
3. Primäre Keratinozyten-Ernte und -Saat
- Euthanisieren Sie vier bis fünf erwachsene weibliche Mäuse über CO 2-Inhalation nach zugelassenen Tieranlagen/IACUC-Standards. Dieses Protokoll kann jedoch auch für einzelne weibliche/männliche Mäuse verwendet werden.
- Clip ca. 9 cm2 des rückenden Fells mit einem elektrischen Tierknipser und legen Sie alle abgeschnittenen Mäuse in ein 500 ml Glas mit genügend Povidon Jod antiseptische Lösung (nicht Peeling), um sie für 1-2 min zu bedecken. Schütteln Sie das Glas gut, um die antiseptische Lösung über die Mäuse.
- Die Lösung abgießen und mit sauberem Wasser abspülen, bis die Flüssigkeit klar läuft. Wiederholen Sie die gleiche antiseptische Wäsche, gefolgt von einer Wasserspülung. Nach dem antiseptischen Waschen mit Jodlösung alle Mäuse in 70% Ethanol für 5–10 min einweichen.
HINWEIS: Mäuse mit hellem Fell (z.B. BALB/c) behalten eine leichte gelbliche Farbe von den antiseptischen Jodwass, während dunklere Mäuse (z. B. C57BL/6) dies nicht tun. Insbesondere ist die Zelllebensfähigkeit oder das Kulturwachstum aufgrund der gelben Farbe nicht beeinträchtigt.
- Entfernen Sie vorsichtig die abgeschnittene Rückenhaut mit Daumenzangen und Schere in einer laminaren Strömungshaube. Die ausgeschnittene Rückenhaut in konische Röhre mit PBS/2x Gentamycin gefüllt. Vermeiden Sie die Verwendung von ventraler Seitenhaut, um eine Kontamination der Brustzellen in der Kultur zu verhindern.
- Mit autoklavierten Zangen und einem Skalpell, legen Sie eine dorsale Haut zu einer Zeit behaarte Seite auf eine dünne Petrischale. Beginnen Sie, alle subkutanen Gewebe einschließlich Fett von der ventralen Seite des Hautgewebes zu kratzen, bis es halbtransluzent ist. Versuchen Sie, maximale Spuren von subkutanem Gewebe zu entfernen, ohne die Haut zu reißen (Haarfollikelteil). Auch nicht für eine lange Zeit kratzen und vermeiden Hauttrocknung.
- Die abgekratzte Haut in der PBS-Lösung aufbewahren, bis alle anderen verbleibenden Skins verarbeitet sind. Mit einem Skalpell die Schalen in 0,5 cm x 1–1,5 cm Streifen schneiden und die haarige Seite auf eine sterile Petrischale legen.
- Sorgfältige Pipette 20 ml PBS/2x Gentamicin Lösung gemischt mit Trypsin (0,25%) in eine 100 mm x 20 mm Kunststoff-Petrischale. Mit sterilen Zangen die Schalen übertragen und behaart seitlich auf die Oberfläche der Trypsinlösung für 2 h in einem 32 °C-Inkubator schweben lassen.
HINWEIS: Trypsinisierungszeit und -temperatur sind entscheidend für eine gute Ausbeute hochkultiverblicher Primärkeratinozyten. Obwohl andere Methoden gute Erträge lebensfähiger Zellen liefern können, war die Kultivierung der Keratinozyten weniger zufriedenstellend.- Während dieser 2 h Inkubationszeit Geschirr mit Kollagenbeschichtung beschichten und bei 37 °C für 1 h platzieren (siehe Schritt 3.1.2). Für klonogene Assays wurden die 60 mm Petrischalen bereits 24 h vor der Keratinozytenernte beschichtet, damit sich die bestrahlte 3T3-Feederschicht am Boden befestigen und gleichmäßig verteilen kann.
HINWEIS: Beschichtung von Kulturgerichten für klonogene Kultur ist sehr wichtig für die richtige Befestigung, Koloniebildung, und ultimatives Wachstum / Proliferation von Mäusen epidermale Keratinozyten.
- Während dieser 2 h Inkubationszeit Geschirr mit Kollagenbeschichtung beschichten und bei 37 °C für 1 h platzieren (siehe Schritt 3.1.2). Für klonogene Assays wurden die 60 mm Petrischalen bereits 24 h vor der Keratinozytenernte beschichtet, damit sich die bestrahlte 3T3-Feederschicht am Boden befestigen und gleichmäßig verteilen kann.
- Epidermaler Abkratzschritt: Ordnen Sie eine sterile kunststoffquadratische Petrischale an und schaffen Sie eine Oberfläche bei einer 30°-Neigung für das richtige epidermale Abkratzen mit 15 ml Erntemedium (siehe Tabelle 1). Entfernen Sie vorsichtig einen schwebenden Hautstreifen aus der Trypsin-Lösung mit gekrümmten Zangen. Mit einer neuen Skalpellklinge die Epidermis und die Haare ins Medium abkratzen.
- Verwenden Sie keine übermäßige Kraft, sondern verwenden Sie genügend Kraft, um die Epidermis zu kratzen, oder es wird die Zelllebensfähigkeit beeinträchtigen.
- Während epidermis Kratzen, halten Sie die Klinge senkrecht zum Hautstück. Wenn die Klinge zur Bewegung der Klinge abgewinkelt ist, gibt es mehr Chancen, dass die Haut reißt. Wenn die Klinge von der Klingenbewegung abgewinkelt ist, gibt es mehr Chancen auf eine unzureichende Entfernung der Epidermis.
- Gießen Sie das Erntemedium mit abgekratzten epidermalen Zellen vorsichtig in ein steriles 60 ml Glas (autoklavierbar und wiederverwendbar) mit einem 1,5 Zoll magnetischen Rührstab. Spülen Sie die Petrischale mit zusätzlichem Erntemittel, um die verbleibenden epidermalen Zellen zu sammeln und das Endvolumen auf 30 ml zu bringen. Verwenden Sie einen Magnetrührer und rühren Sie bei 100 Umdrehungen bei 20 min bei Raumtemperatur. Dieser Prozess wird die gefangenen epidermalen Zellen aus den Haaren entfernen.
- Legen Sie ein steriles 70-m-Zellsieb auf eine 50 ml konische Röhre. Das Zellsieb passt auf ein 50 ml kegelförmiges Rohr.
- Nehmen Sie das Glas in eine Biosicherheitshaube. Entfernen Sie die Rührstange und gießen Sie den Inhalt in den Siebfilter, der an einem 50 ml konischen Rohr befestigt ist. Unerwünschtes Haar und Blätter von Stratum corneum aussieren.
- Drücken Sie die Haare zusammen mit Stratum corneum Materialien innerhalb des Siebs und manipulieren Sie sie, um die gefangenen Haarzellen freizugeben. Verwenden Sie 5 ml Erntemedium, damit sich die verbleibenden eingeschlossenen Zellen lösen und in das Rohr fließen können. Bringen Sie das Gesamtvolumen auf 50 ml in konischem Rohr.
- Das 50 ml konische Rohr mit Zellfiltrat und Zentrifuge bei 160 x g für 7 min bei 4 °C verkapseln. Als nächstes den Überstand ansaugen und 5 ml Erntemedium hinzufügen. Setzen Sie das Zellpellet wieder auf, indem Sie mit einer 5 ml Pipette sanft 20x trituieren.
- Bewahren Sie in diesem Schritt die Zellen in einer Eisbox auf, um eine Aggregation zu vermeiden. 25 ml Erntemedium hinzufügen und erneut triturat (20–25x) hinzufügen.
- Um eine genaue Keratinozytenzahl bei diesem Schritt zu gewährleisten, nehmen Sie 1 ml Zellsuspension und fügen Sie 19 ml Erntemedium hinzu. Jetzt ist die Zellverdünnung 1:20 in 50 ml konischem Rohr. Wenn Keratinozyten von einer einzigen Maus geerntet werden, passen Sie das Volumen der Zellsuspension an. Anstelle von 30 ml 15 ml verwenden und eine Verdünnung von 1:10 für das Zählen der Zellen vornehmen.
- Pipetten Sie 0,5 ml verdünnte Zellen aus dem 50 ml konischen Rohr (1:20 Verdünnung) und übertragen sie in ein 1,5 ml autoklaviertes mikrozentrifugiertes Rohr. Entfernen Sie 0,2 ml (200 l) der Zellmischung in ein weiteres 1,5 ml Mikrozentrifugenrohr und fügen Sie ein gleiches Volumen (200 l) von 0,4% Trypan-Blaulösung hinzu. Mischen Sie diese Lösung 3x und übertragen Sie Zellen auf ein Hämozytometer zum Zählen von nukleatierten Keratinozyten.
- Erzielen Sie alle dunkelblauen Zellen positiv für Trypan blue als nicht lebensfähige tote Zellen und punkten Sie kleine Gold- und rosafarbene Zellen als lebensfähige Zellen. Die endgültige Keratinozytenausbeute pro Maus sollte bei etwa 30 Millionen lebensfähigen Zellen liegen.
- Zentrifugieren Sie das original e50 ml konische Rohr (ab Schritt 3.8) für 7 min bei 160 x g bei 4 °C. In diesem Schritt setzen Sie die Zellen im gewünschten Medium wieder aus und machen Sie die erforderliche Verdünnung für Säzellen.
- Für die Massenkultur samen 2 bis 4 Millionen lebensfähige Goldzellen in jeder 35 mm Petrischale im Zellkulturmedium (KGM-Typ Medium + Ergänzungen für Monolayer-Kulturen) (siehe Tabelle 1). Für einen clonogenen (Koloniebildung) Assay, Samen 1.000 Zellen pro 60 mm Petrischale auf röntgenbestrahlte Schweizer Maus 3T3 Feeder Schichten mit Kollagen-Beschichtung und modifiziert E-Medium von William mit Ergänzungen und Serum.
- Verwenden Sie insgesamt 2 bis 4 ml Medium für 35 mm bzw. 60 mm Petrischalen. Auch formulieren DMEM und Williams E Medium aus ATCC mit reduzierten Mengen an Natriumbicarbonat für den Einsatz bei 5%CO2beschafft.
- Wachsen Sie die Kulturzellen (Masse oder clonogene) bei 32 °C, 95% Luftfeuchtigkeit mit 5%CO2. Ändern Sie die Medien einen Tag nach der ersten Aussaat für Massenkultur, und dann 3x wöchentlich danach. Bei klonalen Assays beträgt die erste mittlere Veränderung jedoch 2 Tage nach der Zellaussaat und danach 3x wöchentlich.
- Für die klonale Kultur, kultivieren Sie Zellen in zwei- und vierwöchigen Intervallen. Nach Abschluss der klonalen Kulturen (2 oder 4 Wochen), aspirieren Sie das Medium. Fixieren Sie die Kolonien in 10% gepuffertem Formalin über Nacht bei Raumtemperatur und Flecken mit 0,5% Rhodamin B im Autoklavenwasser für 1 h. Dann entfernen Sie den Rhodamine B Fleck mit einer Pipette vom Rand des Geschirrs.
- Spülen Sie die Gerichte in kaltem autoklaven Wasser, bis die Gerichte klar laufen. Legen Sie die Gerichte geneigt auf den Deckel der Gerichte und lassen Sie sie trocknen für die endgültige Kolonie zählen. Bemerkenswert ist, dass bei der Durchführung clonogene Kultur-Assay, nie Pipetten <1 ml von Zellen. Wenn Zellen konzentriert sind, verdünnen Sie die Zellkonzentration seriell.
Ergebnisse
Typischerweise werden Erträge von epidermalen Keratinozyten pro Maus im Bereich von 20 x 106 bis 30 x 106 Trypan blau ohne Zellenerhalten 8,9. Die Lebensfähigkeit liegt zwischen 80%-90%. Typische Saatwirkungseffizienzen sind etwa 30% Aufsatz bei 24 h. Koloniebildung auf bestrahlten 3T3 Feederschichten beträgt etwa 60 Kolonien pro 1.000 lebensfähige Zellen, die für C57BL/6-Mäuse gesät wurden, und etwa 30 Kolonien pro 1.000 Zellen für Schweizer Mäuse10 ,11. Typische Ergebnisse von Koloniebildungstests sind in Abbildung 1dargestellt. Die Anzahl der Haarfollikel-Stammzellen beträgt ca. 9% CD34+/CD49f+ Stammzellen für C57BL/6-Mäuse12. Typische Ergebnisse der Durchflusszytometrie sind in Abbildung 2angegeben.
Die Wachstumsmerkmale von vier verschiedenen Medien sind in Abbildung 3dargestellt. Zu den getesteten Medien gehören KGM-gold, SFM, Williams E-Medium und Morris-2 (ein reduziertes Kalziummedium, das im Morris-Labor auf Basis von Williams E entwickelt wurde).
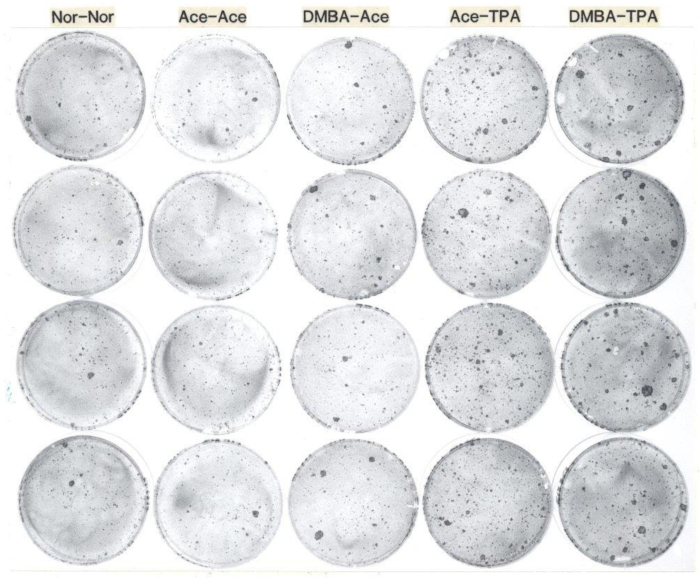
Abbildung 1: Repräsentative Beispiele aus einem Test für klonogene Keratinozyten von erwachsenen Mäusen. Dieses Foto zeigt die Keratinozytenkoloniebildung von CD-1-Mäusen im Alter von 54 Tagen, die topisch mit 1) ohne Behandlung behandelt wurden, 2) Aceton, gefolgt eine Woche später mit Aceton zweimal wöchentlich für zwei Wochen, 3) DMBA gefolgt eine Woche später mit Aceton zweimal wöchentlich für zwei Wochen, 4) Aceton folgte eine Woche später von TPA zweimal wöchentlich für zwei Wochen, und 5) DMBA folgte eine Woche später von TPA zweimal wöchentlich für zwei Wochen. Nach ihren In-vivo-Behandlungen wurden Keratinozyten geerntet und mit 1.000 Zellen pro Schale auf Feederschichten bestrahlten 3T3 gesät und zwei Wochen lang kultiviert, danach wurden die Gerichte mit gepuffertem Formalin fixiert und mit Rhodamin B befleckt. Die Gerichte in jeder Spalte sind Repliken aus jeder Mausbehandlungsgruppe. Beachten Sie, dass die Anzahl der größeren Kolonien nach der Behandlung mit DMBA zunahm und die Gesamtzahl der Kolonien die TPA-Behandlung der Mäuse vor der Keratinozytenernte erhöhte. Abkürzungen: DMBA: 7,12-dimethylbenz[a]anthracen; TPA: 12-O-Tetradecanoylphorbol-13-Acetat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
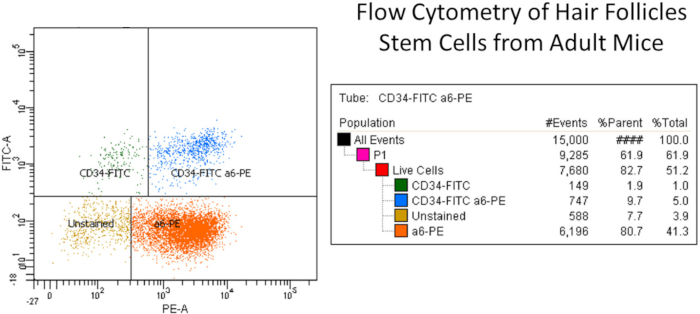
Abbildung 2: Repräsentatives Beispiel für die Durchflusszytometrie von Haarfollikelstammzellen von erwachsenen Mäusen. Kurz gesagt, die isolierten primären Keratinozyten wurden von der dorsalen Mäusehaut isoliert und mit Zellfiltern nach Zellablagerungen gefiltert. Die isolierte Keratinozytensuspension wurde zusammen mit lebenden toten Farbstoffen und anderen Kontrollen mit CD49f- oder 6-Integrin-Antikörpern (PE) und CD34 (FITC) gekennzeichnet. FITC- und PE-Isotyp-Kontrollantikörper (Rat IgG2akappa) wurden zur Kompensation eingesetzt (siehe Materialtabelle). Die Stammzellen wurden mittels CD49f (PE-Kanal) ausgewählt, der die äußere Komponente der Hemi-Desmosomen erkannte, die auf basalen epidermalen und Haarfollikelzellen gefunden wurden, und CD34 (FITC-Kanal), das die Haarfollikel-Stammzellen erkannte (d.h. CD34-FITC+ und a6-PE+ (obere rechte Spalte, insgesamt 5%)). Die rechte Seitenspalte zeigt die verschiedenen Keratinozytenpopulationen, nämlich nur CD34-FITC, CD34-FITC und a6-PE-Zellen (doppelte positive Stammzellpopulation), nur a6-PE und ungefärbte Zellen. Beachten Sie, dass es zwei CD34+ Stammzellpopulationen gibt, wie berichtet6,14. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Vergleich von vier verschiedenen Medien über Primärkulturen epidermaler Zellen von erwachsenen weiblichen Mäusen. Primäre Keratinozyten wurden von der dorsalen Mäusehaut isoliert und für die Aussaat mit vier verschiedenen Medien (KGM, SFM, Willem's-E und Morris-2) gezählt. Die gleiche Anzahl von Keratinozyten wurde gesät und für ihre allgemeine Morphologie und Ihr Wachstumsmuster befolgt. Beachten Sie, dass die sich ausbreitenden Keratinozyten leicht unterschiedliche Morphologien haben. KGM, SFM und Morris-2, die alle reduzierte Kalziummedien sind, haben das robusteste Wachstum nach vierzehn Tagen. Im Gegensatz dazu bleiben die Zellen nicht bestehen, wenn sie in Williams E-Medium kultiviert werden, das 1,4 mM Calcium und ein hohes Verhältnis von Kalium zu Natrium aufweist. Überraschenderweise unterstützt Williams E Medium mit Nahrungsergänzungsmitteln und zwanzig Prozent fetalem Rinderserum Keratinozyten-Klonalkulturen weit besser als jedes andere getestete Medium, wahrscheinlich weil das angereicherte Williams E Medium den 3T3-Feederzellen hilft, besser zu "füttern". Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Lösungen und Medien | Kommentare |
| Erntelösungen | |
| 2,5% Trypsin (5 ml) | |
| PBS von Dulbecco (500 ml) | |
| Gentamycin (2 ml) | |
| PBS mit 2x Gentamycin (45 ml) | |
| Phosphatgepufferte Saline (PBS) mit 2x Gentamycin | |
| Trypsin-Lösung | |
| Zellkulturlösungen | |
| Purecol-Fibronectin Schalenbeschichtungslösung: | |
| 1 M HEPES (1 ml) | |
| 116 mM CaCl2 (1 ml) | |
| Rinderserumalbumin 1,0 mg/ml (10 ml) | |
| Zellkulturmedium (100 ml) | |
| Fibronectin (1 mg) | |
| Purecol Kollagen (1 ml) | |
| Zellgefrierlösung | |
| DMSO (2 ml) | |
| DMEM mit 10% BCS und Stift-Strep | |
| Erntemedium | Muss ohne Kalzium sein |
| 2x Gentamycin (1 ml) | |
| FBS (50 ml) | |
| SMEM (500 ml) | |
| High-Calcium Williams' E Media mit: | |
| EGF (5 g/ml) 1 ml | |
| Glutamin 14,5 ml | |
| Hydrocortison (1 mg/ml) 0,5 ml | |
| Insulin 1 ml | |
| Linoacid-BSA (0,1 mg/ml) 0,5 ml | |
| MEM Ess Aminosäuren 4 ml | |
| MEM Vitamine 5 ml | |
| Penicillin-Streptomycin 5 ml | |
| Transferrin (5mg/ml) 1 ml | |
| Vit A (1 mg/1.000 l) 57,5 l | |
| Vit E 1 mg/ml (4°C) 3,5 l | |
| Vit D2 (10 mg/ml) 50 l | |
| 3T3 Fibroblast ent13 Gesamtwachstumsmedium (CGM) | |
| BCS (100 ml) | |
| DMEM (900 ml) | |
| Penicillin-Streptomycin (10 ml) | |
| Kgm | Medium, das für die Massenkultur verwendet wird, ist ein reduziertes Kalziummedium |
| Morris 2 Medium mit den gleichen Ergänzungen wie Williams' E | Eine reduzierte Kalziumvariante von Williams E mit Nahrungsergänzungsmitteln |
Tabelle 1: Lösungs- und Medienrezepte.
Diskussion
Die hier beschriebene Keratinozyten-Erntemethode wurde entwickelt, um hohe Erträge von hochkultivierbaren primären epidermalen Keratinozyten aus dem Rücken erwachsener weiblicher Mäuse zu produzieren. Diese Keratinozyten eignen sich für Diedurchflusszytometrie, molekularbiologische Anwendung und primäre Zellkultur, einschließlich des hier berichteten clonogenen Assays. Diese Keratinozyten-Erntemethode war auch nützlich für die Untersuchung anderer nachgelagerter Aspekte der kutanen chemischen Karzinogenese und Tumorförderung1,13.
Es gibt mehrere wichtige Schritte im Protokoll. Zunächst wurden für Strenge und Reproduzierbarkeit weibliche Mäuse im Alter von 54 bis 2 Tagen verwendet. Dies hat es uns ermöglicht, empfindliche und quantitative Kolonie-Assays von mehreren Stämmen von Mäusen durchzuführen und sie als Phänotyp in der Linkage-Analyse zu verwenden, was zur Identifizierung von mindestens einem neuen Stammzell-Regulierungsgen10,11führt. Zweitens ist es hilfreich, die Skins in kleinere Stücke zu schneiden, da die Trypsinisierung effektiver ist, als zu versuchen, die Haut ganz zu halten. Drittens ist die Zeit und Temperatur der Trypsinflotation sehr wichtig für die anschließende Kultivierung. Darüber hinaus muss man an den Aufstehenden der Haare , die auf dem Filter verbleiben, "erheblich poke", um die angeschlossenen Zellen zu vertreiben. Dieser Schritt ist wichtig, um hohe Ausbeuten von Zellen zu erhalten. Darüber hinaus ist die 32 °C-Temperatur des Inkubators wichtig für den längerfristigen Anbau von Keratinozyten von erwachsenen Mäusen. Schließlich basieren in diesem Protokoll die parallelen Auslesungen von In-vitro- und In-vivo-Experimenten1 auf Primärkulturen und nicht auf Subkulturen oder Zelllinien. Insbesondere, wenn Ernte primäre Keratinozyten zum ersten Mal mit diesem Protokoll, halten Sie die verbleibende Dermis nach dem Abkratzen, um die vollständige Entfernung von Haarfollikel zusammen mit Epidermis durch histopathologische Beobachtung zu bestätigen.
Die Hauptstärke dieses Protokolls für die Ernte von erwachsenen Mauskeratinozyten besteht darin, dass es hohe Erträge an kulturierbaren Zellen produziert, die für viele nachgelagerte Anwendungen geeignet sind. Die Hauptbeschränkung ist, dass einige Zelloberflächenepitope empfindlich auf Trypsinisierung reagieren können, so dass die Immunfärbung beeinträchtigt werden kann. Daher kann es beim Testen eines neuen Zelloberflächenantikörpers sinnvoll sein, eine Dispase-6- oder Thermolysin-5-basierte Methode zum Vergleich zu verwenden. Die Bedeutung dieses Protokolls besteht darin, dass es streng getestet, quantifiziert und auf so unterschiedliche Anwendungen wie Assays für klonogene Stammzellen1,9,10,11, für Massenkulturen angewendet wurde. in der Biochemie8, zur FACS-Sortierung in der Stammzellanalyse3,4, für Molekularbiologie3,12, und für laufende RNA- und DNA-Sequenzierung.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren haben keine Anerkennung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue 1X in 0.9% saline | Life Technologies Gibco | 15250-061 | |
| 1 M HEPES Buffer | Sigma | H0887 | Sterile |
| 1.5-inch magnetic stir bar with pivot ring | Bel-Art, Wayne | 371101128 | in 2 oz Nalgene jar |
| 10 mL disposable pipettes | BD Falcon | 357551 | |
| 15 mL sterile conical tube | BD Falcon | 352097 | |
| 150 cm2 (T-150) culture flask | Corning | 430825 | |
| 2 mL Screw Cap Micro Tube Conical | Sarstedt | 72.608 | |
| 2 oz Nalgene jar | Thermo Fisher Scientific | 2118-0002 | 60 mL |
| 2.5% Trypsin solution 10X | Life Technologies Gibco | 15090-046 | |
| 225 cm2 (T-225) culture flask | Corning | 431082 | |
| 32 oz Nalgene Square Storage Bottles: PETG | Thermo Fisher Scientific | 2019-1000 | 1000 mL |
| 35-mm sterile culturing dish | Corning | 430165 | |
| 5 mL disposable pipets | BD Falcon | 357543 | |
| 50 mL sterile conicle tube | BD Falcon | 352098 | |
| 60-mm sterile culturing dish | Corning | 430166 | |
| 70% ethanol | |||
| 90-mm diameter Spectra Mesh filter, 74-µm pore size | Spectrum Laboratories | 145956 | |
| Antibiotics (penicillin-streptomycin) | Life Technologies Gibco | 15140-122 | |
| Bovine calf serum (BCS) | Thermo Fisher Scientific Hyclone | SH30073.03 | |
| Bovine serum albumin | BD Biosciences | 354331 | |
| CD34 Ram34 FITC conjugated antibody | BD Pharmingen | 553733 | |
| CD49f (alpha6-integrin, GOH3) PE conjugated antibody | BD Pharmingen | 555736 | |
| Cell Strainer, 70-µm sterile | BD Discovery Labware | 352350 | |
| Collagen, Bovine, Type I, 30mg | BD Biosciences | 354231 | |
| CoolCell Economical cell freezing container for 1 or 2 mL cryovials | Biocison | BCS-136PK | |
| Corning 2mL Polypropylene Cryogenic Vial, Self-Standing with Round Bottom | Corning | 430659 | |
| Dimethyl sulfoxide (DMSO) | Sigma | D2650 | |
| Distilled Milli-Q water | made fresh; twice distilled reverse osmosis water | ||
| Dulbecco’s phosphate-buffered saline 1X, Ca2+ and Mg2+ free | Life Technologies Gibco | 14190-144 | Sterile |
| Dulbecco's Modified Eagle's Medium (DMEM) | ATCC | 30-2002 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Hyclone | SH 300070.03 | |
| Fibronectin | Sigma | F1141-5MG | |
| Fisherbrand 4 oz. Sterile Specimen Container | Fisher Scientific | 16-320-730 | |
| Gentamicin 50 mg/mL 10 | Life Technologies Gibco | 15750-060 | |
| KGM | Lonza | CC-3103 | |
| Nalgene “Mr. Frosty" cell freezer | Thermo Fisher Scientific | 5100-0001 | |
| Nalgene PC Straight-Side Wide-Mouth Jars, 16oz | Thermo Fisher Scientific | 2116-0500 | |
| No. 22 sterile stainless-steel blades | BD Bard-Parker | 371222 | |
| No. 4 scalpel handles | Biomedical Research Instruments | 26-1200 | In a cup with 70% ethanol |
| One pair of full-curve eye dressing forceps | Militex | 18-784 | In a cup with 70% ethanol |
| One pair of scissors | Biomedical Research Instruments | 25-1050 | In a cup with 70% ethanol |
| One pair of thumb dressing forceps | Militex | 6-4 | In a cup with 70% ethanol |
| Oster Pro-Cord/Cordless Trimmer no.40 blade | Jarden Consumer Solutions/Oster | 78997-010 | |
| Plastic Petri dish 100 mm X 20 mm sterile | Corning | 430167 | |
| Pyrex Brand Plain Stemless Glass Funnel | Corning | 6240-75 | |
| Rat IgG2akappa FITC isotype control antibody | BD Pharmingen | 553929 | |
| Rat IgG2akappa PE isotype control antibody | BD Pharmingen | 555844 | |
| SFM | Life Technologies Gibco | 10725-018 | |
| SMEM | Life Technologies Gibco | 11380-037 | |
| SMEM: Ca2+ and Mg2+ free minimal essential medium for suspension culture | Life Technologies Gibco | 11380-037 | |
| Square sterile plastic Petri dishes | BD Falcon | 351112 | |
| Swiss mouse 3T3 fibroblasts | ATCC | CCL-92 | used within 10 passages |
| Triadine; 10% Povidone-Iodine Prep Topical Solution, 16oz | Triad Group | 10-8216 | |
| VWR Plastic Petri dishes, sterile Space Saver 100 X 10 | VWR | 25384-324 | |
| Williams E Medium | Life Technologies Gibco | 12551-032 | |
| Ziploc bag |
Referenzen
- Morris, R. J., Tacker, K. C., Fischer, S. M., Slaga, T. J. Quantitation of primary in vitro clonogenic keratinocytes from normal adult murine epidermis, following initiation, and during promotion of epidermal tumors. Cancer Research. 48 (22), 6285-6290 (1988).
- Tani, H., Morris, R. J., Kaur, P. Enrichment for murine keratinocyte stem cells based on cell surface phenotype. Proceedings of the National Academy of Sciences of the United States of America. 97 (20), 10960-10965 (2000).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nature Biotechnology. 22 (4), 411-417 (2004).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. Journal of Investigative Dermatology. 120 (4), 501-511 (2003).
- Redvers, R. P., Kaur, P. Serial cultivation of primary adult murine keratinocytes. Methods in Molecular Biology. 289, 15-22 (2005).
- Jensen, K. B., Driskell, R. R., Watt, F. M. Assaying proliferation and differentiation capacity of stem cells using disaggregated adult mouse epidermis. Nature Protocols. 5 (5), 898-911 (2010).
- Blacker, K. L., Williams, M. L., Goldyne, M. Mitomycin C-treated 3T3 fibroblasts used as feeder layers for human keratinocyte culture retain the capacity to generate eicosanoids. Journal of Investigative Dermatology. 89 (6), 536-539 (1987).
- Morris, R. J. . Procedure for harvesting epidermal cells from the dorsal epidermis of adult mice for primary cell culture in “high calcium” defined medium. , (1994).
- Wu, W. Y., Morris, R. J. Method for the harvest and assay of in vitro clonogenic keratinocytes stem cells from mice. Methods in Molecular Biology. 289, 79-86 (2005).
- Popova, N. V., Teti, K. A., Wu, K. Q., Morris, R. J. Identification of two keratinocyte stem cell regulatory loci implicated in skin carcinogenesis. Carcinogenesis. 24 (3), 417-425 (2003).
- Popova, N. V., Tryson, K. A., Wu, K. Q., Morris, R. J. Evidence that the keratinocyte colony number is genetically controlled. Experimental Dermatology. 11 (6), 503-508 (2002).
- Trempus, C. S., et al. Comprehensive microarray transcriptome profiling of CD34-enriched mouse keratinocyte stem cells. Journal of Investigative Dermatology. 127 (12), 2904-2907 (2007).
- Baer-Dubowska, W., Morris, R. J., Gill, R. D., DiGiovanni, J. Distribution of covalent DNA adducts in mouse epidermal subpopulations after topical application of benzo(a)pyrene and 7,12-dimethylbenz(a)anthracene. Cancer Research. 50 (10), 3048-3054 (1990).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118 (5), 635-648 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten