Method Article
في فيفو إعادة برمجة مباشرة من الخلايا الغلية المقيمة في الخلايا العصبية المشتركة عن طريق الحقن داخل الدماغ من ناقلات الفيروسية
In This Article
Summary
يهدف هذا البروتوكول إلى توليد الخلايا العصبية البينية المعاد برمجتها مباشرة في الجسم الحي، وذلك باستخدام نظام فيروسي قائم على AAV في الدماغ ومراسل GFP يعمل على إزالة المشبك المرن، والذي يسمح بتحديد الخلايا والمزيد من التحليل في الجسم الحي.
Abstract
تحويل glia المقيم في الدماغ إلى الخلايا العصبية الوظيفية وsubtype محددة في الجسم الحي يوفر خطوة إلى الأمام نحو تطوير العلاجات البديلة استبدال الخلايا في حين أيضا خلق أدوات لدراسة مصير الخلية في الموقع. حتى الآن، كان من الممكن الحصول على الخلايا العصبية عن طريق إعادة برمجة في الجسم الحي، ولكن النمط الظاهري الدقيق لهذه الخلايا العصبية أو كيف تنضج لم يتم تحليلها بالتفصيل. في هذا البروتوكول، ونحن نصف تحويل أكثر كفاءة وتحديد خلية محددة من الخلايا العصبية في الجسم الحي إعادة برمجتها، وذلك باستخدام نظام ناقلات الفيروسية المستندة إلى AAV. كما نقدم بروتوكولاً للتقييم الوظيفي للنضج العصبي للخلايا المعاد برمجتها. عن طريق حقن ناقلات استئصال الوجه (FLEX)، التي تحتوي على إعادة برمجة والجينات مراسل يحركها المشبك إلى أنواع محددة من الخلايا في الدماغ التي تعمل كهدف لإعادة برمجة الخلايا. تسمح هذه التقنية بتحديد الخلايا العصبية المعاد برمجتها حديثًا بسهولة. تظهر النتائج أن الخلايا العصبية المعاد برمجتها التي تم الحصول عليها ناضجة وظيفيا مع مرور الوقت، وتلقي الاتصالات متشابك وتظهر الخصائص الكهرولوجية لأنواع مختلفة من الخلايا العصبية البينية. باستخدام عوامل النسخ Ascl1، Lmx1a وNurr1، فإن غالبية الخلايا المعاد برمجتها لها خصائص الخلايا العصبية البينية التي تحتوي على البارافيلوبينات بسرعة.
Introduction
الهدف العام لهذه الطريقة هو تحويل بكفاءة glia المقيم الدماغ في الجسم الحي إلى الخلايا العصبية وظيفية وsubtype محددة مثل parvalbumin التعبير عن الخلايا العصبية. وهذا يوفر خطوة إلى الأمام نحو تطوير بديل بديل للخلايا استبدال العلاج لأمراض الدماغ دون الحاجة إلى مصدر خلية خارجية. كما أنه يخلق أداة لدراسة مفاتيح مصير الخلية في الموقع.
الدماغ لديه قدرة محدودة فقط لتوليد الخلايا العصبية الجديدة. لذلك ، في الأمراض العصبية ، هناك حاجة إلى مصادر الخلايا الخارجية لإصلاح الدماغ. لهذا، تعرضت مصادر مختلفة من الخلايا لأبحاث مكثفة على مر السنين، بما في ذلك الخلايامن الأنسجة الأولية، والخلايا المشتقة من الخلايا الجذعية والخلايا المعاد برمجتها 1،2،3. إعادة برمجة مباشرة من خلايا الدماغ المقيمة في الخلايا العصبية هو النهج الأخير الذي يمكن أن توفر طريقة جذابة لإصلاح الدماغ كما أنه يستخدم خلايا المريض الخاصة لتوليد الخلايا العصبية الجديدة داخل الدماغ. حتى الآن، وقد أظهرت عدة تقارير في إعادة برمجة الجسم الحي من خلال تسليم ناقلات الفيروسية في الدماغ4،5،6،78،9 في مناطق الدماغ المختلفة مثل القشرة، الحبل الشوكي، السترياتوم ومنتصف الدماغ5،10،11،وكذلك في الدماغ سليمة وآفة5،8،11،12. وقد تم الحصول على كل من الخلايا العصبية المثبطة والمحفزة4,8, ولكن النمط الظاهري الدقيق أو وظيفة هذه الخلايا لم يتم تحليلها بعد بالتفصيل.
في هذا البروتوكول، ونحن نصف إعادة برمجة أكثر كفاءة وتحديد خلية محددة من الخلايا العصبية في الجسم الحي إعادة برمجتها. نحن نقدم بروتوكول اعادة التقييم الوظيفي للنضج العصبي وتوصيف النمط الظاهري على أساس الوظائف والصفات المناعية الكيميائية.
استخدمنا ناقل AAV Cre-inducible ومراسل GFP لتحديد الخلايا العصبية في الجسم الحي إعادة برمجتها. هذا الاختيار من ناقلات الفيروسية لديه ميزة إصابة كل من الخلايا القسمة وغير المقسمة في الدماغ، وزيادة عدد الخلايا المستهدفة، كبديل لاستخدام الفيروس الرجعي7،8. وقد مكّننا مراسل FLEX الذي يحركه المشبك العصبي (GFP) من الكشف عن الخلايا العصبية التي تم إنشاؤها حديثًا على وجه التحديد. وقد استخدمت الدراسات السابقة المروجين نوع فرعي محدد لفي إعادة برمجة الجسم الحي7،9، التي تسمح أيضا التعبير عن إعادة برمجة الجينات والصحفيين في أنواع محددة من الخلايا. ومع ذلك، فإن هذه الطريقة تتطلب المزيد من تحديد الخلايا العصبية المعاد برمجتها عن طريق تحليل ما بعد الوفاة للتعبير المشترك للمراسل وعلامات الخلايا العصبية. استخدام مراسل الخلايا العصبية الخاصة، مثل واحد الموصوفهنا، يسمح لتحديد الهوية المباشرة. وهذا يوفر دليلا مباشرا على نجاح التحويل ويسمح لتحديد الخلية الحية المطلوبة للفيزيولوجيا الكهربائية التصحيح المشبك.
Protocol
ونُفذت جميع الإجراءات التجريبية بموجب توجيه الاتحاد الأوروبي (2010/63/EU) ووافقت عليها اللجنة الأخلاقية لاستخدام الحيوانات المختبرية في جامعة لوند ووزارة الزراعة السويدية (Jordbruksverket). تقع الفئران في دورة ضوئية/مظلمة 12 ساعة مع إمكانية الحصول على الغذاء والماء.
1. ناقلات الفيروسية
- استنساخ ناقلات AAV
- لإنشاء ناقلات AAV5 Cre-inducible، إدراج cDNA لGFP، Ascl1، Lmx1a و NR4A2 (Nurr1) في اتجاه عكسي يحيط به زوجان من غير المتجانسة،المضادة للامتزاج LoxP الوجه excision (FLEX) (جدول المواد). لإدراج cDNA، استخدم العمود الفقري مثل pAAV-Cba-FLEX أو واحد مع بنية مماثلة، تحتوي على تسلسل فليكس والدجاج بيتا أكتين (CBA) المروج.
- إدراج كل cDNA واحد (على سبيل المثال، Ascl1) في العمود الفقري عن طريق تفاعل سلسلة بوليميراز (PCR) وتقييد الإنزيمات. التعبير GFP تحت سيطرة المروج synapsin وAscl1، Lmx1a، Nurr1 تحت سيطرة المروج CBA أعرب في كل مكان.
ملاحظة: تأكد من وجود الحمض النووي الخالي من الإندوتوكسين باستخدام مجموعات محددة خالية من البلازميد للحمض النووي. - إجراء تحليل التسلسل والتقييد على البنيات قبل الاستخدام، من أجل التحقق من نجاح خطوة الاستنساخ.
- إنتاج ناقلات الفيروسية AAV5
تحذير: يرجى الرجوع إلى المبادئ التوجيهية المحلية للسلامة الأحيائية عند التعامل مع الفيروس المرتبط بالغدينو( AAV). وفي السويد، تتطلب التدابير المتعلقة بالسلامة الأحيائية المستخدمة في هذا البروتوكول مستوى السلامة الأحيائية 2 (BSL-2).- خلايا البذور HEK293T مع وسائل الإعلام الثقافة القياسية (DMEM + Glutamax + 10٪ FBS + البنسلين (100 U / مل) ستربيتوميسين (100 ميكروغرام / مل)، انظر جدولالمواد) في T175 قوارير في كثافة 3 × 106 خلايا لكل قارورة. حساب 5 قوارير لكل دفعة من AAV والتخطيط لمدة 6 دفعات في وقت واحد.
- عندما تصل الخلايا إلى 50-70٪ من الملاءمة، قم بإعداد المزيج التالي للتغوط (لكل قارورة 175 سم 2).
- في أنبوب الطرد المركزي 50 مل، إضافة كميات متساوية من بلازميد ناقلات وpDG سلسلة مساعد بلازميد (pDP5، pDP6)، مع كمية إجمالية قدرها 72 ميكروغرام لكل 175 سم2 قارورة.
- إضافة مخزن Tris-EDTA المؤقت (المخزن المؤقت TE، 10 mM Tris-HCl، 1 mEDTA) إلى وحدة تخزين نهائية من 144 مل.
- إضافة المياه فائقة النقاء بحيث يصبح الحجم الإجمالي 1296 مل ومزيج.
- إضافة 144 درجة مئوية من 2.5 M CaCl2 ومزيج. إضافة 1.92 درجة مئوية من HEPES المخزنة المالحة المخزنة (HBS) (1.5 مليون متر Na2HPO 4,140 مل حمض الكلى, 50 مل HEPES) إلى محلول الحمض النووي ومزيج على الفور عن طريق دوامة.
- الحضانة في درجة حرارة الغرفة (RT) لمدة 60 ق. بالضبط نقل الحل إلى 28 مل وسائل الإعلام ثقافة الخلية الطازجة ومزيج.
- استبدال المتوسطة في القوارير مع خلية ثقافة المتوسطة التي تحتوي على مزيج التغوط.
- بعد ثلاثة أيام من التغوط، حصاد الخلايا عن طريق صب قبالة thr المتوسطة من القوارير في حاوية المتاح للنفايات وإضافة 5 مل من الحصاد العازلة (EDTA تضاف إلى الفوسفات المخزنة المالحة، انظر جدول المواد، DPBS إلى تركيز نهائي من 5 MM) إلى تركيز 5 MM) في كل قارورة للسماح انفصال الخلية.
- صب حل الخلية في أنبوب الطرد المركزي 50 مل. إضافة 4 مل أخرى من DPBS إلى كل قارورة لشطف الخلايا المتبقية وتجميع مع حل الخلية الأولى. طرد مركزي الخلايا المقطوعة في 1000 × ز لمدة 5 دقائق في 4 درجة مئوية.
- بعد الطرد المركزي، وإزالة supernatant وحل الكريات في 15 مل من العازلة lysis (50 مل تريس-حمض الهيدروكلوريك درجة الحموضة 8.5،150 مل شمال البحر الكل، 1 M MCl 2) عن طريق الدوامة.
- تجميدها في CO2-الجليد / الإيثانول حمام لمدة 15 دقيقة وتخزينها في -20 درجة مئوية الفريزر. إذابة الخلية المقطوعة في حمام مائي 37 درجة مئوية قبل الاستخدام.
- تنقية ناقلات الفيروسية AAV5
- إجراء تنقية AAV بواسطة Iodixanol التدرج Ultracentrifugation13 واستخدام أنابيب الختم فائقة الطرد المركزي مع الطرد المركزي في 350،000 × ز لمدة ساعة و 45 دقيقة في RT.
- استخدام حقنة 10 مل مع إبرة 18G وإدراج حوالي 2 ملم تحت الحدود مرحلة 40/60٪ مع شطبة تواجه صعودا من أجل استخراج المرحلة التي تحتوي على AAV. تأكد من التوقف قبل الوصول إلى نطاق البروتين بعد استخراج 5-6 مل.
- تخزين مقتطفات التدرج في زجاجات زجاجية الأوتوكلاف في 4 درجة مئوية. تجنب تخزين أوقات أطول من بين عشية وضحاها.
- تخفيف استخراج التدرج Iodixanol 3 أضعاف عن طريق الأنابيب ببطء في 12 مل من Iodixanol Elution (IE) العازلة (20 mM تريس-حمض الهيدروكلوريك درجة الحموضة 8.0، 15 مل NaCl) أثناء الدوامة.
- تنقية وتركيز التدرج Iodixanol المخفف من خلال مرشح تبادل الأنيون. دفع من خلال ببطء مع سرعة لا أسرع من 1 قطرة / ث. دفع 3 مل من العازلة IE ببطء من خلال مرشح لغسله.
- Elute في وحدة تصفية الطرد المركزي مع 1-2 مل من العازلة elution (20 mM تريس-حمض الهيدروكلوريك درجة الحموضة 8.0;250 مل شمال نزع اكل). إضافة DPBS إلى الجهاز إلى وحدة تخزين نهائية من 4 مل. الطرد المركزي في 2000 × غرام في RT حتى يتم ترك أقل من 0.5 مل في الفلتر. إزالة السائل من الجزء السفلي من الأنبوب، وإعادة ملء مع 4 مل من DPBS والطرد المركزي مرة أخرى. كرر هذه الخطوة مرتين أخرى. تأكد من أن حجم المتجه المركز على الفلتر حوالي 200 ميكرولتر بعد خطوة الطرد المركزي الأخيرة.
- إزالة ناقلات 200 μLfocus باستخدام ماصة ودفع التركيز من خلال مرشح 0.22 ملم لتعقيمه. Aliquot 200 μLinto قارورة زجاجية 9مم مع إدراج متشابكة (جدول المواد).
ملاحظة: يمكن تخزين مخزونات ناقلات AAV5 في -80 درجة مئوية المجمدات لتخزين طويلة، أو في 4 درجة مئوية إذا استخدمت في غضون 2 أسابيع.
- AAV5 فيروسي ّة مال [تيتر] تعيين
- تحديد AAV5 titer باستخدام معيار الكمية تفاعل البوليميراز سلسلة (qPCR) مع التمهيديات لتكرار محطة مقلوبة(ITR)تسلسل و5 € FAM / 3 € BHQ1 التحقيق لتسلسل ITR (جدولالمواد). استخدم منحنى قياسي يتحقق مع كميات معروفة من ITR التي تحتوي على بلازميد. يجب أن يكون لكل متجه AAV مجموعة من 1E+14 – 1E+15 نسخ الجينوم لكل ملليلتر إذا تم استخدام تسلسل ITR لتحديد titer.
ملاحظة: إنتاج فيروس AAV5 ناجحة يعطي مخزونات مع titers في نطاق الحد الأدنى من 3E+13 - 7E+13 وحدات / مل.
- تحديد AAV5 titer باستخدام معيار الكمية تفاعل البوليميراز سلسلة (qPCR) مع التمهيديات لتكرار محطة مقلوبة(ITR)تسلسل و5 € FAM / 3 € BHQ1 التحقيق لتسلسل ITR (جدولالمواد). استخدم منحنى قياسي يتحقق مع كميات معروفة من ITR التي تحتوي على بلازميد. يجب أن يكون لكل متجه AAV مجموعة من 1E+14 – 1E+15 نسخ الجينوم لكل ملليلتر إذا تم استخدام تسلسل ITR لتحديد titer.
2. حقن عوامل إعادة البرمجة في الدماغ
- إعداد الحيوان، ووضع مجسمة والحفر
ملاحظه:يركز هذا البروتوكول على استخدام Ascl1 و Lmx1a وNurr1 (ALN) لإعادة برمجة NG2 glia في الخلايا العصبية البينية. في تجربتنا، يمكن الحصول على الخلايا العصبية البينية من النمط الظاهري مماثلة باستخدام تركيبات عوامل أخرى11.- قبل الجراحة، وإعداد المزيج الفيروسي الذي يحتوي على ناقلات Cba-FLEX-Ascl1، Cba-FLEX-Lmx1a، Cba-FLEX-Nurr1 وناقل مراسل Syn-FLEX-GFP. إضافة كل واحد من الأسهم المعدة في القسم 1 إلى المزيج النهائي، بحيث الحل الفيروسي النهائي لديه 5٪ من كل واحد من عوامل إعادة البرمجة (Ascl1، Lmx1a وNurr1) و 10٪ من بناء مراسل (5٪ A، 5٪ L، 5٪ N و 10٪ GFP).
ملاحظة: يمكن تخزين خلطات ناقلات AAV5 عند درجة حرارة 4 درجة مئوية والاحتفاظ بها لاستخدامها في المستقبل في الجسم الحي. - تخدير الماوس باستخدام 2٪ isoflurane في مزيج من الهواء وأكسيد النيتروز (N2O) بنسبة 4:1. مراقبة تنفس الحيوان من خلال مراقبة حركات الحجاب الحاجز. خلال الجراحة، والحفاظ على التخدير باستخدام 1-1.5٪ isoflurane.
ملاحظة: نموذج الماوس الموصوفة بموجب هذا يتكون من سلالة الماوس التي تعبر على وجه التحديد Cre في NG2 glia. في الجسم الحي إعادة برمجة يمكن أن يتحقق باستخدام سلالات الماوس المختلفة التي تعبر عن كري في مجموعات أخرى من الخلايا الغليفية (على سبيل المثال، الخلايا النجمية14). - مرة واحدة يتم التخدير تماما الحيوان (على سبيل المثال، استرخاء العضلات كاملة وعدم الاستجابة لقرصة في وسادة القدم)، وثقب المنطقة حول موقع الشق وجلب الحيوان إلى الإطار مجسم.
- للحفاظ على درجة حرارة جسم الحيوان أثناء الجراحة، قم بإرفاق وسادة تدفئة بقاعدة الإطار المجسم. ضع الماوس على منشفة ورقية نظيفة وجافة.
- وضع رأس الماوس بعناية في قضبان الأذن. إذا وضعت بشكل صحيح ، لا ينبغي ملاحظة أي حركة جانبية للرأس. تعيين شريط الأذن الأيسر إلى 4 ملم، قبل البدء في وضع الماوس في الإطار stereotaxic.
- تأمين شريط الأسنان في مكان، ومن ثم تشديد شريط الأنف. تأكد من أن الرأس لا يتحرك في أي بعد ونقطة مباشرة إلى الأمام (خط الوسط يجري عمودي على مستوى قضبان الأذن). تطبيق مرهم العيون لحماية العين.
- قبل بداية الجراحة، وإدارة التسكين المناسب (على سبيلالمثال، 0.05 ملغ / كغ من البوبرينورفين، تحت الجلد).
- تنظيف منطقة الشق مع شاش القطن أو مسح ة غارقة مع 70٪ EtOH، دون الاقتراب من منطقة العين.
ملاحظة: للحقن الفيروسي داخل الدماغ، يتم استخدام حقنة 5 أو 10 مل تكييفها مع الشعرية الزجاجية المسحوبة. يتم سحب الشعيرات الدموية الزجاجية باستخدام سحب micropipette، مما أدى إلى الشعرية مع طرف غرامة جدا، والتي سوف تقلل من الغازية من الإجراء. لتكييف الشعرية في المحاقن، استخدم قطعة من الأنابيب المطاطية على الاتصال بين إبرة الحقنة والشعيرات الدموية الزجاجية وذابها باستخدام مصدر حراري (على سبيل المثال، ولاعة). وهناك اتصال ضيق بين القطعتين تأكد من عدم وجود تسرب السوائل أثناء الحقن. قبل بدء الجراحة، قم باختبار ذلك عن طريق ملء الحقنة بمحلول ملحي ودفع السائل للخروج من الحقنة. - قم بعمل شق من حوالي 0.5-0.8 سم على طول خط الوسط من الرأس. قطع من خلال كل من طبقات الجلد وتحت الجلد، مع مشرط.
- توسيع اللوحات الجلدية على كل جانب من الشق. تنظيف شق أي دم وكشط مرة أخرى طبقات تحت الجلد مع برعم القطن.
- نقل الذراع M / L-D / V من الإطار stereotaxic في مكان (فوق الحيوان) وتأمينه.
ملاحظة: يسمح الإطار المجسم بتعديل الحقنة على طول محور الأمامي/الخلفي (A/P, Y)، والمحور الوسيط/الجانبي (M/L، X axis) والظهر/البطني (D/V, Z axis). - نقل الحقنة على طول محور مختلف من الإطار stereotaxic، لجلب غيض من الشعرية الزجاجية فقط فوق بريجما (نقطة تقاطع حيث لوحات الجمجمة المختلفة تلبية).
- تأكد من أن الطرف الشعري مستقيم تمامًا في كل من طائرات A/P وM/L. في حالة وجود بريجما غامضة، واتخاذ متوسط الغرز الجانبية وخط الوسط.
- عندما يتم وضع طرف الشعرية بشكل صحيح فوق bregma، قم بإعادة تعيين كل من قيم M/L و A/P إلى 0.0 على عداد الإحداثيات الرقمية.
- للتأكد من أن رأس الحيوان في وضع مسطح تماماً، استخدم عداد الإحداثيات الرقمية لقياس قيمة إحداثيات D/V، عندما يكون ذراع A/P عند +2.0 و-2.0 (M/L = 0.0)، وكذلك عندما يكون ذراع M/L عند +2.0 و-2.0 (A/P = 0.0). ضبط ارتفاع شريط الأسنان وقضبان الأذن وفقا لذلك.
- نقل الحقنة إلى الإحداثيات المطلوبة لحقن النواقل الفيروسية في السترياتوم (A/P = +1.0; M/L = -2.0، نسبة إلى بريغا).
- رفع الحقنة قليلا، وبالنظر إلى موقع الحقن من خلال المجهر، حفر حفرة باستخدام حفر الأسنان في إحداثيات الحقن. بدء الحفر في الموقع، والعمل بطريقة دائرية ولطيفة.
ملاحظة: لا تضع الكثير من الضغط النزولي، كما يجب أن يكون الحفر بت حادة بما فيه الكفاية للذهاب من خلال العظام دون قوة إضافية. تجنب الحفر الطويل والمستمر لأن هذا يخلق الحرارة. - في نهاية الحفر، تحقق من أن الأم دورا لا تزال سليمة وتتعرض للحقن.
- قبل الجراحة، وإعداد المزيج الفيروسي الذي يحتوي على ناقلات Cba-FLEX-Ascl1، Cba-FLEX-Lmx1a، Cba-FLEX-Nurr1 وناقل مراسل Syn-FLEX-GFP. إضافة كل واحد من الأسهم المعدة في القسم 1 إلى المزيج النهائي، بحيث الحل الفيروسي النهائي لديه 5٪ من كل واحد من عوامل إعادة البرمجة (Ascl1، Lmx1a وNurr1) و 10٪ من بناء مراسل (5٪ A، 5٪ L، 5٪ N و 10٪ GFP).
- إعداد الحقنة
- ضع قطعة من شاش القطن فوق الشق المفتوح واغسل المحاقن بمحلول ملحي.
- بعد التنظيف، تناول فقاعة الهواء من 1-2 ميكرولتر، تليها 1 ميكرولتر من الحل الذي يحتوي على النواقل الفيروسية، وتجنب أي فقاعات غير مقصودة. تأكد من أن الحل الفيروسي يمكن تصوربسهولة تحت فقاعة الهواء، في حين يجري حقنها.
- الحقن الفيروسي
- إزالة الشاش القطن من فوق موقع الشق، وخفض الحقنة باستخدام ذراع D / V من الإطار stereotaxic. كما يقترب سطح الجمجمة، ننظر بعناية من خلال المجهر وقياس مستوى D / V من الأم دورا - ينبغي أن انتفاخ قليلا تحت ضغط لطيف.
- أثناء لمس الأم دورا مع غيض من الشعرية، تعيين إحداثيات D / V إلى 0.0.
- خفض الحقنة، وتقدم ببطء إلى العمق المطلوب (D / V = -2.7، بالنسبة إلى الأم دورا). تأكد من أن المسار واضح من شظايا العظام، بحيث لا يلاحظ الانحناء من الإبرة / الشعرية.
ملاحظة: تشير الإحداثيات المعروضة إلى حقن عوامل إعادة البرمجة في striatum من الفئران NG2-Cre. ويمكن استخدام الإحداثيات المقابلة لمناطق الدماغ الأخرى. دائما اختبار إحداثيات الحقن أولا باستخدام صبغة (على سبيل المثال تريبان الأزرق)، حقن حبة ملونة أو ناقلات الفيروسية مراسل قبل حقن عوامل إعادة برمجة في الدماغ من سلالة الماوس جديدة. إذا حقن تريبان الأزرق، والحيوانات تحتاج إلى التضحية مباشرة بعد الجراحة والدماغ تشريح بها. يمكن قطع العقول الطازجة باستخدام ميكروتومي، في حين المجمدة، وموقع الحقن التي يحددها التصور من موقف صبغ في الدماغ. إذا كان اختبار إحداثيات باستخدام الخرز الملون، فمن الممكن لتحديد موقع الحقن على perfused وقطع العقول بعد أسبوع من الحقن. بدلا من ذلك، يمكن استخدام حقن مع ناقلات الفيروسية تحمل جين مراسل، وموقع الحقن المحددة في العقول قطع perfused. - حقن 1 ميكرولتر من الحل الفيروسي بمعدل 0.4 ميكرولتر / دقيقة. عندما يتم حقن حجم كامل، والسماح لفترة انتشار من 2 دقيقة قبل سحب حقنة.
- بعد الانتشار، تراجع ببطء حقنة حتى غيض من الشعرية هو تماما من الدماغ.
- ضع قطعة من الشاش القطني فوق الجرح واغسل المحاقن بمحلول ملحي.
- نقل ذراع M / L-D / V من الإطار stereotaxic للخروج من منطقة العمل.
- إجراءات إغلاق الجروح وما بعد العملية الجراحية
- خياطة بعناية الشق باستخدام خيط خياطة.
ملاحظة: يجب التخلص من جميع خيوط الخياطة المستخدمة في الحيوانات عن طريق الحقن في كوب / قارورة تحتوي على محلول المنظفات المضادة للفيروسات. يتم استخدام نفس الحل لتنظيف جميع الأسطح المحيطة بمنطقة الجراحة التي كانت على اتصال مع المواد الجراحية. يتم غسل جميع الأدوات الجراحية بدقة وautoclaved في نهاية كل يوم من أيام الجراحة. - إزالة الحيوان من الإطار stereotaxic ووضعها في محطة ما بعد العملية الجراحية، والتي تشمل نظيفة، قفص ساخنة، والوصول إلى الغذاء والماء، وحيث يبقى الحيوان حتى مستيقظا تماما. خلال هذه الفترة ، راقب الحيوان عن كثب حتى يستعيد وعيه.
- لا تؤوي الحيوانات التي يتم تشغيلها مع الحيوانات غير العاملة حتى تتعافى الأولى تماما من الجراحة.
- الإشراف على تشغيل الحيوانات يوميا. اعتمادا على الغرز المستخدمة، تأكد من إزالتها إذا لزم الأمر. أعطيت كلّ الحيوانات كان [بوبنورفينوم] ([تمجستيك] في 1ml/kg) [أالجلدينوس] ك [بوست-operative كر] عناية.
ملاحظة: إذا كان يعمل باستخدام نفس الحقنة في يومين متتاليين، اغسلها بالماء، يليه الإيثانول 70٪ والماء مرة أخرى. ترك حقنة مليئة بالماء فوق الليل، للسماح حل أي بقايا ممكنة.
- خياطة بعناية الشق باستخدام خيط خياطة.
3. التسجيلات الفسيولوجية الكهربائية
- إعداد شريحة الأنسجة للفيزيولوجيا الكهربائية
تحذير: إعداد الأنسجة المنفذة بشكل جيد ضروري من أجل تحقيق تسجيلات كهربائية فسيولوجية جيدة. إعداد الغرفة بعناية ووضع أدوات لالتسريب وتشريح على الجليد.- إعداد الجليد الباردة والأكسجين (95٪ O2 و 5٪ CO2)كريبس الحل لضخ، تشريح وقطع (إعداد هذا في نفس اليوم من الأسهم 10X عن طريق تخفيف محلول الأوراق المالية في المياه النقية للغاية وإضافة NaHCO3 والجلوكوز). المكونات في حل كريبس في MM (بعد تخفيف إلى 1X) هي: 126 NaCl، 2.5 كيلو كل، 1.2 NaH2PO4· H2O, 1.3 MgCl2·6H2O, و 2.4 CaCl2·6H2O, 22 NaHCO3, 10 الجلوكوز. ضبط رقم الهيدروجيني للحل إلى 7.4.
- قم بإجراء معايرة (Vibracheck) للاهتزاز باستخدام شفرة حلاقة جديدة.
- بدء كتلة التبريد من الاهتزاز (أو ملء الغرفة المحيطة مع الجليد)، وملء غرفة القطع مع حل كريبس للأكسجين مع 95٪ O2 و 5٪ CO2 على الأقل 30 دقيقة قبل الاستخدام.
- وضع طبق بيتري على الجليد وملء مع حل كريبس الأوكسجين. وضع شفرة، مقص ولوحة تصاعد على الجليد.
تحذير: جلب القفص الذي يحتوي على الماوس إلى الغرفة على الأقل 1 ساعة قبل البدء في إجراء التأقلم. الإجهاد له تأثير سلبي على حالة أقسام أنسجة الدماغ. - التخدير النهائي للماوس عن طريق حقن جرعة زائدة من البنتوباربيتال والسماح للحيواني تغفو. عندما يكون رد الفعل وميض خارج والحيوان لا تستجيب لمحفزات الألم، transcardially perfuse الحيوان مع الجليد الباردة كريبس الحل لمدة 2-3 دقيقة (بمعدل 10-20 مل / دقيقة).
- بسرعة، ولكن بعناية، تشريح الدماغ ووضعها رأسا على عقب في طبق بيتري التي يتم وضعها على الجليد (التي تحتوي على حل كريبس).
ملاحظة: من أجل مقارنة النضج الوظيفي للخلايا العصبية المعاد برمجتها، التضحية الحيوانات للتسجيلات في نقاط زمنية مختلفة بعد الحقن الفيروسي. تقييم خصائص إطلاق الأنواع الفرعية المتميزة من الخلايا العصبية على أساس الأدب الموجود15 . - جعل قطع الإكليل على طول المخيخ منتصف والغراء هذا الجانب على لوحة تصاعد (أيضا الجليد الباردة) لقطع الاهتزاز.
- تراجع الدماغ لصقها بعناية في غرفة العازلة في الاهتزاز.
تحذير: يجب الحرص على عدم لمس شفرة الحلاقة لسلامتك الخاصة، وحتى تبقى شفرة معايرة. - قطع من الجزء الأكثر rostral من الدماغ وصولا الى مستوى striatal بسرعة عالية. ثم قطع striatum coronally في 275 ملم بسرعة بطيئة (0.10 ملم / ث).
- بعد كل قطع، إزالة بعناية الجانب striatal غير حقن (على سبيل المثال، مع إبرة محني) ونقل الجانب حقن في قارورة أخرى في حمام مائي، تحتوي على شبكة أسفل (كريبس الأكسجين في RT) وضعت في حمام مائي. الاحتفاظ بهذا في RT حتى يتم قطع جميع الأقسام.
- زيادة ببطء درجة حرارة حمام الماء إلى 37 درجة مئوية وتركها لمدة 30 دقيقة. ثم إيقاف سخان والسماح تهدئة حتى RT.
ملاحظة: عند هذه النقطة، يمكنك إيقاف مؤقت حتى بدء التسجيل. الأقسام تستمر لمدة 4-6 ساعة.
- تسجيلات كاملة الخلية التصحيح المشبك
- نقل قسم الأنسجة الأولى إلى غرفة التسجيل المغمورة في تدفق مستمر من حل كريبس. جبل القسم باستخدام الأوزان الخفيفة وغمر الهدف.
- تحديد المنطقة السترية في المجهر والبحث عن الخلايا العصبية الإيجابية GFP (إعادة برمجتها). حدد الخلايا العصبية التي هي واسعة في مورفولوجيا وغير مغطاة حزم الألياف أو الأوعية الدموية.
- إعداد الماصات الزجاجية البورسليكات (3-7 MΩ) للتصحيح وملء مع الحل داخل الخلايا التالية (في MM): 122.5 غلوكونات البوتاسيوم، 12.5 كيلو كل، 0.2 EGTA، 10 HEPES، 2 MgATP، 0.3 Na3GTP و 8 NaCl، المعدلة إلى h 7.3 مع KOH.
- لملء السيتين، إضافة 1 ملغ من ملح السيتين إلى 1 مل من الحل الداخلي ودوامة.
تحذير: تأكد من تصفية الحل الداخلي مع biocytin لأن هذا يمكن أن تسد خلاف ذلك القطب الكهربائي. - إرفاق ماصة الزجاج إلى القطب تسجيل وتراجع في الحل. تحقق مرتين من مقاومة القطب الكهربائي. ثم اقترب ببطء الخلية مع ماصة، والحفاظ على ضغط إيجابي طفيف في القطب لتجنب توصيل طرف.
تحذير: كن حذرا لتتبع الخلية الخاصة بك أثناء نزول القطب وليس لتبييض الفلورة في الخلية (أي، إيقاف مصباح الفلورة عندما كنت لا تحتاج إليها). - شطف الأنسجة المحيطة بعناية باستخدام الضغط الإيجابي للقطب الكهربائي والاقتراب من الخلية مع القطب الكهربائي. حدد موقع القطب الأيمن على أعلى الخلية وينزل حتى لمس القطب الغشاء. جعل ختم جيجا-Ω بين القطب وغشاء الخلية، ومع نبضات الضغط السلبي، وتمزق الغشاء لخلق التصحيح خلية كاملة.
تحذير: الخلايا العصبية المعاد برمجتها حساسة. كن حذرا عند التصحيح ولا تضع الكثير من الضغط السلبي عند الوصول إلى ختم جيجا-Ω أو فتح غشاء الخلية. أيضا، التصحيح على الحيوانات التي هي أقدم يتطلب الممارسة والصبر كما النسيج الضام هو أكثر سمكا وأنه من الصعب تصور الخلايا العصبية. - تحقق من إمكانات غشاء يستريح مباشرة بعد اقتحام في وضع المشبك الحالي والكتابة للتحليل.
- في المشبك الحالي، والحفاظ على الخلية بين -60 مل في V إلى -80 مل فولت وحقن 500 مللي ثانية التيارات من -20 pA إلى +90 pA، مع 10 زيادات درجة عالية من العمر للحث على إمكانات العمل.
- نقل إلى الجهد المشبك وقياس الصوديوم الداخل وتأخر تصحيح تيارات البوتاسيوم في خطوات إزالة الاستقطاب من 10 ملفي.
ملاحظة: يتم تقييم تسجيلات الجهد المشبك بشكل أفضل باستخدام حل داخلي مختلف، وتتألف من المواد الكيميائية التي المشبك أكثر كفاءة الغشاء. ومع ذلك، بالنسبة للخلايا العصبية المعاد برمجتها، فإن عدد الخلايا التي يمكنك تسجيلها من عدد قليل وعدد أقسام الأنسجة مع هذه الخلايا العصبية محدود. وبالتالي، فمن ميزة لتسجيل كل من في المشبك الحالي والجهد المشبك من نفس الخلية. - في وضع الجهد المشبك، سجل النشاط المشاركات التلقائي في -70 mV. تمييز الأحداث المثبطة postsynaptic في احتمال غشاء من 0 mV من الأحداث المحفزة في -70 mV.
- بعد الوصول إلى خط أساس مستقر، إضافة Picrotoxin، وGABAA مستقبلات خصم، إلى حل كريبس التي تتدفق إلى غرفة التسجيل، لاستخراج الأحداث الإثارة (إضافة محلول الأسهم من Picrotoxin إلى تركيز نهائي من 50 MM في منفصلة حقنة العازلة التي ترتبط بتسريب الغرفة. قم بتوصيل تدفق العازلة من الغرفة إلى كيس فراغ للتخلص الآمن).
- بعد 20 دقيقة، إضافة CNQX (20 mM)، وهو خصم AMPA، إلى الحل كريبس التي تتدفق إلى غرفة التسجيل، لمنع الأحداث المثبطة (باستخدام نفس الإجراء كما لPicrotoxin). يترك في لمدة 20 دقيقة أخرى ثم يغسل مع حل كريبس. إزالة قسم الأنسجة من الغرفة.
- بعد الانتهاء من التسجيلات، قم بتحليل غير متصل بالتيارات اللاحقة للمشبك (EPSC) والتيارات المثبطة لما بعد متشابك (IPSC) باستخدام الكشف عن حدث العتبة (>5 pA) في برنامج التحليل.
- خلال التسجيل كله، سيتم ملء الخلية ببطء مع الحل الداخلي الذي يحتوي على البيوسيتوين. الحفاظ على التصحيح لمدة 20 دقيقة على الأقل قبل إزالة ببطء القطب من أجل تحقيق ملء كامل للخلية.
تحذير: يجب الحرص على عدم وجود أي ضغط إيجابي في القطب الكهربائي الذي يمكن أن يدمر التحليل المورفولوجي المتتالي للخلايا بعد ذلك. - للتصور biocytin، وضع قسم الأنسجة في 4٪ بارافورمالدهايد (PFA) بين عشية وضحاها في 4 درجة مئوية. شطف القسم في 0.02 M فوسفات البوتاسيوم العازلة (KPBS) مع 0.1٪ تريتون. ثم، وصمة عار لstreptavidin- Cy3 (1: 600 في KPBS-T، 2 ح)، لتحديد الخلية مليئة البيوتيتين والتصور المورفولوجي للخلية العصبية المعاد برمجتها.
ملاحظة: يمكن استخدام ملء البيوسيتوين للتحليل المورفولوجي والرسوم التوضيحية للخلايا العصبية مصححة.
4. الكيمياء المناعية، والقياس، والقياس الكمي
ملاحظة: تخصيص مجموعة محددة من الفئران للكيمياء المناعية، كما أقسام الأنسجة المستخدمة في الفيزيولوجيا الكهربائية ليست الأمثل لالكيمياء المناعية.
- التخدير الفئران مع حقن i.p. من جرعة زائدة من البنتوباربيتال وجبل الحيوان لضخ.
- عبر cardially perfuse الفئران، أولا مع محلول ملحي لإزالة الدم، ومن ثم مع الجليد الباردة 4٪ PFA.
- تشريح العقول وما بعد الإصلاح لمدة لا تقل عن 12 ساعة في 4٪ PFA.
- وضع العقول في 25٪ محلول السكروز (للحماية من التبريد) لمدة 12 ساعة تقريبا.
ملاحظة: العقول على استعداد لقطع عندما تغرق في محلول السكروز 25٪، مما يشير إلى أن السكروز قد اخترقت الدماغ الماوس بأكمله. - جعل قطع الإكليل عبر المخيخ، واستخدام شقة، الجزء الأكثر من الدماغ لوضع الدماغ على ميكروتومي وإصلاحه في مكان باستخدام مجمع درجة الحرارة القطع الأمثل (OCT).
- قطع الدماغ إلى شرائح إكليلية بسمك 35 ملم وتقسيم الدماغ إلى سلسلة متتالية وضعت في قارورة أو الآبار التي تحتوي على 0.02 M KPBS.
- معالجة أقسام الكيمياء المناعية باستخدام الأجسام المضادة ضد GFP وعلامات بين الخلايا العصبية مثل GAD65/67، PV، دردشة (الكولين أسيتيل ترانسفيراز) وNPY (Neuropeptide Y)، وفقا للبروتوكولات القياسية16، 17.
ملاحظة: يمكن الاحتفاظ بشرائح الدماغ عند 4 درجة مئوية أو -20 درجة مئوية في محلول مضاد للتجمد لفترات طويلة. - بعد الانتهاء من تلطيخ، جبل المقاطع على شريحة زجاجية وتغطية مع غطاء زجاجي، وذلك باستخدام حل تصاعد لإصلاحه في مكانه. اترك الشرائح المنزلقة لتجف أكثر من الليل.
ملاحظة: لدراساتنا، يتم قطع العقول كلها في 1:8 سلسلة (أي، كل قارورة تحتوي على أقسام سوف تعقد ثُمن الدماغ الماوس11). - تحليل الأقسام باستخدام الفلورة المقلوبة و / أو المجهر البؤري.
تحذير: الفحص المجهري الفلورسنت مفيد لنظرة عامة على النتائج والتقاط الصور لحساب كفاءة إعادة البرمجة. ولإجراء تحليل أكثر تفصيلاً للهوية الفينوتية عن طريق مراقبة الخلايا ذات الإيجابية المزدوجة، ينبغي استخدام التصوير البؤري. - لتحديد كمية من علامات مختلفة أعرب في GFP+ الخلايا العصبية في striatum، عد عدد الخلايا الإيجابية المزدوجة بالنسبة إلى العدد الإجمالي للGFP+ الخلايا (أي الخلايا العصبية المعاد برمجتها)، في حقلين على الأقل من كل القسم التريج.
- لتحديد العدد الإجمالي التقريبي من الخلايا العصبية المعاد برمجتها لكل دماغ، عد GFP+ الخلايا العصبية الموجودة في striatum من واحدة من سلسلة الدماغ قطع في وقت سابق، ومن ثم ضرب من قبل العدد الإجمالي للسلسلة.
ملاحظة: ويمكن استخدام أساليب مختلفة من القياس الكمي للتعبير عن كفاءة إعادة البرمجة، وعدد الخلايا العصبية المعاد برمجتها لكل الحيوان والنسبة المئوية للخلايا العصبية التي تعبر عن علامات معينة phenotypic. لمزيد من المعلومات، راجع المنشور السابق11. - تحليل الاختلافات بين الشروط باستخدام الرسم البياني الوسادة المنشور أو ما شابه ذلك.
ملاحظة: لحساب الكفاءة، قمنا بحقن الفئران NG2-Cre مع ناقلات التحويل ALN المعتمدة على CRE ومراسل GFP. لتقدير كفاءة التحويل، ونحن أيضا حقن الحيوانات مع GFP تعتمد على Cre تحت المروج CBA في كل مكان، مما يجعل جميع الخلايا المستهدفة GFP+ . باستخدام هذه المقارنة، قدرنا أن 66.81٪ ± 38.38٪ من الخلايا المستهدفة تحويلها إلى الخلايا العصبية. للتحقق من صحة التعبير عن كل واحد من الجينات، يمكن تنفيذ المتكاملة المزدوجة تلطيخ الفلورسنت لGFP / Ascl1، GFP / Lmx1a وGFP / Nurr1. بالإضافة إلى ذلك، يمكن أن يكشف تسلسل الجينوم مثل تسلسل الحمض النووي الريبي أحادي الخلية عن وجود كل واحد من الجينات في الخلايا المعاد برمجتها.
النتائج
يتم استخدام حقن ناقلات AAV لإعادة برمجة بنجاح الخلايا NG2 glia المقيمة في الخلايا العصبية في striatum الماوس NG2-Cre (الشكل1A). لاستهداف NG2 glia على وجه التحديد، يتم إدراج ناقلات FLEX مع الجينات إعادة البرمجة / مراسل، في اتجاه مضاد للتحسس وتحيط بها اثنين من أزواج من مواقع loxP المضادة للاوازيال ، غير المتجانسة (الشكل 1B). يتم وضع كل من الجينات الثلاثة إعادة برمجة (Ascl1, Lmx1a وNurr1) تحت سيطرة المروج CBA في كل مكان على ناقلات الفردية. من أجل التأكد من أن التعبير GFP يقتصر على الخلايا العصبية المعاد برمجتها الناشئة من خلية التعبير عن Cre، يتم وضع GFP تحت سيطرة المروج متشابك الخلايا العصبية محددة، (أيضا في ناقلات FLEX).
استخدام مزيج من إعادة برمجة وبنيات مراسل يسمح لتوليد الخلايا العصبية إيجابية GFP في striatum الماوس (الشكل1C،C'). استخدام بناء مراسل دون وجود الجينات إعادة برمجة لا تسفر عن الخلايا العصبية إيجابية GFP (الشكل1D).
الخلايا العصبية المعاد برمجتها التي تمتلئ بالبيوتاتين مرئية بعد الوفاة تلطيخ المناعة (الشكل2A). إذا كان التحويل ناجحا، يجب أن يكون هناك مورفولوجيا الخلايا العصبية واسعة النطاق. التسجيلات الكهرولوجية للخلايا العصبية المعاد برمجتها تظهر وجود اتصالات وظيفية postsynaptic مع تدابير النشاط التلقائي (الشكل2B،C). هذا يمكن أن تكون مسدودة إما مع غباجيكا أو مانع الجلوتاماتيك (Picrotoxin أو CNQX), مما يشير إلى كل من المدخلات المحفزة والمثبطة متشابك إلى الخلايا العصبية المعاد برمجتها. يزيد حدوث النشاط العفوي مع الحقن الفيروسي بعد الوقت (الشكل2D)،مما يشير إلى النضج التدريجي.
إمكانات العمل الحالية الموجودة في الخلايا العصبية الوظيفية. زيادة إمكانات الإجراء في العدد مع مرور الوقت بعد التحويل (الشكل2E). وهذا يشير كذلك إلى النضج في وظيفة الخلايا العصبية. في الخلايا العصبية غير ناضجة، والحالية سوف تحفز إما لا شيء أو عدد قليل جدا من إمكانات العمل (الشكل2F).
أنماط إطلاق الخلايا العصبية هي نوع الخلية محددة لأنها تعتمد على عوامل مثل مورفولوجيا الخلايا وقناة التعبير15. يمكن تمييز الأنماط المسجلة في الخلايا العصبية المعاد برمجتها في الجسم الحي في مجموعات ومقارنتها بالأنواع الفرعية للخلايا العصبية الذاتية، على سبيل المثال الخلايا العصبية البينية السريعة (نوع الخلية B، الشكل 3B)أو أنواع الخلايا الأخرى (الشكل3A،C، D ). ويمكن تأكيد الاختلافات الكهرولوجية الملاحظة من خلال وجود علامات محددة من النوع الفرعي والتعبير المشترك مع GFP (الشكل3E-H). تماما، تشير هذه البيانات إلى أن الخلايا العصبية المعاد برمجتها الموجودة في striatum لها خصائص أنواع مختلفة من الخلايا العصبية البينية، مثل Parvalbumin-، ChAt- و NPY- التعبير عن الخلايا العصبية البينية، فضلا عن هوية الخلايا العصبية المتوسطة striatal (DARPP32 +) ( الشكل 3 هاء -H).
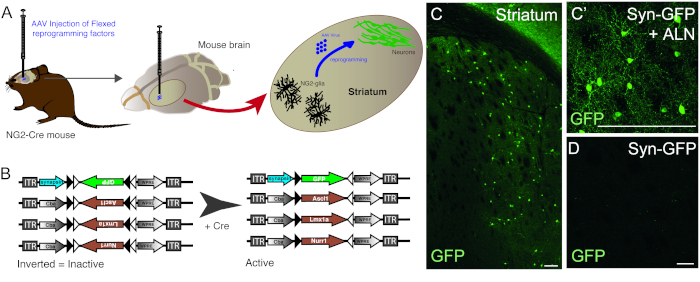
الشكل 1: في إعادة برمجة الجسم الحي من NG2 glia المقيم في الخلايا العصبية. (أ) التمثيل التخطيطي لفيروس AAV بوساطة في إعادة برمجة الجسم الحي من الغليا NG2 striatal. (B) التمثيل التخطيطي للبنيات AAV5 FLEX المستخدمة في إعادة برمجة الجسم الحي، والتي يتم فيها تنظيم التعبير الجيني من خلال التعبير Cre في الخلايا المستهدفة. (C و C') في الخلايا العصبية في الجسم الحي إعادة برمجتها، الناتجة عن سين-GFP + ALN حقن في Striatum. (D) عدم وجود الخلايا العصبية المعاد برمجتها عندما يتم إضافة أي عوامل إعادة برمجة في الكوكتيل الفيروسي، ويتم حقن بناء مراسل فقط في الجسم الحي. قضبان المقياس = 100 مم (C)، 25 مم (C)،25 مم (D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
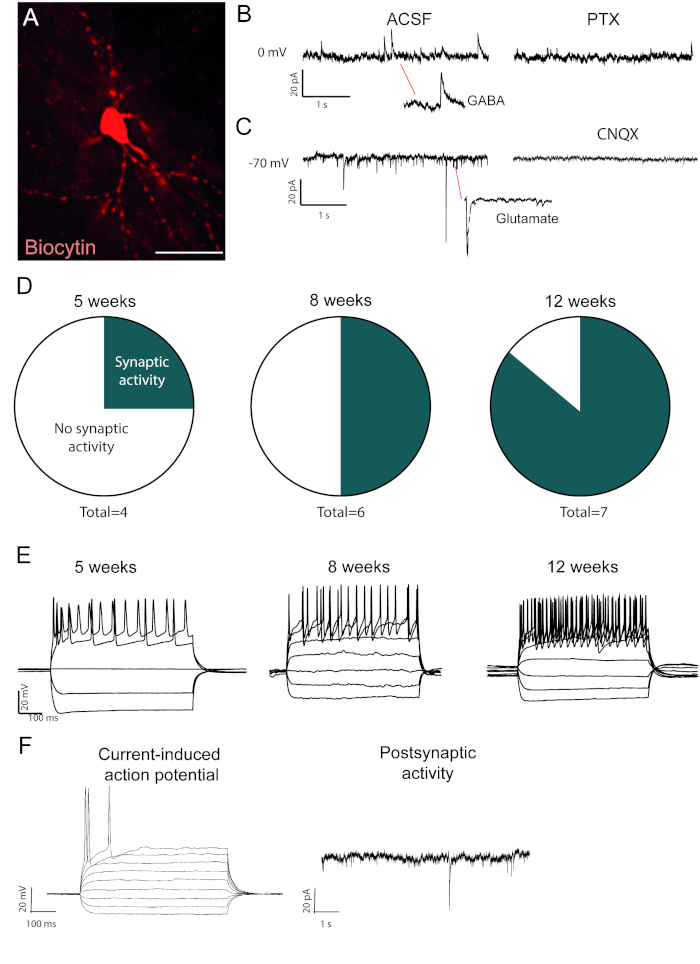
الشكل 2: في الجسم الحي الخلايا العصبية المعاد برمجتها وظيفية وتظهر النضج مع مرور الوقت. (أ) الخلايا العصبية المعاد برمجتها مليئة بالبيوتين، يظهر مورفولوجيا الخلايا العصبية الناضجة، بما في ذلك العمود الفقري الددري. آثار يظهر (B) النشاط المثبط (GABAergic) التي يتم حظرها مع picrotoxin, مضاد مستقبلات GABAA و (C)النشاط المحفز الذي يتم حظره مع CNQX, خصم مستقبلات AMPA. (د) يزيد عدد الخلايا العصبية ذات النشاط المصطفي مع مرور الوقت. (E) الخلايا العصبية مصححة تظهر اطلاق النار المتكررة بالفعل في 5 أسابيع بعد الحقن (w.p.i.) والاستمرار في إظهار أنه في 8 و 12 w.p.i. (F) إمكانات العمل الناجمة حاليا والنشاط postynaptic من الخلايا العصبية غير ناضجة، وتظهر القليل متشابك الأحداث وإمكانات العمل قليلة بالمقارنة مع B و D. مقياس شريط = 25 مم الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
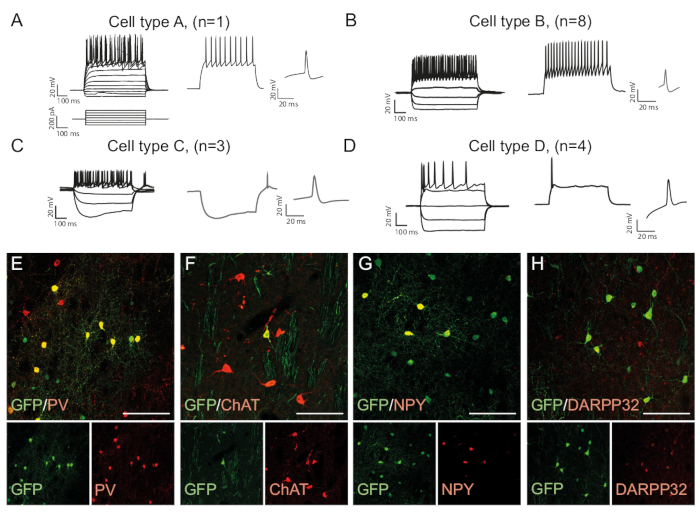
الشكل 3: في الجسم الحي الخلايا العصبية المعاد برمجتها تظهر الخصائص المناعية الكيميائية والفسيولوجية للخلايا العصبية التخلالية. (A-D) أنماط إطلاق في الخلايا العصبية إعادة برمجة فيالجسم الحي يمكن أن تكون من أنواع متميزة: (أ) النوع A يشبه الخلايا العصبية الذاتية المتوسطة سبيني (DARPP32 +); (B) على غرار سريع التجسس (PV +) بين الخلايا العصبية. (C) على غرار الخلايا العصبية تجسس عتبة منخفضة مع الترهل بارزة (NPY +); (D) الخلايا العصبية اطلاق النار مع كبير بعد فرط الاستقطاب (دردشة +). (هـ-هـ) الصور البؤرية التي تظهر التعريب المشترك لGFP وعلامات الخلايا العصبية البينية PV (E) ، ChAT (F) ، NPY (G) ، وعلامات الخلايا العصبية الإسقاط DARPP32 (H). جميع القضبان مقياس = 50 ملم.
Discussion
في الجسم الحي إعادة البرمجة المباشرة يمكن أن يتحقق باستخدام ناقلات AAV FLEX في سلالات الماوس التعبير عن Cre. من المهم ملاحظة أنه قد لوحظت اختلافات بين سلالات الماوس فيما يتعلق بفعالية إعادة البرمجة. لفي إعادة برمجة الجسم الحي في striatum، وقد ثبت خط الماوس NG2-Cre لتكون أكثر كفاءة بالمقارنة مع سلالات أخرى. قبل البدء في استخدام سلالة حيوانية جديدة، من المهم التحقق من المبادئ التوجيهية لموفر الماوس فيما يتعلق بالتعبير عن Cre مع مرور الوقت، حيث أن عمر الحيوانات غالباً ما يؤثر على خصوصية هذا التعبير البروتيني. في دراساتنا، لم تستخدم الحيوانات التي يزيد عمرها عن 12 أسبوعاً في إعادة برمجة الجسم الحي حيث كان هناك خطر على التعبير عن الكري في خلايا أخرى غير NG2 glia. وينصح الوجود المستمر ورصد الحيوانات التحكم حقن فقط مع شنابسين-فليكس-GFP البناء. وهذا يسمح برصد الحيوانات للخلايا الإيجابية GFP التي لا ينبغي أن تكون موجودة إذا لم يتم استخدام أي الجينات إعادة برمجة (ALN).
لتحديد الخلايا العصبية المعاد برمجتها حديثا، طريقة تحديد الخلايا العصبية الخاصة مثل تلك الموصوفة في هذا البروتوكول هي ذات أهمية قصوى. وهذا يسمح لتحديد وتمييز السليم من الخلايا العصبية المعاد برمجتها من الخلايا المحيطة الذاتية التي لها أهمية خاصة عند إعادة البرمجة في منطقة متجانسة.
من المهم أيضا استهداف الهيكل الصحيح للحقن الفيروسي. ولذلك، فإن جراحة مجسمة للحقن الفيروسي مهمة وتحتاج إلى التعامل معها بدقة، وخاصة عند استهداف هياكل أصغر من الدماغ.
لقد أظهرنا في السابق11 أنه لا يمكن الاعتماد على التنبؤ بنتائج إعادة البرمجة في الجسم الحي على أساس تجارب إعادة البرمجة في المختبر باستخدام نفس عوامل إعادة البرمجة. وبالتالي فإن جميع عوامل الاهتمام تحتاج إلى اختبار في الجسم الحي. في أيدينا, العديد من تركيبات عوامل مختلفة تعطي نفس النوع الفرعي من الخلايا العصبية (أي, بين الخلايا العصبية11 في الجسم الحي) على الرغم من حقيقة أن هذه الجينات قد تورطت في تطوير الخلايا العصبية الأخرى.
مشبك التصحيح كامل الخلية للخلايا العصبية المعاد برمجتها هو تقنية حساسة ومعالجة الأنسجة أمر مهم للحصول على نتيجة جيدة. التسريب مع حل كريبس الجليد الباردة يحسن نوعية الأنسجة. أيضا، الخلايا العصبية مصححة تحتاج إلى أن تعامل بعناية. حتى لو كان النضج والهوية الفينوتية من الخلايا العصبية المعاد برمجتها يمكن تقييمها إلى حد ما باستخدام المشبك التصحيح الخلية الكاملة, هذه الخلايا ليست قابلة للمقارنة تماما لنظرائهم الذاتية. وينبغي استخدام أنواع إضافية من التحليل، مثل تسلسل الجينوم (مثل تسلسل الحمض النووي الريبي) لزيادة تأكيد هوية الخلايا المعاد برمجتها.
ويمكن النظر في التقنية الموصوفة هنا لتطوير العلاجات المستقبلية حيث هناك حاجة إلى استبدال الخلايا العصبية في الدماغ. على الرغم من أن إعادة البرمجة في الجسم الحي لا تزال في مراحلها المبكرة وترجمتها إلى البشر لم تكن متوقعة بعد، فإن هذه التقنية يمكن أن توفر طريقة لتقييم وظيفة الجينات الخارجية في الدماغ ودراسة نضج الخلايا في الجسم الحي.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تم تمويل مارسيلا بيرتلي من قبل برنامج أفق الاتحاد الأوروبي 2020 (H2020-MSCA-ITN-2015) في إطار شبكات التدريب المبتكرة ماري سكلودوسكا كوري واتفاق المنح رقم 676408. تم تمويل دانييلا رايلاندر أوتوسون من قبل مجلس البحوث السويدي (2017-01234).
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS FOR AAV5 CLONING AND VIRAL VECTOR PREPARATION | |||
| pAAV-CA-FLEX | AddGene | 38042 | |
| Ascl1 | AddGene | 67291 | NM_008553.4 |
| Lmx1a | AddGene | 33013 | NM_0033652.5 |
| Nurr1 | AddGene | 35000 | NM_013613.2 |
| GFP-syn | AddGene | 30456 | |
| LoxP (FLEX) sequence 1 | GATCTccataacttcgtataaagtatcctatac gaagttatatcaaaataggaagaccaatgcttc accatcgacccgaattgccaagcatcaccatcg acccataacttcgtataatgtatgctatacgaa gttatactagtcccgggaaggcgaagacgcgga agaggctctaga | ||
| LoxP (FLEX) sequences 2 | tactagtataacttcgtataggatactttatac gaagttatcattgggattcttcctattttgatc caagcatcaccatcgaccctctagtccacatct caccatcgacccataacttcgtatagcatacat tatacgaagttatgtccctcgaagaggttcgaa ttcgtttaaacGGTACCCTCGAC | ||
| pDP5 | Plasmid Factory | PF435 | |
| pDP6 | Plasmid Factory | PF436 | |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| FBS (Fetal bovine serum) | Thermo Fisher Scientific | 10500064 | |
| Penicillin streptomycin | Thermo Fisher Scientific | 15140122 | |
| DMEM (Dulbecco's Modified Eagle Medium)+ Glutamax | Thermo Fisher Scientific | 61965026 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | Thermo Fisher Scientific | 14190094 | |
| HEK293 cells | Thermo Fisher Scientific | 85120602-1VL | |
| Flasks | BD Falcon | 10078780 | 175 cm2 |
| Tris H-CL | Sigma Aldrich | 10812846001 | For TE buffer use 10 mM, pH 8.0; for lysis buffer use 50mM, pH 8.5; for IE buffer use 20 mM, pH 8.0; for elution buffer use 20 mM, pH 8.0 |
| EDTA | EDTA: Invitrogen | EDTA: AM9260G | For TE buffer use 1 mM EDTA |
| Ultrapure water | see Ultrapure water system | ||
| CaCl2 | SigmaAldrich | C5080 | 2.5 M |
| Dulbecco´s phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190136 | |
| NaCl | Sigma-Aldrich | S3014 | FOR HBS use 140 mM; for Lysis Buffer use 150 mM; for IE buffer use 15 mM; for elution buffer use 250 mM |
| MgCl2 | Sigma-Aldrich | M8266-100G | For lysis Buffer: 1 mM |
| Ultracentrifuge sealing tubes | Beckman Coulter | Quick-Seal® Polypropylene Tube | |
| OptiPrep™ Density Gradient Medium | Sigma Aldrich | D1556-250ML | |
| 10-mL syringe-18G needle | BD | 305064 | |
| Laboratory glass bottles | VWR | ? | |
| Anion exchange filter | PALL laboratory | MSTG25Q6 | Acrodisc unit with Mustang Q membrane |
| Centrifugal filter unit | Merck | Z740210-24EA | Amicon Ultra-4 device |
| Endotoxin-Free Plasmid DNA Isolation Kits | Thermo Fisher Scientific | A33073 | |
| Na2PO4 | Sigma-Aldrich | S7907 | |
| HEPES | Sigma-Aldrich | H7523 | 15 mL |
| Falcon tube | Thermo Fisher Scientific | Corning 352196 | |
| Falcon tube | Thermo Fisher Scientific | Corning 352070 | |
| Glass Vials | Novatech | 30209-1232 | CGGCCTCAGFGAGCGA |
| Forward Primer for Inverted Terminal Repeat (ITR) sequence | GGAACCCCTAGTGATGGAGTT | ||
| Reverse Primer for Inverted Terminal Repeat (ITR) sequence | CACTCCCTCTCTGCGCGCTCG | ||
| 5´FAM / 3´BHQ1 probe | Jena Bioscience | ||
| 0.22 mm filter | Merck | SLGV004SL | Millex-GV filter |
| EQUIPMENT AAV5 VIRAL VECTOR PREPARATION | |||
| Freezer -20 °C | |||
| Freezer -80 °C | |||
| Fridge +4 °C | |||
| AAV viral room | |||
| Ultrapure Water system | Merck | Milli-Q® IQ 7000 | |
| Vortex mixer | VWR | 444-0004 | |
| Ultracentrifuge | Beckman Coulter | Beckman Optima LE-80K Ultracentrifuge | |
| Autoclave | Tuttnauer | 2540 EL | |
| Polymerase Chain Reaction (PCR) | BioRad | C1000 Touch Thermal Cycler | |
| Quantitative PCR (qPCR) | Roche | LightCycler® 480 System | |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST16 | |
| Water Bath | Thermo Fisher Scientific | TSGP02 | |
| ANIMAL MODEL | |||
| NG2-Cre mice | Jackson | NG2-CrexB6129, Stock #008533 | |
| REAGENTS FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | |||
| Water | |||
| Saline | Apoteket AB | 70% | |
| Ethanol | Solveco | ||
| Isolfurane | Apoteket AB | Dilute to 1% solution with warm water. | |
| Virkon | Viroderm | 7511 | |
| Pentobarbital | Apoteket AB | P0500000 | i.p. for terminal procedure at the dose of 60 mg/ml. |
| Sucrose | Merck | S0389-500G | |
| Trypan Blu | Thermo Fisher Scientific | 15250061 | |
| Retrobeads | Lumafluor | R170 | |
| Buprenorphine | Apoteket AB | ||
| EQUIPMENT FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | From RSG Solingen. | ||
| Scissors | VWR | 233-1552 | From Biochem. |
| Tweezers | VWR | 232-0007 | |
| Forcep | VWR | 232-0120 | |
| Scalpel holder | VWR | RSGA106.621 | Number 20. |
| Scalpel | VWR | RSGA106.200 | |
| Stereotaxic frame | Stoelting Europe | 51500D | |
| Mouse ear bars | Stoelting Europe | 51648 | 5 ul |
| Syringe with Removable needle | Hamilton Company | 65 | 0,75 inner diameter and 1.5 outer diameter. |
| Glass capilaries | Stoelting | 50811 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Dental drill | Agnthos AB | 1464 | |
| Shaver | Agnthos AB | GT420 | |
| Isoflurane Chamber and pump | Agnthos AB | 8323101 | 2 mL |
| Syringes | Merck | Z118400-30EA | 25G |
| Needles | Merck | Z192414 Aldrich | |
| Mouse and neonatal rat adaptor for stereotaxic fram | Stoelting | 51625 | |
| Heating pad | Braintree scientific, inc | 53800M | From Covidien 2187. |
| Cotton gauze | Fisher Scientific | 22-037-902 | |
| Rubber tube | Elfa Distrelec | HFT-A-9.5/4.8 PO-X BK 150 | |
| Cotton swabs | Fisher Scientific | 18-366-473 | |
| REAGENTS FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| NaCl | Sigma-Aldrich | S3014 | |
| KCl | Sigma-Aldrich | P9333 | |
| NaH2PO4-H2O | Sigma-Aldrich | S9638 | |
| MgCl2-6 H2O | Sigma-Aldrich | M2670 | |
| CaCl2-6 H2O | Sigma-Aldrich | C8106 | |
| MgSO4-7 H2O | Sigma-Aldrich | 230391 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Glucose | Sigma-Aldrich | G7021 | see Ultrapure Water system |
| Ultrapure Water | Prepare 1 or 2M. | ||
| KOH | Sigma-Aldrich | P5958-500G | |
| K-D-gluconate | Sigma-Aldrich | G4500 Sigma | |
| KCl | Sigma-Aldrich | P9541 | |
| KOH-EGTA (Etilene glycol-bis-N-tetracetic acid) | Sigma-Aldrich | E3889 Sigma | |
| KOH- Hepes acid (N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid) | Sigma-Aldrich | H7523 | |
| NaCl | Sigma-Aldrich | S3014 | |
| Mg2ATP | Sigma-Aldrich | A9187 | |
| Na3GTP | Sigma-Aldrich | G8877 | |
| Biocytin | Sigma-Aldrich | B4261 | |
| Picrotoxin | Merck | P1675 Sigma | |
| CNQX | Merck | C239 Sigma | |
| Ice | |||
| EQUIPMENT FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| Borosilicate glass pipette | Sutter Company | B150-86-10 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Vibratome | Leica | Leica VT1000 S | |
| WaterBath | Thermo Fisher Scientific | TSGP02 | |
| Clampfit software | Molecular Devices | ||
| Multiclamp software | Molecular Devices | ||
| REAGENTS FOR IMMUNOHISTOCHEMISTRY | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin. | ||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 0.1%. |
| Triton X-100 | Fisher Scientific | 10254640 | Donkey.Use at a concentration of 1 : 400. |
| Serum | Merck Millipore | S30-100ML | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| 4′,6-Diamidino-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | 1: 600 in KPBS-T. |
| streptavidin- Cy3 | Thermo Fisher Scientific | 434315 | 1:5000, rabbit. |
| Anti-GAD65/67 | Abcam | 1:2000, mouse. | |
| Anti-PV | Sigma | P3088 | 1:200, goat. |
| Anti-Chat | Merk | AB143 | 1:5000, rabbit. |
| Anti-NPY | Immunostar | 22940 | |
| K2HPO4 | Sigma-Aldrich | P3786 | |
| NaCl | Sigma-Aldrich | S3014 | |
| KH2PO4 | Sigma-Aldrich | NIST200B | 1:1000, chicken. |
| Anti-GFP | Abcam | ab13970 | |
| Mounting solution | Merck | 10981 | Polyvinyl alcohol mounting medium with DABCO®, antifading |
| OCT | Agar Scientific | ||
| Glycerol | Sigma-Aldrich | G9012-100ML | |
| Distilled water | |||
| Anti-freeze solution | Tissue Pro Technology | AFS05-1000N, 1000 mL/ea. | |
| EQUIPMENT FOR IMMUNOHISTOCHEMISTRY | |||
| Inverted fluorescence microscope | Leica | DMI6000 B | |
| Confocal microscope | Leica | TCS SP8 laser scanning confocal microscope. | |
| Prism | GraphPad | ||
| Microtome | Leica | SM2010R |
References
- Barker, R. A., Parmar, M., Studer, L., Takahashi, J. Human Trials of Stem Cell-Derived Dopamine Neurons for Parkinson's Disease: Dawn of a New Era. Cell Stem Cell. 21 (5), 569-573 (2017).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Parmar, M., Torper, O., Drouin-Ouellet, J. Cell-based therapy for Parkinson's disease: A journey through decades toward the light side of the Force. European Journal of Neuroscience. , (2018).
- Torper, O., et al. In Vivo Reprogramming of Striatal NG2 Glia into Functional Neurons that Integrate into Local Host Circuitry. Cell Reports. 12 (3), 474-481 (2015).
- Su, Z., Niu, W., Liu, M. L., Zou, Y., Zhang, C. L. In vivo conversion of astrocytes to neurons in the injured adult spinal cord. Nature Communication. 5, 3338 (2014).
- Liu, Y., et al. Ascl1 Converts Dorsal Midbrain Astrocytes into Functional Neurons In Vivo. Journal of Neuroscience. 35 (25), 9336-9355 (2015).
- Guo, Z., et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer's disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Grande, A., et al. Environmental impact on direct neuronal reprogramming in vivo in the adult brain. Nature Communication. 4, 2373 (2013).
- Niu, W., et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nature Cell Biology. 15 (10), 1164-1175 (2013).
- Weinberg, M. S., Criswell, H. E., Powell, S. K., Bhatt, A. P., McCown, T. J. Viral Vector Reprogramming of Adult Resident Striatal Oligodendrocytes into Functional Neurons. Molecular Therapy. 25 (4), 928-934 (2017).
- Pereira, M., et al. Direct Reprogramming of Resident NG2 Glia into Neurons with Properties of Fast-Spiking Parvalbumin-Containing Interneurons. Stem Cell Reports. 9 (3), 742-751 (2017).
- Rivetti di Val Cervo, P., et al. Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson's disease model. Nature Biotechnology. 35 (5), 444-452 (2017).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy Methods & Clinial Development. 10, 1-7 (2018).
- Torper, O., et al. Generation of induced neurons via direct conversion in vivo. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 7038-7043 (2013).
- Kawaguchi, Y., Kubota, Y. Correlation of physiological subgroupings of nonpyramidal cells with parvalbumin- and calbindinD28k-immunoreactive neurons in layer V of rat frontal cortex. Journal of Neurophysiology. 70 (1), 387-396 (1993).
- Grealish, S., et al. The A9 dopamine neuron component in grafts of ventral mesencephalon is an important determinant for recovery of motor function in a rat model of Parkinson's disease. Brain. 133 (Pt 2), 482-495 (2010).
- Thompson, L., Barraud, P., Andersson, E., Kirik, D., Bjorklund, A. Identification of dopaminergic neurons of nigral and ventral tegmental area subtypes in grafts of fetal ventral mesencephalon based on cell morphology, protein expression, and efferent projections. Journal of Neuroscience. 25 (27), 6467-6477 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved